芳烃命名(2013-1.0)-5

第6章 各类化合物的命名
本章为前述的有机化合物一般命名规则在各类具体化合物中的应用。
6.1. 卤素,硝基,亚硝基,偶氮,重氮,叠氮化合物 (halogen, nitro, nitroso, azo, diazo, and azido compounds)
6.1.1. 卤素化合物 (halogen compounds)
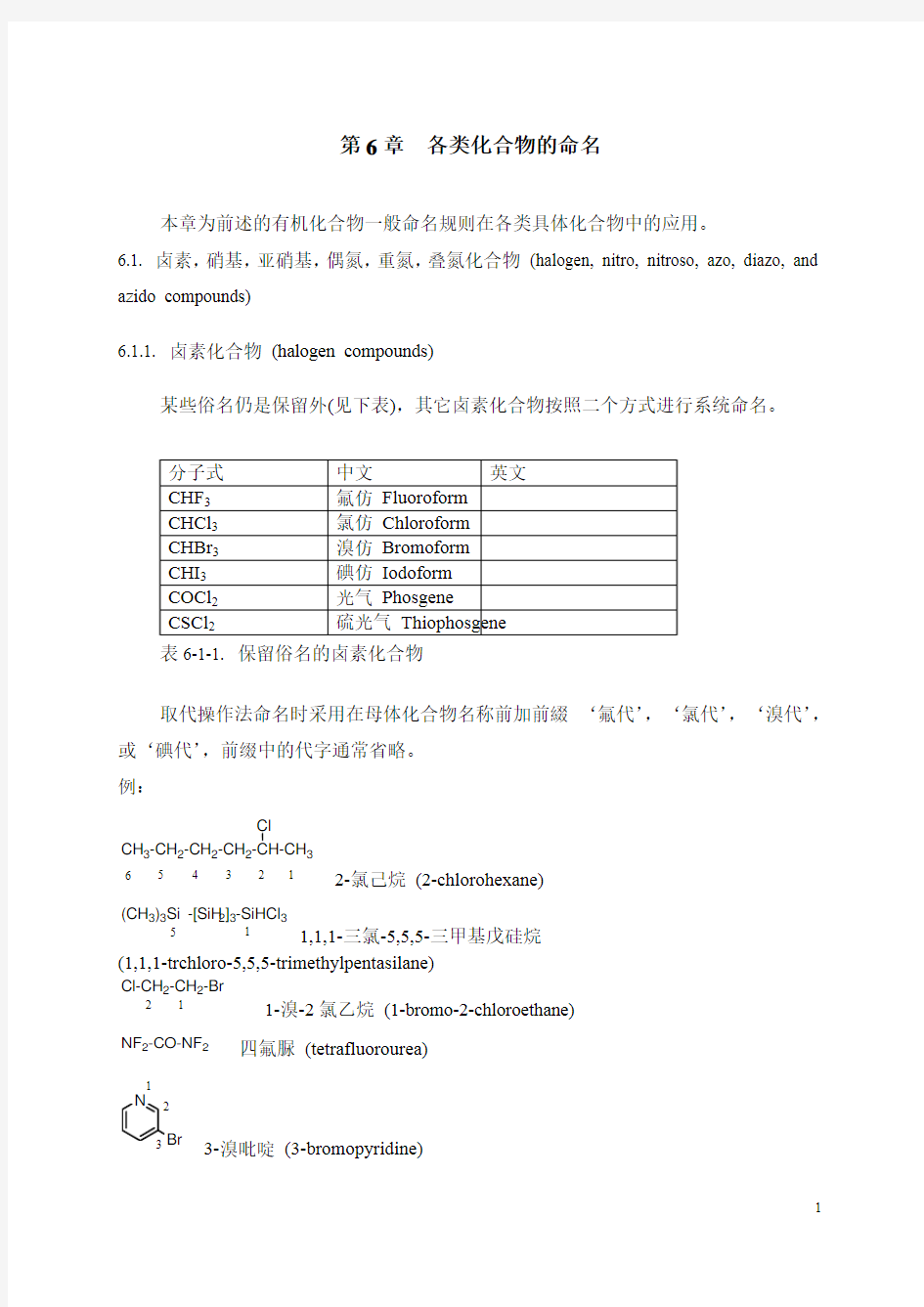
某些俗名仍是保留外(见下表),其它卤素化合物按照二个方式进行系统命名。 分子式 中文 英文
CHF 3 氟仿 Fluoroform CHCl 3 氯仿 Chloroform CHBr 3 溴仿 Bromoform CHI 3 碘仿 Iodoform COCl 2 光气 Phosgene CSCl 2 硫光气 Thiophosgene
表6-1-1. 保留俗名的卤素化合物
取代操作法命名时采用在母体化合物名称前加前綴 ‘氟代’,‘氯代’,‘溴代’,或‘碘代’,前缀中的代字通常省略。 例:
CH 3-CH 2-CH 2-CH 2-CH-CH 3
Cl
6
1
2
3
4
5
2-氯己烷 (2-chlorohexane)
(CH 3)3Si -[SiH 2]3-SiHCl 3
1
5
1,1,1-三氯-5,5,5-三甲基戊硅烷
(1,1,1-trchloro-5,5,5-trimethylpentasilane)
Cl-CH 2-CH 2-Br
1
2
1-溴-2氯乙烷 (1-bromo-2-chloroethane) NF 2-CO-NF 2
四氟脲 (tetrafluorourea)
N
Br
213
3-溴吡啶 (3-bromopyridine)
官能团类别命名则由有机‘基团’后随类别名‘氟化物’,‘氯化物’,‘溴化物’或‘碘化物’而形成,通常‘化物’二字省略。若需要,加上位次前缀。一般讲来,卤素化合物均可由二类命名法给出二个名称,但官能团类别命名法的名称较少采用,或仅见于一些简单的化合物。
例:
CH3-I甲基碘 (methyl iodide);碘甲烷(iodomethan)-取代操作法命名
C6H5-CH2-Br苄溴 (benzyl bromide);溴甲基苯,α-溴甲苯(bromomethylbenzene,
α-bromotoluene)-取代操作法命名
(CH3)3C-Cl叔丁基氯(tert-butyl chloride);2-氯-2-甲基丙烷(2-chloro-2-methylpropane)-取代操作法命名
Br-CH2-CH2-Br乙叉二溴化物 (ethylene dibromide);1,2-二溴乙烷(1,2-dibromoethane)-取代操作法命名
含有基团-XO, -XO2, -XO3(X=卤素)的化合物可采用下列前缀进行取代操作法命名:-XO 次氯酰基(chlorosyl),次溴酰基(bromosyl),次碘酰基(iodosyl),次氟酰基(fluorosyl)
-XO2氯酰基(chloryl),溴酰基(bromyl),碘酰基(iodyl),氟酰基(fluoryl)
-XO3高氯酰基(perchloryl),高溴酰基(perbromyl),高碘酰基(periodyl),高氟酰基(perfluoryl)
例:
I O
次碘酰苯(iodosylbenzene)
I
O
O碘酰苯(iodylbenzene)
Cl O
O
O高氯酰苯(perchlorylbenzene)
O I
I
O
O
O
O
O 1,2-二高碘酰乙(烷)-1,2-二酮(1,2-diperiodylethane-1,2-dione)6.1.2. 硝基和亚硝基化合物(nitro, and nitroso compounds)
含有一个–NO 2 或 –NO 基团化合物的命名可采用分别加前綴‘硝基’或‘亚硝基’。 例:
CH 3-NO 2硝基甲烷
(nitromethane)
(1-nitronaphthalene)
(o –dinitrobenzene)
C 6H 5-NO
亚硝基苯 (nitrosobenzene)
对于含有更高位特性基团的结构命名时,连于碳原子以外的‘硝基’或‘亚硝基’也可类似地将其作为前缀来进行命名。 例:
2-(叔丁氨基)-3-甲基l-3-(硝基氧基)丁酸
(
2-(tert -butylimino)-3-methyl-3-(nitroxy)butanoic acid )
N -甲基-N -亚硝基脲 (N -methy-N -nitrosourea )
含有 =N(O)OH 基团的化合物可命名为官能性母体化合物氮酸(azinic acid) H 2N(O)OH 的衍生物或使用前綴羟基亚硝叉基 (hydroxynitroryl)的方法(见 4.3节表4-2)。 例:
CH 2=N(O)-OH
甲亚基氮酸 (methylideneazinic acid)
2-(羟基亚硝叉基)环己烷-1-羧酸
(2-(hydroxylnitroryl)cyclohexane-1-carboxylic acid)
6.1.3. 偶氮,偶氮氧,重氮,以及有关化合物(azo, azoxy, diazo, and related compounds) 6.1.3.0. 乙氮烯(diazenes). 母体结构HN=NH 命名为乙氮烯(diazene),由其衍生的基团,
即HN=N–和 –N=N–,则各自系统地命名为乙氮烯基(diazenyl)和乙氮烯叉基(diazenediyl)。
6.1.3.1. 偶氮化合物 (azo compounds) 有通用结构R–N=N–R’ ,其中R 和R ’能相同或不同,通常称为‘偶氮化合物’。然而,这类化合物能更系统地以取代操作法命名为母体乙氮烯(diazene)氢化物的衍生物。 例:
CH 3-N=N-CH 3二甲基乙氮烯(dimethyldiazene) [惯称偶氮甲烷 (azomethane)] C 6H 5-N=N-C 6H 5二苯基乙氮烯(diphenyldiazene) [惯称偶氮苯(azobenzene)]
N=N
Cl
Cl
1
1
2
2
3
3
44
(3-氯苯基)(4-氯苯基)乙氮烯(3-chlorophenyl)(4-chlorophenyl)-
diazene [惯称3,4’-二氯偶氮苯(3,4’-dichloroazobenzene)]
CH 2=CH-N=N-CH 3
甲基乙烯基乙氮烯(methyl(vinyl)diazene)
[惯称乙烯偶氮甲烷(ethene azomethane)]
N=N
1
1
2
2
(萘-1-基)(萘-2-基)乙氮烯
(naphthalene-1-yl)(naphthalene-2-yl)diazene)
[惯称1,2’-偶氮萘(1,2’-azonaphthylene)]
N=N C 6H 5
1
2
34
(萘-2-基)苯基乙氮烯 ((naphthalene-2-yl)phenyldiazene )
[惯称萘-2-偶氮苯(naphthalene-2-azobenzene)]
在一个单偶氮化合物有通用结构R-N=N-R ’中R 为一主要特性基团所取代,其命名将基于母体氢化物RH ,R’-N=N- 则作为一个有机乙氮烯基取代基团。如果R 和R ’二者均为同样数目的主要特性基团所取代,那就使用一复合命名。 例:
N=N
1
2
1
234
Cl
NH 2H 3C
[(4-氯-2-甲基苯-1-基)乙氮烯基]萘-2-胺
2
3 4-(苯基乙氮烯基)苯磺酸 (4-(phenyldiazenyl)benzenesulfonic acid )
[惯称 4-(苯基偶氮基)苯磺酸(4-(phenylazo)benzenesulfonic acid)]
N=N
1
2
4
321
SO 2-OH
OH
4-[(2-羟基萘-1-基)乙氮烯基]苯-1-磺酸
(4-[2-hydroxynaphthalen-1-yl]diazenyl)benzene-1-sulfonic acid)
[惯称4-[(2羟基-1-萘基)偶氮]苯磺酸(4-[(2-hydroxy-1-naphthyl)azo]benzenesulfonic acid)]
N=N
4'
43
3'2'
2
1'1
COOH
HOOC
4,4’-乙氮烯叉基二苯甲酸(4,4’-diazenediyldibenzoic acid)
[惯称 4,4’-偶氮二苯甲酸 (4,4’-azodibenzoic acid)]
假如缺少更优先的母体化合物时,双偶氮化合物以及更复杂类似物则是基于母体结构“乙氮烯” 来命名。 例:
7
2
1
N N
N
2
1
N C 6H 5 (蒽-2-基)[(7-苯乙氮烯基)萘-2-基] 乙氮烯 ((anthracen-2-yl)[7-phenyldiazenyl]naphthalene-2-yl)]diazene)
[惯称 蒽-2-偶氮-2’-萘-7’-偶氮苯(anthracene-2-azo-2’-naphthalene-7’-azobenzene)]
当有优先作为后缀的特性基团存在时,则偶氮基团以“乙氮烯基”为前缀来进行命名。 例:
78
2
1
OH
OH N N
N
N 2,7-二(苯基乙氮烯基)萘-1,8-二酚
(2,7-bis(phenyldiazenyl)naphthalene-1,8-diol )
[惯称 2,7-二(苯基偶氮(基))萘-1,8-二酚2,7-bis(phenylazo)naphthalene-1,8-diol]
6.1.3.2. 偶氮氧化合物(azoxy compounds) 有通用结构R-N 2(O)-R 或 R-N 2(O)-R’的偶氮化合物的N -氧化物通常称为‘偶氮氧化物’,它们的命名由加‘氧化物’至相应的偶氮化合物形成。在不对称偶氮氧化物时氧原子以位次1 或2加以标明。 例:
C 6H 5-N 2(O)-C 6H 5
二苯乙氮烯氧化物 (diphenyldiazene oxide)
[惯称氧(化)偶氮基苯(azoxybenzene)]
1'
2'
N 2(O)
1
4
2
Cl
Cl
Cl
(2-氯苯基)(2,4-二氯苯基)乙氮烯氧化物(氧的位置未定) ((2-chlorophenyl)-(2,4-dichlorophenyl)diazene oxide)
[惯称 2,2’,4-三氯氧(化)偶氮基苯(2,2’,4-trichloazoxybenzene)]
Cl
N=N(O)C 6H 5
11
2
2
1-(1-氯-2-萘基)-2-苯基乙氮烯-2-氧化物1-(1-chloro-2-naphthyl)-2-phenyldiazene-2-oxide [惯称1-氯萘-NNO -氧(化)偶氮基苯(1-chloronaphthalene-NNO -azoxybenzene)]
有通用结构R-N=N(O)-R’或 R-N(O)=N-R’的氧化偶氮化物其取代基R 是一主要特性基团,命名将基于母体氢化物RH ,作为取代基的R’-氧化偶氮化物中氧原子位置用适合的前綴NNO -,ONN -,或 NON -进行标注。 例:
COOH
N=N(O)C 6H 5
1
2
2
1
2-(苯基-ONN -氧(化)偶氮基)-1-萘甲酸
(2-(phenyl-ONN -azoxy)-1-naphthoic acid)
此外,化合物命名也可基于母体氢化物乙氮烯而不顾主要特性基团,因此,上述化合物能命名为:1-(1-羧基萘-2-基)-2-苯基乙氮烯-2-氧化物[1-(1-carboxy-2-naphthyl)-2-phenyldiazene 2-oxide]。
6.1.3.3. 重氮正离子化合物(diazonium compounds)。有通用结构R-N 2+X - 的化合物命名时,采用母体氢化物RH 加上后綴‘重氮盐(正离子)’,再以负离子‘X -’名为前缀而组成。(英文中则以负离子‘X -’名加空格置于最后)
例:
CH 3_CH 2_N 2+Cl - 氯化乙烷重氮盐 (ethanediazonium chloride)
C 6H 5_N 2+Cl -
氯化苯重氮盐 (benzenediazonium chloride)
N 2+BF 4-
HO
1
4
23
5
6
7
8
四氟硼酸7-羟基萘-2-重氮盐
(7-hydroxynaphthalene-2-diazonium tetrafluoroborate)
6.1.3.4. 有通用结构R-N=N-X 偶氮化合物应作为母体结构乙氮烯HN=NH 的衍生物来进行命名。 例:
C 6H 5-N=N-OH 苯乙氮烯醇(phenyldiazenol)[惯称氢氧化重氮苯(benzenediazohydroxide)] C 6H 5-N=N-O -Na + 苯乙氮烯醇钠(sodium phenyldiazenolate) [惯称苯重氮酸钠sodium benzenediazoate]
C 6H 5_N=N _SO 3- Na +苯乙氮烯磺酸钠(sodium phenyldiazenesulfonate)
[惯称苯重氮磺酸钠(sodium benzenediazosulfonate)]
6.1.3.5. 重氮化合物(diazo compounds) N 2基团的一个氮原子连接到碳原子的化合物命名采用母体氢化物的名称加前綴‘重氮’的方式。 例:
CH 2N 2 重氮甲烷(diazomethane) N 2CH-CO-O-C 2H 5 重氮乙酸乙酯(ethyl diazoacetate) 6.1.4. 叠氮化合物(azides)
N 3(-N=N +=N -)基团中一个氮原子连接到母体氢化物的化合物命名有二种方式:(a)在取代操作法命名时,以前綴‘叠氮-’加到母体氢化物RH 名称前;或者(b) 在官能团类别命名时,则由R 基团的名称后加类别名‘叠氮化物’而构成。 例:
C 6H 5-N 3 (a)叠氮苯 (azobenzene) (b)苯基叠氮化物 (phenyl azide)
SO 2_OH 1
4
2
3
N 3
(a) 3-叠氮萘-2-磺酸 (3-azidonaphthalene-2-sulfonic acid)
6.1.5. 异乙氮烯 (isodiazene)
有通用结构R 2N-N: ? R 2N +=N - 的化合物可以取代操作法命名为母体‘离子基’肼亚基 (hydrazinylidene)的衍生物,或者基于俗名异乙氮烯进行命名。 例:
(CH 3)2N-N: ? (CH 3)2N +=N - 二甲基异乙氮烯(dimethylisodiazene) 二甲基肼亚基(dimethylhydrazinylidene)
6.2. 胺和亚胺 (Amines and imines )
类名“胺”适用于化合物NH 2R 、NHRR’和NR’R”R’”,它们又分别归类为一级胺(伯胺)、二级胺(仲胺)和三级胺(叔胺)。
胺和亚胺的盐的命名方法是:先写出阳离子(见6.7.2节)的名字,然后写阴离子的名字。除了在编写索引和极为复杂的情况下,不鼓励使用诸如胺盐酸盐这样的名字。
环状胺和亚胺的命名参见第三章的杂环命名。
6.2.1. 伯胺 (Primary amines )
伯胺NH 2R 可按以下三种命名方法之一来命名: (a) 将取代基R 的名称作为前缀加到母体氢化物氮烷的前面;
(b) 将后缀“-胺”加到母体氢化物RH 的名称的后面,IUPAC-2004建议优先采用此类命名法;
(c) 将“-胺”加到基团R 的取代基名后面构成。 例:
CH 3-CH 2-NH 2
(a)乙基氮烷(Ethylarane ) (b) 乙烷胺(Ethanamine ) (c) 乙基胺(Ethylamine )
N
21
234
(a) 4-喹啉基氮烷(4-Quinolylarane ) (b) 喹啉-4-胺(Quinolin-4-amine ) (c) 4-喹啉基胺(4-Quinolylamine )
O
NH 2
12
3
(a) 1-苯并呋喃-2-基氮烷(1-Benzofuran-2-ylazane ) (b) 1-苯并呋喃-2-胺(1-Benzofuran-2-amine ) (c) 1-苯并呋喃-2-基胺(1-Benzofuran-2-ylamine )
2
1NH 23
(b) 2-甲基环己烷胺 (2-methylcyclohexan-1-amine )
(c) (2-甲基环己基)胺 ((2-methylcyclohexyl)amine )
1
4
NH 2
H 2N
(b) 苯-1,4-二胺 (benzene-1,4-diamine )
(c) 苯-1,4-叉基二胺,对苯叉基二胺 (1,4-phenylenediamine, p - phenylenediamine )
NH 2
NH 2
H 2N H 2N
1
23
4
1'2'3'
4'
(a) [1,1' -联萘-3,3',4,4'-四基]四氮烷([1,1’-Binaphthalene-3,3’,4,4’-tetrayl]tetrakis(azane)) (b) [1,1'-联萘]-3,3',4,4'-四胺([1,1’-Binaphthalene-3,3’,4,4’-tetramine )
(c) [1,1'-联萘-3,3',4,4'-四基]四胺([1,1’-Binaphthalene-3,3’,4,4’-tetrayl]tetramine )
当它不是主要的特性基团时,或当不是所有的-NH 2基团都能用后缀表达时,-NH 2
基团可用前缀“氨基-”(amino-)命名。 例:
H 2N
COOH
1
23
4
4-氨基苯甲酸(首选)(4-Aminobenzoic acid ) p -氨基苯甲酸(p -Aminobenzoic acid )
H 2N
3
21
NH 2
NH 2
(b) 2-(氨基甲基)丙烷-1,3-二胺 (2-(aminomethyl)propane-1,3-diamine )
(c) [2-(氨基甲基)丙-1,3-叉基]二胺 ([2-(aminomethyl)propan-1,3-diyl]diamine )
另外,英文中还保留一些俗名,但中文中基本仍为系统命名(表6-2-1)。 表6-2-1 保留俗名的伯胺
6.2.2. 仲胺和叔胺(Secondary and tertiary amines)
对称的仲胺NHR2和NR3叔胺可按照以下前两种方法来命名,但IUPAC-2004建议也可采用第三种命名方法:
(a) 在取代基R的名字的前面分别加上“二”或“三”构成前缀,将它加在母体氢化物氮烷的前面;
(b) 在取代基R的名称的前面分别加上“二”或“三”构成前缀,紧接着加上“胺”字。
(c) 与不对称仲胺和叔胺同样的方式,将其作为伯胺RNH2或仲胺R2NH的N-取代衍生物。此法给出的名称不简洁,本建议对此持保留态度。
例:
(C6H5)2NH
(a) 二苯基氮烷(Diphenylazane)
(b) 二苯基胺(Diphenylamine)
(c) N-苯基苯胺(N-phenylaniline)
(ClCH2-CH2)2NH
(a) 二(2-氯乙基)氮烷(Bis(2-chloroethyl)azane)
(b) 二(2-氯乙基胺)(Bis(2-chloroethyl)amine)
2,2’-二氯二乙基胺(2,2’-Dichlorodiethylamine)
(c) 2-氯-N-(2-氯乙基)乙烷胺2-chloro-N-(2-chloroethyl)ethanamine
(C2H5)3N
(a) 三乙基氮烷(Triethylazane)
(b) 三乙基胺(Triethylamine)
(c) N,N-二乙基乙烷胺(N,N-diethylethanamine)
不对称的仲胺和叔胺NHRR’、NR2R’和NRR’R”可按照以下三种方法来命名:
(a) 作为母体氢化物氮烷的取代衍生物;
(b) 作为伯胺RNH2或仲胺R2NH的N-取代衍生物;
(c) 将数字前缀加在所有的取代基团R、R’或R”的名称的前面构成前缀,紧接着加上“胺”字。
在不对称仲胺和叔胺的名称中的取代基团按字母顺序排列,并用括号分开。
例:
ClCH2-CH2-NH-CH2-CH2-CH3
(a) (2-氯乙基)(丙基)氮烷((2-Chloroethyl)(propyl)azane)
(b) N-(2-氯乙基)丙烷-1-胺(N-(2-Chloroethyl)propan-1-amine)
N-(2-氯乙基)丙胺(N-(2-Chloroethyl)propylamine)
(c) (2-氯乙基)(丙基)胺((2-Chloroethyl)(propyl)amine)
H3C CH2CH2CH2CH2CH3
CH3
(a) 丁基(乙基)甲基氮烷(Butyl(ethyl)methylazane)
(b) N-乙基-N-甲基丁烷-1-胺(N-Ethyl-N-methylbutan-1-amine)
N-乙基-N-甲基丁胺(N-Ethyl-N-methylbutylamine)
(c) 丁基(乙基)甲基胺(Butyl(ethyl)methylamine)
对于含有二个、三个或更多胺结构单元化合物的命名可采用类似方法,可用N, N’等作为前缀来标明不同氮上的取代基,如此会引起混淆时则可以该氮原子所连接母体氢化物上的位次,同时作为前缀来标明其上的取代基。
例:
H3C H
N
N'3
2
1
H
N
N
3
(b) N-乙基-N’-甲基丙烷-1,3-二胺(N-ethyl-N’-methylpropane-1,3-diamine)
(c) N-乙基-N’-甲基(丙-1,3-叉基二胺) (N-ethyl-N’-methyl(propane-1,3-diyldiamine))
H3C H
N
N'5
4
3
21H N
N
CH3
N
H
CH3
(b) N-乙基-N’-甲基-3-[(甲基氨基)甲基]戊烷1,5-二胺
(N-ethyl-N’-methyl-3-[(methylamino)methyl]pentane-1,5-diamine)(c) N-乙基-N’-甲基-3-[(甲基氨基)甲基](戊-1,5-叉基二胺)
(N-ethyl-N’-methyl-3-[(methylamino)methyl](pentane-1,5-diyldiamine))
H3C
H
N
1-N
12345
6
N
H
6-N
N
H
CH3
CH3
(b) 6-N-乙基-1-N-甲基-3-[(甲基氨基)甲基]己烷1,6-二胺
(6-N-ethyl-1-N-methyl-3-[(methylamino)methyl]hexane-1,6-diamine)
(c) 6-N-乙基-1-N-甲基-3-[(甲基氨基)甲基] (己-1,6-叉基二胺)
6-N-ethyl-1-N-methyl-3-[(methylamino)methyl](hexane-1,6-diyldiamine)
当NHRR’、NR2R’和NRR’R”不是主要的特性基团时,或当不都能用后缀表达时,
它们可用前缀“烃基氨基-”((R)-amino-)命名。注意当作为取代基前缀时,中文中统一采用“烃基氨基-”,而不能写作“烃基胺基-”,此相当于英文中前缀用(R)-amino-,而后缀用(R)-amine 。 例:
如上二例中的 CH 3NH- 为甲基氨基- (methylamino-)
1
3
HO
N
CH 3
3-[环己基(甲基)氨基]苯酚 (3-[cyclohexyl(methyl)amino]phenol )
对可采用复合操作命名法(Multiplicative operation )结构中的 -N< 可用前缀‘氨爪基’(nitrilo ),-NH- (HN<)可用前缀‘氨叉基’(azanediyl )进行命名。 例:
1'4'
H N
NC
4
1
CN
4,4’-氨叉基二苯腈 (4,4’-azanediyldibenzonitrile )
4-[(4-氰基苯基)氨基]苯腈(4-[(4-cyanophenyl)amino]benzonitrile )-取代命名法
CH 22''
N H 2C
2
H 2C
2'
COOH
HOOC HOOC
2,2’,2’’-氨爪基三乙酸 (2,2’,2’’-nitrilotriacetic acid )
N,N -二(羧基甲基)甘氨酸 (N,N -bis(carboxymethyl)glycine )-取代命名法
6.2.3. 亚胺(Imines )
通式为R-CH=NR’或RR”C=NR’(其中R’可以是H )的化合物分别称为醛亚胺或酮亚胺。通式为R-CH=NH 或RR’C=NH 的亚胺又可命名为母体氢化物氮烷的“-亚基”衍生物,或者用后缀“-亚胺”加至母体氢化物R-CH 3或R-CH 2-R’的名称后来命名,英文中则将后缀“-imine ”取代母体氢化物R-CH 3或R-CH 2-R’的名称中最后一个字母”e”(如果存在这个字母e 的话)来命名。通式为R-CH=N-R’或RR”C=NR’的化合物也可命名为N -取代的亚胺或者命名为胺R’-NH 2的“亚基”衍生物。(见6.2.1和6.2.2节)
注:上述的类名“醛亚胺”和“酮亚胺”是从诸如“苯甲醛亚胺”或“甲基乙基酮亚胺”之类的名称派生而来的,其中“亚胺”是功能性修饰语。 例:
CH3-CH2-CH2-CH2-CH2-CH=NH
己亚基氮烷(Hexylideneazane)
己烷-1-亚胺(Hexan-1-imine)
己亚基胺(Hexylideneamine)
CH3-CH=N-CH3
乙亚基(甲基)氮烷(Ethylidene(methyl)azane)
N-甲基乙烷亚胺(N-Methylethanimine)
N-甲基乙亚基胺(N-Methylethylideneamine)
2
1
萘-2(1H)-亚胺(Naphthalen-2(1H)-imine)
1,2-二氢萘-2-亚胺(1,2-dihydronaphthalen-2-imine)
当不是主要的特性基团时, =NH基团可用前缀“氨亚基-”(amino-)命名。对可采用复合操作命名法(Multiplicative operation)结构中的 –N=可用前缀‘氨基亚基-’(azanylylidene)来命名。
例:
5H
N1
2
HN
5-氨亚基吡咯烷-2-酮(5-iminopyrrolidin-2-one)
HOOC CH2CH
3N CH2CH2N CH
3'
CH2COOH
3,3’-[乙-1,2-叉基二(氨基亚基)]二丙酸
(3,3’-[ethane-1,2-diylbis(azanylylidene)]dipropanoic acid)
6.2.4. 羟胺(Hydroxyamines)
通式为R-NH-OR’的化合物的命名可以官能性母体化合物“羟基胺”为基础,用取代的方法来进行,同时使用位次码N-或O-来区分在N上或是在O上的取代;或者,通过将前缀“羟基氨基-(hydroxyamino-)”、“烷氧基氨基-(alkoxyamino-)”或“芳氧基氨基-((aryloxy)amino)”加在母体氢化物R-H的名称的前面来命名。
例:
C6H5-NH-OH
N-苯基羟胺(N-Phenylhydroxyamine)
CH3-CO-O-NH-CH3
O-乙酰-N-甲基羟胺(O-Acetyl-N -methylhydroxyamine)
HO N
H OH
1
2
4
3
4-(羟基氨基)苯酚(4-(Hydroxyamino)phenol )
6.2.5. 胺氧化物(Amino oxides )
通式为R 3NO 的化合物(其中R 基团可以相同或者不相同)的命名方法是通过将类名“氧化物”加在胺R 3N 的后面而成。环状的类似物按相同的方法命名,如果需要,用环原子的位次(首选阿拉伯数字,次选大写斜体的元素符号,作为位次码)来表示氧原子的位置。如果需要,R 2N(O)-基团可用由氮酰基(“azinoyl-”)(或二氢亚硝基(dihydronitroryl-)派生而来的前缀来定名。 例:
(CH 3)3NO
三甲基氮烷氧化物 (Trimethylazane oxide ) 三甲胺氧化物(Trimethylamine oxide ) (CH 3)2N(O)-CH 2-C ≡N
(二甲基氮酰基)乙腈,(二甲基亚硝基)乙腈((Dimethylazinoyl)acetonitrile )
N
O
吡啶1-氧化物(首选)(Pyridine 1-oxide ) 吡啶N -氧化物(Pyridine N -oxide )
6.3. 羟基化合物及其衍生物和类似物 6.3.1. 羟基化合物和类似物
6.3.1.1. 醇和酚(Alcohols and phenols ) 在取代命名法中,是将羟基-OH 作为主要的特性基团,酌情把后缀“-醇”或“-酚”(-ol )、“二醇”或“二酚”(diol )等加在母体氢化物或芳烃名称的末端来表示的。中文命名中将羟基连在芳烃上的化合物(phenols )称作‘酚’,且在命名时用作这类化合物的后缀,但英文中无此种区别,均使用“-ol ”为后缀。 例:
CH 3-OH
甲醇(Methanol )
CH 32-CH 2-OH
OH
1
2
3
4
丁-1,3-二醇(Butane-1,3-diol )
123
4
OH
H
环己-2-烯-1-醇(Cyclohex-2-en-1-ol )
1
23
4
OH
H 5
6
7
8
双环[4.2.0]辛-3-醇(Bicyclo[4.2.0]octan-3-ol )
1
23
4
5
6
7
8
OH
9101112
艹屈-1-酚(Chrysen-1-ol ) 1
23
4
OH OH
OH
苯-1,2,4-三酚(Benene-1,2,4-triol )
OH
OH OH
HO
HO
苯六酚(Benzenehexol )
1
234
5
6HO
HO
HO
OH
1'2'
3'
4'5'
6'
联苯-2,4,4’,6-四酚(Biphenyl-2,4,4’,6-tetrol )
1
23
4
5
6
78N
OH
喹啉-8-酚(Quinolin-8-ol )
8-羟基喹啉(俗名,8-Hydroxyquinoline )(另一英文俗名‘oxine ’在此不推荐使用)
在还存在一个基团应优先作为主特性基团的情况下,用前缀“羟基-”表示羟基基团。 例:
H 3C CH CH 2OH
CH 2CH 2CH 2CHO
1
2
3
4
5
6
7
6-羟基庚醛(6-Hydroxyheptanal )
12
3
H COOH
H
OH
3-羟基环己烷羧酸(3-Hydroxycyclohexanecarboxylic acid )
1
2
34
HO
OH
S OH
O
O
2,4-二羟基苯磺酸(2,4-Dihydroxybenzenesulfonic acid )
醇按官能团类别法命名时的名称是从相应的母体氢化物的名称衍生而来的取代基前缀加上类名“醇(alcohol )”构成,在中文中,大多数场合下,取代基的‘基’字省略。实际上中文中这与取代法命名,母体氢化物名称省略烷字后加后缀“-醇(-ol )”,所得的名称是相同的。 例:
H 3C CH 2OH
乙(基)醇(Ethyl alcohol )(官能团类别法命名)
乙(烷)醇(Ethanol )(取代法命名)
H 3C CH 2CH OH
CH 3
仲丁(基)醇(sec -Butyl alcohol )(官能团类别法命名) 仲丁(烷)醇(sec -Butanol )(取代法命名)
英文中对以下的结构及其位置异构体还保留简约的名称,但中文仍为系统名:
1
234
OH
2-萘酚(2-Naphthol )
1
23
4
5
6
7OH
89
10
9-蒽酚(9-Anthrol )
2
OH
14
3
5
2-菲酚(2-Phenanthrol )
一些保留俗名的羟基化合物和醚见下表(表6-3-1),其中部份名称中文仍采用系统名。 表6-3-1. 一些保留俗名的羟基化合物和醚
此是被允许的。 #
名称“片呐醇”也可用作类名。
6.3.1.2. 醇和酚的硫、硒、碲类似物(Sulfur, selenium, and tellurium analogues of alcohols and phenols )用“-硫醇(酚)(-thiol )”、“-硒醇(酚)(-selenol )”、“-碲醇(酚)(-tellurol )”等后缀,按相同的方法命名醇和酚的硫、硒、碲类似物,同时分别用“巯基-(sulfanyl-)”、“氢硒基-(selanyl-)”、“氢碲基-(tellanyl-)”等前缀来定名特性基团-SH 、-SeH 、-TeH 。
IUPAC 不推荐在酚的俗名中使用前缀“硫代”、“硒代”、“碲代”来表示羟基氧原子分别被硫、硒、碲置换。
在1979年版的IUPAC 《有机化学命名法》中分别用前缀“mercapto-(巯基-)”和“hydroseleno-(氢硒基-)”来为HS-和HSe-命名,但在1993年的建议中不推荐使用。中文中我们建议仍使用习惯上的巯基-、氢硒基-等在命名时作为前缀,而不使用甲硫烷基-、甲硒烷基-等。
羟基化合物的硫、硒、碲类似物的高位次序为:O > S > Se > Te 。 例:
H 3C CH 2SH
乙硫醇(Ethanethiol ) H 3C CH 2SeH
乙硒醇(Ethaneselenol ) C 6H 5SH
苯硫酚(而不是硫代苯酚)(Benzenethiol 而不是 Thiophenol )
1
2
HS CH 2CH 2COOH
3
3-巯基丙酸(3-Sulfanylpropanoic acid )
SH
1
2
萘-2-硫酚(Naphthalene-2-thiol )
HSe
COOH
1
23
4
4-氢硒基苯甲酸(4-Selanylbenzoic acid )
2
1OH
2-巯基苯酚 (2-sulfanylphenol )
124
56
OH
SH
HO HS
5-(1-羟基-2-巯基乙基)-2-巯基环己烷-1-醇
(5-(1-hydroxy-2-sulfanylethyl)-2-sulfanylcyclohexan-1-ol )
6.3.2. 由醇、酚及其类似物衍生而来的取代基前缀
基团RO-的取代基前缀名称是通过在基团R 的取代基前缀名称后面加上“氧基”而形成的。英文中有简约的名称(表6-3-2.),但中文中无此问题,只是中文中R 基团后的‘基’字经常可省略。 例:
H 3C CH 2CH 2CH 2CH 2O
戊(基)氧基(Pentyloxy )
戊-1-(基)氧基(Pentan-1-yloxy )
N
O
2-吡啶(基)氧基(2-Pyridyloxy ) 吡啶-2-(基)氧基(Pyridin-2-yloxy )
表6-3-2. 英文中有简约名称的羟基化合物衍生的取代基 类型1——无限制取代 CH 3-O-
甲氧基(Methoxy ) CH 3-CH 2-O-
乙氧基(Ethoxy ) CH 3-[CH 2]2-O-
丙氧基(Propoxy )
CH 3-[CH 2]3-O- 丁氧基(Butoxy ) C 6H 4-O-
苯氧基(Phenoxy )
类型3——无取代 (CH 3)2CH-O-
异丙氧基(Isopropoxy ) (CH 3)2CH-CH 2-O-
异丁氧基(Isobutoxy )
CH 3-CH 2-CH(CH 3)-O- 仲丁氧基(sec -Butoxy ) (CH 3)3C-O-
叔丁氧基(tert -Butoxy )
通过将基团R 的前缀名称分别与“硫基-(sulfanyl-)”(见第4章表4-1)、“硒基
-(selanyl-)”或“碲基-(tellanyl-)”连接,形成RS-、RSe-和RTe-的取代基前缀名称。在IUPAC《有机化学命名法》的前几个版本中,通过将“thio(硫代)”或“sleno(硒代)”加在基团R的取代基前缀名称后来形成RS-和RSe-的取代基前缀名称,但中文命名相同。例:
CH3-S-
甲(基)硫基(Methylsulfanyl)
(习惯上称为甲硫基(Methylthio))
C6H5-Se-
苯(基)硒基(Phenylselanyl)
(习惯上称为苯硒基(Phenylseleno))
通过将“二氧叉基”或“二硫叉基”加在二价基团-Y-的名称上来命名二价基团如-O-Y-O-和-S-Y-S-。
例:
-O-CH2-O-
甲叉(基)二氧叉基(Methylenedioxy)
-S-SO2-S-
磺酰叉(基)二(硫叉基)(Sulfonylbis(sulfanediyl))
6.3.3. 盐(Salts)
由醇、酚和它们的硫属类似物失去硫属原子上的氢原子(以氢阳离子的形式)而产生的阴离子通过将其名称最后的“醇”或“酚”(“ol” )改为“醇盐”或“酚盐”(“olate”)来命名。英文中当基团RO-有缩写名称,例如甲氧基时,可通过将末尾的“oxy”(“氧基”)改为“oxide”(“氧化物”)来命名阴离子。
例:
CH3-O-Na+
甲醇钠(Sodium methanolate)
甲氧(化)钠(Sodium methoxide)
CH3-CH2-S-Na+
乙硫醇钠(Sodium ethanethiolate)
乙(基)硫(化)钠(Sodium ethyl sulfide)
(CH3-CH2-CH2-O-)2Mg2+
二正丙醇镁(Magnesium bis(propan-1-olate))
二正丙(基)氧(化)镁(Magnesium dipropoxide)
6.3.4. 醚和硫属类似物(Ether and chalcogen analogues)
通式为R-O-R’、R-S-R’、R-Se-R’和R-Te-R’的化合物属类上分别称为“醚”、“硫
第七章 多环芳烃
第七章 多环芳烃 1、 联苯及其衍生物 2、 稠环芳烃:萘、蒽、菲及其衍生物的结构和化学性质 1、 芳香体系与休克尔规则 基本要求: 1.熟练掌握稠环芳烃萘蒽等衍生物的命名。 2.熟练掌握萘的化学性质及萘环上亲电取代产物的定位规律。 3.掌握H ückel 规则,理解芳香性的概念,能应用H ückel 规则判断环状化合物的芳香性。 分子中含有多个苯环的烃称作多环芳烃。多环芳烃可分如下三种: 联苯和联多苯类:这类多环芳烃分子中有两个或两个以上的苯环直接以单键相联结。 稠环芳烃:这类多环芳烃分子中有两个或两个以上的苯环以共用两个碳原子的方式相互稠合。 多苯代脂肪类:这类多环芳烃可看作是脂肪烃中两个或两个以上的氢原子被苯基取代。 7.1联苯及其衍生物 联苯是两个苯环通过单键直接连接起来的二环芳烃。 其结构为: 联苯为无色晶体,熔点70℃,沸点254℃。不溶于水而溶于有机溶剂。因其沸点高和具有很好的热稳定性,所以工业上常用它作热传导介质(热载体)。 联苯的化学性质与苯相似,在两个苯环上均可发生磺化、硝化等取代反应。联苯环上碳原子的位置采用下列所示的编号来表示: 联苯可看作是苯的一个氢原子被苯基取代,而苯基是邻对位定位基,所以,当联苯发生取代反应时,取代基进入苯的对邻位和对位。但由于邻位上的空间位阻较大,主要生成对位产物。 7.2稠环芳烃 有多个苯环共用两个或多个碳原子稠合而成的芳烃称为稠环芳烃。简单的稠环芳烃如萘、蒽、菲等。稠环芳烃最重要的是萘。 7.2.1萘(naphthalene) 萘的结构:平面结构,所有的碳原子都是sp 2杂化的,是大π键体系。 分子中十个碳原子不是等同的,为了区别,对其编号如下: 萘的一元取代物只有两种,二元取代物两取代基相同时有10种,不同时有14种。 萘的物理性质:萘是白色晶体,熔点80.5℃,沸点218℃,有特殊气味,易升华,不溶于水,易溶于热的气醇及乙醚,常用作防柱剂。萘在染料合成中应用很广,大部分用于制造邻苯二甲酸酐。 12345678109αβααα βββ1、4、5、8位又称为 位αβ2、3、6、7位又称为 位电荷密度αβ>
第六章-单环芳烃(答案)
第六章 单环芳烃(答案) 【作业题答案】 1. 写出下列化合物的构造式: (1)间二硝基苯 (2)对溴硝基苯 (3)对羟基苯甲酸 (4)3,5-二硝基苯磺酸 (1) NO 2 NO 2 Br NO 2COOH OH SO 3H NO 2 O 2N (2) (3) (4) 2. 命名下列化合物: (2) (3) (1) C(CH 3)3 C 2H 5 NO 2COOH NO 2 NO 2 (1) 叔丁苯 (2)对硝基乙苯 (3)2,4- 二硝基苯甲酸 3. 用化学方法区别下列化合物。 白 白 C CH C H CH 22CCl 4 褪色褪色 Ag(NH 3)2NO 3 ××× × × 4. 用箭头表示下列化合物发生一元硝化反应时硝基进入苯环的主要位置(一个或几个)。
(1) (2) NHCOCH 3 COOH (4) NO 2 OCH COOH (3) 5. 完成下列反应。 + AlCl 3 ( ) (1) ¢ùCH 3 + CH 3CHCH 2Cl CH 3 AlCl 3 ( ) KMnO 4( ) CH 3 C(CH 3)3 COOH C(CH 3)3 (2) 无水AlCl CH 3 + CH 3CH 2CH 2O Cl ( ) ( )Zn-Hg CH 3 C CH 2CH 2CH 3CH 3 H 2C CH 2CH 2CH 3 (3) H 3CO H 3CO CH 2CHCH 2 COCl 3 ( ) H 3CO H 3CO O H 2 C (4) H N O +HNO 3 24 ( )H N O O 2N (5) 6. 指出下列反应中的错误。 (1) CH 2CH 2CH 3 322,AlCl 3 (B ) Cl CH 2CH 2CH 2Cl A 错,应得异丙苯; B 错,应为氯取代α-H 。
苯的同系物的命名
苯的同系物的命名 1.含苯基的单环芳烃的命名 最简单的此类单环芳烃是苯(benzene)。其它的这类单环芳烃可以看作是苯的一元或多元烃基的取代物。苯的一元烃基取代物只有一种。命名的方法有两种,一种是将苯作为母体。烃基作为取代基,称为××苯。另一种是将苯作为取代基,称为苯基(phenyl),它是苯分子减去一个氢原子后剩下的基团,可简写成ph?,苯环以外 meta) )为词头,”) syn”) 顺序规则中较小的基团位次尽可能小,英文命名时,应按英文字母顺序,让字母排在前面的基团位次尽可能小。例如: 除苯外,下面六个芳香烃的俗名也可作为母体化合物的名称。而其它芳烃化合物可看作它们的衍生物。 例如: 2.多环芳烃的命名
分子中含有多个苯环的烃称为多环芳烃(polycyclicarenes)。主要有多苯代脂烃(multi-phenylalicyclichydrocarbons)、联苯(biphenyl)和稠合多环芳烃(fusedpolycyclicarenes)。 (1)多苯代脂烃的命名 链烃分子中的氢被两个或多个苯基取代的化合物称为多苯代脂烃。命名时,一般是将苯基作为取代基,链烃作为母体。例如: (2 例如: (3 β位。蒽分子的1,4,5,8位等同,也称为α位,2,3,6,7位等同,也称为β位,9,10位等同,称为γ位。菲有五对等同的位置,它们分别是:1,8,2,7,3,6,4,5和9,10。取代稠环芳烃的名称格式与有机化合物名称的基本格式一致。例如: 3.非苯芳烃 分子中没有苯环而又具有芳香性的环烃称为非苯芳烃。单环非苯芳烃的结构一般符合Huckel规则。即它们都是含有4n+2个π电子的单环平面共轭多烯。例如:
第六章 单环芳烃(答案)
第六章 单环芳烃(答案) 【作业题答案】 1. 写出下列化合物的构造式: (1)间二硝基苯 (2)对溴硝基苯 (3)对羟基苯甲酸 (4)3,5-二硝基苯磺酸 (1) NO 2 NO 2 Br NO 2COOH OH SO 3H NO 2 O 2N (2) (3) (4) 2. 命名下列化合物: (2) (3) (1) C(CH 3)3 C 2H 5 NO 2COOH NO 2 NO 2 (1) 叔丁苯 (2)对硝基乙苯 (3)2,4- 二硝基苯甲酸 3. 用化学方法区别下列化合物。 白 白 C CH C H CH 22CCl 4 褪色褪色 Ag(NH 3)2NO 3 ××× × × : 4. 用箭头表示下列化合物发生一元硝化反应时硝基进入苯环的主要位置(一个或几个)。
(1) (2) NHCOCH 3 COOH (4) NO 2 OCH COOH (3) 5. 完成下列反应。 + AlCl 3 ( ) (1) ¢ùCH 3 + CH 3CHCH 2Cl CH 3 AlCl 3 ( ) KMnO 4( ) CH 3 C(CH 3)3 COOH C(CH 3)3 (2) 无水AlCl CH 3 + CH 3CH 2CH 2O Cl ( ) ( )Zn-Hg CH 3 C CH 2CH 2CH 3CH 3 H 2C CH 2CH 2CH 3 (3) H 3CO H 3CO CH 2CHCH 2 COCl 3 ( ) H 3CO H 3CO O H 2 C (4) H N O +HNO 3 24 ( )H N O O 2N (5) 6. 指出下列反应中的错误。 (1) CH 2CH 2CH 3 322,AlCl 3 (B ) Cl CH 2CH 2CH 2Cl A 错,应得异丙苯; 。
多环芳烃
多环芳烃、硝基苯等有机污染物去除技术的进展 摘要:目前,污染时当今世界范围所面临的普遍问题。特别是有机的污染是当今更严重的问题。这篇文章主要介绍了多环芳烃和硝基苯类有机污染物去除技术的进展。 关键词:多环芳烃硝基苯去除技术 一、多环芳烃类污染物的研究进展 随着煤、石油在工业生产,交通运输以及生活中被广泛应用,多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)已成为世界各国共同关注的有机污染物。多环芳烃不易溶于水,极易附着在固体颗粒上,所以一般来说,大气、土壤中的大多数多环芳烃处于吸附态。多环芳烃类污染物分布很广,基本上在各种环境介质中都发现了PAH s。因排废气、废水及废物倾倒,多环芳烃对水、大气及土壤产生直接污染。吸附在烟气微粒上的多环芳烃随气流传向周围及更远处,又随降尘、降雨及降雪进入水体及土壤而土壤及地面多环芳烃通过扬尘再次进入大气,通过呼吸及食物链进入动物体产生毒害。 在土壤和沉积物环境中,大多数PAHs因较强的疏水性趋向于分配到土壤或沉积物颗粒上去,并与天然有机物发生相互作用,很少保留在水体当中。当沉积物一旦遭到严重的污染,在与上覆水体发生相互频繁的交换作用时,被污染的沉积物环境还将
成为水体再次污染的潜在来源,造成二次污染。 水环境中PAHs生物降解的程度要靠PAHs的溶解率的大小,正因为大多数PAHs易被吸附分配到土壤或沉积物颗粒上去,使之生物有效性降低而导致其生物降解率大大降低。虽然被吸附于土壤、沉积物上的PAHs因生物有效性降低而减小对环境的毒害,但最终会通过各种因素再次释放到环境之中产生危害。刘凌[12]在研究吸附作用对有机污染物的生物降解过程影响时,发现吸附在土壤颗粒内部的有机污染物,必须通过解吸和扩散过程传输到土壤颗粒外部的水溶液中,然后才能被微生物降解。如果有机污染物的土壤-水吸附分配系数Kd越大,则它存在于土壤水溶液的重量百分比就越小,发生生物降解反应的可能性就越小。Weissenfels等在研究阻碍PAHs生物降解的土壤特性和PAHs吸附与生物降解之间的关系时也发现,PAHs与土壤有机质结合力是PAHs发生生物降解的关键。他在沙和土壤吸附PAHs实验中,观察到沙吸附的PAHs能够很快被微生物降解到检测限以下,而土壤吸附的PAHs则降解很慢,并且有23%的PAHs不可被微生物降解。 二、硝基苯类有机污染物去除技术的进展 硝基芳香族化合物是重要的化工原料,被广泛应用于医药、燃料、农药、塑料等的合成前体,常常在生产和使用过程中被释放到环境中对生态系统造成影响,是一类重要的环境污染物。硝基苯对人与动物有较强的毒害作用,能引起紫绀,刺激皮
单环芳烃
第六章单环芳烃 一、写出分子式为C9H12的单环芳烃所有的异构体并命名之。 二、写出下列化合物的结构式。 1.1.间二硝基苯 2,对溴硝基苯 3, 1,3,5-三乙苯4,对羟基苯甲酸 NO2 NO2 NO2 Br C2H5 C2H5 C2H5 OH COOH 5,2,4,6-三硝基甲苯6,间碘苯酚 7,对氯苄氯8,3,5-二硝基苯磺酸 CH3 NO2NO2 NO2OH I Cl CH2Cl NO2 NO2 SO3H 三、命名下列化合物。 C2H5 C(CH3)3 CH3 Cl NO2 CH2OH 叔丁基苯对氯甲苯对硝基乙苯苄醇
3 SO 2Cl COOH NO 2 NO 2 C 12H 25 SO 3Na CH 3 苯磺酰氯 2,4-二硝基苯甲酸 对十二烷基苯磺酸钠 1-(4-甲苯基丙烯 四、 用化学方法区别各组化合物。 1 . 解:环己烷 环己烯 苯 CH 2CH 3 CH=CH 2 C CH 2, 解:乙苯 苯乙烯 苯乙炔 五、以构造式表示下列各组化合物经硝化后可能得到的主要化合物(一种或几种)。 1,C 6H 5Br 2,C 6H 5NHCOCH 3 Br NO 2 Br NO 2 NHC OC H 3 NO 2 NO 2 NHC OC H 3 C 2H 5 NO 2 NO 2 C 2H 5 3,C 6H 5C 2H 5
4,C 6H 5COOH 5,O - C 6H 4(OH)COOH 6,P - CH 3C 6H 4COOH COOH NO 2 COOH OH COOH OH NO 2 NO 2 NO 2 CH 3 COOH OCH 3 7. m -C 6H 4(OCH 3)2 8.m -C 6H 4(NO 2)COOH 9.o -C 6H 4(OH)Br OCH 3 OCH 3 NO 2 OCH 3 NO 2NO 2 COOH NO 2 OH Br OH Br HO OH 10,邻甲苯酚 11,对甲苯酚 12,间甲苯酚 CH 3NO 2 OH OH CH 3 NO 2 OH CH 3 NO 2 CH 3 CH 3 OH OH CH 3 NO 2 NO 2 NO 2 OH 五、 完成下列反应式。 1, + CH 3AlCl CH 3 23SO 2Cl CH 3 + AlCl CH 3CH 2CH 2Cl CH(CH 3)2 KMnO 4,H 2SO 4 COOH 2, CH 3 Cl 2 /hv CH 2Cl AlCl 3 CH 2 3,
土壤中多环芳烃前处理(中文)
11 水体沉积物和土壤中多环芳烃的分析方法研究 汪瑾彦1* 陈大舟2 汤 桦2 冯 洁1 吴 雪2 王 覃3 赵新颖3 李 蕾1** (1.北京化工大学理学院?北京?100029) (2.中国计量科学研究院化学计量与分析科学研究所?北京?100013) (3.北京市理化分析测试中心?北京?100089?) 摘?要?简单论述水体沉积物和土壤中多环芳烃的来源及危害,系统综述国内外分析多环芳烃的前处理和检测方法的研究进展,对微波辅助萃取、超声波提取、快速溶剂萃取、超临界流体萃取、固相萃取、固相微萃取等前处理技术在水体沉积物和土壤中的应用进行概述和比较,对气相色谱质谱联用、高效液相色谱、高效液相色谱质谱联用等测定方法分别进行归纳和对比,并对多环芳烃的分析方法进行展望。关键词?多环芳烃 沉积物 土壤 前处理 检测 *作者简介:汪瑾彦(1985-),女,湖南湘潭人,硕士研究生,研究方向为环境污染物监测和分析**通讯作者,Email:lilei@https://www.360docs.net/doc/4111484062.html, 多环芳烃(polycyclic aromatic hydrocarbons ,PAHs)是指2个或2个以上苯环以稠环形式相连的化合物, 如萘、蒽、菲等。PAHs 是一类具有“致癌、致畸、致突变”效应的持久性有机污染物。目前已发现的致癌性多环芳烃及其衍生物已超过400种。 环境中的PAHs 主要来源于含碳化合物的不完全燃烧,如石油、木材、垃圾和煤[1]。PAHs 通过废水的排放,大气沉降,土表迁移,石油泄漏等多种形式进入水体,在我国的许多海洋和河流的沉积物中都不同程度地检测出PAHs ,如黄河、黄浦江和珠江等[2~4]。PAHs 虽然在土壤中含量极少,但在我国分布广泛且不均衡,尤其是在农业土壤和人口较集中的城市周边土壤中[5~8],由于其低溶解性和憎水性,比较容易进入生物体内,并通过生物链进入生态系统,从而危害人类健康和整个生态系统的安全。 因此, 在环境质量评价、环境本底调查等方面对PAHs 进行监测显得十分重要。世界各国都制定相关法律来控制PAHs 对环境的危害。目前,大多数国家都将PAHs 列为环境监测的重要内容之一,美国环保总署(EPA)确定16种PAHs(简称EPA-PAHs)作为优先监测污染物[9]。我国颁布的环境监测的项目中,也将PAHs 列入其中。 1?样品前处理 由于PAHs 在土壤和水体沉积物中存在的形态多种多样,而且土壤和水体沉积物成分复杂,基体干扰较严重,因此,在分析检测土壤和水体沉积物 中PAHs 的含量之前,样品前处理步骤十分重要。目前用于土壤和沉积物中PAHs 的前处理方法有微波协助萃取法(MAE)、超声波提取(UE)、加速溶剂萃取(ASE)、固相萃取(SPE)、固相微萃取(SPME)和超临界流体萃取(SFE)等,这些方法各有其优缺点。1.1?微波辅助萃取法(MAE) 微波辅助萃取是以微波为能量的样品制备方法。该法能保持分析对象的原本状态,与传统的索氏提取相比,该法更加快速、节能、节省溶剂、污染小,而且有利于萃取热不稳定的物质,有利于被萃取物从基体上解吸,特别适合处理大量样品。 Criado 等[10]在1g 空白土壤中加入总量为25μg 的16种PAHs ,用2~10mL 乙腈,10min 微波萃取。结果表明,3mL 乙腈时条件最优,微波能量在425W 时信号最强。Li Xu 等[11]用微波辅助微固相萃取(MAE-μ-SPE)一步萃取净化土壤中的PAHs 。在一个装有溶剂探测器的微波萃取系统加入1.0g 土样,加入10mL 水,在2min 内温度由室温升至指定水平。其最佳实验条件是用微波在50℃加热20min ,超声波乙腈洗提5min 。GC-MS 分析检出限达到0.0017~0.0057ng/g,线性范围可达1~500/1000 ng/g 。 Pinuela 等[12]用25mL 丙酮∶二氯甲烷溶剂(1∶1)萃取海洋中19种PAHs ,萃取温度为110℃,微波炉功率1200W ,萃取10min ,回收率可达47%~102%。 1.2?超声波提取(UE)? 超声提取法是一种较为简单、快速的固体样品
芳香烃的命名
芳香烃的命名 The latest revision on November 22, 2020
四、芳香烃的命名 1含苯基的单环芳烃的命名 最简单的此类单环芳烃是苯(benzene)。其它的这类单环芳烃可以看作是苯的一元或多元烃基的取代物。苯的一元烃基取代物只有一种。命名的方法有两种,一种是将苯作为母体。烃基作为取代基,称为××苯。另一种是将苯作为取代基,称为苯基(phenyl),它是苯分子减去一个氢原子后剩下的基团,可简写成ph,苯环以外的部分作为母体,称为苯(基)××。例如: 苯的二元烃基取代物有三种异构体,它们是由于取代基团在苯环上的相对位置的不同而引起的,命名时用邻或o (ortho)表示两个取代基处于邻位,用间或m(meta)表示两个取代基团处于中间相隔一个碳原子的两个碳上,用对或p(para)表示两个取代基团处于对角位置,邻、间、对也可用1,2、1,3、1,4表示。例如: 若苯环上有三个相同的取代基,常用“连”(英文用“vicinal”,简写“vic”)为词头,表示三个基团处在1,2,3位。用“偏”(英文用“unsymmetrical”,简写“unsym”)为词头,表示三个基团处在 1,2,4位。用“均”(英文用“symmetrical”,简写“syn”)为词头,表示三个基团处在1,3,5位。例如: 当苯环上有两个或多个取代基时,苯环上的编号应符合最低系列原则。而当应用最低系列原则无法确定那一种编号优先时,与单环烷烃的情况一样,中文命名时应让顺序规则中较小的基团位次尽可能小,英文命名时,应按英文字母顺序,让字母排在前面的基团位次尽可能小。例如: 除苯外,下面六个芳香烃的俗名也可作为母体化合物的名称。而其它芳烃化合物可看作它们的衍生物。 例如: 2多环芳烃的命名 分子中含有多个苯环的烃称为多环芳烃(polycyclicarenes)。主要有多苯代脂烃(multi-phenylalicyclichydrocarbons)、联苯(biphenyl)和稠合多环芳烃(fusedpolycyclicarenes)。 (1)多苯代脂烃的命名 链烃分子中的氢被两个或多个苯基取代的化合物称为多苯代脂烃。命名时,一般是将苯基作为取代基,链烃作为母体。例如: (2)联苯型化合物的命名 两个或多个苯环以单键直接相连的化合物称为联苯型化合物。例如: 联苯类化合物的编号总是从苯环和单键的直接连接处开始,第二个苯环上的号码分别加上(’)符号,第三个苯环上的号码分别加上“’’”符号,其它依次类推。苯环上如有取代基,编号的方向应使取代基位置尽可能小,命名时以联苯为母体。例如: (3)稠环芳烃的命名 两个或多个苯环共用两个邻位碳原子的化合物称为稠环芳烃。最简单最重要的稠环芳烃是萘、蒽、菲。 萘、蒽、菲的编号都是固定的,如上所示。 萘分子的1,4,5,8位是等同的位置,称为α位,2,3,6,7位也是等同的位置,称为β位。蒽分子的1,4,5,8位等同,也称为α位,2,3,6,7位等同,也称为β位,9,10位等同,称为γ位。菲有五对等同的位置,它们分别是:1,8,2,7,3,6,4,5和9,10。取代稠环芳烃的名称格式与有机化合物名称的基本格式一致。例如: 3非苯芳烃 分子中没有苯环而又具有芳香性的环烃称为非苯芳烃。单环非苯芳烃的结构一般符合Huckel规则。即它们都是含有4n+2个π电子的单环平面共轭多烯。例如: 常见的单环非苯芳烃化合物可按前面讲过的一般原则来命名。轮烯(Annulenes)是一类单双键交替出现的环状烃类化合物。命名时将成环的碳原子数放在方括号内,括号后面写上轮烯即可。也可以不写括号,用一短线将数字和轮烯
写出单环芳烃word版
第七章芳烃 1.写出单环芳烃的同分异构体的构造式并命名之 答案: 解: 2.写出下列化合物的构造式。 (1)3,5-二溴-2-硝基甲苯(2)2,6-二硝基-3-甲氧基甲苯 (3)2- 硝基对甲苯磺酸(4)三苯甲烷 (5)反二苯基乙烯(6)环己基苯 (7)3-苯基戊烷(8)间溴苯乙烯 (9)对溴苯胺(10)氨基苯甲酸 (11)8-氯-奈甲酸(12)(E)-1-苯基-2-丁烯 答案:
(11) Cl COOH (12)CH2 CH3 3、写出下列化合物的结构式。 (1)2-nitrobenzoie acid (2)p-bromotoluene (3)o-dibromobenzene (4)m-dinitrobenzene (5)3,5-dinitrophenol (6)3-chloro-1-ethoxybenzen (7)2-methyl-3-phenyl-1-butanol(8)p-chlorobenzenesulfonic acid (9)benzyl bromide (10)p-nitroaniline
(11)o-xylene (12)tert-butylbenzene (13)p-cresol (14)3-phenylcyclohexanol (15)2-phenyl-2-butene (16)naphthalene 答案: (1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)(14)(15)(16) 4.在下列各组结构中应使用“”或“ ”才能把它们正确地联系起来,为什么? (1) (2) (3) (4) 答案: 解: 两组结构都为烯丙型C+共振杂化体
芳烃命名(2013-1.0)-5
第6章 各类化合物的命名 本章为前述的有机化合物一般命名规则在各类具体化合物中的应用。 6.1. 卤素,硝基,亚硝基,偶氮,重氮,叠氮化合物 (halogen, nitro, nitroso, azo, diazo, and azido compounds) 6.1.1. 卤素化合物 (halogen compounds) 某些俗名仍是保留外(见下表),其它卤素化合物按照二个方式进行系统命名。 分子式 中文 英文 CHF 3 氟仿 Fluoroform CHCl 3 氯仿 Chloroform CHBr 3 溴仿 Bromoform CHI 3 碘仿 Iodoform COCl 2 光气 Phosgene CSCl 2 硫光气 Thiophosgene 表6-1-1. 保留俗名的卤素化合物 取代操作法命名时采用在母体化合物名称前加前綴 ‘氟代’,‘氯代’,‘溴代’,或‘碘代’,前缀中的代字通常省略。 例: CH 3-CH 2-CH 2-CH 2-CH-CH 3 Cl 6 1 2 3 4 5 2-氯己烷 (2-chlorohexane) (CH 3)3Si -[SiH 2]3-SiHCl 3 1 5 1,1,1-三氯-5,5,5-三甲基戊硅烷 (1,1,1-trchloro-5,5,5-trimethylpentasilane) Cl-CH 2-CH 2-Br 1 2 1-溴-2氯乙烷 (1-bromo-2-chloroethane) NF 2-CO-NF 2 四氟脲 (tetrafluorourea) N Br 213 3-溴吡啶 (3-bromopyridine)
多环芳烃
多环芳烃(PAHs)是环境常见的污染物之一,其来源于有机物热解和不完全燃烧, 在空气、水、土壤中广泛分布。由于食品产地环境受到污染, 致使PAHs在食 品中存在,同时加工方式不同, 也会影响食品中PAHs的含量。长期食用含有PAHs的食物对健康将产生潜在威胁[2-5]。不同国家和地区, 烹饪方法和饮 食习惯不同,从食品中摄入的PAHs量也不相同。 不同食品中含有不同种类和浓度的多环芳烃,其主要来源有以下3方面: (1)自 然界天然存在的,如植物、细菌、藻类的内源性合成,使得森林、土壤、海洋 沉积物中存在多环芳烃类化合物; (2)环境污染造成的,现代工业生产和其它许 多方面要使用和产生多环芳烃类化合物;这些物质难免会有一些排放到食品的 生产环境如水源、土壤、空气、海洋中,从而对食品造成污染,这是目前食品 中多环芳烃最主要的来源;(3)食品加工和包装过程中产生的,如食品的烤、炸、熏制和包装材料、印刷油墨中多环芳烃污染,这也是食品中多环芳烃的重要来源。目前,各类食品已检测出20余种PAHs,其中以熏烤类食品污染最严重:如熏 肉吉有屈、苯并[b]荧蒽、苯并[e]芘、苯并[k]荧蒽、苯并[a]芘、1,2,5,6- 二苯并蒽、茚[1,2,3-cd]并芘等PAHs。王绪卿评价了14种熏烤肉中PAHs的污 染水平,并在19份腊昧肉中全部测出屈、苯并[e]芘、苯并[k]荧蒽,其中9份 样品苯并[a]芘量为0.34~27.56μg/kg。另据报道,尼日利亚各种熏烤鱼中均 含有PAHs。比较了现代烤炉与传统烤炉熏烤物中13种PAHs含量,前PAHs<4.5μg/kg。后者苯并[a]芘为0.2~4.1μg/kg(湿质量)。食用植物油及其加热产 物中均含有PAHs[6-7],而且加热后PAHs含量显著增加。实验表明,食用植物油 加温后B(a)P含量是加温前的2.33倍,1,2,5,6-二苯并蒽为4.17倍,而且油烟 雾中其含量更高,厨房空气气态样品中PAHs种类与含量均大于颗粒物,说明厨 房空气中PAHs可能主要是由于食品,特别是动植物蛋白以热油烹炸过程中形成。近年来在各种酒样中也发现了PAHs,但这方面研究尚待深入,Moret等在所有白 酒和啤酒中都检出苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘、1,12-苯并苝、 茚[1,2,3-cd]并芘以及芴、苯并a蒽、1,2,5,6-二苯并蒽,其PAHs总量<0.72 μg/kg。目前, 各种蔬菜亦受到不同程度PAHs污染, 其来源可能是根系吸 收及叶面吸附。国际癌症研究机构(IARC,1973)曾报道西红柿中苯并[a]芘为 0.2pg/kg,王爱玲等测定白菜和西红柿中苯并[a]芘分别为1.310~12.316μ g/kg和0.841~4.335μg/kg[8]。在食品制作的过程中,有许多制作方法是不可
2021年四、芳香烃的命名
四、芳香烃的命名 欧阳光明(2021.03.07) 1 含苯基的单环芳烃的命名 最简单的此类单环芳烃是苯(benzene)。其它的这类单环芳烃可以看作是苯的一元或多元烃基的取代物。苯的一元烃基取代物只有一种。命名的方法有两种,一种是将苯作为母体。烃基作为取代基,称为××苯。另一种是将苯作为取代基,称为苯基(phenyl),它是苯分子减去一个氢原子后剩下的基团,可简写成ph?,苯环以外的部分作为母体,称为苯(基)××。例如: 苯的二元烃基取代物有三种异构体,它们是由于取代基团在苯环上的相对位置的不同而引起的,命名时用邻或o(ortho)表示两个取代基处于邻位,用间或m(meta)表示两个取代基团处于中间相隔一个碳原子的两个碳上,用对或p(para)表示两个取代基团处于对角位置,邻、间、对也可用1,2?、1,3?、1,4?表示。例如: 若苯环上有三个相同的取代基,常用“连”(英文用“vicinal”,简写“vic”)为词头,表示三个基团处在1,2,3位。用“偏”(英文用“unsymmetrical”,简写“unsym”)为词头,表示三个基团处在1,2,4位。用“均”(英文用“symmetrical”,简写“syn”)为词头,表示三个基团处在1,3,5位。例如: 当苯环上有两个或多个取代基时,苯环上的编号应符合最低系列原则。而当应用最低系列原则无法确定那一种编号优先时,与单环烷烃的情况一样,中文命名时应让顺序规则中较小的基团位次尽可能小,英文命名时,应按英文字母顺序,让字母排在前面的基团位次尽可能小。例如:
除苯外,下面六个芳香烃的俗名也可作为母体化合物的名称。而其 它芳烃化合物可看作它们的衍生物。 例如: 2多环芳烃的命名 分子中含有多个苯环的烃称为多环芳烃(polycyclic arenes)。主要 有多苯代脂烃(multi-phenyl alicyclic hydrocarbons)、联苯 (biphenyl)和稠合多环芳烃(fused polycyclic arenes)。 (1)多苯代脂烃的命名 链烃分子中的氢被两个或多个苯基取代的化合物称为多苯代脂烃。 命名时,一般是将苯基作为取代基,链烃作为母体。例如: (2)联苯型化合物的命名 两个或多个苯环以单键直接相连的化合物称为联苯型化合物。例 如: 联苯类化合物的编号总是从苯环和单键的直接连接处开始,第二个苯环上的号码分别加上(’)符号,第三个苯环上的号码分别加上“’’”符号,其它依次类推。苯环上如有取代基,编号的方向应使取代基位置尽可能小,命名时以联苯为母体。例如: (3)稠环芳烃的命名 两个或多个苯环共用两个邻位碳原子的化合物称为稠环芳烃。最简 单最重要的稠环芳烃是萘、蒽、菲。 萘、蒽、菲的编号都是固定的,如上所示。 萘分子的1,4,5,8位是等同的位置,称为α位,2,3,6,7位也是等同的 位置,称为β位。蒽分子的1,4,5,8位等同,也称为α位,2,3,6,7位 等同,也称为β位,9,10位等同,称为γ位。菲有五对等同的位
多环芳烃来源和性质
多环芳烃来源和性质 自然源 主要包括燃烧(森林大火和火山喷发)和生物合成(沉积物成岩过程、生物转化过程和焦油矿坑内气体),未开采的煤、石油中也含有大量的多环芳烃 人为源 PAHs人为源来自于工业工艺过程、缺氧燃烧、垃圾焚烧和填埋、食品制作及直接的交通排放和同时伴随的轮胎磨损、路面磨损产生的沥青颗粒以及道路扬尘中,其数量随着工业生产的发展大大增加,占环境中多环芳烃总量的绝大部分;溢油事件也成为PAHs人为源的一部分。在自然界中这类化合物存在着生物降解、水解、光作用裂解等消除方式,使得环境中的PAHs含量始终有一个动态的平衡,从而保持在一个较低的浓度水平上,但是近些年来,随着人类生产活动的加剧,破坏了其在环境中的动态平衡,使环境中的PAHs大量的增加。因此,如何加快PAHs在环境中的消除速度,减少PAHs对环境的污染等问题,日益引起人们的注意。 多环芳烃大部分是无色或淡黄色的结晶,个别具深色,熔点及沸点较高,蒸气压很小,大多不溶于水,易溶于苯类芳香性溶剂中,微溶于其他有机溶剂中,辛醇-水分配系数比较高。多环芳烃大多具有大的共扼体系,因此其溶液具有一定荧光。一般说来,随多环芳烃分子量的增加,熔沸点升高,蒸气压减小。多环芳烃的颜色、荧光性和溶解性主要与多环芳烃的共扼体系和分子苯环的排列方式有关.随p电子数的增多和p电子离域性的增强,颜色加深、荧光性增强,紫外吸收光谱中的最大吸收波长也明显向长波方向移动;对直线状的多环芳烃,苯环数增多,辛醇-水分配系数增加,对苯环数相同的多环芳烃,苯环结构越“团簇”辛醇-水分配系数越大。 多环芳烃化学性质稳定.当它们发生反应时,趋向保留它们的共扼环状系,一般多通过亲电取代反应形成衍生物并代谢为最终致癌物的活泼形式。其基本单元是苯环,但化学性质与苯并不完全相似.分为以下几类 ⑴具有稠合多苯结构的化合物 如三亚苯、二苯并 [e,i]芘、四苯并 [a,c,h,j]葱等,与苯有相似的化学稳定性, 说明:电子在这些多环芳烃中的分布是和苯类似的。 图1x电子分布与苯类似的多环芳烃 ⑵呈直线排列的多环芳烃
芳烃的命名与结构
第十章 芳烃 第一节 芳烃的命名与结构 一、苯衍生物的命名与苯的结构 1.苯衍生物的命名 a.常见基团的命名优先顺序 常见基团的命名优先顺序:COOH>SO 3H>COOR>CONH 2>CN>CHO>CO>OH>NH 2>C ≡C>C=C>C 6H 5(苯环)>R (烷基)>X ,NO 2(这两种官能团在命名时总是作为取代基)。 当分子中存在多种官能团时物质的类名由命名优先的官能团决定而其它官能团只看作取代基。 b.确定母体名称 苯的同系物、卤代物和硝基化合物以苯作为母体名称。对结构复杂或侧链带有官能团的化合物将侧链当母体而苯环作为取代基。 当苯环上有命名优先的官能团时将苯环与优先官能团一起作为母体其它作为取代基。 c.编号 当苯环上有两个基团时可用词头—“邻”、“间”和“对”表示两个基团在环上的位置但也可用编号数来表示,当苯环上有多个基团时基团在环上的位置只能用编号数来表示,编号遵循官能团最小位次(如果有的话)规则和(优先级最低的)取代基最小位次规则。 d.从左至右按先取代基后母体的顺序书写名称。 e.当存在多种取代基时取代基按优先级增大的顺序从左至右排列,即取代基按CIP 次序规则依次写出。例如, OH CH 3 OH CO 2H 这两个化合物可以分别命名为:邻羟基苯甲酸和2-甲基-5-氯苯酚。 2.苯的结构 苯是一个平面分子,六个碳原子以SP 2杂化轨道相互重叠形成六个碳碳σ键组成一个平面正六边形,每一个碳原子未参与杂化的P 轨道相互平行重叠组成闭合的离域大π键(一个六中心六电子π键)。如果采用共振论,苯的结构可以写成如下两个Kekule 式的杂化体: 由此苯具有大的共振稳定性,根据燃烧热或氢化热数据得到苯的共振能是150kJ/mol 。 可以用如下的非Kekule 式表示苯的结构,其中圆圈表示离域π电子: 但也常常用一个Kekule 式: 或 作为苯杂化体的简写,但必须牢记π键不是孤立的而是离域的。 二、萘衍生物的命名与萘的结构 1.萘衍生物的命名
芳香烃的命名
四、芳香烃的命名 令狐采学 1 含苯基的单环芳烃的命名 最简单的此类单环芳烃是苯(benzene)。其它的这类单环芳烃可以看作是苯的一元或多元烃基的取代物。苯的一元烃基取代物只有一种。命名的方法有两种,一种是将苯作为母体。烃基作为取代基,称为××苯。另一种是将苯作为取代基,称为苯基(phenyl),它是苯分子减去一个氢原子后剩下的基团,可简写成ph?,苯环以外的部分作为母体,称为苯(基)××。例如:苯的二元烃基取代物有三种异构体,它们是由于取代基团在苯环上的相对位置的不同而引起的,命名时用邻或o(ortho)表示两个取代基处于邻位,用间或m(meta)表示两个取代基团处于中间相隔一个碳原子的两个碳上,用对或p(para)表示两个取代基团处于对角位置,邻、间、对也可用1,2?、1,3?、1,4?表示。例如: 若苯环上有三个相同的取代基,常用“连”(英文用“vicinal”,简写“vic”)为词头,表示三个基团处在1,2,3位。用“偏”(英文用“unsymmetrical”,简写“unsym”)为词头,表示三个基团处在1,2,4位。用“均”(英文用“symmetrical”,简写“syn”)为词头,表示三个基团处在1,3,5位。例如: 当苯环上有两个或多个取代基时,苯环上的编号应符合最低系列原则。而当应用最低系列原则无法确定那一种编号优先时,与单环烷烃的情况一样,中文命名时应让顺序规则中较小的基团位次尽可能小,英文命名时,应按英文字母顺序,让字母排在前面的基团位次尽可能小。例如:
除苯外,下面六个芳香烃的俗名也可作为母体化合物的名称。而其它芳烃化合物可看作它们的衍生物。 例如: 2多环芳烃的命名 分子中含有多个苯环的烃称为多环芳烃(polycyclic arenes)。主要有多苯代脂烃(multi-phenyl alicyclic hydrocarbons)、联苯(biphenyl)和稠合多环芳烃(fused polycyclic arenes)。 (1)多苯代脂烃的命名 链烃分子中的氢被两个或多个苯基取代的化合物称为多苯代脂烃。命名时,一般是将苯基作为取代基,链烃作为母体。例如:(2)联苯型化合物的命名 两个或多个苯环以单键直接相连的化合物称为联苯型化合物。例如: 联苯类化合物的编号总是从苯环和单键的直接连接处开始,第二个苯环上的号码分别加上(’)符号,第三个苯环上的号码分别加上“’’”符号,其它依次类推。苯环上如有取代基,编号的方向应使取代基位置尽可能小,命名时以联苯为母体。例如:(3)稠环芳烃的命名 两个或多个苯环共用两个邻位碳原子的化合物称为稠环芳烃。最简单最重要的稠环芳烃是萘、蒽、菲。 萘、蒽、菲的编号都是固定的,如上所示。 萘分子的1,4,5,8位是等同的位置,称为α位,2,3,6,7位也是等同的位置,称为β位。蒽分子的1,4,5,8位等同,也称为α位,2,3,6,7
第七章 多环芳烃
7.1联苯及其衍生物 7.2稠环芳烃 7.2.1萘及其衍生物 萘是有光亮的白色片状晶体,熔点80.2 o C ,沸点218 o C ,不溶于水,易溶于乙醇、乙醚和苯等有机溶剂。燃烧时光亮弱、烟多。萘挥发性大,易升华,有特殊气味,具有驱虫防蛀作用,过去曾用于制作“卫生球”。近年来研究发现,萘可能有致癌作用,现使用樟脑取代萘制造卫生球。萘在工业上主要用于合成染料、农药等。萘的来源主要是煤焦油和石油。 1.萘的结构和萘的衍生物的命名 萘的分子式为C 10H 8,是由两个苯环共用两个相邻的碳原子稠合而成,两个苯环处于 同一平面上。萘分子中每个碳原子均以sp 2 杂化轨道与相邻的碳原子形成碳碳σ键,每个碳原子的p 轨道互相平行,侧面重叠形成一个闭合共轭大π键,因此同苯一样具有芳香性。但萘和苯的结构不完全相同,萘分子中两个共用碳上的p 轨道除了彼此重叠外,还分别与相邻的另外两个碳上的p 轨道重叠,因此闭合大π键电子云在萘环上不是均匀分布的,导致碳碳键长不完全等同,所以萘的芳香性比苯差。 萘分子中碳碳键长数据如下: 萘的芳香性不如苯还可通过离域能数据看出。苯的离域能为150.5kJ?mol -1 ,如果萘的芳香性和苯一样,萘的离域能应为苯的离域能的2倍,而事实上萘的离域能仅是 250kJ?mol -1 。 由于萘环上各碳原子的位置并不完全等同,因此萘的衍生物命名时,无论萘环上有几个取代基,取代基的位置都要注明。萘环的编号方法如下: 其中,1、4、5、8位置相同,称做α-位;2、3、6、7位置相同,称做β-位。 12345678 ααααβββ β CH 3CH 3 SO 3H NO 2甲基萘甲基萘硝基 萘磺酸--甲基萘甲基萘12--αβ--52-nm 0.1418nm 0.1415nm 0.1421nm 0.1363
芳香烃结构
芳香烃结构 第十章芳烃芳香性一、芳烃的特点与分类二、芳烃的构造异构和命名三、苯的结构四、芳烃的来源五、芳烃的物理性质六、单环芳烃的化学性质七、苯环上取代反应定位规则八、稠环芳烃九、芳香性十、富勒烯十一、多官能团的命名 一、芳烃的特点与分类1、芳烃的特点 芳烃是芳香族碳氢化合物的简称, 亦称芳香烃. 其显著特点是: A、高度不饱和性 B、不易进行加成反应和氧化反应,易进行取代反应 C、成环原子间的键长趋于平均化 D、环型π电子离域体系由4n+2个π电子构成,即符合Huckel规则 E、环外质子的NMR信号出现在低场
2、分类a、单环芳烃b、多环芳烃c、稠环芳烃 苯邻二甲苯 1,2-二苯乙烷 萘 乙苯 叔丁苯 苯乙烯 (E)-1,2-二苯乙烯 1,3,5-三苯基苯 蒽菲二、芳烃构造异构和命名1、构造异构分侧链异构和位置异构
两种情况: 正丁苯 侧链异构 仲丁苯 异丁苯 叔丁苯 1,2,3-三甲苯连三甲苯 位置异构 1,2,4-三甲苯偏三甲苯 1,3,5-三甲苯均三甲苯 2、芳烃的命名a.单环芳烃常以苯环为母体,烷基作为取代基:
1-甲基-2-乙基苯 1,3-二甲苯(间二甲苯) 1-乙基-4-丙基苯 2-甲基-4-苯基戊烷 b. 多环芳烃或当侧链较复杂时, 也可以把苯环作为取代基: 2,3-二甲基-1-苯基-1-己烯 1,4-苯二乙烯1,4-二乙烯苯(对二乙烯苯) 对苯二乙烯 c.芳烃去掉一个氢原子剩下部分为芳基: 苯基(Phenyl) (Ph) 苯甲基(苄基)(Benzyl)( Bz) 2-甲苯基邻甲苯基o-tolyl
3-甲苯基间甲苯基m-tolyl 4-甲苯基对甲苯基p-tolyl 三、苯的结构 C6H6: 正六边形、共平面键角120°键长0.140nm(C-C: 0.154nm,C=C: 0.134nm)氢化热低(208.5<3x119.3)苯具有特殊稳定性 1、价键理论: 2、共振论: 3、分子轨道理论: 碳上6个2p轨道重新组合成6个分子轨道,其中3个分子轨道能量比原来的原子轨道即2p轨道能量低,称为成键轨道,另外三个比原子轨道能量低,构成反键轨道. 四、芳烃的来源1、从煤焦油中分离2、从石油裂解产物中分离3、芳构化
第六章 单环芳烃
芳香族化合物最初是指从树脂或香精油等天然物质中提取得到的具有芳香气味的化合物,故称芳香族化合物。后来发现此类化合物都含有苯环,自此以后,芳香族化合物即指含有苯环的化合物。但实际上,含有苯环的化合物并不都具有芳香气味,具有芳香气味的化合物也不一定都含有苯环,所以“芳香族化合物”系指含有苯环的化合物并不太确切。但由于历史原因,这一名称至今仍然沿用,不过它的含义已经不同了。如今芳香族化合物的新含义,系指含有苯环结构及性质类似于苯(芳香性)的一类化合物。 芳香烃根据分子中所含苯环的数目和结合方式分为单环芳烃、稠环芳烃和多环芳烃。 单环芳烃:指分子中仅含一个苯环的芳烃,包括苯、苯的同系物和苯基取代的不饱和烃。例如: 苯 甲苯 乙苯 苯乙烯 稠环芳烃:指分子中含两个或两个以上苯环,且苯环之间共用两个相邻的碳原子结合的芳烃。例如: 萘 蒽 菲 多环芳烃:指分子中两个或两个以上苯环通过单键或碳链连接的芳烃。例如: 二联苯 1,4-联三苯 二苯甲烷 本章重点讨论单环芳烃和稠环芳烃。 6.1 苯的结构 苯的分子式为C 6H 6,碳氢数目比为1:1,应具有高度不饱和性。事实则不然,在一般条件下,苯不能被高锰酸钾等氧化剂氧化,也不能与卤素、卤化氢等进行加成反应,但它却容易发生取代发应。并且苯环具有较高的热稳定性,加热到900℃也不分解。象苯环表现出的对热较稳定,在化学反应中不易发生加成、氧化反应,而易进行取代反应的特性,被称之为芳香性。 苯具有的特殊性质——芳香性,必然是由于它存在一个特殊的结构所决定的。 1865年,凯库勒(Kekule’)提出了苯的环状对称结构式: CH 3CH 2CH 3CH=CH 2 CH 214
多环芳烃
多环芳烃(PAHs)毒作用机制研究进展 多环芳烃(Polycyclic Aromatic Hydrocarbons ,PAHs)是煤,石油,木材,烟草,有机高分子化合物等有机物不完全燃烧时产生的挥发性碳氢化合物,是重要的环境和食品污染物。迄今已发现有几百种PAHs,其中有相当部分具有致癌性,如苯并[α]芘、苯并[α]蒽等。PAHs 广泛分布于环境中,可以在我们生活的每一个角落发现,任何有有机物加工、废弃、燃烧或使用的地方都有可能产生多环芳烃。 多环芳烃的致癌性已被人们研究了200多年,早在1775年,英国医生波特(Pott)就观察到烟囱清洁工常患阴囊皮肤癌,相信阴囊癌的高发病率与他们频繁接触烟灰(煤焦油)有关。到了二十世纪,文献大量报道了石蜡精炼、鲸油加工和煤焦油工业工人高发皮肤癌的现象。在1920s-1930s,科学家从煤焦油中分离出多种化合物。通过生物效应实验,即动物致癌性试验确定了多环芳烃中的苯并[a]芘等具有致癌作用。1950s以前,多环芳烃曾被认为最主要的致癌因素而受到广泛的注意和研究。1950s以后各种不同类型的致癌物大量发现,扩大了人们的眼界,人们认识到多环芳烃只是众多类型致癌物的一类。但是,这并没有因此降低了致癌性多环芳烃的重要性。首先,它至今仍是数量上最多的一类致癌物,在总数己达1000多种的致癌物中,多环芳烃占了三分之一以上。其次,它是分布最广的环境致癌物。近年来的大量调查研究表明,空气、土壤、水体、植物等无不受到多环芳烃的污染。其三,它也是与人类关系最密切的环境致癌物。人类日常生活的某些活动以及某些嗜好常与多环芳烃的产生有密切关系,如吸烟这个嗜好就是产生多环芳烃的重要来源,并已证实是诱发人类肺癌的重要因素;再如油脂食物的煎、烘、熏等烹调过程也产生致癌性多环芳烃,并被认为是某些地区胃癌率增高的主要原因之一。某些偏僻山区的当地居民有室内烤火的习惯,由煤和木材燃烧产生的多环芳烃就弥漫在室内,造成室内极高的多环芳烃浓度,由此造成当地居民中某些呼吸道癌症发病率的升高。多环芳烃不仅具有致癌作用,而且还具有对机体的免疫抑制反应、致畸作用和致突变作用。 由于PAHs的致癌、致畸和致突变作用,以及污染范围的广泛性,所以被各国列为优先控制的环境污染物。至目前,国内外对PAHs毒理学研究取得重大进展,现将其近年来的PAHs 毒作用机制研究进展介绍如下。 一. PAHs的免疫抑制反应研究 PAHs可以引起机体的免疫抑制反应,表现为血清免疫学指标的改变。动物试验表明,烹饪油烟冷凝物对小鼠免疫功能有明显影响,其对T淋巴细胞的影响要比B淋巴细胞更为明显。研究表明,BaP体内染毒对小鼠T淋巴细胞产IL-2(白细胞介素一2)的能力有抑制作用,并影响小鼠脾淋巴细胞的钙稳态。从而导致了机体的免疫抑制反应。工人接触PAHs后有免疫抑制现象,波兰焦炉工血清IgG和IgA明显降低(P<0.001),而血清lgM和lgE都有增高趋势。因此强调工人若长期暴露于PAHs则应定期监测免疫抑制反应水平。 二. PAHs的致癌、致突变和致畸作用 化学致癌是指化学物质引起正常细胞发生转化并发展成肿瘤的过程。化学致癌物可分为直接致癌物和间接致癌物,多环芳烃属于后者,多环芳烃是最早发现且为数最多的一类化学致癌物。 由于苯并[a]芘是第一个被发现的环境化学致癌物,而且致癌性很强,故经常以B[a]P作为PAHs的代表。动物实验已证明B[a]P能诱发皮肤癌、肺癌和胃癌。经多年研究证明,B[a]P 本身是“前致癌物”,需在体内代谢转化后方成为“终致癌物”。B[a]P进入人体后,有很少一部分以原形从尿或经胆汁随粪便排出体外,其余大部分经肝、肺细胞微粒体中的混合功能氧化酶氧化形成环氧化物,然后氧环打开,第10位上的亲电子阳离子与细胞大分子(DNA、RNA、蛋白质等)共价结合,构成癌变的物质基础。
