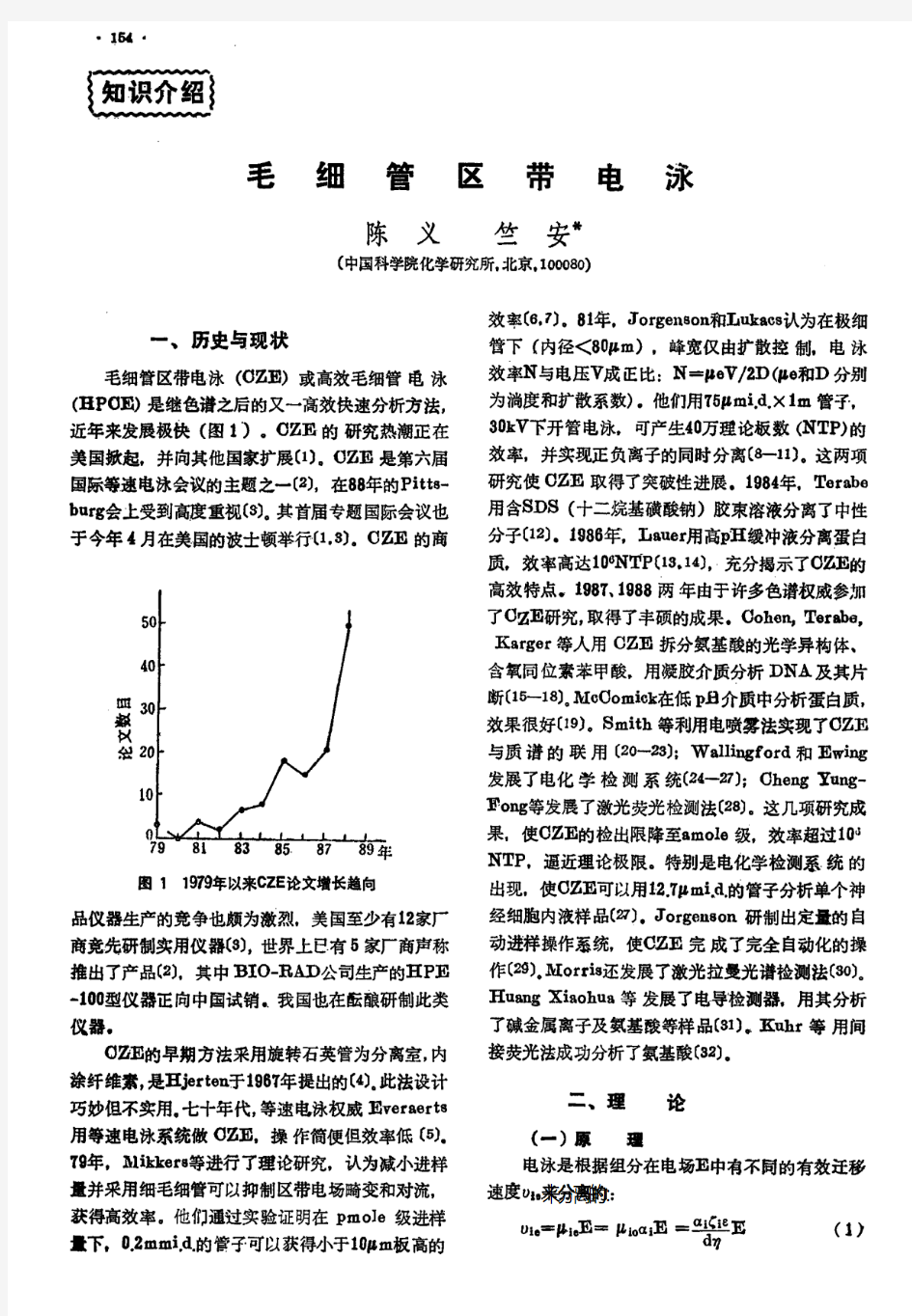
毛细管区带电泳

毛细管区带电泳
毛细管区带电泳(CZE)分离硝基苯酚异构体 一、实验背景 毛细管电泳、气相色谱、液相色谱是目前应用最广泛的高效分离技术,与气相色谱、液相色谱相比,毛细管电泳具有许多独特的优点,如分析速度快、柱效可高达数十万塔板/米、适用于带电样品的分离等,另外毛细管电泳具有样品消耗少、实验试剂成本低等优点,已广泛应用于生物、医药等领域的分离检测。毛细管电泳技术是现代分离科学中必不可少的重要内容。 二、实验目的 1.了解CZE分离的基本原理。 2.了解毛细管电泳仪的基本构造,掌握其基本操作技术。 3.学会计算CZE的重要参数。 4.运用CZE分离硝基苯酚异构体。 三、实验原理 毛细管电泳是指以毛细管为通道、以高压直流电场为驱动力的一类液相分离分析技术。毛细管区带电泳是最常用的一种毛细管电泳分离模式,它是根据被分离物质在毛细管中的迁移速度不同进行分离。毛细管电泳分离分析装置如图1所示。 被分离物质在毛细管中的迁移速度决定于电渗淌度和该物质自身的电泳淌度。一定介质中的带电离子在直流电场作用下的定向运动称为电泳。单位电场下的电泳速度称为电泳淌度或电泳迁移率。电泳速度的大小与电场强度、介质特性、离子的有效电荷及其大小和形状有关。电渗是伴随电泳而产生的一种电动现象。就毛细管区带电泳而言,电渗是指毛细管中电解质溶液在外加直流电场作用下的整体定向移动。电渗起因于固液界面形成的双电层。用熔融石英拉制成的毛细管,其内壁表面存在弱酸性的硅羟基,当毛细管中存在一定pH值的缓冲液时,硅羟基发生电离,在毛细管内壁形成带负电荷的“定域电荷”。根据电中性的要求,
“定域电荷”吸引缓冲液中的反号离子(阳离子)形成双电层。在直流电场作用下双电层中的水合阳离子向负极迁移,并通过碰撞等作用给溶剂施加单向推力,使之通向运动,形成电渗。单位电场下的电渗速度称为电渗淌度。电渗速度与毛细管中电解质溶液的介电常数和粘度、双电层的 电势以及外加直流电场强度有关。若同时含有阳离子、阴离子和中性分子的样品溶液在正极端引入毛细管后,在外加直流电场的作用下,样品组分在毛细管中的迁移情况如图2所示。样品中阳离子组分的电泳方向与电渗流一致,因此迁移速度最快,最先到达检测窗口。中性组分电泳速度为零,它随电渗流而行。阴离子组分因其电泳方向与电渗相反,当电渗速度大于电泳速度时,它将在中性组分之后到达检测窗口;若其电泳速度大于电渗速度,则无法达到检测窗口。由此可见,毛细管电泳分离的出峰顺序是:阳离子>中性分子>阴离子。 毛细管高压电源铂丝 缓冲溶液 记录仪 图1 毛细管电泳分离分析装置 硝基苯酚是弱酸性物质,其邻、间、对位异构体由于pK a 值不同,在一定pH 值的缓冲液中电离程度不同。因此,它们在毛细管电泳分离过程中表现出不同的迁移速度,从而实现分离。
区带毛细管电泳法
实验三区带毛细管电泳法(CZE)测定中药槐米中芦丁的含量 一、实验目的 1、初步掌握毛细管电泳法的原理 2、掌握毛细管电泳仪的使用方法 3、掌握中草药定量分析的基本过程及方法 二、实验原理 毛细管电泳(Capillary Electrophoresis, CE),又叫高效毛细管电泳(HPCE)。CE统指以高压电场为驱动力,以毛细管为分离通道,依据样品中各组分之间的淌度和分配行为上的差异而实现分离的一类液相分离技术。 图1、高效毛细管电泳仪示意图 1-高压电源;2-毛细管;3、4-缓冲溶液瓶;5、6-铂电极;7-检测器毛细管电泳的突出特点是: a、毛细管电泳的仪器简单、操作简便,容易实现自动化 b、分析速度快,分离效率很高 c、操作模式多,分析方法开发容易 d、实验成本低、消耗少 e、应用范围极广 三、仪器及试剂 1、仪器 Lumex 105 高效毛细管电泳仪 JS-3050色谱工作站 TGL-16C台式离心机
WR-E型微波样品制备系统(北京美诚公司) 2、试剂 槐米,芦丁标准品,无水乙醇(AR),硼砂(AR),NaOH(AR),二次蒸馏水。 四、实验步骤 1、样品溶液制备 (1)草药槐米经烘干、粉碎,过40目标准筛。准确称取0.10g粉末于于50mL 锥形瓶中,加入10ml乙醇,微波萃取10min。萃取结束后,萃取液经过抽滤除去固体后,蒸干,用无水乙醇定容至25ml。 (2)将定容后的槐米提取液分装至2个5ml的离心管中,在6000rpm的转速 下离心10min,取离心后的上层清液,将滤液收集合并,保留大约4ml溶液,冷冻保存,即为待测液。 2、缓冲溶液配制 (1)准确称取Na2B4O7.10H2O固体9.5343g,在100ml的烧杯中用二次水溶解 (需水浴加热),待固体全部溶解并冷却至室温后,定容至250ml,即得到0.1mol/L 的Na2B4O7溶液。 (2)用移液器取0.1mol/L的Na2B4O7溶液100μl用二次水稀释配制成 10mmol/L的溶液1ml,稀释两份,置于1ml离心管中,用作电泳缓冲液。 3、毛细管电泳仪的操作要领 (1)开机预热20min。 (2)设定工作温度为25o C。 (3)每天毛细管使用前须依次用0.5mol/LNaOH溶液冲洗5min,二次水冲洗 5min,冲洗之后两端用二次水液封。 (4)每次电泳前,须用二次水冲洗2min,再用缓冲液冲洗2min。 (5)本实验的进样条件为30mPa压力,10s时间。 (6)电泳运行条件为15KV,20min,在启动高压的同时,色谱工作站的记录 系统也触发开始。 (7)电泳结束后,在计算机的色谱工作站软件内保存好色谱图,并打印输出。 4、槐米中芦丁含量测定 (1)取槐米样品溶液100μl,置于1ml离心管中,加入20μl 的0.1mol/l Na2B4O7溶液和880μl二次水,扣紧离心管盖子,摇匀并在离心管上做标记。 (2)将装有配制好的样品溶液和缓冲溶液的1ml离心管放入离心机中,在 6000rpm的转速下离心脱气10min。 (3)离心后得到的10mmol/L的Na2B4O7溶液即为本实验的运行缓冲溶液,做
毛细管电泳法
毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的 含量测定
毛细管电泳法分离水杨酸、苯甲酸及阿司匹林中的含量测定 毛细管电泳又称高效毛细管电泳( High Performance Capillary Electrophoresis, HPCE) 是一种仪器分析方法。通过施加10-40kV 的高电压于充有缓冲液的极细毛细管,对液体中离子或荷电粒子进行高效、快速的分离。现在,HPCE 已广泛应用于氨基酸、蛋白质、多肽、低聚核苷酸、DNA 等生物分子分离分析,药物分析,临床分析,无机离子分析,有机分子分析,糖和低聚糖分析及高聚物和粒子的分离分析。人类基因组工程中DNA 的分离是用毛细管电泳仪进行的。 毛细管电泳较高效液相色谱有较多的优点。其中之一是仪器结构 简单(见图1)。它包括一个高电压源,一根毛细管,紫外检测器及计算机处理数据装置。另有两个供毛细管两端插入而又可和电源相连的缓冲液池。 high-v oltage power supply Buffer V ial Buffer V ial Detector Recording dev ice capillary Electrode Electrode 图1 CE 仪器组成示意图 毛细管中的带电粒子在电场的作用下,一方面发生定向移动的电泳迁移,另一方面,由于电泳过程伴随电渗现象,粒子的运动速度还明显受到溶液电渗流速度的影响。粒子的实际流速 V 是电泳流速度 Vep 和渗流速度 Veo 的矢量和。即: V = Vep + Veo (1) 电渗流是一种液体相对于带电的管壁移动的现象。溶液的这一运动是由硅/水表面的Zeta 势引起的。 CE 通常采用的石英毛细管柱表面一般情况下(pH>3)带负电。当它和溶液接触时,双电层中产生了过剩的阳离子。高电压下这些水合阳离子向阴极迁移形成一个扁平的塞子流,如图2。毛细管管壁的带电状态可以进行修饰,管壁吸附阴离子表面活性剂增加电渗流, 管壁吸附阳离子表面活性
高效毛细管电泳实验
高效毛细管电泳实验 一、实验目的 1. 进一步理解毛细管电泳的基本原理; 2. 熟悉毛细管电泳仪器的构成; 3. 了解影响毛细管电泳分离的主要操作参数。 二、实验原理 1.电泳淌度 毛细管电泳(CE )是以电渗流 (EOF)为驱动力,以毛细管为分离通道,依据样品中组分之间淌度和分配行为上的差异而实现分离的一种液相微分离技术。离子在自由溶液中的迁移速率可以表示为: ν = μE (1) r 6 q πημ= (2) 式中ν是离子迁移速率,μ为电泳淌度,E 为电场强度。η为介质粘度,r 为离子的流体动力学半径,q 为荷电量。因此,离子的电泳淌度与其荷电量呈正比,与其半径及介质粘度呈反比。 2.电渗流和电渗淌度 电渗流(EOF )指毛细管内壁表面电荷所引起的管内液体的整体流动,来源于外加电场对管壁溶液双电层的作用。 在水溶液中多数固体表面根据材料性质的不同带有过剩的负电荷或正电荷。就石英毛细管而言,表面的硅羟基在pH 大于3以后就发生明显的解离,使表面带有负电荷。为了达到电荷平衡,溶液中的正离子就会聚集在表面附近,从而形成所谓双电层,如图1所示。这样,双电层与管壁之间就会产生一个电位差,叫做Zeta 电势。但毛细管两端施加一个电压时,组成扩散层的阳离子被吸引而向负极移动。由于这些离子是溶剂化的,故将拖动毛细管中的体相溶液一起向负极运动,这便形成了电渗流。 电渗流的大小可用速率和淌度来表示: ()E EO F ηεξν/= (3) 或者 ηεξμ/=EO F (4) 式中νEOF 为电渗流速率,μEOF 为电渗淌度,ξ为Zeta 电势,ε为介电常数。 3.毛细管电泳的分离模式 CE 有6种常用的分离模式,其中毛细管区带电泳(CZE )、胶束电动毛细管色谱(MEKC )和毛细管电色谱(CEC )最为常用。本实验的内容为CZE 。 4.毛细管电泳的基本参数
高效毛细管区带电泳色谱的原理和应用
色谱论文 高效毛细管区带电泳色谱的原理和应用
高效毛细管区带电泳色谱原理、方法和应用(化学化工学院 08级化学专业潘超张循) 摘要:高效毛细管电泳( High Performance Capillary Electrophoresis缩写为H P C E ) , 是20 世纪末发展的一种高效、快速的分离技术,是经典电泳技术和现代微柱分离相结合的产物,是继高效液相色谱(HPLC)之后又一重大进展。已在国际学术界引起强烈的反响和关注。高效毛细管区带电泳是最基本、操作最简单、应用最广泛的一种毛细管电泳的分离模式, 通常看作其它模式的母体。本文主要介绍它的原理和一些应用。 关键词:毛细管电泳毛细管区带电泳电渗流电渗现象 引言 在毛细管中进行区带电泳,一方面可减少焦耳热效应导致的区带加宽, 另方又可借用高效液相色谱的检测技术实现在线检测, 免除染色、脱色和扫描或照相。1979年Mikkers 等[1]在内径为0.2mm长为20cm的毛细管中做区带电泳, 达到3.6万理论板。1981年, Jorgenson和Lukacs做了理论上的初步考察, 认为在毛细管长度足够时, 电泳的分离效率与长度无关而与电压成正比:N=mV/2D。其中N为理论板数, m为离子的迁移率, V为电压, D为离子的扩散系数。为了提高电压而又不使电流太大, 同时也为了减小焦耳热效产生的径向温度梯度, 他们使用内径为0.075mm的毛细管。在管长1米,电压3万伏时, 控制进样量尽量小, 达到约40万理论板的效率(用荧光胺衍生的肽)[2.3]是毛细管区带电泳的一次突破。毛细管的采用使产生的热量能够较快散发,大大减小了温度效应,使电场电压可以很高。电压升高,电场推动力大,又可进一步使柱径变小,柱长增加,高效毛细管电泳的柱效远高于高效液相色谱,理论塔板数高达几十万块/米,特殊柱子可以达到数百万。为今后毛细管区带电泳的快速发展奠定了基础。 1、高效毛细管区带电泳色谱的原理 1.1装置的结构 高效毛细管电泳指以高压电场为驱动力, 以毛细管为分离通道, 依据样品中各组分之间淌度和分配行为的差异而实现分离的一类液相分离技术[ 4]。高效毛细管电泳系统主要由高压电源、毛细管、检测器、电解液池、进样系统、冷却系统、计算机管理与数据处理等部分组成( 如图1 所示) 。各个部分的特点介绍如
毛细管区带电泳电化学检测人体尿样中的双氯灭痛、氯丙嗪
毛细管区带电泳电化学检测人体尿样中的双氯灭痛、氯丙嗪 目的建立毛细管区带电泳法测定人体尿样中双氯灭痛、氯丙嗪含量的方法。方法采用弹性石英毛细管(31.5 cm,25 μm i.d.,360 μm o.d.),以4.90×10-3 mol/L Na2HPO4 - 7.80×10-3 mol/L NaH2PO4(pH = 7)为缓冲液,10 kV分离电压,5 kV电渗进样10 s,碳纤维电极工作电极(长200 μm,直径8 μm),检测电势0.72 V。结果双氯灭痛、氯丙嗪两种药物分别在9.90×10-6~5.00×10-4 mol/L(r = 0.998 2)、5.0×10-7~1.0×10-4 mol/L(r = 0.999 8)范围内表现出良好的线性,其回收率分别为104%,96.0%。结论该方法简便、快速、准确,可作为人体尿样中双氯灭痛、氯丙嗪的分离检测方法。 标签:毛细管区带电泳;电化学检测;双氯灭痛;氯丙嗪 毛细管电泳是在散热效率很高的毛细管内进行的电泳,具有“高效、低耗、快速、应用广泛”等特点,在药物的分析方面得到了广泛的应用[1-5]。氯丙嗪是一种抗精神病药,近年来,用HPLC、毛细管气相色谱法[6-9]检测氯丙嗪皆有所报道;双氯灭痛是一种抗风湿药,对该药的检测,HPLC[10-12]曾有过报道。用毛细管电泳在同一缓冲体系中电化学同时检测两种药物还未见报道。本研究建立了毛细管电泳电化学安培检测人体尿样中双氯灭痛、氯丙嗪含量的方法,为双氯灭痛、氯丙嗪体内药代动力学的研究提供了一条可行性途径。 1 仪器与试药 1.1 仪器 高压电源(山东省化工研究所与山东大学联合研制);901-μA型微电流伏安仪(福建宁德分析仪器厂);碳纤维(上海碳素厂);弹性石英毛细管(河北永年光学纤维厂)。 1.2 试药 氯丙嗪(江苏常州东庆制药有限公司);双氯灭痛(兖州制药厂);其他试剂均为分析纯,实验用水均为亚沸蒸馏水。 2 方法与结果 2.1 溶液的配制 2.1.1 双氯灭痛标准溶液准确称取0.159 0 g双氯灭痛,用水稀释至50.00 mL,配成1.00×10-2 mol/L储备液。 2.1.2 氯丙嗪标准溶液准确称取0.177 7 g盐酸氯丙嗪,用水稀释至50.00 mL,配成1.00×10-2 mol/L储备液。 2.2 毛细管电泳电化学安培检测条件的选择 2.2.1 缓冲液pH的选择试验了双氯灭痛、盐酸氯丙嗪在pH为6.6、7.0、7.4、7.7、8.0条件下的柱效及峰电流值:(1)双氯灭痛,n分别为1.63×104、1.77×104、1.80×104、1.81×104、1.64×104,iP(pA)分别为83、108、104、99、89;(2)盐酸氯丙嗪,n分别为6 499、6 404、6 404、6 404、6 310,iP(pA)分别为162、174、185、181、181。因此选择pH = 7.0的缓冲液。 2.2.2 缓冲液浓度的选择缓冲液浓度以Na2HPO4(NaH2PO4∶Na2HPO4为1.6∶1.0)计,试验了双氯灭痛、盐酸氯丙嗪在Na2HPO4浓度为2.40×10-3、 3.10×10-3、 4.90×10-3、 5.80×10-3、 6.70×10-3 mol/L条件下的柱效及峰电流值:(1)双氯灭痛,n分别为6.73×103、8.80×103、1.67×104、1.31×104、1.31×104,iP(pA)分别为99、99、104、105、104;(2)盐酸氯丙嗪,n分别为4 740、5 140、
高效毛细管电泳色谱仪的介绍
高效毛细管电泳色谱仪的介绍 高效毛细管电泳色谱仪(CE)是以毛细管为分离通道,以高压直流电场为驱动力,利用荷电粒子之间的淌度差异和分配系数差异进行分离。由于CE溶质区带的超小体积特性导致光程太短,圆柱形毛细管作为光学表面不够理想,对检测器灵敏度要求相当高。CE常用检测器有紫外检测器、激光诱导荧光检测器、质谱检测器和电化学检测器等。 一、紫外检测器: 紫外检测器是基于物质对紫外吸收进行检测,是成熟的检测器,在CE中应用广。 1、原理: 入射紫外光通过样品时,被吸收的多少符合朗伯-比耳定律。 检测点在毛细管的末端,检测点的毛细管的外涂层要烧掉。 2、检测方法: (1)固定波长: 光源为低紫外氘灯,用滤光片获得固定波长的光。 (2)可变波长: 光源为氘灯或钨灯,用单色器(棱镜或光栅)获得连续可调波长的光。 (3)快速扫描: 1)利用线性二极管阵列快速捕获紫外光。 2)利用硅光电倍增管作快速扫描。 3、特点: (1)通用性好,特别是对蛋白质的适用性很强。 (2)灵敏度不足。 4、提高灵敏度的方法: 由于CE检测池的光路长度为毛细管内径,一般不超过100μm,小内径的毛细管限制了紫外检测器的灵敏度,可采用以下几种方法来提高灵敏度。 (1)优化测定波长: 通过测定不同波长下的信噪比来选择测定波长,以提高灵敏度。
(2)减少检测噪音: 1)提高光源强度。 2)采用聚焦和狭缝等减少背景光的影响。 3)采用良好的信号放大系统。 (3)扩展吸光光路长度: 1)为了克服圆柱形毛细管表面引起的散射、失真等不利的光学特性和增加光路长度,可采用矩形、扁形、Z形和泡型等特殊毛细管。当然柱效会有所下降。 2)对于普通毛细管,可采用轴向照射和多次反射来增加光路长度。 ①轴向照射:将激光光束从毛细管末端沿管轴方向入射,在毛细管侧面进行检测。 ②多次反射:在毛细管壁镀上银,分别开入射窗和出射窗。当入射光以特定角度入射后,在毛细管内反射30~40次后从出射窗口射出。 二、激光诱导荧光检测器: 激光诱导荧光检测器采用激发光源使检测物质产生荧光进行检测。 检测下限为10ˉ12~10ˉ10mol/L。 三、质谱检测器: 在CE-MS联用中,毛细管区带电泳为常用。电子喷雾离子源可检测多种高质量的带电分子,从CE分离出来的分子经过接口后直接进入MS,是MS的离子源。 检测下限为10ˉ9~10ˉ7mol/L,通用性好,可获得溶质的结构信息,但接口复杂。 四、电化学检测器: 电化学检测器可避免光学类检测器遇到的光程太短的问题,是CE中灵敏的检测器之一。 1、电导检测器: 柱上电导检测是在毛细管壁上用激光钻两个孔,插上两根铂电极,再将孔封住进行检测。 检测下限为10ˉ7~10ˉ5mol/L,通用性好,但需专门装置和毛细管处理。 2、安培检测器: CE中微量样品可使库仑效率大大提高,可达40%以上,而在HPLC中很少超过10%。 检测下限为10ˉ9~10ˉ8mol/L,灵敏度高,选择性好,但仅适用于电活性物
毛细管电泳中常用的检测方法.
毛细管电泳中常用的检测方法 毛细管电泳(C E 以其高效、快速的分离, 成为一种令人瞩目的分析手段。为了便于热量散失和进行柱上检$lJ , 采用了极小内径的毛细管(≤50 umi.d. , 这样允许进样量就很小(10 一9 g 。如此小的进样量要求有高灵敏的检测方法, 才能进行定性、定量分析。 紫外吸收法: 一般, 常用于C E 的检测器是市售的紫外和荧光检测器。当采用紫外一可见吸收法时, 石英毛细管壁的内涂层常常用有机溶剂溶解或灼烧而刮去, 使出现一个“小窗口” , 作为柱上检测的流通池。内径很小的毛细管使得流通池的长度也相应很小, 检测灵敏度相当有限, 尤其在生物样品分析中常常需要先行样品预富集然后再检测, 以提高灵敏度。在使用长方形徽面的毛细管进行电泳分离分析时,柱上检测的光学流通池长度明显增大, 使检测灵敏度提高7 1 5 倍。采用高能量的光源, 如氨灯、激光等, 可较大地提高检测灵敏度, 但费用较高, 又因可供选择使用的人射光波长范围较窄, 限制了它的应用。 荧光检测法: 荧光检测的灵敏度比紫外吸收法高几个数量级。对于有适当的激发荧光和发射荧光的供试品, 采用激光诱导荧光检测法和光电倍增管, 可使检测灵敏度大大提高, 而对于绝大多数无自然荧光的化合物, 则必须进行柱前或柱后衍生化, 才能进行荧光检测。 间接检测法: 对供试品进行衍生化的操作繁琐, 且易引入误差, 对于被测浓度极低的生物样品更是如此。于是, 间接检测法应运而生。间接检测就是在电泳缓冲液中加入具有检测响应的检测剂, 如发色团、荧光物质等, 作为本底响应,以产生基线信号。供试品进样后, 供试品离子与反电荷的检测剂离子形成离子对, 或置换了检测剂的同电荷离子, 分别产生正峰和负峰,使基线信号发生改变而被检测。在间接荧光法中, 被分析
高效毛细管电泳的发展及应用
高效毛细管电泳的发展及应用 摘要:高效毛细管电泳(即HPCE)是在传统电泳基础上继现代高效液相色谱技术之后发展起来的一种新型高效分离技术,由于效率更高、速度更快、样品和试剂消耗量特少的特性,逐渐受到越来越多科学家们的青睐。本文结合HPCE的发展史、基本原理、分离模式以及在现实中的实际应用,对毛细管电泳做了系统的分析,并提出合理的展望。 关键字:毛细管电泳;发展史;原理;分离模式;应用 高效毛细管电泳(即HPCE)是在传统电泳基础上继现代高效液相色谱技术之后发展起来的一种新型高效分离技术,它是在熔融的石英毛细管(内径为25~100μm)中进行电泳,其管内填充缓冲液或凝胶,是近年来进展最快的分析方法之一。 毛细管电泳可以说是电泳技术和现代微柱分离相结合的产物,它具有效率更高、速度更快、样品和试剂消耗量特少的特性,因而也受到越来越多科学家们的青睐。 一、毛细管电泳的发展史 1967年在高电场作用下,以3mm直径的毛细管内进行自由溶液的区带电泳,1974年报道了以200-500μm内径玻璃毛细管内进行的区带电泳分析,早期的研究受当时检测灵敏度的影响,未获预期的高效分离效率,但为毛细管电泳分离的发展奠定了基础。 1981年人们第一次展示了毛细管区带电泳,使用75微米内径的玻璃毛细管和荧光检测器进行在线检测,在30KV电压下,分离了氨基酸和多肽类物质,塔板数高达40万,这一工作被认为是现代毛细管电泳发展的里程碑。1983年将聚胶柱制备困难的缺点。1984年使用含有表面活性剂的背景电解质,开辟了毛细管电泳另一个重要分支——胶束毛细管电动力学色谱。1987年又结合传统的等电聚焦电泳和凝胶电泳原理,并移到毛细管内进行电泳,1988年实现了微量制备的可能性,提取和分离了50μmol的蛋白质、肽和寡核苷酸等。80年代未,
