血小板糖蛋白受体拮抗剂应用
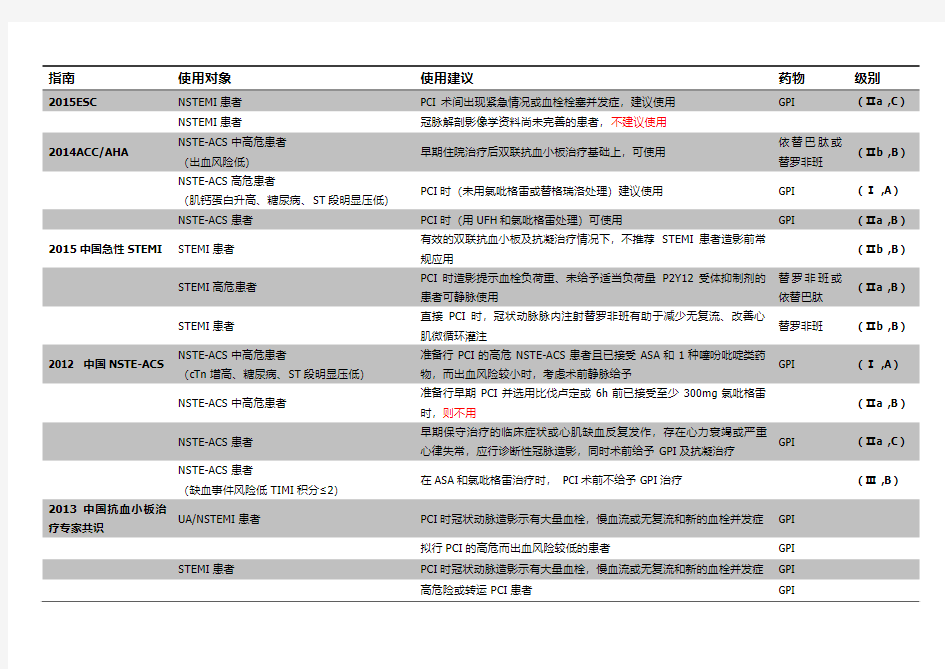
指南使用对象使用建议药物级别
NSTEMI患者冠脉解剖影像学资料尚未完善的患者,不建议使用
2014ACC/AHA NSTE-ACS中高危患者
(出血风险低)
早期住院治疗后双联抗血小板治疗基础上,可使用
依替巴肽或
替罗非班
(Ⅱb ,B)NSTE-ACS高危患者
(肌钙蛋白升高、糖尿病、ST段明显压低)
PCI时(未用氯吡格雷或替格瑞洛处理)建议使用GPI (Ⅰ ,A)NSTE-ACS患者PCI时(用UFH和氯吡格雷处理)可使用GPI (Ⅱa ,B)
2015中国急性STEMI STEMI患者有效的双联抗血小板及抗凝治疗情况下,不推荐STEMI患者造影前常
规应用
(Ⅱb ,B)
STEMI高危患者PCI时造影提示血栓负荷重、未给予适当负荷量P2Y12受体抑制剂的
患者可静脉使用
替罗非班或
依替巴肽
(Ⅱa ,B)
STEMI患者直接PCI时,冠状动脉脉内注射替罗非班有助于减少无复流、改善心
肌微循环灌注
替罗非班(Ⅱb ,B)
2012 中国NSTE-ACS NSTE-ACS中高危患者
(cTn增高、糖尿病、ST段明显压低)
准备行PCI的高危NSTE-ACS患者且已接受ASA和1种噻吩吡啶类药
物,而出血风险较小时,考虑术前静脉给予
GPI (Ⅰ ,A)NSTE-ACS中高危患者
准备行早期PCI并选用比伐卢定或6h前已接受至少300mg氯吡格雷
时,则不用
(Ⅱa ,B)NSTE-ACS患者
早期保守治疗的临床症状或心肌缺血反复发作,存在心力衰竭或严重
心律失常,应行诊断性冠脉造影,同时术前给予GPI及抗凝治疗
GPI (Ⅱa ,C)NSTE-ACS患者
(缺血事件风险低TIMI积分≤2)
在ASA和氯吡格雷治疗时, PCI术前不给予GPI治疗(Ⅲ ,B)
2013中国抗血小板治
疗专家共识
UA/NSTEMI患者PCI时冠状动脉造影示有大量血栓,慢血流或无复流和新的血栓并发症GPI
拟行PCI的高危而出血风险较低的患者GPI STEMI患者PCI时冠状动脉造影示有大量血栓,慢血流或无复流和新的血栓并发症GPI
高危险或转运PCI患者GPI
7 阿片样镇痛药
第七章阿片样镇痛药 *阿片(opium)即鸦片的简介(来源、用途) 阿片是罂粟科植物罂粟的未成熟蒴果被划破后流出的白色液汁,干燥后呈棕黑色膏状物。→阿片内含多种复杂成分,其中的生物碱具有药理活性。阿片中分离到20多种生物碱,其中的主要成分是吗啡,其它成分尚有可待因(Codeine)、蒂巴因(Thebaine)等。 吗啡是用于临床的镇痛药;可待因镇痛作用为Morphine的1/10,主要用作镇咳药;蒂巴因为半合成镇痛药(阿片样激动剂埃托啡(eterphine)、阿片样拮抗剂纳络酮(nalotone)等)的合成原料。 吗啡于1806年从阿片中分离提取出来,1923年确定了化学结构,1952年完成了合成工作。 *吗啡的药理活性: 吗啡除具有强镇痛活性(显著减轻或消除疼痛)、镇静和欣快作用外,还有严重的副作用。例如治疗剂量时呼吸抑制、血压降低、恶心呕吐、大小便困难、嗜睡等,最为严重的不良反应是吗啡反复使用,易产生耐受性、成瘾性,一旦停药即出现戒断症状,危害极大。 寻找成瘾性小、不良反应少的理想镇痛药成为研发新镇痛药的目标。 *在研究构效关系、开发新镇痛药方面所做的工作: 1、对吗啡进行结构修饰——半合成镇痛药。 2、简化吗啡结构——合成镇痛药和吗啡拮抗剂; ——具有阿片样激动/拮抗作用成瘾小的镇痛药、高效镇痛药。(近年的发展)*阿片受体的外源性配体、内源性镇痛物质、阿片受体 阿片样镇痛药作用机理的研究认为:阿片样镇痛药(Opioid Agents)通过与体内高度特异性受体部位结合后产生药理活性。阿片样镇痛药是阿片受体的外源性配体,与阿片受体相互作用产生减轻剧烈锐痛或钝痛等药理活性。 阿片受体的外源性配体及内源性镇痛物质 阿片样镇痛药(阿片样激动剂、拮抗剂和激动/拮抗剂)是阿片受体的外源性配体;脑啡肽、内啡肽、强啡肽等是内源性镇痛物质。阿片受体与其内源性配体相互作用,除调节疼痛感觉外,还有重要的生理功能。 (继1975年发现内源性具有吗啡样镇痛活性的脑啡肽之后,又发现了内啡肽、强啡肽等内源性镇痛物质。)
血小板膜糖蛋白及凋亡相关联的研究
论文题目:血小板膜糖蛋白与凋亡相关联的研究 The research of Platelet Membrane Glycoprotein Associated with Apoptosis 研究生姓名: 马娜 指导教师: 张凤 学科专业: 内科 研究方向: 血栓与止血 论文工作时间: 2013年 12月至2014年3月
学位论文原创性声明 本人郑重声明:本人所呈交的学位论文是本人在导师指导下独立进行实验研究工作所取得的成果,本论文中不包含其他人已经发表或已经获取得的研究成果。在本论文撰写中所引用其他研究者的研究内容和成果时已在论文中给予特别标注和明确说明。对本论文的实验研究以及论文撰写过程中给予帮助和建议等贡献的其他人士,也已作了致谢说明。 本人完全理解本声明的法律责任,以及所涉及的结果将由本人承担。 学位论文作者签名: 日期:年月日 关于学位论文著作权的共享声明 根据《中华人民共和国著作权法》和《高等院校知识产权管理条例》,本学位论文,题目:血小板膜糖蛋白与凋亡相关联的研究,是研究生在导师指导下完成的职务作品,得到蚌埠医学院相关部门科室的物质技术和经费支持,因此,本学位论文的著作权由研究生,导师和蚌埠医学院三方共同享有,均享有署名权和使用权等权益;本学位论文成果归属蚌埠医学院。 根据国家学位授予条例,学校对本学位论文有使用权,包括保存本学位论文;因教学和科研的目的,保留在图书馆被查阅或借阅;学校可根据国家规定将本学位论文送交国家有部门保留和使用。学校在公布本学位论文的全部或部分内容时,应保障研究生和导师的署名权等权益。研究生和导师在公开发表本学位论文的全部或部分内容时必须保障学校的署名权等权益,即在发表论文时蚌埠医学院及相关部门科室应署名为作者单位。 声明人完全理解本声明的法律责任。 研究生签名:导师签名:日期:年月日
血小板糖蛋白受体拮抗剂应用
指南使用对象使用建议药物级别 NSTEMI患者冠脉解剖影像学资料尚未完善的患者,不建议使用 2014ACC/AHA NSTE-ACS中高危患者 (出血风险低) 早期住院治疗后双联抗血小板治疗基础上,可使用 依替巴肽或 替罗非班 (Ⅱb ,B)NSTE-ACS高危患者 (肌钙蛋白升高、糖尿病、ST段明显压低) PCI时(未用氯吡格雷或替格瑞洛处理)建议使用GPI (Ⅰ ,A)NSTE-ACS患者PCI时(用UFH和氯吡格雷处理)可使用GPI (Ⅱa ,B) 2015中国急性STEMI STEMI患者有效的双联抗血小板及抗凝治疗情况下,不推荐STEMI患者造影前常 规应用 (Ⅱb ,B) STEMI高危患者PCI时造影提示血栓负荷重、未给予适当负荷量P2Y12受体抑制剂的 患者可静脉使用 替罗非班或 依替巴肽 (Ⅱa ,B) STEMI患者直接PCI时,冠状动脉脉内注射替罗非班有助于减少无复流、改善心 肌微循环灌注 替罗非班(Ⅱb ,B) 2012 中国NSTE-ACS NSTE-ACS中高危患者 (cTn增高、糖尿病、ST段明显压低) 准备行PCI的高危NSTE-ACS患者且已接受ASA和1种噻吩吡啶类药 物,而出血风险较小时,考虑术前静脉给予 GPI (Ⅰ ,A)NSTE-ACS中高危患者 准备行早期PCI并选用比伐卢定或6h前已接受至少300mg氯吡格雷 时,则不用 (Ⅱa ,B)NSTE-ACS患者 早期保守治疗的临床症状或心肌缺血反复发作,存在心力衰竭或严重 心律失常,应行诊断性冠脉造影,同时术前给予GPI及抗凝治疗 GPI (Ⅱa ,C)NSTE-ACS患者 (缺血事件风险低TIMI积分≤2) 在ASA和氯吡格雷治疗时, PCI术前不给予GPI治疗(Ⅲ ,B) 2013中国抗血小板治 疗专家共识 UA/NSTEMI患者PCI时冠状动脉造影示有大量血栓,慢血流或无复流和新的血栓并发症GPI 拟行PCI的高危而出血风险较低的患者GPI STEMI患者PCI时冠状动脉造影示有大量血栓,慢血流或无复流和新的血栓并发症GPI 高危险或转运PCI患者GPI
人类血小板膜糖蛋白GPⅠbα研究进展
人类血小板膜糖蛋白GPⅠbα研究进展 血小板粘附和血栓形成在正常止血中,以及在急性冠状动脉综合征和血栓形成病变的发病机理中起主要作用。血管内皮细胞破裂后,血管性血友病因子(vWF)结合在血管内膜下,血小板被初始捕获,在高剪切力流体条件下,血小板膜糖蛋白GPIb/Ⅸ/Ⅴ复合物与血管性血友病因子之间可逆性粘附[1]。GPIb/Ⅸ/Ⅴ复合物由4个多肽构成,分别为GPIbα、GPIbβ、GPⅨ和GPⅤ,均属于富含亮氨酸重复序列的跨膜蛋白,是vWF的血小板受体,和其他分子共同参与止血和血栓形成[2]。其中,最大的多肽GPIbα行使完全的配体结合功能,GPIbα可以和固着的vWF相互作用,高剪切力激活是血小板黏附于血管壁的关键,GPIbα和vWF 的黏附对抗快速血流的流体动力学引发血栓形成和促进血小板的激活,阐明GPIbα功能将有助于对预防动脉血小板栓塞的探讨[3]。现对人类血小板膜糖蛋白GPⅠbα的结构功能及其临床意义做如下综述: 1 GPⅠbα重要的结构特点 血小板GPIb受体是一种由GPIbα和GPIbβ二硫化物亚单位组成的异质二聚体,与GPV和GPIX, 在血小板膜上形成了约25000拷贝GPIb-V-IX复合物。复合物的四个成员属于亮氨酸富集基序家族,其序列是以短串联亮氨酸重复片段(LRRs)为主要特征[4]。糖蛋白GPIba是由位于17号染色体的基因编码,是糖蛋白Ib/IX/V受体复合物最主要的配体结合亚单位,具有所有已知的细胞外配体结合位点[5]。糖蛋白Iba包含细胞外球状区域N末端的8个富含亮氨酸串联重复序列(LRRs),3个阴离子硫酸化酪氨酸残基序列,一个高度糖基化的巨糖肽核心区域,以及横跨膜序列和胞质C末端尾巴,与vWF结合的位点已被定位于GPⅠbα的N-末端45 kD结构域[6]。分离出来的GPⅠbα结构域呈现出一个细长的形状,有一个凹面和一个凸面,通过不同的结构形成两个末端之间的侧面。N-末端部分存在一个类似手指的β-发夹结构,它以一个Cys4和Cys17之间的二硫键定位在底部;C-末端部分包含一个α-螺旋和一个长环,其中的两个二硫键分别在Cys209-Cys248和Cys211-Cys264[7]。C-末端的环结构和N-末端的β-发夹结构伸出分子的凹面,可能在配体结合上有调节功能。GPⅠbα分子中富含负电荷的Asp 和Glu残基以及3个Tyr残基区域被认为在调节与vWF的结合中起重要作用,以及在α-凝血酶结合中的决定性作用[8]。 糖蛋白GPIba常见的遗传变异体和氨基酸序列改变的多态性包括:①发生碱基C/T置换,第145位密码子由Thr(ACG)变为Met(ATG),与HPA-2血小板抗原系统有关;②位于糖蛋白Iba 巨糖肽区(Ser399-Thr411) 的可变串联重复序列(VNTR),存在D、C、B或A等位基因39碱基序列拷贝;③位于GPIba启动子5’核苷酸上游区域,Kozak共同翻译起始序列第5密码子发生T/C置换,可能会降低GPIba的转化效率[6]。 2 GPⅠbα的主要功能 2.1介导止血和血栓形成内皮破损时,内皮下的基质蛋白质包括胶原和血管
浅谈血管紧张素Ⅱ受体拮抗剂治疗高血压
浅谈血管紧张素Ⅱ受体拮抗剂治疗高血压 【摘要】目前发现的血管紧张素Ⅱ(AngⅡ)受体拮抗剂主要通过阻断AT1受体而发挥抗高血压的作用,由于其疗效显著,不良反应较血管紧张素转换酶抑制剂(ACEI)少,没有转化酶抑制药的血管神经性水肿、咳嗽等不良反应,因此受到临床的重视。本文对今年来AngⅡ受体拮抗剂在高血压治疗方面的研究作一综述。 【关键词】血管紧张素Ⅱ受体拮抗剂;高血压 AngⅡ受体拮抗剂在受体水平阻断肾素-血管紧张素系统(RAS),通过直接对血管紧张素Ⅱ受体的阻滞,更直接有效地阻断血管紧张素Ⅱ发生作用所导致的水钠潴留、升高血压而发挥降血压的作用。与ACE抑制药比较具有作用专一的特点。早期的AngⅡ受体拮抗药多为肽类,需静脉给药,难以推广,1995年以来研制成功批准应用的非肽类的AngⅡ受体拮抗剂可以口服,对AT1受体有高度选择性,亲和力强,作用持久。AngⅡ刺激在体内引起许多生理性反应以维持血压及肾脏功能,在高血压病、动脉疾病、心脏肥大、心力衰竭及糖尿病、肾病等的发病机制上都起着重要的作用。血管紧张素转换酶抑制剂(ACEI)部分阻断ATⅡ的形成,对上述心脏血管疾病产生了显著的治疗效应,但小部分的患者因干咳不能耐受,从而促使研制出完全阻断ATⅡ效应的ATⅡ受体拮抗剂,AngⅡ受体拮抗剂对ACE没有抑制作用,不引起缓激肽或P 物质的潴留,所以不会引起咳嗽,为心血管病的防治展现了一幅新的宽广前景,特别是替米沙坦的出现,真正维持了24 h,服用一个月达到稳定的血浓度,即使突然停药也不会出现反跳,因此在全球获得广泛使用。 1 作用特定受体,有效降压 高血压是当今世界威胁人类健康的重要疾病之一,也是一种常见病、多发病,其患病率呈逐渐上升的趋势。然而高血压的药物治疗和有效控制长久以来一直是我国高血压人群面临的一个难题。大量流行医学和循证医学研究证实,血压水平与心血管事件危险呈对数线性关系。抗高血压药物治疗的降压幅度与心血管转归直接相关,在一定范围内降压所能达到的血压水平越低,总的心脑血管事件的发生风险减少越显著[1],因此有效控制血压并使其达标有重要意义。肾素-血管紧张素-醛固酮系统(RAAS)的活性激素是AngⅡ,是由血管紧张素I在血管紧张素转换酶(ACE)作用下形成的。AngⅡ是一种强力缩血管物质,具有直接的升压效应,同时还可促进钠的重吸收,刺激醛固酮分泌。目前发现的AngⅡ受体拮抗剂,主要选择性作用于AT1受体亚型,AngⅡ的已知作用就是由AT1受体亚型引起的,AngⅡ受体拮抗剂通过上述作用机制起到稳定的降压作用。 2 改善高血压并发症,提高患者生活质量 2.1 逆转左室肥厚和血管重塑左室肥厚是高血压并发心脑血管病的重要病理基础,可导致各种室性和房性心律失常发生,左心室舒张和收缩功能减退。研究表明左室肥厚独立于血压水平直接影响并发症的发生与发展。目前的高血压治疗不仅要控制血压水平,还要改善左室肥厚。A T1受体被阻滞后,AngⅡ收缩血管与
氯沙坦-血管紧张素Ⅱ受体拮抗剂(ARB)在高血压治疗中的作用及地位
氯沙坦-血管紧张素Ⅱ受体拮抗剂(ARB)在高血压治疗中的作用及地位 北京大学人民医院作者:王鲁雁孙宁玲 2011-6-26 9:56:53 关键字:2011科素亚 ARB 高血压 1986年首个血管紧张素受体拮抗剂(ARB)氯沙坦问世,1994年作为降压药物进人临床,在短短的十余年间该类药物已成为临床广为应用的一线降压药物,且相关研究鳞次栉比、日益深入,不仅加深了我们对于ARB的认识,同时为高血压的治疗开拓了新的领域。 一、ARB与其他降压药具有相似的降压疗效且耐受性良好 临床上常用的5大类降压药物单药降低收缩压疗效相似,且呈剂量依赖性,随剂量增加,降压幅度升高。Volpe教授牵头进行了一项多中心、双盲、前瞻、随机化平行研究。该研究入选了800多例单纯收缩期高血压患者,以收缩压达标为基准,血压控制不佳者增加用药剂量或种类,研究对象被随机分为氯沙坦组和氮氯地平组,以氯沙坦为基础的治疗组初始为氯沙坦50 mg,后加用氢氯噻嗪12.5 mg,必要时,可再增至氯沙坦100 mg十氢氯噻嗪25 m g;以氨氯地平为基础的治疗组初始为氨氯地平5 mg,如控制不佳,则增至氨氯地平10 mg,必要时则加氢氯噻嗪25 mg。结果显示,第6周时氯沙坦50 mg与氨氯地平5 mg降低收缩压幅度相似,提示对于收缩期高血压患者,以氯沙坦为代表ARB类药物的降压疗效与已被公认为参照药物的氨氯地平相似。上述研究结果得到了Law等人研究的支持,Law等人对354项随机、安慰剂对照抗高血压治疗临床研究进行了荟萃分析,接受治疗的患者共40000例,安慰剂治疗的患者16000例。结果显示,五大类降压药物均可将治疗前的血压降低,且在应用1/2标准剂量、标准剂量和2倍标准剂量时,在每个剂量范围内,不同种类药物的降压效果相似,治疗前血压高者血压降低幅度更大。 目前如何改善患者应用降压药物的依从性是提高高血压控制率的关键问题之一,药物不良反应是影响治疗依从性的主要原因之一。通常认为降压药物不良反应的产生与用药剂量有关。Law等人的荟萃分析对五大类降压药物的不良反应产生的剂量一效应关系进行了分析,结果显示:噻嚷类利尿剂、钙拮抗(CCB)、β受体阻滞剂的副作用发生存在明显的剂量-效应关系,ACEI类药物的咳嗽发生与用药剂量有关,.ARB副作用与剂量无关,提示在需增加用药剂量时A。RB类药物的耐受性最好,依从性高。 2005中国高血压治疗指南推荐ARB可作为高血压患者初始治疗药物,在ACEI发生咳嗽及不咳嗽时均可使用,并确立了.ARB在高血压伴有某些特殊疾病如糖尿病、肾脏损害等时的治疗地位。 近年ARB类药物的开发研究迅速,就目前已应用于临床的ARB类药物而言,其降压疗效是否存在差异?conlin等人对43项共11281例患者应用ARB治疗的随机对照临床研究进行了荟萃分析,结果表明纳入分析的包括氯沙坦、缬沙坦、厄贝沙坦、坎地沙坦在内的ARB 类药物降压疗效相当,各组间收缩压和舒张压的降幅均无显著性差异,提示不同ARB之间降压疗效无明显差别。二、在ARB基础上联合用药,提高血压控制率 高血压是一种异质性疾病,多种机制参与了高血压状态的产生及维持,不同类型的降压药物通过不同的机制达到降压目的,因而在多种因素导致的血压升高中使用一种药物治疗通
阿片受体研究进展
阿片受体研究进展 上海第二医科大学附属瑞金医院麻醉科彭章龙 罂粟用于减轻疼痛已有近千年的历史。1803年由罂粟生物碱分离物质出的晶体,被证实是天然阿片的镇痛活性成份,称为吗啡。吗啡的立体化学结构是其与机休特异部位相互作用产生镇痛所必须。通过吗啡、酮唑辛和SKF-10047等一组激动药所产不同药理活性,确定了三种阿片类药物综合征,分别命名为μ, κ和σ原型,由此导致了μ, κ和σ三种阿片受体的发现。后来发现与SKF-10047相关的σ型综合征不能被普通阿片拮抗剂纳洛酮(naloxone)所阻断,因此σ型受体不再被认为是阿片受体家族的成员。δ型受体是由kosterlitz小组在研究内源性阿片肽和内啡肽的效应时发现的。经过近30年的实验室研究,对μ、κ和δ型受体的认识已较清楚,其基因编码已被克隆,这3种受体称为“经典型阿片受体”。最近cDNA 编码一种称之为“孤立阿片”受体,经签定与经典阿片受体有高度同源性,它的结构基团是阿片受体,因此称其为阿片样受体(opioid receptor-like,ORL1)。有药理学迹象表明每种阿片受体存在亚型,以及其他新型、较少了解的阿片受体ε、λ、ι和ζ。本文着重介绍阿片受体研究进展。 一.经典阿片受体 三种经典μ、κ和δ阿片受体被确认后,发现在脑内分布广泛但不均匀。这些受体分布在痛觉传导区以及与情绪和行为有关的区域,集中分布在导水管周围灰质、内侧丘脑、杏仁核和脊髓胶质区。这些复杂的受体可以被不同的激动剂激活,产生不同的生物效应。例如主要分布于脑干的μ受体被吗啡激活后,可产生镇痛和呼吸抑制等作用,而主要分布于大脑皮质的κ受体只产生镇痛作用而不抑制呼吸。然而不同阿片受体在中枢神经系统的分布,以及对不同阿片配体结合能力存在差异。阿片受体的内源性配体为脑啡肽、内啡肽和强啡肽,它们分别由不同的基因编码。这些五肽对阿片受体的亲和力不同,但三者均可与一种以上的阿片受体结合。其中脑啡肽对δ型受体有较强的选择性,被认为是其内源性配体。强啡肽对κ 型受体选择性较强,是其内源性配体。μ型受体的内源性配体直到1997年才被发现,称为内啡肽或内源性吗啡(endomorphine)。内源性吗啡在中枢神经系统与μ-阿片受体呈镜像分布,对μ受体的结合力比对δ和κ受体的结合力高100倍。
临床用阿片受体拮抗剂研究进展
Journal of Organic Chemistry Research 有机化学研究, 2015, 3, 9-15 Published Online March 2015 in Hans. https://www.360docs.net/doc/4918428329.html,/journal/jocr https://www.360docs.net/doc/4918428329.html,/10.12677/jocr.2015.31002 Research Progress of Opioid Receptor Antagonist Used in Clinic Qiao Wang1,2, Lang Shu1,2, Ming Liu3, Kaiyuan Shao2, Wenxiang Hu1,2,3* 1School of Chemical Engineering & Pharmacy, Wuhan Institute of Technology, Wuhan Hubei 2Beijing Excalibur Space Military Academy of Medical Sciences, Beijing 3School of Life Sciences, Capital Normal University, Beijing Email: *huwx66@https://www.360docs.net/doc/4918428329.html, Received: Jan. 23rd, 2015; accepted: Feb. 4th, 2015; published: Feb. 10th, 2015 Copyright ? 2015 by authors and Hans Publishers Inc. This work is licensed under the Creative Commons Attribution International License (CC BY). https://www.360docs.net/doc/4918428329.html,/licenses/by/4.0/ Abstract Opioid receptor antagonists are a class of specifically drugs for antagonizing the opioid on opioid receptors, thereby reducing or reversing the analgesic activity of narcotic agonists. Antagonists can also eliminate breathing suppression, gastrointestinal disorders and other side effects caused by the use of the agonist. Antagonists are used in clinic as side effects and coma antidote arising from excessive usage of analgesic. This paper summarizes several common clinical types of opioid receptor antagonists and clinical applications. In recent years, antagonists have achieved greater development, but there are still some deficiencies; further research of opioid receptor antagonists is needed to get more competitive, safer and simpler novel μ opioid receptor-specific antagonist, for better use in clinical treatment. Keywords Opioid Receptor, General Opioid Receptor Antagonist, Peripheral Opioid Receptor Antagonist 临床用阿片受体拮抗剂研究进展 王乔1,2,舒浪1,2,刘明3,邵开元2,胡文祥1,2,3* 1武汉工程大学化工与制药学院,湖北武汉 2北京神剑天军医学科学院,北京 3首都师范大学生命科学学院,北京 *通讯作者。
药物-纳洛酮-阿片受体拮抗药
纳洛酮 【临床应用】 1.用于拮抗阿片类药物复合麻醉术后的呼吸抑制或阿片类药物过量引起的呼吸抑制。 2.用于促醒(如阿片类药物复合麻醉术后、急性乙醇中毒、安眠药中毒、休克等)。 3.用于对麻醉性镇痛药成瘾者、吸毒成瘾者的催促戒断综合征的试验性诊断。 4.用于急性阿片类药物过量的诊断。 5.亦可用于急性呼吸衰竭、老年性痴呆、慢性阻塞性肺疾病(COPD)等。 【药理】 1.药效学本药为阿片受体拮抗药,本身几乎无药理活性,但对阿片样物 质和内源性阿片样物质有特异性拮抗作用,能竞争性拮抗阿片受体μ、δ和κ,对巴比妥类药物引起的呼吸抑制无对抗作用。本药通过对内源性阿片样物质内啡 肽和脑啡肽的拮抗而发挥兴奋中枢神经、兴奋呼吸、抑制迷走神经作 用,能使血中去甲肾上腺素和肾上腺素水平升高,使血压上升, 从而完全或部分纠正阿片类物质的中枢抑制效应(如呼吸抑制、镇静和低血压)。动物试验表明,本药能改善大脑皮质氧的供应,增加神经细胞的电活动。 阿片类药(如吗啡)中毒者小剂量(400-800μg)注射本药后,2分钟即可逆转其作用,对抗呼吸抑制等中枢抑制症状,对阿片类药物急性中毒治疗较有效。对阿片类激动拮抗药喷他佐辛中毒需较大剂量才能对抗。 对阿片类药物(如吗啡、美沙酮、哌替啶、尤其是二乙酰吗啡)依赖者,肌内注射本药可激发严重戒断反应,结合用药史和尿检结果,可确认为阿片类成瘾。但本药鉴别试验为阴性者,不排除有阿片依赖为阳性的可能。 本药还可增强心肌收缩力,升高动脉压,改善组织的血液灌注, 增加心肌血流,有助于缺血心肌的保护;稳定溶酶体,降低心肌抑制因子作用。 本药为纯阿片受体拮抗药,不具有其他阿片受体拮抗药的“激动性”或吗啡样效应,不引起呼吸抑制、拟精神病反应或缩瞳反应。用药后未见耐药性、生理或精神依赖性。
