总黄酮测定方法
总黄酮测定(紫外分光光度法,以柚皮苷计)[26]
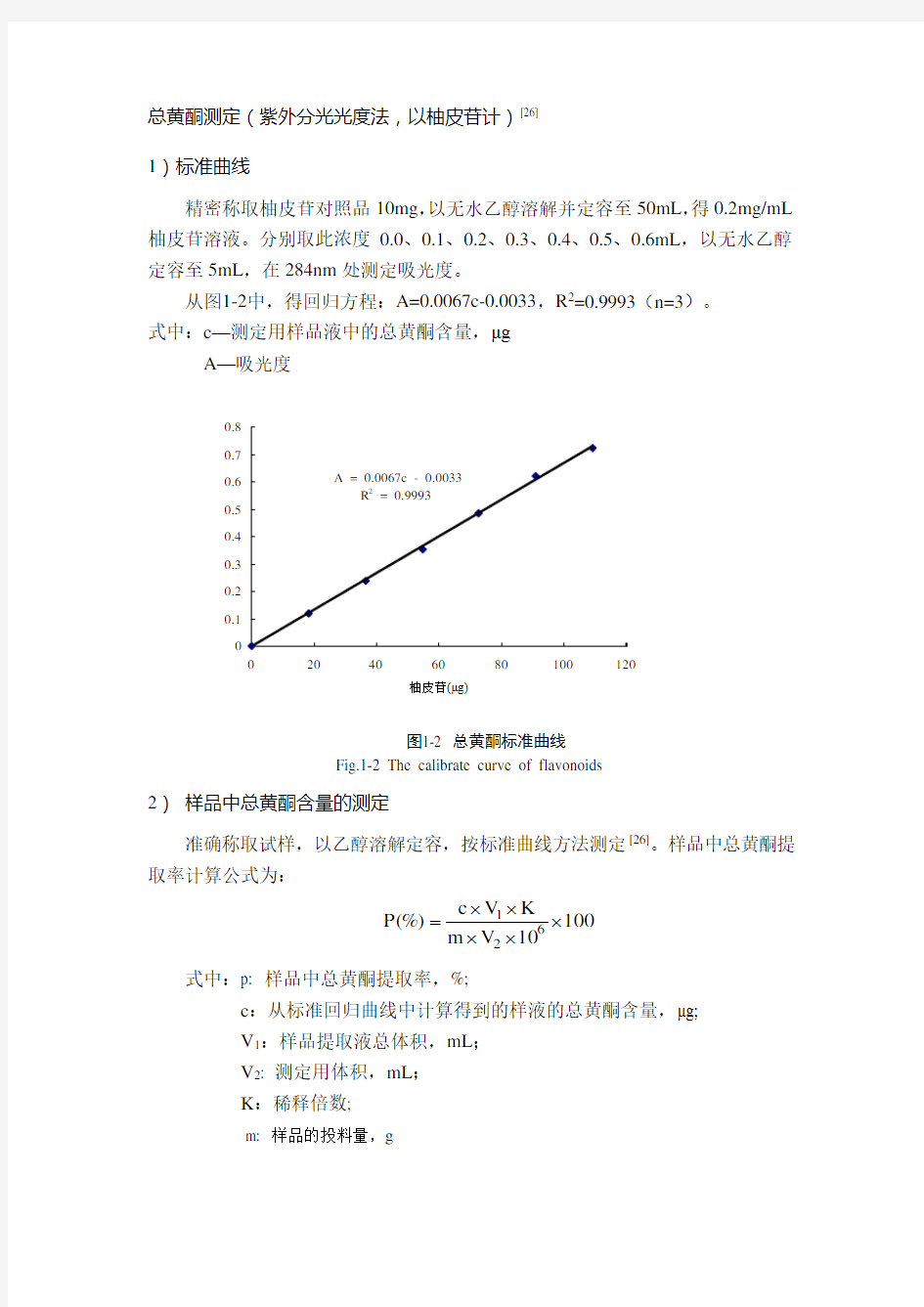
1)标准曲线
精密称取柚皮苷对照品10mg ,以无水乙醇溶解并定容至50mL ,得0.2mg/mL 柚皮苷溶液。分别取此浓度0.0、0.1、0.2、0.3、0.4、0.5、0.6mL ,以无水乙醇定容至5mL ,在284nm 处测定吸光度。
从图1-2中,得回归方程:A=0.0067c-0.0033,R 2=0.9993(n=3)。
式中:c —测定用样品液中的总黄酮含量,μg
A —吸光度
图1-2 总黄酮标准曲线
Fig.1-2 The calibrate curve of flavonoids
2) 样品中总黄酮含量的测定
准确称取试样,以乙醇溶解定容,按标准曲线方法测定[26]。样品中总黄酮提取率计算公式为:
10010
V m K V c %)P (621?????= 式中:p: 样品中总黄酮提取率,%;
c :从标准回归曲线中计算得到的样液的总黄酮含量,μg;
V 1:样品提取液总体积,mL ;
V 2: 测定用体积,mL ;
K :稀释倍数;
m: 样品的投料量,g
总黄酮、多酚含量的测定
燕麦总黄酮含量的测定 一、仪器 紫外-可见分光光度计、分析天平、低速离心机、超声波提取器、恒温水浴锅、粉碎机、pH计、10mL容量瓶15个、10mL具塞试管、100mL烧瓶、10mL离心管10个、试管架2个 二、药品 芦丁标准品40mg、无水乙醇1000mL、亚硝酸钠500g、硝酸铝500g、NaOH 500g 三、实验步骤 (一)、样品处理及总黄酮的提取 1. 将样品籽粒分别称取 2.5 g置于小信封里,80℃烘干24 h。 2. 研成粉末,称取500±2 mg样品于10 mL离心管中,使样品位于试管底部(重复3次)。 3. 每管加4 mL 60%乙醇,放水浴锅60℃浸提2 h。6000 r/min离心10 min,离心后取上清液于10 mL容量瓶中。 4. 再向离心管中加4 mL的60%乙醇,放水浴锅60℃浸提1 h。6000 r/min离心10 min,离心后取上清液于相应的10 mL容量瓶中。60%乙醇定容至10 mL,待测。 (二)、标准曲线绘制 1. 精确量取浓度200 μg/mL芦丁标准溶液0、0.2、0.4、0.8、1.2、1.6、 2.0 mL 分别置于10 mL容量瓶中。 2. 向容量瓶中分别加60%乙醇5、4.8、4.6、4.2、 3.8、3.4、3.0 mL。 3. 然后加5%亚硝酸钠0.3 mL,摇匀,静置6 min。 4. 再加10%硝酸铝0.3 mL,摇匀,静置6 min。 5. 加4%氢氧化钠4.0 mL,用60%的乙醇定容至刻度,摇匀,静置12 min。 6. 于510 nm波长下测定吸光度,并以芦丁标准浓度值为纵坐标,以吸光度为横坐标,绘制标准曲线。 (三)、样品提取液总黄酮含量的测定 准确吸取总黄酮提取液2.0 mL于10 mL容量瓶中,按二的方法测定吸光度,
总黄酮含量测定方案
总黄酮含量测定 一样品溶液的制备 70%乙醇溶液,料液比1﹕8 ,80度下回流2h。取10g样品放入圆底烧 瓶中加入80ml 70%乙醇溶液回流2h,抽滤定容至100ml备用。使用时先离心再用70%乙醇稀释10倍做样品溶液。 二芦丁标准品的配置 精密称取芦丁2mg,加无水乙醇定容至10ml。制得浓度为0.2mg/ml芦 丁标准品溶液。 三显色方法的确定 1 扫描原液分别取芦丁溶液和样品溶液各1ml,加无水乙醇定容至25ml,空白对照,全波扫描。 2硝酸铝显色法分别取芦丁对照品溶液和样品溶液各5ml,加5%亚硝酸 钠溶液(1.25g亚硝酸溶于无水乙醇中定容到25ml容量瓶中) 1ml, 摇匀,放置6min,加10%硝酸铝溶液(4,4014g硝酸铝.九水溶于无水乙醇中定容到25ml 容量瓶中) 1ml,摇匀,放置6min,加4%氢氧化钠试液(2g氢氧化钠溶于无水乙醇中定容到50ml容量瓶中)10ml, 再加无水乙醇定容至25ml,摇匀,放置15min,空白对照,全波扫描bb 。 3氯化铝显色法分别取芦丁对照溶液和样品溶液各5ml ,加1%的氯化 铝溶液(1g氯化铝溶于无水乙醇中定容到100ml容量瓶中)10ml,摇匀放置10min,空白对照,全波扫描。 4 氢氧化钾显色法分别取芦丁对照品溶液和样品溶液各5ml,加3ml10% 氢氧化钾溶液(2.5g氢氧化钾溶于无水乙醇中定容到25ml容量瓶中), 充分摇匀显色5min后,用无水乙醇定容至25ml, 摇匀,空白对照,全波 扫描。 四显色条件的确定 五标准曲线的绘制 分别取1ml,2ml,3ml,4ml,5ml,6ml芦丁对照品溶液,按所选的显色方法测定吸光度,绘制标准曲线。 六精密度实验 按标准曲线绘制方法,分别准确量取1.0ml芦丁标准液5份,按所选显色剂和所确定的最优显色条件在所选波长下测定吸光度。
总黄酮、多酚含量的测定
总黄酮含量的测定 一、仪器 紫外-可见分光光度计、分析天平、低速离心机、超声波提取器、恒温水浴锅、粉碎机、pH计、10mL容量瓶15个、10mL具塞试管、100mL烧瓶、10mL离心管10个、试管架2个 二、药品 芦丁标准品40mg、无水乙醇1000mL、亚硝酸钠500g、硝酸铝500g、NaOH 500g 三、实验步骤 (一)、标准曲线绘制 1. 芦丁标准品40mg置于称量瓶中80℃烘干至恒重,取烘干后的20mg芦丁标准品用水定容至100mL,得200μg/mL芦丁标准贮备液,精确量取上述浓度芦丁标准贮备溶液0、0.2、0.4、0.8、1.2、1.6、 2.0 mL分别置于10 mL具塞试管中。 2. 向具塞试管中分别加60%乙醇5、4.8、4.6、4.2、 3.8、3.4、3.0 mL。 3. 然后加5%亚硝酸钠0.3 mL,摇匀,静置6 min。 4. 再加10%硝酸铝0.3 mL,摇匀,静置6 min。 5. 加4%氢氧化钠4.0 mL,用60%的乙醇定容至刻度,摇匀,静置12 min。 6. 于510 nm波长下测定吸光度,并以芦丁标准浓度值为横坐标,以吸光度为纵坐标,绘制标准曲线。研究表明芦丁标准品含量在0~0.5mg 范围内与吸光度具有良好的线性关系。 (二)、样品处理及总黄酮的提取(以60%乙醇提取为例) 1. 将样品在80℃烘干24 h,粉碎后过80目筛置于干燥器中备用。 2. 称取500±2 mg样品于25 mL具塞三角瓶中,使样品位于三角瓶底部(重复3次)。 3. 每瓶加4 mL 60%乙醇,放超声波提取器提取2 h。提取液转至10 mL具塞离心管中。 4. 再向具塞三角瓶中加4 mL的60%乙醇,放超声波提取器提取1 h,提取液转至相应10 mL具塞离心管中,6000 r/min离心10 min,离心后取上清液于相应
总黄酮测定含量
1 各批次药材含量测定 使用已经确定的总黄酮含量检测方法分别进行5个批次原料含量的测定 总黄酮含量测定:分别精密称取药材粗粉0.5g,置100ml锥形瓶中,加70%乙醇50ml,称定重量,超声60分钟,放冷,称定,加入70%乙醇补足减失重量,摇匀,过滤,弃去粗滤液,精密量取续滤液10.0ml上聚酰胺树脂,待充分吸附后,用乙醇进行洗脱,至流出液基本无色,以洗脱液定容至25ml量瓶中,备用。精密量取供试品溶液5ml,置10ml比色管中,加 5%亚硝酸钠溶液0.4ml,使混匀,放置6分钟,加10%硝酸铝溶液0.4ml,摇匀,放置6 分钟,加2mol/L氢氧化钠溶液3ml,再加30%乙醇至刻度,摇匀,放置15分钟,照分光光度法(《中国药典》2010版一部附录Ⅴ B),在504nm 的波长处测定吸收度。 表1 不同批次药材总黄酮含量测定结果 批号含量(%) 1 2 3 X±S 20140516 0.16350.16480.17010.1661±0.0035 20140516紫外扫描色谱图 2 药材总黄酮转移率研究 2.1 单个药材转移率研究
2.1.1 单个药材的转移率测定 同一批次的各药材,分别按照产品生产工艺提取得单个药材的总黄酮浓缩液样品,进行总黄酮含量检测,与“1”项下同批药材的总黄酮含量相比得出单个药材的转移率(如下式),分别进行5批次药材测定。 黄芪、桑叶、黄精、山茱萸:分别取黄芪、桑叶、黄精、山茱萸各100g,加水煎煮两次(回流),第一次加水12倍量,煎煮2.0h,过滤;第二次加水10倍量,煎煮1.0h,过滤,合并滤液浓缩至100ml,备用。 黄芪不同浓缩程度的考查:取黄芪100g,加水煎煮两次(回流),第一次加水20倍量,煎煮2.5h,过滤;第二次加水20倍量,煎煮2.0h,过滤,合并滤液,重复试验三次,分别浓缩至50ml、100ml、200ml,备用。 精密量取上述溶液5ml,加乙醇15ml,摇匀,过滤,弃去粗滤液,精密量取续滤液10.0ml上聚酰胺树脂,待充分吸附后,用乙醇进行洗脱,至流出液基本无色,以洗脱液定容至25ml量瓶中,备用。精密量取供试品溶液5ml,置10ml 比色管中,加5%亚硝酸钠溶液0.4ml,使混匀,放置6分钟,加10%硝酸铝溶液0.4ml,摇匀,放置6 分钟,加2mol/L氢氧化钠溶液3ml,再加70%乙醇至刻度,摇匀,放置15分钟,照分光光度法(《中国药典》2010版一部附录ⅤB),在504nm 的波长处测定吸收度。 表2 不同批次药材提取液总黄酮含量测定结果 批号含量(%) 1 2 3 X±S 20140516 0.16350.16480.17010.1661±0.0035
黄酮含量的测定方法
黄酮含量的测定方法 1、对照法 1) ①对照品制备:精密称取芦丁对照品20.8mg,置于100ml容量瓶中,加70%乙 醇使溶解并稀释至刻度,摇匀。 ②样品溶液制备 精密称取样品0.50g,精密加入70%乙醇50ml,称定重量,超声处理30分钟,称定重量,用70%乙醇补足减失重量,即得。 ③标准曲线的制备 精密称取对照品溶液0.0、1.0、2.0、3.0、4.0、5.0ml,分别置于25ml比色管中,加70%乙醇10ml,加5%亚硝酸钠溶液1ml,摇匀,放置6分钟,加1mol/L 氢氧化钠溶液10ml,加70%乙醇置刻度,摇匀,放置15分钟。各取10ml 置于50ml容量瓶中,用70%乙醇稀释至刻度。在510nm的波长下测定吸光度。 2) ①样品溶液的制备: 分别精确称取80℃恒温干燥的样品用50%甲醇回流提取,料液比1:15,提取两次,每次30min,将两次提取液合并浓缩至一定体积,用30%甲醇定容至50ml 容量瓶中。从其中取出12ml溶液放入100ml容量瓶中,稀释至刻度,再从100ml 容量瓶中取出1.5ml溶液,放至10ml容量瓶中,定容,为待测样品液Ⅰa和Ⅱa。 ②最大吸收波长的选择:分别作样品液Ⅰa、Ⅱa及芦丁标准品的吸收曲线,均在350 nm 处有一强吸收,因此选择350 nm为测定波长。 ③标准曲线的制定: 精密称取芦丁对照品10.3mg,用少量30%乙醇溶解后,转移至50ml容量瓶,用蒸馏水定容至刻度。分别精密量取2ml、3ml、4ml、5ml、6ml芦丁溶液置于100ml 容量瓶中,于350 nm 波长处测定吸光值,以芦丁空白为参比,以芦丁浓度为横坐标,以吸光度为纵坐标绘制标准曲线,提示在4.12~12.36mg/103ml浓度之间,吸光度值与浓度呈现良好的线性关系。 ④含量测定结果: 分别吸取2.2.1中Ⅰa和Ⅱa待测样品液各适量于石英比色池中,按标准芦丁一吸光度测定法,以样液空白参比,于350nm 波长下测定吸光值,计算各提取液中总黄酮含量。 计算公式为:样品总黄酮含量(%)=0.03692(A+0.1644)/W。 注:上式为通过回归方程转化而来,式中A为测得样品液的吸光度值,W为称样量。
大豆异黄酮的测定方法综述(精)
NANCHANG UNIVERSITY 功能食品学综述论文 学 院:生命科学与食品工程学院专业:食品科学与工程班 级:学号:学生姓名:廖杰 指导教师:王远兴
起讫日期: 2014年 3月至 2014年 4月 大豆异黄酮的测定方法 摘要 本文在参考国内外大量文献的基础上,对大豆异黄酮的测定方法进行了系统的总结和介绍 关键词:大豆异黄酮;测定方法 Abstract: In reference on the basis of a large number of literature at home and abroad, this paper method of the determination of soybean isoflavones were summarized and introduced Keywords:soy isoflavones method 目录 摘 要 ........................................................................................................................................... ........... I Abstract:................................................................................................................................. .............. I 目 录 ........................................................................................................................................... .......... II 1根据紫外吸收特性检测方 法 ......................................................................................................... 1 1.1紫外分光光度法(UV .. (1)
设计实验 总黄酮的提取和测定
设计性实验: 银杏叶中总黄酮的提取和测定 小组人员:袁国明郎启国赵永仓王蓉 一、目的要求 1、探究不同浓度的乙醇和在不同时间下对黄酮类化合物提取率的影响。 2、掌握从银杏叶中提取总黄酮的操作步骤和测定方法。 3、了解提取银杏叶中黄酮类化合物制备的基本原理和方法。 二、实验原理 根据超声波具有空化、粉碎、搅拌等特殊作用,对银杏叶的细胞有破坏现象,使乙醇溶液能渗透到银杏叶中,以便让总黄酮溶解在乙醇中,在通过分离提纯的方法,来获得总黄酮的含量。 黄酮类是含酚羟基的化合物,能够和铝离子产生黄色络合物,在碱性条件下溶液呈红色。因此,本实验所采用的方法是在碱性溶液中加铝盐显色的分光光度法。其具体操作是在所测定的溶液中加入5%NaNO2;10%A1(NO3)3;5%NaOH溶液,在500nm波长下,用紫外分光光度法测定所提溶液中总黄酮的含量。 三、试剂和器材 1、试剂 芦丁标准品;5%NaNO2;10%A1(NO3)3;5%NaOH;30%、40%、50%、60%、70%、80%的乙醇(用95%的酒精31.91ml、42.55ml、53.19ml、68.83ml、74.47ml、85.11ml );及蒸馏水等。 2、材料 新鲜的银杏叶 3、器材 容量瓶25ml(×1) 100ml(×6);吸管0.5ml(×2)1ml(×2),2ml(×1),5ml (×1)粉碎机;超声波清洗机;高速离心机;三角锥形瓶50ml(×6);滤纸;分光光度
计;烧杯;具塞刻度试管;分析天平;20ml量筒等 四、操作方法 1、银杏叶的处理 把新鲜的银杏叶低温烘干,使水分小于8%,制成干粉,待用。 2、制作标准曲线 准确称取芦丁标准品5mg,用80%乙醇溶解,定容于25mL容量瓶中,摇匀,得0.2mg /mL的标准溶液。 移液管精确吸取标准溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2ml,分别置于10mL容量瓶中,加入5%NaNO2 0.4mL,摇匀,放置5min;加入10%A1(NO3)3 0.4mL,摇匀,放置6min;加入5%NaOH 4.0mL,再加蒸馏水至刻度,摇匀,在80℃水浴中保温10min。以试剂空白作为参比溶液。用1cm比色皿,在510nm波长处测定吸光度,绘制标准曲线(标样浓度和吸光度的关系)。 表1-1 标准曲线制作 管号 1 2 3 4 5 6 7 芦丁标准液(mL)0.0 0.2 0.4 0.6 0.8 1.0 1.2 5%NaNO2(mL)0.4 0.4 0.4 0.4 0.4 0.4 0.4 放置时间(min) 5 5 5 5 5 5 5 0.4 0.4 0.4 0.4 0.4 0.4 0.4 10%Al(NO3)3 (mL) 放置时间(min) 6 6 6 6 6 6 6 5%NaOH(mL) 4.0 4.0 4.0 4.0 4.0 4.0 4.0 蒸馏水(mL) 5.2 5.0 4.8 4.6 4.4 4.2 4.0 3、探究不同时间对黄酮提取的影响 分别称取6分1g的银杏叶粉末,放在50mL的三角锥形瓶中,并作相应标记,分别加入70%的乙醇溶液各20mL,在超声波清洗机(500W)超声30 min、35 min 、40min、45 min、50min、 55min将溶液用高速离心机离心后除去滤渣,得到粗产品,用量筒量体积做记录,等待备用。 4、探究不同浓度的乙醇对总黄酮提取的影响
植物总黄酮的提取与测定
试验植物总黄酮的提取与测定 摘要本实验采用紫外分光光度法测定芹菜体内总黄酮含量,利用黄酮类化合物与铝盐反应生成红色络合物。以芦丁为标准品在510nm处测定吸光度。得出标准曲线,然后计算样品的黄酮量。下面会就本实验出现的一些状况作出详尽想分析。 材料与方法 材料新鲜芹菜叶 方法 试剂的配制 标准品芦丁;甲醇;石油醚;磷酸;95%乙醇;硝酸铝;亚硝酸钠;氢氧化钠;去离子水 步骤 1 总黄酮提取称取新鲜芹菜叶子10.0g,研磨后于回流装置中用70ml 95%乙醇回流2h,过滤,然后用石油醚做溶剂萃取1~2次去脂溶物。溶剂用量为提取液的1/2,除脂后浓缩并定容至50ml。 2 芹菜黄酮含量的测定吸取10ml置25ml容量瓶中,加30%乙醇2.5ml,再加入5%亚硝酸钠溶液0.75ml摇匀,放置5min,加10%硝酸铝液0.75ml,摇匀,放置5min,再加1mol/L NaOH溶液10ml,摇匀,加30%乙醇至刻度,放置10min,在510nm波长处测定吸光度。同时,取上述稀释液10ml,置于25ml容量瓶中,
加30%乙醇至刻度,作为对照溶液。根据测得的吸光度得出标准曲线 3 标准溶液配制精确称取与120℃真空干燥至恒重的芦丁标准品20mg,置100ml容量瓶中,加60%乙醇溶液,稀释至刻度,精确量取25ml,置于50ml容量瓶中,稀释至刻度,摇匀既得每1ml 含芦丁0.1mg的标准溶液。 4标准曲线制作精确量取标准溶液0。0,2.5,5.0,7.5,10.0,12.5ml,分别置于25ml容量瓶中,加30%乙醇补足至12.5ml,加5%亚硝酸钠溶液0.75ml摇匀,放置5min,精确加入10%硝酸铝液0.75ml,摇匀,放置5min,再精确加入1mol/L氢氧化钠液10ml,用30%乙醇稀释至刻度,以第一管为空白,与510nm波长下测定吸光度,以吸光度为纵坐标,浓度为横坐标,绘制标准溶液。 结果 标准:A1=0.000;A2=0.121;A3=0.266;A4=0.394;A5=0.530;A6=0.673 样品:A(1)=0.000;A(2)=0.036
总黄酮的测定方法
总黄酮的测定方法 黄酮类化合物是广泛存在于植物界的一大类天然产物,种类繁多, 大多数黄酮类化合物与葡萄糖或鼠李糖结合成苷,部分为游离态或与鞣质结合存在。黄酮化合物系色原烷或色原酮的2-或3-苯基衍生物, 一般具有C6-C3-C6的基本骨架结构。近年来, 黄酮类化合物以其广谱的药理作用倍受青睐, 人们对含有黄酮的化合物进行大量研究, 以期获得黄酮含量较高的中草药。因此黄酮的含量测定成为研究的关键步骤。 一、方法 (一)高效液相色谱法 1. 原理植物类样品用石油醚脱脂后,经甲醇加热回流提取,以高效液相色谱法分离,在紫外检测器360nm条件下,以保留时间定性、峰面积定量。 2.仪器和试剂(1)高效液相色谱仪(2)紫外检测器(3)层析柱(4)超声波清洗仪(5)索氏提取器 (6)微孔过滤器(滤膜0.45um)(7)甲醇(色谱纯)(8)芦丁标准品 (9)石油醚,盐酸,磷酸(分析纯)。(10)去离子水 (11)芦丁标准溶液:精确称取经105℃干燥恒重的芦丁标谁品15.0mg,加甲醇溶解并定容至100ml,配成150ug/ml的芦丁标准溶液 3. 操作步骤 (1)样品处理 1)固体样品:称取2.0g干燥的固体样品,研细,置于索氏提取器中,用石油醚(60~90℃)提取脂肪等脂溶性成分,弃去石油醚提取液,剩余物挥去石油醚,加人甲醇50ml和25%HC1 5ml,80℃水浴回流水解1h,取出后快速冷却至室温,转移至50ml容量瓶中,甲醇定容,经0.45um滤膜过滤,供分析用。 2)液体样品:准确吸取样品2.0ml,直接以石油醚萃取脱脂,挥去石油醚后, 以甲醇溶解并定容,经微孔滤膜(0.45um)滤过后供测定用。 (2)色谱分离条件 色谱柱:CLC-ODS,6mm×150mm,5um; 流动相:0.3%磷酸水溶液:甲醇(V:V)=40:80,临用前用超声波脱气;流速:lml/min;柱温:40℃;检测波长:360nm;灵敏度:0.02AUFS;进样量:20ul。 (3)样品测定:准确吸取样品处理液和标准液各10ul,注入高液相色谱仪进行分离,以其标准溶液峰的保留时间定性,以其峰面积计算出样品中总黄酮的含量。4、结果计算 (二)分光光度法
黄酮含量测定
一、黄酮含量的测定方法 1、样品的处理 取材料地上部分洗净,晾晒至表面无水分,置于干燥箱中,80℃下干燥至恒重,磨成粉末,过筛待用。 2、标准曲线的绘制 准确称取芦丁对照品20mg,置于100ml容量瓶中,加体积分数70%乙醇溶解至刻度,摇匀得0.2mg/ml的对照品溶液。然后,分别吸取0、0.4、0.8、1.2、1.6、2.0、2.4ml,分别置于7支试管中,加水补齐至2.4ml,分别加入5%亚硝酸钠0.4ml,摇匀,放置6min。再加入10%硝酸铝溶液0.4ml,摇匀,放置6min。加入4.3%氢氧化钠溶液4ml,然后分别加2.2ml水,摇匀,放置15min。以空白试剂为参比,用紫外分光光度计在500nm波长处测定吸光度。 3、黄酮的提取(微波提取法) 准确称取干燥至横重的野生马齿苋粉末3份,每份1g,分别置于锥形瓶中,喷洒适量蒸馏水润湿,用中高火微波处理90s。加入一定量体积分数为70%的乙醇溶液,于80℃恒温水浴加热提取1.5h,趁热过滤,洗涤残渣,用70%乙醇定容于50ml容量瓶中,摇匀,得黄酮提取液。 4、黄酮含量的计算 吸取分别黄酮提取液1ml,加1.4ml蒸馏水,摇匀,加入5%亚硝酸钠0.4ml,摇匀,放置6min。再加10%硝酸铝溶液0.4ml,摇匀,放置 6min。加入4.3%氢氧化钠溶液4ml。加入蒸馏水2.8ml,摇匀放置15min。
以蒸馏水代替黄酮提取液的空白试剂为参比,用紫外分光光度计在500nm波长出测定吸光度。带入标准曲线中,计算黄酮含量。 总黄酮含量(mg/g)= c*v/m 式中:c为1ml样品中测得的黄酮含量(mg); v为提取液总体积(ml); m为叶片干重。 二、矿质元素的测定 每份需0.2g
JC-126 植物提取物中总黄酮(Total Flavones)含量测定方法
1. 仪器和试剂 1.1 UV-2450紫外-可见光分光光度计 1.2 分析天平:感量0.00001g 1.3 超声波清洗仪:功率250W,频率40KHz 1.4 芦丁对照品(99%) 1.5 槲皮素对照品(99%) 1.6 容量瓶(10mL、100 mL) 1.7 微量移液管(1 mL) 1.8 移液管(2 mL) 1.9 醋酸(分析级) 1.10 醋酸钠(分析级) 1.11 无水乙醇(分析级) 1.12 蒸馏水 1.13醋酸-醋酸钠缓冲液(PH4.5):准确称取醋酸钠(分析纯)1.8g,加入醋酸(分析纯)0.98mL,加水溶解定容至100mL混匀即可。 1.14 0.1mol/L三氯化铝试液:准确称取三氯化铝(分析纯) 2.41g,加水溶解定容至100mL混匀即可。 2. 测定方法 2.1对照品溶液制备 精密称取102℃减压干燥的槲皮素(芦丁)对照品约20mg,于100mL容量瓶中,加70%乙醇溶液定容,即为对照样品溶液。 2.2 样品溶液制备 精密称取植物提取物适量,于100mL容量瓶中,加入80mL70%乙醇,超声
提取30min ,冷却至室温,加入70%乙醇稀释至刻度,摇匀,过滤。续滤液即为样品溶液。 2.3 标准曲线制作 精密称取槲皮素(芦丁)对照品0.2、0.4、0.6、0.8、1.0、1.2mL 于10mL 容量瓶中,加醋酸-醋酸钠缓冲液2mL ,0.1mol/L 三氯化铝试液2mL ,摇匀,加70%乙醇溶液稀释至刻度,在270nm 处以试剂为空白测定吸光度,以浓度为横坐标,吸光度为纵坐标做标准曲线。 3. 样品测定 取样品续滤液1mL 于10mL 容量瓶中,按工作曲线项下“加加醋酸-醋酸钠缓冲液起”,依法测定吸光度,从工作曲线上读出样品溶液中槲皮素(芦丁)的浓度。 4. 含量计算 100%11???=W K V C )总黄酮含量(﹪ 这是不是少了个百分号? 式中:C 1---从标准曲线计算得的显色液总黄酮的浓度,mg/mL ; V 1:显色液的体积,ml ; K :分取倍数; W :样品的重量,mg 样品含量结果取两个平行样品含量的平均值。 分取倍数:如100ML 盐酸溶液,稀释到1000ML 定容,然后再取25ML 进行测定.分取倍数就是1/40,相当于取原溶液2.5ML 进行测定. 按照你的方法,V1应该是10ML ,K 应该是100. 你这个应该叫稀释倍数吧。从100ML 里取1ML 分析,推回去就应该乘以100.
黄酮含量的测定
黄酮含量的测定 1.提取(以麦苗粉为例) 根据仿生学原理,人体胃、小肠、大肠的体液酸度最佳pH分别为2.0,7.5,8.3。称取1g麦苗粉末,选用乙醇-水作为浸取剂,模拟胃肠道的pH,分别调pH值2.0,7.5,8.3,在60℃下超声50min,合并3次提取剂,,定容。 工艺流程:1g麦苗粉末→一次提取(加入10ml70﹪的乙醇,乙醇pH2.0)→抽滤→留渣继续二次提取,滤液保存→二次提取(加10ml70﹪的乙醇,提取剂pH7.5)→抽滤→留渣继续三次提取,滤液保存→三次提取(加入10ml70﹪的乙醇,乙醇pH8.3)→合并三次滤液→定容至30mL→黄酮类化合物含量的测定分光光度法测吸光值。 麦苗汁的提取 直接从榨汁后定容至100ml的麦苗汁中取36.5ml,加入85.2ml无水乙醇,60℃超声提取150min。 2.试剂配置 芦丁标准液:准确称取芦丁标准品7.5mg,用50%乙醇溶解并定容至25mL,得到浓度为300mg/mL的芦丁标准溶液。 10% Al(NO3)3溶液:称取5g Al(NO3)3,用蒸馏水溶解并定容至50mL。 5% NaOH 溶液:称取2.5g NaOH,用蒸馏水溶解并定容至50mL。 5% NaNO2 溶液:称取2.5g NaNO2,用蒸馏水溶解并定容至50mL。 0.05mol/L Tris-HCl缓冲液(pH=8.2):0.1mol/L Tris 50mL,加入0.1mol/L HCl 22.9mL,混匀,稀释定容至100mL。 3 mmol/L 邻苯三酚-HCl溶液:准确称取0.0189g邻苯三酚,用10 mmol/L HCl溶解并定容至100mL。 9mmol/L水杨酸-乙醇:准确称取1.2430g水杨酸,用95%乙醇溶解并定容到1000mL 容量瓶中。 9mmol/L FeSO4:准确称取1.3680g FeSO4,定容到1000mL容量瓶中。 10mmol/L HCl:准确量取83.3mL分析纯HCl,定容到100mL容量瓶中。 8.8 mmol/L H2O2 溶液:吸取0.109mL 30% H2O2,用蒸馏水溶解并定容至500mL。 3.标准曲线的绘制 准确称取芦丁标准品15mg,用50%乙醇溶解并定容至50mL,得到浓度为0.3mg/mL的芦丁标准溶液。取7支试管编号,分别按表1中所给的量加入各种试剂,并测定其吸光值。 表6 芦丁标准曲线的绘制 试剂0(mL) 1(mL) 2(mL) 3(mL) 4(mL) 5(mL) 6(mL) 芦丁标准溶液0 0.5 1.0 1.5 2.0 2.5 3.0 50%乙醇 3.0 2.5 2.0 1.5 1.0 0.5 0 5% NaNO2 溶液0.4 0.4 0.4 0.4 0.4 0.4 0.4 10% Al(NO3)3 溶液0.4 0.4 0.4 0.4 0.4 0.4 0.4 5% NaOH 溶液 4.0 4.0 4.0 4.0 4.0 4.0 4.0 蒸馏水 2.2 2.2 2.2 2.2 2.2 2.2 2.2 加入5% NaNO2 溶液0.4 mL后,摇匀,放置6min ;加入10% Al(NO3)3 溶液0.4 mL
总黄酮总酚含量测定方法
太行菊的抗氧化活性试验计划 1. 实验内容 对太行菊的甲醇提取物的乙醇、正己烷、二氯甲烷、乙酸乙酯、正丁醇、水共六种萃取物进行总酚、总黄酮含量的测定,分析实验结果,选择总分和总黄酮含量比较高的两个层分进行抗氧化能力测定,分析其抗氧化能力强弱,判断其有无研究价值。 用Folin-Denis法测定太行菊甲醇提取物各萃取层组分的总酚含量,以没食子酸作为标准品进行对照。用三氯化铝法测定太行菊各萃取层组分的总黄酮含量,以槲皮素作为标准品进行对照。根据实验结果,选择总酚和总黄酮含量较高的萃取层组分进行抗氧化能力测定,包括DPPH自由基清除能力测定,羟基自由基清除能力测定,还原能力测定。 2.实验步骤 将太行菊用甲醇溶液回流提取其有效成分,旋转浓缩后用水溶解,然后分别用正己烷、二氯甲烷、乙酸乙酯、正丁醇萃取、水层,得相应层的馏分。 2.1总酚含量测定:在试管中分别加入不同层样品(1mg/ml)0,25ml +Folin-Denis 试剂0.5ml ,5min后,再加入Na2CO3饱和溶液0.5ml,并做三组重复。对照组中样品和Folin-Denis试剂用DW代替,其他不变。空白组中Folin-Denis试剂用DW代替,其他不变。在760nm紫外光下测定吸光度。 对实验结果处理后做标准曲线,以没食子酸为标准品。 以没食子酸的微克数表示总酚含量:吸光度=0.0069 μg没食子酸-0.042。Folin-Denis试剂的配制:在2L烧瓶中加入750ml蒸馏水,再加入100g钨酸钠和20g磷钼酸,再加入50ml正磷酸回流2h, 冷却后装入1L容器内置于暗处 实验组*3: 体积Folin-Denis的体积Na2CO3 MEOH层0.25ml 0.5ml 0.5ml H层0.25ml 0.5ml 0.5ml CH层0.25ml 0.5ml 0.5ml EA层0.25ml 0.5ml 0.5ml BUOH层0.25ml 0.5ml 0.5ml
总黄酮含量的测定
植物中总黄酮的提取与测定 原理 黄酮母核中含有碱性氧原子,一般又多带酚羟基,能和铝离子产生黄色络合物,又加入亚硝酸钠和氢氧化钠,使在碱性溶液中呈红色,溶液在510 nm 处有最大吸收,显色反应在60 min 内稳定。用芦丁作为对照品,用硝酸铝作为黄酮类比色测定的显色剂,吸光度与芦丁的浓度呈线形关系,采用分光光度法对总黄酮进行了含量测定。 仪器与试剂 新锐T6型紫外可见分光光度计;Explrer型电子天平(0.1mg)。60%的乙醇溶液;5%亚硝酸钠溶液;10%硝酸铝溶液。 芦丁标准溶液的配制 称量13.2mg芦丁,用60%乙醇定容到25ml容量瓶作为标准溶液。 标准曲线的制作 准确吸取0,0.4,0.8,1.2,1.6,2.0 ml芦丁标准溶液,放入10毫升容量瓶内(写明标记),分别加入2.0、1.6、1.2、0.8、0.4、0 ml的60%乙醇溶液;再加入5%亚硝酸钠溶液0.5ml摇匀,放置6min;加入10%硝酸铝溶液0.5ml,放置6min后;加入4%氢氧化钠溶液4.0ml,加60%乙醇定容,摇匀后,放置15min;(扫描找到最大吸收)在510nm处测定吸光度。用0.0ml作为空白,用芦丁含量的浓度作为横坐标,纵坐标作为一定浓度下所对应的吸光度,作标准曲线。 总黄酮提取与测定和计算 称取0.6—0.8g样品粉末,加入60ml60%乙醇放于100ml圆底烧瓶内,置于水浴锅上,70℃条件下回流提取60min。过滤、定容于100ml. 吸取样品量(根据样品的吸光度调整)1.0ml,放入10毫升容量瓶内(写明标记),用60%乙醇加到2.0ml;加入5%亚硝酸钠溶液0.5ml摇匀,放置6min;加入10%硝酸铝,溶液0.5ml,放置6min后;加入4%氢氧化钠溶液4.0ml,摇匀后,加60%乙醇定容,放置15min;在510nm处测定吸光度。根据标准曲线计算总黄酮的含量。 总黄酮含量=A/M·100×稀释倍数A为标准曲线中的含量。 例如:测得的吸光度=0.504 Y=0.0101x+0.0017 A= Y-0.0017/0.0101=0.504-0.0017/0.0101=49.73 M为样品的质量(mg)
黄酮的检测方法和理化性质Word版
黄酮类化合物理化性质 不论在黄酮类化合物的提取分离方面还是在其结构测定的研究方面黄酮类化合物的理化性质及其显色反应都发挥着谱学技术所替代不了的作用。下面仅就其与分离和结构测定密切相关的性质进行简要介绍。 一、性状 黄酮类化合物多为结晶性固体少数如黄酮苷类为无定形粉末。游离的各种苷元母核中除二氢黄酮、二氢黄酮醇、黄烷及黄烷醇有族光性外其余则无光学活性。苷类由于在结构中引入糖的分子故均有旋光性且多为左旋。黄酮类化合物的颜色与分子中是否存在交叉共轭体系及助色团OH、OCH3等的种类、数目以及取代位置有关。以黄酮为例其色原酮部分原本元色但在2位上引入苯环后即形成交叉共轭体系并通过电子转移、重排,使共轭链延长。因而显现出颜色。一般情况下黄酮、黄酮醇及其苷类多显灰黄黄色。查耳酮为黄橙黄色而二氢黄酮、二氢黄酮醇、异黄酮类因不具有交叉共轭体系或共轭链短故不显色二氢黄酮及二氢黄酮醇或显微黄色异黄酮。显然在上述黄酮、黄酮醇分子中尤其在7位及4’位引入OH及OCH3等助色团后则因促进电子移位、重排而使化合物的颜色加深。但OH、OCH3引入其他位置则影响较小。花色素及其苷元的颜色随pH不同而改变一般显红 pH 7、紫 pH 85蓝 pH 8 5等颜色。 二、溶解性 黄酮类化合物的溶解度因结构及存在状态苷和苷元、单糖苷、双糖苷或三糖苷不同而有很大差异。一般游离苷元难溶或不溶于水易溶于甲醇、乙醇、醋酸乙酯、乙醇等有机溶剂及稀碱水溶液中。其中黄酮、黄酮醇、查耳酮等平面性强的分子因分子与分子间排列紧密分子间引力较大故更难溶于水而二氢黄酮及二氢黄酮醇等,因系非平面性分子。故分子与分子间排列不紧密分子间引力降低有利于水分子进入溶解度稍大。至于花色苷元花青素类虽也为平面性结构但因以离子形式存在具有盐的通性故亲水性较强水中溶解度较大。黄酮类苷元分子中引入羟基将增加在水中的溶解度而羟基经甲基化后则增加在有机溶剂中的溶解度。例如一般黄酮类化合物不溶于石油醚中故可与脂溶性杂质分开但川陈皮素56783’4’六甲氧基黄酮却可溶于石油醚。 黄酮类化合物的羟基糖苷化后水中溶解度即相应加大而在有机溶剂中的溶解度则相应减小。黄酮苷一般易溶于水、甲醇、乙醇等强极性溶剂中但难溶或不溶于苯、氯仿等有机溶剂中。糖链越长则水中溶解度越大。 另外糖的结合位置不同对苷的水中溶解度也有一定影响以 棉黄素35783’4’六羟基黄酮为例其3O葡 萄糖苷的水中溶解度大于7O葡萄糖苷。 三、酸性与碱性 一酸性 黄酮类化合物因分子中多具有酚羟基故显酸性可溶于碱性水溶液、吡啶、甲酰胺及二甲基甲酰胺中。由于酚羟基数目及位置不同酸性强弱也不同以黄酮为例其酚羟基酸性强弱顺序依次为74’二羟基7或4'羟基一般酚羟基5羟基例如C7 OH因为处于C O的对位在p共轭效应的影响下酸性较强可溶于碳酸钠水溶液中,此性质可用于提取、分离及鉴定工作。 二碱性
总黄酮含量测定
附录A(标准的附录) 总黄酮含量的测定(分光光度比色法) 1 试剂 所用试剂均为分析纯,水为去离子水或蒸馏水。 1.1无水乙醇; 1.2硝酸铝溶液(100g/L):称取AL(NO3)3?9H2O 17.6g,加水溶解,定容于100mL容量瓶中,摇匀备用。 1.3 醋酸钾溶液(9.8g/L):称取KCOOH 9.814g,加水溶解,定容于100mL容量瓶中,摇匀备用。 1.4 芦丁标准溶液: 1.4.1芦丁对照品储备液(1.0g/L):精密称取芦丁标准物质50.000mg,置于50mL容量瓶中,加无水乙醇溶解并稀释定容至50mL。 1.4.2 芦丁对照品工作溶液(0.2g/L):精密吸取芦丁对照品储备液(1.4.1)10mL,置于50mL容量瓶中,加无水乙醇(1.1)至刻度,摇匀备用。 2 仪器 全波长光度计;分析天平(0.000g);容量瓶等玻璃仪器。 3 分析步骤 3.1 标准曲线 3.1.1精密吸取芦丁对照品工作液(1. 4.2)1mL,2 mL,3mL,4mL,5mL,6mL分别置于50mL容量瓶中。 3.1.2加无水乙醇(1.1)至15mL,然后依次加入硝酸铝溶液(1.2)1.0mL,醋酸钾溶液(1.3)1.0mL,摇匀,加水至刻度,摇匀,静止1hr。 3.1.3 用1cm比色杯于415nm处,以30%乙醇(V/V)溶液为空白,测定吸光度。 3.1.4 以50mL溶液中芦丁质量(mg)为横坐标,吸光度为纵坐标,用线性回归法做标准曲线,(线性范围0.0mg ~1.2mg(以50mL计)。 3.2 空白对照 精密吸取待测试样4.0mL,置于50mL容量瓶中,加无水乙醇14mL,加水稀释至刻度,摇匀。静止1hr,用?=0.22μ的过滤膜过滤,滤液作为样品的空白对照。 3.3样品测定 3.3.1精密吸取待测样液 4.0mL,置于50mL容量瓶中,按3.1.2进行操作。静止1hr,用?=0.22μ的过滤膜过滤,滤液作为测定液。 3.3.2以空白对照液(3.2)作参比,用1cm比色杯,在波长415nm处测定样品溶液的显色吸光度。 3.3.4 通过3.1.4标准曲线回归方程计算样品溶液中的总黄酮含量(mg). 4 样品测定结果计算 m X= ×100 W 式中: X ——样品中总黄酮的含量(mg/100mL) ; m ——由直线回归方程求出的样品比色液中芦丁的质量(mg); W ——样品的体积(mL)。
总黄酮的含量测定的操作流程图-分光光度法与比色法-简易图解-李熙灿-Xican Li
总黄酮的含量测定方法:操作流程图2017.11 【简介】黄酮包括黄酮、异黄酮、黄酮醇、二氢黄酮醇、双黄酮等,他们大多同时存在于某一种中药及其他植物中。为了测定这些黄酮的总含量,便建立了总黄酮的检测方法。其原理是:黄酮中的处于相邻羰基、羟基可以共同络合金属而显色。根据显色之深浅(即吸光度A值之大小),判断的总黄酮含量之高低。常用的显色剂是亚硝酸钠-硝酸铝,检测波长是508nm。采用分光光度计,并以某种标准品绘制工作曲线,依该曲线所建立的回归方程,计算其含量。 【检测方法与实验流程图】 图1实验流程图 【文献依据】Xican Li, Dongfeng Chen, Ying Mai, Bi Wen, Xiaozhen Wang. Concordance between antioxidant activities in vitro and chemical components of Radix Astragali. Natural Product Research. 2012;26:1050-1053. 【溶液配制】 1.5%亚硝酸钠溶液配制:称取0.5g亚硝酸钠(NaNO2)固体,加蒸馏水至10mL,即得。 2. 10%硝酸铝溶液配制:称取1g硝酸铝固体,加蒸馏水至9mL,即得。 3. 4% 氢氧化钠溶液配制:称取2g氢氧化钠固体,加蒸馏水至48mL,即得。 4. 芦丁标准液配制:精密称取芦丁10.4 mg置25mL容量瓶中,加80%乙醇溶液溶解、定容。 5. 样品液配制:视样品的溶解性,可选用甲醇、乙醇、95乙醇、水作溶液。浓度尽量高,但要有精确的数值。
【标准曲线绘制】(芦丁) 精密量取0.0,0.2,0.4,0.6,0.8,1.0 mL 芦丁标准液,代替上图中的 “样品液0.5mL ”,依“实验流程图”,测A 508nm 值: 绘制标准曲线如下: A 508n m Concentration (mg/ml) 总黄酮测定的标准曲线(芦丁)y = -0.00339 + 11.92871 x r=0.99926
食品中总黄酮的测定
实验九食品中总黄酮的测定 (-)目的意义 黄酮类化合物(flavonoids)是广泛存在于植物界的一大类多酚化合物,多以苷类形式存在。其分析方法有多种,对于黄酮类化合物的相互分离以及单一成分的定量分析,常采用高效液相色谱法(high performance liquid chromatography,HPLC);而对于总黄酮含量的测定,则主要采用分光光度法。通过本方法的学习,可以掌握食物中总黄酮的测定方法。 (二)高效液相色谱法 1. 原理植物类样品用石油醚脱脂后,经甲醇加热回流提取,以高效液相色谱法分离,在紫外检测器360nm条件下,以保留时间定性、峰面积定量。 2.仪器和试剂 (1)高效液相色谱仪 (2)紫外检测器 (3)层析柱 (4)超声波清洗仪 (5)索氏提取器 (6)微孔过滤器(滤膜0.45um) (7)甲醇(色谱纯) (8)芦丁标准品 (9)石油醚,盐酸,磷酸(分析纯)。 (10)去离子水 (11)芦丁标准溶液:精确称取经105℃干燥恒重的芦丁标谁品15.0mg,加甲醇溶解并定容至100ml,配成150ug/ml的芦丁标准溶液。 3. 操作步骤 (1)样品处理 1)固体样品:称取2.0g干燥的固体样品,研细,置于索氏提取器中,用石油醚(60~90℃)提取脂肪等脂溶性成分,弃去石油醚提取液,剩余物挥去石油醚,加人甲醇50ml和25%HC1 5ml,80℃水浴回流水解1h,取出后快速冷却至室温,转移至50ml容量瓶中,甲醇定容,经0.45um滤膜过滤,供分析用。
2)液体样品:准确吸取样品2.0ml,直接以石油醚萃取脱脂,挥去石油醚后,以甲醇溶解并定容,经微孔滤膜(0.45um)滤过后供测定用。 (2)色谱分离条件 色谱柱:CLC-ODS,6mm×150mm,5um; 流动相:0.3%磷酸水溶液:甲醇(V:V)=40:80,临用前用超声波脱气; 流速:lml/min; 柱温:40℃; 检测波长:360nm; 灵敏度:0.02AUFS; 进样量:20ul。 (3)样品测定:准确吸取样品处理液和标准液各10ul,注入高液相色谱仪进行分离,以其标准溶液峰的保留时间定性,以其峰面积计算出样品中总黄酮的含量。 4.结果计算 (三)分光光度法 1.原理黄酮类化合物是具有苯并吡喃环结构的一类天然化合物的总称,一般都具有4位羰基,且呈现黄色。黄酮类化合物的3—羟基、4—羟基或5—羟基、4-羰基或邻二位酚羟基,与铝盐进行络合反应,在碱性条件下生成红色的络合物。
总黄酮检验方法
总黄酮检验方法 A.1.1 原理 黄酮类化合物是具苯并芘喃环结构的一类天然化合物的总称,其中的3-羟基、4-羟基或5-羟基、4-羰基或邻二位酚羟基,可与铝盐进行络合反应,在碱性液体中生成红色络合物,在一定的浓度范围内,其浓度与吸光度符合比耳定律。显齿蛇葡萄叶中的主要活性成分为黄酮类化合物中的二氢杨梅素(Dihydromyricetin),最大紫外吸收波长为291 nm,可通过制作标准工作曲线和测定样品的吸光度,计算样品中总黄酮含量。 A.2 试剂与仪器 A.2.1试剂与溶液 5%AlCl3(分析纯)溶液,95%甲醇溶液。 A.2.2 对照品 二氢杨梅素。检测方法及纯度:HPLC≥99.0%。 A.2.3分析仪器 紫外可见分光光度计。 A.3 测定步骤 A.3.1标准工作曲线的制定 精密称取二氢杨梅素对照品15.00 mg,加95%甲醇溶解并定容至25 ml。然后精密吸取上述配制的对照品溶液0,0.05,0.10,0.15,0.20,0.25,0.30分别放置10ml容量瓶中,精密加入5%AlCl3溶液3ml,95%甲醇定容10ml,摇匀后室温(避光)放置40min,95%甲醇溶液随行空白(即3ml 5%AlCl3溶液+7ml 95%甲醇),于291nm处测定吸光度。所测吸光度与对应的二氢杨梅素浓度绘制成标准工作曲线。 A.3.2供试样品的测定 A.3.2.1样品母液的制备: 称取100g左右的显齿蛇葡萄代用茶产品,粉碎成20目左右的茶粉,混合均匀。从上述制备的茶粉中,精密称取样品1g,加95%甲醇100ml,于80℃加热回流提取1h(从甲醇沸腾开始计算时间),得醇提取液,放冷,过滤,将滤液移至100ml容量瓶中,并用95%甲醇溶液定容至100ml。 A.3.2.2样品母液的稀释 精密吸取上述配制的样品母液2.0 ml分别置50ml容量瓶中,用95%甲醇定容。 A.3.2.3稀释后样品母液中总黄酮的测定 精密吸取0.5ml稀释的样品母液,置于10ml容量瓶中,精密加入5%AlCl3
