流式临床检测项目之T细胞亚群及其意义
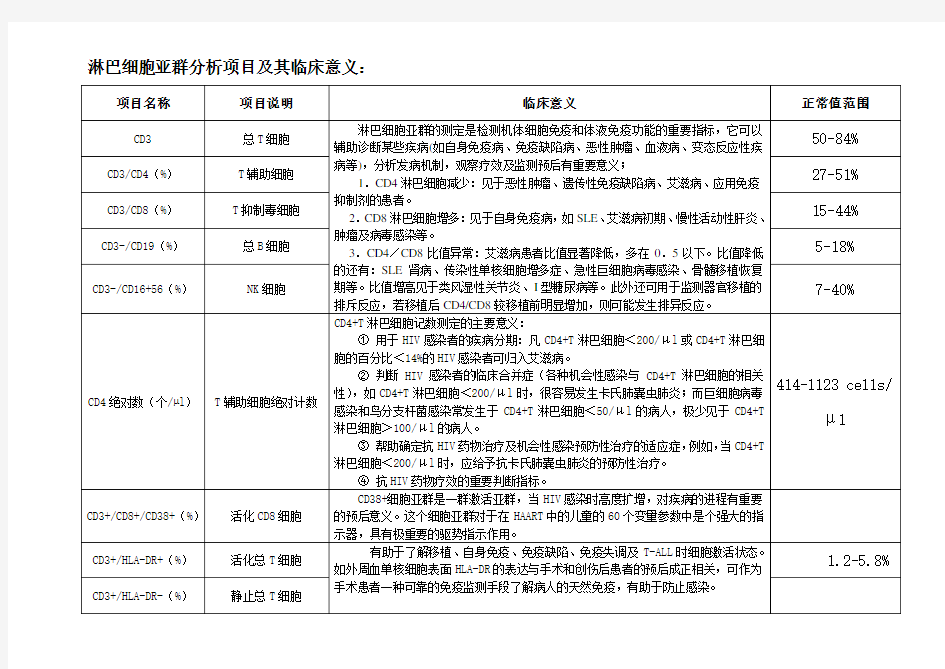
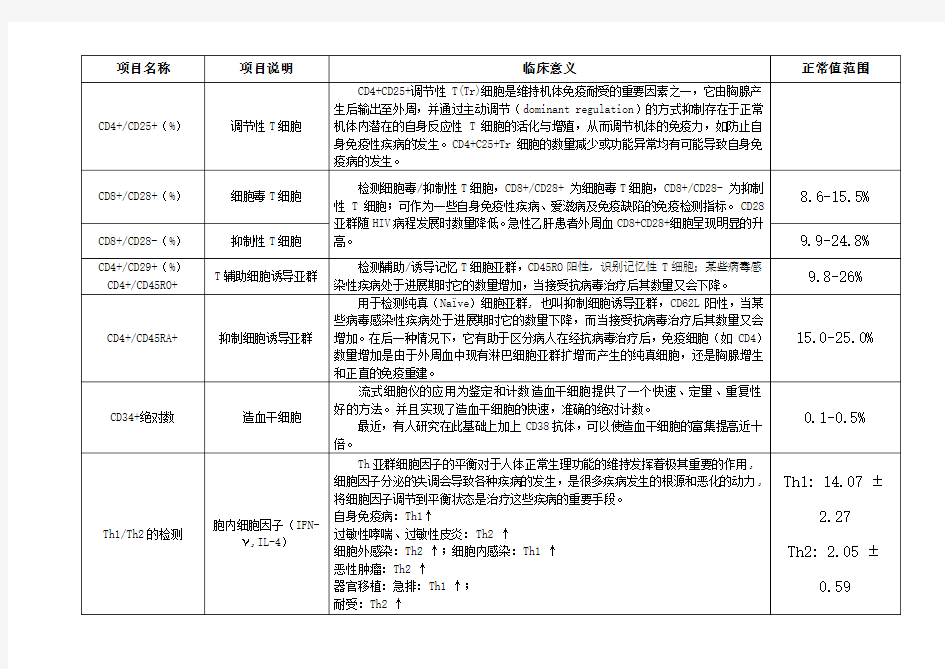
淋巴细胞亚群分析项目及其临床意义:
T细胞亚群的分类及功能
T细胞亚群的分类及功能 更新时间:2004-4-29 3:56:00 T细胞是不均一的群体,按其抗原识别受体,可将T细胞分为二大类。一类是TCRαβ、T细胞,另一类是TCRγδ细胞(表8-2)。 表8-2 TCRαβ+T细胞与TCRγδT细胞的特性 TCRαβT细胞TCRγδT细胞 分子结构二硫键相连的异二聚体分子二硫键相连的异二聚体分子 多样性多少 分布周围血60%~70% 周围血1%~10%表皮及肠粘膜上皮 表型CD4+CD8+(DP)60% CD4-CD8-(DN)35% CD2+100% CD5+>95% CD4-CD8-(DN) CD2+ CD5- 发育胸腺(发生晚) 胸腺(发生早)存在胸腺外途径 功能 识别与MHC分子结合的多肽复合 分子抗原 可能的作用 第一线防御细胞的原始受体 可识别MHC或MHC样分子识别由MHC 样分子呈递的抗原 TCRαβT细胞也是不均一的群体,根据其表型(phenotype)即其细胞表面的特征性分 子的不同,可将成熟T细胞分为二个亚类(subsets)即CD4+T细胞和CD8+细胞。 根据TCRαβT细胞的功能可将其分为二类。一类为调节性T细胞,可包括辅助性T细胞(helper T lymphocte,TH)和抑制性T细胞(suppressor T lymphocyte,Ts)。另一类为效应性T细胞(effector T cell),可包括杀伤性T细胞(eytolytie T cell,CTL,或TC)和迟发型超敏性T细胞(delayed type hypersensitivity T lymphoctye,TDTH)。 (一)TCRαβT细胞 二类T细胞表型分子均呈CD2+、CD3+阳性,但γδT细胞为CD4-、CD8-双阴性细胞(double negative cell,DN)或CD8+,而αβT细胞其表型为CD4+或CD8+单阳性细胞(single positive cell,SP)。
淋巴细胞亚群(详细资料)
机体免疫状态是衡量机体是否患病的重要指标,目前多采用流式细胞术来监测机体的免疫状态,其中最重要的指标是检测T、B和NK淋巴细胞的水平。 T细胞主要包括T辅助细胞(Th)和T抑制细胞(Ts)细胞亚群。CD3+细胞代表外周血中总的成熟T细胞,理论上应约等于CD4+细胞和CD8+细胞的总和,但往往出现CD4+加CD8+细胞之和大于CD3+,这是因为CD4+细胞包括CD3+/CD4+细胞(真正Th细胞)和CD3-CD4+细胞(非Ts细胞),而后者包括CD3-CD8+CD16+56+细胞(一部分NK细胞)和CD3-CD8+CD16+56-(未知细胞)。由此可见,真正的TH细胞是CD3+CD4+细胞,真正Ts细胞是CD3+CD8+细胞。尤其当患者NK细胞明显增加时,会使CD4细胞和CD8细胞的总和远大于CD3+细胞,因此,用三色荧光标记才能分析真正的辅助性T细胞和抑制性T细胞。 首先在淋巴细胞中识别出CD3细胞,然后在CD3细胞中再区分CD4+和CD8+细胞。NK细胞的表面无T细胞和B细胞表面标志,但有CD16和CD56等标志,用CD16+56抗体能鉴定出NK细胞(一定是CD3阴性),CD3-CD16+56+细胞才是真正的NK细胞。根据是否表达CD8,又可将NK细胞分为CD3-CD8+CD16+56+细胞(所占比例小,不影响CD8比例)和CD3-CD8-CD16+56+细胞(主要成分)。 B细胞的表面标志是CD19,理论上CD3-CD19+细胞才是真正的B淋巴细胞。但 CD3+CD19+细胞很少,可忽略不计,所以CD19+细胞就是B淋巴细胞。 在抗肿瘤效应中,CD4和CD8分别是T淋巴细胞的辅助/诱导细胞亚群与抑制/细胞毒细胞亚群,CD4细胞的主要功能是通过其分泌的淋巴因子,增强和扩大免疫应答过程,辅助诱导其它免疫细胞如杀伤性T细胞,B细胞等共同发挥抗肿瘤作用,CD4细胞的减少,导致免疫功能低下。CD4/CD8比值是重要的免疫状态监测指标,其比例的降低与免疫系统损害的程度相关。 CD4降低见于恶性肿瘤、遗传性免疫缺陷症、艾滋病、应用免疫抑制剂者;CD8降低见于自身免疫性疾病或变态反应性疾病;CD4/CD8比值升高见于恶性肿瘤、自身免疫性疾病、变态反应、病毒感染等;CD4/CD8比值降低见于艾滋病(常小于0.5)。监测器官移植排斥反应时,CD4/CD8比值升高预示可能发生排斥反应。
淋巴细胞亚群分析与临床---陈建林
一、流式淋巴细胞亚群检测的临床意义 1.了解不同情况下机体免疫功能状态 肿瘤(手术、放化疗患者的免疫功能检测) 感染(脓毒血症、重症监护患者等) 自身免疫病、免疫缺陷病等 不孕不育 某些血液系统疾病 其他:慢性肾病、骨髓移植恢复期等 2.辅助临床疾病的诊断 3.探索疾病的发病机理、病程及预后 4.观察监测疗效,指导临床建立治疗方案 二、淋巴细胞的分类及功能 B细胞(CD19+):体液免疫 辅助/诱导T细胞(Th):介导和增强免疫应答 (CD4+) 淋巴细胞T细胞(CD3+)细胞毒性(Tc) /抑制性T细胞(Ts): 抗病毒、抗肿瘤 (CD8+) 调节性T 细胞(Treg):抑制免疫应答、维持免疫耐受 (CD4+CD25+) NK细胞:抗肿瘤、抗病毒感染和免疫调节 (CD16+/CD56+) 三、流式淋巴细胞亚群检测的临床应用 淋巴细胞亚群检测与儿科疾病 (一)评估机体免疫功能状态 多种小儿疾病原发或继发疾病均存在T细胞异常,观察T细胞变化,对小儿疾病病因、发病机制以及协助临床诊断与治疗等具有重要价值。 类型指标CD3+ CD4+CD8+CD4+/CD8+细菌性肺炎↓↓↓↓↑↓↓ 支原体肺炎↓↓↓↓↓↓↓↓ 病毒性肺炎↓↓↓↓↓↓↓↓ 传单增多症↑↑↓↓↑↑↓↓ 支气管哮喘↑↓↑
T 细胞CD4、CD8、CD3 检测介入时间-----结合退热、消咳、肺罗音消失时间观察T 细胞变化,特别针对儿科患者可合理调节抗生素使用,改善预后,避免药物损伤. (二)原发性免疫缺陷病的早期识别和干预 1.流式细胞仪分析T细胞亚群(包括CD3+、CD4+和CD8+)、B细胞(CD19+) 和NK细 胞(CD16+/CD56+)比例等主要检查项目,可对大多数原发性免疫缺陷病患儿作出诊断。 2.评估免疫接种前机体免疫状态 案例:T/B细胞联合免疫缺陷患 儿,未评价免疫系统功能,直接 接种灭活疫苗,造成严重感染T 细胞CD4、CD8、CD3 检测介入时间-----结合患儿科反复感染的临床症状及时检测; 在疫苗接种前2-3天作出评估。 淋巴细胞亚群检测在肿瘤临床的应用 恶性肿瘤的发生、发展、转移与人体免疫功能下降密切相关。人体的抗肿瘤免疫以细胞 免疫为主,体内发挥抗肿瘤免疫作用主要由CD4和CD8细胞完成。 (一)评价肿瘤患者的整体免疫功能 1.肿瘤患者处免疫抑制状态,T淋巴细胞降低。 2.肿瘤患者T淋巴细胞与病程相关,随病程逐渐降低。 CD3、CD4、CD4/CD8细胞数下降程度:Ⅳ期> Ⅲ期> Ⅱ期>Ⅰ期3.肿瘤患者T淋巴细胞持续低下,转移率高、易复发
T细胞及其亚群分型
T细胞及其亚群分型 上海优宁维生物科技有限公司 利用标志物分析T细胞亚群 T细胞及其亚群可以根据细胞表面表达的不同标志物而区分,如CD3,CD4,CD8和CD25。使用这些结合了荧光的抗体直接标记这些标志物之后,多色流式分析技术就可以帮助研究者对单个细胞同时进行多个标志物的测量,而这可以提供特定样品关于细胞系以及细胞亚群分化阶段的信息。在分析中通过增加如CCR7,CD62L,或CD69这样的把标志物,则可以提供更多的信息,如细胞粘附并固定到体内的能力,或感兴趣的T细胞亚群的活化状态等。 通过分析细胞表达出的标志物——不仅有细胞表面受体,还包括细胞因子分泌profile和细胞内信号分子——研究者已经确定了多种细胞分型,各自代表了功能各不相同的T细胞亚群(如Th1,Th2,Th17,Treg,Th9)。 通过细胞分选分离选定的细胞群
结合使用表面标志物和细胞分选仪,如BD FACSAria? III 和BD Influx? 系统,可以从复杂的细胞混合物中分离出特定的细胞群。纯净、有活性的细胞群还可以在培养过程中扩增,分化并保存。 针对一些特定的应用,BD生物科学的科学家已经研究出详细分选操作方法,例如分离人调节性T细胞(Treg)方法,使用富含CD4的细胞,根据CD4+CD25int-hi CD127low 表型分选,这种方法的效率和产率都会更高。 充分利用多色流式分析仪的工具 无论您刚刚开始使用流式细胞仪,或是正在设计一个复杂的多色实验,抑或正在寻找一种更简单的方法搭建并优化仪器,我们都一路相伴,为您提供丰富的工具和信息。我们优宁维公司可以为客户提供给免费荧光抗体配色服务: 欢迎同时索取多色荧光配色图谱!Email: fcm@https://www.360docs.net/doc/6415724701.html, 常见T细胞标志物,如下表
T淋巴细胞亚群检测操作程序
一、目的: 保证流式细胞仪检测外周血中T淋巴细胞亚群检验的工作质量,旨在保证正确的T淋巴细胞亚群检测标准操作程序和控制检测结果的精确度与准确度。 二、修改程序: 本标准操作程序的改动,可由任一使用本SOP的工作人员提出,并报经下述人员批准签字:质量主管、授权人(科主任),方可改动。 三、适用范围: 外周血中T淋巴细胞亚群的绝对计数检测。 四、实验原理: 人的T淋巴细胞根据其生物功能和细胞表面抗原的表达可分为二大类:辅助/诱导T细胞和抑制/细胞毒T细胞。辅助/诱导T淋巴细胞表达CD3和CD4;抑制/细胞毒T细胞表达CD3和CD8。利用各种单克隆抗体与淋巴细胞表面抗原结合,再配多色荧光染料以及绝对计数管,即可以把T淋巴细胞区分为两种亚型,进面得到各亚群的绝对值。 六、主要试剂: CD4-FITC/CD8-PE/CD3-APC/CD45-PC7 (美国BCs公司;CAT:IM3548), 七、实验操作: 1、标本采集:使用EDTA-K2抗凝真空采血管,抽取静脉血2ml。 2、染色和固定细胞: (1)标本管编号A,取一只流式专用管A1。 (2)A1管加入CD4-FITC/CD8-PE/CD3-APC/CD45-PC7 20ul。 (3)A1管中再加入全血100ul,混均。 (4)置室温,避光孵育15min。
(5)加入FACSLysing溶血液2.0ml,置室温,避光孵育10min。 (6)300g离心5min,弃上清液。 (7)PBS洗涤细胞两次,300g离心5min,弃上清液。 3、上机检测;分析结果;打印实验报告。 八、参考值: 总T细胞(CD3+):59.4-84.6 辅助/诱导T细胞(CD3+CD4+): 28.5-60.5 抑制/细胞毒T细胞(CD3+CD8+): 11.1-38.3 Th/Ts: 0.9-3.6 九、临床意义: T淋巴细胞可以分为辅助/诱导T细胞和抑制/细胞毒T细胞。测定CD4和CD8可用于化疗、自身免疫病的免疫监视。在造血干细胞移植患者中,CD4+细胞恢复晚于CD8+细胞,导致Th/Ts比例显著下降。HIV及某些病毒感染(EB病毒、SARS病毒等)患者Th/Ts比例也下降显著。 十、质量控制: 1、先用标准微球调整仪器,正确设置电压、补偿。 2、健康人CD4+细胞加CD8+细胞总数应大约等于CD3总数;免疫病、淋 巴瘤可能有较大差异。 3、收集细胞太少(少于500个)、碎片污染太多(超过10%)、门中淋巴细 胞不纯(小于90%)可能引起实验结果不正确。 4、建议使用逻辑设门方法(CD45-SSC设门与FSC-SSC设门)减少杂质的 干干扰。
最新T细胞亚群的分类及功能
T细胞亚群的分类及功能 1 2 更新时间:2004-4-29 3:56:00 3 T细胞是不均一的群体,按其抗原识别受体,可将T细胞分为二大类。4 一类是TCRαβ、T细胞,另一类是TCRγδ细胞(表8-2)。 5 表8-2 TCRαβ+T细胞与TCRγδT细胞的特性
6 TCRαβT细胞也是不均一的群体,根据其表型(phenotype)即其细胞 7 表面的特征性分子的不同,可将成熟T细胞分为二个亚类(subsets)即CD4+T 8 细胞和CD8+细胞。 9 根据TCRαβT细胞的功能可将其分为二类。一类为调节性T细胞,可 10 包括辅助性T细胞(helper T lymphocte,TH)和抑制性T细胞(suppressor T 11 lymphocyte,Ts)。另一类为效应性T细胞(effector T cell),可包括杀伤性 12 T细胞(eytolytie T cell,CTL,或TC)和迟发型超敏性T细胞(delayed type 13 hypersensitivity T lymphoctye,TDTH)。 14 (一)TCRαβT细胞 15 二类T细胞表型分子均呈CD2+、CD3+阳性,但γδT细胞为CD4-、CD8- 16 双阴性细胞(double negative cell,DN)或CD8+,而αβT细胞其表型为CD4+ 17 或CD8+单阳性细胞(single positive cell,SP)。 18 在末梢血主要为αβT细胞可占95%,而γδT细胞只占1%~10%。αβT 19 细胞为主要参予免疫应答的T细胞,而对γδT细胞功能不十分了解,可能是 20 具有原始受体的第一防线的防御细胞,与抗原感染有关。 21 (二)CD4+细胞 22 TCRαβTCD4+细胞(简称为CD4+细胞)的分子表型为CD2+、CD3+、CD4+、 23 CD8-。其TCR识别抗原是MHCⅡ类分子限制性。CD4+T细胞也是不均一的细胞群, 按其功能可包括二种T细胞,即辅助性T细胞(TH),和迟发型超敏性T细胞24 25 (TDTH)。前者为调节性T细胞,后者为效应性T细胞。
淋巴细胞亚群检测
淋巴细胞亚群检测 检测对象 原则:免疫功能受损者均应常规评估淋巴细胞亚群 免疫功能包括: 免疫防御功能 免疫自稳和耐受功能 免疫监视功能 免疫防御功能受损 易发生感染 反复感染 严重感染 多种病原与特殊病原感染 常规治疗效果不佳的感染 除了宿主免疫防御受损容易造成上述少见感染状况之外,感染本身也可造成继发性免疫防御受损,因此免疫评估应注意原发和继发两方面的问题。 免疫自稳和耐受功能受损 过敏性疾病:并非所有这类患者都需要进行淋巴细胞亚群的检测。对于一些严重的过敏患者应考虑淋巴细胞亚群的检测。
①婴幼儿时期全身严重湿疹样表现。 ②嗜酸性粒细胞显著增多 ③血清IgE水平明显增高(IgE>1000IU/L) ④伴有反复、严重感染的患者 自身免疫和自身炎症性疾病 ①存在难以控制的自身免疫反应情况及出现明显的自身免疫性淋巴增殖情况 ②合并反复感染的患者 ③存在自身炎症反应 ④长期免疫抑制药物、生物制剂使用前后 免疫监视功能受损 主要引起肿瘤 血液系统肿瘤:儿童时期最为多见的是血液系统肿瘤 其他肿瘤及实体瘤:其他系统肿瘤患者也应酌情进行淋巴细胞亚群的检测,既可能存在原发性淋巴细胞亚群的异常,也可能出现继发性改变,尤其是进行各种化疗时,淋巴细胞亚群大多会受到影响 其他特殊情况 血常规中淋巴细胞明显异常 家族成员中有免疫缺陷病史
长期使用免疫抑制剂者 淋巴细胞亚群分析结果判读,应对淋巴细胞亚群的相对计数和绝对计数分别进行判别。 结果分析 (一)基本数据判断 1.相对计数的3个基本公式: FCM检测淋巴细胞亚群结果应首先根据下述3个公式进行评估[15]。公式1: CD3+%+CD19+%+CD16+/CD56+%=100%±5% 公式2:CD4+%+CD8+%=CD3+%±5% 公式3:CD4+/CD8+比值>1.0(1.5~2.0,新生儿期可达4.0) 2.相对计数基本公式意义: (1) CD3+%+CD19+%+CD16+/CD56+%明显大于或小于100%±5%,提示检测系统异常或存在明显淋巴细胞亚群异常。(2) CD4+%+CD8+%之和明显大于或小于CD3+%±5%,提示存在双阳性(CD4+CD8+)或双阴性(CD4-CD8-)T淋巴细胞。(3)一般情况CD4+/CD8+比值>1,年龄越小CD4+/CD8+比值越大。CD4+/CD8+比值<1,提示T淋巴细胞亚群存在异常。 3.绝对计数的判断: 绝对数标准不同仪器和年龄段及人群存在差别。个体间变化也比较大。各个实验室所采用的标准有所不同。应根据实验室的参考范围进
流式细胞术检测体液T淋巴细胞亚群的临床应用
?50?垦竖垫墼堕堂垄查!!!!生!旦箜!!鲞箜!塑丛』!坐!!型!』竺!!!型垫!!!y堕:!!:垒坠! ?临床研究?流式细胞术检测体液T淋巴细胞亚群的临床应用 莫扬1,许小东2 (华中科技大学同济医学院附属裹樊医院检验科,湖北襄樊441021;2.卫生部北京医院流式细胞仪室100730) 【摘要】目的探讨胸水、腹水、肺泡灌洗液T淋巴细胞亚群的榆测方法及临床价值。方法采用流式细胞术检测良、恶性疾病患者的50例胸水、46例腹水、47例肺泡灌洗液(BALF)中T淋巴细胞亚群的水平并分组进行比较。结果1)胸水:结核性胸膜炎组胸水Ts细胞占T淋巴细胞的(27.36±6.41)%、Th细胞占T淋巴细胞的(67.98±7.41)%、Th/Ts比值为2.60±0.64,肺部恶性肿瘤组胸水Ts细胞占T淋巴细胞的(67.97士4.20)%、Th细胞占T淋巴细胞的(37.61±4.80)%、Th/Ts比值为0.47-4-0.10,与结核性胸膜炎组比较,恶性组Th、Th/Ts比值显著F降(P<0.01)而Ts显著升高(P<0.01);2)肺泡灌洗液:肺良性疾病组肺泡灌洗液Ts细胞占T淋巴细胞的(44.54-4-9.56)%、Th细胞占T淋巴细胞的(49.28-+4-12.88)%、Th/Ts比值为1.13±0.29,肺部恶性肿瘤组肺泡灌洗液Ts细胞占T淋巴细胞的(65.11±7.77)%、Th细胞占T淋巴细胞的(34.57±6.65)%、Th/Ts比值为0.54-4-0.19,与良性病变组比较,恶性组Th卜.降(P<o.05),Th/Ts比值显著卜.降(P<0.01),而Ts显著升高(P<0.01)。3)腹水:结核性腹膜炎组腹水Ts细胞占T淋巴细胞的(33.11±3.34)%、Th细胞占T淋巴细胞的(66.69±3.78)%、Th/Ts比值为2.03士0.28,恶性组腹水Ts细胞占T淋巴细胞的(56.64±9.34)%、Th细胞占T淋巴细胞的(35.86士3.30)%、Th/Ts比值为0.65±0.10,与结核性腹膜炎组比较,恶性组Th、Th/Ts比值显著F降(P<0.01),而Ts显著升高(P<o.01)。结论胸腹水、肺泡灌洗液T淋巴细胞亚群检测可用于分析性质并有助于评估患者局部免疫功能状态。 【关键词】支气管肺泡灌洗液;流式细胞术;T淋巴细胞哑群 中图分类号:R446.61文献标识码:A文章编号:1673—4130(2010)01—0050—02 InvestigationofTlymphocytesubsetsinfluidofthepatientsbyflowcytometry MOYankl,XUXiao-dong2 (1.DepartmentofClinicalLaboratory,AfJ’iliatedxiangJanHospital,TD竹gJi MedicineCollege, HuazhongScienceandTechnologyUniversity,Xiangfan,Hubei441021,China)[Abstract]0bjectiveToevaluatethemethodoffloweytometricanalysisofTlymphocytesubsetsinbodyfluidofthepa—tients.MethodsInovdertogetTlymphocytesby3-colourstainingmethodutilizingSSC/CD3Percpantibody,47bronchoalveolarlavagefluidand50weretestedbyflowcytometery.Results1)ThepercentageofThis(67.98±7.41)%,Ts(27.36士6.41)%andTh/Ts(2.60±0.64)inBAI。Fwithlungcancer。andthepercentageofThis(37.61士4.8)%,Ts(67.97±4.20)%,andTh/Ts(0.47士0.10)inBALFwithlungcancerrespectively。andtheThcellsinBALFwithlungcancerwerelowerthanthoseinthebenignpulmonarydisorder(P<0.05)。andtheTh/TsratiowassignificantlylowerwhiletheTscellsweresignificantlyhigherinBALFoflungcancer(P<0.01),eompariedwiththebenignpulmonarydisorder;2)ThepercentageofThis(35.76+-7.71)%andTs(64.31士7.37)%andTh/Ts(0.57土0.18)inBALFwithlungcancer,andthepercentageofThis(49.27土12.88)%,Ts(44.54士9.56)oA,andTh/Tsis(1.13±0.29)inBALFwithbenignpulmonarydisorder.TheThcellsinBALFwithlungcancerwaslowerthanthoseinthebenignpulmonarydisorder(P<0.05),theTh/TsratioweresignificantlylowerandtheTscellsweresignificantlyhigherinBALFoflungcancer(P<0.01)compariedwiththebenignpulmonarydisorder;3)ThepercentageofThis(35.76士7.71)%,Tsis(64.31±7.37)%andTh/Tsare(0.57士0.18)inBALFwithlungcancer,andthepercentageofThis(49.27土12.88)%,Tsis(44.54±9.56)%,andTh/Tsis(1.13±0.29)inBALFwithbenignpulmonarydisorder.Respectively,theThcellsin BALFwithlung cancerwerelowerthanthosein thebenignpulmonarydisorder(P<0.05),theTh/Tsratioweresignificantlylow— erandtheTscellsweresignificantlyhigherinBALFoflungcancer(P<0.01)compariedwiththebenignpulmonarydisorder.Con‘clusionTheimmunityfunctioninthepatientswithlungcancerwassignificantlydecreased.FlowcytometrieapproachisvaluableinanalyzingTlymphocytesubsetsinBAI。F. [Keywords]Bronchoalveolarlavagefluid;Flowcytometry;T-lymphocytesubsets 恶性浆膜腔积液确诊的金标准是在积液巾找到肿瘤细胞。然而在临床上,常有高度怀疑为恶性积液但未能找到肿瘤细胞的情况,从而影响到诊断的最终判断。笔者通过对患者胸水、腹水、肺泡灌洗液T淋巴细胞亚群的分析判断其性质,为临床恶性积液的诊断提供了一种检测指标,现报道如下。 资料与方法 1.标本来源病例为2006年6月至2007年12月在襄樊市巾心医院及卫生部北京医院呼吸科、消化科、肿瘤科住院治疗的相应疾病患者。1)胸水来源:肺癌20例(均经病理最终证实),年龄31~69岁,男17例,女3例。组织学分型:鳞癌14例。腺癌4例,小细胞癌2例;结核性胸膜炎30例,年龄26~68岁,男18例,女12例。刷检见结核杆菌(抗酸染色阳性)确诊。2)肺泡灌洗液来源:肺癌组25例(男15例、女10例),均经病理证实,年龄39~71岁;肺部良性疾病组22例(男15例、女7例),年龄28~70岁,其中肺结核8例、肺炎ll例、肺结节病3
T细胞亚群
T淋巴细胞亚群(来自:中国免疫学网) 应用CD4和CD8单克隆抗体可将外周淋巴器官或外周血中的T细胞分为CD4+CD8-和CD4-CD8+两个主要的亚群。每个亚群按照某些表面标志和功能又可分为不同的功能亚群。 一.CD4阳性细胞群 1.Th1和Th2亚群应用Th细胞克隆培养技术和细胞因子产生的不同,可分为Th1和Th2。 Th1细胞能合成IL-2、IFN-γ、,LT、IL-3、TNF-α和GM-CSF,但不能合成IL-4、IIL-5、IL-6、IL-10和IL-13;而Th2能合成TNF-α、IL-3、GM-CSF、IL-4、IL-5、IL-6、IIL-10(细胞因子合成抑制因子,CSIF)和IL-13,不能合成IL-2、IFN-γ和LT。此外Th1和Th2都能分泌三巨噬细胞炎症蛋白和前脑啡肽原。Th1和Th2都能辅助B合成抗体,但辅助的强度和性质不同。体外实验表明,IL-4明显促进B细胞合成和分泌IgE,如使LPS刺激小鼠B细胞合成IgE能力增强10-100倍。少量IFN-γ能完全阴断IL-4对IgE合成的促进作用。Th2分泌IL-4对IgE合成有正调节作用,而Th1分泌IFN-γ则起负调节作用。此外,Th2通过分泌IL-4和IL-5辅助IgA合成,分泌IL-10(CSIF),抑制Th1细胞合成细胞因子,而Th1对IgG1合成则有抑制作用,但辅助其它几种类型Ig的合成。由于Th1和Th2合成淋巴因子的种类不同,因而介导不同的超敏反应。IL-3和IL-4均能促进肥大细胞增殖,且相互有协同作用,IL-5除辅助B细胞合成IgA外,还能刺激骨髓嗜酸性粒细胞的集落形成,因而Th2与速发型超敏反应关系密切。Th1通过产生IFN-γ阻断IgE合成,对速发型超敏反应有抑制作用。Th1与迟发型超敏反应有关,可能与IL-2、IFN-γ等对巨噬细胞活化和促进CTL分化作用有关,此外LT也有直接杀伤靶细胞作用。两群Th克隆均能诱导抗原提呈细胞(APC)表达MHCⅡ类抗原,Th1通过IFN-γ诱导Mφ表达Ia抗原,而Th2通过IL-4对Mφ和B细胞Ia抗原表达起正调节作用。在人类Th1和Th2细胞亚群尚未得到最后证实。从目前发表资料来看,CD4+CD45RO+前体细胞向Th2效应细胞分化,而IFN-γ则对前体细胞向Th2分化过程起抑制作用,因此IL-4和IFN-γ在决定CD4+CD45RO+前体细胞向Th1或Th2分化过程中起着重要的调节作用。人T细
流式细胞术检测淋巴细胞亚群操作规程
流式细胞术检测淋巴细胞亚群操作规程 一、编号:JS0604 二、标题:流式细胞术检测淋巴细胞亚群操作规程 三、关键词:流式细胞术淋巴细胞操作规程 四、目的:规范流式细胞术检测淋巴细胞亚群的实验操作 五、背景知识:T细胞亚群变化的临床意义主要表现在肿瘤、自身免疫性疾病中。在感染性疾病中,因为CD4+ T细胞是辅助、诱导T细胞的标志,CD4+ T 细胞下降常见于某些病毒感染性疾病,如AIDS、巨细胞病毒感染、瘤型麻风。而CD4+ T细胞长期低于正常水平,常提示患者易于被病毒等微生物侵袭。CD8+是抑制、杀伤T细胞的标志,在传染性单核细胞增多症、巨细胞病毒感染、慢性乙型肝炎等感染性疾病中,CD8+ T细胞常升高。CD4+/CD8+细胞比值下降,除肿瘤等疾病外,常见于AIDS、瘤型麻风、传染性单核细胞增多症、巨细胞病毒感染、血吸虫病等。 六、原理:利用不同荧光物质标记的抗CD3、CD4、CD8单克隆抗体,与待测成分作用,然后上流式细胞仪检测待测细胞。待测细胞随流动室内的流动鞘液排列成单列,一个个迅速通过激光聚焦区,激光在对每个细胞进行照射时可同时得到前向角散射和侧向角散射2种散射光以及激发荧光标记物质发出的信号,利用这些信号,可计算出CD3+、CD4+、CD8+的相对含量,从而得出各细胞群的相对比值。 七、仪器设备和材料:肝素抗凝静脉血1ml,不同荧光素标记的抗CD3、CD4、CD8单克隆抗体,同型阴性对照荧光物,溶血剂,固定剂,流式细胞仪。 八、操作步骤 1、100μ1抗凝血加20μl荧光单克隆抗体,同时做阴性对照。 2、避光室温作用20min,溶去红细胞后,固定剂固定。 3、上流式细胞仪测定,以阴性对照测出本底参数,调节荧光补偿,设定阳性参数值,软件将计算出阳性表达细胞比例。 九、注意事项 1、为保证所得结果的可靠性,每次试验前应以标准荧光微球检测仪器的变异系数。
T淋巴细胞亚群报告的阅读与分析
T淋巴细胞亚群报告的阅读与分析 彭晓 在细菌感染性疾病,我们已经习惯了用白总分检查来了解感染的状态和做出相应的处理。作为细胞免疫重要内容的T淋巴细胞及亚群的检测在一些疾病中也有相应的结果,根据这些结果可以解释发病机理、对患者的免疫功能和预后做出判断以及指导治疗。这些疾病主要包括:1.病毒感染性疾病;2.肿瘤性疾病; 3.自体免疫性疾病; 4.器官移植患者; 5.其他免疫缺损或异常的患者。在各大型医院,T细胞亚群已经成为以上疾病中常规使用的项目。 在白细胞中淋巴细胞是非常重要的一类。它分为主要参与细胞免疫的T淋巴细胞(CD3+)和主要参与体液免疫的B淋巴细胞(CD19+)。而T淋巴细胞又分为辅助性T淋巴细胞(CD3+CD4+)和抑制性/细胞毒性T淋巴细胞(CD3+CD8+)。在正常情况下,各群淋巴细胞的数目和相对比例都在一定的范围内。 淋巴细胞和主要的亚群 T h1 辅助T(分泌I F N等) (C D3+C D4+) T淋巴细胞T h2 (C D3+)(分泌I L-4等) C D28(+) 淋巴细胞抑制T\细胞毒T杀伤性细胞毒(肝炎) (C D3+C D8+) C D28(-) B淋巴细胞抑制性(肿瘤) (C D19+) (方框内为T细胞亚群报告中所包括的内容) T淋巴细胞亚群报告中包括实验室报告和医生报告。前者主要是供实验室人员进行条件和质量控制所用,后者是供医生阅读,较为方便清晰。 在T淋巴细胞亚群的医生报告中提供了以下内容: 1. 总T(CD3+)淋巴细胞的绝对计数: 就如白总分中的白细胞计数一样,该细胞的绝对计数(个/ul)一般也在一定范围内。在一些情况下,如病毒感染、化学和物理因素、免疫系统的衰竭或其它功能紊乱、造血系统异常等疾病时此值可能会有异常。曾有人报道淋巴瘤患者的淋巴细胞数目多时预后较好。由此可以推测,肿瘤患者的T淋巴细胞数目较高时(在正常范围内)预后也应该较好。 2. 辅助T(CD3(+)CD4(+))细胞的绝对计数和百分比。 3. 抑制T(CD3(+)CD8(+))细胞的绝对计数和百分比。 如上图所示,无论是CD3(+)CD4(+)还是CD3(+)CD8(+)细胞,都可以进一步划分为更进一步的亚群。 4. CD3(+)细胞中的CD4、CD8双阳性或双阴性细胞:
BD流式临床检测分析-外周血淋巴细胞亚群分析
BD流式细胞术临床应用研究—外周血淋巴细胞亚群分析 临床背景: 淋巴细胞是机体细胞免疫和体液免疫应答的重要细胞成分。正常情况下,各淋巴细胞亚群(包括T细胞、B细胞、NK细胞等)可维持一定数量和比例,相互作用,稳定调节,维持着机体的正常免疫功能。当不同淋巴细胞亚群的量及功能发生异常改变时,机体会产生一序列病理变化和免疫功能障碍,导致疾病的发生。相反,测定淋巴细胞亚群的变化,也能对疾病早期诊断和控制、临床治疗指导等提供理论依据和数据支持。利用流式细胞术对外周血淋巴细胞亚群分析已广发应用月多种疾病的辅助诊断,如恶性肿瘤、血液病、自身免疫和免疫缺陷病等,对分析发病机理、观察疗效及监测预后等也具有重要意义。 检测目的: 分析外周血淋巴细胞亚群,了解患者免疫功能的异常,辅助临床诊断和治疗 常用检测项目及抗体使用: 总T细胞(CD3+):正常值50-84%。细胞降低见于恶性肿瘤、自身免疫疾病、先天性免疫缺陷等;细胞增高见于慢性活动性肝炎、重症肌无力等;所需抗体为CD3。 总B细胞(CD3-/CD19+):正常值5-18%。细胞增多见于自身免疫性疾病;细胞降低见于传染性单核细胞增多症等;所需抗体为CD3和CD19. T辅助/诱导淋巴细胞(CD3+/CD4+):正常值27-51%。细胞减少见于恶性肿瘤;抗体为CD3和CD4。 T抑制/毒性淋巴细胞(CD3+/CD8+)正常值15-44%。细胞增多见于自身免疫性疾病;抗体为CD3和CD8
T辅助:T抑制细胞(CD4+:CD8+):正常值1.4-2.0。比值降低见于艾滋病、SLE肾病、传染性单核细胞增多症、急性巨细胞病毒感染、骨髓移植恢复期等;逼孩子增高见于类风湿性关节炎、I型糖尿病等; NK细胞(CD3-/CD16+/CD56+):正常值7-40%,细胞降低见于恶性肿瘤特别是中晚期伴转移的肿瘤,免于缺陷病及使用免疫抑制剂等;抗体为CD3、CD16和CD56。 自然杀伤性T细胞(CD3+/CD56+/CD16+):正常值2-13%,具有NK细胞和T细胞的标志,参与对细菌和寄生虫的反应,在控制病毒性感染中也发挥作用;抗体同6。 活化总T细胞(CD3+/HLA-DR+)和活化的单核细胞(CD14+/HLA-DR+):正常值1.2-5.8%;抗体为CD3、CD14和HLA-DR。 调节性T细胞(CD4+/CD25+/Foxp3+):正常值为占CD4+淋巴细胞的比例5-10%。Treg 细胞的数量减少或者功能异常具有可能导致自身免疫病的发生,可用于骨髓移植术前术后的跟踪;抗体为CD4、CD25和Foxp3。 细胞毒T细胞(CD8+/CD28+)和抑制性T细胞(CD8+/CD28-):正常值分别为8.6-15.5%和9.9-24.8%。可作为一些自身免疫性疾病、艾滋病及免疫缺陷的免疫检测指标,CD28+亚群随HIV病程发展时数量降低,急性乙肝患者外周血CD8+/CD28+细胞呈现明显的升高;抗体为CD8和CD28。 T辅助细胞诱导亚群(CD4+/CD45RO+):正常值9.8-26%;某些病毒感染性疾病处于进展期是它的数量增加,接收抗病毒治疗后数量会下降;抗体为CD4和CD45RO。 抑制细胞诱导亚群(CD4+/CD45RA+):正常值15-25% 凋亡亚群(CD95+):正常值为占CD4+淋巴细胞的比例20-50%;CD95是介导细胞凋亡的主要受体,凋亡亚群可评价细胞的凋亡情况。抗体为CD95。 血液标本要求
T细胞亚群的分类及功能
T细胞亚群的分类及功能
T细胞亚群的分类及功能 更新时间:2004-4-29 3:56:00 T细胞是不均一的群体,按其抗原识别受体,可将T细胞分为二大类。一类是TCRαβ、T细胞,另一类是TCRγδ细胞(表8-2)。 表8-2 TCRαβ+T细胞与TCRγδT细胞的特性 TCRαβT细胞TCRγδT细胞 分子结构二硫键相连的异二聚体分子二硫键相连的异二聚体分子 多样性多少 分布周围血60%~70% 周围血1%~10%表皮及肠粘膜上皮 表型CD4+CD8+(DP)60% CD4-CD8-(DN)35% CD2+100% CD5+>95% CD4-CD8-(DN) CD2+ CD5- 发育胸腺(发生晚) 胸腺(发生早)存在胸腺外途径 功能 识别与MHC分子结合的多肽复合 分子抗原 可能的作用 第一线防御细胞的原始受体可识别MHC或MHC样分子识别由MHC 样分子呈递的抗原 TCRαβT细胞也是不均一的群体,根据其表型(phenotype)即其细胞表面的特征性分子的不同,可将成熟T细胞分为二个亚类(subsets)即CD4+T细胞和CD8+细胞。
根据TCRαβT细胞的功能可将其分为二类。一类为调节性T细胞,可包括辅助性T细胞(helper T lymphocte,TH)和抑制性T细胞(suppressor T lymphocyte,Ts)。另一类为效应性T细胞(effector T cell),可包括杀伤性T细胞(eytolytie T cell,CTL,或TC)和迟发型超敏性T细胞(delayed type hypersensitivity T lymphoctye,TDTH)。 (一)TCRαβT细胞 二类T细胞表型分子均呈CD2+、CD3+阳性,但γδT细胞为CD4-、CD8-双阴性细胞(double negative cell,DN)或CD8+,而αβT细胞其表型为CD4+或CD8+单阳性细胞(single positive cell,SP)。 在末梢血主要为αβT细胞可占95%,而γδT细胞只占1%~10%。αβT细胞为主要参予免疫应答的T细胞,而对γδT细胞功能不十分了解,可能是具有原始受体的第一防线的防御细胞,与抗原感染有关。 (二)CD4+细胞
