常见阳离子的检验方法
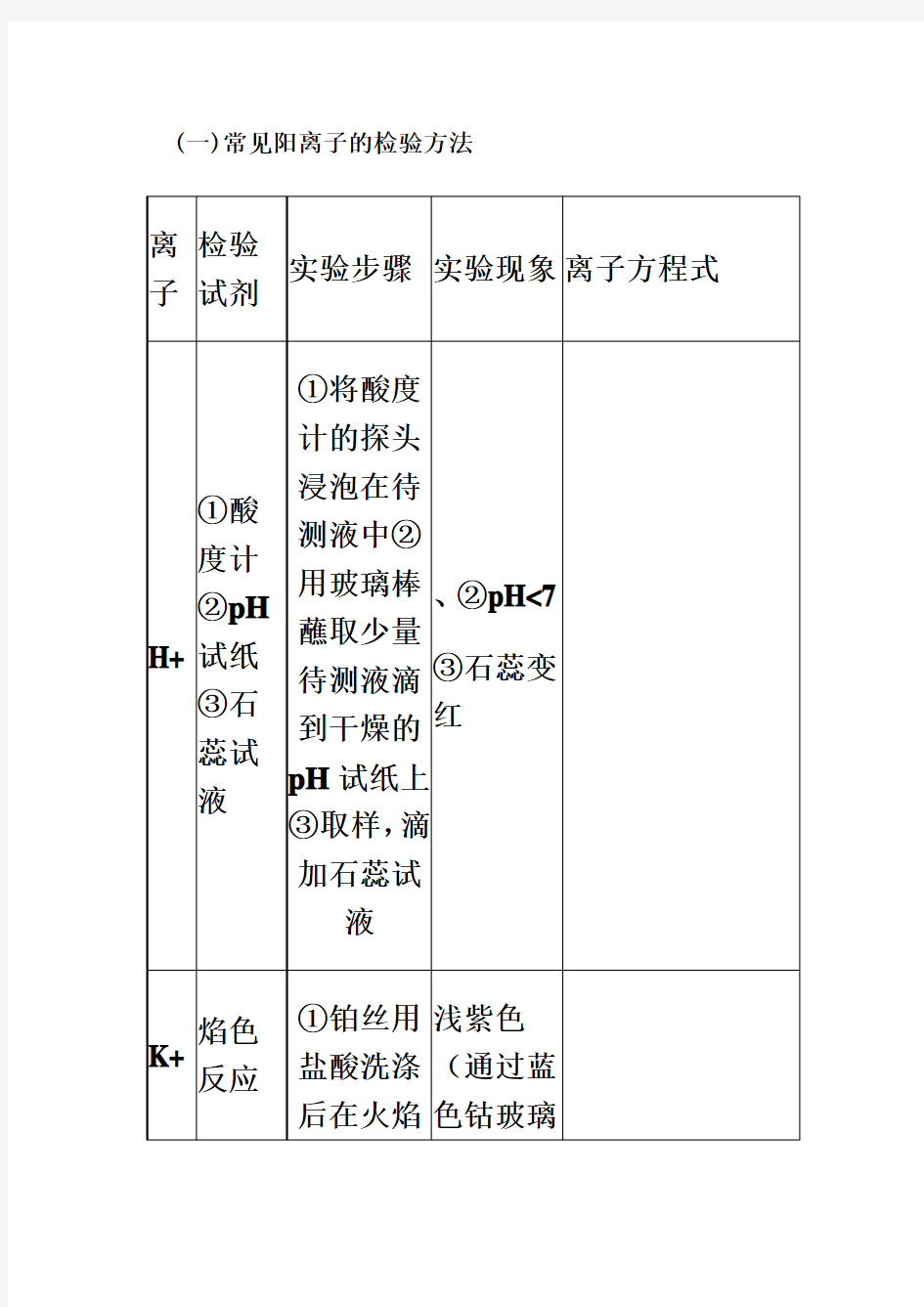
(一)常见阳离子的检验方法 离子 检验
试剂 实验步骤 实验现象 离子方程式
H+ ①酸度计
②pH 试纸③石蕊试液 ①将酸度
计的探头
浸泡在待
测液中②
用玻璃棒蘸取少量待测液滴
到干燥的pH 试纸上③取样,滴
加石蕊试
液
、②pH<7
③石蕊变红
K+ 焰色反应
①
铂丝用盐酸洗涤后在火焰浅紫色(通过蓝色钴玻璃
上灼烧至原火焰色②蘸取溶液,放在火
焰上灼烧,观察火焰颜色。
片观察钾
离子焰
色)
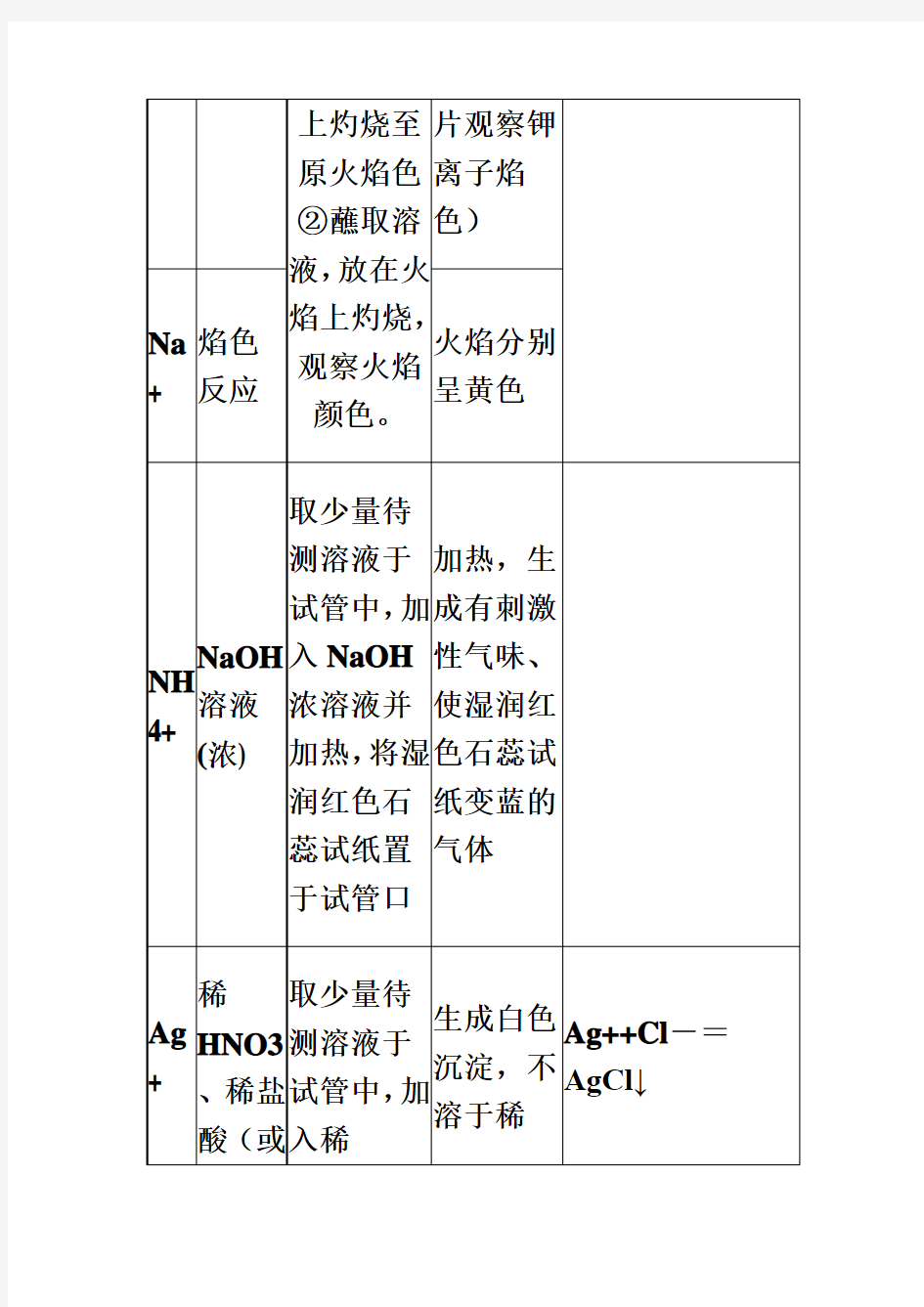
Na + 焰色反应 火焰分别呈黄色 NH
4+ NaOH 溶液(浓) 取少量待
测溶液于试管中,加入NaOH 浓溶液并加热,将湿润红色石蕊试纸置于试管口
加热,生
成有刺激
性气味、使湿润红色石蕊试
纸变蓝的
气体
Ag + 稀HNO3、稀盐酸(或取少量待
测溶液于试管中,加入稀生成白色沉淀,不溶于稀Ag++Cl -=
AgCl↓
NaCl)H NO3再
加入稀盐
酸(或
NaCl)
HNO3
Ba 2+ ①稀
H2SO
4或可
溶性
硫酸
盐溶
液②稀
HNO3
取少量待
测溶液于
试管中,加
入稀
H2SO4再
加入稀
HNO3
产生白色
沉淀,且
沉淀不溶
于稀
HNO3
Ba2++
SO42-=BaSO4↓
Fe 3+ KSCN
溶液
取少量待
测溶液于
试管中,加
入KSCN
溶液
变为血红
色溶液
Fe3++3SCN-=
Fe(SCN)3
加苯
取少量待
测溶液于
溶液显紫
酚试管中,加
苯酚
色
淀粉KI溶液滴加淀粉
KI溶液
溶液显蓝
色
2Fe3++2I-=
2Fe2++ I2
加NaOH 溶液加NaOH
溶
产生红褐
色沉淀
Fe3++3OH-=
Fe(OH)3↓
离子检验
试剂
实验步骤实验现象离子方程式
Fe 2+ ①KSC
N溶
液,新
制的
氯水
①取少量
待测溶液
于试管中,
加入
KSCN溶
液,新制的
氯水
①加入
KSCN溶
液不显红
色,加入
少量新制
的氯水
后,立即
2Fe2+ +
Cl2#FormatImgI
D_1# 2Fe3+ +
2Cl- Fe3++3SCN
-=Fe(SCN)3
显红色。
②加NaOH 溶液②取少量
待测溶液
于试管中,
加入
NaOH溶
液并露置
在空气中
②开始时
生成白色
Fe(OH)2
沉淀,迅
速变成灰
绿色,最
后变成红
褐色
Fe(OH)3
沉淀。
Fe2++2OH —
=Fe(OH)2↓
4Fe(OH)2十
O2+2H2O=4Fe(
OH)3
③(无
其它还原性物质如SO32-)酸性高锰取少量待
测溶液于
试管中,加
入酸性高
锰酸钾溶
液
加入酸性
高锰酸钾
溶液紫色
褪去
酸钾
Al3 + NaOH
溶液
取少量待
测溶液于
试管中,逐
滴加入
NaOH溶
液至过量
加入适量
NaOH溶
液后生成
白色沉
淀,该沉
淀溶于过
量NaOH
溶液中
Al3++3OH-=
Al(OH)3↓
Al(OH)3+OH-
=AlO2-+ 2H2O
Cu 2+ NaOH
溶液
取少量待
测溶液于
试管中,加
入NaOH
溶液
加入适量
NaOH溶
液后生成
蓝色沉淀
Cu++2OH-=
Cu(OH)2↓(二)常见阴离子的检验方法
离子检验试
剂
实验步骤
实验现
象
离子方程式
OH - ①酸度
计②pH
试纸③
酚酞或
石蕊试
液
①将酸度
计的探头
浸泡在待
测液中②
用玻璃棒
蘸取少量
待测液滴
到干燥的
pH试纸
上③取样,
滴加石蕊
试液
②pH>7
③酚酞变
红或石
蕊变蓝
CO 32- ①BaCl
2溶液、
稀盐酸
取少量待
测溶液于
试管中,
加入
BaCl2溶
液再向沉
淀中加入
稀盐酸。
1.加入
BaCl2溶
液后生
成白色
沉淀,沉
淀溶于
稀盐酸,
并放出
Ba2++
CO32-=BaCO3↓
BaCO3+2H+=
Ba2++CO2↑+H2
O
无色无味气体
②稀盐酸、Ca(OH )2溶液取少量待
测溶液于
试管中,
加入稀盐
酸后放出
的气体通
入使澄清
的
Ca(OH)2
溶液
2.加入
稀盐酸
后放出
无色无
味气体,
通入澄
清的
Ca(OH)
2溶液变
浑浊
CO32-+2H+=H2
O+CO2↑
Ca2++2OH-
+CO2=
CaCO3↓+H2O
SO 42- BaCl2
溶液、
稀硝酸
或稀盐
酸
取少量待
测溶液于
试管中,
加入
BaCl2溶
液再向沉
淀中加入
生成不
溶于稀
硝酸或
稀盐酸
的白色
沉淀
Ba2++
SO42-=BaSO4↓
稀盐酸。
SO 32- ①稀盐
酸、品
红溶液
取少量待
测溶液于
试管中,
加入稀盐
酸后放出
的气体通
入品红溶
液
加入稀
盐酸后
放出的
气体使
品红溶
液褪色
SO32-+2H+=H2
O+SO2↑
②BaCl
2溶液、
稀盐酸
取少量待
测溶液于
试管中,
加入
BaCl2溶
液再向沉
淀中加入
稀盐酸。
加入
BaCl2溶
液后生
成白色
沉淀,沉
淀溶于
稀盐酸,
并放出
刺激性
气味的
SO32-+2H+=H2
O+SO2↑
气体
离子检验试
剂
实验步骤
实验现
象
离子方程式
Cl -AgNO3
溶液、
稀硝酸
或稀盐
酸
取少量待
测溶液于
试管中,
加入
AgNO3
溶液,再
向沉淀中
加入稀盐
酸。
生成不
溶于稀
硝酸或
稀盐酸
的白色
沉淀
Ag++Cl-=
AgCl↓
Br -AgNO3
溶液、
稀硝酸
或稀盐
酸
生成不
溶于稀
硝酸或
稀盐酸
的浅黄
色沉淀
Ag++Br-=
AgBr↓
I-①AgN
O3溶
液、稀
①生成不
溶于稀
硝酸的
Ag++I-=AgI↓
硝酸黄色沉
淀
②新制氯水,淀粉溶液取少量待
测溶液于
试管中,
加入新制
氯水,再
加入淀粉
溶液
②滴入新
制Cl2,
振荡后
再滴入
淀粉溶
液,变蓝
Ag++I-=AgI↓
2I-+Cl2=I2+2Cl-
I2遇淀粉变蓝
Cl O- HCl、淀
粉-KI
取少量待
测溶液于
试管中,
加入HCl
溶液,然
后加入淀
粉-KI溶
液
淀粉-KI
溶液变
蓝HCl、石
取少量待
测溶液于
石蕊先
变红后
褪色
蕊试管中,
加入HCl
溶液,然
后加入石
蕊试液
注意:
1.若SO42-与Cl-同时检验,需注意检验顺序。应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-。
2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸。因为稀硝酸能把SO32-氧化成SO42-。
3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+。
4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出
5.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-
常见离子的检验方法
常见离子的检验方法 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
常见离子的检验方法 一、常见阳离子的检验 1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液。 2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。 3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸。 4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。 5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。 6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。 7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2]。②插入铁片或锌片,有红色的铜析出。 8、 NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝。 9、 H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红。
10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察) 12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色 13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色 二、常见阴离子的检验 1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。 2、 Cl-:加入AgNO3溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水 3、 Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。 4、 I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。②加入氯水和淀粉试液,溶液变蓝。 5、 SO42-:加入BaCl2、硝酸钡溶液,生成白色沉淀(BaSO4),滴加稀硝酸沉淀不溶解。 6、 SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色。②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2)。 7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的 Pb(NO3)2试纸变黑。②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS 或CuS)。
高中化学常见离子的检验和物质的鉴别
(一)常见阳离子的检验方法 离子检验试剂实验步骤实验现象离子方程式 H+①酸度计 ②pH试纸 ③石蕊试 液 ①将酸度计的探头 浸泡在待测液中② 用玻璃棒蘸取少量 待测液滴到干燥的 pH试纸上③取样, 滴加石蕊试液 ①、②pH<7 ③石蕊变红 K+焰色反应①铂丝用盐酸洗涤 后在火焰上灼烧至 原火焰色②蘸取溶 液,放在火焰上灼 烧,观察火焰颜色。 浅紫色(通过蓝色 钴玻璃片观察钾 离子焰色) Na+焰色反应火焰分别呈黄色 NH4+NaOH溶液 (浓) 取少量待测溶液于 试管中,加入NaOH 浓溶液并加热,将 湿润红色石蕊试纸 置于试管口 加热,生成有刺激 性气味、使湿润红 色石蕊试纸变蓝 的气体 Ag+稀HNO3、稀 盐酸(或 NaCl) 取少量待测溶液于 试管中,加入稀HNO3 再加入稀盐酸(或 NaCl) 生成白色沉淀,不 溶于稀HNO3 Ag++Cl-=AgCl↓ Ba2+①稀H2SO4 或可溶性 硫酸盐溶 液②稀 HNO3 取少量待测溶液于 试管中,加入稀 H2SO4再加入稀HNO3 产生白色沉淀,且 沉淀不溶于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe3+KSCN溶液 取少量待测溶液于 试管中,加入KSCN 溶液 变为血红色溶液Fe3++3SCN-=Fe(SCN)3加苯酚 取少量待测溶液于 试管中,加苯酚 溶液显紫色 淀粉KI溶 液 滴加淀粉KI溶液溶液显蓝色2Fe3++2I-=2Fe2++ I2加NaOH溶 液 加NaOH溶产生红褐色沉淀Fe3++3OH-=Fe(OH)3↓ Fe2+ ①KSCN溶 液,新制的 氯水 ①取少量待测溶液 于试管中,加入 KSCN溶液,新制的 氯水 ①加入KSCN溶液 不显红色,加入少 量新制的氯水后, 立即显红色。 2Fe2+ + Cl22Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN)3
中学常见离子检验方法与常见操作
一、常见离子的检验方法 1.常见阳离子的检验 2.常见阴离子的检验
1.检验溶液中含有F e3+的实验操作: 取少量溶液置于试管中,滴加几滴K S C N溶液,若溶液变红,则证明溶液中含有F e3+。2.检验溶液中含有F e2+的实验操作是: 取少量溶液置于试管中,滴加几滴K S C N溶液,溶液不变色,在加入几滴氯水后溶液变红,则证明溶液中含有F e2+。 3.验证溶液中不含有铁元素的实验操作是: 取少量溶液置于试管中,滴加几滴K S C N溶液,溶液不变色,在加入几滴氯水后溶液不变红,则证明溶液中不含+铁元素。 4.检验溶液中含有N H 4 +的实验操作是: 取少量溶液置于试管中,加入氢氧化钠后加热,将湿润的红色石蕊试纸放在试管口,若试纸 变蓝则证明溶液中含有N H 4+。
5.如何检验S O 4 2- 取少量溶液置于试管中,加入盐酸无现象,在加入B a C l 2 溶液产生白色沉淀则证明溶液 中有S O 4 2- 。 6.如何检验C l - 取少量溶液置于试管中,加入A g N O 3 溶液有白色沉淀产生,再加入H N O 3 后沉淀不 溶解则证明溶液中含有C l - 。 二、实验室常见操作 1. 气密性检验 (1)装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等) →描述现象→得出结论; (2)微热法检查的关键词是封闭、微热、气泡、水柱; (3)液差法的关键词是封闭、形成液差。 甲 ①实验开始前,某同学对甲实验装置进行了气密性检查,方法是: 关闭活塞,从长颈漏斗加水至浸没长颈漏斗的下端,继续加水形成一段水柱,一段时间水柱无变化则证明装置气密性良好。 ①实验开始前,某同学对乙实验装置进行了气密性检查,方法是: 关闭分液漏斗活塞,将导管插入水中用酒精灯微热烧瓶,导管口有气泡冒出,停止加热导管内出现一段水柱,证明气密性良好。 2.气体的收集 依据:根据气体的溶解性或密度 ① ② ③ ④ ⑤ ⑥
常见离子的检验方法
《生活中常见的化合物》初四化学专题复习 教学目标: 1、通过复习常见离子的检验方法,提高学生分析问题的能力。 2、进一步复习常见化肥的名称和作用、有机物相关知识。 3、培养科学的阅读、分析、解答问题的能力。 教学教程 一、常见离子的检验方法 是。 二、碳酸钙、氧化钙、氢氧化钙三种物质间的转化。 1、复习阅读P73页3 2.练习:1)《石灰吟》中的化学知识。古诗《石灰吟》“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清白在人间。”从化学视角看,它描述了“石灰”的生产使用过程。请你指出诗句中所涉及到的化学变化,并写出反应方程式。思考在系列变化中“石灰”的主要成份及俗称。 2)(2006?威海)某化工厂用石灰石制取碳酸钙,流程图为 (1)请写出上述方案中所依据反应的化学方程式 ①______ ___; ②_______ __; ③. (2)请你仍然用石灰石为原料,其他试剂任选,设计另外一种制备碳酸钙的实验方案,将你的实验方案用流程图的形式表示出来: 三、常见化肥的名称和作用。 1、阅读复习P73 2、练习
1)、(2015?兰州)下列属于复合肥的是() A.NH4Cl B.KCl C.CaHPO4 D.KNO3 2)、(2015?孝感)下列对某一主题的知识归纳,有错误的一组是() A、物质鉴别 硫酸钾和硫酸铵﹣﹣熟石灰混合研磨、闻气味 羊毛纤维与合成纤维﹣﹣灼烧、闻气味 B、物质除杂 盐酸中混有硫酸﹣﹣加适量氯化钡溶液过滤 木炭粉中混有铁粉﹣﹣磁铁吸引 C、安全知识电器着火﹣﹣切断电源,再用干粉灭火器灭火 居室装修﹣﹣常开窗通风,防止甲醛中毒 D、物质与微粒构成 水﹣﹣由氢原子和氧原子构成 氯化钠﹣﹣由钠离子和氯离子构成 A.A B.B C.C D.D 3)、(2015?x疆)古丽同学发观校园中的玫瑰花生长不茂盛,叶子发黄.需要施加下列肥料中的()A.K2CO3B.NH4Cl C.Ca(H2PO4) 4)、某化学兴趣小组进行了识别化肥的探究活动.他们对氯化铵、碳酸氢铵、硫酸钾、磷矿粉四种化肥的实验探究步骤如下: (1)步骤一:在装有四种化肥的试管中,分别加入少量稀盐酸,有气体产生的是_____. (2)步骤二:再分别取少量未区分出的另外三种化肥于研钵中,各加入少量熟石灰粉末,混合、研磨,有刺激性气味气体放出的是_____.由此可知,在使用该类化肥时,要避免与_____(填“酸”或“碱”)性物质混合使用,以防降低肥效. 有同学提出,氯化铵、硫酸钾也可用下列某种物质进行区分,你认为可行的是_____. A.硝酸钡溶液;B.氯化钠溶液;C.酚酞溶液;D.稀盐酸. 四、生活中的有机物。 1、阅读复习P74 2、练习: 1)(2014.威海)8.人体就像一个复杂的“化学工厂”。在下列食物中,不能给这个“化学工厂”提供能量的是 A. 鸡蛋 B.花生油 C.矿泉水 D.馒头6.(2分)2)(2015?威海)在①糖类②油脂③蛋白质④维生素⑤纤维素⑥无机盐⑦水⑧二氧化碳中,属于人体必须 3)2008.威海8.人类从环境中摄取的物质,通过化学反应为生命活动提供物质和能量。下列物质是人的正常生命活动所必需的,且作为反应物参加了化学反应的是 ①蛋白质;②淀粉;③油脂;④维生素;⑤食盐;⑥水;⑦空气;⑧黄曲霉素;⑨二氧化铅;⑩纤维素。 A.①②③④⑤⑥⑦B.①②③④⑤⑥⑦⑧ C.①②③④⑤⑥⑦⑨D.①②③④⑤⑥⑦⑩ 4)2009.威海4.下列说法中,不正确的是 ( ) A.油脂和维生素是人体中重要的供能营养素 B.玻璃钢是日常生活中应用广泛的复合材料之一 C.氮肥、磷肥、钾肥及复合肥是农业生产中主要的化学肥料 D.浓硝酸、重金属盐等可使蛋白质发生化学变化,失去生理功能
常见阴离子的检验
一、常见阴离子的检验 1 .阴离子的初步检验 ①与稀H2SO4 作用,试液中加入稀H2SO4 并加热,有气泡产生,可能有CO32- 、SO32- 、S2- 、NO2- 或CN- 存在,再根据气体的特性不同,再进行判断。 ②与BaCl2 的作用。 试液中加入BaCl2 溶液,生成白色沉淀,可能有SO42- 、SO32- 、PO43- 、S2O32- 根据沉淀性质不同进行检验。 ③与AgNO3+HNO3 作用。 试液中加入AgNO3 再加入稀HNO3 若为白色沉淀为Cl- 黄色沉淀可能有 I- 、Br- 和CN- 存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32- 存在,Ag2S 为黑色沉淀。 ④氧化性阴离子的检验 试液用H2SO4 酸化后,加入KI 溶液和淀粉指示剂,若溶液变蓝,说明有 NO2- 存在。 ⑤还原性阴离子检验 a 、强还原性阴离子与I2 的试验,试液用H2SO4 酸化后,加含0.1%KI 的I2- 淀粉溶液,若其蓝色褪去,可能有SO32- 、C2O42- 、S2O32- 、S2- 和CN- 等离子存在。 b、还原性阴离子与KMnO4 的试验,试液用H2SO4 酸化后,加入 0.03%KMnO4 溶液,若能褪色,可能有SO32- 、S2O32- 、S2- 、C2O42- 、Br- 、I- 、NO2- 等离子。 2 .个别鉴定反应 ⑴SO42- 加入BaCl2 溶液生成BaSO4 白色沉淀,该沉淀不溶于稀HCl 或稀HNO3
Ba2++SO42- === BaSO4 ↓ ⑵SO32- a 、加入BaCl2 溶液生成BaSO3 白色沉淀,加入稀HCl ,沉淀溶解并放出有刺激性气味的气体SO2 Ba2++SO32- === BaSO3 ↓ BaSO3+2H+ === Ba2++H2O+SO2 ↑ b 、加入少量I2- 淀粉溶液,蓝色褪去 SO32-+I2+H 2O === SO42-+2I-+2H + ⑶Cl- 加入AgNO3 生成AgCl 白色沉淀,该沉淀不溶于稀HNO3 或稀 HCl ,但溶于浓NH3 · H2O AgCl+2NH3 · H2O === [Ag(NH3)2]++Cl -+2H2O ⑷Br- a 、加入AgNO3 生成淡黄色AgBr 沉淀,该沉淀不溶于HCl 或HNO3 中,微溶于浓NH3 · H2O 。 Ag++Br- === AgBr ↓ b 、加入新制氯水,振荡后再加入CCl4 ,继续振荡,无色CCl4 层变为红棕色。 Cl2+2Br- === 2Cl-+Br2 ⑸I- a 、加入AgNO3 生成AgI 黄色沉淀,该沉淀不溶于稀HNO3 和浓 NH3 · H2O 。
高中化学常见离子检验方法一览表
高中化学常见离子检验 方法一览表 公司内部编号:(GOOD-TMMT-MMUT-UUPTY-UUYY-DTTI-
高中化学常见离子检验方法一览表(一)常见阳离子的检验方法
Fe3+KSCN溶 液 取少量待测溶 液于试管中, 加入KSCN溶液 变为血红色溶 液 Fe3++3SCN-=Fe(SCN) 3加苯酚 取少量待测溶 液于试管中, 加苯酚 溶液显紫色 淀粉KI 溶液 滴加淀粉KI溶 液 溶液显蓝色2Fe3++2I-=2Fe2++ I 2加NaOH 溶液 加NaOH溶 产生红褐色沉 淀 Fe3++3OH-=Fe(OH) 3 ↓ 离子检验试 剂 实验步骤实验现象离子方程式? Fe2+ ①KSCN 溶液, 新制的 氯水 ①取少量待测 溶液于试管 中,加入KSCN 溶液,新制的 氯水 ①加入KSCN 溶液不显红 色,加入少量 新制的氯水 后,立即显红 色。 2Fe2+ + Cl 2 2Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN) 3 ②加 NaOH溶 液 ②取少量待测 溶液于试管 中,加入NaOH 溶液并露置在 空气中 ②开始时生成 白色Fe(OH) 2 沉淀,迅速变 成灰绿色,最 后变成红褐色 Fe(OH) 3 沉 淀。 Fe2++2OH —=Fe(OH) 2 ↓ 4Fe(OH) 2 十 O 2 +2H 2 O=4Fe(OH) 3 ③(无 其它还 原性物 质如 SO 3 2-)酸 性高锰 酸钾 取少量待测溶 液于试管中, 加入酸性高锰 酸钾溶液 加入酸性高锰 酸钾溶液紫色 褪去 Al3+NaOH溶 液 取少量待测溶 液于试管中, 逐滴加入NaOH 溶液至过量 加入适量 NaOH溶液后 生成白色沉 淀,该沉淀溶 于过量NaOH 溶液中 Al3++3OH-=Al(OH) 3 ↓ Al(OH) 3 +OH-=AlO 2 -+ 2H 2 O
常见离子的检验方法
常见离子的检验方法 一、常见阳离子的检验 1、 Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH) 2 ],该沉淀不溶于过量 的NaOH溶液。 2、 Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水。 3、 Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO 4 ),该沉淀不溶于稀硝酸。 4、 Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸。②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解。 5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH) 2 ],迅速变成灰 绿色,最终变成红褐色[Fe(OH) 3 ]。②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红。 6、 Fe3+:①加入KSCN溶液,溶液变为血红色。②加入NaOH溶液,生成红褐色沉淀。 7、 Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH) 2 ]。②插入铁片或锌片,有红色的铜析出。 8、 NH 4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH 3 ),该气体 能使湿润的红色石蕊试纸变蓝。 9、 H+:①加入锌或Na 2CO 3 溶液,产生无色气体;②能使紫色石蕊试液、pH 试纸变红。 10、K+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察) 12、Na+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈黄色 13、Ca2+:铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈砖红色
二、常见阴离子的检验 1、 OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝。 2、 Cl-:加入AgNO 3 溶液,生成白色沉淀(AgCl)。该沉淀不溶于稀硝酸,能溶于氨水 3、 Br-:①加入AgNO 3 溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸。②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色。 4、 I-:①加入AgNO 3 溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸。 ②加入氯水和淀粉试液,溶液变蓝。 5、 SO 4 2-:加入BaCl2、硝酸钡溶液,生成白色沉淀(BaSO4),滴加稀硝酸沉淀不溶解。 6、 SO 32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO 2 ),该 气体可使品红溶液褪色。②加入BaCl 2溶液,生成白色沉淀(BaSO 3 ),该沉淀可 溶于盐酸,产生无色、有刺激性气味的气体(SO 2 )。 7、 S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的 Pb(NO 3) 2 试纸变黑。②能与Pb(NO 3 ) 2 溶液或CuSO 4 溶液生成黑色的沉淀(PbS或 CuS)。 8、 CO 32-:①加入CaCl 2 或BaCl 2 溶液,生成白色沉淀(CaCO 3 或BaCO 3 ),将 沉淀溶于强酸,产生无色、无味的气体(CO 2 ),该气体能使澄清的石灰水变混 浊。②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向 原溶液中加入CaCl 2 溶液,产生白色沉淀。 9、 HCO 3 -:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变 浑浊;向原溶液中加入CaCl 2 溶液,无明显现象。 10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味 的气体(NO 2 )。 11、PO 43-:AgNO 3 溶液、稀硝酸生成黄色沉淀,加硝酸沉淀溶解
几种常见离子的检验
几种常见离子的检验 离 子 所用试剂方法现象化学方程式 Cl-AgNO3溶液和稀 HNO3 将AgNO3溶液滴入待测液中,再加稀 HNO3 生成白色沉淀.且不溶于稀HNO3 AgNO3+NaCl ==AgCl↓+N aNO3 SO4 2-BaCl2溶液和稀 盐酸 将稀盐酸滴入待测液中,再加BaCl2 溶液 滴加稀盐酸无现象,滴加 BaCl2 溶液生成白色沉淀,且沉淀不溶 于稀盐酸 BaCl2+Na2S O4==BaSO4 ↓+ +2NaCl CO3 2-盐酸(或HNO3) 和澄清石灰水 向待测液中加入盐酸(或HNO3).将产 生的气体通入澄清石灰水中 产生无色无味的气体,此气体能 使澄清的石灰水变浑浊 Na2CO3+2HC l==2NaCl+H 2O+ CO2↑ CO2+Ca(OH) 2==CaCO3↓ +H2O OH-酚酞试液、紫色 石蕊试液或红 色石蕊试纸 ①将酚酞试液滴入待测液中 ②将紫色石蕊试液滴入待测液中 ③将待测液滴在红色石蕊试纸上 ①溶液变红 ②溶液变蓝 ③红色石蕊试纸变蓝 —— H+紫色石蕊试液 或蓝色石蕊试 纸 ①将紫色石蕊试液滴入待测液中 ②将待测液滴在蓝色石蕊试纸上 ①溶液变红 ②蓝色石蕊试纸变红 —— NH4 +浓NaOH溶液 将浓NaOH溶液加入待测液中,加热, 将湿润的红色石蕊试纸置于试管口 (或用玻璃棒蘸浓盐酸置于试管口) 放出有刺激性气味的气体,该气 体能使湿润的红色石蕊试纸变 蓝(或遇到浓盐酸产生大量白 烟) NH4Cl+NaOH NaCl+H2 O+NH3↑ Cu2NaOH溶液将NaOH溶液加入待测液中生成蓝色沉淀CuSO4+2NaO
常见阳离子的检验方法
(一)常见阳离子的检验方法 离子 检验 试剂 实验步骤 实验现象 离子方程式 H+ ①酸度计 ②pH 试纸③石蕊试液 ①将酸度 计的探头 浸泡在待 测液中② 用玻璃棒蘸取少量待测液滴 到干燥的pH 试纸上③取样,滴 加石蕊试 液 、②pH<7 ③石蕊变红 K+ 焰色反应 ① 铂丝用盐酸洗涤后在火焰浅紫色(通过蓝色钴玻璃
上灼烧至原火焰色②蘸取溶液,放在火 焰上灼烧,观察火焰颜色。 片观察钾 离子焰 色) Na + 焰色反应 火焰分别呈黄色 NH 4+ NaOH 溶液(浓) 取少量待 测溶液于试管中,加入NaOH 浓溶液并加热,将湿润红色石蕊试纸置于试管口 加热,生 成有刺激 性气味、使湿润红色石蕊试 纸变蓝的 气体 Ag + 稀HNO3、稀盐酸(或取少量待 测溶液于试管中,加入稀生成白色沉淀,不溶于稀Ag++Cl -= AgCl↓
NaCl)H NO3再 加入稀盐 酸(或 NaCl) HNO3 Ba 2+ ①稀 H2SO 4或可 溶性 硫酸 盐溶 液②稀 HNO3 取少量待 测溶液于 试管中,加 入稀 H2SO4再 加入稀 HNO3 产生白色 沉淀,且 沉淀不溶 于稀 HNO3 Ba2++ SO42-=BaSO4↓ Fe 3+ KSCN 溶液 取少量待 测溶液于 试管中,加 入KSCN 溶液 变为血红 色溶液 Fe3++3SCN-= Fe(SCN)3 加苯 取少量待 测溶液于 溶液显紫
酚试管中,加 苯酚 色 淀粉KI溶液滴加淀粉 KI溶液 溶液显蓝 色 2Fe3++2I-= 2Fe2++ I2 加NaOH 溶液加NaOH 溶 产生红褐 色沉淀 Fe3++3OH-= Fe(OH)3↓ 离子检验 试剂 实验步骤实验现象离子方程式 Fe 2+ ①KSC N溶 液,新 制的 氯水 ①取少量 待测溶液 于试管中, 加入 KSCN溶 液,新制的 氯水 ①加入 KSCN溶 液不显红 色,加入 少量新制 的氯水 后,立即 2Fe2+ + Cl2#FormatImgI D_1# 2Fe3+ + 2Cl- Fe3++3SCN -=Fe(SCN)3
EDTA测定各种金属离子的方法 汇总
EDTA是目前最常用的测定各类金属离子的络合滴定剂,大部分金属离子可以直接滴定其含量,少部分由于动力学原因需要借助返滴定或置换滴定测定。下面我们将对于实验室常见的15种金属离子的EDTA滴定法进行整理。 金属离子如未特殊说明,默认配制成酸性的0.02 mol·L-1的标准溶液,每组测定取25.00 mL。准确加入意味着需要准确知道溶液的浓度和体积。 1. 镁、钙 稀释溶液体积至100 mL,加入10 mL氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入铬黑T(钙镁均可)或钙指示剂(仅限钙),滴定至终点溶液颜色由紫红色变为天蓝色。 注意事项:镁存在下测定钙时,用氢氧化钠调节pH使镁沉淀,此时应增加溶液体积,减少氢氧化镁沉淀对钙指示剂的吸附。 2. 铝(返滴定或置换滴定) 稀释溶液体积至100 mL,准确加入过量EDTA标准溶液,再加入15 mL醋酸缓冲溶液(60 g醋酸钠、2 mL冰乙酸定容至100 mL),加热煮沸3 min,加入PAN指示剂,用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。加入1~2 g氟化钠后煮沸,再用Cu2+标准溶液滴定至终点溶液颜色变为紫红色。 注意事项:通常采用第二步置换滴定测得的结果。 3. 锰(II) 稀释溶液体积至100 mL,用氨水(1+1)调节pH到10,再加入25 mL 氨性缓冲溶液(6.75 g氯化铵、57 mL氨水定容至100 mL),加入K-B混合指示剂,滴定至终点溶液颜色由紫红色变为纯蓝色。 注意事项:高价锰可用盐酸羟胺还原后测定。 4. 铁(III) 用盐酸(1+1)调节pH到2,水浴加热至60℃,加入Ssal指示剂,滴定至终点溶液颜色由紫红色变为无色或淡黄色。 注意事项:二价铁可用过氧化氢氧化至三价后测定。pH需在1.3 ~ 2之间,太低络合不定量,太高铁离子水解沉淀。 5. 钴(II)(返滴定) 准确加入过量EDTA标准溶液,再加入10 mL醋酸缓冲溶液(20 g醋酸钠、2.6 mL冰乙酸定容至100 mL),稀释溶液体积至100 mL,加入PAN 或二甲酚橙,用Cu2+标准溶液或Zn2+标准溶液滴定至终点溶液颜色变为紫红色。 注意事项:钴(III)可用过氧化氢还原至钴(II)后测定。可尝试在80℃下直接滴定。
常见阳离子的检验方法
常见阳离子的检验方法: 离 子 检验试剂实验步骤实验现象离子方程式 K+焰色反应①铂丝在火焰上灼烧至原火 焰色②蘸取溶液,放在火焰 上灼烧,观察火焰颜色。浅紫色(通过蓝色钴玻璃片 观察钾离子焰色) —— N a+ 焰色反应火焰分别呈黄色N H4 +NaOH溶液(浓) 向未知溶液中加入NaOH 浓溶液并加热 生成有刺激性气味、使湿润 红色石蕊试纸变蓝的气体 NH4++OH-=NH3↑+H 2 O Al 3+加NaOH溶液 向未知溶液中加入NaOH 溶液 加入适量NaOH溶液后生 成白色沉淀,该沉淀溶于过 量NaOH溶液中 Al3++3OH-=Al(OH)3↓ Cu 2+浓氨水向未知溶液中加入浓氨水 加入适量浓氨水后生成蓝色 沉淀,该沉淀溶于过量浓氨 水中,溶液呈深蓝色 Cu2++2OH-=Cu(OH) 2 ↓ Cu(OH)2+4NH 3 ·H2O=[Cu(NH3)4]2++ 2OH-+4H2O A g+①稀盐酸或可 溶性盐酸盐② 稀HNO3③氨 向未知溶液中加入稀盐酸再 加入稀HNO3向过滤出的沉 淀中加氨水 生成白色沉淀,不溶于稀H NO3,但溶于氨水,生成[A g(NH3)2]+ Ag++Cl-=AgCl↓
水 Ba 2+稀H2SO4或可 溶性酸盐溶液 向未知溶液中加入稀H2SO4 再加入稀HNO3 产生白色沉淀,且沉淀不溶 于稀HNO3 Ba2++SO42-=BaSO4↓ Fe 3+KSCN溶液 向未知溶液中加入KSCN溶 液或加NaOH溶液或加苯 酚 变为血红色溶液 Fe3++3SCN-=Fe(SC N)3 加NaOH溶液产生红褐色沉淀 Fe3++3OH-=Fe(OH)3 ↓ 加苯酚溶液显紫色 Fe3++6C6H6OH→[Fe (C6H5O)]3-+6H+ Fe 2+①加NaOH溶 液 向未知溶液中加入NaOH 溶液并露置在空气中 开始时生成白色Fe(OH)2沉 淀,迅速变成灰绿色,最后 变成红褐色Fe(OH)3沉淀。 Fe2++2OH-=Fe(OH)2 ↓4Fe(OH)2+O2+2 H2O=4Fe(OH)3 ②KMnO4 (H+) 溶液 向未知溶液中加入KMnO4 (H+)溶液 KMnO4(H+)紫色褪去 MnO4-+5Fe2++8H+= 5Fe3++Mn2++4H2O ③K3[Fe(CN)6] 向未知溶液中加入K3[Fe(C N)6]溶液 出现蓝色Fe3[Fe(CN)6]2沉 淀 3Fe2++2[Fe(CN)6]-=F e3[Fe(CN)6]2↓ ④KSCN溶液, 新制的氯水 加入KSCN溶液,新制的氯 水 加入KSCN溶液不显红色, 加入少量新制的氯水后,立 即显红色。 2Fe2++Cl2=2Fe3++2C l-Fe3++3SCN-=Fe(SC N)3
化学实验3——常见离子的检验方法
化学实验3——常见物质的检验方法 一.常见阳离子的检验方法 ⑴Na+、K+:用干净的铂丝蘸取待测物质少许,放在酒精灯上灼烧,火焰呈黄色,说明有钠存在;透过蓝色的钴玻璃,火焰呈紫色,说明有钾离子存在。 ⑵Al3+:加入氢氧化钠溶液,生成白色絮状沉淀,该沉淀能溶于盐酸与氢氧化钠溶液,但不溶于氨水。 ⑶Ag+:加入稀盐酸,生成白色沉淀,该白色沉淀不溶于稀硝酸 ⑷Fe2+:加入KSCN溶液,无现象,再加入氯水,溶液变血红色 ⑸Fe3+:加入KSCN溶液,溶液变血红色 ⑹NH4+:加入浓的氢氧化钠溶液,产生有刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝。 二.常见阴离子的检验: ⑴Cl-:加入硝酸银溶液反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水。 ⑵I-:能与硝酸银反应,生成黄色沉淀,黄色沉淀不溶于稀硝酸 ⑶SO42-:加入BaCl2溶液反应,生成白色沉淀,白色沉淀不溶于稀盐酸 ⑷SO32-:溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色 ⑸CO32-:能与CaCl2溶液反应,生成白色的CaCO3沉淀,该沉淀溶于盐酸,生成无色无味、能使澄清石灰水变浑浊的CO2气体。 ⑹HCO3-:加盐酸,产生无色无味,能使澄清的石灰水变浑浊的气体;向原溶液加入氯化钙,无明显现象。 三.常见气体的检验方法 1.CO2:将气体分别通入澄清的石灰水和品红溶液中,如果澄清的石灰水变浑浊,且品红不褪色,则通入的气体是CO2。 2.NH3:用润湿的红色石蕊试纸靠近待检气体的瓶口,如果试纸由红色变为蓝色,则证明待检气体是NH3。 3.SO2:将待检气体通入品红溶液中,如果品红溶液褪色,且受热后又恢复原色,则证明待检气体是SO2。
高中化学之常见离子的检验知识点
高中化学之常见离子的检验知识点 Ⅰ常见阳离子的检验: (l)H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。(2)Na+、K+用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。 (3)Ba2+能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。 (4)Mg2+能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。 (5)Al3+能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 (6)Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。(7)NH4+铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。(8)Fe2+能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。2Fe2++Cl2=2Fe3++2Cl- (9)Fe3+能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。(10)Cu2+蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH
溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。 Ⅱ常见阴离子的检验: (1)OH-能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。 (2)Cl-能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。 (3)Br-能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。 (4)I-能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。 (5)SO42-能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。 (6)SO32-浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。 (7)S2-能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀。(8)CO32-能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水
高中化学中常见离子检验方法总结
高中化学中常见离子检验方法总结 一、常见阴离子的检验 1.阴离子的初步检验 ①与稀H2SO4作用,试液中加入稀H2SO4并加热,有气泡产生,可能有CO32-、SO32-、S2-、NO2-或CN-存在,再根据气体的特性不同,再进行判断。 ②与BaCl2的作用。 试液中加入BaCl2溶液,生成白色沉淀,可能有SO42-、SO32-、PO43-、S2O32-根据沉淀性质不同进行检验。 ③与AgNO3HNO3作用。 试液中加入AgNO3再加入稀HNO3若为白色沉淀为Cl-黄色沉淀可能有I-、Br-和CN-存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32-存在,Ag2S 为黑色沉淀。 ④氧化性阴离子的检验 试液用H2SO4酸化后,加入KI溶液和淀粉指示剂,若溶液变蓝,说明有NO2-存在。 ⑤还原性阴离子检验 a、强还原性阴离子与I2的试验,试液用H2SO4酸化后,加含0.1%KI的I2-淀粉溶液,若其蓝色褪去,可能有SO32-、C2O42-、S2O32-、S2-和CN-等离子存在。 b、还原性阴离子与KMnO4的试验,试液用H2SO4酸化后,加入0.03%KMnO4溶液,若能褪色,可能有SO32-、S2O32-、S2-、C2O42-、Br-、I-、NO2-等离子。 2.个别鉴定反应 ⑴SO42-加入BaCl2溶液生成BaSO4白色沉淀,该沉淀不溶于稀HCl或稀HNO3 Ba2SO42-===BaSO4↓ ⑵SO32- a、加入BaCl2溶液生成BaSO3白色沉淀,加入稀HCl,沉淀溶解并放出有刺激性气味的气体SO2
Ba2SO32-===BaSO3↓ BaSO32H===Ba2H2O SO2↑ b、加入少量I2-淀粉溶液,蓝色褪去 SO32-I2H2O===SO42-2I-2H ⑶Cl-加入AgNO3生成AgCl白色沉淀,该沉淀不溶于稀HNO3或稀HCl,但溶于浓NH3·H2O AgCl2NH3·H2O===[Ag(NH3)2]Cl-2H2O ⑷Br- a、加入AgNO3生成淡黄色AgBr沉淀,该沉淀不溶于HCl或HNO3中,微溶于浓NH3·H2O。 Ag Br-===AgBr↓ b、加入新制氯水,振荡后再加入CCl4,继续振荡,无色CCl4层变为红棕色。 Cl22Br-===2Cl-Br2 ⑸I- a、加入AgNO3生成AgI黄色沉淀,该沉淀不溶于稀HNO3和浓NH3·H2O。 Ag I-===AgI↓ b、加入新制氯水,I-被氧化成浅棕色单质I2,加入少量CCl4,I2溶于CCl4等有机溶剂中,颜色加深,现象更明显。 2I-Cl2===2Cl-I2 c、I2遇淀粉显蓝色。 ⑹S2-a、S2-Pb2===PbS↓(黑) S2-Zn2===ZnS↓(白) b、S2-遇H2SO4或HCl放出无色有臭鸡蛋气味的气体。 ZH S2-===H2S↑
常见阳离子的检验实验报告
常见阳离子的检验实验报告 篇一:常见离子检验 1.常见阳离子的检验 检验操作 1.检验溶液中含有Fe3+的实验操作: 取少量溶液置于试管中,滴加几滴KSCN溶液,若溶液变红,则证明溶液中含有Fe。 2.检验溶液中含有Fe的实验操作是: 取少量溶液置于试管中,滴加几滴KSCN溶液,溶液不变色,在加入几滴氯水后溶液变红,则证明溶液中含有Fe。 3.验证溶液中有铁元素的实验操作是: 取少量溶液置于试管中,滴加几滴KSCN溶液,溶液不变色,在加入几滴氯水后溶液不变红,则证明溶液中不含+铁元素。 4.检验溶液中含有NH4的实验操作是: + 2+2+ 3+ 取少量溶液置于试管中,加入氢氧化钠后加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝则证明溶液中含有NH4+。 5.如何检验SO42-
取少量溶液置于试管中,加入盐酸无现象,在加入BaCl2溶液产生白色沉淀则证明溶液中有SO42-。(补充:加入盐酸的作用防止Agcl 干扰) 6.如何检验Cl - 取少量溶液置于试管中,加入AgNO3溶液有白色沉淀产生,再加入H NO3后沉淀不溶解则证明溶液中含有Cl-。 二、实验室常见操作 1.气密性检验 (1)装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等) →描述现象→得出结论; (2)微热法检查的关键词是封闭、微热、气泡、水柱; (3)液差法的关键词是封闭、形成液差。 甲 ①实验开始前,某同学对甲实验装置进行了气密性检查,方法是: 关闭活塞,从长颈漏斗加水至浸没长颈漏斗的下端,继续加水形成一段水柱,一段时间水柱无变化则证明装置气密性良好。 ①实验开始前,某同学对乙实验装置进行了气密性检查,方法是: 关闭分液漏斗活塞,将导管插入水中用酒精灯微热烧瓶,
常见阴离子的检验
常见阴离子的检验 1 .阴离子的初步检验 ①与稀H2SO4 作用,试液中加入稀H2SO4 并加热,有气泡产生,可能有CO32- 、SO32- 、S2- 、NO2- 或CN- 存在,再根据气体的特性不同,再进行判断。 ②与BaCl2 的作用。 试液中加入BaCl2 溶液,生成白色沉淀,可能有SO42- 、SO32- 、PO43- 、S2O32- 根据沉淀性质不同进行检验。 ③与AgNO3+HNO3 作用。 试液中加入AgNO3 再加入稀HNO3 若为白色沉淀为Cl- 黄色沉淀可能有I- 、Br- 和CN- 存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32- 存在,Ag2S 为黑色沉淀。 ④氧化性阴离子的检验 试液用H2SO4 酸化后,加入KI 溶液和淀粉指示剂,若溶液变蓝,说明有NO2- 存在。 ⑤还原性阴离子检验 a 强还原性阴离子与I2 的试验,试液用H2SO4 酸化后,加含0.1%KI 的I2- 淀粉溶液,若其蓝色褪去,可能有SO32- 、C2O42- 、S2O32- 、S2- 和CN- 等离子存在。 b、还原性阴离子与KMnO4 的试验,试液用H2SO4 酸化后,加入0.03%KMnO4 溶液,若能褪色,可能有SO32- 、S2O32- 、S2- 、C2O42- 、Br- 、I- 、NO2- 等离子。 2 .个别鉴定反应 ⑴SO42- 加入BaCl2 溶液生成BaSO4 白色沉淀,该沉淀不溶于稀HCl或稀HNO3 Ba2++SO42- === BaSO4 ↓ ⑵SO32- a 、加入BaCl2 溶液生成BaSO3 白色沉淀,加入稀HCl,沉淀溶解并放出有刺激性气味的气体SO2 Ba2++SO32- === BaSO3 ↓ BaSO3+2H+ === Ba2++H2O+SO2 ↑ b 、加入少量I2- 淀粉溶液,蓝色褪去 SO32-+I2+H 2O === SO42-+2I-+2H + ⑶Cl- 加入AgNO3 生成AgCl白色沉淀,该沉淀不溶于稀HNO3 或稀HCl,但溶于浓NH3 · H2O AgCl+2NH3 · H2O === [Ag(NH3)2]++Cl -+2H2O ⑷Br- a 、加入AgNO3 生成淡黄色AgBr沉淀,该沉淀不溶于HCl或HNO3 中,微溶于浓NH3 · H2O 。 Ag++Br- === AgBr ↓ b 、加入新制氯水,振荡后再加入CCl4 ,继续振荡,无色CCl4 层变为红棕色。 Cl2+2Br- === 2Cl-+Br2 ⑸I- a 、加入AgNO3 生成AgI黄色沉淀,该沉淀不溶于稀HNO3 和浓NH3 · H2O 。 Ag++I- === AgI ↓ b 、加入新制氯水,I- 被氧化成浅棕色单质I2 ,加入少量CCl4 ,I2 溶于CCl4 等有机溶剂中,颜色加深,现象更明显。 2I-+Cl2 === 2Cl-+I2 c 、I2 遇淀粉显蓝色。
高中化学常见离子的检验和物质的鉴别
高中化学常见离子的检验和物质的鉴别 TYYGROUP system office room 【TYYUA16H-TYY-TYYYUA8Q8-
(一)常见阳离子的检验方法
加NaOH溶液加NaOH溶产生红褐色沉 淀 Fe3++3OH-=Fe(OH) 3 ↓ Fe2+ ①KSCN溶 液,新制的 氯水 ①取少量待测 溶液于试管 中,加入KSCN 溶液,新制的 氯水 ①加入KSCN 溶液不显红 色,加入少量 新制的氯水 后,立即显红 色。 2Fe2+ + Cl 2 2Fe3+ + 2Cl- Fe3++3SCN-=Fe(SCN) 3 ②加NaOH溶 液 ②取少量待测 溶液于试管 中,加入NaOH 溶液并露置在 空气中 ②开始时生成 白色Fe(OH) 2 沉淀,迅速变 成灰绿色,最 后变成红褐色 Fe(OH) 3 沉 淀。 Fe2++2OH —=Fe(OH) 2 ↓ 4Fe(OH) 2 十 O 2 +2H 2 O=4Fe(OH) 3 ②加K3 [Fe(CN) 6] 取少量待测溶 液于试管中, 加入铁氰化钾 特征性蓝色沉 淀 Al3+NaOH溶液取少量待测溶 液于试管中, 逐滴加入NaOH 溶液至过量 加入适量NaOH 溶液后生成白 色沉淀,该沉 淀溶于过量 NaOH溶液中 Al3++3OH-=Al(OH) 3 ↓ Al(OH) 3 +OH-=AlO 2 -+ 2H 2 O Cu2+NaOH溶液取少量待测溶 液于试管中, 加入NaOH溶液 加入适量NaOH 溶液后生成蓝 色沉淀 Cu++2OH-=Cu(OH) 2 ↓ (二)常见阴离子的检验方法 离子检验试剂实验步骤实验现象 离子方程式 OH-①酸度计 ②pH试纸 ③酚酞或 石蕊试液 ①将酸度计的 探头浸泡在待 测液中②用玻 璃棒蘸取少量 待测液滴到干 燥的pH试纸上 ③取样,滴加 石蕊试液 ③②pH>7 ③酚酞变红 或石蕊变蓝
常见阳离子检验
常见阳离子检验 ●三价铬离子 Cr3+在强碱性溶液中以CrO2-的形式存在,此离子可以被H2O2氧化为铬酸根离子(黄色) Cr3+ + 4OH- === CrO2- + H2O 2CrO2-+ H2O2 ===2 CrO42- (黄) + 4H2O 黄色CrO42-的出现,即可初步说明试液里存在Cr3+ 为了进一步证实,可用硫酸酸化溶液,使CrO42-转化为Cr2O72-,然后加一些戊醇或乙醚,再加H2O2,若此时在戊醇层中有蓝色的过氧化铬生成,示有Cr3+存在:2 CrO42- +2H+ ==== Cr2O72-+ H2O Cr2O72-+4 H2O2+2 H+===2CrO5+5 H2O Cr2O72-+4 H2O2 +2 H+ ===2H2CrO6+3 H2O CrO5溶于水生成蓝色的过铬酸H2CrO6,它在水中很不稳定,生成后很快分解。所以要在其生成(即加入H2O2)前加入戊醇(或乙醚),否则鉴定容易失败。 ●二价锰离子 Mn2+在强酸性溶液中可被强氧化剂如NaBiO3 ,K2S2O8 ,PbO2氧化为MnO4-,溶液由无色变为紫红色:2 Mn2++5 NaBiO3+14 H+===2 MnO4-+5Bi3++5Na++7 H2O 2 Mn2++5 S2O82-+8 H2O===2 MnO4-+10SO42-+16 H+ 5 PbO2+2 Mn2++4 H+===2 H2O+2 MnO4-+5Pb2+ 这一类的氧化剂还有XeF2,KIO3,H5IO6.. ●二价铁离子 1,Fe2+与K3[Fe(CN)6]在酸性溶液中(非氧化性酸)生成深蓝色沉淀(旧称滕氏蓝)Fe2+ + K++Fe(CN)63-===K Fe[Fe(CN)6] 2,Fe2+与邻二氮菲在弱酸性条件下生成稳定的橙红色可溶性络合物。 ●三价铁离子 Fe3+酸性溶液中与K4[Fe(CN)6]生成蓝色沉淀(旧名普鲁士蓝)实际上与滕氏蓝为同一物质。 Fe3++ K+ + Fe(CN)64-== K Fe [Fe(CN)6] 其它离子在一般情况下不干扰,Co2+ Ni2+等能与试剂生成淡绿色至绿色沉淀,不要误认为是Fe3+。 ●二价钴离子 在中性或酸性溶液中,Co2+与NH4SCN生成蓝色络离子Co(SCN)42-。操作中常用固体NH4SCN或其饱和溶液,目的是促进络离子的形成。在酸性溶液中,上述离子可以以中性分子的形式进入乙醇或丙酮等有机溶剂中,稳定性增加,大大提高灵敏度,Fe3+可用NaF掩蔽.. ●二价镍离子 Ni2+在中性,乙酸性或氨性溶液里与丁二酮肟生成鲜红色螯合物沉淀二丁二酮肟 合镍(Ⅱ)螯合物。 Fe2+可加过氧化氢氧化为Fe3+,Fe3+和锰离子可用柠檬酸或酒石酸掩蔽。
