常用同位素性质
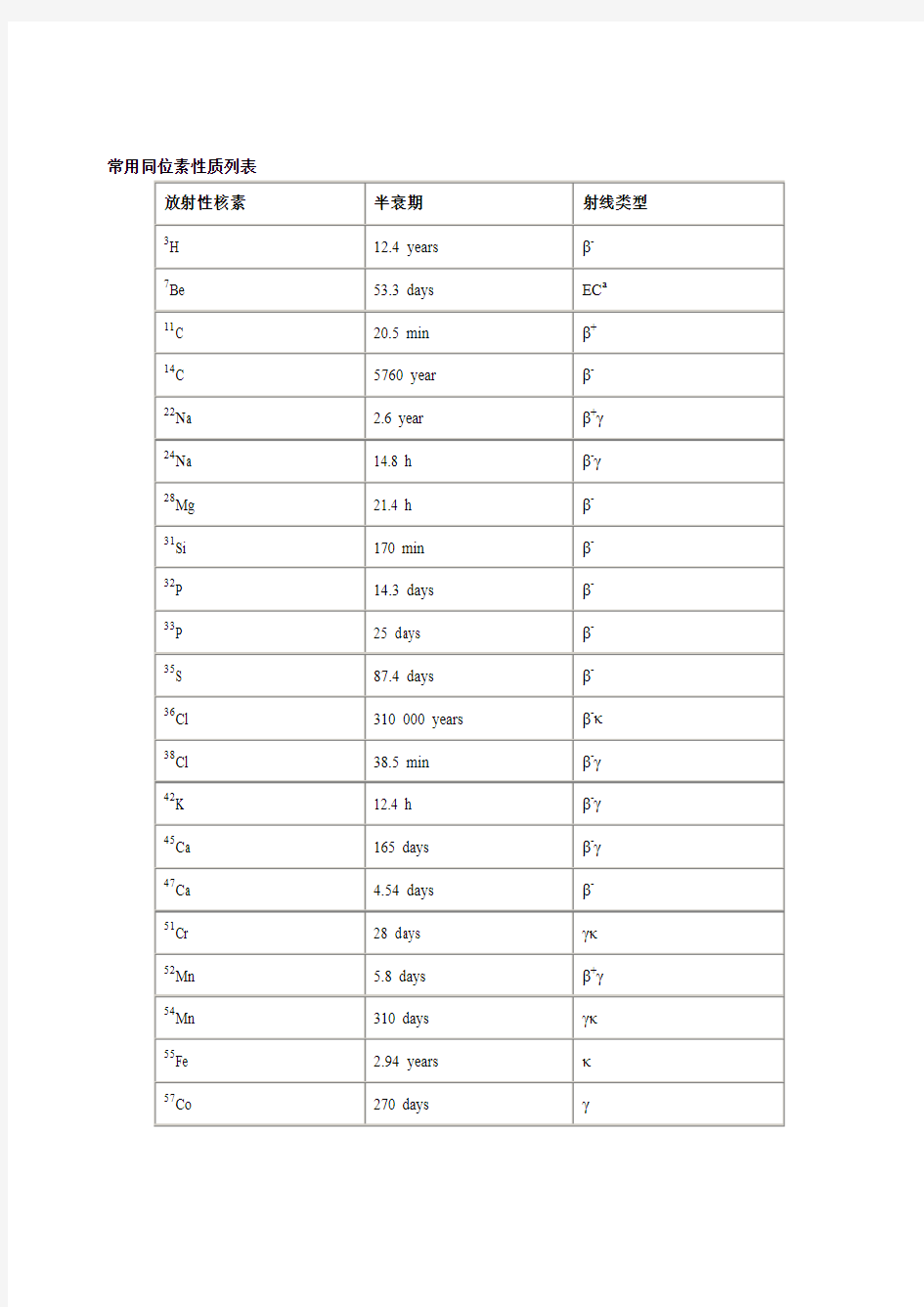
常用同位素性质列表
放射性核素半衰期射线类型
3H 12.4 years β-
7Be 53.3 days EC a
11C 20.5 min β+
14C 5760 year β-
22Na 2.6 year β+γ
24Na 14.8 h β-γ
28Mg 21.4 h β-
31Si 170 min β-
32P 14.3 days β-
33P 25 days β-
35S 87.4 days β-
36Cl 310 000 years β-κ
38Cl 38.5 min β-γ
42K 12.4 h β-γ
45Ca 165 days β-γ
47Ca 4.54 days β-
51Cr 28 days γκ
52Mn 5.8 days β+γ
54Mn 310 days γκ
55Fe 2.94 years κ
57Co 270 days γ
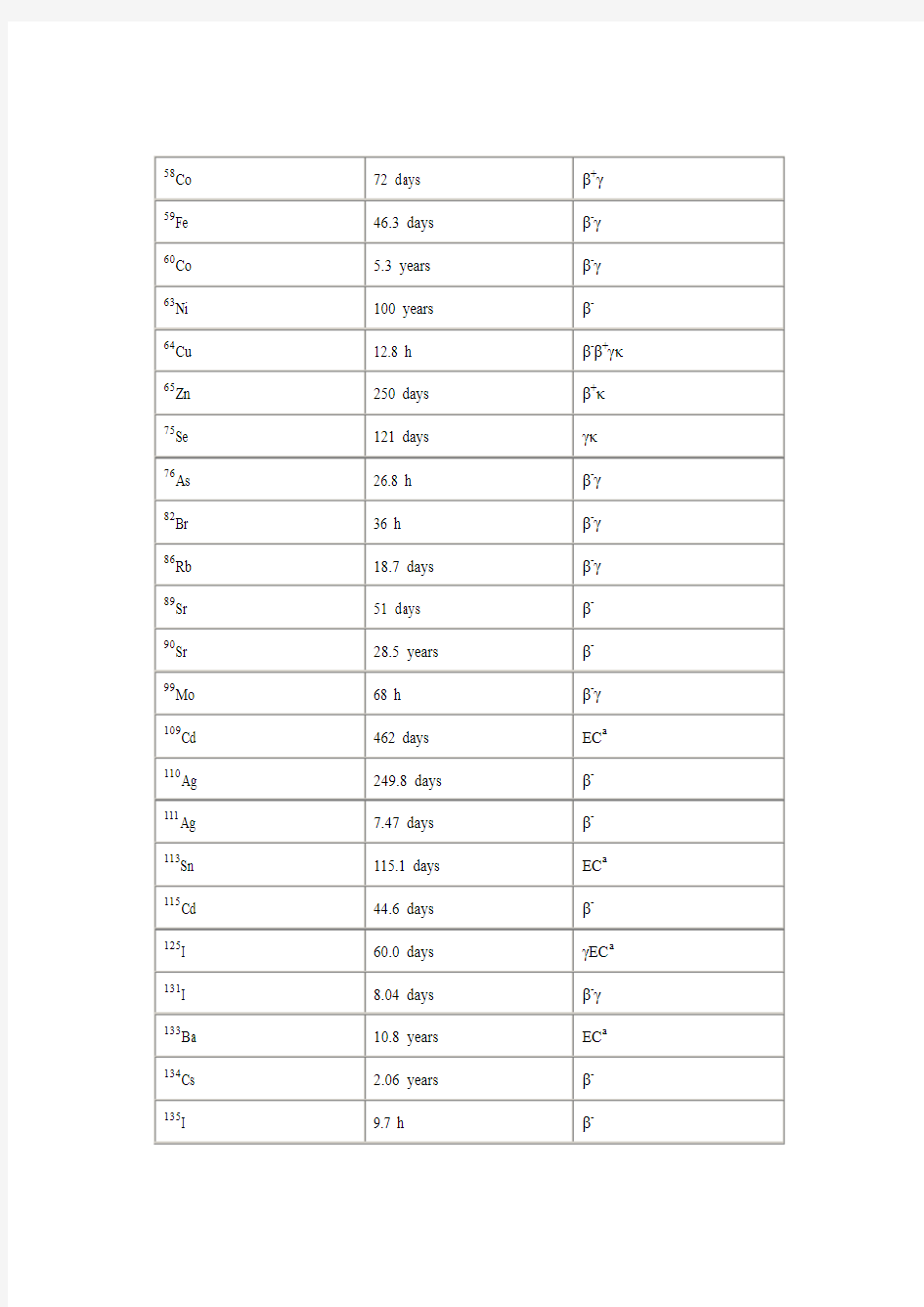
58Co 72 days β+γ59Fe 46.3 days β-γ60Co 5.3 years β-γ63Ni 100 years β-
64Cu 12.8 h β-β+γκ65Zn 250 days β+κ75Se 121 days γκ
76As 26.8 h β-γ82Br 36 h β-γ86Rb 18.7 days β-γ89Sr 51 days β-
90Sr 28.5 years β-
99Mo 68 h β-γ109Cd 462 days EC a 110Ag 249.8 days β-111Ag 7.47 days β-113Sn 115.1 days EC a 115Cd 44.6 days β-125I 60.0 days γEC a 131I 8.04 days β-γ133Ba 10.8 years EC a 134Cs 2.06 years β-135I 9.7 h β-
137Cs 30.17 years β-
185W 75.1 days β-
197Hg 64.4 h EC a
198Au 2.696 days β-
199Au 3.13 days β-
203Hg 46.6 days β-
同位素检测方法
同位素介质检测方法
3H 琼脂糖凝胶闪烁计数
聚丙酰胺凝胶
硝酸纤维素膜,滤纸
14C/35S 琼脂糖凝胶fluorography(for max. sensitivity)or
聚丙酰胺凝胶放射自显影(可获较高的分辩率)
硝酸纤维素膜,滤纸放射自显影
32P/125I 琼脂糖凝胶放射自显影(用增感屏)
聚丙酰胺凝胶(for max. sensitivity) or direct
硝酸纤维素膜,滤纸放射自显影(可获较高的分辩率)同位素在试验中的应用
应用同位素检测方法
DNA/RNA打点杂交32P 放射自显影(用增感屏)
DNA序列测定32P 放射自显影
35S 放射自显影
原位杂交32P 放射自显影
35S 放射自显影
3H 放射自显影
体外蛋白质合成14C/35S 闪烁计数
3H 闪烁计数
噬斑和菌落的筛选32P 放射自显影(用增感屏)
35S 放射自显影
32P 放射自显影(用增感屏)Southern and Northern 杂
交
35S 放射自显影(用增感屏)Western blots 3H 闪烁计数
14C/35S 放射自显影
125I 放射自显影(用增感屏)
常用同位素理化性质,检测方法
单位换算
Curies 和 d . p . m 的换算.
1 Curie (Ci) =2.22×101
2 d . p . m .
1 milliCurie (mCi) =2.22×109 d . p . m .
1 microCurie (m Ci) =2.22×106 d . p . m .
1 nanoCurie (nCi) = 2.22×103 d . p . m .
1 picoCurie (pCi) =2.2
2 d . p . m .
Curies 和Becquerels的换算
1 Ci = 3.7×1010 Bq =37GBq (gigaBq)
1 mCi = 3.7×10 7 Bq =37MBq (megaBq)
1 m Ci = 3.7×10 4 Bq =37kBq (kiloBq)
1 GBq =2.7×10 -4 Ci =27.027mCi(milliCi)
1 MBq =2.7×10 -7 Ci =27.027m Ci(nanoCi)
1 kBq =2.7×10-10 Ci =27.027nCi (nanoCi)
初中数学基本公式和基本定理性质大汇总
初中数学基本公式和基本定理性质大汇总 一、基本公式 1、三角形面积公式:S △=12ah(a 为三角形的底,h 为高)。 2、梯形的面积公式:S 梯=12(a+b )h(a 、b 分别为梯形的上、下底,h 为高)。 3、正方形的面积公式:S 正=a 2(a 为正方形的边长);长方形的面积公式:S 长=ab (a 、b 分别为长方形的长、宽)。 4、正方体的体积公式:V 正=a 3;表面积公式:S 正=6a 2(a 为正方体的边长)。 5、长方体的体积公式:V 长=abh ;表面积公式:S 长=2ab+2ah+2bh (a 、b 、h 分别为长方体的长、宽、高)。 6、弧长公式:l=n 兀R /180(n 为圆心角的度数,R 为弧的半径); 7、扇形面积公式:S 扇形=n 兀R 2/360=lR /2;(n 为圆心角的度数,R 为扇形半径,l 为弧长)。 8、圆的面积公式:S =兀R 2;周长公式:C=兀d=2兀R (d 为直径,R 为半径)。 9、圆柱的体积公式:V 圆柱=S 底h=兀R 2?;表面积公式:S 表=S 侧+S 底=2兀Rh+2兀R 2(R 为底面圆的半径,h 为高)。 10、圆锥的体积公式:V 圆锥=13S 底h=13兀R 2?;表面积公式:S 表=S 侧+S 底=兀Rl+兀R 2(l 为圆锥的母线长,R 为底面圆的半径)。 11、球的体积公式:V 球==43兀R 3(R 为球半径)。 12、三角函数公式:正弦sinA=∠A 的对边斜边 ;余弦cosA=∠A 的邻边斜边;正切tanA=∠A 的对边∠A 的邻边。 13、平方差公式:22()()a b a b a b +-=-。 14、完全平方公式:222()2a b a b ab +=++;222 ()2a b a b ab -=+-。 15、一元二次方程的求根公式:若x 是一元二次方程(a ≠0)20ax bx c ++=的根,则 x =240b ac -≥); 根的判别式:240b ac -><=>方程有两个不等的实数根;240b ac -=<=>方程有两个相等 的实数根;240b ac -<<=>方程没有实数根;根与系数的关系:1x +2x =b a -;1x 2x =c a
常用溶剂的性质
常用溶剂的性质 常用溶剂的性质 常用溶剂的极性顺序:水(最大) >甲酰胺>乙腈>甲醇>乙醇>丙醇>丙酮>二氧六环>四氢呋喃>甲乙酮>正丁醇>乙酸乙酯>乙醚>异丙醚>二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>环己烷>己烷>煤油(最小)。 甲酰胺 分子式HCONH 2 ,透明油状液体,略有氨臭,具有吸湿性,可燃。能与水和乙醇混溶,微溶于苯、三氯甲烷和乙醚。相对密度1.133(20/4℃)。沸点210℃。熔点2.55℃。闪点175℃。折射率nD(25℃)1.4468。燃点>500℃。粘度(20℃)2.926mPa?s。 毒性本品低毒。对皮肤和粘膜有暂时刺激性。小鼠经口LD50大于1000mg/kg。 乙腈;甲基氰 结构式CH 3 CN。分子量41.05。无色透明液体,有醚的气味。相对密度(20℃/4℃)1. 7822,凝固点-43.8℃,沸点81.6℃、闪点5.6℃。折射率1.3441.粘度(20℃)0.35mPa?s,表面张力(20℃)19.10×10-3N/m,临界温度274.7℃,临界压力4.83MPa。能与水、甲醇、醋酸甲酯、醋酸乙酯、丙酮、乙醚、氯仿、四氯化碳、氯乙烯以及各种不饱和烃相混溶。与水形成共沸混合物。易燃,爆炸极限3.0%-16%(vol)。有毒人LD503800mg/kg。空气中最高容许浓度3mg/m3。贮存阴凉、通风、干燥的库房内,远离火种、热源,防止日光直射。 甲醇 结构式为CH 3 OH,分子量32.04。无色澄清易挥发液体,相对密度(20℃ /4℃)0.7914,凝固点-97.49℃,沸点64.5℃.闪点(开口)16℃,燃点470℃,折射率1.3285,表面张力22.55×10-3N/m,蒸气压(20 ℃)12.265kPa,蒸气相对密度1.11,粘度(20℃)0.5945mP a?s,溶解度参数δ=14.8,能与水、乙醇、乙醚、丙酮、苯、氯仿等有机溶剂混溶,甲醇对金属特别是黄铜有轻微的腐蚀性。易燃,燃烧时有无光的谈蓝色火焰。蒸气能与空气形成爆炸混合物.爆炸极限6.0%-36.5%(vol)。纯品略带乙醇味,粗品刺鼻难闻。有毒。饮用7-8g可导致失明,饮用30-100g就会死亡。空气中甲酵蒸气最高容许浓度5mg/m3。 乙醇 结构式为C 2H 5 OH,分子量46.07。无色透明液体,有酒的醉香气味,也有刺激性 的辛辣昧。工业乙醇含量为95%,相对密度(20℃/4℃)0.793。凝固点-114℃,沸点78.32℃,闪点(开口)16℃,燃点390-430 ℃.折射率1.3614,粘度(20℃)1.41mPa?s,表面张力(20℃)22.27×10-3N/m,比热容 (20 ℃)2.42kJ/(kgK),蒸气压(20 ℃)5.732kPa,溶解度参数δ=12.7。溶于苯、甲苯。与水、甲醇、乙醚、醋酸、氯仿任意比例混溶。能溶解许多有机化合物和若干无机化合物。与铬酸、次氯酸钙、过氧化氢、硝酸、硝酸铂、过氮酸盐及氧化剂反应剧烈,爆炸极限4.3%-19.0%(vol)。具有吸湿性,与水形成共沸混合物。微毒,有麻醉性,饮入乙醇中毒剂量75-80g。致死剂量为250-500g。空气中最高容许浓度1880mg/m3。
初中数学公式大全 常用结论(史上最全 免费最新版)
初中数学公式大全 1 过两点有且只有一条直线 2 两点之间线段最短 3 同角或等角的补角相等 4 同角或等角的余角相等 5 过一点有且只有一条直线和已知直线垂直 6 直线外一点与直线上各点连接的所有线段中,垂线段最短 7 平行公理经过直线外一点,有且只有一条直线与这条直线平行 8 如果两条直线都和第三条直线平行,这两条直线也互相平行 9 同位角相等,两直线平行 10 内错角相等,两直线平行 11 同旁内角互补,两直线平行 12两直线平行,同位角相等 13 两直线平行,内错角相等 14 两直线平行,同旁内角互补 15 定理三角形两边的和大于第三边 16 推论三角形两边的差小于第三边 17 三角形内角和定理三角形三个内角的和等于180° 18 推论1 直角三角形的两个锐角互余 19 推论2 三角形的一个外角等于和它不相邻的两个内角的和 20 推论3 三角形的一个外角大于任何一个和它不相邻的内角 21 全等三角形的对应边、对应角相等 22边角边公理(SAS) 有两边和它们的夹角对应相等的两个三角形全等 23 角边角公理( ASA)有两角和它们的夹边对应相等的两个三角形全等 24 推论(AAS) 有两角和其中一角的对边对应相等的两个三角形全等 25 边边边公理(SSS) 有三边对应相等的两个三角形全等 26 斜边、直角边公理(HL) 有斜边和一条直角边对应相等的两个直角三角形全等 27 定理1 在角的平分线上的点到这个角的两边的距离相等 28 定理2 到一个角的两边的距离相同的点,在这个角的平分线上 29 角的平分线是到角的两边距离相等的所有点的集合 30 等腰三角形的性质定理等腰三角形的两个底角相等(即等边对等角) 31 推论1 等腰三角形顶角的平分线平分底边并且垂直于底边 32 等腰三角形的顶角平分线、底边上的中线和底边上的高互相重合 33 推论3 等边三角形的各角都相等,并且每一个角都等于60° 34 等腰三角形的判定定理如果一个三角形有两个角相等,那么这两个角所对的边也相等(等角对等边) 35 推论1 三个角都相等的三角形是等边三角形 36 推论2 有一个角等于60°的等腰三角形是等边三角形 37 在直角三角形中,如果一个锐角等于30°那么它所对的直角边等于斜边的一半 38 直角三角形斜边上的中线等于斜边上的一半 39 定理线段垂直平分线上的点和这条线段两个端点的距离相等 40 逆定理和一条线段两个端点距离相等的点,在这条线段的垂直平分线上 41 线段的垂直平分线可看作和线段两端点距离相等的所有点的集合 42 定理1 关于某条直线对称的两个图形是全等形 43 定理2 如果两个图形关于某直线对称,那么对称轴是对应点连线的垂直平分线 44定理3 两个图形关于某直线对称,如果它们的对应线段或延长线相交,那么交点在对称轴上 45逆定理如果两个图形的对应点连线被同一条直线垂直平分,那么这两个图形关于这条直线对称 46勾股定理直角三角形两直角边a、b的平方和、等于斜边c的平方,即a^2+b^2=c^2 47勾股定理的逆定理如果三角形的三边长a、b、c有关系a^2+b^2=c^2 ,那么这个三角形是直角三角形
常见有机溶剂极性表
有机溶剂是能溶解一些不溶于水的物质的一类有机化合物,其特点是在常温常压下呈液态,具有较大的挥发性,在溶解过程中,溶质与溶剂的性质均无改变。 有机溶剂的种类较多,按其化学结构可分为10大类:①芳香烃类:苯、甲苯、二甲苯等; ②脂肪烃类:戊烷、己烷、辛烷等;③脂环烃类:环己烷、环己酮、甲苯环己酮等;④卤化烃类:氯苯、二氯苯、二氯甲烷等;⑤醇类:甲醇、乙醇、异丙醇等;⑥醚类:乙醚、环氧丙烷等;⑦酯类:醋酸甲酯、醋酸乙酯、醋酸丙酯等;⑧酮类:丙酮、甲基丁酮、甲基异丁酮等;⑨二醇衍生物:乙二醇单甲醚、乙二醇单乙醚、乙二醇单丁醚等;⑩其他:乙腈、吡啶、苯酚等。 有机溶剂具有脂溶性,因此除经呼吸道和消化道进入机体内外,尚可经完整的皮肤迅速吸收,有机溶剂吸收入人体后,将作用于富含脂类物质的神经、血液系统,以及肝肾等实质脏器,同时对皮肤和粘膜也有一定的刺激性。不同有机溶剂其作用的主要靶器官和作用的强弱也不同,这决定于每一种有机溶剂的化学结构、溶解度、接触浓度和时间,以及机体的敏感性。 常用溶剂的极性顺序: 水(极性最大) > 甲酰胺 > 乙腈 > 甲醇 > 乙醇 > 丙醇 > 丙酮 > 二氧六环 > 四氢呋喃 > 甲乙酮 > 正丁醇 > 醋酸乙酯 > 乙醚 > 异丙醚 > 二氯甲烷 > 氯仿 > 溴乙烷 > 苯 > 氯丙烷 > 甲苯 > 四氯化碳 > 二硫化碳 > 环己烷 > 己烷 > 庚 烷 > 煤油(极性最小) 有机溶剂的极性根据官能团和对称性可初步判断,具体的需参照极性参数,如下
表示有机溶剂的极性,关系到其物理化学性质、如介电常数、偶极矩或折射率。这种表示方法把所有的溶剂看作是连续作用的介质,而不是看作由各个分子组成的非连续统一体,并且未考虑到溶剂和溶质之间的特殊的相互作用。
常见有机溶剂的性质大全
溶剂的定义 溶剂(solvent)这个词广义指在均匀的混合物中含有的一种过量存在的组分。狭义地说,在化学组成上不发生任何变化并能溶解其他物质(一般指固体)的液体,或者与固体发生化学反应并将固体溶解的液体。溶解生成的均匀混合物体系称为溶液。在溶液中过量的成分叫溶剂;量少的成分叫溶质。 溶剂也称为溶媒,即含有溶解溶质的媒质之意。但是在工业上所说的溶剂一般是指能够溶解油脂、蜡、树脂(这一类物质多数在水中不溶解)而形成均匀溶液的单一化合物或者两种以上组成的混合物。这类除水之外的溶剂称为非水溶剂或有机溶剂,水、液氨、液态金属、无机气体等则称为无机溶剂。 溶解现象 溶解本来表示固体或气体物质与液体物质相混合,同时以分子状态均匀分散的一种过程。事实上在多数情况下是描述液体状态的一些物质之间的混合,金与铜、铜与镍等许多金属以原子状态相混合的所谓合金也应看成是一种溶解现象。所以严格地说,只要是两种以上的物质相混合组成一个相的过程就可以称为溶解,生成的相称为溶液。一般在一个相中应呈均匀状态,其构成成分的物质可以以分子状态或原子状态相互混合。 溶解过程比较复杂,有的物质在溶剂中可以以任何比例进行溶解,有的部分溶解,有的则不溶。这些现象是怎样发生的,其影响的因素很多,一般认为与溶解过程有关的因素大致有以下几个方面: ⑴相同分子或原子间的引力与不同分子或原子间的引力的相互关系(主要是范德华引力); ⑵分子的极性引起的分子缔合程度; ⑶分子复合物的生成; ⑷溶剂化作用; ⑸溶剂、溶质的相对分子质量; ⑹溶解活性基团的种类和数目。 化学组成类似的物质相互容易溶解,极性溶剂容易溶解极性物质,非极性溶剂容易溶解非极性物质。例如,水、甲醇和乙醇彼此之间可以互溶;苯、甲苯和乙醚之间也容易互溶,但水与苯,甲醇与苯则不能自由混溶。而且在水或甲醇中易溶的物质难溶于苯或乙醚;反之在苯或乙醚中易溶的却难溶于水或甲醇。这些现象可以用分子的极性或者分子缔合程度大小进行判断。纤维素衍生物易溶于酮、有机酸、酯、醚类等溶剂,这是由于分子中的活性基团与这类溶剂中氧原子相互作用的结果。有的纤维素衍生物在纯溶剂中不溶,但可溶于混合溶剂。例如硝化纤维素能溶于醇、醚混合溶剂;三乙酸纤维素溶于二氯乙烷、甲醇混合溶剂。这可能是由于在溶剂之间,溶质与溶剂之间生成分子复合物,或者发生溶剂化作用的结果。总之,溶解过程能够发生,其物质分子间的内聚力应低于物质分子与溶剂分子之间的吸引力才有可能实现。 溶液浓度的表示方法 溶质在溶剂中溶解的多少,彼此间存在着相对量的关系,通常用以下几种方法表示:⑴质量分数 即混合物中某一物质的质量与混合物的质量之比,符号为ω。 物质B的质量分数(ωB)=物质B的质量(mB)/溶液的质量(m) 例如:氯化钠的质量分数ω(NaCl)=15%,即表示100g该溶液中含有NaCl 15g。 ⑵体积分数 通常用于表示溶质为液体的溶液浓度(略) ⑶物质的量的浓度
最新常用有机溶剂的物化性质
常用有机溶剂的物化 性质
推荐答案 2006-3-4 00:20 【中文名称】甲苯;甲基苯;苯基甲烷 【英文名称】toluene;toluol;methylbenzene 【结构或分子式】 【相对分子量或原子量】92.14 【密度】0.866 【熔点(℃)】-95 【沸点(℃)】110.8 【闪点(℃)】4.4(闭式) 【蒸气压(Pa)】907(0℃);2920(20℃);74194(100℃)【折射率】1.4967 【性状】 无色易挥发的液体,有芳香气味。 【溶解情况】
不溶于水,溶于乙醇、乙醚和丙酮。 【用途】 用于制造糖精、染料、药物和炸药等,并用作溶剂。 【制备或来源】 由分馏煤焦油的轻油部分或由催化重整轻汽油馏分而制得。 【其他】 化学性质与苯相像。蒸气与空气形成爆炸性混合物,爆炸极限为1.2~7.0%(体积)。 二甲苯分子量106.16。无色透明液体,芳香气味。有三种异构体:邻二甲苯(o-Xylene),相对密度(25℃/4℃)0.87599,凝固点-25.3℃,沸点144.4℃,折射率1.50295,闪点(闭口)17.4℃,燃点500℃,粘度(25℃)0.75mPa·s;间二甲苯(m-xy1ene),相对密度(25℃/4℃)0.8599,凝固点-47.87℃,沸点139.1℃,闪点(开口)25℃,燃点527.8℃。折射率1. 4946;对二甲苯(p=xy1ene),相对密度(25℃/4℃)0.8567,凝固点13.26℃,沸点138.35℃,闪点(闭口)25℃.折射率1.49325。 一般的二甲苯是混合二甲苯.为邻二甲苯(10%一15%)、间二甲苯(45%-70%)、对二甲苯(15%-25%)及少量乙苯的混合物,相对密度(20 ℃/4℃)约为0.86,溶解度参数δ=8.8-9.0。溶于乙醇、乙醚,不溶于水。易燃,蒸气与空气形成爆炸性混合物,爆炸极限1. 09%-6.6%(vol)。有毒,毒性比苯和甲苯为小,空气中最高容许浓度为100mg/m3。 二甲苯可用作溶剂和稀释剂。贮存于阴凉、通风的库房内,远离火种、热源。 二甲苯根据来源和制法分为石油二甲苯和焦化二甲苯。石油二甲苯是石油轻馏分经予加氢精制,催化重整和分离所得;焦化二甲苯是粗苯经过洗涤、分馏所得。
初中数学常用公式(中考用)
中考数学常用公式及性质 1.乘法与因式分解 ①(a+b)(a-b)=a2-b2;②(a±b)2=a2±2ab+b2;③(a+b)(a2-ab+b2)=a3+b3; ④(a-b)(a2+ab+b2)=a3-b3;a2+b2=(a+b)2-2ab;(a-b)2=(a+b)2-4ab。2.幂的运算性质 ①a m×a n=a m+n;②a m÷a n=a m-n;③(a m)n=a mn;④(ab)n=a n b n;⑤(a b )n= n n a b ; ⑥a-n=1 n a ,特别:()-n=()n;⑦a0=1(a≠0)。 3.二次根式 ①()2=a(a≥0);②=丨a丨;③=×;④=(a>0,b≥0)。 4.三角不等式 |a|-|b|≤|a±b|≤|a|+|b|(定理); 加强条件:||a|-|b||≤|a±b|≤|a|+|b|也成立,这个不等式也可称为向量的三角不等式(其中a,b分别为向量a和向量b) |a+b|≤|a|+|b|;|a-b|≤|a|+|b|;|a|≤b<=>-b≤a≤b ; |a-b|≥|a|-|b|;-|a|≤a≤|a|; 5.某些数列前n项之和 1+2+3+4+5+6+7+8+9+…+n=n(n+1)/2;1+3+5+7+9+11+13+15+…+(2n-1)=n2; 2+4+6+8+10+12+14+…+(2n)=n(n+1);12+22+32+42+52+62+72+82+…+n2=n(n+1)(2n+1)/6; 13+23+33+43+53+63+…n3=n2(n+1)2/4;1*2+2*3+3*4+4*5+5*6+6*7+…+n(n+1)=n(n+1)(n+2)/3;6.一元二次方程 对于方程:ax2+bx+c=0: ①求根公式是x 24 b b ac -±-△=b2-4ac叫做根的判别式。 当△>0时,方程有两个不相等的实数根; 当△=0时,方程有两个相等的实数根; 当△<0时,方程没有实数根.注意:当△≥0时,方程有实数根。 ②若方程有两个实数根x1和x2,则二次三项式ax2+bx+c可分解为a(x-x1)(x-x2)。
常用有机溶剂性质
常用有机溶剂性质
常用溶剂的沸点、溶解性和毒性 溶剂名称沸点 (101.3kPa) 溶解性毒性 液氨-33.35℃特殊溶解 性:能溶解 碱金属和 碱土金属剧毒性、腐蚀性 液态二氧化硫-10.08 溶解胺、 醚、醇苯 酚、有机 酸、芳香 烃、溴、二 硫化碳,多 数饱和烃 不溶 剧毒 甲胺-6.3 是多数有 机物和无 机物的优 良溶剂,液 态甲胺与 水、醚、苯、中等毒性,易燃
丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯 二甲胺7.4 是有机物 和无机物 的优良溶 剂,溶于 水、低级 醇、醚、低 极性溶剂强烈刺激性 石油醚40~80℃不溶于水, 与丙酮、乙 醚、乙酸乙 酯、苯、氯 仿及甲醇 以上高级 醇混溶与低级烷相似
乙醚34.6 微溶于水, 易溶与盐 酸.与醇、 醚、石油 醚、苯、氯 仿等多数 有机溶剂 混溶 麻醉性 戊烷36.1 与乙醇、乙 醚等多数 有机溶剂 混溶 低毒性 二氯甲烷39.75 与醇、醚、 氯仿、苯、 二硫化碳 等有机溶 剂混溶低毒,麻醉性强 二硫化碳46.23 微溶与水, 与多种有 机溶剂混 溶麻醉性,强刺激性 溶剂石油与乙醇、丙较其他石
脑酮、戊醇混溶油系溶剂 大 丙酮56.12 与水、醇、 醚、烃混溶低毒,类乙醇,但较大 1,1-二氯乙烷57.28 与醇、醚等 大多数有 机溶剂混 溶 低毒、局 部刺激性 氯仿61.15 与乙醇、乙 醚、石油 醚、卤代 烃、四氯化 碳、二硫化 碳等混溶中等毒性,强麻醉性 甲醇64.5 与水、乙 醚、醇、酯、 卤代烃、 苯、酮混溶中等毒性,麻醉性, 四氢呋喃66 优良溶剂, 与水混溶, 很好的溶吸入微毒,经口低毒
初中三年数学常用公式定理大全
初中数学定理、公式汇编 第一篇数与代数 第一节数与式 一、实数 1.实数的分类:整数(包括:正整数、0、负整数)和分数(包括:有限小数和无限环循小数)都是有理数.如:-3,,0.231,0.737373…,,等;无限不环循小数叫做无理数. 如:π,,0.1010010001…(两个1之间依次多1个0)等.有理数和无理数统称为实数. 2.数轴:规定了原点、正方向和单位长度的直线叫数轴。实数 和数轴上的点一一对应。 3.绝对值:在数轴上表示数a的点到原点的距离叫数a的绝对值, 记作∣a∣。正数的绝对值是它本身;负数的绝对值是它的相反数;0的绝对值是0。如:丨-_丨=;丨3.14-π丨=π- 3.1 4. 4.相反数:符号不同、绝对值相等的两个数,叫做互为相反数。 a的相反数是-a,0的相反数是0。 5.有效数字:一个近似数,从左边笫一个不是0的数字起,到最末 一个数字止,所有的数字,都叫做这个近似数的有效数字. 如:0.05972精确到0.001得0.060,结果有两个有效数字6,0. 6.科学记数法:把一个数写成a×10n的形式(其中1≤a<10,n是整 数),这种记数法叫做科学记数法. 如:407000=4.07× 105,0.000043=4.3×10-5. 7.大小比较:正数大于0,负数小于0,两个负数,绝对值大的 反而小。
8.数的乘方:求相同因数的积的运算叫乘方,乘方运算的结果 叫幂。 9.平方根:一般地,如果一个数x的平方等于a,即x2=a那么这 个数a就叫做x的平方根(也叫做二次方根式)。一个正数有两个平方根,它们互为相反数;0只有一个平方根,它是0本身; 负数没有平方根. 10.开平方:求一个数a的平方根的运算,叫做开平方. 11.算术平方根:一般地,如果一个正数x的平方等于a,即x2=a,那么这个正数x就叫做a的算术平方根,0的算术平方根是0.12.立方根:一般地,如果一个数x的立方等于a,即x3=a,那么这个数x就叫做a的立方根(也叫做三次方根),正数的立方根是正数;负数的立方根是负数;0的立方根是0. 13.开立方:求一个数a的立方根的运算叫做开立方. 14.平方根易错点:(1)平方根与算术平方根不分,如 64的平方根为士8,易丢掉-8,而求为64的算术平方根;(2)4的平方根是士2,误认为4平方根为士 2,知道4=2. 15.二次根式: (1)定义:形如a(a≥0)的式子叫做二次根式. 16.二次根式的化简: 17.最简二次根式应满足的条件:(1)被开方数的因式是整式或整数;(2)被开方数中不含有能开得尽的因数或因式. 18.同类二次根式:几个二次根式化成最简二次根式以后,如果被
常用有机溶剂性质
溶剂按化学组成分为有机溶剂和无机溶剂。 是一大类在生活和生产中广泛应用的有机化合物,分子量不大,常温下呈液态。有机溶剂包括多类物质,如链烷烃、烯烃、醇、醛、胺、酯、醚、酮、芳香烃、氢化烃、萜烯烃、卤代烃、杂环化物、含氮化合物及含硫化合物等等,多数对人体有一定毒性。 它存在于涂料、粘合剂、漆和清洁剂中。经常使用有机溶剂,如,苯乙烯、全氯乙烯、三氯乙烯、乙烯乙二醇醚和三乙醇胺。 有机溶剂是能溶解一些不溶于水的物质(如油脂、蜡、树脂、橡胶、染料等)的一类有机化合物,其特点是在常温常压下呈液态,具有较大的挥发性,在溶解过程中,溶质与溶剂的性质均无改变。 有机溶剂的种类有机溶剂的种类较多,按其化学结构可分为10大类:①芳香烃类:苯、甲苯、二甲苯等;②脂肪烃类:戊烷、己烷、辛烷等;③脂环烃类:环己烷、环己酮、甲苯环己酮等;④卤化烃类:氯苯、二氯苯、二氯甲烷等;⑤醇类:甲醇、乙醇、异丙醇等;⑥醚类:乙醚、环氧丙烷等;⑦酯类:醋酸甲酯、醋酸乙酯、醋酸丙酯等;⑧酮类:丙酮、甲基丁酮、甲基异丁酮等;⑨二醇衍生物:乙二醇单甲醚、乙二醇单乙醚、乙二醇单丁醚等;⑩其他:乙腈、吡啶、苯酚等。 毒性有机溶剂具有脂溶性,因此除经呼吸道和消化道进入机体内外,尚可经完整的皮肤迅速吸收,有机溶剂吸收入人体后,将作用于富含脂类物质的神经、血液系统,以及肝肾等实质脏器,同时对皮肤和粘膜也有一定的刺激性。不同有机溶剂其作用的主要靶器官和作用的强弱也不同,这决定于每一种有机溶剂的化学结构、溶解度、接触浓度和时间,以及机体的敏感性。 ①神经毒性。以脂肪烃(正己烷、戊烷、汽油)、芳香烃(苯、苯乙烯、丁基甲苯、乙烯基甲苯)、氯化烃(三氯乙烯、二氯甲烷),以及二硫化碳、磷酸三邻甲酚等脂溶性较强的溶剂为多见。有机溶剂对神经系统的损害大致有三种类型:第一种为中毒性神经衰弱和植物神经功能紊乱。病人可有头晕、头痛、失眠、多梦、嗜睡、无力、记忆力减退、食欲不振、消瘦,以及多汗、情绪不稳定,心跳加速或减慢、血压波动、皮肤温度下降或双侧肢体温度不对称等表现;第二种为中毒性末梢神经炎。大部分表现为感觉型,其次为混合型。可有肢端麻木、感觉减退、刺痛、四肢无力、肌肉萎缩等表现;第三种为中毒性脑病,比较少见,见于二硫化碳、苯、汽油等有机溶剂的严重急、慢性中毒。 ②血液毒性。以芳香烃,特别是苯最常见。苯达到一定剂量即可抑制骨髓造血功能,往往先有白细胞减少,以后血小板减少,最后红细胞减少,成为全血细胞减少。个别接触苯的敏感者,可发生白血病。 ③肝肾毒性。多见于氯代烃类有机溶剂,如氯仿、四氯化碳、三氯乙烯、四
小学到初中所有数学公式
小学至初中数学公式 三角形的面积=底×高÷2。公式S= a×h÷2 正方形的面积=边长×边长公式S= a×a 长方形的面积=长×宽公式S= a×b 平行四边形的面积=底×高公式S= a×h 梯形的面积=(上底+下底)×高÷2 公式S=(a+b)h÷2 内角和:三角形的内角和=180度。 长方体的体积=长×宽×高公式:V=abh 长方体(或正方体)的体积=底面积×高公式:V=abh 正方体的体积=棱长×棱长×棱长公式:V=aaa 圆的周长=直径×π 公式:L=πd=2πr 圆的面积=半径×半径×π 公式:S=πr2 圆柱的表(侧)面积:圆柱的表(侧)面积等于底面的周长乘高。公式:S=ch=πdh=2πrh 圆柱的表面积:圆柱的表面积等于底面的周长乘高再加上两头的圆的面积。公式:S=ch+2s=ch+2πr2 圆柱的体积:圆柱的体积等于底面积乘高。公式:V=Sh 圆锥的体积=1/3底面×积高。公式:V=1/3Sh 分数的加、减法则:同分母的分数相加减,只把分子相加减,分母不变。异分母的分数相加减,先通分,然后再加减。 分数的乘法则:用分子的积做分子,用分母的积做分母。 分数的除法则:除以一个数等于乘以这个数的倒数。 读懂理解会应用以下定义定理性质公式 一、算术方面 1、加法交换律:两数相加交换加数的位置,和不变。 2、加法结合律:三个数相加,先把前两个数相加,或先把后两个数相加,再同第三个数相加,和不变。 3、乘法交换律:两数相乘,交换因数的位置,积不变。 4、乘法结合律:三个数相乘,先把前两个数相乘,或先把后两个数相乘,再和第三个数相乘,它们的积不变。 5、乘法分配律:两个数的和同一个数相乘,可以把两个加数分别同这个数相乘,再把两个积相加,结果不变。 如:(2+4)×5=2×5+4×5 6、除法的性质:在除法里,被除数和除数同时扩大(或缩小)相同的倍数,商不变。O除以任何不是O的数都得O。 简便乘法:被乘数、乘数末尾有O的乘法,可以先把O前面的相乘,零不参加运算,有几个零都落下,添在积的末尾。 7、么叫等式?等号左边的数值与等号右边的数值相等的式子 叫做等式。 等式的基本性质:等式两边同时乘以(或除以)一个相同的数, 等式仍然成立。 8、什么叫方程式?答:含有未知数的等式叫方程式。 9、什么叫一元一次方程式?答:含有一个未知数,并且未知数的次数是一次的等式叫做一元一次方程式。 学会一元一次方程式的例法及计算。即例出代有χ的算式并计算。 10、分数:把单位“1”平均分成若干份,表示这样的一份或几分的数,叫做分数。
常用有机溶剂
一、乙醇(ethyl alcohol,ethanol) 1.理化性质: (1)分子式C2H6O (2)相对分子质量46.07 (3)结构式CH3CH2OH (4)外观与性状:无色液体,有酒香。 (5)熔点(℃):-114.1 (6)沸点(℃):78.3 (7)相对密度(水=1):0.79 (8)相对密度(空气=1):1.59 (9)溶解性:与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂。(10)禁忌物:强氧化剂、酸类、酸酐、碱金属、胺类。 危险类别: (1)燃烧性:易燃 (2)闪点(℃):12 (3)引燃温度(℃):363 (4)爆炸下限(%):3.3 (5)爆炸上限(%):19.0 二、甲醇(methyl alcohol,Methanol) 1. 理化性质: (1)分子式CH4O (2)相对分子质量32 (3)结构式CH3OH (4)外观与性状:无色澄清液体,有刺激性气味。 (5)熔点(℃):-97.8 (6)沸点(℃):64.8 (7)相对密度(水=1):0.79 (8)相对密度(空气=1):1.11 (9)溶解性:与水混溶,可混溶于醇、醚等多数有机溶剂。 (10)禁忌物:强氧化剂、酸类、酸酐、碱金属。 危险类别: (1)燃烧性:易燃 (2)闪点(℃):11 (3)引燃温度(℃):385 (4)爆炸下限(%):5.5 (5)爆炸上限(%):44.0
乙酸乙酯,醋酸乙酯(ethyl acetate,acetic ester) 1.理化性质: (1)分子式:C4H8O2 (2)相对分子质量88.10 (3)结构式 CH3-C-OCH2CH3 (4)外观与性状:无色澄清液体,有芳香气味,易挥发。 (5)熔点(℃):-83.6 (6)沸点(℃):77.2 (7)相对密度(水=1):0.90 (8)相对密度(空气=1):3.04 (9)溶解性:微溶于水,可混溶于醇、酮、醚、氯仿等多数有机溶剂。(10)禁忌物:强氧化剂、酸类、碱类。 危险类别: (1)燃烧性:易燃 (2)闪点(℃):-4 (3)引燃温度(℃):426 (4)爆炸下限(%):2.0 (5)爆炸上限(%):11.5 二氯甲烷(dichloromethane) 1.理化性质: (1)分子式:CH2Cl2 (2)相对分子质量84.94 (3)结构式H2CCl2 (4)外观与性状:无色透明液体,有芳香气味。 (5)熔点(℃):-96.7 (6)沸点(℃):39.8 (7)相对密度(水=1):1.33 (8)相对密度(空气=1):2.93 (9)溶解性:微溶于水,溶于乙醇、乙醚。 (10)禁忌物:碱金属、铝。 危险类别: (1)燃烧性:可燃 (2)闪点(℃): (3)引燃温度(℃):615 (4)爆炸下限(%):12 (5)爆炸上限(%):19
常用有机溶剂
常用有机溶剂 一、乙醇(ethyl alcohol,ethanol) 1.理化性质: (1)分子式C2H6O (2)相对分子质量46.07 (3)结构式CH3CH2OH (4)外观与性状:无色液体,有酒香。 (5)熔点(℃):-114.1 (6)沸点(℃):78.3 (7)相对密度(水=1):0.79 (8)相对密度(空气=1):1.59 (9)溶解性:与水混溶,可混溶于醚、氯仿、甘油等多数有机溶剂。(10)禁忌物:强氧化剂、酸类、酸酐、碱金属、胺类。 危险类别: (1)燃烧性:易燃 (2)闪点(℃):12 (3)引燃温度(℃):363 (4)爆炸下限(%):3.3 (5)爆炸上限(%):19.0 二、甲醇(methyl alcohol,Methanol) 1. 理化性质: (1)分子式CH4O (2)相对分子质量32 (3)结构式CH3OH (4)外观与性状:无色澄清液体,有刺激性气味。 (5)熔点(℃):-97.8 (6)沸点(℃):64.8 (7)相对密度(水=1):0.79 (8)相对密度(空气=1):1.11 (9)溶解性:与水混溶,可混溶于醇、醚等多数有机溶剂。(10)禁忌物:强氧化剂、酸类、酸酐、碱金属。 危险类别: (1)燃烧性:易燃 (2)闪点(℃):11 (3)引燃温度(℃):385 (4)爆炸下限(%):5.5 (5)爆炸上限(%):44.0 乙酸乙酯,醋酸乙酯(ethyl acetate,acetic ester) 1.理化性质: (1)分子式:C4H8O2 (2)相对分子质量88.10 (3)结构式 CH3-C-OCH2CH3
(4)外观与性状:无色澄清液体,有芳香气味,易挥发。 (5)熔点(℃):-83.6 (6)沸点(℃):77.2 (7)相对密度(水=1):0.90 (8)相对密度(空气=1):3.04 (9)溶解性:微溶于水,可混溶于醇、酮、醚、氯仿等多数有机溶剂。 (10)禁忌物:强氧化剂、酸类、碱类。 危险类别: (1)燃烧性:易燃 (2)闪点(℃):-4 (3)引燃温度(℃):426 (4)爆炸下限(%):2.0 (5)爆炸上限(%):11.5 二氯甲烷(dichloromethane) 1.理化性质: (1)分子式:CH2Cl2 (2)相对分子质量84.94 (3)结构式H2CCl2 (4)外观与性状:无色透明液体,有芳香气味。 (5)熔点(℃):-96.7 (6)沸点(℃):39.8 (7)相对密度(水=1):1.33 (8)相对密度(空气=1):2.93 (9)溶解性:微溶于水,溶于乙醇、乙醚。 (10)禁忌物:碱金属、铝。 危险类别: (1)燃烧性:可燃 (2)闪点(℃): (3)引燃温度(℃):615 (4)爆炸下限(%):12 (5)爆炸上限(%):19 丙酮,阿西通(acetone) 1.理化性质: (1)分子式:C3H6O (2)相对分子质量58.08 (3)结构式H3COCH3 (4)外观与性状:无色透明易流动液体,有芳香气味,极易挥发。 (5)熔点(℃):-94.6 (6)沸点(℃):56.5 (7)相对密度(水=1):0.80 (8)相对密度(空气=1):2.00 (9)溶解性:与水混溶,可混溶于乙醇、乙醚、氯仿、油类、烃类等多数有机溶剂。(10)禁忌物:碱、强氧化剂、强还原剂。 危险类别:
(完整版)初中数学常用公式和定理大全
初中数学常用公式定理 1、整数(包括:正整数、0、负整数)和分数(包括:有限小数和无限环循小数)都是有理数.如:-3,,0.231,0.737373…,,.无限不环循小数叫做无理数.如:π,-,0.1010010001…(两个1之间依次多1个0).有理数和无理数统称为实数. 2、绝对值:a≥0丨a丨=a;a≤0丨a丨=-a.如:丨-丨=;丨3.14-π丨=π-3.14. 3、一个近似数,从左边笫一个不是0的数字起,到最末一个数字止,所有的数字,都叫做这个近似数的有效数字.如:0.05972精确到0.001得0.060,结果有两个有效数字6,0. 4、把一个数写成±a×10n的形式(其中1≤a<10,n是整数),这种记数法叫做科学记数法.如:-40700=-4.07×105,0.000043=4.3×10-5. 5、乘法公式(反过来就是因式分解的公式):①(a+b)(a-b)=a2-b2.②(a±b)2=a2±2ab+b2.③(a+ b)(a2-ab+b2)=a3+b3.④(a-b)(a2+ab+b2)=a3-b3;a2+b2=(a+b)2-2ab,(a-b)2=(a+b)2-4ab. 6、幂的运算性质:①a m×a n=a m+n.②a m÷a n=a m-n.③(a m)n=a mn.④(ab)n=a n b n.⑤()n=n. ⑥a-n=1 n a ,特别:()-n=()n.⑦a0=1(a≠0).如:a3×a2=a5,a6÷a2=a4,(a3)2=a6,(3a3)3=27a9, (-3)-1=-,5-2==,()-2=()2=,(-3.14)o=1,(-)0=1. 7、二次根式:①()2=a(a≥0),②=丨a丨,③=×,④=(a>0,b≥0).如: ①(3)2=45.②=6.③a<0时,=-a.④的平方根=4的平方根=±2.(平方根、立方根、算术平方根的概念) 8、一元二次方程:对于方程:ax2+bx+c=0: ①求根公式是x= 24 b b ac -±- ,其中△=b2-4ac叫做根的判别式. 当△>0时,方程有两个不相等的实数根; 当△=0时,方程有两个相等的实数根; 当△<0时,方程没有实数根.注意:当△≥0时,方程有实数根. ②若方程有两个实数根x1和x2,并且二次三项式ax2+bx+c可分解为a(x-x1)(x-x2). ③以a和b为根的一元二次方程是x2-(a+b)x+ab=0. 9、一次函数y=kx+b(k≠0)的图象是一条直线(b是直线与y轴的交点的纵坐标即一次函数在y轴上的截距).当k>0时,y随x的增大而增大(直线从左向右上升);当k<0时,y随x的增大而减小(直线从左向右下降).特别:当b=0时,y=kx(k≠0)又叫做正比例函数(y与x成正比例),图象必过原点. 10、反比例函数y=(k≠0)的图象叫做双曲线.当k>0时,双曲线在一、三象限(在每一象限内,从左向右降);当k<0时,双曲线在二、四象限(在每一象限内,从左向右上升).因此,它的增减性与一次函数相反. 11、统计初步:(1)概念:①所要考察的对象的全体叫做总体,其中每一个考察对象叫做个体.从总体
溶剂性质
石油醚PE 别称石油英 CAS登录号101316-46-5, 8032-32-4 熔点 <-73 水溶性不溶 外观无色透明液体,有煤油气味。 英文名 Petroleum ether 化学式 C5H12 C6H14 C7H16 沸点 30-80 密度 0.64~0.66 极性 0.01.属于弱极性有机溶剂,常与其他强极性溶剂(如:乙酸乙酯)混合作为薄层色谱分析的展开剂 乙酸乙酯Ea 别称醋酸乙酯、甜菜糖蜜滓 英文名ethyl acetate CAS登录号141-78-6 分子量88.11 沸点77 °C(350.25 K) 密度0.902 g/mL 化学式C4H8O2 熔点-84 °C(189.55 K) 水溶性8.3 g/100 mL(20 °C) 二氯甲烷DCM 英文名Dichloromethane (Methylene chloride) 化学式CH2Cl2 CAS登录号75-09-2 分子量84.93 沸点39.75 ℃at 760 mm Hg 密度 1.325 g/mL at 25 °C(lit.) 熔点-97 °C 水溶性不溶于水 外观无色透明易挥发液体
N,N-二甲基甲酰胺DMF 英文 N,N-dimethyl formamide 分子式 HCON(CH3)2。 熔点-60.5℃, 沸点 149~156℃, 相对密度 0.9487(20/4℃) 外观无色高沸点液体,易溶于水 丙酮 别称二甲基酮、二甲基甲酮,二甲酮,醋酮、木酮 英文名 Propanone/Acetone CAS登录号 67-64-1 化学式 CH3COCH3 分子量 58.08 沸点 56.53 °C (329.4 K) 密度 (d25)0.7845 熔点?94.9 °C (178.2 K) 水溶性混溶 外观常温下无色液体 甲醇 别称羟基甲烷、木醇、木精 英文名 methanol 化学式 CH3OH CAS登录号 67-56-1 分子量 32.04186 沸点 64.7℃ 密度 0.7918 g/cm3 熔点 -97℃ 水溶性与水完全互溶 外观无色液体 极性是指整个分子电荷分离的程度,分离程度越大,极性越大。所以通常含有N、O、卤素等吸电子基团的分子极性会比较大,但需要注意,氯仿极性比二氯甲烷大,因为氯仿多一个吸电子的氯,但四氯化碳极性小于氯仿,因为这是一个对称结构,这有点类似拔河。化
最全的人教版初中数学常用概念、公式和定理教程文件
最全的人教版初中数学常用概念、公式和 定理
2017最全的初中数学公式 1.整数(包括:正整数、0、负整数)和分数(包括:有限小数和无限环循小数) 都是有理数. 如:-3,,0.231,0.737373…,,.无限不环循小数叫做无理数..如:π,-,0.1010010001…(两个1之间依次多1个0).有理数和无理数统称为实数. 2.绝对值:a≥0丨a丨=a;a≤0丨a丨=-a. 如:丨-丨=;丨3.14-π丨=π-3.14. 3.一个近似数,从左边笫一个不是0的数字起,到最末一个数字止,所有的数 字,都叫做这个近似数的有效数字.如:0.05972精确到0.001得0.060,结果有两个有效数字6,0. 4.把一个数写成±a×10n的形式(其中1≤a<10,n是整数),这种记数法叫做科学记数法. 如:-40700=-4.07×105,0.000043=4.3×10-5. 5.被开方数的小数点每移动2位,算术平方根的小数点就向相同方向移动1 位;被开方数的小数点每移动3位,立方根的小数点就向相同方向移动1位. 如:已知=0.4858,则=48.58;已知=1.558,则=-0.1588. 6.整式的乘除法:①几个单项式相乘除,系数与系数相乘除,同底数的幂结合起来相乘除. ②单项式乘以多项式,用单项式乘以多项式的每一个项.③多项式乘以多项 式,用一个多项式的每一项分别乘以另一个多项式的每一项.④多项式除以单项式,将多项式的每一项 分别除以这个单项式. 7.幂的运算性质:①a m×a n=a m+n.②a m÷a n=a m-n.③(a m)n=a mn.④(ab)n=a n b n.⑤(- )n=n.⑥a-n=n,特别:()-n=()n.⑦a0=1(a≠0). 如:a3×a2=a5,a6÷a2=a4,(a3)2=a6,(3a3)3=27a9,(-3)-1=-,5-2==,()-2=(-)2=,(-3.14)0=1,(-)0=1.
初中数学公式大全
初中数学常用公式 一?代数: 1.1绝对值运算 2.1平面几何:角 1.2有理数的运算 2.2 三角形 1.3整式的乘法运算 2.3四边形 1.4整式乘法公式 2.4比例性质 1.5整式除法公式 2.5三角函数 1.6分式的运算公式 2.6与圆有关的公式1.7 一兀二次方程 2.7点与圆的位置1.8因式分解 2.8直线与圆的位置1.9不等式 2.9两圆的位置 1.10二次根式 1.1绝对值运算 1.2有理数的运算 1.3整式的乘法运算
1.4 整式乘法公式 1.5 整式除法公式 1.6 分式的运算公式 1.7 一元二次方程:的解1.8 因式分解
1.9 不等式若,则 若,则 若,则 1.10 二次根式 2.1 角 1周角=360 ° 1 平角=180 ° 1 直角=90 ° 1°= 60 ;1 = 60”若,则/ A与/ B互为余角。 若,则/ A与/ B互为补角。 2.2 三角形 若,则 若,则 若,则为直角三角形
正弦定理: 余弦定理: 2.3 四边形 (a为底边长,h为底边上的高)(ab 为两邻边长) (ab 为菱形的两条对角线) 2.4 比例性质 若,则 若,则 2.5 三角函数
2.6 与圆有关的公式 圆周长 圆面积 弧长 扇形面积 2.7 点与圆的位置 设P点到圆心的距离为d,圆的半径长为r,则点P 在圆上 点P 在圆内 点P 在圆外 2.8 直线与圆的位置 设圆心到直线的距离为d,圆半径长为r,则
直线与圆相切 直线与圆相离 直线与圆相交 2.9 两圆的位置 设两圆半径分别为R和r,圆心距为d,则 两圆外离 两圆外切 两圆相交 两圆内切 两圆内含
常用有机溶剂性质
常用有机溶剂性质 粘度(20℃)/mPa·s; —介电常数 名称沸点密度粘度波长极性E T(30) 介电分子量溶解性水100 1 1 268 10.2 63.1 58.8 18 二甲亚砜189 2.24 268 7.2 45 48.9 78.14 DMSO能与水、醇、醚、丙酮、乙醛、吡啶、乙酸乙酯等混溶,不溶于乙炔以外的脂肪烃化合物 乙二醇197 1.1155 19.9 210 6.9 56.3 26.33 62.07 与水/乙醇/丙酮/醋酸甘油吡啶等混溶,微溶于醚等,不溶于石油烃及油类.能够溶解氯化锌/氯化钠/碳酸钾/氯化钾/碘化钾/氢氧化钾等无机物. 甲醇64.9 0.7914 0.6 210 6.6 55.5 32.6 32.04 溶于水、乙醇、乙醚、苯等 二甲基甲酰胺152.8 0.92 270 6.4 43.8 36.71 73.10 能和水及大部分有机溶剂互溶,是高沸点的极性(亲水性)非质子性溶剂,能促进SN2反应机构的进行 苯胺184 4.4 - 6.3 44.3 6.98 乙酸118 1.28 230 6.2 51.9 6.19 乙腈81.1 0.37 210 6.2 46 37.5 41.05 相对密度0.79,与水混溶,溶于醇等多数有机溶剂硝基甲烷101 0.67 330 6 46.3 38.6 丙酮56.5 0.32 330 5.4 42.2 20.5 58.08 与水、乙醇、氯仿、乙醚及多种油类混溶吡啶115 0.97 305 5.3 40.2 12.3 二恶烷; 二氧 六环 102 1.04 1.54 220 4.8 36 2.21 88.11 与水混溶,可混溶于多数有机溶剂 2-丁酮80 0.8054 0.43 330 4.5 72.11 甲基乙基酮能溶于4份水中,但温度升高时溶解度降低,20℃时,水中溶解度26.8%(w),水在2-丁酮中的溶解度11.8%(w)。溶于乙醇和乙醚,可与油混溶。与水形成共沸物,其沸点74.3℃,含丁酮88.7%。在空气中的爆炸极限1.97%-10.1%(v) 氯仿61.2 0.57 245 4.4 39.1 4.7 119.39 微溶于水,能与醇、醚、苯等有机溶剂及油类混溶 乙酸乙酯77.0 0.45 260 4.30 38.1 6.03 88.1 能与水、乙醇、乙醚、丙酮及氯仿等混溶 异丙醇82 0.78505 2.37 210 4.3 48.6 18.3 60.07 溶于水、醇、醚、苯、氯仿等多数有机溶剂。与水能形成共沸物。 四氢呋喃66 0.8892 0.55 220 4.2 37.4 7.58 溶于水、乙醇、乙醚、脂肪烃、芳香烃、氯化烃、丙酮、苯等有机溶剂 甲基异丁酮119 - 330 4.2
