有机化学实验制备2-萘乙醚的绿色化研究

第9期 收稿日期:2019-04-23
基金项目:怀化学院教改项目(No:2016-27)作者简介:刘益林(1984—),男,湖南新化人,博士研究生,主要研究方向为有机合成。有机化学实验制备2-萘乙醚的绿色化研究刘益林1,2,李宁杰1,李元祥1,2,胡蔚 1,2
(1.怀化学院化学与材料工程学院,湖南怀化 418008;2.怀化学院功能无机及高分子材料怀化市重点实验室,湖南怀化 418008)
摘要:
探索了以无水三氯化铁作催化剂,2-萘酚和乙醇脱水制备2-萘乙醚的绿色化研究,得出了最佳的反应条件:2-萘酚3.6g(0.025mol),催化剂用量为2-萘酚摩尔数的30%,反应时间为3h,反应产率可达79%,纯度高达98%。将此方法应用在有机化学实验教学是可行的。
关键词:
2-萘酚;乙醇;无水氯化铁中图分类号:TQ244.3 文献标识码:A 文章编号:1008-021X(2019)09-0221-02GreenStudyonthePreparationof2-NaphtylEthylEtherinOrganicChemistryExperimentsLiuYilin1,2,LiNingjie1,LiYuanxiang1,2,HuWeimin1,2(1.DepartmentofChemistryandMaterialsEngineering,HuaihuaUniversity,Huaihua 418008,China;
2.HuaihuaKeyLaboratoryofFunctionalInorganic&PolymericMaterials,HuaihuaUniversity,Huaihua 418008,China)Abstract:Thegreensynthesisof2-naphtylethyletherbydehydrationof2-naphtholandethanolusinganhydrousferricchlorideascatalystwasexplored,andtheoptimumreactionconditionswereobtained:theamountof2-naphtholwas3.6g(0.025mol),theloadingofcatalystwas30mol%of2-naphthol,thereactiontimeis3h,theyieldwasupto79%,andtheproductpuritywasupto98%.Theapplicationofthismethodinorganicchemistryexperimentteachingisfeasible.
Keywords:2-naphthol;ethanol;anhydrousferricchloride
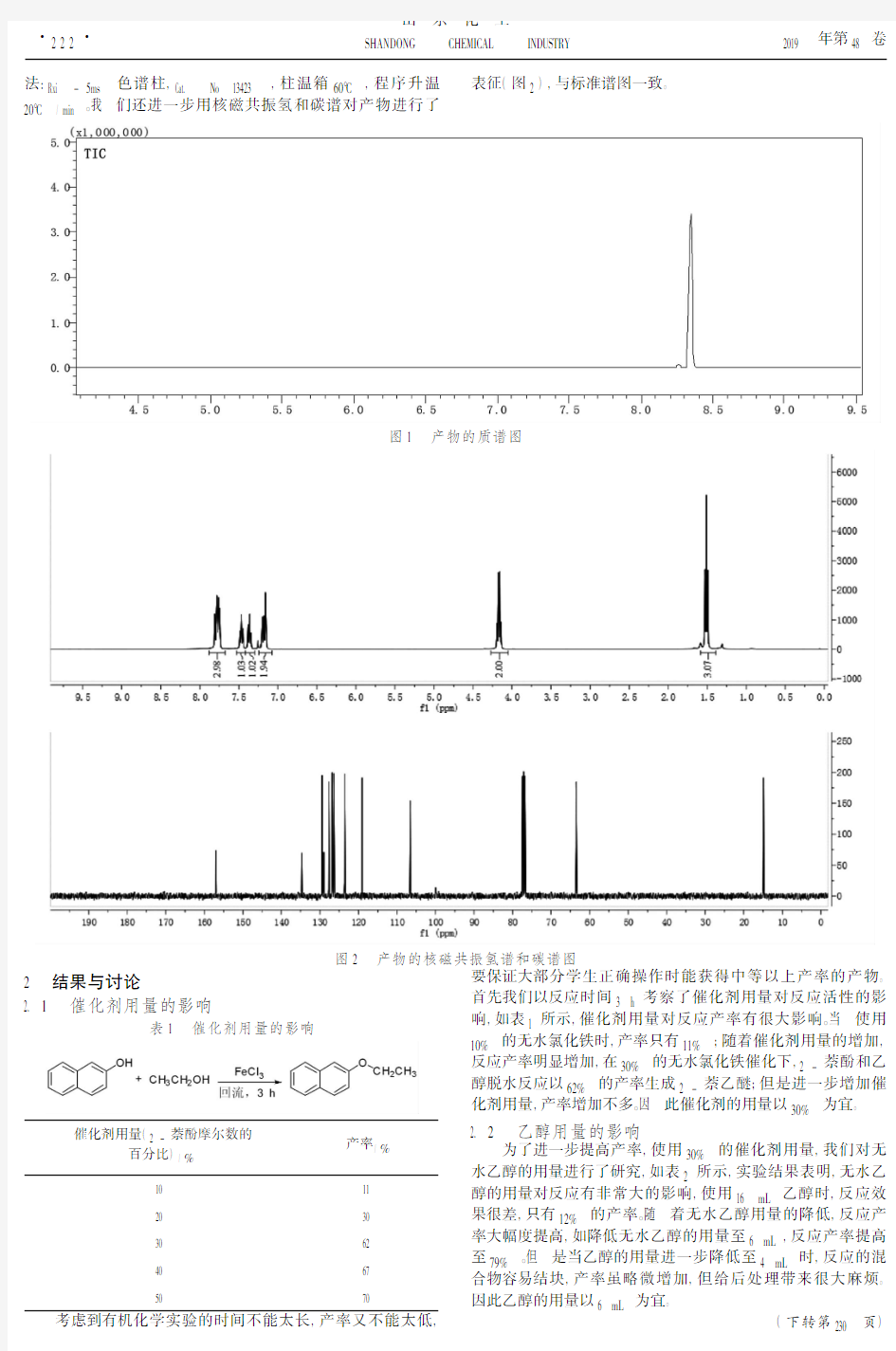
有机化学实验是高等学校化学、药学等相关专业的一门非常重要的基础实验课程。但是,在传统有机化学实验教学中,部分有机实验对环境造成污染。因此,开展有机化学实验绿色化教学研究已经成为当代有机化学实验教学的发展趋势和潮流,对于培养学生的环保意识,保护绿水青山,提高有机化学实验教学质量具有重要的意义。2-萘乙醚具有柔和持久的花香,是香皂和化妆品等的香料添加剂,可用于调配洗涤剂,还可用作柠檬香、玫瑰香等香料定香剂,此外在医药上用作乙氧萘青霉素钠合成的原料。工业上2-萘乙醚的生产是以2-萘酚和乙醇为原料,用浓硫酸作催化剂脱水得到,但存在污染严重和强烈腐蚀设备等问题[1];此外成熟的工艺方法还有:2-萘酚在氢氧化钠的作用下和硫酸二乙酯反应,但是该方法存在硫酸二乙酯的毒性较大等不足[2]。有机化学实验从2-萘酚制备2-萘乙醚,经典的实验教材使用是威廉姆逊合成法,使用溴乙烷或碘乙烷或硫酸二乙酯,回流反应约2h,该方法实验时间较短,但是溴乙烷和碘乙烷容易挥发,价格贵,并且这三种试剂的毒性较大。酸催化2-萘酚合成2-萘乙醚的方法,由于使用的是乙醇作反应物和溶剂,绿色环保,价格便宜,因此,近年来,有机化学工作者围绕从2-萘酚和乙醇合成2-萘乙醚的绿色化教学开展了系列研究,并且取得了一定进展,如管仕斌[3]等发展了硫酸氢钠催化下萘酚和乙醇脱水生成醚的反应,产率达90%,实验操作简单,催化剂使用和保管方便,环境污染小,但是反应时间过长,不利于有机化学实验教学;梁宇[4]等研究了硫酸铁催化合成2-萘乙醚,产率可达83.7%,但反应时间同样过长,达16h;研究发现氯化铜[5]、硫酸铝[6]在催化萘酚和乙醇合成萘乙醚中也具有很好的活性,并且采用微波辐射能极大缩多反应时间,产率仍然较高,在有机化学实验教学中具有比较好的应用前景。无水三氯化铁是一种环保的、价廉易得、性质温和的无机固体盐,本文将无水三氯化铁催化2-萘酚和乙醇合成2-萘乙醚,探究了应用于有机化学实验教学的合成方法。实验研究结果表明:使用无水三氯化铁作催化剂,具有实验操作简单、产率高、产物纯度高,污染少等显著优点,该合成方法能应用于有机化学实验教学。1 实验部分1.1 主要仪器和试剂2-萘酚、乙醇为市售的化学纯试剂,无水三氯化铁为分析纯;常用玻璃仪器、电子天平、日本岛津GC-MSQP-2010联用仪。1.2 实验方法反应式如下:在50mL干燥圆底烧瓶中,加入3.6g(0.025mol)2-萘酚,1.2g氯化铁(0.0075mol),6mL乙醇和3~5粒沸石,充分摇匀后,安装回流装置。用电热套缓缓加热混合物至沸腾,保持微沸状态,回流3h。在回流过程中,间歇摇动反应瓶。稍微冷却后,用水浴加热蒸馏出乙醇,冰水冷却反应瓶析出固体,用冰水转移至布氏漏斗,抽虑,冰水洗涤固体。再将布氏漏斗上固体转移至研钵中,加5mL冰水研磨后,布氏漏斗抽虑,冰水洗涤。将布氏漏斗上固体转移至研钵中,加5mL氢氧化钠水溶液(2.8mol/L)研磨后,布氏漏斗抽虑,冰水洗涤。晾干,称重,计算产率。合成出来的2-萘乙醚为棕色固体,我们用日本岛津GC-MSQP-2010气质联用仪器对产品的纯度进行分析,产物的纯度
高达98%(图1),2-萘乙醚保留时间tR=8.34min。分析方·
122·刘益林,等:有机化学实验制备2-萘
乙醚的绿色化研究
乙醚的制备实验报告
实验名称:乙醚的制备实验 一、 实验目的 1.原理和方法——在酸作用下醇分子间脱水制备 2.基本操作——①控制温度来控制反应方向进行; ②低沸点依然液体的蒸馏,洗涤分离等基本操作要点。 二、实验原理或主要反应式 1.酸作用下,醇分子间脱水成醚 本实验在浓硫酸作用下,乙醇发生分子间脱水生成乙醚。 反应方程式: 2.基本反应历程 3.副反应 在反应过程中,如果温度控制不好,就可能发生乙醇分子内脱水成烯、氧化为醛或酸的副反应。 反应方程式: 三、主要试剂及药品 液体药品:95%乙醇、浓硫酸、5%氢氧化钠溶液、饱和氯化钙溶液、饱和食盐水 固体药品:无水氯化钙
四、实验装置图 五、实验步骤 六、产品质量及产率(网络授课可忽略此项) 七、实验注意事项 1. 仪器要干燥,安装要严密,滴液漏斗下端要浸入液面以下。 2. 注意温度计位置:制备乙醚和蒸馏乙醚时温度计的位置不一样。 3. 分批加浓硫酸时,注意边加边摇边冷却,防止乙醇进一步氧化。 4. 控制好反应温度及滴加乙醇的速度(约1 滴/秒)。 5. 反应完后要先停止加热,稍冷却后再拆下接收瓶,防止产物挥发。
6. 乙醚是易燃溶剂,在洗涤分离、蒸馏时要远离明火,注意通风,保证安全。 八、实验小结或问题讨论 1.在乙醚的制备过程中,滴液漏斗的下端为什么要伸到液面以下? 防止乙醇还没有参加反应就被蒸出。 2.在洗涤分离过程中,每一步分别除去的是哪些杂质?(除杂的原则;粗盐如何提纯) 用氢氧化钠溶液洗涤除去酸性物质:乙酸、亚硫酸; 用饱和食盐水洗涤除去残留的碱并减少乙醚在水中的溶解度; 用饱和氯化钙溶液洗涤除去乙醇。 3.制备乙醚时,反应温度过高或过低对反应有什么影响? 反应温度过高,则副反应增多,产率降低;反应温度过低,则反应速率很慢。 4.在制备乙醚和蒸馏乙醚时,温度计的位置是否相同?为什么? 制备乙醚时,温度计的水银球须浸入液面以下距瓶底约0.5~1cm处,与漏斗脚末端齐平。 蒸馏乙醚时,温度计水银球应位于蒸馏头支管口
乙醚的发现
发现麻醉剂乙醚的故事 远在19世纪早期,出生于美国麻萨诸塞州的威廉·莫顿(William Thomas Green Morton, 1819-1868),是一位乡村农民兼小商店主的儿子。他在巴尔的摩牙科学院学习后,曾短期与韦尔斯(H. We11s,1815-1848)合作,以后自己在波士顿开业。 在1844年间,他刚结婚不久,经济桔据,终日梦想改革当时的假牙,来改善自己的经济状况。但首先遇到的一个严重问题是,需要拔去原来的坏牙和牙根,有时还需把全部的牙都得拔去。在当时还没有麻醉剂的情况下,拔去那么多牙,则病人疼痛难忍。他曾看见不止一个病人,没有等把牙拔完,就愤怒地大踏步离开他的诊所,发誓不再登门。 有鉴于此,莫顿立志一定要找到一个无痛拔牙的方法。他想,如果能找到这种方法,他就会成为波士顿最富有的牙医了。但这在当时确实还是一个梦想。他知道,几个世纪以来,人们为了寻找无痛外科手术方法,一直没有结果。但他并不灰心,他试验用白兰地酒、香槟酒、阿片和催眠术,都无效,反倒引起病人很不舒服。这时,他意识到,既然世界上最大的科学家还未能解决这个难题,他这个学牙科仅一年半的人,恐怕是无能为力的。于是,他决定去求师请教。 正好离他位处不远,有一位有学识的医生,名叫查理·杰克森(Charles Thomas Jackson,1805一1880),他不仅懂医学,还是一位化学家、地质学家和旅行家。莫顿想,这样一个人一定能教给他很多很多。按当时的习惯,他就在杰克森的办公室注册,充当业余学生,在空闲的晚上与老师交谈并阅读老师的著作。有一天晚上,莫顿向老师请教如何使拔牙无疼痛的问题,杰克森建议可试用乙醚,当时用此药治疗哮喘病。第二天莫顿就去药房买了一瓶乙醚,在一个牙痛病人牙齿上涂抹后拔牙,有一定止痛效果,但作用时间很短,很快就气化了。后来他想最好能改为吸入法以产生麻醉。他先在乡间岳父家将这一方法试用于捉到的松鼠和兔子,但一个个都被乙醚熏死了。这时他意识到,乙醚能致动物于死,那一定也能致人于死。他害怕了,于是放弃了用乙醚麻醉的想法。 有一天,莫顿在麻州总医院观看一次外科手术,使他感慨极深。那是1825年12月,著名外科医生约翰·瓦伦(John C, warren)为一个病人截去一条腿。在没有麻醉剂的条件下,除了给病人口中含上一根小木捧在疼痛难忍时用力咬木棒外, 只有医生快速地缩短手术时间。莫顿亲眼看到这种惨痛状况,心中十分难受。他想,人类是多么需要无痛手术呀!原来幻想的无痛拔牙方法,又重新回到他的脑子里来,他决定再试乙醚。 他翻阅药物学教科书,了解到乙醚有几种,如氯化乙醚和硫酸乙醚。他回想自己把松鼠和兔子熏死,是否用错了乙醚?书上讲乙醚可产生昏迷,那么在昏迷和死亡之间是否存在尚未发现的另一种状态?他于是买了一瓶硫酸乙醚回家,趁他妻子没有注意,把爱犬引诱到后院,将蘸了乙醚的海绵捂住犬的口鼻使它吸入,几秒钟后,犬软弱无力了,躺下了,失去知觉了。这时的犬不仅昏迷,而真是睡着了。他拿开海绵,用力摇动,犬渐渐睁开眼,并站起来摇摆着走路,不久即恢复了原状。这是他第一次得到的最满意的实验结果。
实验八 乙醚的制备
乙醚实验室制法 [实验原理] [实验步骤] 按图安装好装置 [注意事项]1.在反应装置中,滴液漏斗末端和温度计水银球必须浸入液面以下,接受器必须浸入冰水浴中,尾接管支管接橡皮管通入下水道或室 外。 2.控制好滴加乙醇的速度(1D/S)和反应温度(135-145℃)。 3.乙醚是低沸点易燃的液体,仪器装置连接处必须严密。在洗涤过程 中必须远离火源。 制备乙醚实验装置图 乙醚的制备. 1. 乙醚的制备 ①在干燥的三角烧瓶中加入12ml乙醇,缓缓加入12ml浓H2SO4混合均匀。 ①滴液漏斗中加入25ml乙醇。 ②如图连接好装置。 ③用电热套加热,使反应温度比较迅速升到 1400C。开始由滴液漏斗慢慢滴加乙醇。 ④控制滴入速度与馏出液速度大致相等(1滴/s)。 ⑤维持反应温度在135-1450C内30-45min滴完,再继续加热10min,直到温度升到1600C,停止反应。 2. 乙醚的精制 ①将馏出液转至分液漏斗中,依次用8ml5%NaOH,8ml饱和NaCl洗涤,最后用8ml饱和CaCl2洗涤2次 ②分出醚层,用无水CaCl2干燥。 ③分出醚,蒸馏收集33-380C馏液。 ④计算产率。 四、思考题 1、反应温度过高或过低对反应有什么影响 参考答案 1、主要由原料CH3COOH(.118℃)生成物水(.100℃)的沸点所决定。控制在105℃这样可以保证原料CH3COOH充分反应而不被蒸出,生成的水立即移走促使反应向生成物方向移动,有利于提高产率。 三十一乙醚的制备
204. 实验室使用或蒸馏乙醚时应注意哪些问题 答:在实验室使用或蒸馏乙醚时,实验台附近严禁有明火。因为乙醚容易挥发,且易燃烧,与空气混和到一定比例时即发生爆炸。所以蒸馏乙醚时,只能用热水浴加热,蒸馏装置要严密不漏气,接收器支管上接的橡皮管要引入水槽或室外,且接收器外要用冰水冷却。 另外,蒸馏保存时间较久的乙醚时,应事先检验是否含过氧化合物。因为乙醚在保存期间与空气接触和受光照射的影响可能产生二乙基过氧化物(C2H5OOC2H5),过氧化物受热容易发生爆炸。 检验方法:取少量乙醚,加等体积的2% KI 溶液,再加几滴稀盐酸振摇,振摇后的溶液若能使淀粉显蓝色,则表明有过氧化合物存在。 除去过氧化合物的方法:在分液漏斗中加入乙醚(含过氧化物),加入相当乙醚体积1/5的新配制的硫酸亚铁溶液(55 ml水中加3 ml浓硫酸,再加30g 硫酸亚铁),剧烈振动后分去水层即可。 205. 在制备乙醚时,滴液漏斗的下端若不浸入反应液液面以下会有什么影响如果滴液漏斗的下端较短不能浸入反应液液面下应怎么办 答:滴液漏斗的下端应浸入反应液液面以下,若在液面上面,则滴入的乙醇易受热被蒸出,无法参与反应,造成产率低、杂质多。如果滴液漏斗下端较短而不能浸入反应液液面以下,应在其下端用一小段橡皮管接一段玻璃上去。但要注意,橡皮管不要接触到反应液,以免反应液中的浓硫酸腐蚀橡皮管。 206. 在制备乙醚和蒸馏乙醚时,温度计被装的位置是否相同为什么 答:不同。在制备乙醚时,温度计的水银球必须插入反应液的液面以下。因为此时温度计的作用是测量反应温度;而蒸馏时,温度计的位置是在液面上即水银球的上部与蒸馏烧瓶的支管下沿平齐,因为此时温度计的作用是测量乙醚蒸气的温度。 207. 在制备乙醚时,反应温度已高于乙醇的沸点,为何乙醇不易被蒸出 答:因为此时,乙醇已与浓硫酸作用形成了盐。 该盐是离子型化合物,沸点较高,不易被蒸出。 208. 制备乙醚时,为何要控制滴加乙醇的速度怎样的滴加速度才比较合适 答:制乙醚时,反应液加热到130-140 oC 时,产生乙醚。此时再滴加乙醇,乙醇将继续与硫酸氢乙酯作用生成乙醚。若此时滴加乙醇的速度过快,不仅会降低反应液的温度,而且,滴加的部分乙醇因来不及作用就会被蒸出。若滴加乙醇的速度过慢,则反应时间会太长,瓶内的乙醇易被热的浓硫酸氧化或碳化。因此,滴加乙醇的速度应控制到能保持与馏出乙醚的速度相等为宜(1滴/秒)。 209. 在粗制乙醚中有哪些杂质它们是怎样形成的实验中采用了哪些措施将它们一一除去的 答:在粗制乙醚中尚含有水、醋酸、亚硫酸以及未反应的乙醇。 实验中用NaOH溶液除去酸性物质:醋酸和亚硫酸;用饱和氯化钙除去乙醇;用无水氯化钙干燥除去所剩的少量水和乙醇。 210. 在用NaOH溶液洗涤乙醚粗产物之后,用饱和氯化钙水溶液洗涤之前,为何要用饱和氯化钠水溶液洗涤产品 答:因为在用NaOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗涤和分离。因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤。这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度。 211. 若精制后的乙醚沸程仍较长,估计可能是什么杂质未除尽如何将其完全除去 答:若精制后的乙醚沸程仍较长,则说明此乙醚中还含有较少量的
2-萘乙醚的制备及检测
β―萘乙醚的制备及检测(一) 一、实验目的: 熟悉威廉逊法制备混合醚的原理,掌握β―萘乙醚的制备方法。 掌握普通回流反应装置的安装与操作方法, 掌握利用重结晶法精制固体粗产品的方法。 二、实验原理: β―萘乙醚又称橙花醚,是一种合成香料,其稀溶液具有类似橙花和洋槐花的香味,并伴有甜味和草莓和菠萝的芳香。β―萘乙醚是一种无色片状晶体,若将其加入到一些易挥发的香料中,便会减慢这些香料的挥发速度(具有这种性质的化合物成为定香剂),因而它广泛的用于肥皂中作为香料和用作其它香料(如玫瑰香、薰衣草香、柠檬香等)的定香剂。β―萘乙醚是一种芳香基烷基混合醚,如果用浓硫酸脱水法制备β―萘乙醚,反应中有副产物乙醚和乙烯,它们易燃易爆,安全性差。实验室制备β―萘乙醚常采用威廉逊法,本实验用溴乙烷和β―萘酚钠在乙醇中反应制备β―萘乙醚,反应式如下: 三、实验试剂及装置: 四、实验步骤: 1、威廉逊合成:在干燥的100ml圆底烧瓶中,加入5克β―萘酚、30ml无水乙醇、1.8克研细的氢氧化钠,充分振摇(氢氧化钠全部溶解效果更好),在摇动下加入3.2ml溴乙烷。 2、安装回流冷凝管,用水浴加热,回流1.5小时。(回流过程中会产生固体) 3、抽滤分离:反应物稍冷,拆除装置,在搅拌下将反应物倒入盛有200ml冷水的烧杯中(先进行蒸馏,蒸出大部分乙醇后再倒入冷水更好),冰水浴冷却后减压抽滤,用20ml冷水分两次洗涤滤饼。 4、干燥:滤饼转移到表面皿上,在蒸气浴上烘干或自然晾干。 5、称重,得粗品质量。 五、注意事项 1、溴乙烷和β―萘酚都有毒,应小心使用。 2、威廉逊合成反应水浴温度不能太高,保持微沸即可,否则溴乙烷可能逸出。
有机化学实验制备2-萘乙醚的绿色化研究
第9期 收稿日期:2019-04-23 基金项目:怀化学院教改项目(No:2016-27)作者简介:刘益林(1984—),男,湖南新化人,博士研究生,主要研究方向为有机合成。有机化学实验制备2-萘乙醚的绿色化研究刘益林1,2,李宁杰1,李元祥1,2,胡蔚 1,2 (1.怀化学院化学与材料工程学院,湖南怀化 418008;2.怀化学院功能无机及高分子材料怀化市重点实验室,湖南怀化 418008) 摘要: 探索了以无水三氯化铁作催化剂,2-萘酚和乙醇脱水制备2-萘乙醚的绿色化研究,得出了最佳的反应条件:2-萘酚3.6g(0.025mol),催化剂用量为2-萘酚摩尔数的30%,反应时间为3h,反应产率可达79%,纯度高达98%。将此方法应用在有机化学实验教学是可行的。 关键词: 2-萘酚;乙醇;无水氯化铁中图分类号:TQ244.3 文献标识码:A 文章编号:1008-021X(2019)09-0221-02GreenStudyonthePreparationof2-NaphtylEthylEtherinOrganicChemistryExperimentsLiuYilin1,2,LiNingjie1,LiYuanxiang1,2,HuWeimin1,2(1.DepartmentofChemistryandMaterialsEngineering,HuaihuaUniversity,Huaihua 418008,China; 2.HuaihuaKeyLaboratoryofFunctionalInorganic&PolymericMaterials,HuaihuaUniversity,Huaihua 418008,China)Abstract:Thegreensynthesisof2-naphtylethyletherbydehydrationof2-naphtholandethanolusinganhydrousferricchlorideascatalystwasexplored,andtheoptimumreactionconditionswereobtained:theamountof2-naphtholwas3.6g(0.025mol),theloadingofcatalystwas30mol%of2-naphthol,thereactiontimeis3h,theyieldwasupto79%,andtheproductpuritywasupto98%.Theapplicationofthismethodinorganicchemistryexperimentteachingisfeasible. Keywords:2-naphthol;ethanol;anhydrousferricchloride 有机化学实验是高等学校化学、药学等相关专业的一门非常重要的基础实验课程。但是,在传统有机化学实验教学中,部分有机实验对环境造成污染。因此,开展有机化学实验绿色化教学研究已经成为当代有机化学实验教学的发展趋势和潮流,对于培养学生的环保意识,保护绿水青山,提高有机化学实验教学质量具有重要的意义。2-萘乙醚具有柔和持久的花香,是香皂和化妆品等的香料添加剂,可用于调配洗涤剂,还可用作柠檬香、玫瑰香等香料定香剂,此外在医药上用作乙氧萘青霉素钠合成的原料。工业上2-萘乙醚的生产是以2-萘酚和乙醇为原料,用浓硫酸作催化剂脱水得到,但存在污染严重和强烈腐蚀设备等问题[1];此外成熟的工艺方法还有:2-萘酚在氢氧化钠的作用下和硫酸二乙酯反应,但是该方法存在硫酸二乙酯的毒性较大等不足[2]。有机化学实验从2-萘酚制备2-萘乙醚,经典的实验教材使用是威廉姆逊合成法,使用溴乙烷或碘乙烷或硫酸二乙酯,回流反应约2h,该方法实验时间较短,但是溴乙烷和碘乙烷容易挥发,价格贵,并且这三种试剂的毒性较大。酸催化2-萘酚合成2-萘乙醚的方法,由于使用的是乙醇作反应物和溶剂,绿色环保,价格便宜,因此,近年来,有机化学工作者围绕从2-萘酚和乙醇合成2-萘乙醚的绿色化教学开展了系列研究,并且取得了一定进展,如管仕斌[3]等发展了硫酸氢钠催化下萘酚和乙醇脱水生成醚的反应,产率达90%,实验操作简单,催化剂使用和保管方便,环境污染小,但是反应时间过长,不利于有机化学实验教学;梁宇[4]等研究了硫酸铁催化合成2-萘乙醚,产率可达83.7%,但反应时间同样过长,达16h;研究发现氯化铜[5]、硫酸铝[6]在催化萘酚和乙醇合成萘乙醚中也具有很好的活性,并且采用微波辐射能极大缩多反应时间,产率仍然较高,在有机化学实验教学中具有比较好的应用前景。无水三氯化铁是一种环保的、价廉易得、性质温和的无机固体盐,本文将无水三氯化铁催化2-萘酚和乙醇合成2-萘乙醚,探究了应用于有机化学实验教学的合成方法。实验研究结果表明:使用无水三氯化铁作催化剂,具有实验操作简单、产率高、产物纯度高,污染少等显著优点,该合成方法能应用于有机化学实验教学。1 实验部分1.1 主要仪器和试剂2-萘酚、乙醇为市售的化学纯试剂,无水三氯化铁为分析纯;常用玻璃仪器、电子天平、日本岛津GC-MSQP-2010联用仪。1.2 实验方法反应式如下:在50mL干燥圆底烧瓶中,加入3.6g(0.025mol)2-萘酚,1.2g氯化铁(0.0075mol),6mL乙醇和3~5粒沸石,充分摇匀后,安装回流装置。用电热套缓缓加热混合物至沸腾,保持微沸状态,回流3h。在回流过程中,间歇摇动反应瓶。稍微冷却后,用水浴加热蒸馏出乙醇,冰水冷却反应瓶析出固体,用冰水转移至布氏漏斗,抽虑,冰水洗涤固体。再将布氏漏斗上固体转移至研钵中,加5mL冰水研磨后,布氏漏斗抽虑,冰水洗涤。将布氏漏斗上固体转移至研钵中,加5mL氢氧化钠水溶液(2.8mol/L)研磨后,布氏漏斗抽虑,冰水洗涤。晾干,称重,计算产率。合成出来的2-萘乙醚为棕色固体,我们用日本岛津GC-MSQP-2010气质联用仪器对产品的纯度进行分析,产物的纯度 高达98%(图1),2-萘乙醚保留时间tR=8.34min。分析方· 122·刘益林,等:有机化学实验制备2-萘 乙醚的绿色化研究
乙醚的制备
兴义师范学院 有机化学实验报告 实验名称:乙醚的制备 专业:化学教育 班级: 11化学本科班 姓名:周兴翠学号 201140651053 指导教师:陈明华 日期: 2013年5月22日
一、实验目的: 1掌握实验室制备原理和方法。 2初步掌握低沸点易燃液体的操作要点。 二、实验原理: 醚能溶解多数的有机化合物,有些有机反应必须在醚中进行,因此,醚是有机合成中常用的溶剂。 制乙醚的主要反应: 得到主要反应的分步反应: 三、主要试剂及物理性质: 1乙醇是无色、有特殊香味的液体,密度比水小,溶沸点低,易挥发,能溶解多种有机物和无机物,能与水以任意比互溶。 2浓硫酸是无色无味的油状液体,是一种高沸点难挥发的强酸,浓硫酸中H2SO4的质量分数为98.3%,易溶于水,并且为任意比互溶,溶解时放出大量的热。 四、试剂用量规格: 95%的乙醇、浓硫酸。 五、仪器装置:
图1 制备乙醚的装置图2洗涤装置 六、实验步骤及现象 步骤现象在干燥的三颈烧瓶中加入12mL95%乙醇,并 将烧瓶浸入冷水浴中,缓缓加入12mL浓硫 酸混匀,滴液漏斗内盛有25mL95%乙醇,按 图一安装好。 都为无色 用电热套开始加热,温度到140℃,开始由滴液漏斗慢慢滴加乙醇,滴入速度与滴出速度大致相同,,并维持反应温度在135―145℃,30―45min,继续加10min,直到上升160℃时,去掉热源,停止加热。温度慢慢上升,由无色变为黑色。 将馏出液转入分液漏斗,分别用8mL5%的氢氧化钠溶液、8mL饱和氯化钠溶液洗涤,最后用8mL饱和氯化钠溶液洗涤2次。洗涤过程中乙醚上层,洗涤液为下层。 七、实验结果:
精细化工合成原理复习题
精细化工合成原理 一.填空题 1.精细化工产品的生产主要表现以下特点:(1),综合生产流程和多功能生产装置,(2),(3)。 2.芳环是一个环状的共轭体系,由于π电子高度离域,电子云密度较高,容易发生(4)反应,如磺化、硝化、卤化、C-烷化、C-酰化、C-羧化、氯甲基化等。当芳环已有取代基的邻、对位置上存在强的吸电子基团时,则此取代基容易被其他供电子基团所置换,即发生(5),如氨基化、羟基化、氰基化等。 3.根据氧化剂和氧化工艺的区别,可把氧化反应分为(6)、(7)以及(8)三种类型。 4.磺化或硫酸盐化反应是指(9)。磺化得到的产物是磺酸化合物,硫酸盐化得到的产物是(10)。 5.精细化工产品的生产全过程包括(11)、(12)和(13)三个过程。 6.化学动力学是研究(14)的科学,它对于了解(15),研究(16)有十分重要的作用;同时也可为寻找优化工艺条件,以及反应设备的数学模型设计提供实验依据。 7.在催化剂存在下,烯烃与一氧化碳及氢气反应,得到比原料烯烃多一个碳原子的醛,这类反应称为(17)反应,工业上把这种方法称为(18)。烯烃与一氧化碳及具有一个活泼氢的亲核试剂反应生成羧酸及其衍生物的过程称为(19)反应。 8.N-硝化是指硝基与氮原子相连接的反应,得到的产物是(20)。 9.以下几种发展精细化工的模式是值得提倡的:以某种原料为基础,(21),(22)。 10.软硬酸碱规则认为:(23)最易与硬碱结合,软酸最易与(24)结合。 11.齐聚反应可分为下列四种类型:(25),(26),(27),(28)。 12.气相加氢的主要特征是(29)。这种工艺适用于(30)。 13.向有机分子中引入(31)的反应称为硝化反应。硝化反应又可进一步分成C-硝化,O-硝化和N-硝化。其中C-硝化是指硝基与碳原子相连接的反应,得到的产物称为(32);O-硝化是指硝基与氧原子相连接的反应,得到的产物是(33),因此也可看作是(34)反应;N-硝化是指硝基与氮原子相连接的反应,得到的产物是(35)。 14.芳烃的结构对磺化反应的影响较大,环上存在(36)基团,磺化较易进行;存在(37)基团,则反应较难迸行。 15.最常用的酰化剂有(38、39、40)三种。 16.取代型烷化剂有(41)、(42)、(43)和(44);加成型烷化剂是(45)和(46);缩合-还原型烷化剂是(47)和(48)。 17.对于不同化合物的磺化π值是不同的。容易磺化的物质π值(49);难磺化的物质π值(50)。 18.工业上常用的磺化剂有(51)、(52)、(53)和(54)。为了使用及运输上的便利,工业发烟硫酞通常制成(55)和(56)两种规格。 19.加氢催化剂可分为下列三大类;第八族元素中的金属本身以及由合金制成的骨架催化剂;(57);(58)。 20.当某反应可以循两条或更多条途径进行时,如果所分离得到的主产物为仅需最低活化能的途径,而不考虑这一途径是否使系统的自由能降低最大,则称此反应受(59)控制;如果所选反应条件适合在原
