大输液生产工艺规程

大输液生产工艺规程
部门:生产部题目:大输液生产工艺规程1/15
文件编号: STP-PC-99000( 01)新订:替代:起草:
部门审阅:审核:批准:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
目的:建立一个大容量注射液(大输液)生产的通用工艺规程,为车间提供一个通用技术标准适
用范围:大输液的生产工艺
责任者:生产部经理、输液车间主任、工艺技术员、质监员及操作员
内容:
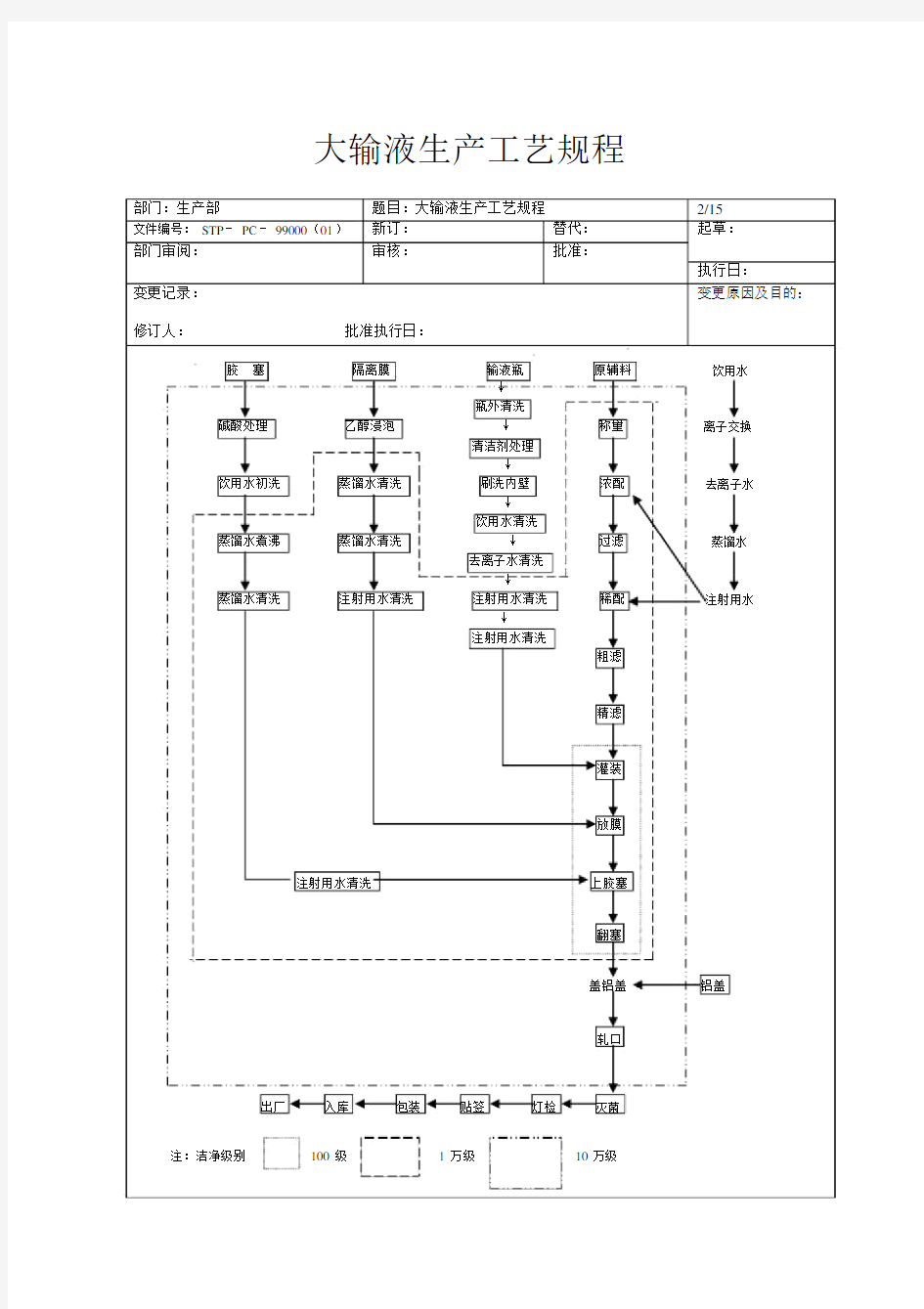
一、生产工艺流程图(见下页)。
二、操作过程及工艺条件。
1、制水
将饮用水(来自青城山)经石英砂过滤和活性碳过滤去除水中有机质及微粒,经电渗析初步脱盐
(脱盐率 75± 5%后,再经过“阳—阴—阴—混”离子交换柱去离子化制得去离子水,再经过切割分子
量为 10000(相当于0.001μ m)中空纤维滤材组成的超滤系统过滤后制得超纯水(纯化水),再经五效蒸馏水机制造蒸馏水,经微孔滤膜(孔径0.45μ m)过滤后制得注射用水。
2、洗瓶
将检验合格的输液瓶在车间外脱去外包装(麻袋或纸箱),在玻瓶进入口处转入周转箱中,运至理瓶室理瓶机旁,逐一上瓶于转盘上,开动外洗瓶机,淋水下对玻瓶进行外刷洗,同时灌入约100ml 自来水,传送至内洗瓶(粗洗)机,先用0.5%NaOH 洗刷,再用自来水洗刷,再用自来水洗刷,最后用纯化水冲洗,传送至精洗瓶机,用注射用水(经0.45μ m 滤过)冲洗两次,精选剔除不合格瓶,并经检查不得带有残余洗涤剂和洗水澄明度检查合格,pH5.0 — 7.0,合格的输液瓶传送至灌装间待用。
3、胶塞处理
新胶塞及使用过的回收胶塞,均需按以下程序进行处理:
①用 1.2%( g/ml ) NaOH 液煮沸 1 小时,用自来水洗净,pH 为 7.0;
②用 1%( ml/ml ) HCl 液煮沸 1 小时,用自来水洗净,pH 为 7.0;
③用蒸馏水煮沸 1 小时,用蒸馏水漂洗至最后一次洗涤水经检查不显氯化物反应,洗水澄清(允
许少量白点存在)为合格,转移至洁净不锈钢盛桶内备用;
④当天未使用完的胶塞隔天重新经蒸馏水煮沸、漂洗合格后再用。
4、涤纶薄膜处理
0.9%NaCl 中除去静
将按计划领取的薄膜在分散前用牙刷小心刷去毛边、飞屑等微粒,然后浸泡于
电并消毒 12 小时,从盐水中捞起,逐张分散浸泡于经过滤后的95%乙醇中,浸泡 12 小时以上,滤干,用注射用水反复漂洗至最后一次洗涤水经澄明度检查应无白块、小白点在二个以下(含二
个)为合格,将合格的薄膜分装于不锈钢盛器内备用。
5、配料
按批生产指令和流水通知单等规定领取原辅料,仔细检查所使用的原辅料必须有检验合格证,仔
细核对原辅料品名、批号及外观无误无损后,根据处方计算投料量,填写投料处方,逐一称量,
计算与称量必须双人复核并签名,投料进行配制(浓配—稀配或稀配),药液配好后,经中间品检验 pH 值、含量限度符合规定后,经钛棒过滤(0.65μ m)送入贮药罐,再经微孔滤膜过滤[ 0.45μm或(和) 0.22μ m] ,澄明度检查合格后送至灌装间灌装。生产时必须确认所用器具、管道、配
液罐及贮液罐已经清洗干净并消毒备用。
6、灌封
大输液生产工艺规程
部门:生产部题目:大输液生产工艺规程2/15
文件编号: STP- PC- 99000(01)新订:替代:起草:
部门审阅:审核:批准:
执行日:
变更记录:变更原因及目的:修订人:批准执行日:
胶塞隔离膜输液瓶原辅料饮用水
↓
瓶外清洗
碱酸处理乙醇浸泡↓称量离子交换
清洁剂处理
↓
饮用水初洗蒸馏水清洗刷洗内壁浓配去离子水
↓
饮用水清洗
蒸馏水煮沸蒸馏水清洗↓过滤蒸馏水
去离子水清洗
↓
蒸馏水清洗注射用水清洗注射用水清洗稀配注射用水
↓
注射用水清洗
粗滤
精滤
灌装
放膜
注射用水清洗上胶塞
翻塞
盖铝盖铝盖
轧口
出厂入库包装贴签灯检灭菌
注:洁净级别100级 1 万级10万级
部门:生产部题目:大输液生产工艺规程3/15
文件编号: STP-PC-99000( 01)新订:替代:起草:
部门审阅:质量审核:批准:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
药液经中间检验各项指标合格后输送至灌装机,开机灌装入洁净的输液瓶中,立即盖薄膜,膜必须放正,然后对准膜中心,垂直塞入胶塞,经翻塞机翻塞后传送到轧盖。药液配制好后至灌装结束不得超过 4 小时。
7、轧盖
灌封好的药瓶送至轧盖间,开机上铝盖、轧盖,随时检查轧盖质量,凡有胶塞损伤、轧盖不严(一
手持瓶,一手以大拇指、食指、中指卡住铝盖铝边缘,成三角锥形直立,向一个方向转动,无松动表明
轧盖牢固,为合格)以及其他不良等剔出,进行返工处理。8、灭菌
轧盖好后的药瓶逐层装入灭菌车内,每车装满后推至灭菌柜前门侧,开柜门,将灭菌车沿内轨推入
柜中,等柜内装满或装毕,关闭柜门,打开进汽阀、进水阀,按以下灭菌条件设定灭菌参数后,开机运
行自动灭菌程序:“准备—升温—灭菌—冷却—结束”。灭菌方法采用热压灭菌,以温度为依据、汽压为
参考,自动记录温度压力和 F 值。灭菌结束后,开灭菌柜后门侧,拉出已灭菌物品车,挂上“已灭菌
/可以灯检”等状态标示并记录。送至已灭菌物品暂存室备用。药液从灌装轧盖至灭菌的间隔时间不得超
过 2小时。
灭菌条件表(特殊品除外)
品种灭菌温度灭菌时间汽压F0值
100ml 250ml 500ml 115℃ (±1℃ )
115℃ (±1℃ )
115℃ (±1℃ )
32min
32min
32min
0.08MPa(
0.08MPa(
0.08MPa(
±0.005MPa)
±0.005MPa)
±0.005MPa)
≥ 8.0
≥ 8.0
≥ 8.0
9、灯检
已灭菌的半成品推至灯检理瓶机,开机,逐瓶上于转盘上,经传送带送入灯检室,在不反光的黑色
背景下逐瓶灯检,光源采用20W日光灯,照度为1000— 1500Lx,检品与眼睛的距离为20-25cm,检查标准按卫生部WS-362( B-121 ) -91 规定逐瓶直立、倒立、平视三步法旋转检视,每瓶检视时间不超过15秒,但不得少于 4 秒,取出不合格品并分因素暂放于不合格暂存间,按各品种要求进行回收或报废处理。
灯检每检视 2 小时必须停检,让眼睛休息20 分钟,灯检员每年必须检查视力一次,视力在0.9 以上并无色盲色弱等眼疾。
10、贴签包装
操作前必须核对待包装品的品名、批号、规格是否与批包装指令一致,有无清场合格证。无清场合
格证必须先清场合格后方可进行贴签包装。按计划指令领取所需标签、纸箱、装箱单等,先将标签逐一
盖好规定的批号,开贴签机贴签或手工贴签,批号必须字迹清晰、端正无误,贴签必须适中、端正、贴
牢、不皱折、不漏贴、不缺角等。贴好瓶签后小心装入纸箱内,不得短少、损伤瓶签,每箱放一张装箱
单,待每箱装满后封箱签封牢,堆码整齐,转运到成品待验库,由车间工艺员填写请验单,由QA抽样全检。
11、工作区域及清洁消毒方法
工作区域分一般生产区和控制区,控制区又分为100 级— 1 万级洁净区和 1 万— 10 万级洁净控制区及≥ 10 万级一般控制区。
部门:生产部题目:大输液生产工艺规程4/15
文件编号: STP-PC-99000( 01)新订:替代:起草:
部门审阅:质量审核:批准:
执行日:
变更记录:变更原因及目
的:
修订人:批准执行日:
工作区域及清洁消毒方法
岗位区域洁净度级别清洁消毒方法
制水一般生产区A每日用自来水冲洗、抹净,管道、罐
体蒸镏水清洗后用纯蒸汽灭菌。
洗瓶
理瓶一般生产区B每日用 0.1%新洁尔灭对设备、墙壁、
门窗抹净,地面用水拖净。
粗洗一般控制区>10 万级C每日用 0.1%新洁尔灭对设备、墙壁、
门窗抹净,拖净地面。
精洗洁净控制区1万级D每日用 0.1%新洁尔灭对设备、墙壁门
窗抹净,拖净地面,并紫外灯或臭氧
灭菌 30 分钟。
漂洗薄膜洁净控制区1万级每日用 0.1%新洁尔灭对设备、墙壁、
门窗抹净,拖净地面,并紫外灯或
臭氧灭菌 30 分钟。
洗胶塞
粗洗一般控制区>10万级每日用 0.1%新洁尔灭对设备、墙壁、
门窗抹净,拖净地面。
精洗洁净控制区1万级每日用 0.1%新洁尔灭对设备、墙壁、
门窗抹净,拖净地面,并紫外灯或臭
氧灭菌 30 分钟。
配液洁净控制区1万级每日用 0.1%新洁尔灭对设备、墙壁、门
窗、抹净,拖净地面,并紫外灯或臭氧
灭菌 30 分钟。罐体及管道、滤器清洗后
蒸汽灭菌 30 分钟。
灌装洁净区1万— 100 级每日用 0.1%新洁尔灭对设备、墙壁、门窗
抹净,拖净地面,并紫外灯对照30分钟,
臭氧灭菌 30 分钟。
轧盖一般控制区>10万级每日用 0.1%新洁尔灭对设备、墙壁、门窗
抹净,拖净地面。
灭菌一般生产区每周用湿毛巾抹净设备、门窗,地面用1%
来苏水或 2%苯酚拖净。
灯检一般生产区每周用湿毛巾抹净设备、门窗,地面用1%
来苏水或 2%苯酚拖净。
部门:生产部题目:大输液生产工艺规程5/15
文件编号:部门审阅:STP-PC-99000( 01)新订:
质量审核:
替代:
批准:
起草:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
包装一般生产区每周用湿毛帽抹净设备、门窗,地面用1%
来苏水或2%苯酚拖净。
12、菌落检查
菌落检查由QA 部指定专人负责完成。
洁净区每班做一次菌落检查,平均菌落数≤ 3 个
洁净控制区每天做一次菌落检查,平均菌落数≤10 个
一般控制区( >10 万级)每月做一次菌落检查,平均菌落数≤15 个;
三、处方和依据(详见各品种工艺卡)
四、技术安全
1、按 GMP 要求,药品生产必须严格执行经批准的各项规章制度、规程(
作必须“按章执行” ,特别是以下制度要时刻牢记并执行。
①双人复核制:计算时
称量时
投料时
检测时
②工序清场制:每一工序结束时
每一批生产结束时
更换品种时
更换规格时
包装结束时或开始时
③关键点质控制(详见关键质控要点)
④半成品质量检查制:薄膜精洗水检查
胶塞精洗水检查
玻瓶精洗水检查
稀配液中间检验
灌封品中间检查
SOP)和指令,一切操
⑤安全生产制:
2、凡电器设备只能电工维修,各岗位的机器设备均由专人负责操作并有固定替身,非指定人员
不得擅自开动。
3、压力设备(配液罐、灭菌柜等)必须定期检查。
4、生产过程中发现电机外壳过热和运动中发生异常声音时,必须立即停车检查,所有机器运转
部份在转动时禁止用手或其它物件接触。
5、每当机器进行调整后,一定将松过的螺钉紧固好才能开机。
6、灭菌时,从关柜门开始进汽进水到停止灭菌开柜门止,操作人员不允许离开工作岗位,随时
观察并如实记录灭菌情况,严禁一个人进行灭菌操作。开灭菌柜门前必须确认:①灭菌柜处于“准
备”或“结束”状态;
②灭菌柜内压力指示为 0Mpa;③灭菌柜内温度小于冷却温度(一般为 60℃)。开柜门拉出货物时必须穿戴
好防护面罩。
部门:生产部题目:大输液生产工艺规程6/15
文件编号:部门审阅:STP-PC-99000( 01)新订:
质量审核:
替代:
批准:
起草:
变更记录:执行日:
变更原因及目的:
修订人:批准执行日:
7、使用浓酸、浓碱或其它有腐蚀性物品时,必须戴防护手套、面罩、不得裸手操作。
8、岗位操作人员必须按有关规定穿戴好工作衣、帽、袜子及口罩,定期换洗、消毒;各岗位工
作服不得穿出本岗位规定范围,未穿戴工作服和劳保用品,不准上岗操作。
五、工艺卫生
1、进入车间所有人员必须更衣更鞋,穿戴合格并净化处理后才能进入不同区域和岗位。
①一般生产区穿分体夹克或衣裤、戴帽和口罩、穿工作鞋或白大褂(非岗位人员)。
②一般控制区穿分体夹克或衣裤、戴帽和口罩,穿拖鞋。
③洁净控制区二次更衣鞋分体式或连体式洁净衣、帽和口罩、工作鞋。
④洁净区二次更衣鞋连体式洁净衣、帽和口罩、工作鞋。
2、生产性人员每年必须体检一次并建立健康档案,传染病患者不得从事接触药品的生产。
3、在生产过程中,不准用手直接接触药液。灌装间不准裸手操作。
4、保持生产操作场所环境整洁,通风(净化后)良好,各墙面(含天棚)无剥落及霉斑、无缝
隙,工具、用具定点存放,物料定点堆放,走廊清洁通畅,无杂物存在于操作场所。所有物
料的外包装不准进入生产区。
5、生产场所不准吸烟、吃食品,不得带入或存放与生产无关的物品。
6、每天生产完毕或更换产品时均要做好地面、设备、工具的清洗消毒工作,一般生产区每周大
清扫一次,控制区按规定每天至少用消毒液擦拭门窗、地面、桌面、设备面和墙面一次,公
共场所每天进行清扫,保持清洁卫生。
7、进入控制区、洁净区的人员,操作前必须先洗手,再用0.1%新洁尔灭浸泡或淋洗消毒,再纯
水冲净。进入洁净区人员不准留指甲、不准化妆或佩戴饰物(含手表),患有感冒、外伤及其
它法定传染病,必须立即调出车间。
8、控制区内不准游岗、串岗,不准高声喧哗,不准打喷嚏、咳嗽和吐痰。不准有其它不卫生
行为。
六、劳动保护
1、所有岗位操作人员必须按规定更衣鞋合格后才能上岗;
2、所有浓酸、浓碱或其它有腐蚀性的物品一般在车间外配制完毕再带入或有耐酸碱手套和防护
面罩保护下才能作业;
3、使用压力容器时必须小心谨慎,要穿戴好防护面罩;
4、进入车间的人员必须戴帽,女士不宜留长发,以免有传动装置带来意外;
5、灯检员每连续灯检二小时后必须让眼睛休息20 分钟并每月发放鱼肝油丸保护眼睛;
6、所有操作人员必须注意个人卫生,勤洗澡勤换衣,并按规定领取劳保用品。
七、主要技术经济指标
1、理论产量
①500ml 规格
总配制量(升)
理论产量(瓶) =————————
0.51( 升 /瓶 )
②250ml 规格
部门:生产部题目:大输液生产工艺规程7/15
文件编号:部门审阅:STP-PC-99000( 01)新订:
质量审核:
替代:
批准:
起草:
变更记录:执行日:
变更原因及目的:
修订人:批准执行日:
总配制量(升)
理论产量(瓶)=————————
0.255(升 /瓶 )
③100ml 规格
总配制量(升)
理论产量(瓶) =————————
0.102(升 /瓶 )
2、总配制量
总配制量(升) = 一次投料配制量 + 回收量(折纯)
成品入库数(瓶)
3、成品率( %) =————————× 100
理论产量(瓶)
成品入库数(瓶)—回收数(折纯
4、一次成品率( %) =———————————————× 100
一次投料理论产量(瓶)
成品入库数
5、灯检合格率( %) = ——————————————× 100
成品入库数 +灯检不合格数
成品入库数
6、瓶子利用率( %) = ————————× 100
领用玻瓶数
总投料量(不折纯)
7、消耗定额( kg/ 万瓶) =———————
成品入库数(万瓶)
8、成品入库数=成品数—(留样数+检验取样数)
各品种消耗定额指标
品名原辅包材名单位消耗定额
5%葡萄糖注射液葡萄糖kg/ 万瓶283
10%葡萄糖注射液葡萄糖kg/ 万瓶567
葡萄糖氯化钠注射液葡萄糖kg/万瓶283
氯化钠kg/万瓶52复方氯化钠注射液氯化钠kg/万瓶52
氯化钾kg/万瓶 1.7
部门:生产部题目:大输液生产工艺规程8/15
文件编号: STP-PC-99000( 01)新订:替代:起草:
部门审阅:质量审核:批准:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
氯化钙kg/ 万瓶 1.9氯化钠注射液氯化钠kg/ 万瓶53
甘露醇注射液甘露醇kg/ 万瓶568
甲硝唑注射液甲硝唑kg/ 万瓶 5.7
氯化钠kg/ 万瓶9.1
输液玻瓶个 /万瓶10500(5%)
橡胶塞只 /万瓶10100(1%)
铝塑盖个 /万瓶10300(3%)
标签张 /万瓶10200(2%)
纸箱个 /万瓶515(3%)八、包装要求与贮存方法
(一)装箱内容
包装规格每箱装量(瓶)每瓶贴标签(张)箱内附装箱单(张)500ml2011
250ml3011
100ml100110
(二 )纸箱规格
装箱规格尺寸(长×宽×高)卡子(长×宽×高)纸板公差
500ml 250ml 100 ml 427× 335× 210
445× 370× 170
590× 293× 270
422× 330× 200
440× 365× 165
五层瓦楞
五层瓦楞
五层瓦楞
6—7mm
6—7mm
6— 7mm
± 2 mm
± 2 mm
± 2 mm
(三)纸箱质量要求:
①四角方正,棱角硬直,无涂块,不起泡,不分层,造型美观、平面随压力符合要求;
②尺寸大小应符合规定,产品包装时,不宽不挤,大小适宜;
③印字清晰,颜色鲜明,端正不歪,装订牢实。
(四)包装要求和贮存方法
①标签专人领取,按每日批生产指令限额领取,领取后专人专柜专锁保管,剩余和报废的标签,
由操作员与质监员共同销毁并记录,多余的未打批号的标签退回,经手人签字并记录;
②标签领回后逐一盖好(印好)批号,贴签要端正,位置适中;
③每批结束时统计数量是否与灯检数量相符,防止差错,零头不足一箱时,贮放一房,等有同品
种、同规格时混合装箱,箱签上盖上两批批号;
④将包装好的成品运入成品待验库,分批、分品种堆放;注意防热、防潮、小心轻放,切勿倒
置,码整齐,挂贴“待验”标示,填写成品请验单,由QA 部全检合格并出具合格证,将“待
部门:生产部题目:大输液生产工艺规程9/15
文件编号: STP-PC-99000( 01)新订:替代:起草:
部门审阅:质量审核:批准:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
验”标示换成“合格”标示,等待出厂销售;若经QA 部全检不合格,将“待验”标示换成“不合格”标示,移至“不合格品”库,通知生产部处理。不合格品在库不得超过 6 个月。不合格品不准出厂。
九、关键质检要点(下表)
工 质控项目
质控要点
检查频率
序
常水 机械净化处理后应符合饮用水标准
1 次/季
去离子水 电导率≤5μs/cm ,其它符合蒸镏水标准
1 次/2小时 超纯水
全检
中国药典(最新版)注射用水标准
1 次/月
pH 、氨 CI -、电导率 按药典单项标准检查,电导率≤2μs/cm 1 次/天 制 注射 全检
中国药典(最新版)注射用水标准
1 次/月 水
用水 pH 、氨 CI -、电导率 按药典单项标准检查,电导率≤1μs/cm 1 次/2小时 贮水
贮水罐 蒸镏水清洗后蒸汽灭菌
1 次/天
贮罐材料 316L ,呼吸器带疏水性过滤器
贮水时间
洗瓶水贮存不超过 12小时,配制水不超过 8小时或者在
每天检查记录
80℃贮存不超过 24小时
洗瓶室
分成理瓶、粗洗、精洗隔断,精洗空气洁净度 10万——1
洗 万级
瓶
洗瓶后澄明度
装洁净水检查,澄明度检查合格;不得有残留水滴, 4 次/天
PH5.0-7.0
活性炭用量 按工艺卡规定 每批检查 浓 浓配浓度
按工艺卡规定 每批检查 煮沸时间
按工艺卡规定 每批检查 配
粗滤
除净炭未 钛棒每天清洗消毒
浓配空气洁净度 10万—1 万级 1 次/月
药液含量限度 按工艺卡规定
1 次/批
稀 pH 值 按工艺卡规定
1 次/批
配
精滤
钛棒(0.65μm ),微孔(0.45μm 或 0.22μm ) 每天清洗消毒 稀配空气洁净度
1 万级
1 次/月
100级别或 1 万级环境下局部 100级
1 次/月
空气洁净度
尘埃粒子数
压差 1 次/月
菌落数
1 次/天
药液澄明度
澄明,无白块、异物等,小白点 500ml ≤3 个
1 次/批
不合格≤2%
灌
500 ml 装:503—508 ml 1 次/2小时
装
装量检查
250 ml 装:252—254 ml
100 ml 装:102—104 ml 存放时间 稀配到灌装灭菌≯6小时 随时检查 薄 漂洗 95%乙醇浸泡用 0.65μm 微孔滤膜过滤的注射用水漂洗 随时检查 膜 洗水澄明度 澄明度不得有小白块(200ml 装瓶检查) 随时检查 胶塞
精洗水
洗水澄清,无氯离子反应,不得有白块,允许少量小白点 随时检查
(20个—50个)
轧 铝盖检查
塑盖上厂标、厂名,轧盖牢固(三指法),边缘整齐光滑 随时检查
盖
灭菌参数 灭菌温度、灭菌时间、冷却温度、室内压力、F 0值 随时检查 灭 自动记录
自动记录情况
随时检查 菌
半成品存放时间 灌装至灭菌≯2小时
随时检查
灭菌关键条件 115℃,32分钟或工艺卡规定
随时检查 灯 已灭菌标示 每车有“已灭菌/可以灯检”标示牌
随时检查 检
灯检标准
参考卫生部 WS 1-362(B -121)-91执行
随时检查
工质控项目质控要点检查频率序
标签专人保管、限额发放、剩余及损坏监督销毁1次/批
包贴签端正斜度≤3mm,不合格率≤3%1次/批装箱数量准确无误,不损坏瓶签随时抽查
装
封箱封箱前检查数量足否,封签贴牢随时抽查待验库送检每批≥8 瓶,送样全检每批查记录十、半成品质量标准(指标)、成品及原辅料质量标准依据
输液半成品质量标准(指标)
产品名称
组成
葡萄糖注射液葡萄糖
葡萄糖氯化钠注射葡萄糖
液
氯化钠
氯化钠注射液氯化钠
复方氯化钠
总氯量
注射液
甘露醇注射液甘露醇
甲硝唑注射液甲硝唑
规格标示装量
100ml 抽出量不低于100 ml
250ml 抽出量不低于250 ml
500ml 抽出量不低于500
ml
含量pH值
标示量内控标准标示量内控标准
95-105%98—102% 3.2—5.5 3.8—4.2
95-105%98—102% 3.5—5.5 4.0—4.5
95-105%98—102%
95-105%98—102% 4.5-7.0 5.2-5.6
0.52-0.5898-102% 4.5-7.0 5.2-5.6
95-105%98-102% 4.5-6.5 5.0-5.5
93-107%98-102% 4.5-7.0 5.0-6.5
药典规定附加量内控装量
2 ml102-104 l m
5 ml252-254 l m
10 ml503-508 l m
色泽澄明度
成品药液
500ml 无白点、
异物小白点
无色无色澄明,,≤1 个
无色无色澄明,≤1 个
无色无色澄明,,≤1 个
无色无色澄明,,≤1 个
无色无色澄明,≤1 个
无色或几乎无色无色澄明,≤1 个
灯检品内控标准
按标准抽查次品≤3%
按标准抽查次品≤3%
按标准抽查次品≤3%
原辅料及成品质量标准依据
品名质量标准依据
葡萄糖中国药典95年版二部Р .845氯化钠中国药典95年版二部Р .945氯化钾中国药典95年版二部Р .947氯化钙中国药典95年版二部Р .943甘露醇中国药典95年版二部Р .85甲硝唑中国药典95年版二部Р .152各种氨基酸日本味之素质量标准( 92 版)
大输液生产工艺规程
部门:生产部题目:大输液生产工艺规程12/15
文件编号: STP-PC-99000( 01)新订:替代:起草:
部门审阅:质量审核:批准:
执行日:
变更记录:变更原因及目
的:
修订人:批准执行日:
原辅料及成品质量标准依据
品名质量标准依据
葡萄糖注射液中国药典95版二部Р .846
葡萄糖氯化钠注射液中国药典95版二部Р .847
氯化钠注射液中国药典95版二部Р .946
复方氯化钠注射液中国药典95版二部Р .495
甘露醇注射液中国药典95版二部Р .86
甲硝唑注射液中国药典95版二部Р .154
18—氨基酸注射液卫生部药品标准二部(六册)Р.88
十一、劳动组织和岗位定员
车间主任1人
技术主任1人
车间工艺员1人
车间统计员1人
现场质监员(专职)4人(二班)
配制组25 人(三班)
灌装组28 人(二班)
洗瓶组18 人(二班)
灭菌组24 人(三班)
灯检组30 人(三班)
包装组36 人(三班)
制水组6人(三班)
清洁组3人(二班)
空调及维修组10 人(三班)
合计188 人
部门:生产部题目:大输液生产工艺规程13/15
文件编号: STP-PC- 99000( 01)新订:替代:起草:
部门审阅:审核:批准:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
十二、设备一览表及主要设备生产能力
序号设备名称型号规格数量生产能力
1活性炭过滤机RT/ JL- 12 不锈钢 1 套
2多介质过滤机RT/ JL- 12 不锈钢 1 套
3微孔过滤机RT/ MF- 30× 9 不锈钢 1 套
41-2水泵CHI10 - 40 不锈钢 380V0.6KW 2 台
51-2捆扎机WG22X 380V 1KW 8× 8 2 台
61-2胶带封口机FJ56220V 0.18KW 2 台
71-2贴签机ZT20/1000380V2KW 2 台20- 80 瓶/分8螺杆式空压机(风冷)LU610 - 11A 1.85M 3/分 380V 11KW 1 台
9储气罐0.6M 3Ф 700× 2045 1 台
10干燥器LD98 1.63M 3 /分220V 0.46KW 1 台
111-2水泵TS125 - 100- 315C 380V 11KW 2 台
12螺杆冷冻机30HK - 161 380V118KW 1 台
131-2水泵IS125 -100- 315 380V 15KW 2 台
14空调机组ZKW - 40 380V 37KW 1 台
15输送机 1 台
16外袋封口机 2 台
17软袋灯检机 1 台
18打印机 1 台
191-6软袋灌装机进口 6 台
20药液储罐1500LФ1000 × 1800 316L 1 台
21微孔过滤器5芯×10英寸316L0.2um 1 台
22微孔过滤器5芯×10英寸316L0.2um 1 台
23稀配罐1000L Ф1000 × 1400 316L 1 台
24泵CHI2 - 50 不锈钢380V 0.6KW 1 台
部门:生产部题目:大输液生产工艺规程14/15
文件编号: STP-PC- 99000( 01)新订:替代:起草:
部门审阅:审核:批准:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
251-2泵CHI2 - 50不锈钢380V0.6KW 2 台
26回收罐500LФ 600× 900316L 1 台
27泵CHI2 - 50不锈钢380V0.6KW 1 台
28氮气缓冲罐Ф 400× 1154 1Cr18Ni9Ti1台
29氮气分气罐Ф 159× 1200 1Cr18Ni9Ti 1 台
30胶塞酸处理罐500L Ф 1000× 1400搪瓷1台
31胶塞碱处理罐500LФ 1000× 1400搪瓷 1 台
32胶塞清洗罐500LФ 1000× 1400 1Cr18Ni9Ti1台
33薄膜漂洗机LXG- F60Q 220V 0.18KW 6000张/次 1 台
341-2洗衣机滚筒烘干式220V 0.5KW2台
35泵CHI2- 40 380V 0.6KW1台
361- 2泵CHI2- 50 380V 0.6KW2台
371- 2药液储罐2500LФ 1200× 2200 316L2台
381-2微孔过滤器3芯× 20 英寸 0.65um 316L2台
391-2微孔过滤器3芯× 20 英寸 0.65um316L2台
401- 2稀配罐2000LФ 1300 ×1600 316L2台
411-2钛棒过滤器7 芯× 500316L1um 2 台
421-2泵CHI2 - 30380V0.6KW 2 台
431-2浓配罐1000L Ф1000 × 1400 316L 2 台
44制袋机进口 1 台
451-2理瓶机TLP380V 0.3KW 2 台
461-2外洗机QJW100 / 500 380V 0.8KW 2 台15- 60 瓶/分47泵CHI2 - 30380V0.6KW 1 台
481-2碱罐500L Ф 600× 900 2 台
491-2粗洗机QJS3/ 100- 500 380V 2.5KW 2 台40- 60 瓶/分501-2精洗机QSS2/100- 500 380V 1.5KW 2 台
部门:生产部题目:大输液生产工艺规程15/15
文件编号: STP-PC- 99000( 01)新订:替代:起草:
部门审阅:审核:批准:
执行日:
变更记录:变更原因及目的:
修订人:批准执行日:
511-2灌装机GXZ12380V 1.5KW 2 台40- 60 瓶 /分521-2胶塞翻塞机DSFI380V 2.8KW 2 台
531-2轧盖机FGSI38V 1.5KW 2 台40- 60 瓶 /分541-3快速冷却灭菌器PLMQ - 4.8380V 4.1KW
220V0.6KW 3 台
551-8风机FA- 40C 380V 1KW8 台
561-2灯检线UDJ4380V1KW 2 台
571-2理瓶机TLP380V0.3KW 2 台
581-2列管多效蒸馏水机
- 5
380V 1.5KW 2 台2000L/ 小时LD - 2000
59泵MC ×80/ 60 380V0.7KW 1 台60离子水储罐10TФ 1800× 6000不锈钢1台61超滤机RT/UF-8 380V 0.6KW 1 台621-3中间水箱P.E.47Ф1600 × 4000 3 台63离子交换器RT/ IEM - 8 Ф 800不锈钢 2 台64耐酸泵380V0.7KW 1 台65碱槽700× 1200塑料 1 台66酸槽700× 1500塑料 1 台67耐腐泵380V0.7KW 1 台68泵VIR16 - 30380V3KW 1 台69电渗析RT/ DS- 10 380V 5KW 1 台70泵VIR16 - 30380V3KW 1 台711-2蒸馏水储罐6000LФ 1600×3600316L 2 台721-2高低位槽Ф 500 × 2400 316L 2 台73冷却塔100J380V Ф 24005KW玻璃的 1 台74燃灶锅炉DZL4 - 1.25 1 台
非PVC软袋大输液的生产工艺及市场前景
非PVC软袋大输液的生产工艺及市场前景 非PVC软袋大输液的生产工艺及市场前景 摘要 目前国内软袋包装大部分仍是以玻璃瓶为主,只有少数大型制药企业有能力生产非PVC 软袋输液,因此非PVC软袋大输液的生产技术将成为今后国家鼓励发展和使用的高新技术产品之一。非PVC 软袋技术在发达国家临床应用已十余年,而在我国则是刚刚起步。与传统玻璃瓶及塑料瓶输液相比,非PVC 多层共挤膜输液工艺设计中的关键生产工序实现全密闭,有效避免了二次污染。在使用过程中,非PVC 多层共挤膜包装输液能够依*自身的张力将药液压迫滴出,无需形成空气回路,是一种全新概念的全密闭静脉输液产品。而且该种产品具有重量轻、密闭强度高、不易破碎、不怕冷冻及便于运输、节省空间等优点。非PVC新型输液包装材质机械强度高、表面光滑,而且能够阻止水气渗透,不含任何对人体有害的增塑剂、填充剂、润滑剂,无热源、无溶出物、无不溶性微粒,这些指标均达到或超过了发达国家药典的标准。可以说,非PVC 软袋输液是输液生产工艺和技术的一场革命。本文对非PVC在药品输液剂包装中的使用进行了分析,对我国及FDA对药品内包材料的要求作了简要的阐述,分析了目前输液剂包装存在的不足,阐述了非PVC膜的特点及在国内输液剂中使用的可能性和在国际上使用的发展趋势。 关键词输液剂;非PVC;生产工艺;应用 目录 引言 (3) 1研究背景与目的 (3) 1.1研究背景 (3) 1.2研究目的 (3) 2我国非PVC软袋大输液的现状 (4) 2.1当前软袋大输液发展情况 (4) 2.2我国非PVC软袋大输液的应用情况 (4) 3非PVC软袋大输液的可行性 (5) 3.1目前其它类输液剂包装存在的不足 (5) 3.2应用非PVC软袋大输液的可行性 (6) 3.3非PVC软袋大输液的优点 (6) 4非PVC软袋大输液生产的工艺 (8) 4.1基本工艺流程 (8) 4.2非PVC软袋大输液大输液生产工艺 (9) 5非PVC软袋大输液的市场前景 (9) 结语 (11) 致谢 (11) 参考文献 (12)
注射用水工艺流程
合肥工业大学2011年大学生暑期“三下乡”社会实践活动 优秀调查报告(论文)申报表 报告(论文)标 注射用水工艺流程题 申报者情况第一作者所在学院 医学工程学 院 学历本科专业年级 合作者所在学院 医学工程学 院 学历本科专业年级 指导教师工作单位 医学工程学 院 职务(职称)辅导员 摘要: 注射用水:指符合中国药典注射用水项下规定的水。注射用水为蒸馏水或去离子经蒸馏所得的水,故又称重蒸馏水。 注射用水是生产塑瓶输液的主要原料,注射用水是否合格直接影响产品的质量,是塑瓶输液生产中极其重要的环节。因此对于注射用水生产的各个环节行业内有严格的规定。 关键字:注射用水生产工艺,注射用水的质量检测 校社会 实践领 导小组 意见 学院(社团)推 荐意 签章: 日 签章: 年月年月日
注射用水工艺流程 、摘要 注射用水:指符合中国药典注射用水项下规定的水。注射用水为蒸馏水或去离子经蒸馏所得的水,故又称重蒸馏水。 注射用水是生产塑瓶输液的主要原料,注射用水是否合格直接影响产品的质量,是塑瓶输液生产中极其重要的环节。因此对于注射用水生产的各个环节行业内有严格的规定。 1、对贮水容器(贮罐)的基本要求: ①采用316L不锈钢制作,内壁电抛光并作钝化处理; ②贮水罐上安装0.2 am疏水性的通气过滤器(呼吸器),并 可以加热消毒或有夹套; ③能经受至少121 C高温蒸汽的消毒; ④排水阀采用不锈钢隔膜阀; ⑤若充以氮气,须装0.2 勺疏水性过滤器 过滤。 2、对管路及分配系统的基本要求: ①采用316L不锈钢管材内壁电抛光作钝化处理; ②管道采用热熔式氩弧焊焊接,或者采用卫生夹头分段连 接; ③阀门采用不锈钢聚四乙烯隔膜阀,卫生夹头连接; ④管道有一定的倾斜度,便于排除存水;
氧氟沙星注射液生产工艺规程
制药有限公司 氧氟沙星注射液生产工艺规程 颁发单位:GMP办公室
工艺规程批准程
目录 1. 剂型、规格 (3) 2. 生产工艺流程 (3) 3. 操作过程及工艺条件 (4) 4.质量控制要点 (7) 5.设备一览表、主要设备生产能力 (7) 6.工艺过程中的SOP (8) 7.中间产品的控制 (9) 8.验证工作要点 (9) 9.工艺验证的具体要求 (10) 10.工艺卫生和环境卫生 (10) 11.劳动组织及岗位定员 (10)
一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。10ml:0.2g 二、流程图:氧氟沙星注射液生产工艺流程图
三、操作过程及工艺条件 1 生产前的检查与确认 1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格 证”。 1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上 “合格”标示。 1.3 所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能 使用。 1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。 1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是 否已准备齐全。 1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在 30%-65%)。 2 洗瓶、干燥灭菌 2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。在 理瓶室将安瓶的合格品摆满瓶盘。 2.2粗洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯 化水洗安瓿瓶内外壁。将安瓿瓶盘对称放置,固定在甩水机上,启动 甩水机,甩水处理8分钟,至安瓶甩干。重复上述操作。 2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的 注射用水清洗安瓿瓶内外壁,重复粗洗步骤。定时检查安瓿的清洁度: 目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。 2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,消除热 原。 2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。洗瓶岗 位按清场SOP进行清场,并填写生产记录。 3 称量、配料 原辅料除去外包装、经净化处理后,经缓冲区进入称量室。对称量室 内的案称、天平、量筒等计量器具进行校零。称量人核对原辅料、中
恩诺沙星溶液生产工艺规程
制药有限公司 恩诺沙星溶液生产工艺规程 颁发单位:GMP办公室
工艺规程批准程序
目录 1、产品概述 (3) 2、生产的工艺流程图 (4) 3、操作过程及工艺条件 (4) 4、生产质量控制要点 (6) 5、设备一览表及主要设备生产能力 (6) 6、工艺验证及具体要求 (7) 7、中间品的控制 (7) 8、验证工作要点 (7) 9、工艺卫生和环境卫生 (7) 10、技术经济指标计算 (8) 11、技术安全及劳动保护 (9) 12、劳动组织与岗位定员 (9)
一、产品概述 (1)产品名称 商品名: 通用名:恩诺沙星溶液 (2)剂型:溶液 (3)规格:500ml:25g;包装规格:500ml/瓶(4)处方:300L水+7.5kg恩诺沙星 (5)依据:二OO五版《中国兽药典》一部(6)有效期:二年 (7)成品贮存方法及注意事项: 成品贮存方法:遮光、密闭保存。 注意事项:按用法用量使用。 (8)原辅材料、半成品和成品质量标准:参见:塑料瓶质量内控标准 标签、说明书内控质量标准 纯水内控质量标准 恩诺沙星内控质量标准 恩诺沙星溶液半成品内控质量标准 恩诺沙星溶液成品内控质量标准 (9)原辅材料贮存注意事项: 贮藏:遮光、密封,在阴凉处保存(10)半成品检查方法及生产质量控制 恩诺沙星口服液半成品检验标准操作规程(11)包装要求:20瓶/件 (12)标签、说明书(附样本):
二、流程图: 注:加粗部分为主要控制点 三、操作过程及工艺条件 1 生产前的检查与确认 1.1是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。 1.2检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格”标示。 1.3所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能使用。 1.4 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。 2 称量、配料 2.1原辅料或中间产品,除去外包装、经净化处理后,经缓冲区进入称量室。对称量室 内的案称、天平、量筒等计量器具进行校零。称量人核对原辅料、中间产品的品名、
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点 -------------制备注射用水 一.用于蒸馏器 1)水源:去离子水 2)冷却水:洁净的软水(即生活用水) 二.蒸馏水质量检查 1)生产时:每台每隔2小时检查氯化物,酸碱度,易氧化物的铵盐2)贮藏时:每星期全项检查一次 三.蒸馏水贮藏条件 1)容器:不锈钢罐或搪瓷罐 2)温度:80摄氏度以下 3)时间: 不超过12小时 -------------洗输液瓶 一.常水冲洗 1)温度: 60摄氏度~70摄氏度 2)压力: 不低于9.81×10Pa 3)时间: 不低于三秒 4)次数: 2~3次 二.精洗 1)次数: 2~3 次 2)压力: 不低于9.81×Pa 3)时间: 不少于3秒 4)末道滤材: 0.8~1.2um微孔滤膜 5)蒸馏水澄明度: 200ml容量瓶不得有可见异物 -------------配液 一.浓配 1)活性炭用量: 0.02%(g/ml) 2)煮沸时间: 10~15min 3)药液浓度不低于50% 二.稀配 1)活性炭用量0.01%(g/ml) 2)药液温度: 40~60摄氏度 质量检查: 1)含量:97.5%~102.5%
2)PH: 应符合规定 三.滤材 1)炭脱: 砂棒或钛合金制成的滤棒 2)初滤: 垂熔玻璃滤器 3)精滤: 0.8~1.2um 微孔滤膜 四.微孔滤膜 1)磨砂棒灯检: 均无亮点 2)起泡点试验: 合格 五.无菌要求 配料间空气菌落数: 9cm培养皿,暴露空间30minih 小于15个 六.药液温度控制: 含盐品种: 40~50摄氏度 七.药液温度控制: 含糖品种: 50~60摄氏度 -------------洗涤纶薄膜 质量要求 1)乙醇浓度: 95% 2)浸泡时间: 大于8小时 3)加盐煮沸: 100摄氏度. 30min,消除静电效应 4)漂洗水澄明度: 200ml容量瓶仅允许有微量白点 -------------洗涤橡皮塞 一.NaOH 1)浓度: 1%(g/ml) 2)温度: 100摄氏度 3)时间: 30分钟 二.HCl 1)浓度: 1%(g/ml) 2)室内温度15~25摄氏度浸泡 3)时间30分钟 三.洗胶塞水澄明度检查: 200ml容量瓶检查允许微量白点 -------------灌装 一.药液澄明度: 200ml容量瓶检查应无异物 二.容量 1)500ml : 500~510ml 2)250ml : 250~255ml 三.药渡稀释到灌装时间: 不超过4小时 四.空气菌落数: 9cm培养皿,暴露空间30min<10个 -------------轧盖
小容量注射液生产工艺规程
制药有限公司 小容量注射液生产工艺规程 文件编号:1 颁发单位:GMP办公室
工艺规程批准程序 1. 剂型、规格 (2) 2. 生产工艺流程 (2) 3. 操作过程及工艺条件 (3) 4.质量控制要点 (6) 5.设备一览表、主要设备生产能力 (6) 6.工艺过程中的SOP (7) 7.中间产品的控制 (8) 8.验证工作要点 (8) 9.工艺验证的具体要求 (9) 10.工艺卫生和环境卫生 (9) 11.劳动组织及岗位定员 (9)
一、制剂类型:最终灭菌小容量注射液,10ml规格,安瓿瓶包装。 二、流程图:小容量注射液生产工艺流程图
三、操作过程及工艺条件 1 生产前的检查与确认 1.1 是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格 证”。 1.2 检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上 “合格”标示。 1.3 所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能 使用。 1.4 检查工艺用水是否新鲜制备,贮存不得超过24小时。 1.5 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是 否已准备齐全。 1.6 检查确认生产场所的温度是否在规定范围内(18-26℃,相对湿度在 30%-65%)。 2 洗瓶、干燥灭菌 2.1理瓶:根据“批生产指令”准备所需的清洁盘、领取必须的安瓶。在 理瓶室将安瓶的合格品摆满瓶盘。 2.2粗洗:把安瓿瓶盘放在不锈钢传送链条上,开动洗瓶机用高压循环纯 化水洗安瓿瓶内外壁。将安瓿瓶盘对称放置,固定在甩水机上,启动 甩水机,甩水处理8分钟,至安瓶甩干。重复上述操作。 2.3 精洗:用水温50--60℃,经孔径0.45um滤膜滤过的澄明度合格的 注射用水清洗安瓿瓶内外壁,重复粗洗步骤。定时检查安瓿的清洁 度:目检1000ml注射用水无可见异物,抽50支,毛、块≤2%。 2.4 干燥与灭菌:安瓿盘均匀放入烘干箱内,150℃烘干1小时,或350℃ 烘干5分钟,消除热原。 2.5 灭菌后的安瓿立即使用或清洁存放,贮存不得超过48小时。洗瓶岗 位按清场SOP进行清场,并填写生产记录。 3 称量、配料 原辅料除去外包装、经净化处理后,经缓冲区进入称量室。对称量室内的
500mL大输液车间生产工艺解析
目录 1 前言..............................................................................1.1 输液剂概念 (1) 1.1.1 输液剂的定义 (1) 1.1.2 输液剂的特点 (1) 1.1.3 输液剂的质量要求 (1) 1.1.4 输液剂的应用 (2) 1.2 输液剂生产工艺 (2) 1.3 设计任务 (2) 1.3.1 设计药品 (2) 1.3.2 设计任务简介 (3) 2 右旋糖酐70葡萄糖注射液简介 (3) 2.1 处方组成 (3) 2.2 药理作用 (4) 3 工艺流程设计 (4) 3.1 工艺流程简图 (5) 3.2 工艺流程论证 (7) 4 工艺计算 (13) 4.1 计算基准 (13) 4.2 物料衡算 (13) 5 定型设备选择 (14) 5.1 选择设备型号、规格、数量 (14) 5.1.1 BSY50/500型玻璃瓶大输液生产线 (14) 5.1.2 QG180型启盖机 (15) 5.1.3 QJW6型外洗机 (15) 5.1.4 QJB24(16)型超声波洗瓶机 (16) 5.1.5 GFA1型灌封机 (16) 5.1.6 上瓶机、卸瓶机、灯检机、贴签机 (17) 6 车间GMP设计要求 (20) 6.1 GMP简述 (20) 6.2 车间GMP设计要求 (20) 6.2.1 大输液生产车间设计一般性要求 (21) 7 车间工艺设计 (21) 7.1 生产工艺流程图 (21) 8 结束语 (22) 参考文献 (23)
1 前言 1.1 输液剂概述 1.1.1 输液剂的定义 输液(infusion solution)是通过静脉滴注输入体内的大剂量(一次给药在100mL以上)注射液。它不仅可以补充必要的营养、热能和水分,以维持体内水、盐(电解质〕的平衡,而且对改善血液循环,防止和治疗休克,调节酸碱平衡,稀释和排泄毒素,经静脉滴注给药等均有重要作用。通常包装在玻璃或塑料的输液瓶或袋中,不含防腐剂或抑菌剂。使用时通过输液器调整滴速,持续而稳定的进入静脉,以补充体液, 电解质或提供营养物质。例如:生理盐水, 等渗葡萄糖注射液, 水解蛋白注射液及右旋糖酐注射液等。近年又出现了治疗行输液。由于其用量大而且是直接进入血液的,故质量要求高,生产工艺亦与小针注射剂有一定差异。 1.1.2 输液剂的特点 输液剂能够补充营养、热量和水分,纠正体内电解质代谢紊乱;维持血容量以防治休克;调节体液酸碱平衡医学教育`网搜集整理;解毒,用以稀释毒素、促使毒物排泄;抗生素、强心药、升压药等多种注射液加入输液剂中静脉滴注,起效迅速,疗效好,且可避免高浓度药液静脉推注对血管的刺激。 1.1.3 输液剂的质量要求 除应符合注射剂一般要求外,尚有下列特殊要求:①应具有适宜的渗透压,等渗或略高渗;②输液的pH值力求接近人体血液的pH值;③应无毒副作用,输入体内不会引起血象的异常变化,不损害肝、肾等脏器,某些输液还要求无致
冻干粉针生产工艺规程通则
1.目的:建立冻干粉针生产工艺规程,确保冻干粉针的生产过程按规定程序进行。 2.范围:适用于冻干粉针生产的全过程。 3.责任者:生产管理部技术员、质量管理部QA 监督员、车间工艺员、各工段长、操作工。 题 目 冻干粉针工艺规程通则 编 码 STP-TF (Z ) -1001-02 制 定 人 制定日期 审 核 人 审核日期 批 准 人 批准日期 颁发部门 生产管理部 颁发数量 3份 执行日期 替 代 STP-TF (Z ) -1001-01 分发部门 质量管理部、生产车间、生产管理部 变更原因 更换版本 共 11 页 第 1 页 黑龙江澳利达奈德制药有限公司 HEILONGJIANG AOLIDANED PHARMACEUTICAL CO.,LTD . 标 准 技 术 规 程
4.正文 冻干粉针工艺流程及环境区域划分示意图。 操作过程及工艺条件 4.2.1洗瓶 4.2.1.1瓶子需经纯化水或注射用水冲洗,最终淋洗用μm滤膜滤过的注射用水至少冲洗一次。 4.2.1.2洗净的瓶子应在4小时内灭菌,灭菌温度设为350℃,时间在5分钟以上。 4.2.1.3隧道式干热灭菌器已灭菌/去热原瓶子的出口应在单向流保护罩内存放。 4.2.2胶塞清洗:丁基胶塞需用注射用水清洗,至最终淋洗水符合质量要求。 4.2.3胶塞的灭菌:经125℃灭菌150分钟。 4.2.4称量 冻干粉针工艺流程及环境区域划分示意图。
图例 D 级区 C 级区 B 级区 ﹡ A 级区 非最终灭菌无菌冻干粉注射剂工艺流程及环境区域划分示意 图
4.2.4.1按处方及SOP要求配料,记录原辅料代号、品名、批号并做好称量记录。 4.2.4.2称量及计算必须复核,操作人、复核人应在记录上签名。 4.2.4.3剩余的原辅料应封口贮存。 4.2.4.4天平及其他称重设备每次使用前应校正,并定期由计量部门专人校验,校验结果应予记录。 4.2.5配液 4.2. 5.1配制药液用的注射用水必须符合要求。 4.2. 5.2按品种进行在线控制。如测定PH值等。 4.2. 5.3凡接触药液的设备、管道和容器具,应根据SOP进行清洁,必要时进行灭菌处理。 4.2. 5.4在线控制用计量器具应按SOP要求校验后方可使用。 4.2. 5.5按批生产记录及SOP的要求做好各种记录。 4.2.6过滤
口服液生产流程
口服液生产流程 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
现有业务流程调研报告 生产计划与控制模块 流程编号:AI-PP-010 流程名称:口服液生产流程 流程描述 本流程描述口服液制剂(太太、美容、静心)的生产工艺过程,包括提取、配液、灌装、包装等工序,并记录相关物流、单据的传递过程。 储运部:备料负责人 质保部:生产线检验人员 生产部:各车间主管,工艺负责人 1.生产计划部门根据《周生产计划》将《批生产记录》、《批包装记录》下达到储运部,储运部提前组织备料,将备好的原料和该批料的《批生产记录》存放于备料赞存室,待投料时领用; 2.提取车间按照《周生产计划》的要求领料,在接收批生产纪录、物料时,工序负责人应核对产品名称、批号,物料名称及数量、重量,确认无误后方可接收,接收物料后,工序负责人应确认该批料在那条提取线生产,无误后方可投料生产。生产中按照《批生产记录》及工艺规程的要求,进行浸泡、煎
煮、一次离心、浓缩、二次离心等工艺操作,及时监控并调整生产设备的各项技术指标,同时详细记录各生产工艺过程中的浓度、密度、PH值、温度等各项指标,生产出合格的口服液浓缩原液,暂存在储液罐中; 3.配液车间通过炼蜜工艺生产配液用辅料,生产完成后将生产信息如批号、日期等在《生产控制台帐》登记; 4.在配液车间按照《批生产记录》的工艺要求,经过配液、第三次离心、精滤、定容等四步工艺,并将生产的各项参数指标记录在《批生产记录》;5.在口服液车间的注塑工序,按计划生产10毫升、15毫升两种规格的PP瓶身、瓶底;其生产是根据库存量及月度口服液生产计划安排生产,货物存放由注塑工序自行管理; 6.灌装工序按照《批生产记录》及工艺规程的要求,经灌装、理瓶、打压、灭菌等四道工序,完成中间产品的生产; 7.灭菌完成后,质保部门对每批产品抽检,该检测时间为72小时(成品检测); 8.清洗中间产品,存放24小时待包装; 9.储运部按照《周生产计划》提前备料,将包装材料提前配货到包装车间,并由提料工将包装材料提前存放在包材周转区,等待领用; 10.包装车间,按照生产计划部门下达的《周生产计划》包装要求,到储运部包材周转区领取包材及《批包装记录》,同时复核包材编码、名称、数量等,无误后则上线首检生产包装入库。
口服液生产工艺规程参考
(前面目录包括1-3项参照片剂) 4 产品概述 4.1 产品名称及剂型 产品名称:鹿茸口服液 剂型:液体口服液剂 4.2产品特点 4.2.1规格:每支装10ml。 4.2.2性状:本品为橙黄色的澄清液体;气芳香,味甜。 4.2.3功能与主治:温肾壮阳,生精养血,补髓健骨。用于阳萎滑精,胃寒无力,血虚眩晕,腰膝痿软,虚寒血崩。 4.2.4用法与用量:口服,一次10ml,一日2次。 4.2.5贮藏:密封,置阴凉处。 4.3 处方来源 本处方出自。。。。。。。。。。。。(此处写自己处方来源,和标准号)
5.处方与依据 5.1处方 物料名称处方量批量 鹿茸(去毛) 10g 7.2kg 蜂蜜 700g 504kg 枸橼酸钠 10g 7.2kg 香精(乙醇溶解)适量适量 制成 1000ml 7.2万支 5. 2依据:部颁标准十一册九六版第176页 批准文号:国药准字Z22022653 6.生产工艺流程 见附录中附图:鹿茸口服液生产工艺流程图 7.原药材的整理炮制 《中国药典》2010年版一部 7.2 整理炮制依据:《中华人民国药典》2010年版(一部)(附录 D药材炮制通则)的方法和操作。 8 操作过程及工艺条件(按100付处方量) 8.2 提取 8.2.1 物料恒算 8.2.2提取当归、川芎 8.2.3操作人员将领取的当归、川芎,投入多功能提取罐中,加入药材重量的6倍量的饮用水,浸泡1小时后,将汽阀打开,同时打开冷却循环水,开始蒸馏。用洁净的容器收集芳香液(芳香液为白色浑浊液体),每隔2小时记录一次,直至芳香液无白色为止。在蒸馏过程中温度控制在95~100℃,夹层压力不得超过0.1MPa。芳香液放入洁净桶中,入冷库。 8.2.4设备操作执行型多功能提取罐标准操作规程。 8.2.5提取鹿茸口服液提取液
年产5200万瓶大输液葡萄糖注射液车间GMP工艺设计
年产5200万瓶大输液葡萄糖注射液车间GMP工艺设计
课程设计说明书 题目: 年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计 院系: 制药工程系 专业班级: 制药工程07-1班 学号: 2 0 0 7 1 3 2 8 6 学生姓名: 张世平 指导教师: 江章应 1 月 6 日
安徽理工大学课程设计(论文)任务书 化学工程学院制药工程系 学号学生姓名张世平专业(班级) 制药工程07-1班 设计题目年产5300万瓶大输液(葡萄糖注射液)车间GMP工艺设计 设技术参数计(1)年工作日 255天。 (2)生产班制一天两班,按每班6h生产计。(3)产品规格 500ml/瓶,玻璃瓶。 设计要求(1)根据上述条件设计一条完整的GMP生产线,写出完整的设计说明书,完成相关的附图。 (2)合理选择设计方案、工艺操作参数和计算公式,计算准确。 (3)设计计算说明书书写规范,文字准确简练,图标清晰规范。 (4)设备主要技术参数符合国家标准。 (5)前言、后记及参考文献。 工 作 量 设计计算说明书一份,GMP工艺流程图一份。 工作计划设计时间二周 12月27日—布置设计任务; 12月28日至12月31日)—完成设计方案的选定和初步设计计算; 1月4日至1月7日—完成设计计算说明书抄写及绘图、装订。 参考资料<制药工艺给水系统>、<制药工程课程设计>、<药厂反应工程与车间设计>等
指导教师签字系主任签字 12月20日 目录 第一章前言 1.1 简介 大输液为大容量注射剂,是中国医药行业五大类重要制剂之一,在临床上应用广泛。随着中国医疗技术的进步和人民生活水平的提高,近十多年来,输液剂的研究取得了令人瞩目的成绩。当前,中国经批准上市的新品种达100余种;输液产量从1990年的6.34亿瓶增加到的35亿瓶,输液剂的种类也发生了很大的变化,进一步满足了临床治疗的需要。 输液又名打点滴或者挂水。是由静脉滴注输入体内的大剂量 (一次给药在100ml以上)注射液。一般包装在玻璃或塑料的输液瓶或袋中,不含防腐剂或抑菌剂。使用时经过输液器调整滴速,持续而稳定地进入静脉,以补充体液、电解质或提供营养物质。由于其用量大而且是直接进入血液的,故质量要求高,生产工艺等亦与小针注射剂有一定差异。
注射剂生产工艺流程与厂方设计布局
2.2注射剂生产工艺流程简介 图1:注射剂生产流程图 由图1,注射剂生产流程图可以看出: 注射剂生产流程[4]主要包含以下工序:原料领料工序,要求领料人员进行原料品种、批号的复核。原料经过拆外包工序,由一般区经传递窗消毒和灭菌后,传递至十万级暂存称量间存放。称量工序,要求操作人员准确对衡器进行校验,进行称量时要求双人二次复核品种、批号和质量并做好标识。配液工序要求操作人员应完全遵守并按照生产指令和生产工艺卡片执行配液的各项操作,依此保证生产出合格的中间品(半成品)。半成品经取样交质保部检测,检测标准依据《兽药典》[5]半成品检验检测合格后,药液被送入灌装工序。 内包材领料工序,要求领料人员复核瓶子外观和规格。经过拆外包后,由一般区经传递窗传至十万级洗瓶间,由洗瓶机进行洗瓶。西林瓶经超声清洗后进行烘干灭菌工序,按照生产工艺要求和实际生产需要进行洗瓶,根据生产要求,合理控制洗瓶数量,待灭菌冷凉瓶后,由十万级经传递窗转移至万级灌装间进入灌封工序。灌封工序为灌装和加塞操作,其主要要求是最大限度保证装量均匀度。灌装加塞后由传送带送至十万级扎盖间,进行扎盖工序后,进行最终灭菌工序,按照每种产品的灭菌工艺要求灭菌。灯检工序要求按生产操作规程进行灯检,应明确标识待灯检品的品种、批号,灯检后的合格与不合格品,杜绝混批事故出现。灯检合格后,进行贴签。 外包装材料领料工序,其主要要求准确复核标签规格和批准文号。依据生产 贴 签 湿热灭菌 灯 检 包 装 装 箱 入 库 拆外包 原 料 配 液 称 量 灌 封药液 西林瓶 拆外包 洗 瓶 烘干灭菌 扎 盖 库房领料 批 生 产 指 令
指令进行打印标签和合格证,经复核无误后进行贴签。贴签工序要求按统一整齐美观标准进行贴签。包装后进行装箱,装箱要求产品按顺序摆放并放置合格证。包装完毕后进行入库。 3.生产车间介绍 3.1车间平面布局 图2:注射剂车间平面布局图 由图2,注射剂车间平面布局图可以看出: 注射剂车间包含非洁净区的普通区和洁净区的十万级区和万级区[6]。非洁净区(普通区)与洁净区的十万级区间人流通道设有缓冲间,物流通道设有传递窗,洁净区内不同洁净级别间,十万级区与万级区间同样设有缓冲间和传递窗。 非洁净区和洁净区分别配有各自级别内且独立的其他房间有洁具洗、洁具存和器具洗、器具存,以及洗衣间和整衣间。其中洁净区的洗衣间设在十万级区,万级服在洗衣间(十万级)洗衣后,经低温烘干臭氧灭菌柜(双扉互锁)灭菌后,由后门整衣间(万级)取出并整衣备用。 此外,普通区的地面为灰色环氧树脂涂层,十万级区为绿色环氧树脂自流平,万级区为黄绿色环氧自流平。
口服液工艺规程10ml
1. 主题内容 (2) 2. 适用范围 (2) 3. 责任 (3) 4. 产品名称及剂型 (2) 5. 产品概述 (2) 5.1.产品特点 (2) 6. 工艺流程图 (2) 7. 操作过程及工艺条件 (3) 7.1.处方 (3) 7.2.称量 (3) 7.3.配液 (3) 7.4.理瓶 (3) 7.5.洗瓶 (4) 7.6.灌装加塞轧盖 (4) 7.7.操作过程 (4) 7.8.灭菌 (4) 7.9.灯检 (4) 7.10.包装 (5) 8. 生产过程中重点工艺控制检查(包括中间体检查) (5) 9. 技术安全与劳动保护 (7) 9.1.工作场所 (7) 9.2.机器设备 (6) 9.3防火 (7) 9.4.工艺卫生 (7) 10.操作工时与生产周期 (7) 11.原辅料质量标准 (8) 12.包装材料质量标准 (8) 13.成品、半成品、中间体质量标准 (8) 14.劳动组织与岗位定员 (8) 15.主要设备一览表 (9) 16.原材料消耗定额 (9) 17.物料平衡、收率 (10)
1主题内容本文件规定了口服液的生产工艺过程、人员配备、原辅材料、包装材料的技术要求、安全生产要求、三废处理、物料平衡等内容。 2适用范围本文件是生产口服液的基础技术文件,用于指导生产操作。 3责任本文件由生产技术部负责起草,质量管理部经理审核,总经理批准。 4产品名称及剂型 产品名称:单糖浆口服液 汉语拼音名: dan tang jiang kou fu ye 5产品概述 5.1产品特点 5.1.1性状:本品为淡棕色的液体,无味 5.1.2规格:10ml/瓶 5.1.3类别:口服溶液剂 5.1.4用法与用量:-- 5.1.5贮藏:遮光,密封保存 5.1.6有效期:二年 6工艺流程图
鱼腥草注射液生产工艺规程资料
鱼腥草注射液 工 艺 规 程 ***********有限公司
鱼腥草注射液工艺规程 (一)产品概述 产品名称:鱼腥草注射液 剂型:最终灭菌小容量注射剂 规格:10ml/支,每1ml相当与原药材2g.。 性状:本品为无色或微黄色的澄明液体,有鱼腥味。 包装规格:10ml/支×5支/盒×120盒/箱 批量:60L 批准文号:待批 (二)处方和依据 1. 处方: 原辅料处方量规格每100支量鱼腥草 2.0kg 提取液 聚山梨酯80 3g 分析纯 氯化钠9g 分析纯 用注射用水稀释至1000ml 每千支量 鱼腥草20kg 提取液 聚山梨酯80 30g 分析纯 氯化钠90g 分析纯 注射用水适量稀释至10000ml
每批量 鱼腥草120kg 提取液 聚山梨酯80 180g 分析纯 氯化钠540g 分析纯 注射用水适量稀释至60000ml 2. 依据标准:《中华人民共和国兽药典》2005年版二部
(四)生产工艺操作过程及条件 4.1原辅料的领取 根据本工艺处方及生产指令,车间领料员填写领料单,经车间主任签字后,按“原辅料领用发放规程”到原辅料仓库领取辅料。领料前,认真核对所领辅料的品名、规格、批号、生产厂家用及检验合格报告单和辅料放行单,核对无误后,称取规定量的辅料,需拆零称量的辅料,可以整件领取到车间称量室称量,剩余辅料包装密闭,挂上物料标签,并填上品名、批号、当次称量日期、剩余量,称量人签名。仓库保管员及车间领料员分别称量及复核,并在领料单上签字,运至中药提取车间,同步填写生产记录,与下工序进行交接。 4.2提取冷凝 取药材饮片,置提取罐中,以水浸没药材为度,冷浸1小时,加温至100℃,提取2小时,收集冷凝液,用整洁密闭的容器在洁净取样车内进行提取冷凝液的采集(洁净级别不低于10万级)。转入小容量注射剂车间,进行注射剂的配制。 4.3 配制 4.3.1 配制的洁净级别为10万级洁净区。配制应检查生产指令内容与生产所用的原辅料进行核对。取检验合格的鱼腥草蒸馏和辅料聚山梨酯80、氯化钠,清洁后脱去外包,消毒后经传递窗传至配制室,核对生产指令及处方,然后进行称量。 4.3.2 先向浓配罐内加入1/3量的合格的注射用水。 4.3.3 按照原辅料顺序进行投料,搅拌至全溶。 4.3.4用钛棒过滤器过滤至稀配罐。加注射用水至规定体积。 4.3.5 测试半成品,检验合格后再用钛棒过滤器过滤,进行灌装。 4.3.6 称量前应该对原辅料品名、批号、生产厂家、规格等,应与检验报告单相符。调 换原辅料供应商时应有小样试验合格单或已经经过验证的报告。 4.3.7称重前应先对称量器(定期由计量部门校验)校零,确认无误后再进行称量,称量 时必须有复核人,操作人和复核人均应在称量原始记录上签名。处方必须复核按处方量的100%投料。 4.3.8配料前应对配料罐的容量进行验证。每一个配制罐必须标明配制液的品名、规格批号和配制量。 4.3.9配制时,每一种原辅料的加入和调制,必须由核对人确认并做好记录。配制过程中
口服液生产工艺规程
制药有限公司 口服液生产工艺规程颁发单位:GMP办公室
工艺规程批准程序
目录 1. 剂型、规格 (3) 2. 生产工艺流程 (3) 3. 操作过程及工艺条件 (4) 4.质量控制要点 (6) 5.设备一览表、主要设备生产能力 (6) 6.工艺过程中的SOP (7) 7.中间产品的控制 (7) 8.验证工作要点 (7) 9.工艺卫生和环境卫生 (8) 10.劳动组织及岗位定员 (8)
一、制剂类型:非最终灭菌口服液生产,500ml 规格,洁净塑料瓶包装。 二、流程图: 口服液生产工艺流程图 注:加粗部分为主要控制点 三、操作过程及工艺条件
1 生产前的检查与确认 1.1是否还留有前批生产的产品或物料,是否已清洁并取得“清场合格证”。 1.2检查确认生产现场的机器设备和器具是否已清洁并准备完毕挂上“合格” 标示。 1.3所使用原辅料是否准备齐全。是否有质量检验报告单,合格品才能使用。 1.4 检查确认与生产品种相适应的批生产指令、配套文件及有关记录是否已准备齐全。 2 称量、配料 2.1原辅料或中间产品,除去外包装、经净化处理后,经缓冲区进入称量室。 对称量室内的案称、天平、量筒等计量器具进行校零。称量人核对原辅料、中间产品的品名、规格、批号、合格证等确认无误后记录、签名。 称量必须复核,复核人对品名、数量确认无误后记录、签名。配好的批量辅料、中间产品装入洁净密闭容器中,附上标志,注明品名、规格、批号、数量称量人、日期。 3 配制、过滤 3.1口服液的质量,采用纯水配制。称量好的原辅料、中间产品加入到500L 配液罐中,注根据不同产品的工艺要求进行配制,配制好的药液应作性状、PH、相对密度、定性、定量等质量检验。配制中添加的防腐剂、抑菌剂的品种和用量应当无害、不影响疗效,对质量标准规定的检验方法无干扰。 3.2要求选用适宜的滤材及过滤方法(经验证确认的方法),过滤后药液先经 含量、澄清度检查合格后打入灌装室。 4 灌装、旋盖、封口 4.1瓶子必须是不低于10万级净化环境生产,并经微生物检验合格的产品。 灌装前检查所用瓶子是否有检验合格证,包装是否完好、洁净。开机灌装初期应检查装量,调整至装量符合要求后,正式操作。配制好的药液应在当天灌装完毕。 4.2旋盖、封口时检查瓶盖的紧密度,质量符合要求后正式操作。操作过程 中随时检查装量和旋盖、封口质量,剔除不合格品。
11恩诺沙星注射液生产工艺规程
目录1产品概述 2处方依据 3生产工艺流程及环境区域划分示意图4操作过程及工艺条件 5工艺卫生和环境卫生 6质量控制要点 7原辅材料、中间产品和成品的质量标准8技术安全及劳动保护 9原辅材料的消耗定额、技术经济指标10主要设备及生产能力 11劳动组织及岗位定员 12物料平衡以及各项指标的计算方法 13常用理化常数及换算表 14、附页
目的:建立恩诺沙星注射液生产工艺流程,使其生产能按规定的工艺程序进行。范围:适用于恩诺沙星注射液的生产。 职责:生产管理部、小容量注射剂生产车间及质量管理部对本规程的实施负责。规程: 1 产品概述 1.1品名及规格 通用化学名称:恩诺沙星注射液 规格:100ml:2.5g 包装规格:5 ml×5支×60盒 1.2剂型 小容量注射剂(安瓿瓶拉丝灌封) 2 处方与依据 2.1处方 2.2 依据: 1、《中华人民共和国兽药典》2000年版一部 2、批准文号:粤兽药字
3 生产工艺流程示意图 一般生产区为100000级区为10000级区
4 操作过程及工艺条件 4.1 安瓿的处理 4.1.1拆外包与理瓶: 按领料单领来安瓿,先在拆外包间做好安瓿箱的外清洁,除去外包装箱后由物料传递口传入理瓶间,将安瓿整理并清出破损安瓿后,装盘,送入粗洗瓶间,进行清洗。 4.1.2安瓿的清洗及干燥灭菌: 4.1.2.1首先按超声波洗瓶机操作要求调试机器,检查使用纯化水是否合格,合格方可 使用,检查超生波洗瓶机各运转部位的润滑情况,接通电源,开动超生波洗瓶机试运行。一切正常后,将安瓿托盘置于安瓿洗瓶机清洗槽内,开始进行粗洗。粗洗使用水源为纯化水。将用纯化水进行粗洗后的安瓿瓶,经传递窗传至精洗 间,精洗瓶条件为100000级区,精洗使用水源为经孔径为0.45μm滤膜滤过的澄明度合格的注射用水。 4.1.2.2清洗干净后安瓿应进行清洁度检查。 4.1.2.3清洗干净后安瓿必须在4小时内灭菌处理。 4.1.2.4将安瓿置于托盘上烘箱内进行灭菌,灭菌条件为167O C、120分钟; 4.1.2.5安瓿干燥后,由灌装岗位操作人员出瓶,并将安瓿凉瓶间自然冷却降温待用, 贮存至使用时间不得超过24小时。 4.2原辅料称量备料 4.2.1称量备料 4.2.1.1从质量管理部批准的供货单位进购原辅材料。原辅料须验合格由质量管理部门放 行后,方可使用。原辅料生产商的变更应通过小样试验,必要时须通过验证。 4.2.1.2物料应经脱外包间及传递窗进入暂存室,原辅料配料室的环境和空气洁净度与生 产一致,并有捕尘和防止交叉污染措施。 4.2.1.3称量时应一人称量一人复核,并填写相应称量记录,称量好后的物料应做好明显 的状态标志。 4.3配液 4.3.1检查配好料的物料标签,物料标签应标有品名、规格、批号、数量、日期和操作者
大输液生产工艺质量控制要点
大输液生产工艺质量控制要点 -------------制备注射用水 一.用于蒸馏器 1)水源:去离子水 2)冷却水:洁净的软水(即生活用水) 二.蒸馏水质量检查 1)生产时:每台每隔2小时检查氯化物,酸碱度,易氧化物的铵盐 2)贮藏时:每星期全项检查一次 三.蒸馏水贮藏条件 1)容器:不锈钢罐或搪瓷罐 2)温度:80摄氏度以下 3)时间: 不超过12小时 -------------洗输液瓶 一.常水冲洗 1)温度: 60摄氏度~70摄氏度 2)压力: 不低于9.81×10Pa 3)时间: 不低于三秒 4)次数: 2~3次 二.精洗 1)次数: 2~3 次 2)压力: 不低于9.81×Pa 3)时间: 不少于3秒 4)末道滤材: 0.8~1.2um微孔滤膜 5)蒸馏水澄明度: 200ml容量瓶不得有可见异物 -------------配液 一.浓配 1)活性炭用量: 0.02%(g/ml) 2)煮沸时间: 10~15min 3)药液浓度不低于50% 二.稀配 1)活性炭用量0.01%(g/ml) 2)药液温度: 40~60摄氏度 质量检查: 1)含量:97.5%~102.5%
2)PH: 应符合规定 三.滤材 1)炭脱: 砂棒或钛合金制成的滤棒 2)初滤: 垂熔玻璃滤器 3)精滤: 0.8~1.2um 微孔滤膜 四.微孔滤膜 1)磨砂棒灯检: 均无亮点 2)起泡点试验: 合格 五.无菌要求 配料间空气菌落数: 9cm培养皿,暴露空间30minih 小于15个 六.药液温度控制: 含盐品种: 40~50摄氏度 七.药液温度控制: 含糖品种: 50~60摄氏度 -------------洗涤纶薄膜 质量要求 1)乙醇浓度: 95% 2)浸泡时间: 大于8小时 3)加盐煮沸: 100摄氏度. 30min,消除静电效应 4)漂洗水澄明度: 200ml容量瓶仅允许有微量白点 -------------洗涤橡皮塞 一.NaOH 1)浓度: 1%(g/ml) 2)温度: 100摄氏度 3)时间: 30分钟 二.HCl 1)浓度: 1%(g/ml) 2)室内温度15~25摄氏度浸泡 3)时间30分钟 三.洗胶塞水澄明度检查: 200ml容量瓶检查允许微量白点 -------------灌装 一.药液澄明度: 200ml容量瓶检查应无异物 二.容量 1)500ml : 500~510ml 2)250ml : 250~255ml 三.药渡稀释到灌装时间: 不超过4小时 四.空气菌落数: 9cm培养皿,暴露空间30min<10个 -------------轧盖
小容量注射剂生产工艺
小容量注射剂生产工艺规程通则 目录 1.小容量注射剂生产工艺流程图、小容量注射剂车间概况(附图)2.需要验证的关键工序及工艺验证(列表) 3.操作过程及工艺条件 4.技术安全、工艺卫生及劳动保护 5.物料平衡及技经指标 6.设备一览表 7.岗位定员 8.附件目录(岗位操作、清洁规程)
1. 可灭菌小容量注射剂的生产流程图 10000级区域 100000级区域 小容量注射剂车间概况(附图) 说明:由质监科按洁净厂房监控制度SMP-ZL-014对洁净区进行监控,由工 饮用水 注射用水 纯化 水 原料 安瓿 理 瓶 配 制 粗 滤 精 滤 灌 装 粗 洗 多效蒸馏 离子交换 印 字 灭菌、检漏 灯 检 封 口 精 洗 冷 却 干燥灭菌 全项检验合格 过滤 过 滤 检验合格 包装 入库待验 合格成品出厂 纸盒 纸箱
程设备科负责维修,车间应根据实际使用情况提出相应的建议,保证洁净厂房在 使用中符合GMP的规定。 2.需要验证的关键工序及工艺验证(列表) 项目名称验证文件编号 注射剂车间厂房空气净化系统VP-ZJ-001 VP-ZJ-021 纯化水系统VP-ZJ-002 VP-ZJ-022 注射用水系统VP-ZJ-003 VP-ZJ-023 工艺用气系统VP-ZJ-004 VP-ZJ-024 HBD-1隧道烘房VP-ZJ-005 VP-ZJ-025 药液滤过系统VP-ZJ-006 VP-ZJ-031 药液灌封系统(东线)VP-ZJ-007 VP-ZJ-031 ACSD-5洗烘灌封联动机VP-ZJ-008 VP-ZJ-026 注射剂(东线)在线清洗、清洁VP-ZJ-009 VP-ZJ-029 注射剂(西线)在线清洗、清洁VP-ZJ-010 VP-ZJ-030 AQ-1.2安瓿检漏灭菌柜(东线)VP-ZJ-011 VP-ZJ-027 AQ-1.2安瓿检漏灭菌柜(西线)VP-ZJ-012 VP-ZJ-028 注射剂(东线)生产工艺验证VP-ZJ-013 VP-ZJ-031 注射剂(西线)生产工艺验证VP-ZJ-014 VP-ZJ-032 DGA8/1-2拉丝灌封机VP-ZJ-018 VP-ZJ-031 说明:每年需按验证管理制度SMP-ZL-012对上述关键工序及工艺进行验证(再验证或回顾性验证)。若系统、设备设施发生变更则必须进行相应的验证。 验证由厂验证小组负责。车间应根据情况及时提出相应的申请。 3.操作过程及工艺条件 3.1 工艺用水: 3.1.1 操作过程: 3.1.1.1 原水为符合国家饮用水的标准自来水。 3.1.1.2 纯化水由原水经石英砂过滤→精滤(PE棒)→阴床→阳床→混床→ 紫外灯灭菌→进入贮罐。 3.1.1.3 注射用水由纯化水经多效蒸馏水机经过蒸馏而得。 3.1.2 工艺条件: 3.1.2.1 原水应符合国家饮用水标准。
