蛋白酶水解蛋清的工艺研究_王彩丽

[收稿日期]2009-02-16
[基金项目]湖北省科技攻关项目(2006AA201C56)
[第一作者简介]王彩丽(1977),女,陕西渭南人,实验师,硕士研究生,主要从事生物化学与分子生物学研究.
doi:10 3969/j.issn.1673-1409(S).2009 02 020
蛋白酶水解蛋清的工艺研究
王彩丽
(长江大学生命科学学院,湖北荆州434025;甘肃农业大学农学院,甘肃兰州730070) 方正武 (长江大学农学院,湖北荆州434025) 荣 俊
(长江大学生命科学学院,湖北荆州434025)
[摘要]选用木瓜蛋白酶、碱性蛋白酶和复合风味蛋白酶3种酶分别对鸡蛋蛋清进行水解,研究了酶水解鸡蛋蛋清的工艺。结果表明:用复合风味蛋白酶水解蛋清效果最好,其水解最佳条件为:温度50 ,pH 6.0,底物浓度25%,酶用量0.8mL /g (5200U /g)水解12h,水解度可达61.66%。[关键词]蛋清;木瓜蛋白酶;碱性蛋白酶;复合风味蛋白酶;水解[中图分类号]T S201 1
[文献标识码]A [文章编号]1673-1409(2009)02-S072-03
蛋清含有丰富的蛋白质和人体所需要的多种氨基酸,且其组成比例非常适合人体的需要,是人体内利用率最高的蛋白质之一[1]。用蛋白酶处理后的蛋清水溶液,具有口感好、无腥味、营养丰富、耐储存,又保持着鸡蛋的特有风味等优点[2],而且用酶处理后的蛋清透明水溶液,其中蛋白质已局部降解,有利于人体的消化吸收,不会引起消化不良,可用作保健饮料,符合现代人们对饮品的要求,尤其适宜于作为老人和婴儿的营养品,具有广阔的应用前景。为此,本研究探讨了蛋清的蛋白酶水解工艺条件,以期为鸡蛋的深加工奠定理论基础。
1 材料与方法
1.1 试验材料
鸡蛋为市售,复合风味蛋白酶(Flavourzym e)、碱性蛋白酶(Alcalase)和木瓜蛋白酶(Papain)均为诺和诺德公司产品。1.2 水解液的制备
将鸡蛋蛋清取出并用纱布过滤,以5g 鸡蛋蛋清加25mL 水配制成蛋清水溶液作为酶水解底物,调节pH ,加入水解所需要量的酶,在反应所需温度下水解一定时间,沸水浴20m in 以终止酶反应,待冷却后离心分离,收集上清液。同时做对照试验(不加酶液)。1.3 酶水解工艺
(1)最佳用酶的选择 蛋清水解选用木瓜蛋白酶、碱性蛋白酶和复合风味蛋白酶分别对蛋清进行水解并分别在其各自的最适温度、pH 、用量(均按诺和诺德公司提供,作适当调整)的条件下,对底物进行水解,8h 后测定各酶水解产物中蛋白质的水解度,根据各酶对蛋清的水解度大小,确定最佳用酶。
(2)水解温度的确定 对于选定的最佳用酶,测定其在不同的水解温度下酶水解产物中蛋白质的水解度,根据测定的水解度大小,确定酶反应的最适温度。
(3)水解pH 的确定 在酶反应的最适温度下,测定其在不同的水解pH 下酶水解产物中蛋白质的水解度,根据测定的水解度大小,确定酶反应的最适pH 。
(4)酶用量的确定 加入不同的酶量,在酶反应的最适温度和pH 下,测定其各水解产物中蛋白质的
72 长江大学学报(自然科学版) 2009年6月第6卷第2期:农学
Journal of Yangtze University(Nat Sci Edit) Jun 2009,Vo l 6N o 2:A gr i Sci
水解度,根据测定的水解度大小,并综合考虑经济性,确定最佳的酶用量。
(5)底物浓度的确定 在反应的最适温度、pH 和最佳酶用量的条件下,采用不同的底物浓度对蛋清进行水解,测定各水解产物中蛋白质的水解度,根据测定的水解度大小,确定酶反应的最佳底物浓度。
(6)水解时间的确定 在反应的最适温度、pH 、底物浓度和最佳酶用量的条件下,采用不同的水解时间对蛋清进行水解,测定各水解产物中蛋白质的水解度,根据测定的水解度大小,并结合实际生产,确定最适宜的反应时间。1.4 测定方法
(1)酶活力的测定 采用Folin -酚法,以每克酶制剂在37 、pH 7.5的条件下水解酪蛋白,每分钟产生1 g 酪氨酸为1个酶活力单位(I U )。
(2)蛋白质含量的测定 采用凯氏定氮法[3],测定不同清液中的蛋白质含量和对照管的蛋白质含量,分别记为N 和N 0(m g/m L)。
(3)水解度的测定 采用茚三酮比色法[4]测定出不同清液中氨基酸的含量,根据氨基酸的分子量再换算出-NH 2的摩尔含量( mol/m L),同时测定对照管的-NH 2含量。
水解度(Deg ree of hydr olysis,DH )为蛋白质在水解过程中肽键被裂解的程度或百分比,按以下公式计算[5]。
DH (%)=
h h tot 100=[a 6 23 N -b 6 25 N 0
] h tot 100式中:h 是被裂解的肽键数,即每克蛋白质中被裂解的肽键的毫摩尔数;h tot 是原蛋白质中的总肽键,即每
克蛋白质中肽键的毫摩尔数,一般为定值。对蛋清蛋白而言,该值为9.1438;a 是不同清液中-NH 2的含量( mol/mL);b 是对照管中-NH 2的含量( mo l/mL)。
2 结果与分析
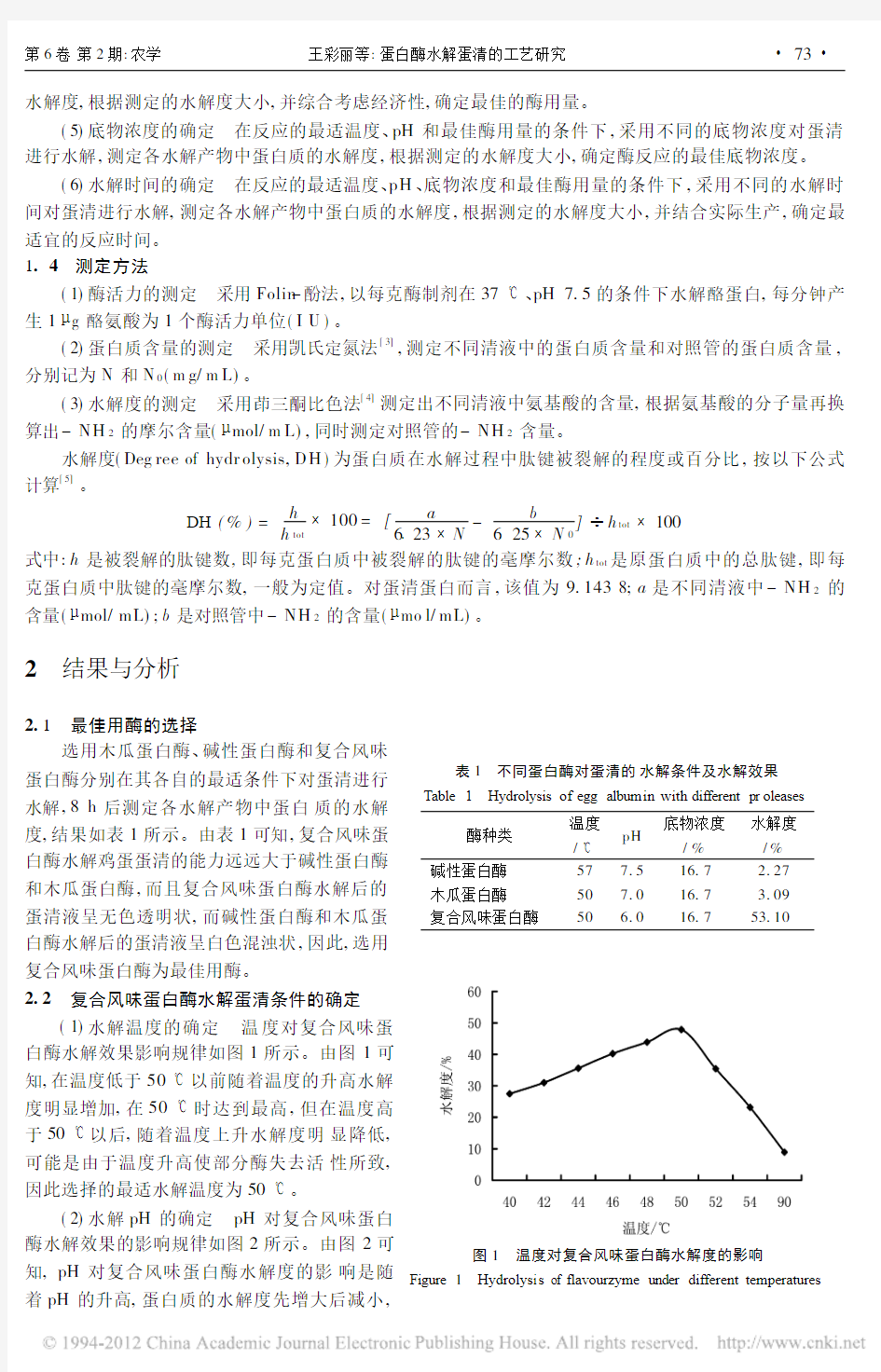
2.1 最佳用酶的选择表1 不同蛋白酶对蛋清的水解条件及水解效果Table 1 Hydrolysis of egg album in with different pr oleases
酶种类温度/ pH 底物浓度/%水解度/%碱性蛋白酶577.516.7 2.27木瓜蛋白酶
507.016.7 3.09复合风味蛋白酶
50
6.0
16.7
53.10
选用木瓜蛋白酶、碱性蛋白酶和复合风味蛋白酶分别在其各自的最适条件下对蛋清进行水解,8h 后测定各水解产物中蛋白质的水解度,结果如表1所示。由表1可知,复合风味蛋白酶水解鸡蛋蛋清的能力远远大于碱性蛋白酶和木瓜蛋白酶,而且复合风味蛋白酶水解后的蛋清液呈无色透明状,而碱性蛋白酶和木瓜蛋白酶水解后的蛋清液呈白色混浊状,因此,
选用图1 温度对复合风味蛋白酶水解度的影响
Figure 1 Hydrolys i s of flavourzyme under different temperatures 复合风味蛋白酶为最佳用酶。
2.2 复合风味蛋白酶水解蛋清条件的确定(1)水解温度的确定 温度对复合风味蛋白酶水解效果影响规律如图1所示。由图1可知,在温度低于50 以前随着温度的升高水解度明显增加,在50 时达到最高,但在温度高于50 以后,随着温度上升水解度明显降低,可能是由于温度升高使部分酶失去活性所致,因此选择的最适水解温度为50 。
(2)水解pH 的确定 pH 对复合风味蛋白酶水解效果的影响规律如图2所示。由图2可
知,pH 对复合风味蛋白酶水解度的影响是随着pH 的升高,蛋白质的水解度先增大后减小,
73 第6卷第2期:农学王彩丽等:蛋白酶水解蛋清的工艺研究
图2 pH 对复合风味蛋白酶水解度的影响Fi gure 2 H ydrolysis of flavour z ym e with di fferent pH
在pH 为6.0时的水解度出现峰值。因此,选pH 6.0为最佳水解pH 。
(3)酶用量的确定 将复合风味蛋白酶配成6500U/m L 的酶溶液,向底物中加入不同体积的酶液即不同的酶量来进行水解,以研究酶的用量对复合风味蛋白酶水解效果的影响,结果如图3所示。由图3可知,随着复合风味蛋白酶用量的增大,水解度不断升高,但当酶的用量超过0.8m L/g 时,水解度增加缓慢。综合考虑经济性,选用酶的用量为0.8mL/g 。
(4)底物浓度的确定 底物浓度对复合风味蛋图3 复合风味蛋白酶的用量对水解效果的影响Figure 3 Hydrolys i s of flavourzyme wi th different
dosages of proleas e
白酶水解效果的影响规律如图4所示。由图4可知,当底物浓度小于25%时,随着底物浓度的升高,蛋白质水解度不断增大;但当底物浓度达到25%时,蛋白质的水解度也达到最高;再升高底物浓度反而使蛋白质的水解度降低。故确定最佳底物浓度为25%。
(5)水解时间的确定 水解时间对复合风味蛋白酶水解效果的影响规律如图5所示。由图5可知:随着酶水解时间的延长,水解度不断增大,但在水解12h 以后,水解度增加缓慢。综合考虑经济性,选用最佳水解时间为12h
。
图4 底物浓度对复合风味蛋白酶水解度的影响Figure 4 Hydrolysi s of flavourzym e wi th different
concentrations of
substrate
图5 水解时间对复合风味蛋白酶水解效果的影响Figure 5 Effect of hydrolys i s duration on flavourzyme
3 结论
在用木瓜蛋白酶、碱性蛋白酶和复合风味蛋白酶分别对鸡蛋蛋清进行水解时,复合风味蛋白酶水解效果最好。当用复合风味蛋白酶水解蛋清时,在其最适温度、pH 和最佳底物浓度及酶用量的条件下,反应12h 后其对底物的水解度可达61.66%,而且水解液清亮、透明、感官性好。
(下转第106页)
[3]景士西,吴鲁平,杨思尧.解放思想,求实创新,改革育种学教学内容 对园艺植物育种学改革几个重要问题的研讨[J].高等农业教
育,1999,(11):57~62.
[4]李桂荣,周俊国,杨鹏鸣,等.园艺植物育种学实验教学的改革和实践[J].河南职业技术师范学院学报(职业教育版),2007,(2):113~
114.
[5]陈 明.园艺植物育种学立体化教学体系构建初探[J].西南科技大学 高教研究 ,2007,(2):76~78.
[6]陈火英.探究式教学模式在植物育种学教学中的运用与学生创新能力培养[J].高等农业教育,2004,(12):70~71.
(上接第71页)
[参考文献]
[1]达良俊,陈 鸣.凤眼莲不同部位对重金属的吸收、吸附作用研究[J].上海环境科学,2003,22(11):765~767.
[2]M ehra A,Farago M E,Banezjee D K.A Study of Eichhomia cr assip es Grow ing in the Overbank and Floodplain S oils of the River Yamuna
in Delhi,India[J].Environmental M on itorin g and Assessm ent,2000,60:25~45.
[3]Zh u Y L,Zayed A M,Qian J H,et al.Phtoaccu mulation of trace elements by w etlan d plants:II.w ater hyacinth[J].J ournal of Environ-
m ental Qu ality,1999,28:339~344.
[4]国家环保总局 水和废水监测分析方法 编委会.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社,2002.343~353.
[5]姚朝英,杜 青.原子吸收光谱法测定水生生物体内铜、锌、镍、铬、铅、镉[J].化学分析计量.2006,15(3):36~37.
[6]李卫平,王 军,李 文,等.应用水葫芦去除电镀废水中重金属的研究[J].生态学杂志,1995,14(4):30~35.
[7]梁俊美,雷泽湘,陈中义.水浮莲对铜污染水体的修复研究[J].仲恺农业技术学院学报,2008,21(1):29~33.
[8]郝飞麟,沈明卫.pH对水葫芦净化养殖废水效率的影响研究[J].上海交通大学学报(农业科学版),2006,24(2):196~199.
[9]黄永杰,刘登义,王友保,等.八种水生植物对重金属富集能力的比较研究[J].生态学杂志,2006,25(5):541~545.
[10]蔡成翔,王华敏,张宗明.水葫芦对五种重金属离子的去除速率与富集机制研究[J].广西右江民族师专学报,2002,15(6):48~51.
[11]颜素珠,梁 东,彭秀娟.8种水生植物对污水中重金属 铜的抗性及净化能力研究[J].中国环境科学,1990,10(3):166~170.
(上接第74页)
[参考文献]
[1]郑 云,蔡木易,范慰慰.蛋清白蛋白酶解工艺的研究[J].食品工业,2005,21(12):1~3.
[2]邓舜扬.新型饮料生产工艺与配方[M].北京:中国轻工业出版社,2000.511~512.
[3]中华人民共和国国家标准GB/T5009.5 2003[S].北京:中国标准出版社,2003.
[4]张水华.食品分析[M].北京:中国轻工业出版社,2008.175~176.
[5]徐英操,刘春红.蛋白质水解度测定方法综述[J].食品研究与开发,2007,28(7):173~175.
(上接第92页)
[参考文献]
[1]田智仁,徐雪云.全力推进标准化生产提高茶叶产业效益[J].茶业通报,2007,(6):30~32.
[2]余根平,陈振平.闽东茶叶产业发展的财政对策[J].农村财政与财务,2004,(11):15~17.
[3]陈 巧.闽东茶叶企业应对 QS 认证初探[J].福建质量信息,2006,(8):23~24.
[4]张居德.做强做大闽东茶业确保茶业持续健康发展[J].福建茶叶,2006,(12):9~11.
Key words:Solanum tuberosum;rapid shoot cutt ing s propagation;tuber
068Study on Purification for Copper Polluted Water by Eichhornia crassipes CAI Qing,LEI Ze-xiang Dep artment of E nv ir onmen tal S cience and Enginee ring,Zhongkai Univ er sity of
A gricu lture and Eng ine ering,Gu angz hou,Gu angd on g510225,China
HU H o ng-w ei Gu angd on g ne M e dicine Eng inee ring Re se arch Center Co.L td,Jinan Univ er sity,Gu angz
Gu angd on g510632,China
CHEN Zho ng-yi(College of H or ticulture and G ar d ening,Yang tze Unive rsity,J in gz hou,H ubei434025,China)
Abstract:After cultivated in t he solut ion of different copper(Cu2+)concentrat ions and pH,the absorption and enrichment of Cu2+by Eichhornia cr assip es and the effect s of Cu2+concentrat ion and pH on the absorpt ion of Cu2+by E.cr assip es w ere studied.The results show ed that E.cr assip es w as good in remediating the w ater contaminated by low concentration of Cu2+in short time.When the Cu2+concentrat ion w as2.00,4.00,8.00 mg/L,the tot al removal rate of Cu2+by E.crassip es w as91.38%,91.64%and
77 64%,respectively.When pH w as4.0, 5.5,7.0w ith the Cu2+concentrat ion of
4 00mg/L,the t ot al removal rat e of Cu2+w as88.02%,93.15%and81.32%respec-
tively.T he remediat ion of Cu2+by E.crassip es mainly depended on the absorption and enrichment of its root s.When the Cu2+concentrat ion w as abover20.00mg/L, E.cras-sip es w as suffered distinctly.
Key words:Eichhornia crassip es;the cupric ion;removal rate;t olerance
072Study on Hydrolysis of Egg Albumin with Prolease
WANG Ca i-li Colle ge of L if e S cience,Yang tz e Univ er sity,Jing z hou,H ube i434025,China;Colle ge of A g ronomy,
G ansu Ag ricultural Univ er sity,L anz hou,Gansu730070,Ch ina
FANG Zhe ng-wu (Colleg e of A gr onomy,Yang tze Unive rsity,J ingz hou,H ubei434025,China)
RONG Jun (Colle ge of L if e Science,Yang tz e Univ er sity,J ing z hou,H ube i434025,China)
Abstract:The caroid,alkaline prot einase and compound proteinase w ere used to st udy a-l bumen dig estion techniques.The results demonstrated that compound prot einase a-chieved bet ter digestion efficiency compared w ith caroid and alkaline prot einase.T he op-timized digestion condition is that25percent subst rate(V/V)digested w it h0.8mL/g (5200U/g)for12h in50 ,pH6.0.T he digest ion eff iciency reached up to61.66%.
Key words:hydrolysis;compound proteinase;egg albumin
075Study on Influence Parameters of Water C ontent of Newly Harvested Peanuts PENG San-he,LIU Ya ng (Colle ge of M ec hanic al Eng ineering,Yan gtz e Univ ersity,Jing zh ou,H u bei434023,Ch ina) Abstract:Through t he self-made peanut cleaning up and drying apparatus,the influence parameters of w ater content of new ly harvested peanuts such as immersion t ime,spra-ying of w at er,velocity of w hirl and flame roast ing time had been studied.The best value of various parameters w hich caused the new ly harvest ed shell peanut to obt ain the ap-propriate w ater cont ent had been found.
Key words:peanuts w at er content;immersion t ime;spraying of w at er;velocit y of w hirl;
roasting time
078Design for Rape Seed and Fertilizer Application Machine
LIU S hou-xia ng (Colleg e of M echanical Eng inee ring,Yangtz e Univ ersity,Jing zh ou,H u bei434023,Ch ina)
XU Deng-xu (Yuanlin S enior S econd ary S chool of H ong hu Cou nty,H ong hu,H ubei434200,China)
Abstract:Based on t he present situation of the rape seed sow ing,fert ilization and the pow er machinery in Jiang han Plain as w ell as the surrounding areas,t he solution to de-veloping t he fertilizing machine w as provided.It s principle w as int roduced,and the mechanisms of sow and fertilizer w as designined,and the determination principle of the main mechanism parameters w as analyzed.
Key words:rape;seed;fertilizer;design
酪蛋白磷酸肽的药理作用
酪蛋白磷酸肽的药理作用 【摘要】酪蛋白磷酸肽具有促进钙、铁、锌的吸收、利用,增强精卵的结合等作用。近年来对其进行了深入研究发现它在增强机体免疫力,促肿瘤细胞凋亡方面有潜在的药理作用,通过对其作用机制的研究,将为其用于临床提供理论依据。 【Abstract】Casein protein phosphorylation peptide with the promotion of calcium,iron,zinc absorption,utilization and enhance the integration of sperm,In recent years their has conducted in-depth study found that it enhanced immunity,and promote apoptosis of tumor cells have the potential pharmacological effects,through the mechanism of its role will be to provide a theoretical basis for clinical. 【Key words】Casein Phospho peptides; Pharmacological effects 英文:Casein Phospho Peptides(CPP) 别名:酪蛋白磷肽 化学结构:CPP的活性中心是成串的磷酸丝氨酸和谷氨酸族,其基本结构可表示为-serp-serp-serp-glu-glu-,相对分子质量约2000~4000。 性状:乳白色或淡黄色粉末,有轻微的芳香气味。易溶于水,水溶液呈中性,在酸性条件下不易沉淀。有良好的热稳定性。 来源与结构:Nato[1]最早用酪蛋白喂养大鼠,在肠内容物中发现CPP。Nicholas等[ 2-3]用胰酶或胰蛋白酶水解酪蛋白,精制、纯化制备CCP。CPPs有α和β两种构型[4],其主要功能区是αSI-(59-79)5P和β(1-25)4P,不同条件下制备的CPP 都含有相同的核心构:-Ser(P)-Ser(P)-Ser(P)-Glu-Glu-(Ser:丝氨酸,Glu:谷氨酸,P:磷酸基)。此结构中磷酸丝氨酸残基[-Ser(P)-]成簇存在,在肠道pH弱碱性环境下带负电荷,可阻止消化酶的进一步作用,使CPP不会被进一步水解而在肠道中稳定存在。同时,-Ser(P)-对CPP 的功能发挥起重要作用。冯凤琴等[5]研究了CPP的纯度、CPP 中氮与磷摩尔比值(N∶P)与其功能的关系,发现N∶P 越小,CPP的肽链越短,磷酸基密度越大,CPP 纯度越高,促进钙吸收和利用的作用越强。 1 酪蛋白磷酸肽的药理功能 1.1 促进小肠对钙的吸收25-(OH)2VitD3可促进钙吸收,其吸收率取决于小肠内游离的钙离子浓度。人日常膳食中,谷类等植物性食物中含有大量的植酸、肌醇六磷酸等高磷成分,它们在小肠下端pH 7~8 的环境下与钙结合成磷酸钙沉淀,因此影响钙离子的被动吸收。CPP[1] 能抑制磷酸钙沉淀的形成,使游离钙保持较高的浓度,促进钙离子的被动吸收,从另一个途径提高钙离子的吸收率。冯凤琴等[3]用pH-stat法观察实验室制得的CPP抑制磷酸钙沉淀的效果。结果发现0.11~0.12 g/L的CPP使磷酸钙沉淀的形成延缓5~40 min。相同条件下,不加
年产1000吨酸性蛋白酶的生产工艺设计
1. 前言 酸性蛋白酶是一类最适pH值为2.5?5.0的天冬氨酸蛋白酶,相对分子质量为30000 ?40000。酸性蛋白酶主要来源于动物的脏器和微生物分泌物,包括胃蛋白酶、凝乳酶和一些微生物蛋白酶。根据其产生菌的不同,微生物酸性蛋白酶可分为霉菌酸性蛋白酶、酵母菌酸性蛋白酶和担子菌酸性蛋白酶.根据作用方式可分为两类:一类是与胃蛋白酶相似,主要产酶微生物是曲霉、青霉和根霉等;另一类是与凝乳酶相似,主要产酶微生物是毛霉和栗疫霉等。细菌未发现产酸性蛋白酶的菌株.由于酸性蛋白酶具有较好的耐酸性,因此被广泛地应用于食品、医药、轻工、皮革工艺以及饲料加工工业中。 国外关于酸性蛋白酶的生产研究从20世纪初就开始了。1908年,德国科学家从动物的胰脏中提取出胰蛋白酶,并将其用于皮革的鞣质。1911年美国科学家从木瓜中提取木瓜蛋白酶(在酸性,碱性和中性的条件下都能分解蛋白质的酶)并将木瓜蛋白酶用于除去啤酒中的蛋白质浑浊物。自1954年吉田首次发现黑曲霉可产生酸性蛋白酶以来,国外对微生物发酵生产酸性蛋白酶进行了广泛的研究。1964年外国科学家首次发现大孢子黑曲霉突变体能产生两种不同的酸性蛋白酶,即酸性蛋白酶和酸性蛋白酶。1965年又从血红色陀螺孔菌,中分离出了一种酸性蛋白酶,并对该酶进行了纯化和结晶。1968年从微小毛霉中筛选出了一种酸性蛋白酶,并对其进行了纯化和酶学性质分析。1995年外国科学家对烟曲霉酸性蛋白酶的基因进行了克隆和测序。2001年又从假丝酵母中筛选出了一种酸性蛋白酶菌株,并对该酶进行了核苷酸序列分析和功能分析。国外学者对曲霉酸性蛋白酶的结构和功能等己经研究的较为透彻。 与国外相比,我国对酸性蛋白酶的研究相对较晚些。1970年上海工业微生
蛋白酶酶切位点
蛋白酶酶切位点 木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素 胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写
名称三字符号单字符号 丙氨酸Ala A 精氨酸Arg R 天冬氨酸Asp D 半胱氨酸Cys C 谷氨酰胺Gln Q 谷氨酸Glu/Gln E 组氨酸His H 异亮氨酸Ile I 甘氨酸Gly G 天冬酰胺Asn N 亮氨酸Leu L 赖氨酸Lys K 甲硫氨酸Met M 苯丙氨酸Phe F 脯氨酸Pro P 丝氨酸Ser S 苏氨酸Thr T 色氨酸Trp W 酪氨酸Tyr Y 缬氨酸Val V 【生化】特异性蛋白酶的酶切位点 胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。胰凝乳蛋白酶phe、trp、tyr 等疏水aa。胃蛋白酶phe、trp、tyr等疏水aa。木瓜蛋白酶arg、lys。葡萄球菌蛋白酶,磷酸缓冲液ph7.8时断裂glu、asp。碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。梭菌蛋白酶arg,用于不溶性蛋白的长时间裂解。CNBr断裂Met。羟胺断裂asn—gly间的肽键。二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。 木瓜蛋白酶(Papain),又称木瓜酶,是一种蛋白水解酶。木瓜蛋白酶是番木瓜(Carieapapaya)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。 木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。纯木瓜蛋白酶制品可含有:(1)木瓜蛋白酶,分子量21000,约占可溶性蛋白质的10%;(2)木瓜凝乳蛋白酶,分子量26000,约占可溶性蛋白质的45%;(3)溶菌酶,分子量25000,约占可溶性蛋白质的20%;及纤维素酶等不同的酶。 番木瓜未成熟果实中含有木瓜蛋白酶(Papain)、木瓜凝乳蛋白酶A(Chymopapain A )、木瓜凝乳蛋白酶B(Chym opapain B )、木瓜肽酶B (PapayaPeptidase B ) 等多种蛋白水解酶。且已知四种半胱氨酸蛋白酶的一级结构具有高度的同源性。其中,木瓜蛋白酶属巯基蛋白酶,可水解蛋白质和多肽中精氨酸和赖氨酸的羧基端,并能优先水解那些在肽键的N-端具有二个羧基的氨基酸或芳香L-氨基酸的肽键。
酪蛋白水解物
酪蛋白水解物 一、中文名称:酪蛋白水解物 二、拉丁文名称/或英文名称:Lactium 三、主要成分:多肽 四、酪蛋白水解物(Lactium)的来源 酪蛋白水解物(Lactium)是以脱脂牛奶为原料,经过分离酪蛋白、水解、喷雾干燥等程序得到的一种酪蛋白水解产物。其典型化学成分为:蛋白质75%,脂肪1%,水分5%,灰分15%,乳糖1%。可溶解于水,无苦味,pH2-9时稳定,热稳定,可耐180℃高温50min。 酪蛋白水解后得到的αs1-Cn (f91-100),是一种含10个氨基酸的三维结构多肽,在Lactium中的典型含量为1.8%,其氨基酸序列为:Tyr-Leu-Gly-Tyr-Leu-Glu-Gln-Leu-Leu-Arg。 五、酪蛋白水解物(Lactium )生产工艺流程图和简述 1.工艺流程图: 脱脂牛奶 酪蛋白分离 碱化 胰蛋白酶水解
酸化 热处理 巴氏杀菌 浓缩、喷雾干燥 过筛 包装 2. 工艺说明 1.)以脱脂牛奶为原料,沉淀分离酪蛋白 2.)使用氢氧化钠将其碱化到pH为7.5-8.5之间 3.)在40-55℃下用胰蛋白酶进行水解。得到的产物中,游离10肽在干物质中的含量最低为1.8%。 4.)用盐酸进行酸处理,将pH降到3.0- 5.0 5.)在90℃下热处理1.5分钟 6.) 85℃进行巴氏杀菌、浓缩,此步骤为关键控制点 7.)喷雾干燥(进风温度180-200℃),得到粉末产品。 8.)过筛得到粒度在1mm以下的均匀粉末,其中游离10肽的含量最低为1.8%。此过程为关键控制点。
3. 拟公告的生产工艺简述:以脱脂牛奶为原料,经过酪蛋白分离、水解、浓缩、喷雾干燥等工艺制成。 六、酪蛋白水解物(Lactium)对酸奶的促进作用 酸奶具有促进肠道蠕动与消化和机体物质的代谢,并具有提高人体免疫力、防衰老、抗肿瘤等作用。酸奶中的大量乳酸菌及乳酸代谢产物能调节人体肠道微生态平衡,达到补充营养、防病、治病和保健的目的。 将酪蛋白水解物(含蛋白质7.6%)以2%(w/w)添加到奶液中混合发酵,做空白样对照。研究了二者发酵过程中各发酵参数的变化,并对二者的质构进行了分析比较。研究结果表明:酪蛋白水解物能明显促进酸奶发酵;促发酵作用随所添加的水解物水解程度提高而增强;添加酪蛋白水解物改变了酸奶发酵过程中的 pH 下降速度,在发酵中期二者的 pH 下降速度之间存在最大差距;质构分析表明添加2%酪蛋白水解物对酸奶整体质构有所改善。 七、酪蛋白水解物(Lactium)的作用 1、增强记忆力 2、提高精神状态、集中注意力 3、提高睡眠质量下降 4、缓解压力 5、控制体重 6、美容养颜 八、酪蛋白水解物(Lactium)的适应人群 1、记忆力下降者 2、注意力不集中精神状态不佳者 3、失眠、睡眠质量下降者 4、工作、生活、学习压力大者 5、肥胖人群 6、需要美容养颜者 九、酪蛋白水解物(Lactium)的社会及经济效益 在现代社会,生活节奏加快,人们面对的各种各样的压力越来越大。由于个体差异,
年产1000吨酸性蛋白酶的生产工艺设计
1. 前言 酸性蛋白酶是一类最适pH值为的天冬氨酸蛋白酶,相对分子质量为30000 40000。酸性蛋白酶主要来源于动物的脏器和微生物分泌物,包括胃蛋白酶、凝乳酶和一些微生物蛋白酶。根据其产生菌的不同,微生物酸性蛋白酶可分为霉菌酸性蛋白酶、酵母菌酸性蛋白酶和担子菌酸性蛋白酶.根据作用方式可分为两类:一类是与胃蛋白酶相似,主要产酶微生物是曲霉、青霉和根霉等;另一类是与凝乳酶相似,主要产酶微生物是毛霉和栗疫霉等。细菌中尚未发现产酸性蛋白酶的菌株.由于酸性蛋白酶具有较好的耐酸性,因此被广泛地应用于食品、医药、轻工、皮革工艺以及饲料加工工业中。 国外关于酸性蛋白酶的生产研究从20世纪初就开始了。1908年,德国科学家从动物的胰脏中提取出胰蛋白酶,并将其用于皮革的鞣质。1911年美国科学家从木瓜中提取木瓜蛋白酶(在酸性,碱性和中性的条件下都能分解蛋白质的酶)并将木瓜蛋白酶用于除去啤酒中的蛋白质浑浊物。自1954年吉田首次发现黑曲霉可产生酸性蛋白酶以来,国内外对微生物发酵生产酸性蛋白酶进行了广泛的研究。1964年外国科学家首次发现大孢子黑曲霉突变体能产生两种不同的酸性蛋白酶,即酸性蛋白酶和酸性蛋白酶。1965年又从血红色陀螺孔菌,中分离出了一种酸性蛋白酶,并对该酶进行了纯化和结晶。1968年从微小毛霉中筛选出了一种酸性蛋白酶,并对其进行了纯化和酶学性质分析。1995年外国科学家对烟曲霉酸性蛋白酶的基因进行了克隆和测序。2001年又从假丝酵母中筛选出了一种酸性蛋白酶菌株,并对该酶进行了核苷酸序列分析和功能分析。国外学者对曲霉酸性蛋白酶的结构和功能等己经研究的较为透彻。 与国外相比,我国对酸性蛋白酶的研究相对较晚些。1970年上海工业微生物研究所首先从黑曲霉中筛选出一株产酸性蛋白酶菌株,并和上海酒精厂协作进行中试生产,填补了我国酸性蛋白酶制剂的空白.近年来国内在酸性蛋白酶上的研究大都致力于选育产酶活力高、抗逆性好的菌种,并获得了一些很有应用前途的产酶菌株。目前用于酸性蛋白酶生产的高产菌株主要有黑曲霉、宇佐美曲霉和青霉及它们的突变株。李永泉等,对宇佐美曲霉所产的酸性蛋白酶进行了发酵过程动力学研究.戚淑威等对青霉产酸性蛋白酶的适宜条件和酶学性质进行了分析。谢必峰等,采用硫酸铵盐析法和离子交换层析法分离纯化了黑曲霉产酸性蛋
酪蛋白课程报告
生物技术学院 课程论文 课程名称:高级生物化学成绩: 教师签名:
酪蛋白研究进展综述 提纲:酪蛋白简介-酪蛋白亚基结构-酪蛋白酶特性-酪蛋白活性肽研究进展 摘要:酪蛋白是一种含磷钙的结合蛋白,常见于哺乳动物及其乳汁中,如母牛、羊 以及人奶。酪蛋白对酸敏感,pH较低时会沉淀,因此本科生实验室常用其进行蛋 白质的沉淀反应。哺乳动物的主要蛋白是α-酪蛋白,然而人类乳汁中没有α-酪蛋 白,人乳中的酪蛋白主要是β-酪蛋白形式。对于人类幼儿而言,酪蛋白是氨基酸 的来源,但同时,它也是钙和磷的主要来源,同时,因为胃的酸性环境,酪蛋白还 能在胃中形成凝乳以便消化。本文综合中外文献,对酪蛋白进行了研究进展综述。 关键词:酪蛋白;蛋白亚基;活性肽 酪蛋白简介 在20℃,pH值为4.6时,牛乳中能沉淀下来一种呈酸性的蛋白质,我们将其称为酪蛋白。酪蛋白又名干酪素、乳酪素、酪朊,在牛奶中含量非常丰富。它是一种含磷的蛋白质,具有极高的营养价值,其中含有多种生物活性肽,因此它具有抗菌、降血压、抗氧化和促进双歧杆菌增殖等功能。 酪蛋白在母体蛋白质序列内是无活性的,通过体内或体外酶水解的方式释放出来后,它们即可作为具有类似激素活性的调节物质。这些产物可用作肽类药物、肽类试剂,主要用于科学试验和生化检测;也可用于活性肽功能性食品中,具有增强机体防御功能、调节生理节律、预防疾病和促进康复等功能。 酪蛋白的亚基结构 酪蛋白的分子质量约为20-25ku,由4类遗传变种组成,分别为αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白和K-酪蛋白。其中,αs2-酪蛋白是牛乳中的主要酪蛋白,占总含量的38%;β-酪蛋白含量仅次于αs-酪蛋白,占总含量的35%,
酪蛋白磷酸肽的概况
酪蛋白磷酸肽的概况 第一节:酪蛋白磷酸肽的基本概况 中文名称:酪蛋白磷酸肽 英文名称:Casein Phosphopeptides 钙是人体内含量最丰富的元素之一,对人体健康起着十分重要的作用,然而它也是最易缺乏的矿物质元素之一。当今世界上缺钙已成为一大营养问题,即使经济很发达的国家也未能幸免,在我国表现得尤为突出。据报道,我国老年人因缺钙引起的骨质疏松发病率高达30%-50%,儿童因缺钙引起的佝偻病高达40%,妊娠妇女缺钙比例也非常高,严重威胁着人们的健康。因此,补钙是众所需求。 现代研究已证实钙缺乏的主要原因并不是食物不足,而是由于吸收率低下。如何提高钙的吸收率,是人们长期以来一直在进行的研究。而今从牛奶中分离的一种生物活性肽——酪蛋白磷酸肽(CPP),由于具有很强的促钙吸收活性,正成为功能性食品添加剂的开发和研究热点。 酪蛋白磷酸肽(Casein Phosphopeptides),简称CPP,是以牛奶酪蛋白为原料,经单一酶或复合酶水解,再对水解产物进行分离纯化而得到的含有簇磷酸丝氨酚的多肽。专家们认为,将钙和CPP应用于各类食品中,作为一种食品基料,可提高食品的附加值,使人们长期存在的钙摄取量不足的问题得以解决,有效地预防骨质疏松症和儿童缺钙症。 CPP具有促进成长期儿童骨骼和牙齿发育的作用,并能预防和改善骨质疏松症,促进骨折患者的康复,预防和改善缺铁性贫血;还具有抗龋齿作用。 CPP可添加于各类食品。包括饮料、烘烤食品、冷饮、乳制品、发酵食品、快餐食品、糖果、果酱、儿童咖喱饭、口香糖及保健品和调料中,可满足各种年龄段人群的需要。CPP还可用于动物饲料中,促进动物体外受精。纯CPP和高纯CPP可应用于制药工业,能进一步促进钙质吸收,防止矿物质流失。
胰蛋白酶活力测定
实验胰蛋白酶活力测定 一、原理 福林—酚试剂中的磷钨酸和磷钼酸,在碱性条件下极不稳定,易被酚类化合物还原为蓝色化合物(钨蓝和钼蓝)。 蛋白质中含具酚基的氨基酸(酪氨酸、色氨酸、苯丙氨酸),用胰蛋白酶水解蛋白底物,生成含酚基的氨基酸与福林—酚试剂反应,生成蓝色化合物,在一定的范围内,蓝色化合物颜色的深浅与酶活力的大小成正比。 二、实验仪器 试管 7220分光光度计 恒温水浴锅 三、实验试剂 福林试剂B:见福林(Folin)-酚试剂法测定蛋白质的浓度部分(冰箱中) 0.55mol/L碳酸钠溶液:58.3g无水碳酸钠溶于蒸馏水,稀释并定容至1000ml 10%三氯乙酸溶液 0. 2mol/L磷酸缓冲液(pH7.5): 0.5% 酪素溶液:称取0.5g酪素,以0.5mol/L氢氧化钠1ml湿润,再
加少量0. 2mol/L 磷酸缓冲液稀释。在水浴中煮沸溶解,冷却,稀释并容至100ml ,冷藏在(冰箱)里。 500ug/L 酪氨酸溶液 胰蛋白酶溶液(冰箱中) 四、实验步骤 标准曲线的制作:按下表加入试剂: 0.20.40.60.81.0蒸馏水 1.0 0.80.60.40.20500ug/L 酪氨酸溶液6 54321管号 各管中加0.5%酪素2ml ,于37℃水浴中反应15分钟,然后加入10%三氯乙酸3ml ,过滤除去沉淀,取清液1ml ,加入0.55mol/L 碳酸钠5ml ,再加入福林试剂1ml ,于37 ℃水浴中显色15分钟,测OD 680。 以光密度为纵坐标,酪氨酸的微克数为横坐标绘制标准曲线。 样品测定:取干燥的试管2支,按下表加入试剂
0 OD6801 1福林试剂B 5.0 5.0 0.55mol/L碳酸钠溶液 37水浴中显色15分钟1 1上清液 过滤3.0 3.0 10%三氯乙酸溶液1.0 0 2mg/ml胰酶溶液0 1.0 0. 2mol/L磷酸缓冲液 37水浴中酶解15分钟2.0 2.0 0.5%酪素溶液 备注2 1 管号 五、结果计算 酶活力:在37℃下每分钟水解酪素产生lug酪氨酸为一个活力单位。样品中含酶活力单位=A/15 ╳F A—样品测定光密度查曲线得相当酪氨酸ug数 F—酶液稀释倍数 原始数据:(注:7号为待测液) 液体编 号 0 1 2 3 4 5 7 分光光 度计值 0 0.057 0.172 0.201 0.255 0.373 0.919 分光光 度计值 0 0.057 0.173 0.194 0.263 0.386 0.928 分光光 度计值 0 0.068 0.174 0.194 0.271 0.391 0.934
蛋白酶活力测定方法
酸性蛋白酶产品概述: 蛋白质由氨基酸组成,是自然界中发现的最复杂的有机化合物之一。由盐酸和蛋白酶分解成易被高等动物的肠道和微生物有机体的细胞膜吸收的氨基酸。包括人类在内的每种动物,必须要有足够的蛋白质来维持自身生长,来生成每个细胞所必需的氨基酸,一些特种蛋白质还是某些特殊细胞、腺体分泌物、酶和激素的功能性组成元素。蛋白酶是指一些有催化功能的酶,能够水解(断裂)蛋白质,因此也被称为蛋白水解酶。蛋白水解酶在许多的生理和病理过程中发挥着重要作用,在食品和乳品加工业也有着广泛应用。工作机理 蛋白水解酶制剂本产品能在酸性条件下水解蛋白质食品中的缩氨酸键,释放氨基酸或者多肽。在酒精、葡萄酒、果汁、啤酒、黄油和酱油生产中,添加酸性蛋白酶可澄清发酵液中的雾气。酵母在发酵阶段的生长可以通过悬浮蛋白质转化的氨基酸来加以促进,从而加速发酵并提高产量。本产品是一种酸性蛋白酶制剂,在酸性条件下具有较高活性,由酸性蛋白酶高产菌株——曲霉菌深层发酵而成。它广泛应用于饲料、纺织、废水处理和果汁提纯方面。 酸性蛋白酶(Acid protease )是指蛋白酶具有较低的最适pH,而不是指酸性基团存在于酶的活性部位,酸性蛋白酶的最适PH从2左右(胃蛋白酶)到4左右。从酶的活力-PH曲线分析,在酶的活性部位中含有一个或更多的羟基。这一类蛋白酶中研究最彻底的是胃蛋白酶。(酸性蛋白酶537容易失活)
简介:酸性蛋白酶是由隆科特黑曲霉优良菌种经发酵精制提炼而成,它能在低PH条件下,有效水解蛋白质,广泛应用于酒精、白酒、啤酒、酿造、食品加工、饲料添加、皮革加工等行业。 1、产品规格:,规格有5万u/g~10万u/g 液体型为黑褐色液体,规格有50000u/ml~10000u/ml. 2、酶活力定义:一个酶活力单位是1g酶粉或1ml酶液在40℃,PH3.0条件下,1分钟水解酪素产生1ug酪氨酸为一个酶活力单位(u/g或u/ml) 特性1、温度范围为:最适温度范围为40℃-50℃2、PH为:最适PH范围为2.5~3.5 使用方法 1、白酒工业: 本品用以淀粉为原料的生产酒精及白酒行业,提高出酒率0.25%个酒分,提高发酵速度。 2、食品工业: 食品上用以淀粉改良,提高食品风味、改良品质,因能提高氨基酸含量 3、啤酒生产: 能有效阻断双乙酰生成,缩短啤酒成熟期。 4 饲料添加剂:提高饲料利用率。 5、毛皮软化: 提高上色率,手感丰满,增加毛皮光泽。
不同的酶切位点
ApaI (类型:Type II restriction enzyme )识别序列:5'GGGCC^C 3' BamHI(类型:Type II restriction enzyme )识别序列:5' G^GATCC 3' BglII (类型:Type II restriction enzyme )识别序列:5' A^GATCT 3' EcoRI (类型:Type II restriction enzyme )识别序列:5' G^AATTC 3' HindIII (类型:Type II restriction enzyme )识别序列:5' A^AGCTT 3' KpnI (类型:Type II restriction enzyme )识别序列:5' GGTAC^C 3' NcoI (类型:Type II restriction enzyme )识别序列:5' C^CATGG 3' NdeI (类型:Type II restriction enzyme )识别序列:5' CA^TATG 3' NheI (类型:Type II restriction enzyme )识别序列:5' G^CTAGC 3' NotI (类型:Type II restriction enzyme )识别序列:5' GC^GGCCGC 3' SacI (类型:Type II restriction enzyme )识别序列:5' GAGCT^C 3' SalI (类型:Type II restriction enzyme )识别序列:5' G^TCGAC 3' SphI (类型:Type II restriction enzyme )识别序列:5' GCATG^C 3' XbaI (类型:Type II restriction enzyme )识别序列:5' T^CTAGA 3' XhoI (类型:Type II restriction enzyme )识别序列:5' C^TCGAG 3'
蛋白酶专一性酶切位点地影响因素分析报告
蛋白酶专一性酶切位点的影响因素分析 摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。 关键词:生物活性肽;蛋白酶;水解条件;酶切位点 Influencing Factors Analysis of Protease Specific Cleavage Sites Abstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production. Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites 1.前言 生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。生物活性肽有的是天然存在的,如谷胱甘肽、催产素、加压素、舒缓激肽、部分抗菌肽等,有的生物活性肽是以非活性的状态存在于某些蛋白质中,当用特定的蛋白酶水解后被释放出来,才成为有特定生理活性的肽。同种蛋白质经不同的蛋白酶酶解后,可以产生具有不同氨基酸序列、不同生理功能的生物活性肽,如大豆蛋白、
蛋白酶活力测定方法
中华人民共和国专业标准 蛋白酶活力测定法 SB/T 10317-1999 Measurement of proteinase activity ━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━━本方法适用于酿造酱油时在制品菌种、成曲的蛋白酶活力测定。 1 福林法 1.1 试剂及溶液: 以下试剂都为分析纯 1.1.1 福林试剂(Folin试剂):于2000mL磨口回流装置内,加入钨酸钠(Na2WO4·2H2O) 100g,钼酸钠(Na2MoO4·2H2O)25g,蒸馏水700mL,85%磷酸50mL,浓盐酸100mL,文火回流10h。 取去冷凝器,加入硫酸锂(Li2SO4)50g,蒸馏水50mL,混匀,加入几滴液体溴,再煮沸15min, 以驱逐残溴及除去颜色,溶液应呈黄色而非绿色。若溶液仍有绿色,需要再加几滴溴液,再 煮沸除去之。冷却后,定容至1000mL,用细菌漏斗(No4~5)过滤,置于棕色瓶中保存。此溶 液使用时加2倍蒸馏水稀释。即成已稀释的福林试剂。 1.1.2 0.4mol碳酸钠溶液: 称取无水碳酸钠(Na2CO3)4 2.4g,定容至1000mL。 1.1.3 0.4mol三氯乙酸(T C A)溶液: 称取三氯乙酸(CCL3COOH)65.4g,定容至1000mL。 1.1.4 pH7.2磷酸盐缓冲液:称取磷酸二氢钠(NaH2PO4·2H2O)31.2g,定容至1000mL,即成0.2mol溶液(A液)。称取磷酸氢二钠(Na2HPO4·12H2O)71.63g,定容至1000mL,即成0.2mol溶液(B液)。 取A 液28mL 和B 液72mL,再用蒸馏水稀释1倍,即成0.1mol pH7.2的磷酸盐缓冲液。 1.1.5 2%酪蛋白溶液:准确称取干酪素2g,称准至0.002g,加入0.1N氢氧化钠10mL,在 水浴中加热使溶解(必要时用小火加热煮沸),然后用pH7.2磷酸盐缓冲液定容至100mL即成。配制后应及时使用或放入冰箱内保存,否则极易繁殖细菌,引起变质。 1.1.6 100μg/mL酪氨酸溶液:精确称取在105℃烘箱中烘至恒重的酪氨酸0.1000g,逐 步加入6mL 1N盐酸使溶解,用0.2N盐酸定容至100mL,其浓度为1000μg/mL,再吸取此液10 mL,以0.2N盐酸定容至100mL,即配成100μg/mL的酪氨酸溶液。此溶液配成后也应及时使 用或放入冰箱内保存,以免繁殖细菌而变质。 1.2 仪器 a. 分析天平: 感量0.1mg; b. 581-G型光电比色计或72型分光光度计; c. 水浴锅; d. 1、2、5、10mL移液管等。 1.3 操作 1.3.1 标准曲线的绘制 1.3.1.1 按下表配制各种不同浓度的酪氨酸溶液(表1)。 表 1 配制各种不同浓度的酪氨酸溶液 ━━━━━━━━━━━┳━━━━━━━━━━━━━━━━━━ ┃管号 试剂┣━━┳━━┳━━┳━━┳━━┳━━━
蛋白酶活力的测定
实验三蛋白酶活力的测定 一、目的 掌握用分光光度计法测定蛋白酶活力的原理与操作技术。 二、原理 蛋白酶水解酪蛋白,其产物酪氨酸能在碱性条件下使福林——酚试剂还原,生成鉬蓝与钨蓝,以比色法测定。 三、试剂及仪器 1.福林—酚试剂 称取50g钨酸钠(Na2WO4?2H2O),12.5g钼酸钠(Na2MoO4?2H2O),置入1000mL原底烧瓶中,加350mL水,25mL85%磷酸,50mL浓盐酸,文火微沸回流10h,取下回流冷凝器,加50g硫酸锂(Li2SO4)和25mL水,混匀后,加溴水脱色,直至溶液呈金黄色,再微沸15min,驱除残余的溴,冷却,用4号耐酸玻璃过滤器抽滤,滤液用水稀释至500mL。 使用时用2倍体积的水稀释。 2.0.4mol/L碳酸钠溶液:称取42.4g碳酸钠,用水溶解并定容至1000mL。 3.0.4mol/L三氯乙酸溶液:称取65.5g三氯乙酸,用水溶解并定容至1000mL。 4.2%酪蛋白溶液 称取2.00g酪蛋白(又名干酪素),加约40mL水和2~3滴浓氨水,于沸水浴中加热溶解,冷却后,用pH7.2磷酸缓冲溶液稀释定容至100mL,贮存于冰箱中。 5.pH7.2磷酸缓冲液 0.2mol/L 磷酸二氢钠溶液:称取31.2g磷酸二氢钠(NaH2PO4?2H2O),用水溶解稀释至1000mL; 0.2mol/L 磷酸氢二钠溶液:称取71.6g磷酸氢二钠(Na2HPO4?12H2O),用水溶解稀释至1000mL; pH7.2磷酸缓冲溶液:取28mL 0.2mol/L磷酸二氢钠溶液和72mL 0.2mol/L磷酸氢二钠溶液,用水稀释至1000mL。 6.标准酪氨酸溶液: 准确称取0.1g DL-酪氨酸,加少量0.2mol/L盐酸溶液(取1.7mL浓盐酸,用水稀释至100mL),加热溶解,用水定容至1000mL,每毫升含DL-酪氨酸100微克。 7.仪器:分光光度计、试管 四、操作步骤 1.标准曲线绘制 在上述各管中各取1mL,分别加入5mL 0.4mol/L碳酸钠溶液,1mL福林—酚试剂,于400C水浴显色20min,在680nm波长下测吸光度,绘制标准曲线,在标准曲线上求得吸光度为1时相当的酪氨酸μg数,即为K值。 2.酶液的制备
胰蛋白酶的动力学研究
实验三:胰蛋白酶的动力学研究 一.实验目的 1.掌握酶的米氏常数km值和Vmax的测定原理和方法。 2.了解底物浓度对酶促反应速率的影响。 二.实验原理 1.米氏方程:V=Vmax[S]/km+[S] V是反应初速度,[S]是底物浓度 2.采用双倒数作图法,对1/V=km/(Vmax[S])+1/Vmax作图: 3.本实验以酪蛋白为底物,来测定胰蛋白酶的km值 氨基酸是两性电解质,在水溶液中有如下平衡: -NH3是弱酸,完全解离时PH为11-12或更高,若用碱滴定-NH3所释放的H+来测定氨基酸,一般指示剂变色域小于10,很难准确指示滴定终点。 常温下,甲醛能迅速与氨基酸的氨基结合,生成羟甲基化合物,使上述平衡右移,促使-NH3释放H+,使溶液的酸度增加,滴定中和终点移至酚酞的变色域内(PH9.0左右)。因此可用酚酞作指示剂,用标准氢氧化钠溶液滴定。 如样品为一种已知的氨基酸,从甲醛滴定的结果可算出氨基氮的含量。如样品为多种氨基酸的混合物如蛋白质水解液,则滴定结果不能作为氨基酸的定量依据。但此法简便快速,常用来测定蛋白质的水解程度,随水解程度的增加滴定值也增加,滴定值不再增加时,表明水解作用已完全。 三.试剂与仪器 1.0.5%的胰蛋白酶溶液,用无离子水溶解。 2.酪蛋白酶溶液:40g/L,30 g/L,25 g/L,20 g/L,15 g/L,10 g/L,5 g/L,2.5 g/L;用稀碱溶解。
3.0.25%的酚酞溶液:2.5g酚酞用50%的酒精溶解,定容至1L。其变色范围是8.0—10.0(无色红 色)。 4.中性甲醛溶液:75ml分析纯甲醛加15ml0.25%酚酞乙醇溶液,以0.01mol/lNAOH滴定至微红,密闭 存放于棕色玻璃瓶中。 四.操作步骤 1. 组号 1 2 3 4 5 6 7 8 2.准备:7个50ml的三角瓶(分别编号:0 6),分别加入2.5ml中性甲醛与1滴酚酞(如果所取 甲醛已是微红色,则不用加碱;若不是微红色,以0.01mol/lNAOH滴定至微红色)。7瓶溶液的颜色应当一致。 3.滴定空白:按照操作1中的组号分别在0号三角瓶中加入5ml相对应的酪蛋白底物,以0.01mol/l 标准的NAOH滴定到微红色,记录消耗NAOH的体积。 4.1个200ml的碘量瓶(带磨口塞三角瓶),加40ml操作1中的组号相对应的酪蛋白底物,记为V空白, 在37℃水浴恒温锅中水浴10min,胰蛋白酶溶液也要在37℃水浴恒温锅中水浴10min。 5.10min到点后,取4ml胰蛋白酶溶液加入到酪蛋白溶液中,充分混匀,立即取出5ml反应液加入1 号三角瓶中,计时开始(0时刻)。滴入2滴酚酞,用0.01mol/lNAOH滴定至微红色,记录体积V0min。 6.按照操作5的步骤,在保温2min,4min,6min,8min,10min后,分别取反应液加入到2——6号 三角瓶中,分别滴入2滴酚酞,并用0.01mol/lNAOH滴定至微红色,分别记录体积V2min、V4min、V6min、V8min、V10min。 五.结果与分析 1.
水解酪蛋白琼脂培养基配方
北京华越洋生物提供 QQ:1733351176 水解酪蛋白琼脂培养基,MHAmedium 用途:用于抗生素敏感试验 水解酪蛋白琼脂培养基 配方(每升): 琼脂 17g 牛肉 300g(从中提取浸出粉) 可溶性淀粉 1.5g 酪蛋白水解物 17.5g 最终pH7.3±0.2 水解酪蛋白琼脂培养基使用方法: 1、 称取本品38g,加入蒸馏水或去离子水1 L,搅拌加热煮沸至完全溶解,分装三角瓶,121℃高压灭菌15min,备用. 2、 试验菌液的制备:从TSA 平皿上挑取3-5个形态相似的菌落顶端部分接种MHB 或TSB 培养基.经36±1℃培养4-6小时后,比浊至0.5麦氏单位. 3、 接种:用无菌棉拭浸取比浊好的菌液,在管壁内轻轻转压除去过多菌液,然后再轻轻涂抹培养基,每一平皿涂抹三次.每次涂抹后均需将平皿转动60度,再行下一次涂抹.每一质控菌株涂抹三个平皿. 4、 贴片:接种后的平皿置室温片刻,待稍干后,用无菌镊子将抗生素纸片均匀贴布于平皿琼脂表面.各纸片间中心间距不得小于24mm,纸片距平皿边不得小于15mm.一旦纸片接触琼脂表面,即不可再移动,因此时药物已开始扩散. 5、 培养:纸片贴妥后,在15-30分钟内,将平皿翻过来置于36±1℃培养16—24h 后,观察结果.平皿培养时不宜堆放,以二个相叠为宜. 水解酪蛋白琼脂培养基 原理:牛肉粉和酸水解酪蛋白提供氮源、维生素和氨基酸;可溶性淀粉吸收有毒的代谢产物;琼脂是培养基的凝固剂。 用法: 称取本品 42.0g,加热溶解于1000ml 蒸馏水中,121℃高压灭菌 15 分钟,待冷至 50℃, 倾入无菌平皿,备用。 质量控制: 在36±1℃培养18-24小时。 水解酪蛋白琼脂培养基用途:用于培养基原材料,提供细菌生长所需的生长因子。 技术指标 总氮 (8)
Prescission蛋白酶制作及使用方法
Prescission蛋白酶制作及使用方法 柱下酶切用酶的制作方法 1L TB菌体用PBS重悬至35ml做高压裂解,最终40ml总量。上清用流速,挂3-4ml柱子,PBS漂洗30ml。用含有10%甘油的洗脱液洗脱,每管收集体积为2ml,只取主峰,可以粗略定量,也可以取百分之一的量在Akta上用上样泵来做积分定量(参考下面的积分定量方法举例)。也可以用分光光度计定量,一般可用稀释20倍定量。马上分装成每管,可切5ml介质。 柱上酶切用酶的制作方法 亲和纯化方法同柱下酶切,洗脱液不含甘油,得到10ml左右洗脱液,浓缩10倍,再加入10ml 含有10%甘油和2mM DTT的PBS稀释,一共浓缩三次换buffer,每次浓缩时间一般在30分钟以内。最终浓缩至10mg/ml,浓缩10分钟混匀一次。尽快分装成每管,可切5ml介质。 柱上酶切用酶的Q纯化制作方法 亲和纯化方法同柱下酶切,洗脱液不含甘油,收集后加水大于三分之一。过Q柱,AB液配方中含有10%甘油,8%B洗脱,50%B直接洗下后积分定量,分装。 粗略定量参考 2000峰宽为,蛋白质总量为24mg,取了12ml,浓度为2mg/ml,直接分装的话,可以用125ul和250ul每份。 积分定量方法举例 取10ul ppase浓缩液,用本底缓冲液(PBS)稀释到500ul,用上样泵做积分定量,积分体积为325mAu*ml,可知浓缩好的蛋白质光吸收为每毫升为,光吸收为1,浓缩好的蛋白质浓度为ml,一共24mg 蛋白。 表达 1.取-80度保存的质粒pGEX-PPase转化BL21(DE3)感受态,涂布,37度孵箱培养12~16 h。 2.挑取单克隆到50ml LBA培养基37度培养12-15小时。 3.1%接种到1L TBA中,培养3小时,4度水浴降温,加终浓度为0.2mM的IPTG,度诱导培 养18小时。 4.4000rpm离心20分钟收菌。加入PBSE(1mM EDTA)至终体积30-40ml重悬。 纯化 1.高压裂解2-3次。 2.万转离心30分钟,留上清。 3.PBSS平衡5ml的GST柱,上样,PBSS漂洗,4℃放置过夜,等RNA降解,再用含有10%甘油和% Tween20的酶切buffer漂洗干净。洗脱用含10%甘油的还原性谷胱甘肽溶液,2ml每管收集,取峰尖3*。 4.上样泵灌盐酸胍再生柱子,重力流灌水,灌20%乙醇,4℃保存柱子。 酶切效率确定 5ul,10ul,20ul酶切PH35C蛋白3-4天,电泳检测酶切产物,全部切开了。估计10ul过夜酶切1L的培养产物足够,下次实验再做验证。 保存 用PCR管,分装50ul每管,冻存于-80度。 使用 谷胱甘肽洗脱的融合蛋白,加入1份PPase,混匀后4度过夜酶切。 缓冲液 1.10*PBSS(欧蒙基础) 配方:5包PBS粉剂(欧蒙),加入360ml 5M NaCl,定容到500ml,4℃保存。 2.500ml 2M Tris(),500ml 2M Tris()
pH对热处理状态下κ-酪蛋白水解作用和凝乳酶凝胶脱脂乳作用的影响解读
pH对热处理状态下κ-酪蛋白水解作用和凝乳酶 凝胶脱脂乳作用的影响 Effect of pH at heat treatment on the hydrolysis of k-casein and the gelation of skim milk by chymosin 目录 2 2 4 4 4 4 4 5 5 5 8牛奶的pH重调,酪蛋白在胶体相和血清相之间的分布
摘要 脱脂牛奶是指牛奶在调整pH值在6.5和7.1之间,在90℃加热30分钟后的牛乳。热处理后,样本再次进行调整到自然pH(pH值为6.67),建立新的平衡。高浓度的变性乳清蛋白与在pH为6.5时加热过程中的酪蛋白胶束有关(约占加热30分钟后总数的70%—80%)。变性乳清蛋白的含量在加热的条件下随pH的升高而降低。所以分别在pH6.7、6.9、7.1加热30分钟后与酪蛋白胶束有关的变性乳清蛋白的含量为30%、20%、10%。在加热时pH的增加使越来越多的酪蛋白转入到血清相中。以κ-酪蛋白的损失和副-κ-酪蛋白的形成时间作为用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测牛奶样本凝乳酶处理的结果。无论pH值在加热或热处理应用中,κ-酪蛋白的损失和副-κ-酪蛋白的形成在常温或加热的样品中相似。检测用凝乳酶作用过的牛奶样品的胶凝化性能随时间的变化表明不管已变性的乳清蛋白是否与酪蛋白微胶粒或牛奶中的血清有关,经过热处理的奶的凝胶化时间显著增加,所形成的凝胶的牢固性显著减小。pH对热处理没有影响。这些结果表明,牛奶的热处理只对凝乳酶反应(酶相)的初级阶段有很小的影响。然而,热处理对本反应的第二阶段有显著影响,不管变性乳清蛋白是否和酪蛋白胶束或牛奶血清中不沉淀的聚集体有关,其效果是类似的。 关键词:牛奶;热处理;pH值;凝乳酶;酪蛋白胶束;凝胶。 1.简介 在牛的酪蛋白胶束中,κ-酪蛋白主要位于二硫键连接的聚合物的胶束表面。疏水的N末端区域与亲水的胶束相关联,带负电荷的C末端区域作为一个高度柔性的纤维在胶束表面突出。 这种结构使酪蛋白胶束的稳定性提高,因为柔性纤维提供了抗聚集的空间位阻和静电稳定。虽然酪蛋白非常稳定,但是他们可以通过某些方法破坏,如酸化至等电点,加入溶剂如乙醇或某些特定酶。 酪蛋白胶束酶的不稳定是奶酪制作过程的基础。传统上所用的酶提取物是凝乳酶,是从年轻的小牛的第四个胃获得,它包含了一些主要控制牛奶凝固的主要凝乳酶(EC3.4.23.4)。凝乳酶添加到牛奶中后发生的反应可被分为不同的步骤或阶段。第一阶段是酶水解κ-酪蛋白的酶促反应,形成二肽作为反应产物。是一种N末端为副-κ-酪蛋白与酪蛋白胶束保持缔合,而C-末端的糖巨肽(GMP),被释放到血清相中的肽。实际上,凝乳酶被酪蛋白胶束表面上的柔性纤维切割,降低了表面电荷作用,去除立体“毛发”层。这导致酪蛋白胶束的不稳定。第二阶段包括胶束聚集,当有足够的κ-酪蛋白被水解并且如果温度和钙离子的活性足够高,这个阶段就会发生。第二阶段导致凝胶的形成。一些报道称在第三阶段将进一步反应,其中步骤包括如脱水收缩作用,非特异性的蛋白水解作用和结构重组的凝胶网络。
