研究生学位论文申请重新盲审的修改说明
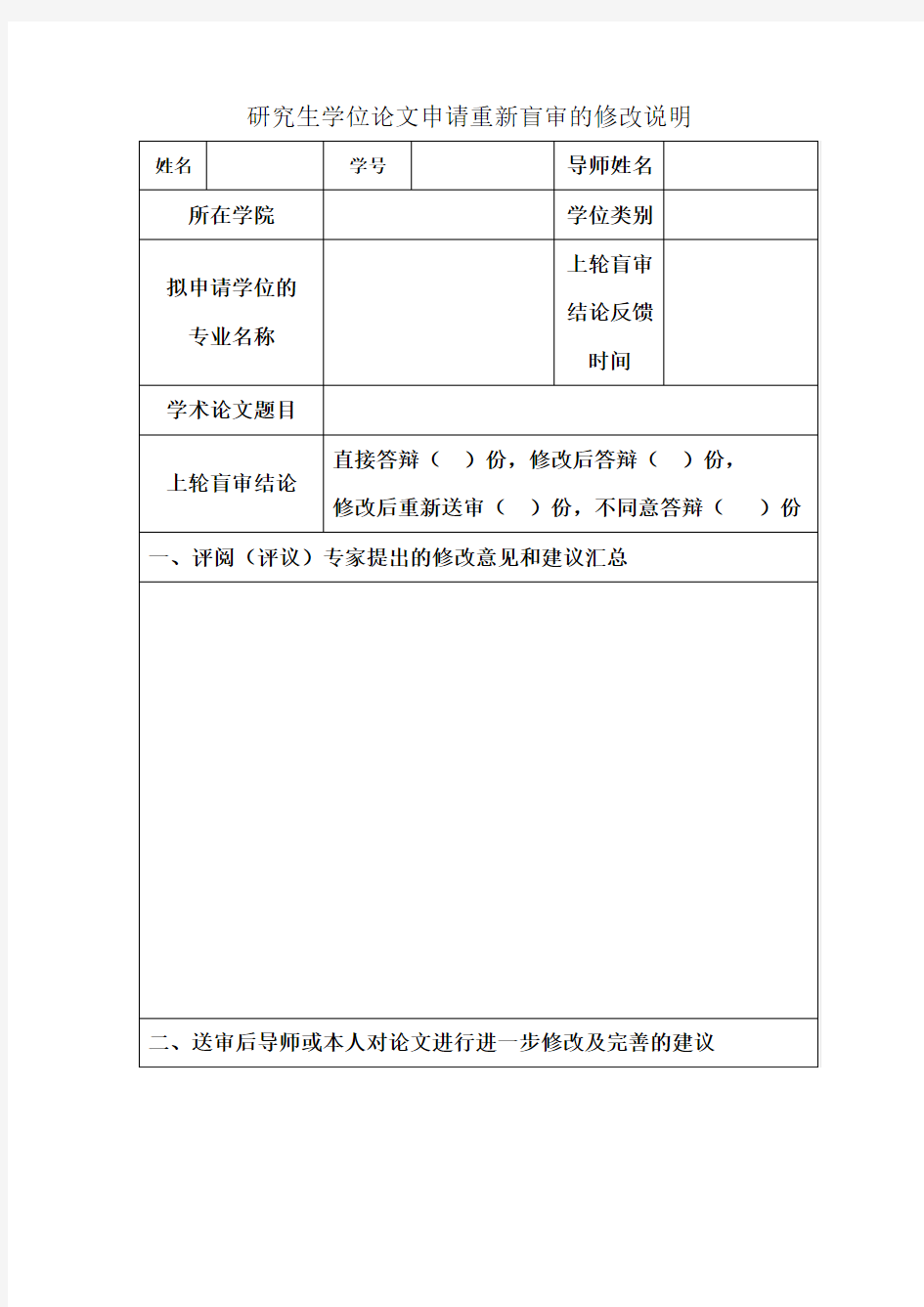

研究生学位论文申请重新盲审的修改说明
注:此表双面印制,可加页;表格一式两份,一份由学院留存,一份交校学位办。
药品补充申请表填表说明
药品补充申请-填表说明 我们保证:本项内容是各申请机构对于本项申请符合法律、法规和规章的郑重保证,各申请机构应当一致同意。 其他特别申明事项:需要另行申明的事项。同时标注:注册申请前是否进行过注册检验,以及检验单位名称。 1.本申请属于:系指如果属于申请境内注册品种选“境内生产药品补充申请”,如果属于申请境外注册选“境外生产药品补充申请”,如果属于申请港澳台注册选“港澳台医药产品补充申请”。本项为必选项目。 2.药品注册分类:按本品种原批准的注册分类属性选择相应的选项。本项为必选项。 3.是否为OTC:如同时申请非处方药,则选非处方药,此项不选,默认为申请处方药。 4.原申请品种状态:按品种实际情况选择相应的选项。本项为必选项。 5.申请事项分类:变更事项分类应按照《药品注册管理办法》、变更事项及申报资料要求等配套文件中有关分类要求选择。多个变更一并申报时,同时勾选。本项为必选项目。 6.药品通用名称:应当使用国家药品标准或者药品注册标准收载的药品通用名称。申报复方制剂或者中药制剂自拟药品名称的,应当预先进行药品名称查重工作。本项为必填项目。 7.英文名称:英文名填写INN英文名;中药制剂没有英文名的,可以免填;申报中药材的需提供拉丁名。本项为必填项目。 8.汉语拼音:均需填写,注意正确区分字、词、字母大小写等。可以参照中国药典格式填写。本项为必填项目。 9.化学名称:应当以文字正确表达药物活性物质的化学结构,不要采用结构式。本项为必填项目。 10.商品名称:申请人为方便其药品上市销售而申请使用的商品名称。境外生产药品可同时填写英文商品名称。商品名称仅限于符合新药要求的化学药品、生物制品及境外生产中药可以申请使用。 11.剂型:本项为必选项目。境外生产药品同时填写剂型的英文。 中国药典剂型:在“剂型”后选择所属剂型;剂型属于《中国药典》或其增补本收载的剂型,选中国药典剂型。 非制剂类:根据本品类型进行选择。其中“有效成份”系从植物、动物、矿物等物
药品补充申请
药品补充申请文件编码(GHTU-UITID-GGBKT-POIU-WUUI-8968)
药品补充申请(一) (省局审核,国家局审批部分) 一、行政许可内容 (一)持有新药证书的药品生产企业申请该药品的批准文号。 (二)使用药品商品名称。 (三)增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。 (四)变更用法用量或者变更适用人群范围但不改变给药途径。 (五)变更药品规格。 (六)变更药品处方中已有药用要求的辅料。 (七)改变影响药品质量的生产工艺。 (八)修改药品注册标准。 (九)替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。 (十)进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。 (十一)申请药品组合包装。 (十二)新药的技术转让。 (十三)修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。 (十四)进口药品在中国国内分包装。 (十五)其他。 五、申请材料
并按照下列顺序排列: (一)申报材料封面即目录; (二)《药品补充申请表》(5份);注册申请人可自行在国家食品药品监督管理总局网站()上下载最新表格。 (三)申报资料3套(按药品注册管理办法附件四要求提供) 注:申报资料原件2套、复印件1套;复印件应当与原件完全一致,应当由原件复制并保持完整、清晰,用A4纸打印或复印 药品补充申请(二) (省局审批,国家局备案部分) 一、行政许可内容 (一)改变国内药品生产企业名称。 (二)国内药品生产企业内部改变药品生产场地。 (三)变更直接接触药品的包装材料或者容器(除上述第10事项外)。 (四)改变国内生产药品的有效期。 (五)改变进口药品制剂所用原料药的产地。 (六)变更进口药品外观,但不改变药品标准的。 (七)根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。 (八)补充完善进口药品说明书安全性内容。 (九)按规定变更进口药品包装标签。 (十)改变进口药品注册代理机构。 (十一)其他。 五、申请材料
合同补充说明格式范文
合同编号: 合同补充说明格式范文 签订地点: 签订日期:年月日
合同补充说明格式范文 《XXX合同/协议》的补充协议 甲方:××公司(以下简称甲方)乙方:(以下简称乙方) 本协议中的所有术语,除非另有说明,否则其定义与双方于年月日签订的《XXX合同/协议》(下称"原协议")中的定义相同。 鉴于: 甲方和乙方于年月日共同签署了《XXX合同/协议》,双方本着互利互惠的原则,经友好协商,就《XXX合同/协议》中未尽事项特订立以下补充协议。 合同内容补充部分 其它事项说明 本协议生效 本协议生效后,即成为《XXX合同/协议》不可分割的组成部分,与《XXX合同/协议》具有同等的法律效力。 除本协议中明确所作修改的条款之外,原协议的其余部分应完全继续有效。 甲方(公章):乙方(公章): 法定人代表法定人代表 (或授权代表):(或授权代表): 开户银行:开户银行: 银行帐号:银行帐号:
通讯地址:通讯地址: 联系人:联系人: 联系电话:联系电话: 传真:传真: 篇二: 一、预租有关事宜 11 甲乙双方约定,甲方于本合同生效之日向乙方一次性收取________(币)________元(折合人民币________元)预收款。预收款的用途为________________。 12 甲方预租的商品房的交付必须符合下列第________种方案所列条款: (一)办理了房地产初始登记手续,取得新建商品房的房地产权证; (二)商品非住宅的,取得了竣工验收合格证明;商品住宅的,取得了《新建住宅交付使用许可证》。 甲、乙双方约定,选择上述第(二)种方案的,则本补充条款中应明确双方当事人在房屋交付与签订使用交接书期间的权利、义务和风险责任。 13 甲、乙双方约定: 选择上述第(一)种方案的,甲方应在取得新建商品房的房地产权证后的________日内通知乙方签订预租商品房使用交接书,并在签订预租商品房使用交接书的同时交付预租的商品房。
补充报告格式
关于申请提交资质补充材料的报告 省住建厅: 根据《湖南省2015年第四批建设工程质量检验检测机构资质审查意见公示》文件意见,我中心已按相关要求补充完全以下资料:1、人员医保、工伤证明材料;2、比表面积测定仪、砖用卡尺、弯沉仪有效检定证书。(内容见附件)现申请提交。 特此报告。 张家界市武陵源区建筑材料检测中心 2015年4月20日篇二:补充情况说明 补充情况说明 海南省食药局: 对去年五月份市食药局有关人员抽查我司16g产品送检的细节,进行了进一步详细调查了解,发现了几个新的情况汇报如下: 1、抽检单上我公司没有盖公章; 2、也没有我公司法人代表或指定的质量管理人签字 并按手(指)印; 3、产品类型的确定,系由抽检人员填写; 4、综上所述,本次抽检的有效性,按相关管理规定有 疑议。 海南金欣食品有限公司 2015年7月11日篇三:补充协议报告 报告 我司与重庆华厦门窗有限公司签订的专业工程施工分包合同《合川职教中心项目彩钢门窗分部分项工程合同》(以下简称原合同),因(分包方单位属于金属门窗制作为主的企业,税务规定,在异地最多只能开合同造价的28%的建安发票,其余开具材料增值发票),经协商,其中72%的建安税由甲乙双方各自承担一半,现签订本协议作为对原合同条款进行补充,本次补充协议代表甲乙方在本工程中由于税金而引起的总价调整,其余条款均执行原合同条款,甲、乙双方各自的权利、义务仍按原合同执行,增加暂定合同金额:1.5万元(大写:壹万伍仟元)篇四:实践报告规范格式 xxxxxxxxxxxx思想政治理论课实践教学 学生实践调研报告格式规范 为提高我校思想政治理论课程的实践教学水平,加强对实践教学的管理,社科部特制订xxxxxxxx学院思想政治理论课实践教学学生实践调研报告格式规范。 一、学生实践调研报告编写要求 思想政治理论课实践教学学生实践调研报告分为三个部分: 第一部分——报告封面(采用统一格式模版) 第二部分——报告正文(2000字以上) 第三部分——学生实践调研报告的佐证材料:如照片、调查问卷、实践证明及其它相关材料。 二、学生实践调研报告正文格式 1.调研报告页面设置 页面设置为a4纸;论文上边距2.54cm ,下边距2.54cm ,左边距3.17cm ,右边距3.17cm,行间距 1.5倍行距;页码在页面底端外侧设置。 以word(*.doc)格式存储,论文打印用a4纸双面打印。 2.调研报告字体字号选用
药品补充申请注册申报资料项目及说明
药品补充申请注册申报资料项目及说明 1.药品批准证明文件及其附件的复印件: 包括与申请事项有关的本品各种批准文件,如药品注册批件、补充申请批件、商品名批准文件、药品标准颁布件、药品标准修订批件和统一换发药品批准文号的文件、《新药证书》、《进口药品注册证》、《医药产品注册证》等。附件包括上述批件的附件,如药品标准、说明书、标签样稿及其他附件。 2.证明性文件: (1)申请人是药品生产企业的,应当提供《药品生产许可证》及其变更记录页、营业执照、《药品生产质量管理规范》认证证书复印件。申请人不是药品生产企业的,应当提供其机构合法登记证明文件的复印件。由境外制药厂商常驻中国代表机构办理注册事务的,应当提供外国企业常驻中国代表机构登记证复印件。境外制药厂商委托中国药品注册代理机构代理申报的,应当提供委托文书、公证文书及其中文译本,以及中国药品注册代理机构的营业执照复印件。 (2)对于不同申请事项,应当按照“申报资料项目表”要求分别提供有关证明文件。 (3)对于进口药品,应当提交其生产国家或者地区药品管理机构出具的允许药品变更的证明文件、公证文书及其中文译本。其格式应当符合中药、天然药物、化学药品、生物制品申报资料项目中对有关证明性文件的要求。 除变更药品规格、改变产地、改变制药厂商和注册地址名称外,生产国家或者地区药品管理机构不能出具有关证明文件的,可以依据当地法律法规的规定做出说明。 3.修订的药品说明书样稿,并附详细修订说明。 4.修订的药品标签样稿,并附详细修订说明。 5.药学研究资料: 根据对注册事项的不同要求,分别提供部分或全部药学研究试验资料和必要的原注册申请相关资料,申报资料项目按照附件1~3中相应的申报资料项目提供。 6.药理毒理研究资料: 根据对注册事项的不同要求,分别提供部分或全部药理毒理研究的试验资料和必要的国内外文献资料,申报资料项目按照附件1~3中相应的申报资料项目提供。 7.临床研究资料: 要求进行临床研究的,应当按照附件1~3中相应的申报资料项目要求,在临床研究前后分别提交所需项目资料。不要求进行临床研究的,可提供有关的临床研究文献。
药品补充申请申报事项说明
药品补充申请申报指南 一、报SDA批准的注册事项: 1、持有新药证书的药品生产企业申请该药品的批准文号指新药研制单位获得新药证书时不具备该新药生产条件,并且没有转让给其他药品生产企业的,在具备相应生产条件以后,申请生产该新药。 资料要求: 1.药品批准证明文件及其附件的复印件,同时提交新药证书原件 2.证明性文件:GMP证书、生产许可证、营业执照 3.修订的药品包装标签样稿(附详细修订比较说明) 4.样品自检报告(3批) 5.现场考察报告表 6.省所检验报告(3批) 注意事项:新药证书持有人应共同提出此项申请,即申请表中均应 填写并共同盖章 2、使用药品商品名称 资料要求: 1.药品批准证明文件及其附件的复印件 2.证明性文件:GMP证书、生产许可证、营业执照、\ 商标查询或注册证明 3.修订的药品说明书样稿(附详细修订比较说明) 4.修订的药品包装标签样稿(附详细修订比较说明) 注意事项: 1.药品商品名称仅适用于新化学药品、新生物制品。 2.中药不允许使用商品名。 3.不同规格使用一个商品名。 4.商标查询或受理注册证明的单位与申报人不一致,则需提供授权申报 人使用该商标的合同(原件),同时在申请表的申请理由中注明。
5.商品名基本原则:商品名不能包含以下文字:有暗示疗效作用、有夸大或褒扬药品作用、有该药品通用名称、有生产单位名称、包含数字等。 6.新药拟使用商品名,应当由药品生产企业在申请新药注册时一并提出。 7.设立监测期的新药,在监测期内,申请人可以按照补充申请的要求申请增加商品名;监测期已过的药品不再批准增加商品名。 8.不设立监测期的新药,自批准首家注册后,2年内申请人可以按照补充申请的要求申请增加商品名;超过2年不再批准增加商品名。 9.新药保护期、过渡期已过的药品不再批准增加商品名。 3、增加药品新的适应症或者功能主治 只能由药品生产企业提出申请。 资料要求: 1.药品批准证明文件及其附件的复印件 2.证明性文件:GMP证书、生产许可证、营业执照、 3.修订的药品说明书样稿(附详细修订比较说明) 4.修订的药品包装标签样稿(附详细修订比较说明) 5.药理毒理研究资料 6.临床研究资料 其药理毒理研究和临床研究应当按照下列进行: (1)增加新的适应症或者功能主治,需延长用药周期或者增加剂量者,应当提供主要药效学试验资料及文献资料、一般药理研究的试验资料或者文献资料、急性毒性试验资料或者文献资料、长期毒性试验资料或者文献资料,局部用药应当提供有关试验资料。临床研究应当进行人体药代动力学研究和随机对照试验,试验组病例数不少于300例。 (2)增加新的适应症,国外已有同品种获准使用此适应症者,应当提供主要药效学试验资料或者文献资料,并须进行至少60对随机对照临床试验。 (3)增加新的适应症或者功能主治,国内已有同品种获准使用此适应症 者,须进行至少60对随机对照临床试验,或者进行以获准使用此适应
关于资质证书变更情况的说明
关于资质证书变更情况的说明 一、变更应提交以下更名材料: 1.建设工程企业资质证书变更备案表、审核表; 2.由法人、股东或董事签字的变更申请; 3.职工代表大会(股东代表大会或董事会决议)意见; 4.未改制单位的上级主管部门的更名批复; 5.整体改制单位的上级主管部门的改制批复; 企业吸收合并,被吸收企业的注销登记证明; 企业新设合并重组,原有企业的注销登记证明; 6.变更后的营业执照或营业执照预核准通知书复印件; 7.新、旧企业章程; 8.工程勘察工程设计资质证书申请表一份及电子版数据;(只有变更单位名称的企业提供此表) 二、增补证书相关附件材料: 1.建设工程企业资质证书增补审核表; 2.需要提供全国性建筑行业报刊或省级以上(含省级)综合类报刊上刊登的遗失作废声明; 3.证书丢失的原因(盖单位公章);对丢失证书人作出的处理意见(盖单位公章)。
关于建设工程企业发生改制、重组、分立等情况 资质核定有关问题的通知 建市[2007]229号 各省、自治区建设厅,直辖市建委,北京市规划委员会,江苏省、山东省建管局,新疆生产建设兵团建设局,国务院有关部门建设司(局),总后营房部工程管理局,国资委管理的有关企业: 为了进一步明确工程勘察设计、施工、监理企业及招标代理机构(简称建设工程企业)改制、重组、分立后涉及资质重新审核办理的有关要求,简化审核办理程序,方便和服务企业,现将建设工程企业改制、重组、分立后涉及资质办理的有关事项通知如下: 一、下列类型建设工程企业改制、重组、分立,申请办理企业资质,按照有关规定重新进行核定。 1.企业新设分立(也称“解散分立”),即企业的资产(含设备,下同)、人员、业务等分立为两个或两个以上的新企业,原企业注销,新企业分别申请原企业的相关资质的; 2.企业派生分立(也称“存续分立”),即企业的部分资产、人员、业务等分立设立一个或几个新企业,原企业仍然存在。原企业和新企业分别申请原企业原有相关资质的,或者原企业不再拥有资质,由新企业申请原企业原有相关资质的; 3.企业经济性质变更,即内资企业被外资企业整体收购或收购部分股权,企业性质由内资企业变更为外资企业,经商务主管部门审批后,取得外商投资批准证书的;或者外资企业由于外国投资者的退出,企业性质由外资企业变更为内资企业,经商务主管部门注销外商投资批准证书后,办理工商营业执照变更为内资的。 属于以上第1、2两种情况的,分立设立的新企业应当提交原企业关于代表工程业绩、法律责任承继或分割情况的说明材料;若分立后的两家新企业分别申请原企业的同一项资质类别,则应当分别提供相应的代表工程业绩;属于第3种情况的,变更后的新企业申请原企业原有资质可不提交代表工程业绩材料。 对外资收购内资的,应按照《外商投资建筑业企业管理规定》(建设部、外经贸部令第113号)、《外商投资建设工程设计企业管理规定》(建设部、外经贸部令第114号)、《外商投资建设工程服务企业管理规定》(建设部、商务部令第155号)及《外商投资建设工程设计企业管理规定实施细则》(建市[2007]18号)等有关规定办理。 二、根据有关法律法规和企业资质管理规定,下列类型的建设工程企业发生改制、合并等情况申请资质证书的,可按照有关规定简化审批手续,直接进行证书变更。有关具体申报材料和程序按照《关于建设部批准的建设工程企业办理资质证书变更和增补有关事项的通知》(建市函[2005]375号)等要求办理。 1.企业吸收合并,即一个企业吸收另一个企业,被吸收企业已办理注销登记的; 2.企业新设合并,即有资质的几家企业,合并重组为一个新企业,原有企业注销,新企业申请承继原有企业资质的; 3.国有企业整体改制的,改制后的企业申请承继原国有企业的所有资质的;或者国有企业将其主营业务资产、人员等投资设立新的公司制企业,原国有企业依然存续,不再拥有建设工程企业资质,由新企业申请承继原企业与主营业务相
关于规范考勤管理的补充说明
关于规范考勤管理的补充说明 根据广州智康的实际运营情况,为进一步规范考勤、休假及数据提报工作,提高工作效率,根据《考勤管理制度》的相关规定,特进行考勤管理的补充说明。 第一条工时工作制 公司全体员工均需根据公司排班进行考勤,不实施打卡满9小时的工时工作制。 第二条打卡规定 一、公司全体员工实行指纹打卡,因加班、临时外出或当日请假未满8小时的员工,在离开或返回公司时均需指纹打卡。 二、跨校区授课老师,到其他校区上课,皆须在其所授课校区录入指纹。上课和离开均需进行指纹打卡。 三、各校区做好跨校区上课老师的考勤工作,需将所有到其校区上课的老师指纹录入指纹机。 四、员工忘记打卡,月累计3次(含3次),记为迟到一次。教师在其他校区授课忘记打卡,同样按照月累计3次(含3次),记为迟到一次。 忘记打卡,需填写《未打卡记录表》,并由部门/校区负责人签字确认。无任何手续视为旷工。《未打卡记录表》不是到其他校区/总部上课或工作的记录,是指忘记打卡需填写的表单。 公司总部职能员工外出,需填写《外出登记表》,并不计入未打卡记录。 五、员工请假必须填写《请假申请单》,经过审批后,方能进行休假。无纸质《请假申请单》的员工休假,一律按照旷工处理。员工如有紧急情况,不能及时填写《请假申请单》,需第一时间电话、邮件告知直属领导,休假完毕后需补填写《请假申请单》,经过审批后,由考勤员提交到人力资源部。无纸质版请假单,人力资源部皆视为无效请假,将按照公司考勤制度处理。 六、寒暑假期间的调休需在当年度12月31日前休完。其他员工(非老师)周一、二调休需在当月考勤周期内调休完毕。 第三条考勤表单、数据提报流程 一、校区/部门将自己校区/部门内的《请假申请单》、《未打卡记录表》、《加班申请表》、《员工存休汇总表》、《实际考勤记录汇总表》在每周一交到人力资源
软件登记事项变更或补充登记申请表填写说明
软件登记事项变更或补充登记申请表填写说明 本表适用范围: 本表格是软件著作权事项变更或补充登记事项的记载,作为证明已办理软件著作权或者合同登记事项变更或者补充登记的证明,例如:企业名称发生的变更。由已完成软件著作权登记的人和已完成软件著作权转让合同、专有许可合同登记人填写使用。 个人死亡、个人与法人或者法人之间的转让不在本变更的范围。 1、软件基本信息 “原登记类别”:按照所要变更的类别进行选择。 “原登记号”:填写软件著作权登记证书的登记号码。如:2006SR10234。 2、变更或补充信息 申请人应当根据情况,在变更和补充拦中做出选择。 a.变更登记,对原著作权登记和合同登记事项的变更。 b.补充登记,对原著作权登记和合同登记事项的补充。 变更事项填写:选择变更项、填写变更后内容;软件名称变更的,变更后内容应填写软件全称、简称、版本号,如,办公管理自动化软件[简称:办公自动化]V1.0。 注释:软件为多方共有的,办理著作权人名称变更时,变更后内容应填写全部著作权人名称,著作权人名称间需用分号分隔。 补充事项填写:选择补充项(首次发表日期)、填写补充后内容。 3、申请人 a.软件名称变更的: 申请人应当与软件著作权登记人、转让合同、专有许可合同登记人一致; b.软件著作权人名称变更的: 申请人应当与工商行政管理机关出示的企业变更证明中的名称一致; c.个人名称变更的:申请人应当与公安机关出示的个人更名证明中名称一致。
d.申请人是法人或其他组织的,填写单位全称、地址、电话、邮政编码、传真号、E-mail,并指定专人作为联系人。 e申请者是个人的,应填写姓名、地址、联系人(可以不是申请人)、电话、邮政编码、传真号、E-mail。 注释:软件为多方共有的,办理著作权人名称变更时,申请人填写全部著作权人名称,著作权人名称间需用分号分隔。 4、代理人 申请者委托代理的,写明委托权限范围、期限等内容,并写出代理人的单位全称(或个人的姓名)、地址、电话、邮政编码、传真号、E-mail,代理机构应指定一名专人作为联系人。代理者应当与授权委托书的单位全称(或个人的姓名)一致。 申请人和代理人请准确填写详细地址和E-mail,以免登记机构发出的信件和各类通知无法收到。 5、申请人签章栏 申请人应认真阅读并承诺所保证条文。 申请人为个人的签名或者加盖人名章;申请人为单位时请加盖公章,影印无效。 6、申请表自填报完成之日起6个月内未向登记机构提交相关申请材料的,系统将自动删除相关数据。请申请人及时进行登记申请。
申请增加工作人员的请示格式及范文
相关格式: ***领导: (第一段提出理由)我单位(或部门)目前......(主要说明你单位的实际情况,如:工作、生产存在的难度、造成人员紧缺的现状。即提出增加人员的理由和紧迫感.....话语要真实、理由要充分,让领导看后也认为应该增加人员) (第二段说明增加人员的必要性)简单明了......不要啰嗦 最后:提出以上请求当否,请领导批示......然后是年月日......就可以了 (篇一) 县政府: **年国土资源管理体制改革后,核定国土资源局机关编制共13名,其中:行政编制10名,后勤事业编制3名。局机关内设5个股室:办公室、矿产资源管理股、资源补偿费征收股、地籍规划测绘股、耕地保护和利用股。 国土资源执法监察大队为副科级事业单位(依照公务员管理),隶属县国土资源局,核定编制9名,其中:领导职数1名,事业编制7名,工勤编制1名。实有人数11名。 随着我局业务量的不断增加,工作人员紧缺,现请求调入秘书1名,监察专干1名(监察大队),工勤岗位2名(其中局机关司机1名、监察大队司机1名)。 以上请示妥否,请批示。 (篇二) 尊敬的总公司领导: **职业技术培训学校按编制配备了行政编制人员6人(其中主任一人,下属教务一人,办公室一人,招生一人,财务一人,及出纳一名)。在7个分公司中,我公司的人员配备,无论是领导总数还是人员总数都是最少的。随着培训工作的逐步细化和发展,在新形势学生培训出现了许多新情况、新问题,职校的培训工作;学生问题;学生报考处理;考点准备、执行及后续等任务相当繁重。因此,我职校人员少任务重的矛盾十分突出,已经难以适应职校工作发展的需要。为了切实加强职校的工作,进一步发挥职校的桥梁、纽带作用,恳请区编委能考虑职校的实际困难,增加一名工作人员。妥否,请批示。 **职业培训学校 年10月27日 (篇三) 公司领导: 根据《会计法》和《内部控制制度》的要求,结合公司财务管理制度,按照企业对财务岗位的具体要求,财务部门需要基本设置以下岗位人员:财务机构负责人、出纳、材料稽核、往来核算、固定资产核算、成本利润费用等,出纳人员不得兼管稽核、会计档案保管和收入、费用、债权债务账目的登记工作。 另外,按现代公司财务发展的要求需要编制财务决算和预算,各种专项财务预测和分析,也需要有专人负责核算。 公司财务部门目前财务人员仅有**人,为了健全企业财务制度,加强财务管理,特请示公司领导增加财务人员*?名。 妥否,请批示。 **财务部 (篇四) 公司领导: 随着公司项目进度的推进,业务量的增加,现有的人员无法满足公司正常管理的需求,人力资源部对各部门现有的在职人员情况进行了汇总,对现有岗位人员进行分析,为了能够满足
合同能源管理项目申报条情况补充说明及节能申请报告申请广东省节能专项资金的相关附
附件1 合同能源管理项目申报条件情况补充说明 一、本次支持的合同能源管理项目是指节能服务公司与用能单位以契约形式约定节能目标,节能服务公司提供必要的服务,用能单位以节能效益支付节能服务公司投入及其合理利润的节能效益分享型合同能源管理项目。节能服务公司,是指能提供用能状况诊断和节能项目设计、融资、改造、运行管理等服务的专业化公司。范围包括工业、建筑、交通、商贸酒店、公共机构等方面,内容主要为电机系统节能、锅炉(窑炉)改造、余热余压利用、能量系统优化、绿色照明改造、建筑节能改造等节能技术改造完工项目,且采用的技术、工艺和产品先进适用。 二、申请奖励资金的项目主体应稳定运行2年以上;节能服务公司投资70%以上,并在合同中约定节能效益分享方式;节能改造完工后应稳定运行3个月以上,满足节能量审核的条件,并取得执行合同以来节能效果分享收益;用能单位能源计量装置齐备,具备完善的能源统计和管理制度,实施后可实现单个项目年节能量(指节能能力)在10000吨标准煤以下、100吨标准煤以上(含),其中工业项目年节能量在500吨标准煤以
上(含)。三、属于下列情形之一的项目不予支持:新建、异地迁建项目;以扩大产能为主的改造项目,或“上大压小”、等量淘汰类项目;改造所依附的主体装置不符合国家产业政策;改造主体属违规审批或违规建设的项目;太阳能、风能利用类项目;以全烧或掺烧秸杆、稻壳和其它废弃生物质燃料,或以劣质能源替代优质能源类项目;煤矸石发电、煤层气发电、垃圾焚烧发电类项目;热电联产类项目;添加燃煤助燃剂类项目;2007年1月1日以后建成投产的水泥生产线余热发电项目,以及2007年1月1日以后建成投产的钢铁企业高炉煤气、焦炉煤气、烧结余热余压发电项目;已获得国家或省其他相关奖励或补助的项目。
湖北省建筑业企业资质变更申请表
湖北省建筑业企业资质变更申请表
填表说明 一、本表适用于建筑业企业资质变更申请。 二、本表应用钢笔或圆珠笔填写,或采用计算机A4幅面纸张打印,字迹工整,不得涂改。 三、申请变更时应由企业提出书面申请并提供相关附件资料。 四、申报企业对申报材料的真实性负责。 □1、企业名称变更 □建设行政主管部门关于同意企业更名的公函(注:一级企业需市级建设行政主管部门行文;二级企业需县级行政主管部门的批文,并经市级建设行政主管部门签署意见); □企业名称变更申请报告及变更申请表;□企业原有资质证书正、副本原件及复印件; □变更后的营业执照及工商部门出具的变更通知;□企业债权债务承诺书; □董事会或股东会关于变更事项的决议或文件; □若属改制更名应提供改制文件(改制方案、主管部门批文、国资部门批文、企业章程)。 □2、法定代表人变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □企业原有资质证书正、副本原件及复印件;□变更后的营业执照及工商部门出具的变更通知; □任职文件或董事会决议;□工作简历;□身份证;□职称证。 □3、企业地址变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □企业原有资质证书正、副本原件及复印件;□变更后的营业执照及工商部门出具的变更通知; □新办公场所的租赁合同、产权证明或购房合同。 □4、注册资本金变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □企业原有资质证书正、副本原件及复印件; □变更后的营业执照及工商部门出具的变更通知;□验资报告。 □5、营业执照注册号变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □变更后的营业执照及工商部门出具的变更通知; □6、经济类型变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □变更后的营业执照及工商部门出具的变更通知; □7、技术负责人变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □企业原有资质证书正、副本原件及复印件;□任职文件;□工作简历;□身份证;□职称证。 □8、企业负责人变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □企业原有资质证书正、副本原件及复印件;□任职文件;□工作简历;□身份证;□职称证。 □9、企业注册地变更 □企业申请变更的报告及变更申请表需经市级建设行政主管部门签署意见; □企业原工商营业执照注销证明及变更后新工商营业执照正副本复印件; □企业原工商注册地建设主管部门同意资质变更注册地的书面意见;□申请资质的全部材料。 五、企业资质变更一经核准,应在核准后15日内进行网上资料的变更,并按规定权限上传备案。 六、相关规定 根据《建筑业企业资质管理规定》(建设部令第159号):建筑业企业在资质证书有效期内名称、地址、注册资本、法定代表人等发生变更的,应当在工商部门办理变更手续后30日内办理资质证书变更手续。 未在规定期限内办理资质变更手续的,责令限期办理,处1万元以上3万元以下罚款。 六、企业在办理完相关资质变更手续后,应到我厅政务中心相关窗口办理《安全许可证变更》。 注:省直企业需提供有关材料的原件。
药品补充申请注册事项及申报 要求
附件4:药品补充申请注册事项及申报资料要求一、注册事项 (一)国家食品药品监督管理局审批的补充申请事项: 1、持有新药证书的药品生产企业申请该药品的批准文号。 2、使用药品商品名称。 3、增加中药的功能主治或者化学药品、生物制品国内已有批准的适应症。 4、变更用法用量或者变更适用人群范围但不改变给药途径。 5、变更药品规格。 6、变更药品处方中已有药用要求的辅料。 7、改变影响药品质量的生产工艺。 8、修改药品注册标准。 9、替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。 10、进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。 11、申请药品组合包装。 12、新药的技术转让。 13、修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。 14、改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。 15、改变进口药品的产地。 16、改变进口药品的国外包装厂。 17、进口药品在中国国内分包装。
18、其它 (二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监 督管理局直接备案的进口药品补充申请事项: 19、改变国内药品生产企业名称。 20、国内药品生产企业内部改变药品生产场地。 21、变更直接接触药品的包装材料或者容器(除上述第10事项外)。 22、改变国内生产药品的有效期。 23、改变进口药品制剂所用原料药的产地。 24、变更进口药品外观,但不改变药品标准的。 25、根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。 26、补充完善进口药品说明书安全性内容。 27、按规定变更进口药品包装标签。 28、改变进口药品注册代理机构。 29、其他 (三)省级食品药品监督管理部门备案的补充申请事项 30、根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。 31、补充完善国内生产药品说明书安全性内容。 32、按规定变更国内生产药品包装标签。 33、变更国内生产药品的包装规格。 34、改变国内生产药品制剂的原料药产地。 35、变更国内生产药品外观,但不改变药品标准的。 36、其他
药品补充申请注册事项及申报资料要求
附件4: 药品补充申请注册事项及申报资料要求 一、注册事项 (一)国家食品药品监督管理局审批的补充申请事项: 1.持有新药证书的药品生产企业申请该药品的批准文号。 2.使用药品商品名称。 3.增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。 4.变更用法用量或者变更适用人群范围但不改变给药途径。 5.变更药品规格。 6.变更药品处方中已有药用要求的辅料。 7.改变影响药品质量的生产工艺。 8.修改药品注册标准。 9.替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。 10.进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。 11.申请药品组合包装。 12.新药的技术转让。 13.修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。 14.改变进口药品注册证的登记项目,如药品名称、制药厂商名称、注册地址、药品有效期、包装规格等。 15.改变进口药品的产地。 16.改变进口药品的国外包装厂。 17.进口药品在中国国内分包装。 18.其他。 (二)省级食品药品监督管理部门批准国家食品药品监督管理局备案或国家食品药品监督管理局直接备案的进口药品补充申请事项: 19.改变国内药品生产企业名称。 20.国内药品生产企业内部改变药品生产场地。 21.变更直接接触药品的包装材料或者容器(除上述第10事项外)。 22.改变国内生产药品的有效期。 23.改变进口药品制剂所用原料药的产地。 24.变更进口药品外观,但不改变药品标准的。 25.根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。 26.补充完善进口药品说明书安全性内容。 27.按规定变更进口药品包装标签。 28.改变进口药品注册代理机构。 29.其他。 (三)省级食品药品监督管理部门备案的补充申请事项: 30.根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。 31.补充完善国内生产药品说明书安全性内容。
申报资料的补充说明
附件1 申报资料的补充说明 本文所列的申报资料内容要点的补充说明为通用要求。对于具体品种,可根据实际情况,及依据有关法规和指导原则选择适用的部分,不适用的项目和内容可不列出。本说明未尽事宜参照《化学药品新注册分类申报资料要求(试行)》以及相关管理规定办理。 一.药品名称 1、本项资料一般包括:通用名称、汉语拼音、英文名称、化学名称、化学结构式、分子式、分子量、曾用名、商品名、命名依据、药品名称查询情况(通用名称的查询情况及证明文件、商品名的查询情况及证明文件)。 2、药品的通用名称命名应当符合《中国药品通用名称》(国家药典委员会编)或国家药典委员会以其它方式确定的通用名称。自拟的药品通用名称,应符合药品通用名称命名原则,并提供在食药监总局网站数据库以中文和英文活性成分名称进行的药品通用名称查询记录,避免出现同名异物或同物异名的情况。复方制剂中各活性成分比例不同的,通用名称的命名应不同。在提交生产注册申请时,应提供经国家药典委员会核定的药品通用名称证明文件。创新药在申报临床试验阶段可以暂时以代号方式填报通用名称。 3、汉语拼音名称应当参照中国药典的格式编排,注意正确区分
字、词、字母大小写等。 4、在研发过程及各项资料中曾经使用的其他名称或代号,应在曾用名项下逐一列出。各项资料中所用的其他名称与所申报活性成分存在酸根或碱基等差异的,应详细作出说明。 5、化学药品新药在提出注册申请时,可以申请使用商品名,并可同时提出英文商品名。商品名应符合食药监总局发布的药品商品名称命名原则。申请使用商品名的,应当提供商标查询单(距药品注册受理日期半年内)或商标注册证。商标所有权人如非申请单位的,应当提供商标授权使用证明文件。商标注册受理通知书不能作为申请商品名的依据。 二.证明性文件 (一)本项资料一般包括: 1.申请机构资质证明文件 1.1境内申请人机构合法登记证明文件(营业执照或事业单位法 人证书复印件、组织机构代码证复印件等) 1.2 《药品生产许可证》正本及副本变更记录页复印件 1.3 《药品生产质量管理规范》认证证书复印件 1.4 申请人机构变更机构名称或地址等相关变更证明文件复印 件 2. 产品权属证明文件原件及技术转让合同复印件 3. 专利证明文件 3.1 申请的药物或者使用的处方、工艺、用途等专利情况及其权
护士执业资格证变更申请表
护士执业资格证变更申请表 中华人民共和国卫生部制 document management as a breakthrough, and constantly improve the content, active in the application. Government information between the provincial and municipal governments all passed through a network of offices, and six counties (districts) have complete decision-making service system and through dial-up internetworking is realized with the city, the City Planning Commission and other 10 departments has been one of the first to achieve a single network with the city. On the Government's website, focus on strengthening the management and operation of the site, update the website in a timely manner, strengthening the network resource sharing. At present, nearly 700 municipal government website page, updated news more than more than 6,000. Not long ago, China International e-government technology and application Conference was carried out in the country, "survey of best public services Government website" activities in Pingliang city people's Government website in five Northwestern provinces (districts) ranked second, ranked first in the Gansu province. V, infrastructure has made new breakthroughs In 2002 smooth completed organ office building of construction, and decoration and relocation of based Shang, we according to organ construction general planning, demolition hospital within old room 37 between, transformation garden 3600 square meters, new plant lawn 2700 square meters, planting
药品补充申请
药品补充申请 药品补充申请(一) (省局审核,国家局审批部分) 一、行政许可内容 (一)持有新药证书的药品生产企业申请该药品的批准文号。 (二)使用药品商品名称。 (三)增加中药的功能主治、天然药物适应症或者化学药品、生物制品国内已有批准的适应症。 (四)变更用法用量或者变更适用人群范围但不改变给药途径。 (五)变更药品规格。 (六)变更药品处方中已有药用要求的辅料。 (七)改变影响药品质量的生产工艺。 (八)修改药品注册标准。 (九)替代或减去国家药品标准处方中的毒性药材或处于濒危状态的药材。 (十)进口药品、国内生产的注射剂、眼用制剂、气雾剂、粉雾剂、喷雾剂变更直接接触药品的包装材料或者容器;使用新型直接接触药品的包装材料或者容器。 (十一)申请药品组合包装。 (十二)新药的技术转让。 (十三)修订或增加中药、天然药物说明书中药理毒理、临床试验、药代动力学等项目。(十四)进口药品在中国国内分包装。 (十五)其他。 五、申请材料 应按要求报送以下相关材料,所有材料用A4纸制作,文字材料和表格用电脑打印,并按照下列顺序排列: (一)申报材料封面即目录; (二)《药品补充申请表》(5份);注册申请人可自行在国家食品药品监督管理总局网站(https://www.360docs.net/doc/808742173.html,)上下载最新表格。 (三)申报资料3套(按药品注册管理办法附件四要求提供) 注:申报资料原件2套、复印件1套;复印件应当与原件完全一致,应当由原件复制并保持完整、清晰,用A4纸打印或复印 药品补充申请(二) (省局审批,国家局备案部分)
一、行政许可内容 (一)改变国内药品生产企业名称。 (二)国内药品生产企业内部改变药品生产场地。 (三)变更直接接触药品的包装材料或者容器(除上述第10事项外)。 (四)改变国内生产药品的有效期。 (五)改变进口药品制剂所用原料药的产地。 (六)变更进口药品外观,但不改变药品标准的。 (七)根据国家药品标准或者国家食品药品监督管理局的要求修改进口药品说明书。 (八)补充完善进口药品说明书安全性内容。 (九)按规定变更进口药品包装标签。 (十)改变进口药品注册代理机构。 (十一)其他。 五、申请材料 应按要求报送以下相关材料,所有材料用A4纸制作,文字材料和表格用电脑打印,并按照下列顺序排列。 (一)申报材料封面即目录; (二)《药品补充申请表》(4份);注册申请人可自行在国家食品药品监督管理总局网站(https://www.360docs.net/doc/808742173.html,)上下载最新表格。 (三)申报资料1套(按药品注册管理办法附件四要求提供) (三)药品注册管理处对资料进行形式审查,不符合要求的应一次性告知需补正的资料,符合要求的予以受理。要求进行现场核查和抽取样品的,在规定时限内完成现场考核和抽取样品,并通知省食品药品监督检验研究院进行样品检验;不能受理的予以退审并说明理由。 (四)下达《药品补充申请批件》,需样品检验的,在收到样品检验报告后下达《药品补充申请批件》或《药品补充申请通知件》。 (五)向国家食品药品监督管理总局上报备案。 药品补充申请(三) (省局备案部分) 一、行政许可内容 (一)根据国家药品标准或者国家食品药品监督管理局的要求修改国内生产药品说明书。 (二)补充完善国内生产药品说明书安全性内容。 (三)按规定变更国内生产药品包装标签。 (四)变更国内生产药品的包装规格。
