(完整版)元素周期表练习及答案

元素周期表练习---黄博伟
一、选择题
1.美国劳伦斯国家实验室曾在1999年宣布用86Rb离子轰击208Pb靶得到118号元素的一种原子,其质量数为293。其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文;但是科学家们相信,完整的第7周期包含的元素数目与第6周期相同。若118号元素将来被确认,则下列预测合理的是()
A.它的中子数是118 B.它是第8周期元素
C.它是活泼的金属元素D.它的最外层电子数是8
2.14C具有放射性,它能自发放出某种射线,而衰变成其他元素。考古学对出土生物遗骸的年代断定可以使用多种方法,其中较精确的一种是基于14C放射性的方法,但被断定的年代一般不超过5万年。下列考古遗址发现的遗物中能用14C测定年代的是() A.战国曾侯乙墓的青铜编钟(距今约2400年)
B.马家窑文化遗址的粟(距今约5300年)
C.秦始皇兵马俑(距今约2200年)
D.元谋人的门齿(距今约170万年)
3.对于第二周期从左到右的主族元素,下列说法中不正确的是()
A.原子半径逐渐减小B.电子层数逐渐增多
C.最高正化合价逐渐增大D.元素的非金属性逐渐增强4.据报道,某些花岗岩会产生氡(22286Rn),这是一种放射性很强的原子,会对人体产生伤害,因此,家庭装修时应尽量避免使用天然产的花岗岩材料。已知氡是一种稀有气体元素,下列叙述正确的是()
A.该原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子层结构
B.该原子最外层有8个电子
C.该原子中子数是86 D.1 mol气体氡的质量大约是444 g 5.2011年3月17日,因日本福岛第一核电站发生核辐射泄漏,放射碘可能被附近居民吸入,引发甲状腺疾病或甲状腺癌。我国香港和内地出现抢购碘盐的疯狂热潮,用于防护核辐射,医疗专家提醒:由于碘盐中碘含量相对较低,根本起不到预防放射性碘的作用,不可盲目过量吃碘盐或碘片,否则可能诱发甲状腺毒症、甲状腺技能减退、甲状腺肿等疾病。已知核辐射中放射性碘(碘-131)的核电荷数为53,则下列说法不正确的是() A.碘131I原子核所含中子数是78 B.核能的利用证实原子的可分性
C.碘127I原子和放射性碘原子131I属于同位素
D.碘127I原子和碘131I原子的质子数不同
6.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A 与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是() A.原子半径A<B<C B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物熔点比B的氧化物高D.A与C可形成离子化合物
7.下列叙述正确的是()
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
D.第三周期元素的离子半径从左到右逐渐减小
8.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是()
A.这几种元素在自然界中都不能以游离态存在
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
C.C、D、E的半径:C>D>E
D.化合物AE与CE具有相同类型的化学键
9.已知1~18号元素的离子a W3+、b X+、c Y2-、d Z-都具有相同电子层结构,下列关系正确的是()
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
10.门捷列夫在19世纪中叶,曾根据他所发现的周期律,预言过第四周期ⅣA族元素X(当时他称为“类硅”),下列有关“类硅”元素性质的叙述不正确的是() A.XH4不稳定,但有强还原性B.可用焦炭在高温下从XO2中冶炼X
C.X的单质的熔点比硅低
D.X的最高价氧化物对应的水化物分子式为X(OH)4,其酸性比H2SiO3强
11.A、B两元素为某周期ⅡA族和ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为()
①x+1②x+81③x+11④x+18⑤x+25⑥x+32
A.①②B.②④C.①③⑤D.②④⑥
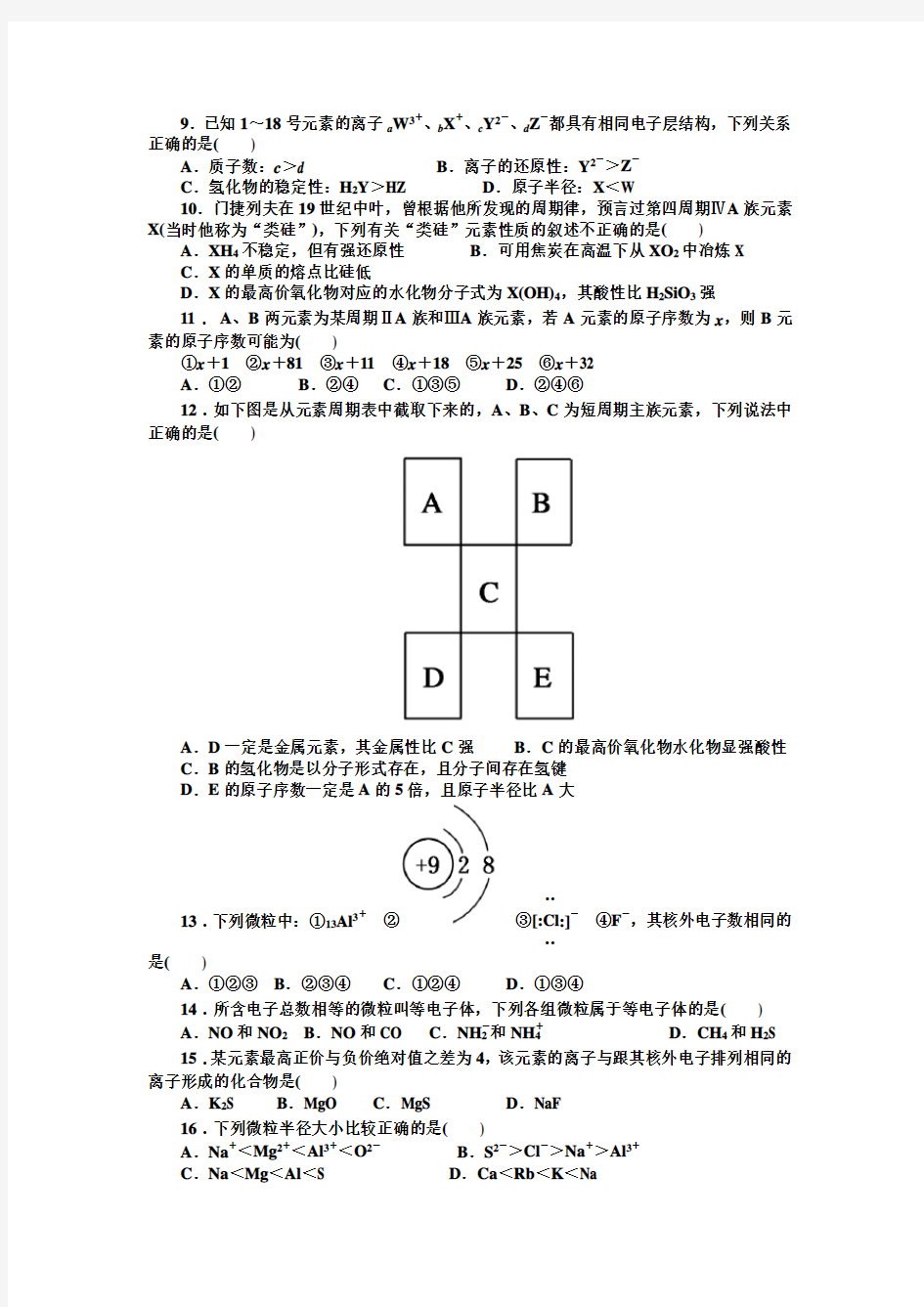
12.如下图是从元素周期表中截取下来的,A、B、C为短周期主族元素,下列说法中正确的是()
A.D一定是金属元素,其金属性比C强B.C的最高价氧化物水化物显强酸性C.B的氢化物是以分子形式存在,且分子间存在氢键
D.E的原子序数一定是A的5倍,且原子半径比A大
··
13.下列微粒中:①13Al3+②③[:Cl
:]-④F-,其核外电子数相同的
··
是()
A.①②③B.②③④C.①②④D.①③④
14.所含电子总数相等的微粒叫等电子体,下列各组微粒属于等电子体的是() A.NO和NO2B.NO和CO C.NH-2和NH+4D.CH4和H2S 15.某元素最高正价与负价绝对值之差为4,该元素的离子与跟其核外电子排列相同的离子形成的化合物是()
A.K2S B.MgO C.MgS D.NaF
16.下列微粒半径大小比较正确的是()
A.Na+<Mg2+<Al3+<O2-B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S D.Ca<Rb<K<Na
17.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,则下列叙述正确的是()
A.原子序数:A>B>D>C B.单质熔点:D>B>C>A
C.原子半径:D>B>C>A D.简单离子半径:C>A>D>B
18.在一定条件下,RO-3与R-可发生反应:RO-3+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是()
A.元素R位于周期表中第ⅤA族B.RO-3中的R只能被还原
C.R2在常温常压下一定是气体
D.若1 mol RO-3参与该反应,则转移电子的物质的量为5 mol
二、非选择题(本题包括5小题,共46分)
19.(10分)元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑩九种元素在周期表中的位置。
请回答:(以下用相应的元素符号回答问题
..............)
(1)在表里填写①~⑩元素符号
..,写出元素符号①________、③________、⑧________。
(2)其中化学性质最不活泼的是________(填元素符号
....)。
(3)在②、③、④三种元素的氧化物对应的水化物中,碱性最强
...)。
....的是________(填化学式
(4)元素①、②、⑤按原子半径由大到小的顺序依次为________(填元素符号
....),原因________。
(5)元素⑥的氢化物的化学式是________,该氢化物溶于水,所得溶液的pH________(填“<”、“>”或“=”)7。该氢化物与水发生反应的化学方程式为__________________________________。
(6)元素②与元素⑧形成的化合物的化学式是______;电子式是________,高温下灼烧该化合物火焰呈________色。
(7)________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的化学方程式是___________ _________________________________________________________。
20.(8分)X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+只含有一个质子;Y的正、负化合价绝对值相等,在同族元素中其氢化物最稳定;Z的原子核内质子数是Y的最外层电子数的2倍;F与Z同主族;E与X同主族。试推断
(1)下列元素分别是:Y__________、Z____________、F__________。(用元素符号表示)
(2)X、Z、E形成化合物的电子式为________,所含有的化学键有________;它属于________化合物(填“离子”或“共价”)。
21.(8分)A、B、C是短周期元素中的三种相邻元素,A、B为同周期元素,B、C为同主族元素,A、B、C的核外电子数之和为31。请回答下列问题:
(1)A、B、C的元素名称分别为:________、________、________;
(2)写出由A元素组成单质的电子式________,画出C离子的结构示意图:________;
(3)用电子式表示C的氢化物的形成过程:
_____________________________________________________。
22.(12分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)D元素在周期表中的位置是________,乙物质的电子式是________。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是________(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是:
_____________________________________________________。
(4)简述比较D与E金属性强弱的实验方法:__________________ _______________________________________________________________________________ _____________________________________。
23.(8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是________、________。
(2)②中反应的化学方程式为________________。
③中反应的离子方程式为__________________。
(3)CCl4在实验中所起的作用是________。
(4)该同学的实验设计不足之处是______________________,改进的办法是_______________________________________________。
元素周期表练习-黄博伟详解答案1:D点拨:根据各周期元素种类可推断出118号元素是第7周期最后1种元素。根据周期变化,最后为稀有气体,所以D项合理。
2:B 点拨:A中青铜编钟,C中兵马俑不是生物,D中元谋人的门齿其年代已经超过5万年。
3:B
4:B
5:D
6:B
7:C
8:C
9:B
10:D 点拨:X的最高价氧化物对应的水化物的酸性比H2SiO3弱。
11:C 点拨:在同一周期的前提下,若A、B为第2或第3周期元素,其原子序数之差为1,即B的原子序数为x+1。若A、B为第4或第5周期元素,其原子序数之差要加上10种过渡元素,B的原子序数为x+11。若A、B为第六或第七周期元素,其原子序数之差还包括15种镧系或锕系元素,即有24种过渡元素,B的原子序数为x+25。
12:C 点拨:A中D不一定是金属元素,A为O,B为Ne,C为Cl,则D为硒(Se)。B中C的最高价化合物水化物不一定显强酸性。A为硼、B为氮,则C为硅,硅的最高价氧化物是H2SiO3,H2SiO3是弱酸不显强酸性。D中E的原子序数不一定是A的5倍。如A 为O、B为Ne、C为Cl、D为Se、E为Kr,36号元素K不是8号元素O的5倍。
13:C 点拨:①②④中核外电子数都是10个,故C项正确。
14:C 点拨:C中NH-2含10e-。NH+4也含10e-,二者属于等电子体。
15:A 点拨:O、F无正价,B、D错。C中Mg2+与S2-核外电子排布不相同,C错,A中S的最高正价+6价与负价-2价绝对值差为4,且S2-与K+核外电子排布相同。故A 正确。
16:B 点拨:A项,4种离子核外电子数相同,随着核电荷数增多,离子半径依次减小Al3+<Mg2+<Na+<O2-,A错误。B项,S2-、Cl-比Na+、Al3+多一个电子层,
则S2-、Cl-半径比Na+、Al3+大,又因为S2-、Cl-核外电子数相同,S2-核电荷数小于Cl-核电荷数,半径S2->Cl-,Na+与Al3+核外电子数相同,核电荷数Na+<Al3+,半径Al3+<Na+,即S2->Cl->Na+>Al3+,B项正确。C项,Na、Mg、Al按照元素周期律半径依次减小,C项错误。D项,Na、K、Rb最外层电子数相同,电子层数依次增多,半径依次增大,D项错误。
17:CD 点拨:结合已知条件B的阳离子比C的阴离子少一个电子层可知:B、C同周期,原子序数B<C,再由B的阳离子比D的阳离子氧化性强,可推出原子序数D<B。由A、C同主族,A的气态氢化物比C的气态氢化物稳定可知原子序数A<C且在C的上一周期,由此推出原子序数为A<D<B<C,原子半径D>B>C>A。离子半径C>A>D>B,单质熔点比较无此规律,假若A为C,C为Si;B为Mg,D为Na则单质熔点为A>C
>B >D 。
18:D 点拨:R 元素可形成R -。说明R 是ⅦA 族元素并不是ⅤA 族。RO -3中R 元素是+5价不是最高正价。RO -3中R 既能被氧化,也能被还原。R 2在常温下不一定是气体,还可以是液体、固体,故A 、B 、C 错。D 中1 mol RO -3参与该反应变为R 2,由+5价到0价,转移电子的物质的量为5 mol ,故D 正确。
19:(1)H Mg Cl (2)He (3)NaOH
(4)K >Na >H 处于同一主族,同一主族从上到下原子半径逐渐增大
(5)NH 3 > NH 3+H 2O NH 3·H 2O
(6)NaCl Na +[:Cl ··
··
:]- 黄
(7)Al 2Al +2NaOH +2H 2O===2NaAlO 2+2H 2↑
20:(1)C O S (2)Na +[:O ··
··
:H]- 离子键、极性共价键 离子
21:(1)氮 氧 硫
(2) :N ??N:
(3)2H·+·S ·····―→H:S ··
··
:H
22:(1)第三周期第ⅡA 族
Na +[:O ····:O ··
··
:]2-Na +
(2)O <N <Al <Mg <Na
(3)2Al +2OH -+2H 2O===2AlO -2+3H 2↑
(4)镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应(其他合理也可) 23:(1)试管 胶头滴管
(2)2NaBr +Cl 2===2NaCl +Br 2
Cl 2+2I -===2Cl -+I 2
(3)萃取剂
(4)没能比较出溴和碘单质的氧化性强弱 将第③改为:KI 溶液+溴水+1 mL CCl 4,振荡,静置,观察四氯化碳层的颜色
高中化学必修2《元素周期表》的教学设计
人教版高中化学必修2《元素周期表》的教学设计 一、在教材中的地位和作用 本节课的内容选自于人民教育出版社出版的高中化学必修模块《化学2》第一章《物质结构元素周期律》第一节《元素周期表》的第一课时。通过义务教育九年级和高一必修《化学1》的学习,学生已经基本具备了一定的化学基础知识,为本节的学习奠定了一定的基础。元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律,是我们学习化学的重要工具。通过学习元素周期表,为以后学习元素周期律做好了铺垫。 二、教学目标 【知识与技能】 1.了解门捷列夫的成长史及其发现元素周期表的艰辛历程; 2.初步理解和掌握元素周期表的结构、周期和族的概念以及元素的“位-构”关系; 3.巧记周期表中的元素。 【过程与方法】 1.通过亲自编排元素周期表,培养学生的抽象和逻辑思维能力; 2.通过解读元素周期表,阅读教材,培养学生归纳总结,形成规律的能力; 3.通过推导元素的原子结构和位置之间的关系,培养学生的分析和推理能力。 【情感态度与价值观】 1.通过了解门捷列夫的成长史及其发现元素周期表的艰辛历程,培养学生在逆境中勇于挑战自我、不断追求真理的坚韧不拔的精神和勇于创新、不断探索的科学品质; 2.在“纸牌游戏”中,感受科学家发现元素周期表的情景,培养学生善于观察、勤于思考总结的科学态度,同时,激发学生学习化学的兴趣。 【教学重点】1.元素周期表的结构;2.元素在周期表中的位置与原子结构的关系。 【教学难点】元素的原子结构与其在元素周期表的位置的相互推断。 三、设计思路以故事引入新课题→纸牌游戏→周期表的编排规则和结构→周期表的巧记方法→达到开发学生智力,培养学生的创新精神和科学发现能力的目的。
高一化学必修2-元素周期表的推断专题训练
专项训练物质结构和元素周期律(推断题) 1、下列为元素周期表的一部分,表中阿拉伯数字(1、2……)是原周期表中行或列的序号.请参照元素A~I (1)B、C、H三元素中非金属性最强的是________(写出元素名称),写出由一种氢化物制取CD气体的化学方程式______________________________________。 (2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液反应的离子方程式:_____________________________________________________。 (3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1∶1和1∶2的两种化合物X和Y,该元素还能与A~I中的另一种元素构成原子个数比为1∶1和1∶2的两种化合物Z和M.写出Z与Y反应的化学方程式:____________________________________。 (4)F B C D E的原子半径顺序:(化学符号表示) F D E的离子半径顺序(化学符号表示,下同) 最高正价最高的是:族序数最大的是: 2、已知X、Y、Z、W是短周期元素中的四种非金属元素,它们的原子序数依次增大.X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍. (1)请写出Z在元素周期表中的位置。 (2)在一定条件下,由X单质与Z单质反应生E,写出该反应的化学方程式:____ _________________; E在催化剂存在的条件下,可用于还原汽车尾气中的_____________. (3)仅由X、Z、W三种元素组成的某种盐是____________________________;由X、Y、Z、W 四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为____________________________________。 (4)工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式_______________________________________________,该反应中被氧化的E与参与反
高中化学元素周期表练习题(附答案)
高中化学元素周期表练习题 一、单选题 1.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In )等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb )同周期。下列说法不正确的是( ) A.In 是第五周期第ⅢA 族元素 B.11549In 的中子数与电子数的差值为17 C.原子半径:In>Al D.碱性:()3In OH >RbOH 2.科学家合成出了一种新化合物(如图所示),其中W 、X 、Y 、Z 为同一短周期元素,Z 核外最外层电子数是X 核外电子数的一半。下列叙述正确的是( ) A.WZ 的水溶液呈碱性 B.元素非金属性的顺序为X>Y>Z C.Y 的最高价氧化物的水化物是中强酸 D.该新化合物中Y 不满足8电子稳定结构 3.今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W 、X 、Y 、Z 为短周期主族元素,W 与X 的最高化合价之和为8。下列说法错误的是( ) B.常温常压下,Y 单质为固态 C.气态氢化物热稳定性:Z 教学准备 1. 教学目标 1.认识元素周期表的结构;掌握周期、族的概念; 2.学会推算元素在周期表中的位置。 2. 教学重点/难点 教学重点 元素周期表的结构、元素的性质、元素在周期表中的位置与原子结构的关系。 教学难点 元素的性质、元素在周期表中的位置和原子结构的关系、核素、同位素。 3. 教学用具 多媒体、元素周期表挂图 4. 标签 教学过程 教学过程设计 [引言]上一节我们学习了元素周期律,知道元素的性质随着原子序数的递增而呈现周期性的变化。那么,有没有一种工具可以把我们已知的一百多种元素之间的这种周期性很好地表现出来呢?答案是肯定的。那就是元素周期表,也是我们本节课所要讲的主要内容。 [板书]第三节元素周期表(第一课时) [师]请大家拿出自己亲手绘制的元素周期表。 [学生取表,教师把元素周期表的挂图挂于黑板上] [师]根据元素周期律,把电子层数目相同的各种元素,按原子序数递增的顺序从左到右排成横行;再把不同横行中最外层的电子数相同的元素,按电子层 数递增的顺序由上而下排成纵行。这样,就可以得到一个表,这个表就叫元素 周期表。元素周期表有不同的形式,我们这里介绍的是其中一种常见的形式。 元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律,是我们学习化学的重要工具。下面我们就来学习元素周期表的有关知识。 首先,我们来认识元素周期表的结构。 [板书]元素周期表的结构 [师]数一数元素周期表有多少个横行?多少个纵行? [生](数后回答)有7个横行,18个纵行。 [师]对。我们把元素周期表中的每一个横行称作一个周期,每一个纵行称作 一族。下面,我们先来认识元素周期表中的横行——周期。 [板书]1.周期 [师]元素周期表中共有7个周期,请大家阅读课本P104的有关内容。 [学生活动] [问]把不同的元素排在同一个横行即同一个周期的依据是什么? [生]依据为具有相同电子层数的元素按照原子序数递增的顺序排列在一个横 行里。 [问]周期序数与什么有关? [生]周期序数等于该周期元素具有的电子层数。 [师]如此,我们可以得出如下结论: [板书]周期序数=电子层数 [投影练习]已知镁元素和溴元素的原子结构示意图: 它们分别位于第几周期?为什么? [生]镁有三个电子层,位于第三周期;溴有四个电子层,位于第四周期。 推断40 **测试试卷 一、推断题 1. (14分)下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、D是金属单质,L为红褐色沉淀,E为食盐的主要成分,I的水溶液呈强酸性。 (1)I的电子式为____________; (2)写出反应①的化学方程式:______________________________________。 (3)向M溶液中加入过量的I溶液反应的离子方程式为______________________。(4)写出一个由化合反应生成L的化学方程式______________________________。 (5)常温下,在pH=12的F溶液中逐渐滴入pH=2 CH3COOH至pH=7后,所得溶液中离子浓度的大小关系是: (6)从K的结晶水合物制备K的无水晶体的操作为 (7)在J的溶液中加入酸化H2O2的离子方程式 2. 从以下公共安全事件中,你能得到关于氯气性质的一些什么信息? ⑶为确定另一种金属离子是否存在,应补充的操作是__________________。 6. 通常 已知:E能溶于NaOH溶液中;F转化为G时,产物只有一种结构,且能使溴水褪色。请回答下列问题。 (1)结构简式:A ;B 。 ? D ; (2)化学方程式:C?→ ?G 。 F?→ 7. A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题: (1)A和D的氢化物中,沸点较低的是________(填“A”或“D”);A和B的离子中,半径较小的是_______________________________________________(填离子符号)。(2)C在元素周期表中的位置是_____________。 元素周期表练习 一、选择题 1. 对于第二周期从左到右的主族兀素,下列说法中不正确的是 (B ) A .原子半径逐渐减小 B .电子层数逐渐增多 C .最高正化合价逐渐增大 D .元素的非金属性逐渐增强 2. 据报道,某些花岗岩会产生氡 (需Rn ),这是一种放射性很强的原子,会对人体产生伤 害,因此,家庭装修时应尽量避免使用天然产的花岗岩材料。已知氡是一种稀有气体元素, 下列叙述正确的是 (B ) A .该原子与同周期I A 、n A 族阳离子具有相同的核外电子层结构 B .该原子最外层有 8个电子 C .该原子中子数是 86 D .该原子核外有 5个电子层 3. 2011年3月17日,因日本福岛第一核电站发生核辐射泄漏,放射碘可能被附近居民吸 入,引发甲状腺疾病或甲状腺癌。我国香港和内地出现抢购碘盐的疯狂热潮,用于防护核 辐射,医疗专家提醒:由于碘盐中碘含量相对较低,根本起不到预防放射性碘的作用,不 可盲目过量吃碘盐或碘片,否则可能诱发甲状腺毒症、甲状腺技能减退、甲状腺肿等疾病。 已知核辐射中放射性碘(碘—131)的核电荷数为53,则下列说法不正确的是 (D ) A .碘1311原子核所含中子数是 78 B .核能的利用证实原子的可分性 C .碘1271原子和放射性碘原子1311属于同位素 D .碘1271原子和碘1311原子的质子数不同 C. R 2在常温常压下一定是气体 D. 若1 mol RO 3参与该反应,则转移电子的物质的量为 5 mol 二、非选择题(本题包括5小题,共46分) 7:元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①? ⑩九种元素在周期表中的位置。 @F — ,其核外电子数相(C ) A .①②③ B .②③④ C .①②④ 5. 某元素最高正价与负价绝对值之差为 4, 形成的化合物是(A ) A . K S B . MgO C . MgS D .①③④ 该元素的离子与跟其核外电子排列相同的离子 D . NaF 6. 在一定条件下, RO 3与 R — 可发生反应: 元素的叙述中,正确的是 (D ) A .元素R 位于周期表中第V A 族 RO 3 + 5R — + 6H + ===3R 2+ 3H 2O ,下列关于 R B. R03中的R 只能被还原 元素周期表的应用 教材分析 (一)知识脉络 在学过原子结构、元素周期律和元素周期表之后,结合《化学1(必修)》中学习的大量元素化合物知识,通过对第3周期元素原子得失电子能力强弱的探究,整合ⅧA族元素及其化合物的性质,以及对金属钾性质的预测等一系列活动,归纳得出同周期、同主族元素的性质递变规律,体会元素在周期表中的位置、元素的原子结构、元素性质(以下简称“位、构、性”)三者间的关系,学会运用元素周期律和元素周期表指导化学学习、科学研究和生产实践。 (二)知识框架 (三)新教材的主要特点: 旧教材是根据第3周期元素性质的递变通过归纳得出元素周期律和元素周期表,而新教材则是在学过元素周期律和元素周期表之后,让学生根据原子结构理论预测第3周期元素原子得失电子能力的递变规律和金属钾性质,再通过自己设计实验去验证。教材这样处理旨在培养学生的探究能力,引导学生学会运用元素周期律和元素周期表来指导化学学习和科学研究。 二.教学目标 (一)知识与技能目标 1、以第3周期元素和ⅦA、ⅠA族元素为例,使学生掌握同周期、同主族元素性质递变规律,并能用原子结构理论初步加以解释; 2、了解元素“位、构、性”三者间的关系,初步学会运用元素周期表; 3、通过“实验探究”、“观察思考”,培养学生实验能力以及对实验结果的分析、处理和总结能力; 4、了解元素周期表在指导生产实践等方面的作用。 (二)过程与方法目标 1、通过“活动·探究”,学会运用具体事物来研究抽象概念的思想方法; 2、通过“阅读探究”、“交流·研讨”、“观察思考”等活动,培养学生获取并整合信息的能力; 3、通过对本节内容的整体学习,学会运用元素周期律和元素周期表指导探究化学知识的学习方法。 (三)情感态度与价值观目的 1、通过对门捷列夫的预言和一些化学元素的发现等化学史的学习,让学生体验科学研究的艰辛与喜悦; 2、通过对元素“位、构、性”间关系的学习,帮助学生初步树立“事物的普遍联系”和“量变引起质变”等辨证唯物主义观点; 3、通过对元素周期表在指导生产实践中的作用等知识的学习,让学生体会化学对人类生活、科学研究和社会发展的贡献,培养学生将化学知识应用于生产生活实践的意识。 三、教学重点、难点 (一)知识上重点、难点 1、同周期、同主族元素性质递变规律; 2、元素“位、构、性”三者间的关系。 (二)方法上重点、难点 学会在元素周期律和元素周期表指导下探究和学习元素化合物知识的学习方法。 四、教学准备 1、第1课时前,布置学生预习并准备实验探究方案; 2、第2 课时前,教师绘制“ⅦA族元素原子结构和性质比较”表格,并布置学生完成。 3、第3 课时前,布置学生上网查阅“元素周期表的意义” 五、教学方法 实验探究法、讨论归纳法 六、课时安排 3课时 七、教学过程 第1课时 元素推断试题专题练习 1、下面给出几道高考试题或高考模拟题中元素周期表推断题的题干描述,请以最快的速度将题目中的各字母所代表的元素推出。 (1)(07武汉)X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水。 X Y Z W (2)(08全国II)Q、R、X、Y、Z 为前20 号元素中的五种,Q 的低价氧化物与X 单质分子的电子总数相等,R 与Q 同族,Y 和Z 的离子与Ar 原子的电子结构相同,Q 能分别与Y、Z 形成的共价化合物,且原子序数Y 元素周期表练习题 一、选择题(每小题只有1个选项符合题意) [ ]1.下列关于元素周期表的说法,错误的是 A.元素周期表是元素按原子量大小排列而成的 B.从第一周期到第三周期元素,其原子的价电子数和族数是一致的 C.主族元素中(氢除外)族序数越小的元素,其最高价氧化物的水化物碱性越强 D.元素周期表是元素周期律的具体表现形式 [ ]2.下列各图若为元素周期表的一部分(表中数字为原子序数),其中正确的是 [ ]3.下列各组中的元素用原子序数表示,其中都属于主族的一组元素是 A.2、4、6 B.19、20、21 C.1、3、5 D.8、16、18 [ ]4.主族元素在周期表中的位置取决于元素原子的 A.原子量和核外电子数 B.电子层数和最外层电子数 C.原子量和最外层电子数 D.电子层数和次外层电子数 二、选择题(每小题有1或2个选项符合题意) [ ]6.下列关于周期表中第三周期元素性质从左到右变化趋势的叙述,错误的是 A.最高正价依次升高 B.气态氢化物稳定性逐渐增强 C.原子半径逐渐增大 D.最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强 [ ]7.下列气态氢化物中,按稳定性由强到弱的顺序排列的是 A.HI、HBr、HCl、HF B.HCl、H2S、PH3、SiH4 C.H2O、H2S、HCl、HBr D.HF、H2O、NH3、CH4 [ ]8.下列各组元素最高价氧化物对应水化物碱性渐弱,酸性渐强的是 A.NaOH、Mg(OH)2、H3PO4、H2SO4 B.KOH、NaOH、H2SO4、HClO4 C.Be(OH)2、Ca(OH)2、HBrO4、HClO4 D.Mg(OH)2、Ba(OH)2、H3PO4、H2SO4 [ ]9.同主族3种元素X、Y、Z,已知它们的最高价氧化物对应水化物的酸性HXO4>HYO4>HZO4则下列判断正确的是 A.原子半径X>Y>Z B.气态氢化物稳定性 HX<HY<HZ C.非金属性X>Y>Z D.气态氢化物还原性HX>HY>HZ [ ]10.R元素的原子有3个电子层,M层电子数是K层电子数的3倍,对R元素的判断不正确的是A.R元素处于3周期ⅥA族 B.R元素是较活泼的非金属元素 C.原子核外共有14个电子 D.元素最低化合价为-2价 [ ]11.某元素Y的核外电子数等于核内中子数,取 g该元素的单质与氧气充分反应,可得化合物YO2,则该元素在周期表中位置 A.第三周期 B.第二周期 C.第ⅣA族 D.第Ⅴ族 [ ]12.短周期中的两种元素X和Y,X的原子序数大于Y,X原子的最外层电子数是内层电子总数的一半,Y的二价阴离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是 A.Z是酸性氧化物 B.Z的水化物是碱 C.Z的化学式为X2Y D.Z的水化物的酸性强于硫酸 [ ]13.A、B、C 3种元素的核外电子数都比氩原子少,若A和C处于同一主族,A和B的核电荷数之差为5,B原子的M电子层比L电子层少2个电子,则A、B、C 3种元素分别为 A.Li、Na、S B.Na、S、Li 元素周期律、元素周期表 2 1.了解元素周期表的结构,周期与族的概念。 2.通过学生自主学习,谈周期表的结构完成本节课。 3.确定位置和结构的关系,形成科学的学习方法 重点:通过自行设计,掌握元素周期表 难点:确定位置和结构的关系,形成科学的学习方法 提问或学生发表意见 元素周期表 一、元素周期表的结构 (一)周期 三长三短一不全,七周不全还待填 周期序数=电子层数 (二)族 7主、7副、0族、第八族 包括:主族(A)、副族(B)、第VIII族和零族 主族序数=最外层电子数 第1-2课时 【引入】上节课我们学习了元素周期律,都有哪些规律? 【过渡】今天这节课我们用一个表的形式把它表现出来,这个表就叫元素周期表。 【板书】元素周期表 【设疑】至今为止元素周期表中排列着100多种元素。 【指导看表】浅绿 -----?金属 绿色 -----?非金属 【提出目标】今天我们要解决的问题有: 1、这些元素时按照怎样的规律排列到对应的位置呢? 2、元素在周期表中的结构。 【板书】一、元素周期表的结构 看元素周期表 【提问】谁来总结第一个问题? 【小结】表由横行、纵行构成 周期族 电子层数相同,最外层电子数相同 【板书】(一)周期 周期序数=电子层数 “三长三短一不全,七周不全还待填” 【讨论】教材104 页5-11表,介绍镧系、锕系元素及超铀元素概念 【板书】(二)族 包括:主族(A)、副族(B)、第VIII族和零族 主族序数=最外层电子数 各族在周期表中的位置关系: 主族在中间,副族夹两边; 零族最右边,Ⅷ族最中间 练习 1、已知S的电子结构示意图为,写出S在元素周期表中的位置。 2、第三周期最外层有5个电子是那种元素? 3、第六周期第ⅧB的元素名称是 【小结】周期表的结构: 族的种类、数目和具体位置(七主、七副、零族、第八族) 周期的种类、数目和具体位置(三短、三长、不完全) 掌握前20号元素、七个主族和零族元素的元素名称和元素符号 阅读课本<<元素周期律的发现>>回答下列有关问题. 1、元素周期律的发现背景是什么? 2、元素周期律的发现和元素周期表的编制是否是完全归功于门捷列夫? 3、门捷列夫总结出的元素周期律是否就是我们现在所学的元素周期律? 4、门捷列夫在研究的过程中,最突出的两大贡献是什么? 推断40 **测试试卷 、推断题 1. (14分)下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、D是金属单质,L为红褐色沉淀,E为食盐的主要成分,I的水溶液呈强酸性。 (1)________________________ I的电子式为; (2)写出反应①的化学方程式:_________________________________________ 。 (3)向M溶液中加入过量的I溶液反应的离子方程式为_________________________ 。 (4)_______________________________________________________________________ 写出一个由化合反应生成L的化学方程式_____________________________________________ 。 (5)常温下,在pH=12的F溶液中逐渐滴入pH=2CHC00至pH=7后,所得溶液中离子 浓度的大小关系是: (6)从K的结晶水合物制备K的无水晶体的操作为 (7)在J的溶液中加入酸化H2Q的离子方程式 2. 从以下公共安全事件中,你能得到关于氯气性质的一些什么信息? 马来西亚中部怡保市郊区2010年3月22日下午发生氯气中毒事件,造成近千人受到不同程度的中毒,其中有16人中毒较重,被送入怡保中央医院治疗。 2004 年4月15日下午,处于主城区的重庆天原化工总厂氯氢分厂工人在操作中发现,2号氯冷凝器出现穿孔,有氯气泄漏,厂方随即进行处置。16日1时左右,裂管发生爆炸;凌晨4时左右,再次发生局部爆炸,大量氯气向周围弥漫。由于附近民居和单位较多,重庆市连夜组织人员疏散居民。16日17时57分,5个装有液氯的氯罐在抢险 处置过程中突然发生爆炸,事故共造成9人死亡和失踪,3名重伤已脱离生命危险。死 伤人员均为天原化工总厂领导技术人员和职工。事故发生后,重庆市消防特勤队员昼夜连续用高压水网(碱液)进行高空稀释,在较短的时间内控制了氯气的扩散。 3?酒精灯的火焰分为三层,由外到内依次为外焰、内焰、焰心,若把一根洁净的铜丝,由外焰逐渐深入到内焰,能观察到什么现象?又由内焰逐渐拉出,又能观察到现象依次写出可能有的化学方程式 4. A —F 6种有机物,在一定条件下,按下图发生转化 又知烃A的密度(在标准状况下)是1.16g/L,试回答下列问题: (1)有机物的名称:A. ,B ,D. 。 (2)有机物的结构简式:E , F o (3)反应B C的化学方程式是 (4) C D的反应类型属于反应。C + E f F的反应类型属于反应。 5. 某溶液中可能含有Na+、K+、Br「、SQ「、CO2「等离子中的全部或其中的几种,现进行以下的连续操作: a .用洁净铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色; b溶液中通入氯气,溶液由无色变为红棕色; c ?溶液中加入过量的稀硫酸后,无 气体放出;再加Ba(OH)2溶液后,产生白色沉淀。试填写下列空白: ⑵上述a—c的操作中,是错误的,理由是 第一章物质结构元素周期律 第一节元素周期表 第一课时 ●教学目标:使学生了解元素周期表的结构以及周期、族等概念。 ●教学重点:元素周期表的结构 ●教学方法:启发、诱导、阅读、讨论、练习、探究等 ●教学用具:投影仪、多媒体、元素周期表挂图等 ●教学过程 【引入】丰富多彩的物质世界是由一百多种元素组成的,这一百多种化学元素有什么内在联系呢?那么,有没有一种工具可以把我们已知的一百多种元素之间的这种内在联系很好地表现出来呢?答案是肯定的。那就是元素周期表,也是我们本节课所要讲的主要内容。 【板书】第一节元素周期表(第一课时) 【阅读】请同学们阅读课本第四页的文字,回答: (1)哪一位科学家首先制得了第一张元素周期表? (2)编排第一张元素周期表时,是以什么为编排顺序?现在的周期表又以什么为编排顺序? (3)什么叫原子序数?它和核电核数、质子数有什么关系? 【板书】原子序数=核电核数=质子数=核外电子数 【探究】你能否将1—18号元素编成一个小小的周期表? 要求: 1.将性质相似的元素归类。 2.体现元素性质的周期性递变规律。 编制原则: 1.将最外层电子数相同的元素归为一列。 2.将相同电子层数相同的元素排在一行。 3.按原子序数的递增编排。 【投影】收集具代表性的由学生所编制的周期表。用实物投影仪投影到屏幕上。设计1:设计2: H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar 【讨论】请大家讨论一下以上两种周期表的编排,哪一种更为合理呢? 【小结】虽然He的最外层电子数与Be和Mg相同,但He原子的最外层已经排满了,达到了稳定结构,而Be和Mg都没达到稳定结构,因此He的性质与Be和Mg并不相似,反而与同是达到稳定结构的Ne和Ar相似,所以将He、Ne、Ar归为一列更合理。 【讲述】把电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行;再把不同横行中最外层的电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。这样,就可以得到一个表,这个表就叫元素周期表。元素周期表有不同的形式,我们这里介绍的是其中一种常见的形式。 【课件展示】讲解元素周期表的结构 【板书】一、元素周期表的结构: 【讲述】元素周期表有7个横行,每一个横行叫做一个周期。其中第一、二、三周期叫做短周期,四至六周期叫做长周期,第七周期由于没有排满叫做不完全周期。 【探究】观察周期表的结构,归纳填表: 【讨论】根据上述填表和周期表的观察思考,你能得出什么结论? 【板书】结论: 1.周期序数=电子层数 【化学】化学原子结构与元素周期表的专项培优练习题(含答案)含 答案 一、原子结构与元素周期表练习题(含详细答案解析) 1.南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。 (1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。 (2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示: N、O、Mg元素的前3级电离能如下表所示: 元素I1/kJ?mol-1I2/kJ?mol-1I3/kJ?mol-1 X737.71450.77732.7 Y1313.93388.35300.5 Z1402.32856.04578.1 ①X、Y、Z中为N元素的是____,判断理由是__________。 ②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。 ③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6- 表示,其中m代表等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号πn m 参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则N4-中的大π键应表示为_________。 (3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。若晶体中紧邻的N5-与Ag+的平均距离为a nm,N A表示阿伏加德罗常数的值,则AgN5的密度可表示为 _____g?cm-3(用含a、N A的代数式表示)。 【答案】3d5 ds Z X最外层为2个电子,X为镁;N的2p轨道处于半充满的稳定状态, 高中化学组卷元素周期表及周期律练习题 答案及解析 一.选择题(共6小题) 1.地壳中含量最多的元素在周期表中的位置是() A.第二周期VIA族B.第二周期VA族 C.第三周期VIA族D.第三周期VA族 2.Q、W、X、Y、Z都是短周期元素.X、Y、Q在周期表中的位置关系如图.W、Z的最外层电子数相同,Z的核电荷数是W的2倍.则下列说法不正确的是() ⅠAⅡAⅢAⅣA Q X Y A.非金属性:W>Z B.原子半径:X>Y>Z C.最高价氧化物对应水化物的碱性:X>Y D.氢化物稳定性:Q>W 3.下列叙述正确的有() A.第四周期元素中,锰原子价电子层中未成对电子数最多 B.第二周期主族元素的原子半径随核电荷数增大依次减小 C.卤素氢化物中,HCl的沸点最低的原因是其分子间的范德华力最小 D.价层电子对相斥理论中,π键电子对数不计入中心原子的价层电子对数 4.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是() A.简单离子半径:W<X<Z B.W与X形成的化合物溶于水后溶液呈碱性 C.气态氢化物的热稳定性:W<Y D.最高价氧化物的水化物的酸性:Y>Z 5.根据元素周期表和元素周期律分析下面的推断,其中错误的是() A.酸性由强到弱的顺序:HClO4>H2SO4>H3PO4 B.氢氧化钙比氢氧化镁碱性强 C.气态氢化物的稳定性X>Y,说明X的非金属性比Y强 D.最外层电子数X>Y,说明X的非金属性比Y强 6.已知Cl、S、P为三种原子序数相连的元素,则下列说法正确的是() A.气态氢化物的稳定性:HCl>H2S>PH3 B.非金属活泼性:S<Cl<P C.原子半径:Cl>S>P D.原子序数:S<P<Cl 二.填空题(共3小题) 7.针对下面10种元素,完成以下各小题.回答下列间题. 1.现有A 、B 、C 、D 、E 、F 六种短周期元素,它们的原子序数依次增大。A 、D 同主 族,C 、E 同主族,D 、E 、F 同周期。A 、B 的原子最外层电子数之和与C 原子的最外层电子数相等。 A 能分别与B 、C 形成电子总数相等的分子,且A 与C 形成的化合物常温下为液态,A 能分别与E 、F 形成电子总数相等的气体分子。 请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关): (1)A ~F 六种元素原子,原子半径最大的是 (填对应的元素符号,下同)。 (2)A 与B 两种元素组成一种阳离子,该离子的结构式为 。 (3)C 、A 两种元素组成的化合物中,既含有极性共价键,又含有非极性共价键, 该化合物的电子式为 。 (4)E 、F 两种元素中非金属性强的是 ;能够证明这一结论的化学事 实是 。 (1)Na (2) (3) (4)Cl 酸性:HClO 4>H 2SO 4 或稳定性:HCl >H 2S 等 (只要合理就得2分) 2.X 、Y 、Z 、L 、M 五种元素的原子序数依次增大。X 、Y 、Z 、L 是组成蛋白质的基础 元素,M 是地壳中含量最高的金属元素。回答下列问题: (1)五种元素的原子半径从大到小的顺序是 (用元素符号 表示)。 (2)X 与Z 形成的3∶1的化合物A ,它与Z 的最高价氧化物对应的水化物B 反应的 化学方程式 ,该水溶液显 性,用离子方程式解释原因 。 (3)硒是人体必需的微量元素,与L 同一主族,其最高价氧化物对应的水化物化学 式为 。该元素固体单质与H 2反应生成0.5 mol 气态氢化物时吸收了14.87kJ 的热量,请写出1mol 该物质与氢气化合的热化学方程式 。 (4)用M 单质作阳极,石墨作阴极,NaHCO 3溶液作电解液进行电解,生成难溶物R , R 受热分解生成化合物Q 。写出阳极生成R 的电极反应 式: ;由R 生成Q 的化学方程 式: 。 (1) Al >C >N >O >H(2分) (2) NH 3+HNO 3===NH 4NO 3(2分) 酸(1分) NH +4+H 2O NH 3·H 2O +H +(2分) (3)H 2SeO 4(2分) Se(s)+H 2(g)===H 2Se(g) ΔH =+29.74kJ·mol -1 (2分) (4) Al -3e -+3HCO - 3===Al(OH)3↓+3CO 2↑(2分) 2Al(OH)3=====△Al 2O 3+3H 2O(2分) 3.W 、X 、Y 、Z 是短周期中的四种常见元素,其原子序数依次增大。W 、Y 的氧化物 是导致酸雨的主要物质,X 原子最外层电子数等于电子层数,Z 元素的最高价氧化物的水化物的酸性是最强的。 (1)W 位于元素周期表第______周期第______族。W 的气态氢化物稳定性比 2H O(g)______(填“强”或“弱”)。 (2)Y 有两种常见的氧化物,能同时使溴水和酸性高锰酸钾溶液褪色的是 (写化学式)。 N H H H H + 第二节《元素周期律》练习题1 1、原子序数从11依次增加到17,下列递变关系中,错误的是 A.最外层电子数逐渐增多B.原子半径逐渐增大 C.最高正化合价数值逐渐增大D.从Si到Cl,最低负化合价从-4到-1 2、下列化合物中阳离子半径和阴离子半径之比最大的是() A、LiI B、NaBr C、KCl D、CsF 3、下列元素原子半径最大的是A、Li B、F C、Na D、Cl 4、下列各组元素中按微粒半径递增顺序排列的是() A、K Na Li B、Ba2+ Ca2+ Mg2+ C、Ca2+ K+ Cl- D、N O F 5.下列所画原子结构示意图正确的是 6、某元素的核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是 7、和氖原子有相同的电子层结构的微粒是 8、核外电子层结构相同的一组粒子是 A.Mg2+、Al3+、Cl-、Ne B.Na+、F-、S2-、Ar C.K+、Ca2+、S2-、Ar D.Mg2+、Na+、Cl-、S2- 9、某元素X的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,X元素的化合价为A、5n-12 B、3n-12 C、3n-6 D、n-10 10、元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是 11、元素性质呈周期性变化的决定因素是 A.元素原子半径大小呈周期性变化 B.元素原子量依次递增 C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化 12、aXn-和bYm+两种简单离子,其电子层结构相同,下列关系式或化学式正确 A、a –n = b + m B、a + m = b –n C、氧化物为YO m D、氢化物为H n X 13.下列各组元素性质的递变情况错误的是( ) A.Li、Be、B原子最外层电子数依次增多B.P、S、C1元素最高正价依次升高 C.N、O、F原子半径依次增大D.Na、K、Rb的电子层数依次增多 第一章物质结构元素周期律 教材分析 物质结构和元素周期律是化学的重要理论知识,也是中学化学教学的重要内容.通过学习这部分知识,可以使学生对所学元素化合物等知识进行综合、归纳,从理论进一步加深理解.同时作为理论指导,也为学生继续学习打下基础.本章内容虽然是理论性知识,但教材结合元素化合物知识相互融合,以利于学生理解和掌握. 第一节元素周期表 第1课时 教学目标 1、能描述元素周期表的结构。 2、了解元素原子核外电子排布. 3、通过对原子结构的初步认识,树立对立统一的观点,知道有关元素、核素、同位 素的涵义及其简单的计算。 重点难点 元素周期表的结构及元素周期律 教学过程 [导入]展示一张元素周期表(有条件的可让学生自己查找各种元素周期 表) [过度]我们按照元素在周期表中的顺序给元素编号,得到原子序数。可见原子序数与原子结构间存在什么关系?(结合1~18号元素原子结构) [板书]原子序数=核电荷数=质子数=核外电子数 [提问]请同学们回忆初中所介绍的原子结构的知识。 [学生]原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。原子核由质子和中子构成。下面我们对原子的结构做进一步认识。 [板书]第一章物质结构元素周期律 第一节元素周期表 一、原子结构 质子 原子 核外电子 [过渡]下面我们先分析构成原子的个微粒的电性及其质量情况。 (投影) 表5—1 构成原子的粒子及其性质 [提问]从表格得出原子的质量主要取决于哪种微粒? [教师]原子的质量主要集中在原子核,质子和中子的相对质量都近似为1,如果忽略电子的 质量,将核内所有质子和中子的相对质量取近似值相加起来,所得的数值叫做质量数。 [提问]根据质量数的定义,可得质量数与质子数和中子数间的关系。 [板书]质量数(A )=质子数(Z )+中子数(N ) [过渡]在化学上,我们为了方便地表示某一原子。在元素符号的左下角表出其质子数,左上 角标出质量数A Z X 。 [投影练习] 原子核 中子 第一部分专题七 一、选择题 1.(2015·石家庄一模)根据原子结构及元素周期律的知识,下列推断正确的是() A.3517Cl2与3717Cl2氧化能力相近,二者互为同位素 B.7834Se与8034Se所含质子数相同,中子数不同 C.同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 D.同周期主族元素形成的简单离子半径随核电荷数的增大而减小 解析:本题考查物质结构与元素周期律,意在考查考生对同位素、核素概念的理解及对元素周期律的应用能力。同位素是针对元素而言的,而不是单质,A项错误;7834Se和8034Se是Se的两种核素,二者质子数均为34,前者中子数为44,后者中子数为46,B项正确;同主族元素形成的最高价含氧酸(最高价氧化物对应的水化物)的酸性随着核电荷数的增加而减弱,而不是同主族元素的任一含氧酸,C项错误;同周期主族元素的金属离子比非金属离子少一个电子层,同周期非金属离子的半径比金属离子的半径大,D项错误。 答案:B 2.(2015·合肥一模)下列物质性质排列顺序正确的是() ①热稳定性:H2O>HF>H2S②还原性:HI>HBr>HCl③熔沸点:AsH3>PH3>NH3 ④酸性:HNO3>H2CO3>HClO A.①③B.②④ C.①④D.②③ 解析:本题考查物质性质的比较,意在考查考生对物质结构和元素周期律的理解能力。 ①非金属性:F>O>S,则热稳定性:HF>H2O>H2S,错误;②非金属性:Cl>Br>I,则还原性:HCl元素周期表教学设计教案
元素周期表推断题 40道概要
高中元素周期表练习及答案
高中化学《元素周期表的应用》教案
元素推断题整理
元素周期表练习题附答案
元素周期表教案
元素周期表推断题40道
《元素周期表》教案 (人教版必
【化学】化学原子结构与元素周期表的专项培优练习题(含答案)含答案
元素周期表及周期律试题答案及解析
元素周期表推断题
元素周期表结构习题及答案
高中化学优质教案 元素周期表 教学设计[必修]
【走向高考】2016高考化学二轮复习习题:专题7元素周期表 元素周期律
