食品致泻大肠埃希氏菌检验原始记录
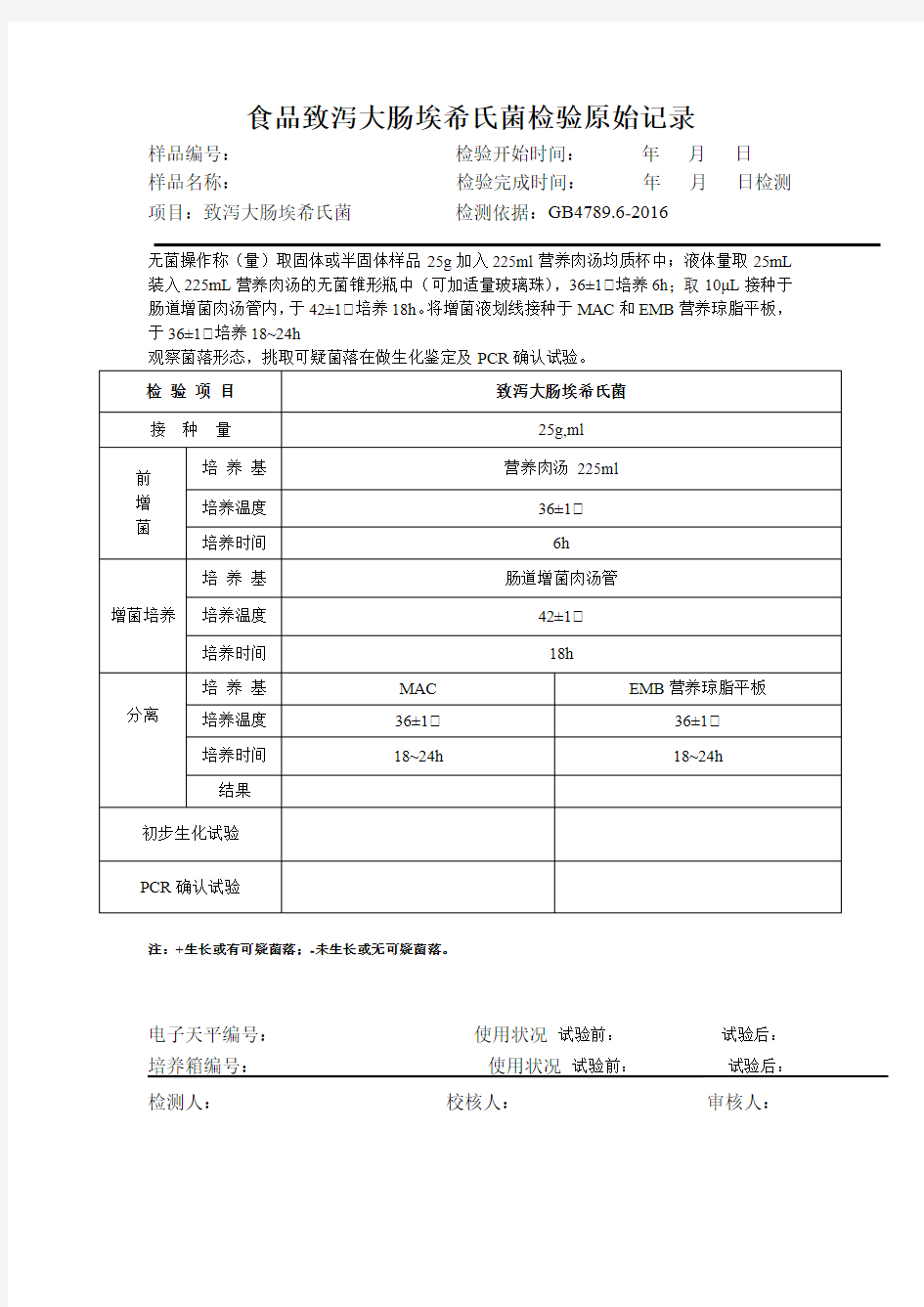
食品致泻大肠埃希氏菌检验原始记录
样品编号:检验开始时间:年月日
样品名称:检验完成时间:年月日检测项目:致泻大肠埃希氏菌检测依据:GB4789.6-2016
无菌操作称(量)取固体或半固体样品25g加入225ml营养肉汤均质杯中;液体量取25mL 装入225mL营养肉汤的无菌锥形瓶中(可加适量玻璃珠),36±1℃培养6h;取10μL接种于肠道增菌肉汤管内,于42±1℃培养18h。将增菌液划线接种于MAC和EMB营养琼脂平板,于36±1℃培养18~24h
观察菌落形态,挑取可疑菌落在做生化鉴定及PCR确认试验。
注:+生长或有可疑菌落;-未生长或无可疑菌落。
电子天平编号:使用状况试验前:试验后:培养箱编号:使用状况试验前:试验后:检测人:校核人:审核人:
微生物原始记录(大肠杆菌)
微生物检验原始记录 受理编号检()号第页/共页 检验依据GB15979—2002 《一次性使用卫生用品卫生标准》 一、实验器材 1. 试验菌株名称:大肠杆菌,菌株号:8099,培养代数代,琼脂斜面培养基培养,培养条件: 2. 试剂及培养基配制、灭菌见《试剂及培养基配制记录C》: 第1次; 第2次; 第3次。 3.恒温水浴箱:编号。 4. 恒温培养箱:编号。 5.秒表:编号 6.样品名称:。 有效成份:,含量:,批号:。 二、方法 1. 操作步骤:按GB15979—2002 附录C4溶出性抗(抑)菌产品抑菌性能试验方法操作程序进行。受理编号:()号第页/共页
三、结果 1. 第1次试验对大肠杆菌的抑菌效果 作用时间接种稀释倍数平皿生长菌数菌药管菌数抑菌率(min)(cfu/皿)(cfu/ml)(%) 2 5 10 20 阳性对照:接种稀释倍数: 平皿生长菌数: cfu/皿 菌液浓度: cfu/ml。 阴性对照:阴性对照:菌生长。 受理编号:检()号第页/共页
2. 第2次试验对大肠杆菌的抑菌效果 作用时间接种稀释倍数平皿生长菌数菌药管菌数抑菌率(min)(cfu/皿)(cfu/ml)(%) 2 5 10 20 阳性对照:接种稀释倍数: 平皿生长菌数: cfu/皿 菌液浓度: cfu/ml。 阴性对照:阴性对照:菌生长。 3. 第3次试验对大肠杆菌的抑菌效果 作用时间接种稀释倍数平皿生长菌数菌药管菌数抑菌率(min)(cfu/皿)(cfu/ml)(%)2 5 10 20 阳性对照:接种稀释倍数: 平皿生长菌数: cfu/皿 菌液浓度: cfu/ml。 阴性对照:阴性对照:菌生长。 受理编号:检()号第页/共页
大肠埃希菌的检查
药品中大肠埃希菌的检验 (1)按细菌总数测定方法制备供试液。 (2)取供试品l:10稀释液10mL,接种在制好的100mL胆盐乳糖培养基中,在37℃恒温箱中培养18~24 h,进行增菌培养。 (3)用接种环挑取上述培养物接种在麦康凯琼脂平板(MacC)或伊红美蓝琼脂平板(EMB)上,置37℃培养18~24 h,进行分离培养。观察有无鲜桃红色或微红色、中心深桃红色、圆形、扁平、边缘整齐、表面光滑、湿润的菌落形成。 (4)挑取2~3个疑似大肠埃希菌菌落,分别接种在营养琼脂斜面培养基上,在37℃下培养18~24 h,进行纯培养。 (5)将疑似大肠杆菌的培养物涂片进行革兰染色,经镜检证明为G-无芽孢短杆菌的,应继续做生化试验。 (6)生化试验 ①乳糖发酵试验。将上述纯培养物接种在乳糖发酵管中,在37℃下培养24~ 48 h。凡大肠埃希菌,可发酵乳糖产酸产气。 ②靛基质试验。将上述纯培养物接种在蛋白胨水培养基中,在37℃下培养(48±2)h.加入0 .3~0 .5 mL靛基质试液(对二甲基氨基苯甲醛),观察液面。液面呈玫瑰红色为阳性反应,呈试剂本色为阴性反应。 ③甲基红试验将纯培养物接种在磷酸盐葡萄糖胨水培养基内,在37℃下培养(48±2)h,在1 rnL培养液中加入l滴甲基红试剂,立即观察结果。呈鲜红色或橘红色为阳性反应。呈黄色为阴性反应。 ④乙酰甲基甲醇生成试验(VP试验)。将纯培养物接种在磷酸盐葡萄糖胨水培养基内,在37℃下培养(48±2)h,在2mL培养液中加入α一萘酚乙醇液1 mL_,混匀,再加入质量分数为40%的氢氧化钾溶液0.4mL后观察结果。培养液应在加入试剂后的4 h内呈红色为阳性反应,无红色为阴性反应。 ⑤枸橼酸盐利用试验。将纯培养物接种在枸橼酸盐斜面培养基上,在37℃下培养(48±2)h,观察结果。斜面有菌生长,培养基由绿色变为蓝色为阳性反应,斜面无菌生长培养基仍呈绿色为阴性反应。 (7)判断结果。经染色镜检证实为G–无芽孢短杆菌,乳糖发酵试验产酸产气,IMVC试验结果为++––或–+––的,可确认供试品中含有大肠埃希菌。
环境监测原始记录表
环境监测原始记录表 环境保护监测中心站 2012年
目录 1. 地表水采样原始记录表19.离子选择电极原始记录表 2. 大气采样原始记录表20.分光光度法分析原始记录表 3. 降水采样原始记录表21.原子吸收分光光度法分析原始记录表 4. 降尘采样原始记录表22.气相色谱分析原始记录表 5. 土壤采样原始记录表23.离子色谱分析原始记录表 6. 底质(底泥、沉积物)采样原始记录表24.细菌总数测定原始记录表 7. 污染源废水采样原始记录表25.粪大肠菌群测定原始记录表 8. 固定污染源排气中气态污染物采样原始记录表26.区域环境噪声监测原始记录表 9. 固定污染源排气中颗粒物采样原始记录表27.城市交通噪声监测原始记录表 10.烟气烟色监测现场记录表28.污染源噪声监测原始记录表 11.pH值分析原始记录表29.机动车排气路检原始记录表 12.电导率分析原始记录表30.一般试剂配制原始记录表 13.色度分析原始记录表(铂钴比色法)31.校准曲线配制原始记录表 14.色度分析原始记录表(稀释倍数法)32.标准溶液配制与标定原始记录表 15.重量分析原始记录表33.样品交接记录表 16.容量法分析原始记录表34.样品分析任务表 17.五日生化需氧量分析原始记录表35.样品前处理原始记录表 18.一氧化碳分析原始记录表36.大气采样器流量校准原始记录表
xx 省环境监测原始记录表( 1 ) 地表水采样原始记录表 采样目的: 方法依据:GB12998-91 采样日期: 年 月 日 枯 丰 平 pH 计型号及编号: DO 仪型号及编号: 电导仪型号及编号: 采样: 送样: 接样: .第 页 共 页
大肠埃希菌检查法.docx
大肠埃希菌检查法 ESCheriChia COliTeSt MethOd 1. 目的 建立大肠埃希菌检查法的标准操作程序。 2. 范围 适用于大肠埃希菌检查的操作。 3. 责任者 QC化验员。 4. 程序: 4.1. 简述 4.1.1. 大肠埃希菌(ESCheriChia coli)即大肠埃希菌,为肠埃希菌科埃希菌属 的模式种。埃希菌属除大肠埃希菌外,新近发现有非脱羧埃希氏菌等5个种。大肠埃希菌是人和温血动物肠道内的栖居菌,随粪便排出体外。在药品中检出大肠 埃希菌,表明该样品受到人和温血动物的粪便污染,即可能污染肠道病原体。大 肠埃希菌除普通大肠埃希菌外尚有致病性大肠埃希菌,可引起婴幼儿、成人爆发性腹泻。为保证人体健康,口服药品必须检查大肠埃希菌。 4.1.2. 用4-甲基伞形酮葡糖苷酸(4-MethylumbelliferyI- β -D-glucuronide , MUG和靛基质(Indole)试验检查大肠埃希菌是一项新技术,其检验步骤为:增菌培养后,转种MUG蛋白胨培养基培养,多数情况下不需要从混合菌中分离单个菌,如MUG Indole试验为阳性或阴性即可报告结果。 4.1.3. 原理:利用目标菌限定酶作用的底物的水解产物,产生颜色或荧光反应 作为指示系统来鉴定目标菌。 实验证明,96%的大肠埃希菌含β-葡糖苷酸酶(β-glucuronidase ,GUD) 约10%的沙门菌属一些菌种也含有此酶。MUGS GUD水解,产生荧光,由于荧光反应的敏感度较颜色反应强千万倍,易于观察,没有主观性,因而用MUG鉴定大肠埃希菌已被广泛应用于临床、食品、饮水、污水等的检测。单一的MUG鉴别大肠埃希菌其漏检率达6%,鉴于98%的大肠埃希菌其靛基质试验为阳性,故将MUGf靛基质试验结合,比单用MU可提高大肠埃希菌的检出率。如MUGf Indole 试验的反应不一致时,则需将供试液的增菌培养物用EMB琼脂平板分离培养、革兰染色、镜检及生化试验鉴别。该法理论上可使大肠埃希菌的检出率达98%。 如仅用IMViC生化试验来鉴别大肠埃希菌属中的大肠埃希菌,其结果是含混的。 4.2. 仪器、设备及用具 4.2.1. 无菌室 4.2.2. 净化工作台 4.2.3. 培养箱(36 ± 1C ) 4.2.4. 高压蒸汽灭菌器 4.2. 5. 显微镜(1500X)
大肠杆菌实验报告
大肠杆菌紫外线诱变及抗药性菌株筛选 0740063 阿噟兰 1.前言 抗生素能破坏细菌细胞壁的结构,使细菌的繁殖和生长受到抑制。但某些细菌对抗生素表现出抗性,原因是其基因发生了改变,产生能抵抗抗生素的性状。在自然情况下,细菌的基因突变率很低,而且突变是不定向的,因此在自然条件下,想要获得有抗性的细菌是很困难的。当给与适当的物理条件时,其突变率会大大增加。如当用α射线、β射线、γ射线、Χ射线、中子和其他粒子、紫外线、微波等物理因素辐射时,能够促进遗传物质突变。DNA 对紫外线(UV)有强烈的吸收作用,尤其是碱基中的嘧啶,它比嘌呤更为敏感。紫外线引起DNA 结构变化的形式有DNA 链断裂、碱基破坏、胸腺嘧啶二聚体等。因此,紫外线通常作为诱变剂,用于微生物菌种选育。一般细胞分裂越旺盛,诱变剂量越大,突变率高,诱变最有效的波长253~265 nm。选择合适的诱变剂量对于获得较高突变率十分关键,过高或过低的辐射剂量会导致菌株死亡或诱变不充分而降低诱变效果。 在紫外线诱变下,菌株发生不定向的突变,想要得到需要的特向变异必须对诱变后的菌株做筛选。本实验想要得到的是能够抵抗抗生素的菌株,因此可以用抗生素培养基作为筛选培养基对菌种进行筛选。若菌株没有发生定向突变,则该菌株不能在抗性培养基上正常生长,只有发生了定向突变才可能在筛选培养基上正常生长。 紫外线对于菌株有诱变作用外,对菌株还有较强的致死作用,因为紫外线改变了菌株的基因结构导致菌株无法正常生长繁殖。 因此,通过本实验的操作,在合适的照射剂量的设置下,比较不同不同照射剂量下的致死效果和突变率,并初步分析两者的相关性。在分析死亡曲线和诱变率曲线的基础上,能了解诱变育种的机理和方法,为做进一步的诱变实验做准备。 2.材料和方法 实验材料、仪器和试剂 菌种:大肠杆菌 仪器:超净台、离心机、高压灭菌锅、培养箱、磁力搅拌器、培养皿、涂布器、移液管、移液器 试剂:牛肉膏蛋白胨培养基相关试剂、硫酸卡那霉素水溶液(50mg/ml)、生理盐水 实验方法 2.2.1制备培养基 普通培养基——牛肉膏蛋白胨培养基(400ml): 牛肉膏5g 蛋白胨10g Nacl 5g 琼脂20g 蒸馏水1000ml 按配方配制好培养基后置于灭菌锅中115℃15min,倒平板,4皿*15ml*5组+2皿*15ml=22皿*15ml=330ml 筛选培养基(200ml):含抗生素50mg/L。(卡那霉素属于氨基糖苷类抗生素,能结合细菌核糖体的30S亚基上的16SrRNA,阻断细菌蛋白质的合成。) 牛肉膏5g 蛋白胨10g Nacl 5g 琼脂20g 蒸馏水1000ml 硫酸卡那霉素水溶液(50mg/ml),按配方先不要加硫酸卡那霉素配制然后115℃15min灭菌,取出培养基后冷却至60℃时将硫酸卡那霉素加入培养基中,充分震荡混匀,倒平板,2皿*15ml*5组+2皿*15ml=12皿*15ml=180ml 2.2.2制备菌悬液(106 ~ 108个/mL) ①固体培养:大肠杆菌划线或涂布接种于固体培养基,37℃培养24-48h。 ②菌悬液:用适量生理盐水刮洗菌落,倒入一个无菌小三角瓶(或试管)中,充分振荡使菌
大肠杆菌检测方法(借鉴材料)
大肠菌群及检验 一、大肠菌群介绍 大肠菌群并非细菌学分类命名,而是卫生细菌领域的用语,它不代表某一个或某一属细菌,而指的是具有某些特性的一组与粪便污染有关的细菌,这些细菌在生化及血清学方面并非完全一致,其定义为:需氧及兼性厌氧、在37℃能分解乳糖产酸产气的革兰氏阴性无芽胞杆菌。一般认为该菌群细菌可包括大肠埃希氏菌、柠檬酸杆菌、产气克雷白氏菌和阴沟肠杆菌等。 大肠菌群分布较广,在温血动物粪便和自然界广泛存在。调查研究表明,大肠菌群细菌多存在于温血动物粪便、人类经常活动的场所以及有粪便污染的地方,人、畜粪便对外界环境的污染是大肠菌群在自然界存在的主要原因。粪便中多以典型大肠杆菌为主,而外界环境中则以大肠菌群其他型别较多。 大肠菌群是作为粪便污染指标菌提出来的,主要是以该菌群的检出情况来表示食品中有否粪便污染。大肠菌群数的高低,表明了粪便污染的程度,也反映了对人体健康危害性的大小。粪便是人类肠道排泄物,其中有健康人粪便,也有肠道患者或带菌者的粪便,所以粪便内除一般正常细菌外,同时也会有一些肠道致病菌存在(如沙门氏菌、志贺氏菌等),因而食品中有粪便污染,则可以推测该食品中存在着肠道致病菌污染的可能性,潜伏着食物中毒和流行病的威胁,必须看作对人体健康具有潜在的危险性。 大肠菌群是评价食品卫生质量的重要指标之一,目前已被国内外广泛应用于食品卫生工
作中。 二、大肠菌群检验方法: 由于大肠菌群指的是具有某些特性的一组与粪便污染有关的细菌,即:需氧及兼性厌氧、在37℃能分解乳糖产酸产气的革兰氏阴性无芽胞杆菌。因此大肠菌群的检测一般都是按照它的定义进行。 目前国内采用的进出口食品大肠菌群检测方法主要有国家标准和原国家商检局制订的行业标准。两个标准方法在检测程序上略有不同。 (一)国家标准:国家标准采用三步法,即:乳糖发酵试验、分离培养和证实试验。 乳糖发酵试验:样品稀释后,选择三个稀释度,每个稀释度接种三管乳糖胆盐发酵管。36±1℃培养48±2h,观察是否产气。 分离培养:将产气发酵管培养物转种于伊红美蓝琼脂平板上,36±1℃培养18-24h,观察菌落形态。 证实试验:挑取平板上的可疑菌落,进行革兰氏染色观察。同时接种乳糖发酵管36±1℃培养24±2h,观察产气情况。 报告:根据证实为大肠杆菌阳性的管数,查MPN表,报告每100ml(g)大肠菌群的MPN值。
大肠埃希菌检查法
大肠埃希菌检查法 Escherichia Coli Test Method 1.目的 建立大肠埃希菌检查法的标准操作程序。 2.范围 适用于大肠埃希菌检查的操作。 3.责任者 QC 化验员。 4.程序: 4.1.简述 4.1.1.大肠埃希菌(Escherichia coli)即大肠埃希菌,为肠埃希菌科埃希菌属的模式种。埃希菌属除大肠埃希菌外,新近发现有非脱羧埃希氏菌等 5个种。大肠埃希菌是人和温血动物肠道内的栖居菌,随粪便排出体外。在药品中检出大肠埃希菌,表明该样品受到人和温血动物的粪便污染,即可能污染肠道病原体。大肠埃希菌除普通大肠埃希菌外尚有致病性大肠埃希菌,可引起婴幼儿、成人爆发性腹泻。为保证人体健康,口服药品必须检查大肠埃希菌。 4.1.2.用 4-甲基伞形酮葡糖苷酸(4-Methylumbelliferyl-β -D-glucuronide,MUG)和靛基质(Indole)试验检查大肠埃希菌是一项新技术,其检验步骤为:增菌培养后,转种 MUG-蛋白胨培养基培养,多数情况下不需要从混合菌中分离单个菌,如 MUG、Indole试验为阳性或阴性即可报告结果。 4.1.3.原理:利用目标菌限定酶作用的底物的水解产物,产生颜色或荧光反应作为指示系统来鉴定目标菌。 实验证明,96%的大肠埃希菌含β-葡糖苷酸酶(β-glucuronidase,GUD),约 10 %的沙门菌属一些菌种也含有此酶。MUG 被 GUD 水解,产生荧光,由于荧光反应的敏感度较颜色反应强千万倍,易于观察,没有主观性,因而用MUG 鉴定大肠埃希菌已被广泛应用于临床、食品、饮水、污水等的检测。单一的MUG 鉴别大肠埃希菌其漏检率达 6%,鉴于98%的大肠埃希菌其靛基质试验为阳性,故将MUG与靛基质试验结合,比单用MUG可提高大肠埃希菌的检出率。如MUG与Indole 试验的反应不一致时,则需将供试液的增菌培养物用 EMB琼脂平板分离培养、革兰染色、镜检及生化试验鉴别。该法理论上可使大肠埃希菌的检出率达98%。如仅用 IMViC生化试验来鉴别大肠埃希菌属中的大肠埃希菌,其结果是含混的。 4.2.仪器、设备及用具 4.2.1.无菌室 4.2.2.净化工作台 4.2.3.培养箱(36±1℃) 4.2.4.高压蒸汽灭菌器
大肠杆菌检测实验报告
国标法测定大肠杆菌样本的细菌总数 实验目的 实验原理:国标法操作的原理 实验器材: 培养箱,10只移液管,1只250ml锥形瓶,5只大试管,试管架,4个平皿,500ml 大烧杯1个,电子天平,纱布,脱脂棉,灭菌锅,PH计或PH试纸,100ml量筒,橡皮手套,超净台 实验药品: 磷酸盐缓冲液,蒸馏水,LB培养基,琼脂,5%NaOH,5%HCl 实验步骤: 一: 10只移液管,1只250ml锥形瓶,5只大试管,4个平皿,500ml大烧杯1个,100ml量筒进行洗涤,然后一起放入高压蒸汽灭菌锅中在121摄氏度条件下灭菌20min。灭完菌后烘干,完成后放入超净台中。 用酒精擦拭超净台,紫外消毒30min 二: 1:用电子天平称取成品LB 3.1241g和琼脂1.8756g放入250ml的洁净锥形瓶中。 2:用量筒量取125ml的蒸馏水加入该锥形瓶中,制成培养基。 3:用棉花堵住该锥形瓶的瓶口,用牛皮纸包住瓶口,用橡皮筋扎牢,再将培养基放入灭菌锅中在121摄氏度之下灭菌20min。 4:灭完菌后放入超净台中备用。 三: 1:取1只无菌250ml锥形瓶,用量筒向其中加入49ml PBS 2:将1ml样品加入到该锥形瓶中,摇匀制成1:50的细菌溶液。 3:取4只试管,编号1—4 4:用无菌移液管分别向4只试管中加入9ml的PBS 5:用1ml无菌移液管从样品中移取1ml菌液加入到1中.震荡试管使菌液均匀。 6:用1ml无菌移液管从1号试管中移取1ml的细菌溶液加入2号试管中,摇匀 7:用另一只1ml无菌移液管从2号试管中移取1ml细菌溶液,加入3中,摇匀......以此类推直至4只试管中均加入了细菌溶液。 9:取4只平皿,编号1—4 10:分别用4只无菌移液管从这4只试管中移取1ml的菌液置于4只平皿中,加入45—50摄氏度温度下的培养基,约15mm厚度。缓慢旋转平皿使菌液与培养基混合均匀;待培养基冷凝后倒置。 11:将培养基在36摄氏度条件下培养12小时。 12:取出培养皿,选择细菌个数在30至300个之间的平皿数细菌的个数。 四:实验结果(记得在操作过程和得到结果时拍照) 1号,2号菌落个数多不可计,舍弃 4号平皿中菌落数目小于10 cfu ,舍弃 3号平皿中菌落分布较均匀,数3号中的菌落数,一共有210个cfu 。 计算样品中细菌浓度为:1.05× 105 Cfu/ml
微生物检验原始记录(大肠菌群)
微生物检验原始记录(大肠菌群)
检验原始记录 编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点: 样品名称:样品编号: 样品状态:符合检验要求;其他境条件: 实验依据及步骤GB4789.3-2016 样品稀释 固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。依次进行10倍递增稀释。 液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。 样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。 取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。 按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。从样品匀液制备到样品接种完毕,全过程不得超过15min。 初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤) 36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。 产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。未产气者为大肠菌群阴性。 复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。 数据分析与结果一、菌落计数
五种致泻性大肠埃希氏菌多重PCR检测试剂盒
五种致泻性大肠埃希氏菌多重PCR检测试剂盒 研发背景 大部分的大肠杆菌是人或动物倡导的共生菌,但其中也有部分菌株可引起腹泻等疾病。致泻大肠杆菌不但可引起传染性疾病而且可引起食源性疾病的暴发。根据发病机制、临床特征、流行病学特征、O抗原血清及细菌的毒力测定,可将致泻大肠杆菌分为5类:致病性大肠杆菌(EPEC)、产毒性大肠杆菌(ETEC)、侵袭性大肠杆菌(EIEC)、粘附性大肠杆菌(EAEC)、出血性大肠杆菌(EHEC)。目前针对致泻大肠杆菌的常规实验室检测方法仍然较为薄弱,需要研究快速、简便、准确的分子生物学方法。 【检验原理】 五种致泻性大肠杆菌(EPEC、EHEC、EAEC、EIEC、ETEC)共含有11种毒力基因,针对这11种毒力基因,天津生物芯片试剂盒使用11对特异引物,与样本中基因组的相应靶位点特异性结合,PCR反应后,不同类型的样本产生不同的扩增片段,从而达到对五种致泻性大肠杆菌快速分型检测的目的。 【使用方法】 1.试剂配制(试剂准备区) 从试剂盒中取出PCR反应液在室温融化,将PCR反应液充分震荡混匀,所有试剂在使用前2000rpm离心10s。设所需要的管数n(n=样本数+1管阴性对照品),每个测试反应体系试剂配置如下表。计算所需要的n管反应的各试剂的使用量,加入至适当体积的无菌离心管中,充分混合均匀,分装至无菌PCR反应管中,每管24μl。 2.PCR扩增(扩增和产物分析区)
将样本、阴性对照品使用前恢复至室温,2000rpm离心10s。向每个PCR反应管中分别加入样本、阴性对照品各1μl,震荡混匀,于2000rpm离心10s。将PCR管放入PCR仪中,使用以下程序进行扩增反应,整个扩增反应约需2小时: Step 1 94℃ 5min Step 2 94℃ 30s Step 3 63℃ 30s 30 个循环 Step 4 72℃ 90s Step 5 72℃ 5min 3.结果判断(扩增和产物分析区) 从PCR管中取出2μl PCR产物与9μl阳性对照品一起进行浓度为2%的琼脂糖凝胶电泳检测,在紫外灯下阳性对照品从上至下应有11条带,分别为1487bp、1111bp、910bp、766bp、655bp、544bp、400bp、324bp、244bp、171bp和102bp。 样品观察到1487bp、910bp、544bp条带即为毒力基因uidA、bfpB和escV阳性,即为典型EPEC菌株。 观察到1487bp、544bp、324bp、244bp条带即为毒力基因uidA、escV、stx2A和stx1A 阳性,即为典型的EHEC菌株。 观察到1487bp、655bp和171bp条带即为毒力基因uidA、elt和estlb阳性,即为典型的ETEC菌株。 观察到1487bp和766bp条带即为毒力基因uidA和invE阳性,即为典型的EIEC菌株。 观察到1487bp、1111bp、400bp和102bp条带即为毒力基因uidA、pic、aggR和astA 阳性,即为典型的EAEC菌株。 阴性对照品结果应为阴性。 产品特点
大肠菌群_菌落总数检验报告原始记录
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 微生物实验原始记录 粤珍小厨餐饮管理有限公司 样品名称样品编号放入时培养 箱温度 ℃ 设备名称电热恒温培养箱(±1℃) 设备编号DHP-9082取出时培养 箱温度 ℃ 检验依据GB/T4789.2-2010 GB/T4789.3-2010 样品状态 一、菌落总数(cfu/g) 以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。 每个稀释度吸取1ml于灭菌培养皿内,注入凉至46℃的营养琼脂15ml,混匀。待营养琼脂凝固后,翻转平板于36℃培养48h。同时做空白对照。 样品匀液 (10-i) 10-110-2 10-3 观察结果(C) 计算结果N 报告结果 CFU/g 二、大肠菌群(MPN/100g) 以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。 每个稀释梯度取1ml注入9mlLST接种试管,36℃培养48h。 样品匀液 (10-i) 10-110-210-3
主检:审核:检验日期:年月日 邹平县产品质量监督检验所检验原始记 录 共页
主检:校核:检验日期:年月日 邹平县产品质量监督检验所检验原始记录 共页
主检:校核:检验日期:年月日 创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王*
