能力验证测试结果报告单
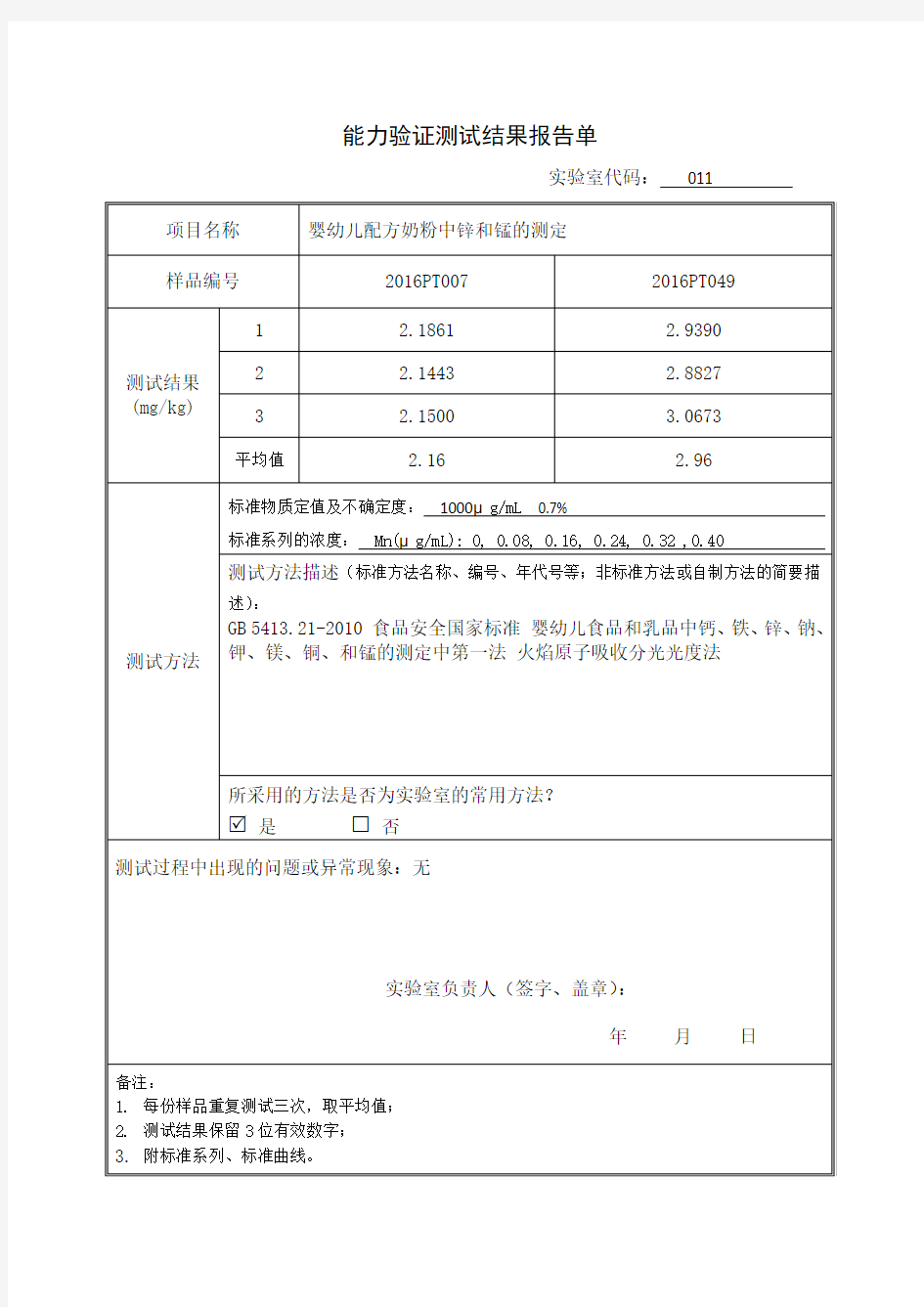

能力验证测试结果报告单
实验室代码:011
能力验证测试原始信息单
实验室代码:011 检测日期:2016年9月30日
放射检查报告单模板
放射检查报告单模板 篇一:X射线机性能检测报告模板 检测报告 编号:QCJC-xxxxx-xxxxxx 检测项目:单位名称:检测类别:报告日期: 放射诊疗设备性能检测 xxxxxxxxxxxxx 状态检测 XX年x月x日 xxxxxxxxxxxxxxxxxxxxxxxxxxxx公司 放射诊疗设备性能检测报告 一. 项目基本情况 1. 委托单位和检测单位 委托单位:地址:邮编:负责人:联系人:电话: 检测单位:地址:邮编:法人: 资质证书编号:电话: 2. 检测时间: XX年8月7日 3. 检测项目:放射诊疗设备性能检测 4. 检测和评价依据: 检测方式:现场检测检测类型:状态检测 (1)《放射诊疗管理规定》,卫生部令第46号,XX年1月(2)《医用X射线诊断放射防护要求》GBZ130-XX (3)《医用常规X射线诊断设备影像质量控制检测规范》WS76-XX
5.性能检测设备 6. 主要检测仪器 7. 检测质量保证措施: (1)合理选择检测项目。 (2)检测方法和检测条件严格按照国家有关标准规范实施。 (3)每年定期在有资质的单位对检测仪器进行检定或校准,在其有效期内使用。(4)每次测量前后均检查仪器的工作状态是否正常。检测人员均经过培训上岗。严格按照仪器的操作规程操作。 (5)严格质量管理体系、质量管理制度和规范检测工作程序。(6)检测数据和报告严格实行四审三校制度。 二、检测结果: (1)基本情况 设备名称:生产厂家:技术参数: (2)现场照片 牙片机福建梅生 65kV、 规格型号: MS(来自: 小龙文档网:放射检查报告单模板)D-Ⅲ出厂日期: XX年9月设备编号: 004966 牙片机 (3)检测结果 表福建梅生MSD-Ⅲ型牙片机性能检测结果
能力验证含义
能力验证 1.能力验证的作用和目的 (1)能力验证的作用 能力验证(定义)是利用实验室间比对来确定实验室能力的活动,实际上它是为确保 实验室维持较高的校准和检测水平而对其能力进行考核、监督和确认的一种验证活动。 参加能力验证计划,可为实验室提供评价其出具数据可靠性和有效性的客观证据,它的主要作用可归纳为以下四点: ①评价实验室是否具有胜任其所从事的校准/检测工作的能力,包括由实验室自身、实验室客户,以及认可或法定机构等其他机构进行的评价; ②通过实验室检测能力的外部措施,来补充实验室内部的质量控制程序; ③这些活动也补充了由技术专家进行实验室现场评审的手段,而现场评审被认可或法定机构所经常采用; ④增加实验室客户对实验室能力的信任,就实验室的生存与发展而言,用户对其是否能够持续出具可靠数据的信任度是非常重要的。 (2)能力验证的目的 能力验证是确定实验室能力的实验室间比对,而开展这种比对活动的目的可归纳为以下七点: ①确定实验室进行某些特定检测或测量的能力,以及监控实验室的持续能力; ②识别实验室中的问题并制定相应的补救措施,这些措施可能涉及如个别人员的行为或仪器的校准等; ③确定新的检测和测量方法的有效性和可比性,并对这些方法进行相应的监控;
④增加实验室用户的信心; ⑤识别实验室间的差异; ⑥确定某种方法的性能特征——通常称为协作试验; ⑦为参考物质(RMs)赋值,并评价它们在特定检测或测量程序中应用的适用性。 能力验证是为实现目的之①而进行的实验室间比对,即确定实验室的检测或测量能力。 但能力验证计划的运作也常为上面所列的其他目的提供信息。 2.能力验证计划的类型 为确定实验室在特定领域的检测、测量和校准能力而设计和运作的实验室间比对,称 为能力验证计划。这一计划可覆盖某个特定类型的检测,或对某些特定的产品、项目或材 料的检测。显然,所涉及的能力验证技术,根据被测物品的性质、所用的方法和参加实验 室的数目,会随之发生变化。但大部分能力验证活动具有以下的共同特征:将一个实验室 所得的结果,与其他一个或多个实验室所得的结果进行比对。在某些计划中,参加实验室 之一可能具有控制、协调或参考的功能。最常用的能力验证计划有以下六种类型: (1)实验室间校准计划(测量比对计划) 校准计划所涉及的被测物品,是按顺序从一个参加实验室传送到下一个实验室,这类计划通常具有如下四个特征: ①被测物品的指定值(参考值) 由某个参考实验室提供,该实验室应尽量考虑由国家有关测量的最高权威机构(如国家计量院)承担; ②被测物品是按顺序传递给下一个参加实验室,在传递过程中应确保被测物品的稳定性,因此有必要在能力验证计划过程中对其进行校核,以保证特性及其指定值不发生明显变化;
实验室间比对和能力验证结果的分析报告
实验室间比对和能力验证结果的分析报告 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
湖北华源包装有限公司 实验室间比对和能力验证结果的分析报告为了通过适时开展比对试验和能力验证等质量控制活动,对检测质量及其过程的有效性进行监控,保证检测工作的质量,确保检测结果的准确、可靠、有效,或者为无法溯源的检测设备和标准物质提供评价测量结果的可靠证据,依据《实验室资质认定评审准则》和公司《质量手册》、《程序文件》要求,2011年我组织了实验室间比对和能力验证,定期开展内部质量控制活动,采用有证标准物质测定、留样再测、平行样测定、空白对照试验等进行人员和方法的比对。现将2011年的质量控制结果报告如下: 一、质量控制方法: 1、外部质量控制 (1)接受省技术监督局计量认证监督评审现场试验考核。 2、内部质量控制: (1)组织人员和方法比对; (2)开展检测过程平行样、空白试验; (3)抽查检测报告,考核平行样、空白试验是否符合规定要求。 二、质量控制内容和结果: 1、参加省技术质量计量认证监督物理数据鉴定考核,见表1 表1 物理数据鉴定考核记录 2、参加省质量技术监督局组织的产品卫生检测质量考核,见表2 表2 卫生检测鉴定考核结果
3、内部组织的人员比对和方法比对,见表3 表3 内部考核样品考核结果 4、平行样、空白试验。 抽查25份检测原始记录,其平行样的相结相差均符合相关检验方法的精确度要求,符合率100%,每批样品检测均做空白对照试验,符合检测方法的要求。 5、2011年11月份通过省技术监督局组织的监督评审组的现场试验考核,共考核个样品(标本)10个项目。 三、讨论 1、开展实验室间比对活动,组织人员或方法比对在实验室内进行平行样的试验等实验室质量控制活动,都是实验室质量控制的有效方法。对于可溯源的物理分析和不可溯源的卫生检验,比对和能力验证活动都可提供评价其测量结果可靠性的证据,同时也可证实实验室比对和卫生检测质量考核活动,组织人员比对和方法比对,通过考核平行样、空白试验等开展内部质量控制活动,符合公司质量管理体系有关质量控制规定的要求。 2、根据《湖北省质量技术监督检验局对我司样品考核结果的通报》,我司实验室3份考核样品考核结果全部合格;参加省质量技术监督局产品卫生测定考核,符合相关标准分析方法的技术要求,结果全部合格;组织开展考核样品复合强度、摩擦系数、热封强度,结果全部合格。证明我司实验室检测质量和检测过程,基本满足《确保检测/校准结果质量的控制程序》的要求,表明实验室的检测过程是受控的、可信的、有效的。
新产品验证试验报告样本
可靠性实验报告 Reliability Test Report 报告名称:XXXXXX验证试验报告 报告编号:XXXXXXXX 发出日期:Jan.13.2013 封 面 产品验证试验报告 TO: XXX CC: XXX 拟制: XXX 审核: XXX
报告编号:QA1301001 完成日期:Jan.15.2009 页码:1of 14样品数量: 10PCS 委托日期: Dec.25.2009 目录 1.0实验目的 (2) 2.0实验设备 (2) 3.0样品名称、编号及来源 (2) 4.0试验方法/环境与步骤要求 (2) 4.1实验室环境测试: (2) 4.2试验流程: (3) 4.3预处理: (3) 4.4初始测试项目及数据: (3) 4.5关键器件温升试验: (7) 4.6低温贮存与工作试验: (7) 4.7高温贮存与工作试验: (9) 4.8恒定湿热试验: (9) 4.9模拟故障测试试验: (10) 4.10最后测试: (11) 5.0实验结果判定 (14) 6.0附件 (14)
报告编号:QA1301001 完成日期:Jan.15.2009 页码:2of 14样品数量: 10PCS 委托日期: Dec.25.2009 1.0实验目的 新产品可靠性验证试验。 2.0实验设备 序号 设备名称 设备型号 设备编号 1 高压仪 TOS8870A FE-0011 2 三用表 34410A FE-0399 3 AC SOURCE Chroma 6520 FE-0400 4 电子负载 Chroma 6214 FZ-0010 5 功率测试仪 AN2102W FC11098 6 可程式恒温恒湿仪 TH-225D 060420A 7 数字示波器 DOS6032A FE-0398A 8 温度测试仪 DR130 FZ-0009 9 调压仪 TDGC2 \ 10 振动试验台 DZD-450A \ 11 跌落测试台 \ \ 3.0样品名称、编号及来源 3.1样品型号/名称:FP09M038 3.2FEREX P/N #: 3.3样品编号: No.1 ~ No.10 3.4试验样品来源:R&D 4.0试验方法/环境与步骤要求 4.1实验室环境测试:
能力验证常见问题和解答第二版
附件:能力验证常见问题及解答 (第二版) 一、CNAS-RL02《能力验证规则》中基本要求的相关问题 1.申请认可时,是否必须参加能力验证?参加能力验证的最低要求 是什么? CNAS-RL02《能力验证规则》4.2.3款规定“只要存在可获得的能力验证,合格评定机构初次申请认可的每个子领域应至少参加过1次能力验证且获得满意结果(申请认可之日前3年内参加的能力验证有效)。”扩大认可范围申请视同初次申请,故此要求适用于初次申请认可和扩大认可范围申请认可。 本条款中的子领域和频次要求见CNAS-AL07《CNAS 能力验证领域和频次表》。CNAS-AL07中所规定的子领域中都有可获得的CNAS 承认的能力验证活动。 2.合格评定机构涉及到多场所,如何参加能力验证? 对于多场所合格评定机构,每个场所视同单独的合格评定机构,应分别满足CNAS-RL02《能力验证规则》4.2.6款的要求。 3.申请认可的项目,参加能力验证的有效期限如何计算? 申请认可之日前3年内参加的能力验证有效。(以结果报告时间为准)
4.申请认可的项目不在CNAS-AL07规定的能力验证子领域范围内, 怎么办? 初次/扩项申请认可的项目不在CNAS-AL07规定的子领域范围内,可不提交参加能力验证的材料。 5.获准认可的合格评定机构怎样满足能力验证的领域频次要求? 获准认可的合格评定机构必须根据CNAS-AL07中领域频次的要求参加能力验证(频次的计算参见问题“18. 参加能力验证计划频次如何计算?”),同时,参加能力验证要取得满意结果,若结果不满意,应按照CNAS-RL02《能力验证规则》4.2.7款和4.2.8款规定,采取相关措施并验证措施为有效。 获准认可的合格评定机构还应参加CNAS指定的能力验证计划,如CNAS组织的专项计划。 6.机构搬家了,必须重新参加能力验证吗? 搬家的机构根据自身情况自行决定,不一定要求额外参加能力验证活动;但如机构扩地点认可,必须提供新地点的PT经历证明。 7.合格评定机构刚参加完测量审核,是否有必要参加同项目的能力 验证计划? 合格评定机构在满足领域频次要求的前提下自行决定,但获准
实验室能力验证的一份结果报告
实验室能力验证的一份结果报告 信息产业部信息传输线质量监督检验中心 朱荣华 程万茂 [摘 要]本文通过一次实验室间的测量比对,对测量的结果进行分析,给出能力的验证的结果报告。 [关键词]能力验证,测量比对,衰减,回波损耗,测量不确定度,比对分析 1前言 能力验证是通过实验室间的比对来确定实验室能力的活动,它可用于确定某个实验室进行某些特定检测或测量的能力,以及监控实验室的持续能力。在评价和保障实验室能力的各种措施中,能力验证活动已经成为世界各国尤其是各国实验室认可机构广泛采用的重要技术手段。通过持续地开展能力验证,可以有效地提高实验室的检测能力,并为科研工作以及政府管理工作提供科学、客观的信息。我国目前的能力验证活动大多是由专业认可机构组织实施的,而这些能力验证较多关注的是与国计民生或是安全健康等领域相关的实验室,针对相对而言纯技术领域的专业实验室的能力验证活动较少。为此,笔者所在实验室联合了其他几个专业实验室组织了一次能力验证活动,按照能力验证的要求实施了整个过程,并对测量的结果进行分析,给出能力验证的结果报告。笔者希望通过此文,与其他同行交流一些实验室间测量比对的经验,并起到抛砖引玉的作用。 2 实施方案 2.1 比对(能力验证)项目:用Anritsu 37269/37347测量射频同轴电缆的衰减及回波损耗。 2.2 参加实验室:二十三所、航天808所、计量测试院。 2.3 比对样品:SFF-50-2 同轴电缆 2.4 比对依据:GB/T 1548 3.1-1999 《利用实验室间比对的能力验证 第一部分 能力验证计划的建立和运作》。 GB/T 15483.2-1999 《利用实验室间比对的能力验证 第一部分 实验室认可机构对能力验证计划的选择和使用》。 2.5 比对参数:衰减及回波损耗 2.6 比对时间:2002年11月6日 2.7 比对测试方框图 被测电缆负载 被测电缆 (a) 衰减测量 (b) 回波损耗测量 图1. 比对测试方框图
产品包装验证报告.doc
文件编号:产品包装材料验证报告 拟制日期年月日 审核日期年月日 批准日期年月日 版号生效日期年月日 有限公司
产品包装材料验证报告 一、总则 1 包装材料的要求 依据:YY/T0681.1、YY/T0313 、YZB/国《体》产品注册标准。 用作制造XXXX的包装材料原料是原始材料,应有原料的来源,明确其历史和可追溯性,并受到控制,以确保成品始终能满足要求。 2 包装材料的设计必须在满足原定用途的条件下,既能够确保内包装材料的符合性,又把对使用者或患者的安全造成危害的可能性降低到最小程度。 2.1 包装材料与XXXX的相容性(即包装与医疗器材相互无不良影响):主要考虑的有:包装材料的安全性毒性的要求,拟包装的医疗器械的大小和形状,对物理和其它防护的要求,医疗器械对特殊危险例如辐射、湿气、机械性撞击,静电放射的敏感性。 2.2 包装材料与标识方式的相容性:标识方法必须对包装材料与采用的灭菌过程的相容性无不良影响,印刷或书写所采用的油墨不会转移到XXXX产品上,也不会和包装材料起反应而影响包装材料的效用,也不会变色而使标识变的模糊不清,对固定在包装材料表面的标识,其附着方式必须能耐受灭菌过程的使用及制造厂规定的贮存和运输条件。 3 包装材料能够提供对物理、化学和微生物的防护。 3.1包装材料在使用场所与使用者撕开包装取出使用时的要求相容性(例如无菌的开封)。
3.2 在使用条件下,在灭菌前、中、后,包装材料不可释放已知是有毒的,其数量足以对健康危害的物质。 3.3无菌状态的保持:(即从其产品灭菌后,成为无菌之时起,直至规定的失效日期或使用时止),包装完整性及包装材料的微生物阻隔特性。 3.4 材料的毒性检测。
比对和能力验证程序
1. 工作目的 为了保证检测/鉴定数据的可靠性及结果的有效性。 2. 适用范围 本程序适用于本站比对和能力验证工作。 3. 工作职责 3.1技术质量管理部负责制定比对、能力验证计划。 3.2技术质量管理部负责组织比对能力验证的实施。 3.3各检测所、土工实验室负责比对、能力验证计划的实施。 3.4各部门技术主任负责对比对能力验证结果进行评价。 3.5技术质量管理部负责比对、能力验证相关记录、报告等资料的保存和归档。 4. 工作程序 4.1能力验证和比对工作计划的制定 4.1.1 能力验证和比对项目的选择 4.1.1.1 认可委公布的能力验证计划中本站可开展的项目; 4.1.1.2 省认证认可协会组织的实验室间验证比对。 4.1.1.3 对于技术能力要求较高的项目; 4.1.1.4 新开展的项目;
4.1.1.5 曾经发生过质量事故或投诉的项目。 4.1.2 对一些无法参加能力验证的关键量,技术负责人可根据实际需要组织实验室间比 对。 4.1.3 技术质量管理部根据以上要求和上年度的质控情况,制定年度《能力验证和比对 计划》。 4.1.4 计划内容包含:能力验证或比对的项目、测试方法、组织方或参加试验室、负责和参加人员、技术要求、辅助资源、验证或比对结果的评价等。 4.1.6参加实验室的选择 4.161 能力验证选择认可委指定的组织方。 4.1.6.2 应在同类试验室中选择水平相当或较高的试验室作为比对的实验室。 4.1.6.3 比对既可以是双边的也可以是多边的,如多边实验室参加则应指定一个主持试 验室,其余实验室为参加实验室。 4.2能力验证和比对工作计划的实施 4.2.1技术质量管理部在获得能力验证计划和样品后,及时将样品交接给各检测所、土 工实验室技术主任,由技术主任按照其作业指导书要求制定《能力验证和比对实施方案》,实施方案经技术负责人批准后实施。《能力验证和比对实施方案》应包括实施时间、参加人 员及职责、试验方案、试验过程控制要点、数据处理等内容。 4.2.2对于实验室间比对,由技术主任制定《能力验证和比对实施方案》(方案中应明确判断指标)和相应比对作业指导书,报技术负责人批准,并准备稳定的样品进行检测/鉴定。由技术主任负责将比对作业指导书和样品一起交参比实验室进行检测/鉴定。 4.2.3技术负责人随时协调解决能力验证或比对试验中出现的资源和技术问题。 4.3能力验证和比对结果的分析和评价
工艺验证报告模板
验证文件 XXXXXX有限公司2013年XX月
6.验证报告起草、审核与批准6.1验证报告起草 6.2 再验证报告审核 6.3 再验证报告批准
目录 1. 验证概述 2. 验证目的 3. 验证范围 4. 再验证依据标准 5. 机构与职责 5.1 验证机构 5.2 验证职责 6. 验证方式 7. 验证准备 7.1 设备设施准备 7.2 仪器试剂准备 7.3 原辅物料准备 7.4 文件与培训 8. 验证时间与计划 9. 验证实施 9.1 产品的工艺流程图 9.2产品的工艺验证: 9.2.1称量备料 9.2.1.1目的 9.2.1.2文件 9.2.1.3检查项目及结果9.2.2 配制 9.2.2.1 目的 9.2.2.2 文件 9.2.2.3 评估项目 9.2.2.4 评估方法 9.2.2.5 取样方法 9.2.2.6配制试验数据 9.2.3 灌装封尾 9.2.3.1 目的 9.2.3.2文件 9.2.3.3评估项目 9.2.3.4评估方法 9.2.3.5灌装封尾检查数据9.2.4 成品抽样检验 9.2.4.1 目的 9.2.4.2 文件
9.2.4.3 评估项目 9.2.4.4 评估方法 9.2.4.5产品检验报告复印件 10. 偏差与处理. 11. 结果与分析 11.1 验证数据汇总 11.2 存在问题与措施 11.3 风险与预防 12. 验证结论 12.1 验证结论 12.2 验证评价与建议 13. 验证周期 14. 附件 15.参考或引用文件 1.概述: 复方醋酸地塞米松乳膏为我司生产多年的乳膏剂品种,自2009GMP再认证以来,乳膏剂生产线生产所用关键设备、生产工艺及工艺参数没有改变,为了验证在正常的生产条件和GMP文件管理体系下能生产出符合预定的规格及质量标准的产品,根据验证管理文件的要求,我们对复方醋酸地塞米松乳膏的生产工艺进行再验证。 2.目的: 在现行的GMP文件管理体系下,生产三批复方醋酸地塞米松乳膏进行工艺再验证: (1)确认关键工序质量监控点是否符合质量要求; (2)确认该产品质量是否符合预定成品的标准。 3.验证范围: 本次验证对复方醋酸地塞米松乳膏,依据工艺规程的各项参数设定指标,并认真按方案组织了实施,仅验证该品种工艺参数设定的科学性符合性。 4.再验证的依据与标准: 《药品生产质量管理规范》(2010版)、《复方醋酸地塞米松乳膏生产工艺规程》、《复方醋酸地塞米松乳膏中间产品内控质量标准》、《复方醋酸地塞米松乳膏成品内控质量标准》。
实验室间比对和能力验证结果的分析报告
湖北华源包装有限公司 实验室间比对和能力验证结果的分析报告为了通过适时开展比对试验和能力验证等质量控制活动,对检测质量及其过程的有效性进行监控,保证检测工作的质量,确保检测结果的准确、可靠、有效,或者为无法溯源的检测设备和标准物质提供评价测量结果的可靠证据,依据《实验室资质认定评审准则》和公司《质量手册》、《程序文件》要求,2011年我组织了实验室间比对和能力验证,定期开展内部质量控制活动,采用有证标准物质测定、留样再测、平行样测定、空白对照试验等进行人员和方法的比对。现将2011年的质量控制结果报告如下: 一、质量控制方法: 1、外部质量控制 (1)接受省技术监督局计量认证监督评审现场试验考核。 2、内部质量控制: (1)组织人员和方法比对; (2)开展检测过程平行样、空白试验; (3)抽查检测报告,考核平行样、空白试验是否符合规定要求。 二、质量控制内容和结果: 1、参加省技术质量计量认证监督物理数据鉴定考核,见表1 表1 物理数据鉴定考核记录 2、参加省质量技术监督局组织的产品卫生检测质量考核,见表2 3、内部组织的人员比对和方法比对,见表3 表3 内部考核样品考核结果
4、平行样、空白试验。 抽查25份检测原始记录,其平行样的相结相差均符合相关检验方法的精确度要求,符合率100%,每批样品检测均做空白对照试验,符合检测方法的要求。 5、2011年11月份通过省技术监督局组织的监督评审组的现场试验考核,共考核个样品(标本)10个项目。 三、讨论 1、开展实验室间比对活动,组织人员或方法比对在实验室内进行平行样的试验等实验室质量控制活动,都是实验室质量控制的有效方法。对于可溯源的物理分析和不可溯源的卫生检验,比对和能力验证活动都可提供评价其测量结果可靠性的证据,同时也可证实实验室比对和卫生检测质量考核活动,组织人员比对和方法比对,通过考核平行样、空白试验等开展内部质量控制活动,符合公司质量管理体系有关质量控制规定的要求。 2、根据《湖北省质量技术监督检验局对我司样品考核结果的通报》,我司实验室3份考核样品考核结果全部合格;参加省质量技术监督局产品卫生测定考核,符合相关标准分析方法的技术要求,结果全部合格;组织开展考核样品复合强度、摩擦系数、热封强度,结果全部合格。证明我司实验室检测质量和检测过程,基本满足《确保检测/校准结果质量的控制程序》的要求,表明实验室的检测过程是受控的、可信的、有效的。 四、建议 1、除定期的实验室间质量控制外,要高度重视实验室内的质量控制,每年内部组织的人员比对要使每个检测人员都有机会参与,以提高检测人员检测技术质量。 2、除参加外部质量控制和组织内部质量控制活动外,平时的检测质量控制要通过利用质量控制图来分析检测质量的稳定性,以便及时发现某些偶然的异常现象,随时采取相应的校正措施。 湖北华源包装品管部实验室 2011年11月
注塑机验证报告
注塑机验证报告 编审批记录: 编制审核批准 会签记录: 会签单位负责人会签单位负责人
目次 序号内容页码1 概述2/13 2目的2/13 3 范围2/13 4 职责2/13 5 验证小组2/13 6 注塑机安装确认(IQ)2/13 7 运行确认(OQ)4/13 8 性能确认(PQ)9/13 9 再验证12/13 10 报告12/13
1. 概述 公司产品为**管医疗器械,属于II类无菌器械,与负压吸引装置配套使用,该产品用于人工流产手术,产品组成有导管和手柄,其中手柄材料为PP材料,型号为5、6、7、8号,其中5号适用于单管,其余适于单管和双管产品,导管手柄采用注塑方法制造,要求手柄外观整齐、无毛刺、无注塑缺陷,为达到此目的,特展开以下确认工作。 2.目的 通过验证,证实EH160B注塑机能够实现**管正常生产,并为正常生产和工艺文件编写提供参数依据。 3.范围 本方案适用于公司生产车间***型注塑机安装、运行和性能验证。 4.职责 技术部负责起草验证方案,负责配合设备的安装调试过程,主要参与性能验证。 生产部负责对验证活动的开展实施和过程记录。 质管部负责验证方案的审核,负责对验证过程的监控和检验。 管理者代表负责方案和报告的最后批准。 5.验证小组 验证小组成员名单组长 小组成员 部门姓名部门姓名部门姓名生产部质管部 生产部质管部 生产部 6.注塑机安装确认(IQ) 6.1注塑机基本信息 设备名称注塑机型号设备编号生产厂家设备生产日期入厂日期
6.2注塑机系统描述 设备结构:主要由液压系统、锁模系统和射台系统等部分组成。 技术参数:见操作说明书 6.3注塑机资料档案和备件检查 序号 确认内容 检查人 检查结果 1 EH160B 注塑机使用说明书 已归档,齐备 2 EH160B 注塑机产品合格证 同上 3 备件清单 已归档,备件和清单对应 4 工具箱 工具齐备 6.4 注塑机安装要求确认 6.3安装确认小结 亿利达注塑机能力符合公司产品生产要求,操作前对各部件的安装过程进行了检查和确认,各运动和控制部件进行了模拟操作(服务人员指导),未见异常,具备进行注塑工作实际操作条件,安装确认合格。 评价人: 日期: 复核人: 日期: 项 目 描 述 检查结果 检查者 完成 未完成及原因 1 检查设备的紧固和松动部件安装无误 √ 无 郝壮壮 2 检查设备安装到位 √ 3 检查模具规格型号与要验证的是否一致 √ 4 确认所有的正常生产操作所必须的其它配件都准备完好 √ 5 确认主电路开关有标识并运行正常 √ 6 确认计数器有效性并运行正常 √ 7 确认热电偶有效性并运行正常 √ 复核人: 日期:
DR报告模板
. ②双膝关节解剖关系正常,双膝关节内、外侧髁间隆突及髌骨上缘骨质增生变尖;关节面内侧份变白,关节间隙未见明显狭窄征象;余双膝骨质未见明显异常征象。 ③肘关节解剖关系正常,关节间隙清晰,所属骨质结构连续、完整,未见骨质吸收及破坏征象,周围软组织未见明显肿胀。 ④骶尾椎生理曲度存在,排列序列正常,未见明显侧弯及滑脱征象;各椎体未见明显骨质增生及骨质吸收破坏征象,椎体附件及周围软组织未见明显异常,韧带未见钙化。 ⑤骨盆所属诸骨骨皮质连续、完整,未见明显骨质吸收破坏征象,双侧骶髂关节清晰,双髋关节在位,股骨头形态正常,沈通氏线连续。 ⑥双侧膈下未见明显游离气体影,腹部可见少许肠气及肠内容物投影,未见明 显气液平面及肠管扩张征象,双侧泌尿系走行区未见确切阳性结石影,双侧腹脂线清晰。腹部立位未见明显急腹症征象,请结合临床。 ⑦右侧跟骨前下缘可见钩状骨性突起,边界清晰。余片内跟骨骨质连续,未见明显异常征象。 ⑧右手各关节解剖关系正常,诸组成骨骨皮质连续,形态、密度尚可,右手骨质未见明显骨折征象。 ⑨窦腔密度增高,透过度减低,右侧上颌窦粘膜增厚,窦壁骨质结构未见异常;余未见异常。 前列腺体积增大并呈球状,大小约4.9X4.3X3.5cm,中央叶增大,
SPIR/DWI前列腺信号教均匀,前列腺周围叶稍受压,信号未见明显异常。前列腺包膜完整,周围血管对称,余未见明显异常。 . . 肝内胆管及形态信号及各叶比例未见明确异常,肝脏轮廓光整,壁未见明确增厚,其内信号均匀,胰管未见扩张,胆囊体积大小正常,腹腔内未见明确肿大淋巴双肾形态信号未见明确异常,胰腺,脾脏,结及积液征象。76%双肾轮廓显示清晰,双侧泌尿系行程未见明显阳性结石影, 静脉注射 7,20.30分钟时显影清晰:综合分钟时即见显影,15泛影葡胺20毫升,双肾7分钟各片所见,左侧肾盂,左侧可见积水,双侧输尿管通畅,膀胱内可见数个结石影,余未见明显异常。平扫示,双侧胫骨平台骨质增生,变尖,骨质信号未见明显异常,关节间 MRI 隙变窄,关节软骨面连续,前后交叉韧带及侧副韧带信号未见异常。 形态及灰白质位置正常,脑实质未见明显异常信小脑半球及脑干大小.双侧大.号改变,脑室,脑池,脑沟未见明显异常,中线结构无移位,双侧等T1信号,边界清晰,双侧上额窦及前阻筛窦见片状长T2脑实质未见明显异形态及灰白质位置正常,小脑半球及脑干大小.大. 常信号改变,脑室,脑池,脑沟未见明显异常,中线结构无移位。平扫示:腰椎各椎体边缘可见骨赘形成,椎间隙明显变窄,腰MRI 椎间盘向后突出,相应硬膜明显受压,生理曲度明显变形,余3/4/5 未见明显异常。 线摄影双侧乳腺钼靶X双乳腺显影为蜂窝状;乳腺可见粗大血管影;乳腺内未见异常钙化影乳腺皮肤正常,未见厚皮征; 乳头无内陷,乳晕区未见异常;其余未见异常双侧乳腺未见异
化学分析室能力验证整改报告.docx
化学分析室能力验证整改报告 化学分析室能力验证整改报告整改报告 检测项目:塑料中的BDE-209 实验室代码: 单位负责人: (签字) 整改日期: 化学分析室 二零一六年X月 存在可疑/有问题结果的整改要求说明 依据本次能力验证方案的相关规定:对于有指标出现存在可疑/有问题的实验室,要求其提交相应的原因分析报告,查找结果偏差较大的原因,并采取纠正措施以利于进一步提高检测质量。建议从以下几个方面进行整改: 1、影响检测结果的因素分析 2、就因素进行排查 3、提出改进措施:如仪器核查、人员核查、人员再培训 4、组织实施的情况说明 5、整改结果和今后的注意事项,必要时可开展一次内审,审核的重点为可疑结果涉及
的要素。 整改完成后实验室应形成原因分析报告,提交本次能力验证组织单位专家组,对整改内容和提出的改进措施的有效性等进行确认。原因分析报告中应包含以下几个方面的要素: 1、不符合事实的描述; 2、最根本原因分析及相关证据; 3、采取的纠正措施及相关证据; 4、对已发出报告的影响及证据。 原因分析报告中还应酌情提供以下证据: 1、质量记录:不符合工作控制记录、纠正措施记录、预防措施记录、人员培训纪录、修改的体系文件等; 2、技术记录:原始记录、验证记录等。 一、能力验证检测结果 1、实验室代码:XXX 2、检测项目:塑料中多溴二苯醚含量的测定能力验证(BDE-209) 3、检测依据:IEC62321.6-2015 4、实验条件: 仪器型号色谱柱型号萃取方式试剂定容 GC-MS(QP2010plus)DB-5HT索氏萃取法丙酮/正己烷(1:1)100ml
5、检测结果: 样品编号实验室结果 BDE-209/(mg/kg)ZBZW评价结果 143854-2.02.5可疑/有问题 741459 二、检测结果可疑原因分析: 实验室对此次能力验证结果中期报告中的两组数据检测结果”可疑/不满意”原因情况从人、机、料、法、环五个基础环节进行了详细而认真的查找和分析,初步认定为两个可疑原因。 1、检测人员为配合完成公司内部的检测任务,在使用仪器三个月后并没有及时对仪器GCMS逐一进行详细和细致的检查和排除,如:GCMS仪器使用中的垫片、进样系统中的内衬管、GC中的色谱柱等与之相关而能够对测量结果引起误差的配件进行维护与保养,虽在做能力验证的时候有初步对部分配件进行检查和更换更新,但因需配合内部的检测任务和即将面对的体系外审,都促使检测人员没有更多的时间进行关机做色谱柱的维护保养(保养方式:切掉一小段色谱柱以清除不挥发性残留物、隔垫碎屑和密封圈碎片,否则,有可能导致样品吸收,降低样品回收率),而在整改过程中重新进行了细致排查发现,也证明了此分析思路的准确性,因色谱柱(DB-5HT)未能及时进行维护保养,而导致了数据结果出现偏差,而整改后利用质控样品进行数据验证的过程中,均未发现有明显数据差异。说明了检测人员对于此次的能力验证重视程度不够,忽视了对仪器部分环节进行检测和维护,使仪器保持最佳的测试状态,确保出具数据的准确性。 2、由于实验室人员要应对即将到来的CNAS17025体系外审,审核时间为2016年8月6日和2016年8月7日,因此在完成能力验证样品的时候(时间为2016年7月27日)因检测时间过于紧张,且无更多的时间做比对和复检,在数据审核的时已初步对样品编号为74号样品两组数据怀有可疑,但因时间紧迫,未认真查找原因,仓促汇总并递交上报了结果,这说明了负责人在进行数据审核验证时责任不到位,缺乏足够的重视。 三、纠正措施计划: 针对本次验证活动中出现的不符合项所提出的纠正措施计划: 1、实验室积极按要求重新参加能力验证补测,对实验室检测能力进行再次评估和确认;同时按照内部质控计划进行数据核查和严格评估。 2、召开会议,针对这次能力验证“可疑/不符合”事件中进行多方面的分析,对检测人员和品质数据审核人员开展责任心培训和教育,对实验室内部质量控制的有效性进行检查,找出是否有不符合管理要求的行为。 3、对本次所使用的仪器含辅助的设备进行逐一核查维护保养是否到位,检查过程中如发现不符合保养的仪器且已即将到报废年限的设备,可提前评估进行更换和报废处理,及时补充并保证检测质量控制的最佳状态。 4、将此次能力验证所剩样品再一次进行测定和验证,严格按照规程进行全方位的检测和数据分析。 5、在参加能力验证补测工作之前,由质量负责人组织相关检测人员进行学习整改。 6、平行展开实验室所有仪器维护保养的核查和关键性配件的检查是否符合仪器维护保养使用频率,使实验室现有仪器保持最佳的测试状态。同时加强维护与保养意识。 四、技术负责人评价: 针对对2016年7月年实验室检测能力验证活动中,塑料中多溴二苯醚(BDE-209)的测试结果偏小(Z值为-2.0)。实验室通过学习整改,从人员素质、仪器设备、环境条件、检测方法、样品材料这五方面进行了详细认真的复查,从中找出了出现误差的原因,提出了整改
DR报告模板
②双膝关节解剖关系正常,双膝关节、外侧髁间隆突及髌骨上缘骨质增生变尖;关节面侧份变白,关节间隙未见明显狭窄征象;余双膝骨质未见明显异常征象。 ③肘关节解剖关系正常,关节间隙清晰,所属骨质结构连续、完整,未见骨质吸收及破坏征象,围软组织未见明显肿胀。 ④骶尾椎生理曲度存在,排列序列正常,未见明显侧弯及滑脱征象;各椎体未见明显骨质增生及骨质吸收破坏征象,椎体附件及围软组织未见明显异常,韧带未见钙化。 ⑤骨盆所属诸骨骨皮质连续、完整,未见明显骨质吸收破坏征象,双侧骶髂关节清晰,双髋关节在位,股骨头形态正常,通氏线连续。 ⑥双侧膈下未见明显游离气体影,腹部可见少肠气及肠容物投影,未见明显气液平面及肠管扩征象,双侧泌尿系走行区未见确切阳性结影,双侧腹脂线清晰。腹部立位未见明显急腹症征象,请结合临床。 ⑦右侧跟骨前下缘可见钩状骨性突起,边界清晰。余片跟骨骨质连续,未见明显异常征象。 ⑧右手各关节解剖关系正常,诸组成骨骨皮质连续,形态、密度尚可,右手骨质未见明显骨折征象。 ⑨窦腔密度增高,透过度减低,右侧上颌窦粘膜增厚,窦壁骨质结构未见异常;余未见异常。 前列腺体积增大并呈球状,大小约4.9X4.3X3.5cm,中央叶增大,SPIR/DWI前列腺信号教均匀,前列腺围叶稍受压,信号未见
明显异常。前列腺包膜完整,围血管对称,余未见明显异常。 肝脏轮廓光整,形态信号及各叶比例未见明确异常,肝胆管及胰管未见扩,胆囊体积大小正常,其信号均匀,壁未见明确增厚,胰腺,脾脏,双肾形态信号未见明确异常,腹腔未见明确肿大淋巴结及积液征象。 双肾轮廓显示清晰,双侧泌尿系行程未见明显阳性结影,静脉注射76%泛影葡胺20毫升,双肾7分钟时即见显影,15分钟时显影清晰:综合7,20.30分钟各片所见,左侧肾盂,左侧可见积水,双侧输尿管通畅,膀胱可见数个结影,余未见明显异常。 MRI平扫示,双侧胫骨平台骨质增生,变尖,骨质信号未见明显异常,关节间隙变窄,关节软骨面连续,前后交叉韧带及侧副韧带信号未见异常。 双侧大.小脑半球及脑干大小.形态及灰白质位置正常,脑实质未见明显异常信号改变,脑室,脑池,脑沟未见明显异常,中线结构无移位, 双侧上额窦及前阻筛窦见片状长T2等T1信号,边界清晰,双侧大.小脑半球及脑干大小.形态及灰白质位置正常,脑实质未见明显异常信号改变,脑室,脑池,脑沟未见明显异常,中线结构无移位。MRI平扫示:腰椎各椎体边缘可见骨赘形成,椎间隙明显变窄,腰3/4/5椎间盘向后突出,相应硬膜明显受压,生理曲度明显变形,余未见明显异常。 双侧乳腺钼靶X线摄影
dr报告单模板[工作范文]
dr报告单模板 篇一:CRDR诊断报告模板 CR DR诊断报告模板 呼吸系统 心肺未见异常。 两侧胸廓对称、所见骨质未见异常;两侧肺野透过度正常,未见异常密度增高影;两肺纹理清晰,无增粗、增多、变形;两肺门无增大、增浓;心影大小、形态如常,主动脉未见异常;纵隔居中,两膈面光整,肋膈角清晰锐利;其它:未见异常。 两肺纹理增粗 两侧胸廓对称、所见骨质未见异常;两侧肺野透过度正常,未见异常密度增高影;两肺纹理增粗、增多、模糊;两肺门未见增大、增浓;心影大小、形态如常,主动脉未见异常;纵隔居中,两膈面光整,肋膈角清晰锐利;其它:未见异常。 符合高血压病心脏改变,请结合临床。 心影呈主动脉型增大,心尖部向左下增大,两侧肺野透过度稍减低;两肺纹理稍增粗、增多,模糊;两肺门稍增大、增浓,模糊;双膈面光整,肋膈角清晰锐利;纵隔居中、无增宽;两侧胸廓对称;所见骨质未见异常;其他:未见异常。
心肺未见明显异常 两侧胸廓对称、所见骨质未见异常;两侧肺野透过度正常,未见异常密度 增高影;两肺纹理略增粗、增多;两肺门无增大、增浓;心影大小、形态如常,主动脉未见异常;纵隔居中,两膈面光整,肋膈角清晰锐利;其它:未见异常。 主动脉硬化 主动脉扩张、迂曲、延长,主动脉结向左突出;两侧肺野透光度正常,未见明确实变影;两肺纹理清晰,无增粗、增多、变形;两侧肺门无增大、增浓;两膈面光整,肋膈角清晰锐利;纵隔居中,心影大小、形态未见异常;其它:未见异常。 主动脉粥样硬化。 主动脉扩张、迂曲、延长,主动脉结向左突出,见弧状钙化影;两侧肺野透光度正常,未见明确实变影;两肺纹理清晰,无增粗、增多、变形;两侧肺门无增大、增浓;双膈面光整,肋膈角锐利清晰;心影大小、形态正常,纵隔居中,无增大;两侧胸廓对称、所见骨质未见异常;其它:未见异常。 DR已报告,PACS补报告 本次检查报告已由DR发出,可在PACS上补上报告,注意与DR一致,不要打印。
能力验证和实验室间比对结果的分析报告
能力验证和实验室间比对结果的 分析报告 资料5 能力验证和实验室比对结果的分析报告 1. 2009 年参见项目:伤残程度鉴定。 结果:满意。 2009 年本所首次参加能力验证活动,接到能力验证计划指导书后本所积极组织鉴定人分析住院病历史摘抄,法医学临床检验记录和放射科检验记录。根据指导书中被鉴定人的受伤情况,鉴定人进行讨论分析,达成共识。 能力验证专家评审组评价意见:鉴定书格式不够规范;对腰2 椎体骨折类型认定准确,对胸12 椎体楔形变分析正确,未说明腰部活动受限程度,适用标准条款准确,鉴定结论正确。 2. 2011 年参加项目:死亡原因和死亡方式鉴定 结果:满意 能力验证专家评审组评价意见:法医病理学诊断要件全面,重
点突出,条理清晰,专业术语合乎规范;分析说明能够够提炼材料中提供的要素并进行合理论证分析,对机械性窒息和腹部损伤认识清楚,对致伤物及只上过程分析准确,对死亡方式论证合理,条理清晰,逻辑性强;鉴定意见准确、规范。 3. 2011 年参加项目:伤残程度鉴定 结果:通过能力验证专家评审组评价意见:鉴定文书格式符合《司法鉴定文书规范》的基本要求。病历摘录能够全面反映被鉴定人原发性损伤及后遗手功能障碍等主要信息。分析说明层次清晰,理由充分,逻辑性较强。能正确理解和运用鉴定标准条款,鉴定结论与专家公议结果基本一致。主要不足:文书格式欠规范;阅片所见未明确说明锁骨陈旧性骨折遭受外力后有错位;本次外伤与锁骨骨折因果关系分析不准确。 4. 2012年3月本所参加了司法部司法鉴定科学技术研究所损伤程度鉴定项目的测量审核。 结果:比对结果一致(通过) 审核意见和评价结果: 1. 鉴定意见书的形式 本测量审核为人体损伤程度鉴定项目。鉴定书的形式符合要求,项目完整。 2. 阅片 阅片较为全面,对鼻骨骨折和上颌骨额突骨折诊断正确,但错误地将眼眶陈旧改变认定为新鲜骨折。
罗氏性能验证报告模板
电化学发光免疫检验项目性能验证报告 一、检测系统 我院检验科生化室共申请认可的电化学发光检验项目27项,各项目的检测系统配对情况如表1。故各分析性能的验证均按其配对情况进行。 表1 生化检验项目检测系统配对情况
二、范围: 2.1 精密度(包括批内及日间精密度)。 2.2 准确度 2.3线性范围验证: 2.4 稀释度(可报告范围) 2.5 生物参考区间的验证 三方法 1、精密度评估 1.1 批内精密度; 仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。 评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,重复测定20次上述各质控品,计算出各项目的均值、标准差和变异系数。变异系数即代表精密度。 统计方法:用EXCEL来分析计算均数、标准差和变异系数。
评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。 结论: 1. 2 批间精密度; 仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。 评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,在5个工作日,测定2批,每次测定2次上述质控,计算出均值,标准差和变异系数。变异系数即代表精密度。 统计方法:用EXCEL来分析计算均数、标准差和变异系数。 评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。 结论 2、正确度评估 仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:卫生部临床检验中心2012年全国肿瘤标志物测定室间质评质控物(批号),2013年卫生部内分泌测定室间质评质控物(批号)作为正确度评估的标本。 评估步骤:根据卫生部临床检验中心2013年室间质评回报结果,挑选以上质控物中相对高值及相对低值质控品进行检测,每个质控品测定3次,计算出均值,标准差和变异系数。 评价方法:将上述测定结果与卫生部临检中心回馈的质评报告中相应的“靶
