甲醛固定组织蛋白提取方法

膜蛋白提取
1分离组织膜蛋白的方法: 1、取组织,加入10ml Buffer A 于冰上充分匀浆。 2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。 3、100000g,4℃离心1hr。弃去上清,沉淀用适量的Buffer B重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。 4、收集所得上清液即为膜组份。 Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。冰上预冷。Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。冰上预冷。 2 取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。样品蛋白含量测定采用酚试剂法。 3 我们实验室提取膜蛋白的方法如下: 1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。3.按 2.5毫升(T75)/每瓶或5毫升(T175/ 每瓶加入冰冷的匀浆液(HEPES:50mM,PH7.4,MgCl2:3mM,EGTA:1mM)于离心管中,将溶液和沉淀转移到匀浆器中,匀浆。 4.将匀浆液转入离心管中,加入适量的Tris –HCl (50mM, PH7.4) 4oC, 18000rpm (40000g) 10分钟。在沉淀中加入同前量的匀浆液,再匀浆,匀浆后加入适量的tris-HCl buffer. 4度18000rpm(40000g)离心,共离心三次。 5.在最后一次离心得到沉淀中按250微升每瓶(T75)或500微升每瓶(T175)加入tris-HCl buffer,匀浆,取50微升匀浆液测量蛋白浓度。 6.按实验要求,将匀浆分装于1毫升的Eppendoff 管中,其于-80oC 冰箱中待用。 主要基于膜蛋白分子量较大,在40000g时易沉降来分离。 做膜蛋白的免疫荧光,可以用荧光抗体染色,然后用荧光显微镜或共聚焦显微镜观察,具体的protocol可以找到,就不多说了。需要注意的是,要弄清楚你所使用的一抗结合部位是在膜蛋白的胞外结构域还是胞内结构域,如果是胞外,可以直接染色;如果在胞内,则需要用无水甲醇在-20度处理10min,使细胞膜通透,然后再用抗体孵育,这样抗体才能进入细胞内与蛋白结合。
那个免疫球蛋白是从人的血液的提取出来的
那个免疫球蛋白是从人的血液的提取出来的 如果那个人的血是有病毒的话不一定可以百分百的杀死 那个人的病毒就会跑到BB那里去 比如艾滋,梅毒,常见是丙肝 真的要验血检查过是缺乏免疫球蛋白的才打 国内是很流行打这些的,我们这边从来不打,除非真的是缺乏免疫球蛋白的BB才会建议打BB又是母乳喂养的,应该不会缺乏的啦 过了4岁就不会经常病的了 以前我们小时候也是经常病啊,所以不用太担心 以上是妹妹咨询她们医院的医生说的,以下是百度了一下的 球蛋白的种类球蛋白有两种:丙种球蛋白和胎盘球蛋白。丙种球蛋白是从健康人的血液中提取的。丙种球蛋白又称抗体,是健康人在和疾病作斗争的过程中产生的。胎盘球蛋白是从健康产妇的胎盘中提取制成的,其主要成分是丙种球蛋白。球蛋白可以增强人体抵抗疾病的能力,属于人工被动免疫制剂。球蛋白不能代替预防接种有些家长迷信球蛋白,把它看成是万能预防针,常常要求医生给孩子打球蛋白针。这种做法是不对的,球蛋白虽然有一定的抗病能力,但绝不是万能药。通常人体在注射球蛋白后3-4周,体内保持一定浓度的抗体,可以预防有关的疾病,以后抗体含量逐渐减少以致消失,就没有防病作用了。而且它只能对麻疹、脊髓灰质炎、肝炎等有一定效果。由此可见,球蛋白的抗病时间是比较短的,适用的疾病范围也是有限的,它不能长时间对各种传染病都有效,不能代替预防接种。为了预防传染病还是应该按免疫程序接种各种疫苗。使用球蛋白的时间要恰当使用球蛋白制剂,应选择恰当的时间,过早过晚都不起作用。如孩子接触了麻疹病人,应在一周内注射球蛋白制剂才有保护作用,注射晚了仍然可能发病;如在接触病人前2个月注射的球蛋白,因为抗体已经消失,则不可能起到防病的作用。/
蛋白提取步骤
提蛋白及WB的步骤 整个过程细胞或蛋白都必须放冰上 准备工作:前一天准备:借钥匙、检查细胞裂解液相关试剂是否充足、 当天准备:洗玻璃板、开紫外,冰块、碎冰、标记离心管及离心管、细胞刮板、 开低温高速离心机 细胞裂解液配制: 1ml cell lysis 10ul NP-40(离心机后) 25ul 焦磷酸钠 40ul NaF 1ul β-甘油磷酸 2 ul Na3VO4 1ul 蛋白酶抑制剂(用完即放回冰箱) 10ul PMSF(最后加,随加随用,有毒) 细胞裂解和收集 1.观察细胞状态,并准备提蛋白:吸走培养基、用PBS洗细胞两次(倾斜贴壁加PBS,左 右轻轻摇),倾斜贴壁吸走PBS。 2.将细胞盘拿到外间冰上,加裂解液(体积网上推荐:一般106加),冰上静置1-2min。 3.刮细胞:细胞刮板每次用之前拿水涮一涮,甩干,然后从中间到外面打圈刮,再从下往 上,从上往下全面刮,(刮的时候要迅速),最后用枪吸取裂解液至离心管。 细胞破碎 4.超声波破碎细胞:准备三个小烧杯,加满冰块,三个小夹子。(超声波破碎仪的铁棒不 要碰到离心管的壁和底部) 超声波设置: 工作功率5% 工作时间3min 开机时间15s,关机时间30s 温度0度, 报警温度1度 5.4℃、13000r/min,离心15min。(离心机用后一直保持打开的状态,) 蛋白保存 6.蛋白保存及分装:吸上清液至离心管,涡旋、吸一半至另一个管中,涡旋。-80℃保存。注意事项:PMSF一定要现用现加,PMSF在水溶液中不稳定,30min内就会降解一半。样品处理超过1h,补加一次。
BCA测定蛋白浓度 1、测空白板,选差异较小的孔。 BCA测定法波长570,Bracford:595 2、标准蛋白的稀释(5mg/ul):分装1ml PBS来使用,稀释标准蛋白至ul。 取5ul标准蛋白+45ul PBS 3、加样: 浓度0 BSA(ul)0481216 PBS(ul)20161284 4、样品蛋白稀释20倍:2ul蛋白+18ul PBS 5、配BCA:每个孔200ul,一个样品2个重复,A:B=50:1,根据样品数来计算BCA的用量, 一般防止损耗,多算一个样。 6、加BCA:悬空加、37℃孵育30 min。(手不能碰板的底部,影响测定结果) 7、计时30min 8、配分离胶,灌胶,加水封。 9、计时20min。 10、测蛋白:先振板、再设置参数。 11、计算上样体积: 12、配浓缩胶,灌胶,加梳子,等1-2min,出现缩胶的地方补上。 13、打开干式加热器 10、蛋白质上样:根据计算结果乘以稀释倍数,算出蛋白浓度,以体积最大的为准,其他用 水补足。(最大上样量为20ul,除去buffer的体积,蛋白质最大上样体积为16ul) 标记离心管 加样顺序:水、buffer(1/4)、蛋白、离心-涡旋-离心。100℃变性10min(迅速,确保变性程度一致) 11、计时10min ,变性10min。 12、安装电泳槽: 电泳液(1X):配制:90ml(10X)+810ml水(只能用一次) 液面刚覆盖胶,不能有气泡。 13、上样:maker 上样量为3ul。依次上样(吸样品时最好一次吸完)枪头不能撬板,笔直打进去 14、电泳 分离胶100V,20min左右、条带都跑开即可。 浓缩胶145V 1h 有等紫色部分跑到底结束。 转膜 准备工作:转移缓冲液(只能用2次)、三层滤纸、海绵、PVDF膜 PVDF膜用之前用甲醇浸泡数秒。 用海绵和滤纸之前先浸湿。 转膜:负极(黑板)海绵-三层滤纸-胶-PVDF膜-三层滤纸-海绵-正极(白板)。 三层滤纸和膜都需要赶气泡。
组织蛋白提取
1. 提取蛋白裂解液配方: 25 mM HEPEs PH:7.4 5 mM EDTA 5 mM EGTA 50 mM NaCl 1 mM Na3VO3(矾酸钠) 1 mM sodium phosphophate 0.05% SDS 0.05% sodium deoxycholate (脱氧胆酸盐) 1% Triton-X 100 5 mM NaF 0.1% 2-mercaptoethanol 1 mM PMSF (1ul 100mmol/L+纯水99ul) 1uM Microcysin-LR 40ug/ml pepstatin A 40ug/ml aprotinin 40ug/ml leupeptin 2..组织蛋白提取及定量: 称量组织重量置小烧杯 用PBS清洗1-2次 加入组织裂解液【悬浮buffer储存液500ml+苯甲基磺酰氟(PMSF,有毒物)30+leapeptin (蛋白抑制酶)0.5ul于EP管混合,倒入盛组织的烧杯】 置冰上5min 用眼科剪剪碎 倒入5ml匀浆器(反复抽吸匀浆组织) 倒入或吸入EP管 离心(4°C 1000g 10min)取上清 用于蛋白定量或储存于-80°C 蛋白定量 取5ul蛋白样本+15ul去离子水(DW)+200ulBCA(A:B为50:1即196:4),分别混合样本与DW和BCA的A液与B液置于干净的96孔板上37°C,30min
酶联免疫测OD值(570nm,ELX-800型酶标仪) 由OD值计算蛋白浓度(用excel表或用下列公式计算) (OD值×987.7108-198.342)×103ng/ul;OD=样本OD值-空白对照OD值)
植物组织蛋白提取方法
植物蛋白质提取方法总汇 一、植物组织蛋白质提取方法 1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。 2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。 3、用离心机离心8000rpm40min4℃或11100rpm20min4℃ 4、提取上清液,样品制备完成。 蛋白质提取液:300ml 1、1Mtris-HCl(PH8) 45ml 2、甘油(Glycerol)75ml 3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g 这种方法针对SDS-PAGE,垂直板电泳! 二、植物组织蛋白质提取方法 氯醋酸—丙酮沉淀法 1、在液氮中研磨叶片 2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。 3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm 以上1小时),然后真空干燥沉淀,备用。 4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。 5、用Brandford法定量蛋白,然后可分装放入-80℃备用。 药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮。裂解液:2.7g尿素0.2gCHAPS 溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。 这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少!
三、组织:肠黏膜 目的:WESTERN BLOT检测凋亡相关蛋白的表达 应用TRIPURE提取蛋白质步骤: 含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量) 倒转混匀,置室温10min 离心:12000 g,10min,4度,弃上清 加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量) 振荡,置室温20min 离心: 7500g,5 min,4度,弃上清 重复0.3M盐酸胍/95%乙醇步2次 沉淀中加入100%乙醇 2ml 充分振荡混匀,置室温20 min 离心: 7500g,5min,4度,弃上清吹干沉淀 1%SDS溶解沉淀 离心:10000g,10min,4度 取上清-20度保存(或可直接用于WESTERN BLOT) 存在的问题:加入1%SDS后沉淀不溶解,还是很大的一块,4度离心后又多了白色沉定,SDS结晶?测浓度,含量才1mg/ml左右。 解决:提蛋白试剂盒,另外组织大小适中,要碎,立即加2X BUFFER,然后煮5-10分钟,效果很好的。 四、植物材料:水稻苗,叶鞘,根 1、200毫克样品置于冰上磨碎 2、加lysis buffer,离心,10000rpm,4度,5min取上清 3、重复离心5min
细胞总蛋白提取方法
细胞总蛋白提取方法 一、溶液配制 1.100mM NaF (NaF MW=41.99) 10ml 称取NaF 41.99mg,超纯水8ml溶解后定容至10ml。 2.100 mM PMSF 3.RIPA溶液100ml 成分分子量终浓度 Tris 121.14 0.6 g 5.0 mM (pH 7.4) NaCl 58.44 0.87 g 150 mM EDTA 372.24 37.22 mg 1 mM NP-40 1 ml 1% SDS 0.1 g 0.1% 脱氧胆酸钠0.5 g 0.5% 溶解于80 ml超纯水中,待溶解后加入HCl调pH值至7.4,定容至100 ml。 ※使用前加入 成分储存浓度加入量终浓度 PMSF 100 mM 10μl/1ml 1 mM NaF 100 mM 10μl/1ml 1 mM Aprotinin 10μg/μl0.2μl/1ml 2μg/μl Leupetin 10μg/μl0.2μl/1ml 2μg/μl 二、方法 1.细胞收取 1)细胞传代至60mm培养皿中,待细胞融合约100%,收集细胞 2)弃培养基,加入PBS 2ml清洗培养皿一次,弃PBS。 3)加入0.05%胰酶2ml,37℃温育1min。 4)待细胞变形后,将细胞吹下转移至一个1.5ml ependorf 管中,10,000rpm×3min,4℃ 5)弃上清,1ml预冷的PBS清洗沉淀,10,000rpm×
6)重复PBS清洗一次 7)弃上清,-80℃冻存待裂解 2.蛋白提取 1)向细胞沉淀中加入200μl RIPA缓冲液(含1mM PMS 1mM NaF、2μg/ml Aprotinin、2μg/ml Leupetin) 后冰上放置40mins 2)10,000rpm×15min,4℃ 将上清转移至一个新的ependorf 管中(约250μl)
辛酸—硫酸铵沉淀法提取免疫球蛋白G
辛酸—硫酸铵沉淀法提取免疫球蛋白G 一、实验目的: 1、了解蛋白质纯化的基本技术; 2、学习辛酸—硫酸铵法纯化抗体的方法。 二、实验原理: 根据免疫球蛋白的性质利用生物化学各种纯化方法进行抗体的纯化,主要有常规生物化学和特异性亲和层析两类方法。本实验采用辛酸—硫酸铵沉淀法从动物血清中纯化抗体,纯度和回收率较高,且抗体活性不被破坏;同时此方法操作简便、周期短、成本低、不需要复杂的仪器设备,不仅使用于小量抗体的纯化,也适合大批量抗体的制备。 三、实验材料试剂和器材: 1、实验材料:兔血清。 2、试剂:乙酸-乙酸钠缓冲液、10×磷酸盐-NaCl缓冲液、透析液、5 mol/LNaOH、0.1mol/L NaOH。 3、器材:电磁搅拌器、离心机、透析袋。 四、操作方法: 1、动物血清用4倍体积乙酸-乙酸钠缓冲液稀释,0.1mol/L NaOH调整血清稀释液pH至4.5。 2、室温下用电磁搅拌器边搅拌边缓慢滴加辛酸(加入量为1L血清稀释液加25ml),滴加完 后继续搅拌30min。 3、离心(10000转/分,20分钟),收集上清液,弃去沉淀,上清液用滤纸过滤除去悬浮物, 量体积。 4、按照10%体积加入10×磷酸盐-NaCl缓冲液,用5 mol/LNaOH调pH至7.4。 5、上清液4℃预冷10min,测量溶液总体积,在4℃按277g/L缓慢加入硫酸铵粉末(终浓 度达到45%饱和度),边加边搅拌,加完后继续搅拌30min。 6、离心(5000转/分,15分钟),弃去上清液,收集沉淀。 7、沉淀用少量透析液溶解(一般为原血清体积的1/10),透析并更换两次透析液。 8、透析后的抗体溶液在50~55℃水浴中加热20min,离心(5000转/分,20分钟),上清液于-20℃保存。
提取蛋白的常规方法
1、原料的选择 早年为了研究的方便,尽量寻找含某种蛋白质丰富的器官从中提取蛋白质。但至目前经 常遇到的多是含量低的器官或组织且量也很小,如下丘脑、松果体、细胞膜或内膜等原材料, - 105 - 蛋白质提取与制备Protein Extraction and Preparation 因而对提取要求更复杂一些。 原料的选择主要依据实验目的定。从工业生产角度考虑,注意选含量高、来源丰富及成 本低的原料。尽量要新鲜原料。但有时这几方面不同时具备。含量丰富但来源困难,或含量 来源均理想,但分离纯化操作繁琐,反而不如含量略低些易于获得纯品者。一般要注意种属 的关系,如鲣的心肌细胞色素C 较马的易结晶,马的血红蛋白较牛的易结晶。要事前调查 制备的难易情况。若利用蛋白质的活性,对原料的种属应几乎无影响。如利用胰蛋白酶水解 蛋白质的活性,用猪或牛胰脏均可。但若研究蛋白质自身的性质及结构时,原料的来源种属 必须一定。研究由于病态引起的特殊蛋白质(本斯.琼斯氏蛋白、贫血血红蛋白)时,不但 使用种属一定的原料,而且要取自同一个体的原料。可能时尽量用全年均可采到的原料。对 动物生理状态间的差异(如饥饿时脂肪和糖类相对减少),采收期及产地等因素也要注意。 2、前处理 a、细胞的破碎 材料选定通常要进行处理。要剔除结缔组织及脂肪组织。如不能立即进行实验,则应冷 冻保存。除了提取及胞细外成分,对细胞内及多细胞生物组织中的蛋白质的分离提取均须先 将细胞破碎,使其充分释放到溶液中。不同生物体或同一生物体不同的组织,其细胞破坏难 易不一,使用方法也不完全相同。如动物胰、肝、脑组织一般较柔软,作普通匀浆器磨研即 可,肌肉及心组织较韧,需预先绞碎再制成匀桨。 ⑴机械方法 主要通过机械切力的作用使组织细胞破坏。常用器械有:①高速组织捣碎机(转速可达 10000rpm,具高速转动的锋利的刀片),宜用于动物内脏组织的破碎;②玻璃匀浆器(用两 个磨砂面相互摩擦,将细胞磨碎),适用于少量材料,也可用不锈钢或硬质塑料等,两面间
蛋白提取方法
?1 材料与方法 1、1 材料 1、1、1组织与细胞得来源: ?1。1、2 仪器设备?机械组织匀浆器?低温高速离心机(>40,000g) 超速离心机?超生细胞破碎仪 超纯水装置 ??1、1。3 试剂 三氯醋酸(TCA) 丙酮 二硫苏糖醇(DTT) ?尿素?CHAPS?PMSF?EDTA ?乙醇?磷酸 考马斯亮蓝R350 ?抑肽素A?亮肽素 试剂纯度均应就是分析纯或以上。? 1。1、4溶液配制?(1) PBS: ?NaCl8g,KCl 0、2 g,Na2HPO4 1。44 g,KH2PO4,溶于800 ml水中,用HCl调pH至7.4,用纯水定容至1 L; ?(2)EDTA 储存液: 18.61g Na2EDTA?2H2O,溶于70 ml纯水中,用10 mol/L NaOH调节pH值至8.0(约需2 g NaOH颗粒),定容为100 ml、可高压灭菌后分装备用;?(3) 亮肽素储存液(50 μg/ml,100×) 10mg/ml溶于水,-75℃保存;使用时配成50 μg/ml储液,-20℃保存; (4) 抑肽素储存液(70μg/ml,100×) 1 mg/ml溶于甲醇,—75℃保存;使用时配成70 μg/ml储液,-20℃保存; (5) PMSF储存液(10mM,100×): 17.4mgPMSF,溶于1ml异丙醇中,—20℃保存。?DTT储存液(1 M): ?0。31gDTT溶于2 mlH2O中,-20℃保存(DTT或含有DTT得溶液不能进行高压处理,可过滤除菌)。?(7) 裂解液: Lysis buffer A (9M urea,4%w/v CHAPS, 1%w/v DTT, 0.5%CA and a cocktailof proteaseinhibitors)??Lysis buffer B (7 M urea, 2M thiourea,4% w/v CHAPS, 1%w/v DTT,0、5% CA andacocktailofprotease inhibitors) ?Lysisbuffer C 40 mMTris-base (pH 9。5)inultrapure H2O Lysis buffer D (8 Murea, 4%CHAPS, 40mM Tris(base), 40 ml) ?Lysis buffer E ?(5M urea, 2 M thiourea, 2%SB3-10, 2%CHAPS,1% w/v DTT, 0、5% CAandacocktail ofprotease inhibitors) 100μL SDSsample solution (1% w/v SDS, 0、375M Tris-HCl, pH8。8, 50 mM DTT,25%v/vgly ?LysisbufferF? cerol) ●CA、蛋白酶抑制剂混合物与DTT在临用前加入。?蛋白酶抑制剂混合物[3]?成分终浓度?蛋白酶抑制剂混合物 PMSF 35 μg/ml or 1 mM EDTA 0、3mg/ml (1 mM) 抑肽素 0。7 μg/ml?亮肽素 0、5μg/ml? 1.2 方法?1。1.1组织蛋白提取方法 1、2.1。1三氯醋酸/丙酮沉淀法[1]?(1)冰上取材,称湿重,置液氮中冻存或直接进行下一步; (2)在液氮中研碎样品或使用机械匀浆器磨碎组织; ?(3)将粉末悬浮于含DTT(0。2%w/v)得10%三氯醋酸(w/v)得丙酮溶液中; (4)蛋白–20℃沉淀过夜; ?(5)35000×g(6℃)离心30min; ?将沉淀重悬于含0.2%DTT得预冷丙酮中; ?(7)-20℃放置1h; 35000×g(6℃)离心30min; (9)在通风橱中让丙酮充分挥发,得到干燥得沉淀; 15℃,40000×g,离心1hr; (10)在裂解液中重新溶解沉淀(50-100mg组织需要1ml裂解液); ?( ) 11 (12)用Bradford法[2]测定上清得蛋白浓度,分装后置–75℃保存。?1、2、1。2超速离心法?(1)取材; ?(2)用研钵在液氮冷冻条件下将样品
免疫球蛋白的提取方法
免疫球蛋白的提取方法 根据猪血中含有的各种蛋白质的分子大小、电荷多少、溶解度以及免疫学特征等,从血液中提取免疫球蛋白,常用的有盐析法、有机溶剂沉淀法、有机聚合物沉淀法、变性沉淀法等。 免疫球蛋白的提取盐析法盐析法是分离蛋白质的重要方法之一,是利用抗体与杂质之间对盐浓度敏感程度的差异性进行的。选择一定浓度范围的盐溶液使部分杂质呈“盐析”状态,抗体成分呈“盐溶”溶解状态。离心去除盐析沉淀状态的杂蛋白,得到的上清液再选择一定浓度范围的盐溶液使抗体成分呈盐析状态,离心得到的沉淀物即为纯化的目标抗体。目前常用的盐析法有饱和硫酸铵分步盐析法、辛酸沉淀法、氯化铁沉淀法、多聚磷酸盐盐析法等。饱和硫酸铵分步盐析硫酸铵是盐析法最常用的无机盐,主要原因是它溶解度大,随温度变化小,对蛋白质有保护作用,高浓度时可抑制微生物和蛋白酶的活性,价格也不贵。 免疫球蛋白的饱和硫酸铵分步盐析法操作简单,对设备和操作条件要求不高,便于工业化生产。其具体步骤为:取一定量血浆,加生理盐水稀释,边搅拌边缓慢加入饱和硫酸铵溶液至硫酸铵终浓度20%,4℃静置1h,4000r/min离心10min,弃沉淀,上清液中继续加入饱和硫酸铵溶液至硫酸铵终浓度50%,浓氨水调pH值至7.0,4℃静置2h,4000r/min离心20m弃上清,将沉淀溶于生理盐水,超滤除盐浓缩,滤液中无S2- 4为止,即得IgG粗提物。 免疫球蛋白的辛酸沉淀法辛酸沉淀法提取IgG时,对设备和操作条件要求较高,在离心时,转速为10000 r/min,普通离心机达不到要求。在调节溶液pH值时,要控制得当,pH值稍低或稍高对IgG的得率和纯度都有很大影响,这些都限制了它的广泛应用。其具体步骤为:取一定量0.1mol调pH值至4.5;室温下边搅拌边缓慢加入辛酸(按辛酸25 μl/mL血清混合液添加),继续搅拌30min 后,10000r/min离心30min,弃沉淀,留上清液,上清液用多层纱布过滤,留滤液,然后将滤液装入透析袋中析48h,每8~10h换一次透析液,最后超滤浓缩即得1gG粗提液。 免疫球蛋白的氯化铁沉淀法氯化铁沉淀法的原理是据蛋白质分子与金属离子反应形成盐复合物的形式和种类的不同,达到分离不同蛋白质的目的。其具体步为:取一定量的血浆(加抗凝剂),用生理盐水稀释后,边搅拌边缓加入三氯化铁溶液,调pH值至4.5,搅拌混,40℃水浴保温60min后,4000r/min离心15min,弃去沉淀,上清液调pH值至9.0,常温静置2h,离心去沉淀过滤,上清液经超滤浓缩即得IgG粗提。 免疫球蛋白多聚磷酸盐盐析法多聚磷酸盐作为一种食品添加剂,常被添加在肉制品中以提高产品的保水性或者作为絮凝剂在食品加工中使用。多聚磷酸盐作为沉淀剂具有安全和高效的特点,是解决猪血清IgG大规模分离制备有效途径之一,但目前尚未有深入系统的研究。其具体步骤为:取一定量的血清加入相应量的多聚磷酸盐溶液,以0.1mol/L盐酸调至所需pH值,在一定温度水浴中保温反应一段时间后,取出8000r/min离心10min,弃沉淀,收集上清液,即为IgG粗提液。 免疫球蛋白的有机溶剂沉淀法有机溶剂沉淀法广泛用于生产蛋白质制剂,常用的试剂是丙酮和乙醇等,其中以乙醇最为常用。目前,国际上常用冷乙醇法有两种,一种是美国等国主要使用的Cohn-Oncley法,另一种是西欧等国主要使用的Kistler和Nitschmann法。冷乙醇分离法是WHO规程和中国生物制品规程推荐用的方法,不仅分离物质多,可同时分离多种血浆成分,分辨率高,提纯效果好,而
脂肪组织蛋白的提取方法.doc
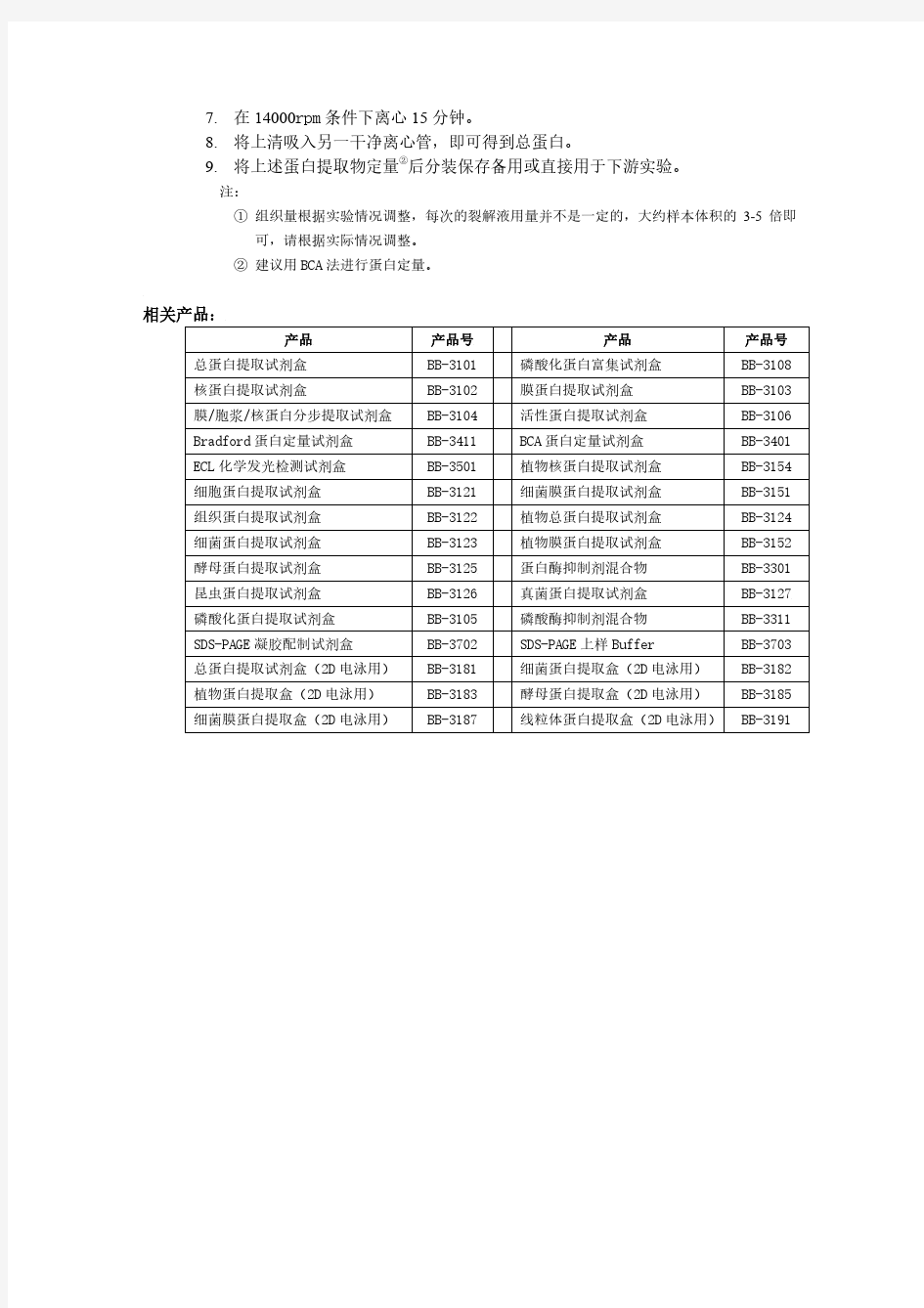
①用液氮研磨的方法更佳,具体方法可以联系本公司****@***.c*m索取详细资料。 beibokit https://www.360docs.net/doc/8a16579856.html, - 2 - 产品说明书 相关产品: 产品 总蛋白提取试剂盒核蛋白提取试剂盒 膜/胞浆/核蛋白分步提取试剂盒Bradford蛋白定量试剂盒ECL化学发光检测试剂盒细胞蛋白提取试剂盒组织蛋白提取试剂盒细菌蛋白提取试剂盒酵母蛋白提取试剂盒昆虫蛋白提取试剂盒磷酸化蛋白提取试剂盒SDS-PAGE凝胶配制试剂盒总蛋白提取试剂盒(2D电泳用)植物蛋白提取盒(2D电泳用)细菌膜蛋白提取盒(2D电泳用) 产品号BB-3101 BB-3102 BB-3104 BB-3411 BB-3501 BB-3121 BB-3122 BB-3123 BB-3125 BB-3126 BB-3105 BB-3702 BB-3181 BB-3183 BB-3187 产品 磷酸化蛋白富集试剂盒膜蛋白提取试剂盒活性蛋白提取试剂盒BCA蛋白定量试剂盒植物核蛋白提取试剂盒细菌膜蛋白提取试剂盒植物总蛋白提取试剂盒植物膜蛋白提取试剂盒
蛋白酶抑制剂混合物真菌蛋白提取试剂盒磷酸酶抑制剂混合物SDS-PAGE上样Buffer 细菌蛋白提取盒(2D电泳用)酵母蛋白提取盒(2D电泳用)线粒体蛋白提取盒(2D电泳用) 产品号BB-3108 BB-3103 BB-3106 BB-3401 BB-3154 BB-3151 BB-3124 BB-3152 BB-3301 BB-3127 BB-3311 BB-3703 BB-3182 BB-3185 BB-3191 beibokit https://www.360docs.net/doc/8a16579856.html, - 3 -
蛋白质提取方法
蛋白质提取方法-------列举10种方法 一、植物组织蛋白质提取方法(summer) 1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。 2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4 小时)。 3、用离心机离心8000rpm40min4℃或11100rpm20min4℃ 4、提取上清夜,样品制备完成。 蛋白质提取液:300ml 1、1Mtris-HCl(PH8)45ml 2、甘油(Glycerol)75ml 3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g 这种方法针对SDS-PAGE,垂直板电泳! 二、植物组织蛋白质提取方法(summer) 三氯醋酸—丙酮沉淀法 1、在液氮中研磨叶片 2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。 3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1 小时),然后真空干燥沉淀,备用。 4、上样前加入裂解液,室温放置30 分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm 以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。 5、用Brandford法定量蛋白,然后可分装放入-80℃备用。 药品: 提取液:含10%TCA 和0.07%的β-巯基乙醇的丙酮 裂解液:2.7g 尿素0.2gCHAPS 溶于3ml 灭菌的去离子水中(终体积为5ml),使用前再加入1M 的DTT65ul/ml。 这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少! 三、组织:肠黏膜(newinbio) 目的:WESTERN BLOT检测凋亡相关蛋白的表达 应用TRIPURE 提取蛋白质步骤: 含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量)倒转混匀,置室温10min 离心:12000 g,10min,4度,弃上清,加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE 用量)振荡,置室温20min 离心:7500g,5 min,4 度,弃上清 重复0.3M盐酸胍/95%乙醇步2 次 沉淀中加入100%乙醇2ml 充分振荡混匀,置室温20 min 离心:7500g,5min,4度,弃上清吹干沉淀,1%SDS溶解沉淀 离心:10000g,10min,4度 取上清-20 度保存(或可直接用于WESTERN BLOT) 存在的问题:加入1%SDS 后沉淀不溶解,还是很大的一块,4 度离心后又多了白色沉定,SDS 结晶?测浓度,含量才1mg/ml左右。 解决:提蛋白试剂盒,另外组织大小适中,要碎,立即加2X BUFFER,然后煮5-10分钟,
中图版高中生物选修1 6.1蛋白质的提取和分离_教案设计1
蛋白质的提取和分离 【教学目标】 1.知道蛋白质分离和提取技术的基本原理。 2.能进行血清蛋白的提取和分离。 3.尝试提取和检测牛奶中的酪蛋白。 4.尝试卵清蛋白的分离。 【教学重难点】 1.知道蛋白质分离和提取技术的基本原理。 2.能进行血清蛋白的提取和分离。 【教学过程】 一、蛋白质分离提纯技术 1.将生物体内的蛋白质提取出来并加以分离,就可以得到高纯度的、甚至是单一种类的蛋白质。 2.蛋白质分离提纯技术包括离心技术、层析技术和电泳技术等。其中,电泳技术最为快捷灵敏、简便易行。 二、电泳技术及分离蛋白质的原理 1.电泳现象:带电粒子在电场中可以向与其自身所带电荷相反的电极方向移动。电泳常用的支持物是聚丙烯酰胺凝胶,由此而来的技术称为聚丙烯酰胺凝胶电泳。 2.电泳技术分离蛋白质的原理: (1)蛋白质含有游离的氨基和羧基,是两性电解质,在一定pH条件下带有电荷。 (2)蛋白质所带的电荷数越多,移动得越快;电荷数相同时,分子量越小,则移动越快。 (3)不同蛋白质的混合溶液,在经过同一个电场电泳后,会在凝胶上形成不同的带纹。每一种带纹可能就是一种蛋白质。将这些带纹一个一个地剪下来,分别予以洗脱,然后对洗脱液中的蛋白质做进一步的分离。如果待测洗脱液不能再分离,则这个带纹中很可能含有一种单纯蛋白质。如果待测洗脱液还能再分离,则这个带纹中含有多种蛋白质,需要作进一步分离,直至提纯。 三、血清蛋白的提取和分离 1.新鲜血液在体外凝固后,会析出清亮的淡黄色液体——血清。血清中含有丙种球蛋白、
凝集素等多种蛋白质。 2.过程: (1)点样:取新制血清与蔗糖溶液及溴酚蓝指示剂等体积混匀后,小心加到电泳样品槽的胶面上。 (2)电泳。 (3)染色:取出凝胶,放入质量分数为0.05%的考马斯亮蓝R250染色液中。染色与固定同时进行,使染色液没过胶板,染色30min。 (4)脱色:用体积分数为7%的醋酸溶液浸泡漂洗数次,每隔1~2h更换脱色液,直至底色脱净,背景清晰。 (5)制干胶板:将已脱色的凝胶板放在保存液中浸泡3~4h,然后放在两层透气玻璃纸中间,自然干燥即可获得血清蛋白的电泳谱带。 四、其他蛋白质的提取与分离 1.牛奶中酪蛋白的提取与检测: 当pH=4.8时,酪蛋白的溶解度降低,并析出沉淀。用酒精除去酪蛋白沉淀中的脂肪后,即得到纯的酪蛋白。 酪蛋白中含有酪氨酸,能与米伦试剂起颜色反应,首先生成白色沉淀,加热后变成红色。 2.卵清蛋白质的分离: 选取鸡、鸭、鹅、鹌鹑等动物的新鲜卵清做实验材料。采用电泳法分离卵清蛋白质。 自主思考: 可否利用蛋白质的提取与分离技术快速诊断早期癌变? 提示:可以。只需从早期患者的尿液、血液或细胞裂解液中提取少量蛋白质样品,采用蛋白质指纹图谱技术,就可以更加快速、简便、准确地对细胞癌变做出诊断。 探究一:蛋白质的分离原理 问题导引: 为年老多病的人注射丙种球蛋白,可以在一定程度上增强其身体的抵抗力。在动物体内,丙种球蛋白和许多蛋白质混在一起。要获得纯净的丙种球蛋白,就必须进行提取和分离。你能提供分离蛋白质的思路吗? 提示:可根据蛋白质各种特性的差异,如分子的大小、所带电荷的性质和多少等来分离不同种类的蛋白质。 名师精讲: 蛋白质的分离方法:
血清免疫球蛋白的提取分离、纯化及鉴定
I 血液及组织样品的制备 分析组织中某种物质的含量、探索物质代谢的过程和规律,经常使用动物的肝、肾、脑、粘膜和肌肉等组织,也选用全血、血浆、血清或者无蛋白血滤液等血液样品,有时也采用尿液、胃液等完成各种生化实验。掌握以上各种实验样品的正确处理和制备方法是保证生化实验顺利进行的关键。 一、血液样品 (一)采血 测定用的血液,多由静脉采集。一般在饲喂前空腹采取,因此时血液中化学成分含量比较稳定,采血时所用的针头、注射器,盛血容器要清洁干净;接血时应让血液沿着容器壁慢慢注入,以防溶血和产生泡沫。 (二)血清、全血及血浆的制备 1.血清的制备 血清是全血不加抗凝剂自然凝固后析出的淡黄清亮液体。制备方法是:将刚采集的血液直接注入试管或离心管中。将试管放成斜面,让其自然凝固,一般经3h 血块自然收缩而析出血清;也可将血样放入37 ℃恒温箱内,促使血块收缩,能较快约析出血清。为了缩短时间,也可用离心机分离(未凝或凝固的均可离心),分离出的血青,用吸管吸出置于另一试管中,若不清亮或带有血细胞,应重离心,加盖冷藏备用。 2.全血及血浆的制备 取清洁干燥的试管或其它容器,收集动物的新鲜血液,立即与适量的抗凝剂充分混合,所得到的抗凝血为全血。每毫升血液中加入抗凝剂的种类可以根据实验的需要进行选择,但是用量不宜过大,否则将影响实验的结果。将已抗凝的全二于2,000r / min 离心10min ,沉降血细胞,取上层清液即为血浆。血浆比血清分离得快而且量多:两者的差别,主要是血浆比血清多含一种纤维蛋白原,其它成分基本相同。 3.抗凝剂 凡能够抑制血液凝固反应进行的化合物称为抗凝剂。抗凝剂种类甚多,实验室常用的有如下几种,可根据情况选择使用。 (1)草酸钾(钠)优点是溶解度大,可迅速与血中钙离子结合,形成不溶性草酸钙,使血液不凝固。每毫升血液用1-2mg 即可。 配制方法:配制10%草酸钾水溶液二吸取此液0.1ml 放入一试管中,慢慢转动试管,泛草酸钾尽量铺散在试管壁上,置80 ℃烘箱烤干(若超过150 ℃则分解),管壁即呈一薄层三色粉末,加塞备用。可抗凝血液5ml 。 此抗凝血,常用于非蛋白氮等多种测定项目,但不适用于钾、钙的测定。对乳酸脱氯酸性磷酸酶和淀粉酶具有抑制作用,使用时应注意。 ( 2)草酸钾-氟化钠氟化钠是一种弱抗凝剂。但浓度2mg / ml 时能抑制血液内葡萄糖的分解,因此在测定血糖时常与草酸钾混合使用。 配制方法:草酸钾6g、氟化钠3g,溶于100ml 蒸馏水中。每个试管加入0.25ml,于80℃烘干备用。每管含混合剂22. 5mg,可抗凝5ml 血液。 此抗凝血,因氟化钠抑制睬酶,所以不能用于脉酶法的尿素氮测定;也不能用于淀粉酶及磷酸酶的测定。 (3)乙二胺四乙酸二钠盐(简称EDTANa2 ) EDTANa2 易与钙离子络合而使血液不凝。 有效浓度为0.5mg 可抗凝lml 血液。 配制方法:配成4 % EDTANa :水溶液。每管装0.lml , 80 ℃烘干,可抗凝5ml 血液。此抗凝血液适用于多种生化分析。但不能用于血浆中含氮物质、钙及钠的测定。
蛋白质提取与制备的原理和方法
蛋白质提取与制备的原理和方法 蛋白质提取与制备蛋白质种类很多,性质上的差异很大,既或是同类蛋白质,因选用材料不同,使用方法差别也很大,且又处于不同的体系中,因此不可能有一个固定的程序适用各类蛋白质的分离。但多数分离工作中的关键部分基本手段还是共同的,大部分蛋白质均可溶于水、稀盐、稀酸或稀碱溶液中,少数与脂类结合的蛋白质溶于乙醇、丙酮及丁醇等有机溶剂中。因此可采用不同溶剂提取、分离及纯化蛋白质和酶。 蛋白质与酶在不同溶剂中溶解度的差异,主要取决于蛋白分子中非极性疏水基团与极性亲水基团的比例,其次取决于这些基团的排列和偶极矩。故分子结构性质是不同蛋白质溶解差异的内因。温度、pH、离子强度等是影响蛋白质溶解度的外界条件。提取蛋白质时常根据这些内外因素综合加以利用。将细胞内蛋白质提取出来。并与其它不需要的物质分开。但动物材料中的蛋白质有些可溶性的形式存在于体液(如血浆、消化硫等)中,可以不必经过提取直接进行分离。蛋白质中的角蛋白、胶原及丝蛋白等不溶性蛋白质,只需要适当的溶剂洗去可溶性的伴随物,如脂类、糖类以及其他可溶性蛋白质,最后剩下的就是不溶性蛋白质。这些蛋白质经细胞破碎后,用水、稀盐酸及缓冲液等适当溶剂,将蛋白质溶解出来,再用离心法除去不溶物,即得粗提取液。水适用于白蛋白类蛋白质的抽提。如果抽提物的pH用适当缓冲液控制时,共稳定性及溶解度均能增加。如球蛋白 类能溶于稀盐溶液中,脂蛋白可用 稀的去垢剂溶液如十二烷基硫酸钠、洋地黄皂苷(Digitonin)溶液或有机溶剂来抽提。其它不溶于水的蛋白质通常用稀碱溶液抽提。 蛋白质类别和溶解性质 白蛋白和球蛋白: 溶于水及稀盐、稀酸、稀碱溶液,可被50%饱和度硫酸铵析出。 真球蛋白: 一般在等电点时不溶于水,但加入少量的盐、酸、碱则可溶解。 拟球蛋白: 溶于水,可为50%饱和度硫酸铵析出 醇溶蛋白: 溶于70~80%乙醇中,不溶于水及无水乙醇 壳蛋白: 在等电点不溶于水,也不溶于稀盐酸,易溶于稀酸、稀碱溶液 精蛋白: 溶于水和稀酸,易在稀氨水中沉淀 组蛋白: 溶于水和稀酸,易在稀氨水中沉淀 硬蛋白质: 不溶于水、盐、稀酸及稀碱 缀合蛋白(包括磷蛋白、粘蛋白、糖蛋白、核蛋白、脂蛋白、血红蛋白、金属蛋白、黄素蛋白和氮苯蛋白等) : 此类蛋白质溶解性质随蛋白质与非蛋白质结合部分的不同而异,除脂蛋白外,一般可溶于稀酸、稀碱及盐溶液中,脂蛋白如
实验方案_低温乙醇法从人血清中提取免疫球蛋白
低温乙醇法从人血清中提取免疫球蛋白 一、实验目的 利用低温乙醇法从人血清中分离出免疫球蛋白(Ig),并获得副产物血清白蛋白。 二、实验原理 (1)低温乙醇法Cohn6法:美国哈佛大学E·J·COHN教授研究组,在短短两年建立了低温乙醇分段提取法。 方法原理:往蛋白水溶液中加入中溶性有机溶剂,如乙醇、丙酮等,主要是降低水分子的活度,降低溶液的介电常数,从蛋白分子周围排斥水分子,使蛋白分子之间通过极性基团的相互作用,在范德华力作用下,发生凝聚。不过由于有机溶剂存在,降低了蛋白分子表面憎水基团的作用,因而引起蛋白分子聚集的主要极性基团的相互电荷之间的引力。(文献20) 分离过程中,二法通过五个因素的变动(五变系统),使很多血浆蛋白质得以分离。这五个因素及其各自的作用是;①乙醇:使蛋白质分子“脱水”;⑦pH值;蛋白质在等电点时易于沉淀;②电解质浓度:在低离子浓度下,对蛋白质溶解度有较大影响;④蛋白质浓度:浓度越低,其沉淀作用越小;⑥温度:在低温下,可避免乙醇对蛋白质的变性作用。同时,蛋白质溶解为吸热反应,溶解度随温度上升而增高。 经实验得知,利用低温乙醇法能将血清蛋白分成六个组分(Ⅰ~Ⅵ),其中免疫球蛋白IgG主要存在于Ⅱ+Ⅲ中,白蛋白Alb主要存在于Ⅴ中。 (2) Cohn氏9法;该法对Cohn氏6法的组分Ⅱ+Ⅲ作进一步分离和提纯,可获得组分Ⅱ—l,2,3(Y—G),组分Ⅲ一1(同种凝集素),组分Ⅲ—2(凝血酶原),组分Ⅲ—3(血浆酶原)等产品。其工艺流程见图:
乙醇法生产中所用的乙醇是通过予冷、慢速搅拌滴入的。其体积可按下式计算: 式中V=所需乙醇体积;V 0=原来溶液体积;C 1 =原来溶液乙醇浓度;C 2 = 所需达到乙醇浓度;C 3 =加入乙醇的浓度。 三、材料和试剂 3.1 血清:100 mL 3.2 相关试剂:95%乙醇,pH 4. 0醋酸盐缓冲液,磷酸盐缓冲液Ⅰ,磷酸盐缓 冲液Ⅱ,3 mol/L NaCl溶液,1 mol/L NaHCO 3 ,生理氯化钠溶液,麦芽糖, 3.3 实验仪器: 四、方法与步骤 基本思路:
蛋白提取实验步骤
蛋白提取实验步骤: 1、细胞总蛋白提取 A、对于悬浮细胞: 离心收集细胞,每106细胞加250 ul RIPA (在使用前数分钟内加入蛋白酶抑制剂),振荡。如果需要提高蛋白浓度,可以适当减少细胞总蛋白提取试剂体积。 B、对于贴壁细胞: a、用TBS冲洗细胞2-3次。最后一次彻底吸干残留液。 b、加入适当体积的 RIPA(使用前数分内加入蛋白酶抑制剂)于培养板、瓶内3-5分钟。期间反复晃动培养板、瓶,使试剂与细胞充分接触。 c、用细胞刮刀将细胞及试剂刮下,收集到1.5ml离心管中。 C、冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。 D、12000g离心5min,收集上清,即为总蛋白溶液。 2、组织蛋白提取: A、组织块用冷TBS洗涤2-3次,去除血污,剪成小块置于匀浆器。加入10倍组织体积本试剂(使用前数分钟内加入蛋白酶抑制剂)冰上彻底匀浆。如果需要提高蛋白浓度,可以适量减少该试剂体积。 B、将匀浆液转移至1.5ml离心管中,振荡。冰浴30min,期间用移液器反复吹打,确保细胞完全裂解。 C、12000g离心5min,收集上清,即为总蛋白溶液。 注意事项 1、组织尽可能新鲜,若不能及时提蛋白,组织标本应保存在-80℃冰箱,并避免反复冻融。 2、全程必须在冰上进行,避免蛋白降解。 3、蛋白酶抑制剂在水溶液中不稳定,需在RIPA使用前数分钟加入蛋白酶抑制剂。
4、裂解过程中如有溶液粘稠现象可用移液器(200μl)反复吹打,或再加入适量裂解液以保证充分裂解。 5、总蛋白溶液不稳定(蛋白酶依旧有活性)可在-80℃短时间保存,建议立即加入蛋白上样缓冲液变性后与-20℃保存,避免反复冻融。
