2021高考化学二轮电解质溶液中的图像分析
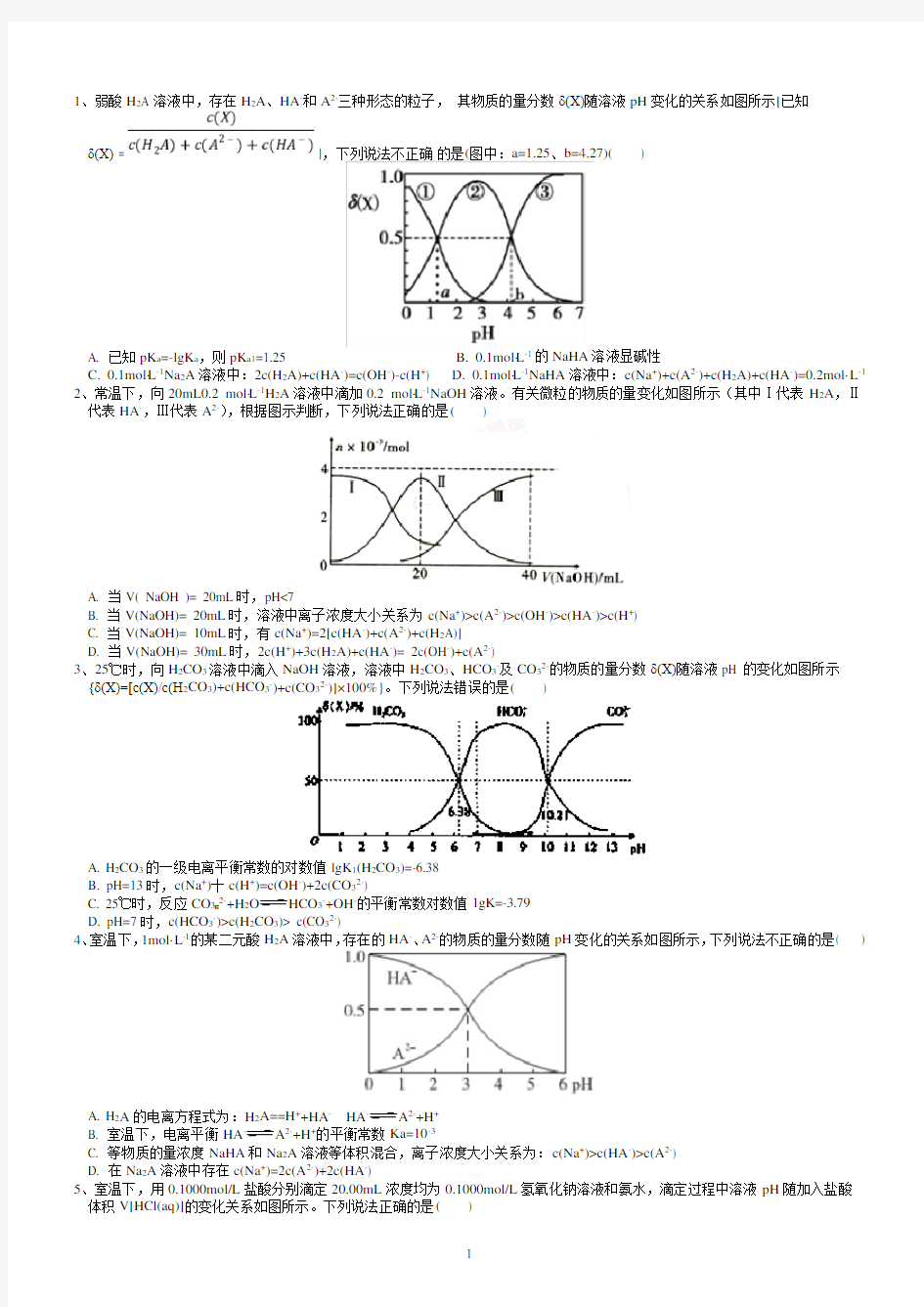
1、弱酸H2A 溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知
δ(X) = ],下列说法不正确的是(图中:a=1.25、b=4.27)()
A. 已知pK a=-lgK a,则pK a1=1.25
B. 0.1mol·L-1的NaHA溶液显碱性
C. 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)=c(OH-)-c(H+)
D. 0.1mol·L-1NaHA溶液中:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1
2、常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是()
A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
3、25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH 的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。下列说法错误的是()
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)
C. 25℃时,反应CO32-+H2O HCO3-+OH-的平衡常数对数值1gK=-3.79
D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
4、室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法不正确的是( )
A. H2A的电离方程式为:H2A==H++HA-HA-A2-+H+
B. 室温下,电离平衡HA-A2-+H+的平衡常数Ka=10-3
C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-)
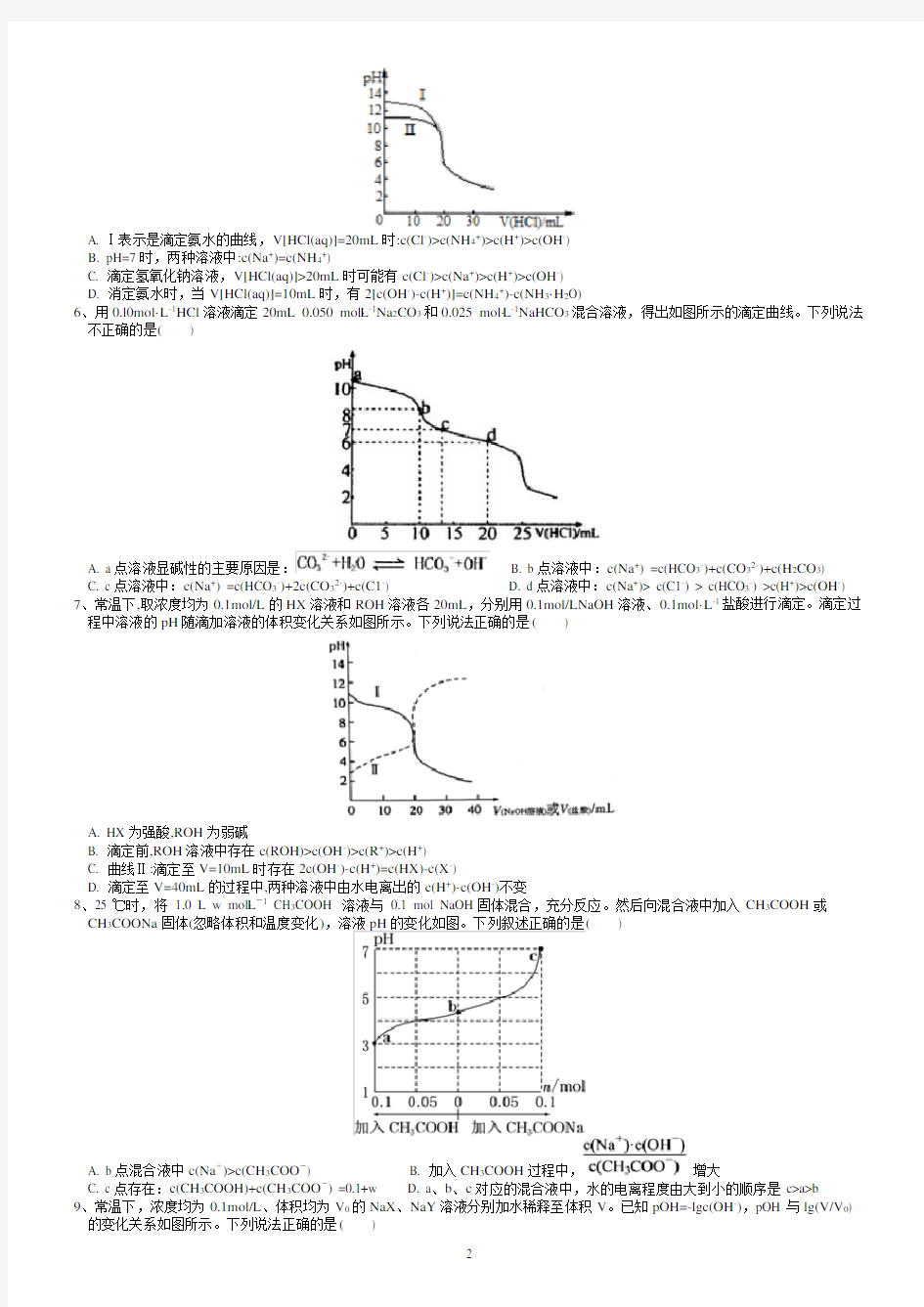
5、室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸
体积V[HCl(aq)]的变化关系如图所示。下列说法正确的是()
A. Ⅰ表示是滴定氨水的曲线,V[HCl(aq)]=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. pH=7时,两种溶液中:c(Na+)=c(NH4+)
C. 滴定氢氧化钠溶液,V[HCl(aq)]>20mL时可能有c(Cl-)>c(Na+)>c(H+)>c(OH-)
D. 消定氨水时,当V[HCl(aq)]=10mL时,有2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
6、用0.l0mol·L-1HCl溶液滴定20mL 0.050 mol·L-1Na2CO3和0.025 mol·L-1NaHCO3混合溶液,得出如图所示的滴定曲线。下列说法不正确的是()
A. a点溶液显碱性的主要原因是:
B. b点溶液中:c(Na+) =c(HCO3-)+c(CO32-)+c(H2CO3)
C. c点溶液中:c(Na+) =c(HCO3-)+2c(CO32-)+c(C1-)
D. d点溶液中:c(Na+)> c(C1-) > c(HCO3-) >c(H+)>c(OH-)
7、常温下,取浓度均为0.1mol/L的HX溶液和ROH溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol·L-1盐酸进行滴定。滴定过程中溶液的pH随滴加溶液的体积变化关系如图所示。下列说法正确的是()
A. HX为强酸,ROH为弱碱
B. 滴定前,ROH溶液中存在c(ROH)>c(OH-)>c(R+)>c(H+)
C. 曲线Ⅱ:滴定至V=10mL时存在2c(OH-)-c(H+)=c(HX)-c(X-)
D. 滴定至V=40mL的过程中,两种溶液中由水电离出的c(H+)·c(OH-)不变
8、25 ℃时,将1.0 L w mol·L-1 CH3COOH 溶液与0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或
CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是()
A. b点混合液中c(Na+)>c(CH3COO-)
B. 加入CH3COOH过程中,增大
C. c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D. a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
9、常温下,浓度均为0.1mol/L、体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与lg(V/V0) 的变化关系如图所示。下列说法正确的是()
A. K h(NaY)=10-6
B. HX、HY都是弱酸,且K a(HX) C. lg(V/V0)=3时,NaX溶液中所含离子总数大于NaY溶液 D. 向稀释前的两溶液中分别加盐酸至pH=7时,c(X-)=c(Y-) 10、常温下,向20 mL 0.10 mol/L甲胺的溶液中滴加0.10 mol/L盐酸时混合溶液的pH与相关微粒的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不正确的是() A. 甲胺在水中的电离方程式CH3NH2+H2O CH3NH3++OH— B. b点对应的加入盐酸的体积小于20mL C. 将等物质的量的CH3NH2和CH3NH3Cl一起溶于蒸馏水,得到对应a点的溶液 D. 常温下,甲胺的电离常数为K b,则pK b=—lgK b=3.4 11、常温下,用0.1mol/LNaOH 溶液分别滴定体积均为20.00 mL、浓度均为0.1mol/L的HX、HY溶液,pH 随NaOH 溶液体积变化如图。下列结论正确的是() A. 水解常数:X->Y- B. 10.00 mL时,有c(Na+)>c(HX)>c(X-)>c(H+) C. pH=7时,c(Y-)>c(X-) D. a、b两点溶液混合后,c(HX)+c(HY)+ c(H+)=c(OH-) 12、常温下,用0.1000mol/LNaOH溶液分别滴定浓度均为0.1000mol/L HX溶液和HY溶液各20.00mL,得到2条滴定曲线,如图所示。下列叙述正确的是() A. 由图可推知,HX是弱酸,而HY是强酸 B. 滴定HY时,可用甲基橙作指示剂,当溶液颜色由橙色变为黄色时,达到滴定终点 C. 滴定至B点时,溶液中:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-) D. 若A、C两点对应的pH分别为1、9,则两点处水电离出的c(H+)之比为104∶1 13、常温下,现有0.1 mol·L-1的NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH 的关系如下图所示。下列说法正确的是() A.当溶液的pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-) B.NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3) C.往该溶液中逐滴滴加氢氧化钠时,NH4+和HCO3-浓度均逐渐减小 D.通过分析可知常温下K b(NH3·H2O)大于K a1(H2CO3) 14、已知:pKa=-lgKa,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1NaOH 溶液滴定20 mL0.1 mol/LH2SO3溶液的滴定曲线如右图所示。下列说法不正确的是( ) A.a 点所得溶液中:c(HSO3-)=c(H2SO3) B.b 点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) C.c 点所得溶液中:c(Na+)=3c(HSO3-) D.d 点所得溶液中:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) 15、室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是() A. K b2的数量级为10-8 B. X(OH)NO3水溶液显碱性 C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c[X(OH)+] D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+) 16、(多选)H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是() A.pH=2.5的溶液中:c(H2C2O4)+c(C2O2-4)>c(HC2O-4) B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O2-4) C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O-4) D.pH=7的溶液中:c(Na+)>2c(C2O2-4) 17、常温下,K a1(H2C2O4)=10-1.3,K a2(H2C2O4)=10-4.2。用0.l000mol/L NaOH溶液滴定10.00 mL 0.l000mol/L H2C2O4溶液所得滴定曲线如图。下列说法正确的是() A.点①所示溶液中: B.点②所示溶液中: C.点③所示溶液中: D.点④所示溶液中: 18、常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100 mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是() (己知:CO32-+H2O HCO3-+OH- K=2×10-4,1g5=0.7) A. a点的溶液中:c(HCO3-)> c(H2CO3)+c(CO32-) B. b点横坐标数值大约为10.3 C. c点的溶液中:c(Na+)<2c(CO32-)十c(HCO3-) D. 溶液中水的电离程度:a 19、常温下,用0. 1000 mol·L-1的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是() A. 若c(Na2CO3)=0.1000 mol·L-1,则H2CO3的K a2数量级约为10-6 B. c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-) C. a、c两点水的c(OH-)之比为10-11.6 :10-7 D. 若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-) 20、常温下,向100mL 0. 1mol/LNH4Cl溶液中,逐滴滴加0. 1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是() A. M点溶液中水的电离程度比原溶液大 B. 在M点时,n(H+)-n( OH- )=(0.005-a)mol C. 随着NaOH溶液的滴加,不断增大 D. 当n(NaOH)= 0.01mol时,c(NH3·H2O)>c( Na+)>c(OH-) 21、设pC为溶液中粒子物质的量浓度的负对数,即: pC=-lgC。25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。下列说法正确的是() A. 曲线I表明,c(R2-)随着pH增大而逐渐增大 B. pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/L C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)=1000 D. NaHR水溶液中: c(Na+)>c(HR-)>c(OH-)>c(H+) 22、常温下,分别取未知浓度的MOH 和HA溶液,加水稀释至原体积的n倍。稀释过程中,两溶液pH的变化如图所示。下列叙述错误的是() A. MOH为强碱,HA 为弱酸 B. 水的电离程度:X=Y>Z C. 若升高温度,Y、Z 点对应溶液的pH值均减小 D. 将X 点溶液与Z点溶液等体积混合,所得溶液中c(A-)>c(M+)>c(H+)>c(OH-) 23、T ℃,分别向10 mL浓度均为1 mol·L-1的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lgc)的关系如图所示。已知:pK a=-lgK a,下列叙述正确的是() A. 弱酸的K a随溶液浓度的降低而增大 B. a点对应的溶液中c(HA)=0.1 mol·L-1,pH=4 C. 弱酸HB的pK a≈5 D. 酸性:HA 24、常温下将NaOH 溶液分别滴加到两种一元弱酸HA 和HB 中,两种混合溶液的pH 与离子浓度变化的关系如图所示。下列叙述错误的是() A. 电离常数:Ka(HB)>Ka(HA) B. Ka(HA)的数量级为10-5 C. 当HA 与NaOH 溶液混合至中性时:c(A-)=c(HA) D. 等浓度等体积的HA 和NaB混合后所得溶液中:c(H+)>c(OH-) 2020届高三化学高考专题复习 ——电解质溶液中的图像分析答案 1、B ,电离大于水解,所以0.1mol·L-1的NaHA溶液显酸性,故B错误;根据质子守恒, 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)+c(H+)=c(OH-),故C正确;根据物料守恒, c(Na+)=c(A2-)+c(H2A)+c(HA-)=0.1mol·L-1,所以c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1,故D正确。 2、D【解析】A. 当V( NaOH )= 20mL时,H2A恰好与NaOH反应生成HA-,由图可知,此时溶液中n(H2A)>n(A2-),说明HA-的水解程度大于其电离程度,故溶液显碱性,pH>7,A不正确;B. 当V(NaOH)= 20mL时,结合图中信息可知,溶液中离子浓度大小关系为c(Na+)> c(HA-)> c(OH-)> c(H+)>c(A2-),B不正确;C. 当V(NaOH)= 10mL时,由物料守恒可知,2c(Na+)= c(HA-)+c(A2-)+c(H2A),C不正确;D. 当V(NaOH)= 30mL时,由电荷守恒c(H+)+c(Na+)= c(HA-)+2c(A2-)+ c(OH-)和物料守恒2c(Na+)= 3[c(HA-)+c(A2-)+c(H2A)],可以求得质子守恒式:2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-),D正确。本题选D。 3、B 4、C HA-A2-+H+的平衡常数Ka=10-3,A2-水解平衡常数是 -14 -11 -3 10 =10 10 ,HA-电离大于A2-水解,所以c(HA-) 根据物料守恒,在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-),故D正确。 5、B 之比为1:1,则根据溶液中离子电荷守恒得c(NH4+)+c(H+)=c(Cl -)+c(OH-),Cl元素与N元素原子数之比为1:2,既2c(Cl -)=c(NH4+)+c(NH3?H2O),约去Cl-得2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O),D 正确。正确答案B。 6、B >c(HCO3-),又因为d点pH<7,所以c(H+)>c(OH-),故D正确。故选B。 7、B 中由水电离出的c(H+)·c(OH-)先增大后减小,故D错误。 8、C【解析】A. 根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),b点混合液中pH<7,则c(H+)>c(OH-),故c(Na+) -),选项A错误;B.加入CH3COOH过程中,c(CH3COO-)和c(H+)增大,c(OH-)减小,c(Na+)不变,减小,选项B错误;C. 根据物料守恒c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w,选项C正确;D.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,选项D错误。答案选C。 9、C NaX水解能力小于NaY的水解能力,所以c(OH-):NaX小于NaY,所以c(H+):NaX大于NaY,所以NaX溶液中所含离子总数大于NaY溶液,C正确;向稀释前的两溶液中分别加盐酸至pH=7时,溶液中电荷守恒:c(Na+)+c(H+)=c(OH-)+c(X-)+ c(Cl-);c(Na+)+c(H+)=c(OH-)+ c(Y-)+ c(Cl-);由于c(H+)=c(OH-),所以c(Na+)= c(X-)+ c(Cl-),c(Y-)+ c(Cl-)=c(Na+),由于NaX溶液中pOH 较大,加入盐酸的量就少,c(Cl-)较少,所以c(X-)> c(Y-),D错误;正确选项C。 10、C 电离,则所得溶液中c(CH3NH2)≠c(CH3NH3+),即lg≠0,所以对应的不是a点的溶液,故C错误;D. 由甲胺的电离方程式CH3NH2+H2O CH3NH3++OH-可知,甲胺的电离常数为K b=,a点溶液的pH=10.6,c(OH-)=10-3.4,lg=0,则pK b=-lgK b=-lg=-lgc(OH-)-lg=-lgc(OH-)=3.4,故D正确;答案选C。 11、D【解析】A.对于HX和HY,酸性越弱,电离出的H+的数量越少,初始时刻根据图象,pH越小的酸酸性越强,酸性越弱,盐的水解程度增大,水解常数越大,故水解常数:X- 12、C 13、D 14、C C、c点加入的氢氧化钠溶液大于20mL小于40mL,所以生成的溶质为Na2SO3和NaHSO3,根据c点溶液中H2SO3的第二步平衡常 数,由pK a2=7.19可得K a2=10-7.19,又根据K a2=c(SO32-)×c(H+)/c(HSO3-),c(H+)=10-7.19,所以c(SO32-)=c(HSO3-),又根据电荷守恒有c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),所以有c(Na+)=c(OH-)+3c(HSO3-)-c(H+),又因为c点呈碱性,c(OH-)>c(H+),所以c(Na+)>3c(HSO3-),故C错误;D、d点恰好完全反应生成Na2SO3溶液,SO32-水解得到HSO3-,但是水解程度小,故有c(Na+)>c(SO32-)>c(OH -)>c(HSO3-)>c(H+),故D正确。 15、C【解析】分析:本题是一道图形比较熟悉的题目,不过题目将一般使用的二元酸变为了二元碱,所以在分析图示时要随时注意考查的是多元碱的分步电离。详解:A.选取图中左侧的交点数据,此时,pH=6.2,c[X(OH)+]=c(X2+),所以K b2=,选项A正确。B.X(OH)NO3水溶液中X的主要 存在形式为X(OH)+,由图示X(OH)+占主导位置时,pH为7到8之间,溶液显碱性,选项B正确。C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)和c[X(OH)+]近似相等,根据图示此时溶液的pH约为6,所以溶液显酸性X2+的水解占主导,所以此时c(X2+)<c[X(OH)+],选项C错误。D.在X(OH)NO3水溶液中,有电荷守恒:c(NO3-)+c(OH-)=2c(X2+)+c(H+)+c[X(OH)]+,物料守恒:c(NO3-)=c(X2+)+c[X(OH)2]+c[X(OH)]+,将物料守恒带入电荷守恒,将硝酸根离子的浓度消去,得到该溶液的质子守恒式为:c[X(OH)2]+c(OH-)=c(X2+)+c(H+)。 16、BD【2016江苏卷】 17、B 18、C【解析】分析:本题考查电解质溶液中水的电离、盐的水解等知识点。 详解:A. a点的溶液中主要是碳酸氢钠溶液,碳酸氢根离子水解程度大于碳酸氢根离子的电离程度, 结合c(CO32-)+c(HCO3-)+ c(H2CO3)=0.100 mol·L-1,c(HCO3-)>0.05 mol·L-1,溶液中离子浓度大小c(HCO3-)>c(H2CO3)+c(CO32-),所以A选项是正确的; B.b点 c(CO32-)=c(HCO3-)=0.05mol/L, 因为CO32-+H2O HCO3-+OH- ,K==c(OH-)=2×10-4,c(H+)=5 10-11,pH=-lg(510-11),所以B选项是正确的; C.c点溶液中,c(OH-)>c(H+),溶液中存在电荷守恒, c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+), c(Na+)>2c(CO32-)+c(HCO3-)故C错误;D.a、b、c三点溶液中所含Na2CO3依次增多,所含NaHCO3依次减少,越弱越水解,对水的电离促进越大,即溶液中水的电离程度:a 19、D 20、B 21、C【解析】分析:H2R H++HR-, HR-H++R2-,随pH增大电离平衡正向移动,c(H2R),开始较大,后逐渐减小,c(HR-)先增大后减小,c(R2-)开始较小,后逐渐增大,pC为溶液中粒子物质的量浓度的负对数,C越大pC越小,由图像可知:曲线I是pC(HR-)随溶液pH的变化曲线,曲线II是pC(H2R)随溶液pH的变化曲线,曲线III是pC(R2-)随溶液pH的变化曲线; 详解:A. 从以上分析可知,曲线III表明,c(R2-)随着pH增大而逐渐增大,故A错误;B. pH=1.3时,c(HR-)= c(H2R),根据电荷守恒c(HR-)+2c(R2-)+c(OH-)=c(H+)=10-1.3mol/L 由于c(HR-)> c(R2-),所以3c(R2-)+c(OH-)<10-1.3mol/L,故B错误;C. 常温下,该体系中c2(HR-)/ c(R2-)·c(H2R)= ====1000,故C正确;D. pH=1.3时,c(HR-)= c(H2R),Ka1==c(H+)=10-1.3,pH=4.3时,c(HR-)= c(R2-),Ka2==c(H+)=10-4.3,NaHR的水解常数Kh===10-12.7,因此,NaHR水解小于电离,溶液显酸性,c(OH-) 22、B【解析】A.lgn变化量与pH变化量相等时为强酸、强碱,故A正确;B.三个点均是抑制水的电离,酸中氢离子浓度越大、碱中氢氧根浓度越大,水的电离程度越弱,故X=Z>Y,故B错误;C.若升高温度,氢氧根离子浓度不变,K w增大,所以氢离子浓度增大,对应溶液的pH值降低,故C正确;由于MOH为强碱、HA为弱酸,X点溶液的氢离子浓度与Z点溶液的氢氧根离子的浓度相等,等体积混合后,溶液显酸性,所得溶液中c(A-) > c(M+) > c(H+) > c(OH-),故D正确。 23、C 24、C 电解质溶液图像专题 电解质溶液的图像题,从知识载体的角度看:一可用于考查溶液中离子浓度的大小比较;二可考查溶液中离子浓度的守恒问题;三可考查有关电解质溶液的各种计算;四可结合生产和生活实际考查分离和提纯等具体的化学应用问题。 常见的图像题类型: 1.pH(或pOH)—体积的变化曲线 2.微粒分布分数(或系数)—pH(或pOH)的变化曲线 3.浓度—浓度的变化曲线 4.对数的变化曲线 5.导电能力(或电导率) —体积(或浓度)变化曲线 【练1】分布分数图:可以表示溶液中各种组分随pH的变化而变化的曲线。 1.25℃,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合 溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关离 子浓度关系叙述正确的是() A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1 D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略): c(Na+)+c(H+)=c(CH3COOH)+c(OH-) +c(Cl-) 2.草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态 有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH 变化的关系如图所示: (1)图中曲线1表示的分布系数变化;曲线3表示 的分布系数变化. 现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4 ③H2C2O4 ④(NH4)2C2O4 ⑤NH4HC2O4 已知NaHC2O4溶液显酸性. (2)Na2C2O4溶液中,c(Na+)/c(C2O42-) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示). (3)常温下,向10mL 0.1mol/L H2C2O4溶液中滴加0.1mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,溶液显性(填“酸”、“碱”或“中”),且V(NaOH) 10mL (填“>”、“=”或“<”). (4)下列关于五种溶液的说法中,正确的是 A.溶液②中,c(C2O42-)<c(H2C2O4) 电解质溶液的图像题集 ————————————————————————————————作者:————————————————————————————————日期: 电解质溶液图像表格题集 一、选择题 1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是() A.升高温度,可能引起由c向b的变化 B.该温度下,水的离子积常数为1.0×10-13 C.该温度下,加入FeCl3可能引起由b向a的变化 D.该温度下,稀释溶液可能引起由c向d的变化 2.如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是() A.盐酸的物质的量浓度为1 mol·L-1 B.P点时反应恰好完全,溶液呈中性 C.曲线a是盐酸滴定氢氧化钠的滴定曲线 D.酚酞不能用作本实验的指示剂 3.常温下,向20 mL某盐酸溶液中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是() A.盐酸的物质的量浓度为1 mol·L-1 B.在①、②之间的任意一点:c(Cl-)>c(NH+4),c(H+)>c(OH-) C.在点②所示溶液中:c(NH+4)=c(Cl-)>c(OH-)=c(H+),且V<20 D.在点③所示溶液中:由水电离出的c(OH-)>10-7 mol·L-1 4.室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是() A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA) 5.水的电离平衡曲线如图所示,下列说法正确的是() A.图中五点的K w的关系:b>c>a>d>e B.若从a点到d点,可采用:温度不变在水中加入少量的酸 C.若从a点到c点,可采用:温度不变在水中加入适量的 CH3COONa固体 D.处在b点时,将0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合后,溶液显酸性 有关电解质溶液图像题的解题技巧 分析解答此类图像问题要注意几点: ①读图,弄清图像含义,通过观察弄清横坐标、纵坐标的含义及单位;搞清特殊点的意义,如坐标轴的原点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率的大小及升降。 ②识图,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。 ③用图,联想化学原理解答问题。 图像问题分析— ? ? ? ?定 ? ? ? ?―→关键点 ―→曲线 变 ? ? ? ?――→ 原因分析 曲线走势 ――→ 计算推理 浓度等关系 纵观历年高考试题,电解质溶液图像题越来越受到命题者的青睐。 题型一强、弱电解质加水稀释的变化曲线【解题策略】 强、弱电 解质加 水稀释 — ? ? ? ? ? ?――→本质弱电解质在水溶液中电离程度不同 ――→ 图像 pH变化幅度大小 延伸 ? ? ? ?―→弱电解质盐溶液酸碱性变化 ―→判断弱电解质强弱的方法 ―→ 弱酸溶液中加入强碱、强酸或水后 的pH变化 1 室温下,将10.00 mL 5.000 0 mol·L-1醋酸滴入100.00 mL 蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示。 下列有关说法正确的是() A.a~b段,醋酸电离过程为放热过程 B.c~d段,c(H+)增加,醋酸电离度增加 C.c点时,加入等体积等浓度的NaOH溶液则:c(Na+)= c(CH3COO-)+c(CH3COOH) D.d点时,c(H+)>c(CH3COOH) 式题在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,图中比较符合反应事实的曲线是() 题型二中和滴定曲线【解题策略】 1.思路分析 专题一电解质溶液知识的图像问题电解质溶液知识的综合应用是高考必考的热点之一,近几年来,以图像问题分析考查电解质溶液的题目频频出现。考查知识主要涉及:电离平衡和水解平衡、酸碱混合液pH的变化,溶液中微粒浓度的大小比较、溶液的导电性变化、水的离子积、水的电离程度变化等。侧重考查考生数形结合、提炼关键信息等综合分析能力、数据处理与计算能力、知识的迁移应用能力。顺利解答该类试题要注重以下两点: 1.“有序思维”破解弱(强)酸与强(弱)碱混合的若干问题 向弱酸(或强酸)溶液中逐滴滴入强碱(或弱碱)溶液,离子浓度、pH有一定的变化规律。现以向CH3COOH溶液中逐滴加入NaOH溶液为例进行分析,以能够对该类试题有一个整体把握。 上图一目了然,可以很清楚地得出不同情况下溶液中的pH、离子浓度的关系。2.掌握电解质溶液中微粒浓度大小判断的方法思路 【解题技巧】 抓“四点”巧析酸碱混合或滴定图像题 (1)抓反应“一半”点,判断是什么溶质的等量混合。 (2)抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。 (3)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。 (4)抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。 【例题1】、25 ℃时,将0.1 mol·L-1 NaOH溶液加入20 mL 0.1 mol·L-1 CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH的关系曲线如图所示。下列结论正确的是() A.①点时,c(CH3COO-)+c(CH3COOH)=c(Na+) B.对曲线上①、②、③任何一点,溶液中都有:c(Na+)+c(H+)=c(OH-) +c(CH3COO-) C.③点时,醋酸恰好反应完,溶液中有:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) D.滴定过程中可能出现:c(H+)>c(Na+)>c(CH3COO–)>c(OH–) 专题一电解质溶液知识的图像问题 电解质溶液知识的综合应用是高考必考的热点之一,近几年来,以图像问题分析考查电解质溶液的题目频频出现。考查知识主要涉及:电离平衡和水解平衡、酸碱混合液pH的变化,溶液中微粒浓度的大小比较、溶液的导电性变化、水的离子积、水的电离程度变化等。侧重考查考生数形结合、提炼关键信息等综合分析能力、数据处理与计算能力、知识的迁移应用能力。顺利解答该类试题要注重以下两点: 1.“有序思维”破解弱(强)酸与强(弱)碱混合的若干问题 向弱酸(或强酸)溶液中逐滴滴入强碱(或弱碱)溶液,离子浓度、pH有一定的变化规律。现以向CH3COOH溶液中逐滴加入NaOH溶液为例进行分析,以能够对该类试题有一个整体把握。 上图一目了然,可以很清楚地得出不同情况下溶液中的pH、离子浓度的关系。 2.掌握电解质溶液中微粒浓度大小判断的方法思路 【解题技巧】 抓“四点”巧析酸碱混合或滴定图像题 (1)抓反应“一半”点,判断是什么溶质的等量混合。 (2)抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。 (3)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。 (4)抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。 【例题1】、25 ℃时,将 mol·L-1?NaOH溶液加入20 mL mol·L-1?CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH的关系曲线如图所示。下列结论正确的是() A.①点时,c(CH3COO-)+c(CH3COOH)=c(Na+) B.对曲线上①、②、③任何一点,溶液中都有 :c (Na +)+c (H +)=c (OH -) +c (CH 3COO - ) C.③点时,醋酸恰好反应完,溶液中有:c (CH 3COO -)=c (Na + )>c (H + )=c (OH - ) D.滴定过程中可能出现:c (H + )>c (Na + )>c (CH 3COO – )>c (OH – ) 【例题2】.(2017新课标1)常温下将NaOH 溶液添加到己二酸(H 2X )溶液中,混合溶 液的pH 与离子浓度变化的关系如图所示。下列叙述错误的是( ) A .K a2(H 2X )的数量级为10-6 B .曲线N 表示pH 与2(HX ) lg (H X) c c 的变化关系 C .NaHX 溶液中c(H +)>c(OH - ) D .当混合溶液呈中性时,c(Na + )>c(HX -)>c(X 2-)>c(H +)=c(OH -) 【例题3】.(2016新课标1)298 K 时,在 mL mol ·L -1 氨水中滴入 mol ·L -1 的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。已知 mol ·L -1氨水的电离度为%,下列有关叙述正确的是( ) A .该滴定过程应该选择酚酞作为指示剂 B .M 点对应的盐酸体积为 mL 专题一电解质溶液知识得图像问题 电解质溶液知识得综合应用就是高考必考得热点之一,近几年来,以图像问题分析考查电解质溶液得题目频频出现。考查知识主要涉及:电离平衡与水解平衡、酸碱混合液pH得变化,溶液中微粒浓度得大小比较、溶液得导电性变化、水得离子积、水得电离程度变化等。侧重考查考生数形结合、提炼关键信息等综合分析能力、数据处理与计算能力、知识得迁移应用能力。顺利解答该类试题要注重以下两点: 1.“有序思维”破解弱(强)酸与强(弱)碱混合得若干问题 向弱酸(或强酸)溶液中逐滴滴入强碱(或弱碱)溶液,离子浓度、pH有一定得变化规律。现以向CH3COOH溶液中逐滴加入NaOH溶液为例进行分析,以能够对该类试题有一个整体把握。 上图一目了然,可以很清楚地得出不同情况下溶液中得pH、离子浓度得关系。 2.掌握电解质溶液中微粒浓度大小判断得方法思路 【解题技巧】 抓“四点”巧析酸碱混合或滴定图像题 (1)抓反应“一半”点,判断就是什么溶质得等量混合。 (2)抓“恰好”反应点,生成什么溶质,溶液呈什么性,就是什么因素造成得。 (3)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。 (4)抓反应“过量”点,溶质就是什么,判断谁多、谁少还就是等量。 【例题1】、25 ℃时,将0、1 mol·L-1NaOH溶液加入20 mL 0、1 mol·L-1CH3COOH溶液中,所加入溶液得体积(V)与混合液得pH得关系曲线如图所示。下列结论正确得就是( ) A、①点时,c(CH3COO-)+c(CH3COOH)=c(Na+) B、对曲线上①、②、③任何一点,溶液中都有:c(Na+)+c(H+)=c(OH-) +c(CH3COO-) C、③点时,醋酸恰好反应完,溶液中有:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) D、滴定过程中可能出现:c(H+)>c(Na+)>c(CH3COO–)>c(OH–) 电解质溶液——滴定曲线图像分析 一、酸碱滴定 2.(2015·山东理综,13)室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是() A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA) 答案 D 解析A项,a点NaOH与HA恰好完全反应,溶液的pH为8.7,呈碱性,说明HA为弱酸,NaA发生了水解反应,则溶液中:c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),错误;B项,a点NaA发生了水解反应,促进了水的电离,b点主要由于HA的电离而使溶液呈酸性,抑制了水的电离,所以a点水的电离程度大于b点水的电离程度,错误;C项,根据电荷守恒:c(Na +)+c(H+)=c(A-)+c(OH-),pH=7,则c(H+)=c(OH-),可得c(Na+)=c(A-),错误;D项,b点溶液中溶质为等物质的量NaA和HA,溶液呈酸性,说明HA的电离程度大于NaA的水解程度,所以c(A-)>c(HA),正确。 常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得滴定曲线如右图。下列说法正确的是() A.点①所示溶液中: c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) B.点②所示溶液中: c(Na+)=c(CH3COOH)+c(CH3COO-) C.点③所示溶液中: c(Na+)>c(OH-)>c(CH3COO-)>c(H+) D.滴定过程中可能出现: c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) 解析点①溶液中的溶质为0.001molCH3COOH和0.001molCH3COONa,据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH -),整理后得c(CH COOH)+2c(H+)=c(CH3COO-)+2c(OH-);点②溶液的pH=7,据电荷 3 守恒有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),又c(H+)=c(OH-),则c(Na+)=c(CH3COO -);点③溶液中的溶质为0.002molCH COONa,离子浓度大小关系为c(Na+)>c(CH3COO-) 3 >c(OH-)>c(H+)。 答案 D 6.(2017届湖南益阳一调,13)常温下,用0.100 0 mol/LNaOH溶液分别滴定20.00 mL 0.100 0 mol/L 盐酸和20.00 mL 0.100 0 mol/L 醋酸溶液,得到2条滴定曲线,如图所示。若用HA 表示酸,下列说法正确的是() A.滴定盐酸的曲线是图2 B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-) C.达到B、E状态时,反应消耗n(CH3COOH)>n(HCl) D.当V(NaOH溶液)=20.00 mL 时,两混合溶液中各离子浓度由大到小的顺序均为c(Na +)>c(A-)>c(OH-)>c(H+) 【答案】B 【解析】A项,常温下0.100 0 mol/L 盐酸的pH=1,显然图1是滴定盐酸的曲线,图2是滴定醋酸的曲线,错误。B项,图中B、D两点溶液的pH均为7,则有c(H+)=c(OH-),结合电荷守恒推知,溶液中c(Na+)=c(A-),正确。C项,B、E两点时消耗NaOH溶液的体积均为a mL,据CH3COOH~NaOH及HCl~NaOH可知,反应消耗n(CH3COOH)=n(HCl),错误。D项,当V(NaOH溶液)=20.00 mL 时,两混合液中酸、碱均恰好完全反应,滴定盐酸后所得溶液的溶质为NaCl,溶液呈中性,则有c(Na+)=c(A-)>c(OH-)=c(H+);滴定醋酸后所得溶液的溶质为CH3COONa,由于CH3COO-发生水解而显碱性,则有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),错误。 电解质溶液图像 【易错分析】 电解质溶液属于高中化学重要的基本概念和基本理论,因而是每年高考的必考内容。电解质溶液是高考必考知识,主要涉及强弱电解质、电离平衡、水的离子积、溶液的酸碱性或pH、盐类水解及其应用、酸碱中和滴定、微粒浓度大小比较、三大原理(物料守恒、电荷守恒、质子守恒)等内容。解答有关试题时,要分门别类地考虑电离、水解、过量等内外因素,充分利用化学平衡移动原理、几大常数之间的计算关系、电荷守恒关系式、物料守恒关系式、质子守恒关系式进行分析和解答。 【错题纠正】 例题1、以酚酞为指示剂,用0.1000 mol·L?1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数随滴加NaOH溶液体积V NaOH的变化关系如图所示。[比如A2?的分布系数:] 下列叙述正确的是 A.曲线①代表,曲线②代表 B.H2A溶液的浓度为0.2000 mol·L?1 C.HA?的电离常数K a=1.0×10?2 D.滴定终点时,溶液中 【解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入 40mLNaOH 溶液时,溶液的pH 在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH 时,pH 约为1,说明H 2A 第一步完全电离,第二步部分电离,曲线①代表δ(HA -),曲线②代表δ(A 2-),根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)= =0.1000mol/L ,据此分析作答。 A .根据分析,曲线①代表δ(HA -),曲线②代表δ(A 2-),A 错误; B .当加入40.00mLNaOH 溶液时,溶液的pH 发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)= =0.1000mol/L ,B 错误; C .根据曲线当δ(HA -)=δ(A 2-)时溶液的pH=2,则HA -的电离平衡常数 K a ==c (H +)=1×10-2,C 正确; D .用酚酞作指示剂,酚酞变色的pH 范围为8.2~10,终点时溶液呈碱性,c (OH -)>c (H +), 溶液中的电荷守恒为c (Na +)+c (H +)=2c (A 2-)+c (HA -)+c (OH -),则c (Na +)>2c (A 2-)+c (HA - ),D 错误; 答案选C 。 例题2、常温下,下列有关电解质溶液的说法错误的是 A .相同浓度的 HCOONa 和NaF 两溶液,前者的pH 较大,则 a a K (HCOOH)>K (HF) B .相同浓度的CH 3COOH 和CH 3COONa 两溶液等体积混合后pH 约为4.7,则溶液中()()()()-++-3c CH COO >c Na >c H >c OH C .FeS 溶于稀硫酸,而CuS 不溶于稀硫酸,则sp sp K (FeS)>K (CuS) D .在-121mol L Na S 溶液中,()()()2-- -12c S +c HS +c H S =1mol L 【解析】A .HCOONa 和NaF 的浓度相同,HCOONa 溶液的pH 较大,说明HCOO -的水解程度较 大,根据越弱越水解,因此甲酸的电离平衡常数较小,即K a (HCOOH)<K a (HF),故A 错误; B .相同浓度的CH 3COOH 和CH 3COONa 两溶液等体积混合后pH 约为4.7,此时溶液呈酸性,氢离子浓度大于氢氧根浓度,说明溶液中醋酸电离程度大于水解程度,则醋酸根浓度大于钠离子浓度,则溶液中c (CH 3COO -)>c (Na +)>c (H +)>c (OH -),故B 正确; C .CuS 的溶解度较小,将CuS 投入到稀硫酸溶液中,CuS 溶解平衡电离出的S 2?不足以与H + 电解质溶液图像表格题集 一、选择题 1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是() A.升高温度,可能引起由c向b的变化 B.该温度下,水的离子积常数为1.0×10-13 C.该温度下,加入FeCl3可能引起由b向a的变化 D.该温度下,稀释溶液可能引起由c向d的变化 2.如图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是() A.盐酸的物质的量浓度为1 mol·L-1 B.P点时反应恰好完全,溶液呈中性 C.曲线a是盐酸滴定氢氧化钠的滴定曲线 D.酚酞不能用作本实验的指示剂 3.常温下,向20 mL某盐酸溶液中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下 列叙述正确的是() A.盐酸的物质的量浓度为1 mol·L-1 B.在①、②之间的任意一点:c(Cl-)>c(NH+4),c(H+)>c(OH-) C.在点②所示溶液中:c(NH+4)=c(Cl-)>c(OH-)=c(H+),且V<20 D.在点③所示溶液中:由水电离出的c(OH-)>10-7 mol·L-1 4.室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法 正确的是() A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA) 5.水的电离平衡曲线如图所示,下列说法正确的是() A.图中五点的K w的关系:b>c>a>d>e B.若从a点到d点,可采用:温度不变在水中加入少量的酸 C.若从a点到c点,可采用:温度不变在水中加入适量的 CH3COONa固体 D.处在b点时,将0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合后,溶液显酸性 6.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是() A.三种酸的电离常数关系:K HA>K HB>K HD B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) 1、弱酸H2A 溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知 δ(X) = ],下列说法不正确的是(图中:a=1.25、b=4.27)() A. 已知pK a=-lgK a,则pK a1=1.25 B. 0.1mol·L-1的NaHA溶液显碱性 C. 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)=c(OH-)-c(H+) D. 0.1mol·L-1NaHA溶液中:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1 2、常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是() A. 当V( NaOH )= 20mL时,pH<7 B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)] D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-) 3、25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH 的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。下列说法错误的是() A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38 B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-) C. 25℃时,反应CO32-+H2O HCO3-+OH-的平衡常数对数值1gK=-3.79 D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-) 4、室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法不正确的是( ) A. H2A的电离方程式为:H2A==H++HA-HA-A2-+H+ B. 室温下,电离平衡HA-A2-+H+的平衡常数Ka=10-3 C. 等物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-) D. 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) 5、室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸 体积V[HCl(aq)]的变化关系如图所示。下列说法正确的是() 离子浓度的图像题专题 题型一:溶液离子浓度及导电能力的变化 1、(08年广东·18)电导率就是衡量电解质溶液导电能力大小的物 理量,根据溶液电导率变化可以确定滴定反应的终应。右图就 是KOH溶液分别滴定HCl溶液与CH3COOH溶液的滴定曲线示意 图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl与 CH3COOH混合溶液的滴定曲线的就是( ) 2、(09河北正定中学高三第四次月考)往含0、2 molNaOH与0、1 molBa(OH)2的溶液中持 续稳定地通入CO2气体,当通入气体的体积为6、72L(标况下)时立即停止,则在这一过程中,溶液中离子总的物质的量与通入CO2气体的体积关系正确的图象就是(气体的溶解忽略不计) ( ) 3、一定温度下,将一定量的冰醋酸加水稀释.溶液的导电能力变化如图23—1所示,下列说法中,正确的就是 ( ) A.a、b、c三点溶液的pH:c 4、在25 mL 0、1 mol/L NaOH溶液中逐滴加入0、2 mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的( ) A.在A、B间任一点,溶液中一定都有 c(Na+) > c(CH3COO-) > c(OH-) > c(H+) B.在B点,a > 12、5,且有 c(Na+) = c(CH3COO-) = c(OH-) = c(H+) C.在C点:c(CH3COO-) > c(Na+) > c(OH-) > c(H+) D.在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+) 题型二:溶液稀释过程中离子浓度的变化 5、(09山东)15、某温度下,相同pH值的盐酸与醋酸溶液分别加 水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图 判断正确的就是( ) A、ll为盐酸稀释时pH值变化曲线 B、b点溶液的导电性比c点溶液的导电性强 C、a点K w的数值比c点K w的数值大 D、b点酸的总浓度大于a点酸的总浓度 6、pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH与 溶液体积(V)的关系如图所示,下列说法正确的就是( ) A.稀释后x溶液中水的电离程度比y溶液中水电离 程度小 B.若x、y就是一元碱,等物质的量浓度的盐酸盐溶液 y的pH大 C.若x、y都就是弱碱,则a的值一定大于9 D.完全中与x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) 7、pH=2的A、B两种酸溶液各1 ml,分别加水稀释到1000 ml,其中pH与溶液体积V的关系如图所示,下列说法正确的就是 ( ) ①.A、B两酸溶液的物质的量浓度一定相等②.稀释后,A酸溶液的酸性比B酸溶液强 ③.a=5时,A就是强酸,B就是弱酸④.若A、B都就是弱酸,则5>a>2 A、②④ B、③④ C、①③ D、④ 8、MOH与ROH两种一元碱的溶液分别加水稀释时,pH 变化如下图所示。下列叙述中不正确 ...的就是: ( ) ★电解质溶液图像补充 一.电导率变化图象-四类中和滴定的电导率曲线规律 1.影响电导率因素________________________ 2.中和滴定中电导率变化规律:拐点即为反应终点即中和点 【典例1】用0.1mol?L-1NaOH溶液滴定10mL0·1mol?L-1盐酸过程中的电导率曲线. 下列说法错误的是() A. 电导率传感器能用于判断酸碱中和滴定的终点 B. 该过程中,a点所示溶液的导电性最强 C. C点电导率最小是因为此时溶液中导电微粒的数目最少 D. D点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) 【典例2】(2008年广东)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变 化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲 线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴 定曲线的是( ) 练习1.电导率是衡量电解质溶液导电能力大小的物理量。室温下,用0.100mol?L-1的 NH3?H2O 滴定10.00mL浓度均为0.100mol?L-1的HCl和CH3COOH的混合溶液, 所得曲线如图所示。下列说法正确的是() A.①点溶液中:c(H+)=0.200 mol?L-1 B.溶液温度:①>③>② C.③点溶液中:c(Cl-)>c(CH3COO-) D.③点后因离子数目减少使溶液的电导率略降 练习2. (2017西安模拟)电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.在一定温度下,用0.1 mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示.下列有关判断正确的是 a n n =-- ) (ClO )(C1O 3 电解质溶液中图像问题 题型一:溶液离子浓度及导电能力的变化 1.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终应。下图是KOH 溶液分别滴定HCl 溶液和CH 3COOH 溶液的滴定曲线示意图。下列示意图中,能正确表示用NH 3·H 2O 溶液滴定HCl 和CH 3COOH 混合溶液的滴定曲线的是( ) 2.往含0.2 molNaOH 和0.1 molBa(OH)2的溶液中持续稳定地通入CO 2气体,当通入气体的体积为6.72L (标况 下)时立即停止,则在这一过程中,溶液中离子总的物质的量和通入CO 2气体的体积关系正确的图象是(气体的溶解忽略不计)( ) 题型二:溶液稀释过程中离子浓度的变化 3.pH=2的A 、B 两种酸溶液各1 ml ,分别加水稀释到1000 ml ,其中pH 与溶液体积V 的关系如图所示,下列说法正确的是 ( ) ①.A 、B 两酸溶液的物质的量浓度一定相等②.稀释后,A 酸溶液的酸性比B 酸溶液强 ③.a=5时,A 是强酸,B 是弱酸 ④.若A 、B 都是弱酸,则5>a>2 A. ②④ B. ③④ C. ①③ D. ④ 4.将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误..的是( ) 题型三:溶液PH 值或离子浓度的计算 5.在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl -、C1O -、C1O 3-三种含氯元素的离子,其中C1O -、C1O 3- 两种离子的物质的量(n )与反应时间(t )的曲线如上图所示。 ⑴t 1时,Ca(OH)2与Cl 2发生反应的总的化学方程式为 。 t 2时,Ca(OH)2与Cl 2发生反应的总的化学方程式为 。 ⑵该石灰乳中含有Ca(OH)2的物质的量是 mol 。 ⑶ 据分析,生成Ca(C1O 3)2的反应是由温度升高引起的,通入氯气的速度不同,C1O -和C1O 3- 的比例也不 同。若在原石灰乳中通入氯气的速度加快,则反应 后 2(填“>”、“<”或“=”);若 则n (Cl - )= mol (用含a 的代数式来表示)。 6.常温下,用0.1000 mol/L NaOH 溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。 若以HA 表示酸,下列说法正确的是( ) A .滴定盐酸的曲线是图2 B .达到B 、D 状态时,两溶液中离子浓度均为 c (Na +) = c (A —) C .达到B 、E 状态时,反应消耗的n (CH 3COOH)>n (HCl) D .当0 mL< V (NaOH) <20. 00 mL 时,对应混合溶液中各离子浓度 由大到小的顺序均为 c (A —) >c (Na +)> c (H +) > c (OH — ) 题型四:电解过程中溶液离子浓度的变化 7.已知电解(石墨电极)盐酸、硫酸混合酸时两极生成的气体与时间关系如右图所示。则其电解过程中溶液pH 随时间变化关系的正确图形是下列的 ( ) A B C D 题型五:难溶电解质中的相关图像问题 8.已知Ag 2SO 4的K sp 为2.0×10-5,将适量Ag 2SO 4固体溶于 100 mL 水中至刚好饱和,该过程中Ag +和SO 42—浓度随时间变化关系如右图(饱和Ag 2SO 4溶液中c (Ag +)=0.034mol·L -1)。若t 1 时刻在上述体系中加入100mL0.020mol·L -1 Na 2SO 4 溶液,下列示意图中,能正确表示t 1时刻后Ag +和SO 42—浓度随时间变化关系的是 ( ) 9.某温度时,BaSO 4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( ) A .加入Na 2SO 4可以使溶液由a 点变到b 点 B .通过蒸发可以使溶液由d 点变到c 点 C .d 点无BaSO 4沉淀生成 D .a 点对应的K ap 大于c 点对应的K ap 10.某工厂生产硼砂过程中产生的固体废料,主要含有MgCO 3、MgSiO 3、 CaMg(CO 3)2、Al 2O 3和Fe 2O 3等,回收其中镁的工艺流程如下: 部分阳离子以氢氧化物形式完全沉淀时溶液的pH 由见上表,请回答下列问题: (1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条) 7 2020届高三化学高考专题复习 ——电解质溶液中的图像分析 1、弱酸H2A 溶液中,存在H2A、HA-和A2-三种形态的粒子,其物质的量分数δ(X)随溶液pH变化的关系如图所示[已知 δ(X) = ],下列说法不正确的是(图中:a=1.25、b=4.27)() A. 已知pK a=-lgK a,则pK a1=1.25 B. 0.1mol·L-1的NaHA溶液显碱性 C. 0.1mol·L-1Na2A溶液中:2c(H2A)+c(HA-)=c(OH-)-c(H+) D. 0.1mol·L-1NaHA溶液中:c(Na+)+c(A2-)+c(H2A)+c(HA-)=0.2mol·L-1 2、常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是() A. 当V( NaOH )= 20mL时,pH<7 B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)] D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-) 3、25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH 的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。下列说法错误的是() A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38 B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-) C. 25℃时,反应CO32-+H2O HCO3-+OH-的平衡常数对数值1gK=-3.79 D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-) 4、室温下,1mol·L-l的某二元酸H2A溶液中,存在的HA-、A2-的物质的量分数随pH变化的关系如图所示,下列说法不正确的是( ) A. H2A的电离方程式为:H2A==H++HA-HA-A2-+H+ B. 室温下,电离平衡HA-A2-+H+的平衡常数Ka=10-3 专题7-电解质溶液相关图像题 本讲座的核心内容索引: (1)中和反应的电导率规律;(2)交叉图速解;(3)中和滴定全程离子浓度比大小;(4)基元法快写质子守恒式;(5)中和反应的四个点。 一、知识梳理 1.溶液中有关离子平衡的基本思路 看清坐标轴的含义,弄清楚曲线上的起点,交点,拐点,终点的而特殊意义 根据信息明确涉及到那些反应,并与数据结合分析。 2.规律方法 1.计算弱酸碱的平衡常数,找起点,交叉点;起点用于粗略计算,交叉点处两种离子浓 度相等。 2.酸式盐,比较电离水解程度的相对大小,看pH比较。弱酸与弱酸盐;弱碱与弱碱盐 等量混合,也要看溶液酸碱性判断。 3.离子浓度大小的相关判定,需要根据离子浓度的变化趋势,并合理用韵三大守恒,等 量代换。 4.借助电离常数,水解常数进行分析。 5.注意对数与负对数与浓度大小关系的关系。 二、中和反应的电导率的变化 【诠释】:(1)等浓度强酸加强碱,导电离子数不变,体积增大,故电导率减小。中和完成后,继续添加电导率趋于强酸的电导率,故电导率又增大。 (2)弱碱中加弱酸,弱碱部分电离,生成的盐完全电离,故导电性增强。中和完成后,继续添加弱酸,逐渐趋于弱酸的电导率,故导电性又减弱。 (3)强酸中加弱酸,导电离子数不变,总体积增大,故导电性减弱。继续添加弱酸,电导率趋于弱酸的电导率。故继续减弱。 (4)弱酸中加强碱,弱酸电导率小,生成盐的电导率大,故电导率逐渐增大。中和后继续添加强碱,电导率趋于强碱的电导率,故电导率继续增大。 三、典例分析 【例1】 (北京理综)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是() 微专题 中和滴定曲线拓展应用 题型一 一元强酸(碱)与一元弱碱(酸)滴定曲线 例题1 25 ℃时,将0.1 mol ·L -1 NaOH 溶液加入20 mL 0.1 mol ·L -1 CH 3COOH 溶液中,所加入溶液的体积(V )和混合液的pH 的关系曲线如图所示。下列结论正确的是( ) A.①点时,c (CH 3COO -)+c (CH 3COOH)=c (Na + ) B.对曲线上①、②、③任何一点,溶液中都有:c (Na + )+c (H + )=c (OH -) +c (CH 3COO -) C.③点时,醋酸恰好反应完,溶液中有:c (CH 3COO -)=c (Na + )>c (H + )=c (OH -) D.滴定过程中可能出现:c (H +)>c (Na +)>c (CH 3COO –)>c (OH –) 【解题技巧】 【拓展一】(2018届河北省承德市联校高三上学期期末)25 ℃时,用0.10 mol·L -1的盐酸分别滴定体积相同且浓度均为0.10 mol·L -1的三种一元碱XOH 、YOH 及ZOH ,滴定曲线如图所示。下列说法正确的是 A. YOH 是强碱 B. V(盐酸)/V(碱)=0.5 时,c(Z +)>c(Y + )>c(X +) C. X ++H 2O XOH+H + 的平衡常数K=10-4 D. 滴定XOH 时可用酚酞作指示剂 【变式二】(2017四川省宜宾市第二次诊断)25℃时, 将浓度均为0.1 mol/L 、体积分别为V a 和V b 的HA 溶液与BOH 溶液按不同体积比混合,保持V a +V b =100mL ,V a 、V b 与混合液的pH 的关系如图所示。 下列说法正确的是 A. K a (HA)的值与 K b (BOH) 的值不相等 B. b 点时, 水电离出的 c(H +)=10- 7mol/L C. c 点时, c(A - ) > c(B +) D. a→c 过程中( ) ( )() c A c O H c H A - - ?不变 【记录天地】 题型二 一元强碱滴定二元弱酸 例题2 (2018北京四中.12)已知:p K a =-lg K a ,25 ℃ 时,H 2A 的p K a1=1.85,p K a2=7.19。常温下,用0.1 mol·L -1 NaOH 溶液滴定20 mL 0.1 mol·L -1 H 2A 溶液的滴定曲线如图所示。下列说法正确的是( ) A .A 点所得溶液中: V 0=10 mL B.B 点所得溶液中: c (H 2A)+c (H +)=c (HA -)+c (OH -) C .C 点所得溶液中: c (A 2-)=c (HA -) D .D 点所得溶液中A 2-水解平衡常数K h1=10-7.19 【记录天地】 构建思维导图------滴定曲线图像解题策略】电解质溶液图像专题 例题+练习
电解质溶液的图像题集
(完整版)有关电解质溶液图像题的解题技巧Word版无答案
电解质溶液学习知识的图像问答
电解质溶液知识的图像问题
电解质溶液知识的图像问题
电解质溶液——滴定图像分析
2021年高考化学一轮复习易错题电解质溶液图像含解析
电解质溶液的图像题集
2021高考化学二轮电解质溶液中的图像分析
溶液中离子浓度的图像题专题
高中化学电解质溶液图像补充
电解质溶液中的图像问题
2020年高考化学专题复习《电解质溶液中的图像分析》
专题7-电解质溶液图像题-学案
电解质溶液图像教学设计及课后反思
