凝固点降低法测分子量
实验二 凝固点降低法测分子量
1.摘要
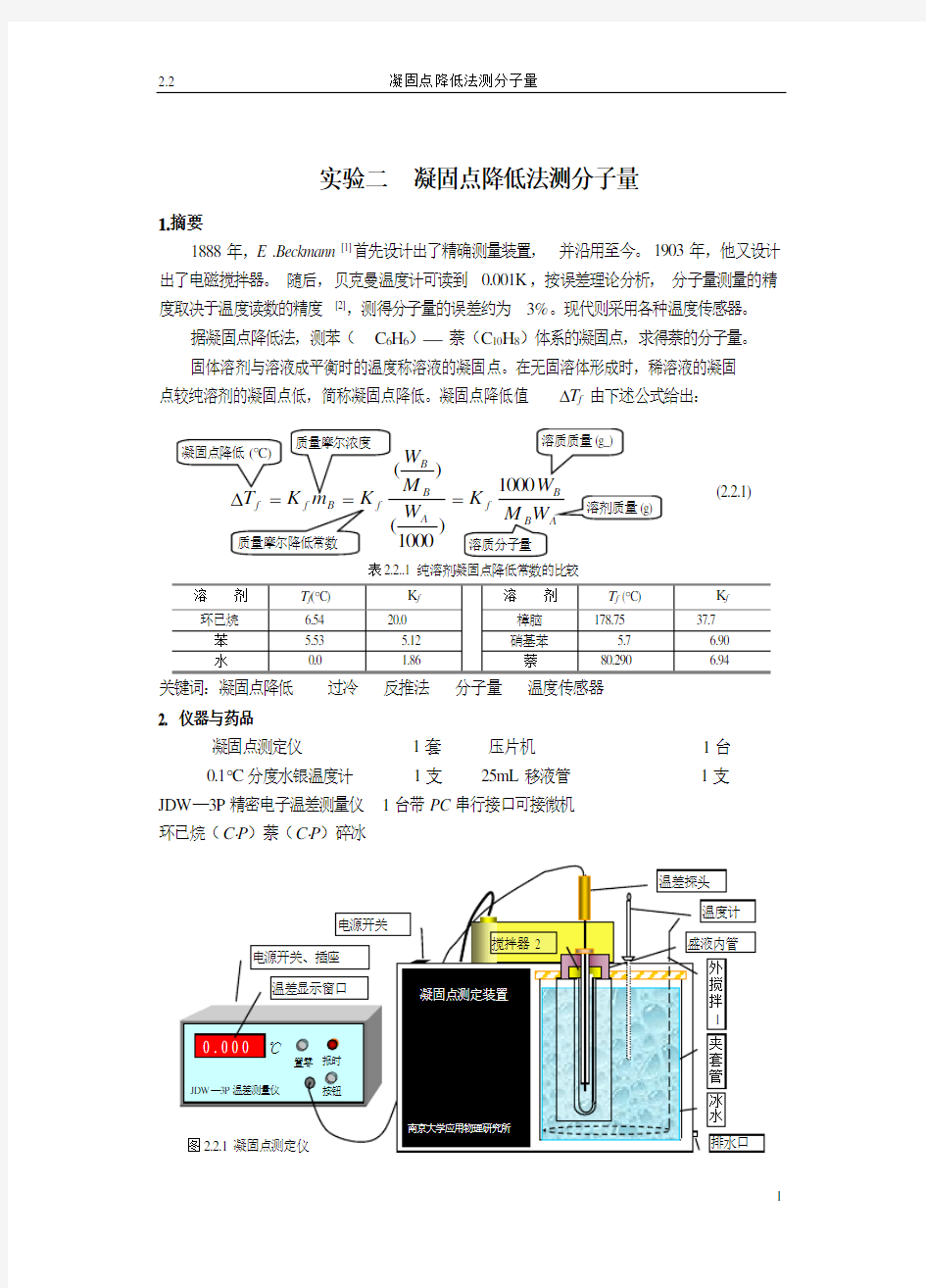
1888年,E .Beckmann [1]首先设计出了精确测量装置,并沿用至今。1903年,他又设计出了电磁搅拌器。随后,贝克曼温度计可读到0.001K ,按误差理论分析,分子量测量的精度取决于温度读数的精度[2],测得分子量的误差约为3%。现代则采用各种温度传感器。 据凝固点降低法,测苯( C 6H 6)? 萘(C 10H 8)体系的凝固点,求得萘的分子量。 固体溶剂与溶液成平衡时的温度称溶液的凝固点。在无固溶体形成时,稀溶液的凝固点较纯溶剂的凝固点低,简称凝固点降低。凝固点降低值?T f 由下述公式给出:
f
A
B
B f
K
W M
W )
1000
(
)(
= 表2.2..1纯溶剂凝固点降低常数的比较
关键词:凝固点降低 过冷 反推法 分子量 温度传感器 2. 仪器与药品
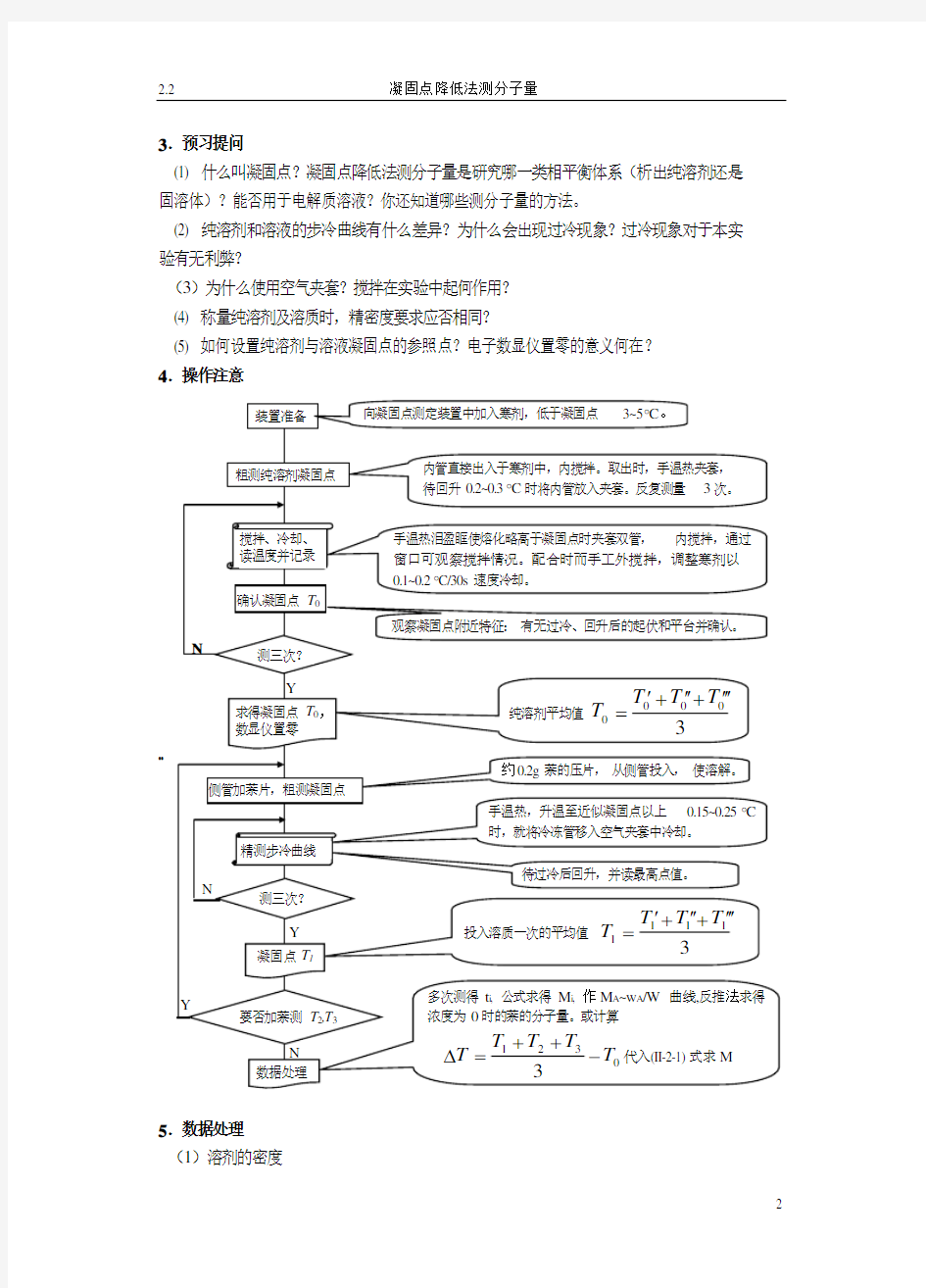
凝固点测定仪 1套 压片机 1台
0.1?C 分度水银温度计 1支 25mL 移液管 1支 JDW —3P 精密电子温差测量仪 1台带PC 串行接口可接微机 环已烷(C ?P )萘(C ?P )碎冰
(2.2.1)
3.预习提问
(1) 什么叫凝固点?凝固点降低法测分子量是研究哪一类相平衡体系(析出纯溶剂还是固溶体)?能否用于电解质溶液?你还知道哪些测分子量的方法。
(2) 纯溶剂和溶液的步冷曲线有什么差异?为什么会出现过冷现象?过冷现象对于本实验有无利弊?
(3)为什么使用空气夹套?搅拌在实验中起何作用?
(4) 称量纯溶剂及溶质时,精密度要求应否相同?
(5) 如何设置纯溶剂与溶液凝固点的参照点?电子数显仪置零的意义何在?
4.操作注意
5.数据处理
(1)溶剂的密度
2-33-6
步冷曲线记录
次/半分
凝固点测定记录
(2)图象
如图2.2.2所示。
a.. 纯溶剂出现一段稳定的平台,即达凝固点t 0。 过冷甚,可能出现回升温度最高点可能出现过平台 的情况。 ?T f b . 溶液的冷却曲线不同,随着纯溶剂的析出,溶 液中萘的相对浓度增大,凝固点依照简单低共熔相图中 液相线的规律不断下降,因为最初析出的纯溶剂是细晶, 具有较大的比表面积P T V A ,???
????,根据: 图2.2.2 步冷曲线 σμρ=???
????=?
???
??
??P T P T n A M V A
,,/ (2.2.2) 细晶的化学势显然比通常两相平衡时的平板结晶的化学势要大。即:
μ细晶>μ平板
致使体系进入介稳态,必须继续降温才能结晶。此即步冷曲线过冷的原因。
过冷回升,有利于溶液凝固点测定实验的判断。过冷程度不同,温度回升所达最高点 也不同,溶液的正常凝固点应如图2.2.2所示,由步冷曲线反推至交点确定。所以需要控 制过冷程度,使回升转折明显,最高点接近于正常凝固点值。 控制过冷程度小,相应析粗晶,过冷至一定程度时骤然加 速搅拌(提供搅拌热),或者加入晶种作为晶核,都可以促进 粗晶生长而接近真正凝固点值。
(3) 外推法求分子量 实验也可以采用多次投放溶质,测量?T i = T i -T 0。
作图如图2.2.3,所求为 溶质浓度为0时的极限值。 下面选用南充师院的一组实验数据
以?t 对g 作图,钭率b = 8.080;计算萘的分子量 M=128.21
(4) 溶剂相变热?H f 的计算
据稀溶液凝固点下降公式 T
W M W RT M H A B B A f
?=
?2
0 (2.2.3)
(5) 误差估计
直接测量误差的传递:
%8.14
.0005.02
.00003.025
10.0)(±=+
+
=
???+
?+
?=
?f
f B
B A
A B
B T T W W W W M
M
其中温度的测量误差占误差总量的约3/4,为主要直接测量误差。另外, 实验存在理论、公式、试剂、个人因素等方面的系统误差。实验误差在3%左右。 (6) 结果要求
文献值:M =128.11
根据误差讨论, 萘的分子是测定的平均误差传递的结果,要求落在M =127±4的范围, 测值一般比真值略低一点。不用外推法的测量,所测分子量在124~128之间。
本实验要求用平均误差传递或者标准误差传递进行误差计算, 从而对实验结果进行准确度和精密度的评价。 6. 点评 (1) 实验关键:
①纯溶剂凝固点设定于贝克曼温度计中、上段,测量过程中要防止毛细 管中水银与扩张(贮)管中水银相接而导致重做。 ②装冰量约占冰水总体积的1/2~2/3,冰浴温度控制低于待测系统凝固点约5?C ,寒剂温差小,测量精密,需时长。注意冷冻管从空气夹套中取出时,塞上空气夹套,保持冷气和干燥。放入夹套时,擦干冷冻管。
③努力防止溶剂因骤冷而在管壁附近结成块晶体,尽可能减少溶液由里向外的温度梯度, 不停地搅拌,除过冷回升外,其它时间里,搅拌注意要尽可能减少磨擦热。 ④控制过冷程度在0.2?C 以内。据溶液凝固曲线分析,初析晶量愈少愈好。 (2) 以苯为溶剂测定萘分子量的实验结果往往偏低,苯有毒。改用环已烷作溶剂,凝固点降低常数K f 约为苯的4倍,可减少溶质的加入量,从而更符合稀溶液条件,且环已烷的凝固点为6.5?C ,环已烷的摩尔凝固热仅是苯的1/4,其过冷程度小于苯,过冷回升不明显,
增加了过冷现象观察的难度。
在高温高湿季节,溶剂易吸水,如同增加溶质的质点数,所测结果容易偏低。
(5)使用电动搅拌棒比过去人工搅拌括擦器坒和玻璃温度计产生搅拌热优越,另外一种搅拌方法是用上端带有乳胶头的玻璃管插入测试管中,用挤压乳头的方式鼓泡搅拌,可以观察到纯溶剂平台上波浪线趋于平直。 7.解题研习
(1) 估计加入0.1克晶种对于分子量测定结果的影响? 解:
%5.022
1.0==
=
A
A
B
B W dW M
dM
影响分子量测值偏高+0.5%, 这对于实际测量中分子量测值往往偏低(?T 测值偏高), 同时对于实验事实存在3%的测量误差来说, 影响不算大。 (2) 如何测苯甲酸的缔合度?
解: 设苯甲酸在苯液中的缔合度为 α, 则当 n 摩尔苯甲酸溶入苯液后, 以单分子存在的占n (1-α) 摩尔,以二聚体存在的约占n α/2 摩尔,总摩尔数为 )2
11(α-n ,实验测得的表
观分子量M B 和苯甲酸的分子量M ,根据三者 关系:
α2
11-
=M
M B
便可求得苯甲酸的缔合度。测一些分子的电离度同样采用以质点数代分子数的原理。 (3) 根据什么原则考虑加入溶质的量, 太多太少影响如何?
解: 根据稀溶液依数性, 溶质加入量要少;而对于称量相对精密度来说,溶质不能太少。
萘 X →苯 苯
图2.2.4 萘-苯体系相图
T /?C 80. 2 (3)
用本装置,改换100?C 量程温度计,可测萘-苯二元相图 (图2.2.4) 。 (4)
用多组热电偶即热电堆测温,采用示差法可以测量冰点降低。以K f
较大的樟脑为溶剂,只需数毫克溶质进行微量法测定。这些本世纪初,前人已获得较好的的实验结果。此后,无重大进展。1997年4期,《大学化学》报道用电致冷块代替寒剂致冷、采用双差示法测量。近几年来,在温度测量方面采用电阻温度计和数显示温仪使实验操作条件得以改善。
f f b 图2.2.5 结晶时μ -T 示意图
(4) 搅拌速度过快和过慢对实验有何影响?
解:在温度逐渐降低过程中,搅拌过快,不易过冷;搅拌过慢,体系温度不均。 温度回升时,搅拌过快,回升最高点因搅拌热而偏高;过慢,影响溶液凝固点测值偏低。 所以,搅拌的作用,一是使体系温度均匀,二是供热(尤其是刮擦器壁)促进固体新 相的形成。
(5) 凝固点下降是根据什么相平衡体系和哪一类相线?
解:二组分低共熔体系中的凝固点降低曲线,也称对某一纯物质饱和的析晶线。 (6) 过冷现象的成因及其对实验的影响?
解:微细结晶必然产生过冷现象,因为它较之于平板结晶,有更大的(等质量)比表面 积,需要附加的自由能dA dG σ=,又dn dG μ=,显然是化学势的差别,即微晶的化学势要求高于平板的化学势平板细晶μμ->0。在化学势-温度曲线的图象(图2.2.5)上,
虚线代表细晶线,实线代表平板结晶线。点划线代表介稳 态,微细结晶时,意味着液相化学势必须沿着点划线爬高 以求达到细晶析晶时的化学势(虚线)高度,故两线交点 T f 、‘
,较之T f 有一个冰点下降?T 值。
过冷后回升至最高点,是实验终点判断的依据。得到 的是略偏低的近似凝固点。过冷程度则影响偏低的程度。 (7)凝固点降低公式自身具有哪类和哪些误差?
解:稀溶液凝固点降低公式在推导过程中引入四点系统误差:
T H
S T T x RT m
m p
T p ?-=?-=???? ?
????=???
????)(ln *1μ (2.2.4)
221((ln x T T R H T T T T R H x f
f
m f f f
f m =??≈'?-'?=-***
, 21
22
2
12121
22
m K W M W K
W W W M H RT
n n H RT
T f f
m
f
m
f
f ==?
??=
?
?≈
?**
(8) 有人认为吉林大学教材和印永嘉教材关于凝固点下降式的简化推导
2
11ln RT
H T G T R T x m p
m p ?-
=????
?
???? ?????=???
????存在问题,理由是
①?H m :视为积分项中常数
③T f ? 2:视为凝固点温度的平方 ② x 2:斯特令公式,溶质摩尔分数
④n 1:溶液摩尔总数n 1+n 2,视为溶剂摩尔数
p
(图2.2.5 新(I)旧(II)平衡态参数解析图
p
p
l m s m p T l S S T s ???? ????=-≠-=???? ????)()(*1*1μμ 因此认为:公式推导只能采用全微分
dp T G p R dT T G T R dp p
x dT T x T m p m T p ???
??
???? ?????+????????? ?????=?
??? ????+??? ????11ln ln 11你认为错在哪里?
解:据其理由,一级相变的性质?S ≠0,如果二级相变则?S =0,化学势-温度曲线(图2.2.5)在相变点时仅一条切线。这不成了一级相变不能用偏微分推导,而二级相变用偏微分推导就会相等因而不必全微分的说法了吗。其实
RT
G RT
l s x m ?=
-=
)
()(ln *
1*
11μμ
p
m p m p T
l S T s S T x R ????
????-???? ????=???
????)()(ln *
*1。 而是两个不同温度下(?T =T f
*‘、
-T f *
)的化
学势之差值(?μ*
)。见图2.2.6,偏微分意义 是用化学势变化的分量求证。
(9) 请举几个关于分子量测定方法的事例。 解:根据溶液依数性,还可用沸点上升法
(如以丙酮为溶剂,测苯甲酸的分子量);粘度法测高聚物的相对分子质量。胶体(如刚果红)用渗透压法;气体(如四氯化碳)用Victor Meyer(梅耶)法[3];中药材用质谱法等测定分子量。
(10) 冰点与三相点的定义有何原则上的区别? 解:冰点与三相点的定义原则上的区别见下表:
(11) 于一块砖形冰(冰温度272.0K )上搁一细铁丝,下系一重锤(图2-2-7),假定冰受压面积0.1cm 2
,若欲铁丝穿冰而过,而冰仍复一
整体,未被切分成两块,则重锤质量应是:(A )10kg (B)16kg (C)24kg (D)30kg 解:根据克拉贝龙方程,压力每增大1k Pa 时,冰的熔点降低7.43?10-5度。而冰温低于正常 熔点1.15K 。
1550332
.11
.016/1
=?=
-
p p
7.43?10-5?(155-1)?102= 1.15K ,冰恰好熔化。答案应是B 。
评注 滑冰者,在定温度的冰上是否能划出水痕而致滑自由滑行,属于与此同类的问题。
(12) 将一定量海水致冷冻结,步冷曲线应是
(
选C ,-20?C 是食盐-水体系的低共熔温度值。 (13)糖水冰棒,为何越吃越甜?
解:糖水冰棒在结晶过程中,先析出纯溶剂冰,并非糖与水同时折出,直至大部分冰析完,才与糖在低共熔温度下定比例共析混合物,这种现象称为包晶,所以此类冰棒的外壳尤如冰窟,是不甜的。糖份沉积成底物。
(14) 在澳洲有一种称为Coolgardie safe 用于保持食物冷却的装置,它内含一个盒子而四周包有棉布,将水经由一种毛细管作用流至盒子顶端,当水从此棉布上挥发时,食物盒便被冷却。假定当地相对湿度是20%,水的?H 为43.8kJ ?mol -1
,如在298K 下p (H 2O)=3.17kPa ,空气的热容是1.0kJ ?kg -1
?K -1
。炎热天当温度达到318K 时,用此装置可达最低温度应为多
少?
解:盒外小环境,相对湿度由20%变化至100%,则
V T H dT dp m
V ??=, p
RT V
V
V
V g
l
g
=
≈-=?
2RT
H p dT
dp m V ?=, dT RT
H p d m
V 2
ln ?=
)11(/ln 1
2
12T T R H p p m
V -?-
=,
所以)298
1318
1(314
.84380017
.3ln 2-
-=p
p 2=9.66kPa ,所以p w =20%?p 2=1.93 kPa 水汽相对密度差
?ρ=ρ0-ρ=M 水(p 2-p w )/(M 空气?101.3)=18?(9.66-1.93)/(29?100)=0.0480kg/kg(空气) 空气的热容是1.0kJ ?kg -1
?K -
1
43.8?0.0480?1000/18=?T ?1, ?T=117K 所以T =318-117=201K 评注201K 是空气的降温效果,但事实上,若有水存在,则温度不可能降到此温;而无水,
蒸发也就没有降温效果。所以这是一个理想值。既干燥隔热又能保持低温蒸发,是沙漠地区“木乃伊”得以保存的一个重要原因。
参考文献
[1] Friderich H.Daniels etc.,“Experimental Physical Chemistry”,Locasse(1956)
[2] M. james,“Practical Physical Chmistry”p. 106~109(1961)
[3]北京大学物理化学教研室。物理化学实验(1985)
凝固点降低法测定摩尔质量的思考题与答案
实验七十三凝固点降低法测定摩尔质量 1、简述凝固点降低法测定摩尔质量的基本原理 2、在凝固点降低法测定摩尔质量实验中,当溶质在溶液中有离解,缔合和生成络合物的情况下,对摩尔质量的测定值各有什么影响? 3、在凝固点降低法测定摩尔质量实验中,根据什么原则考虑加入溶质的量,太多太少影响如何? 4、凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液? 5、在凝固点降低法测定摩尔质量实验中,为什么会产生过冷现象?过冷太甚对结果有何影响?如何控制过冷程度? 6、在凝固点降低法测定摩尔质量实验中,为了提高实验的准确度,是否可用增加溶液浓度的办法来增加ΔT值?为什么? 7、什么是稀溶液依数性质?稀溶液依数性质和哪些因素有关? 8、测定溶液凝固点时若过冷程度太大对结果有何影响?两相共存时溶液系统和纯溶剂系统的自由度各为多少? 9、什么叫凝固点?凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液? 10、在凝固点降低法测定摩尔质量实验中,为什么要使用空气夹套?过冷太甚有何弊病? 11、在凝固点降低法测定摩尔质量实验中,实验测量成败的关键是什么? 12、在凝固点降低法测定摩尔质量实验中,加入萘的时候,不小心将萘附着在内管壁上,对实验结果有何影响? 13、在凝固点降低法测定摩尔质量实验中,为什么要先测近似凝固点? 14、当溶质在溶液中有解离、缔合、溶剂化和形成配合物时,测定的结果有何意义? 15、在凝固点降低法测定摩尔质量实验中,测定环已烷和萘丸质量时,精密度要求是否相同?为什么? 16、用凝固点降低法测定摩尔质量在选择溶剂时应考虑哪些因素? 17、为什么纯溶剂和稀溶液的的凝固曲线不同? 18、在凝固点降低法测定摩尔质量实验中,寒剂温度的温度应控制在什么范围?为什么? 19、在凝固点降低法测定摩尔质量实验中,为什么实验所用的内套管必须洁净、干燥? 20、在凝固点降低法测定摩尔质量实验中,搅拌速度的控制是做好本实验的关键,在实验过程中怎样控制搅拌速度?
凝固点降低实验报告
华南师范大学实验报告 学生姓名学号 专业化学(师范) 年级、班级 课程名称物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型:□验证□设计□综合实验时间年月日 实验指导老师蔡跃鹏实验评分 【实验目的】 1、明确溶液凝固点的定义及获得凝固点的正确方法。 2、确定环己烷的凝固点降低值,计算萘的相对分子质量。 3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。 4、掌握贝克曼温度计的使用方法。 【实验原理】 物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。 凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T f*下降,其降低值△T f =T f*-T f与溶液的质量摩尔浓度成正比,即 △T f =K f m (3-1)式中,△T f为凝固点降低值;m为溶液质量摩尔浓度;K f为凝固点降低常数,它与溶剂的特性有关。表3-1给出了部分溶剂的凝固点降低常数值。 表3-1 几种溶剂的凝固点降低常数值 若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则此溶液的质量摩尔浓度m B为 W B
m B = ×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。将式(3-2)代入式(3-1),整理得 M B = ×103 mol/kg (3-3) 若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。 通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。本实验采用后者。其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘出步冷曲线(温度-时间曲线),用外推法求得纯溶剂或稀溶液中溶剂的凝固点。 首先,将纯溶剂逐步冷却时,体系温度随时间均匀下降,到某一温度时有固体析出,由于结晶放出的凝固热抵消了体系将温室传递给环境的热量,因而保持固液两相平衡,当放热与散热达到平衡时,温度不再改变。在步冷曲线上呈现出一个平台;当全部凝固后,温度又开始下降。从理论上来讲,对于纯溶剂,只要固液两相平衡共存,同时体系温度均匀,那么每次测定的凝固点只应该不变。但实际上由于过冷现象存在,往往每次测定值会有起伏。当过冷现象存在时,纯溶剂的不冷曲线如图3-1(a)所示。即先过冷后足够量的晶体产生时,大量的凝固热使体系温度回升,回升后在某一温度维持不变,此不变的温度作为纯溶剂的凝固点。 稀溶液的凝固点测定也存在上述类似现象,如图3-1(b)所示。没有过冷现象存在时,溶液首先均匀降温,当某一温度有溶剂开始析出时,凝固热抵消了部分体系向环境的放热,因此降温变缓慢,在步冷曲线上表现为一个转折点,此温度即为该平衡浓度稀溶液的凝固点,随着溶剂析出,溶液浓度增加,凝固点逐渐降低。但溶液的过冷现象也是普遍存在的。当某一浓度的溶液逐渐冷却成过冷溶液(冷却到凝固点,并不析出晶体),通过搅拌或加入晶种促使溶剂结晶,凝固热抵消了体系降温时传递给环境的热量,使体系温度回升,当凝固放热与体系散热达到平衡时,温度不再回升。此固液两相共存的平衡温度即为溶液的凝固点。后又随着溶剂析出,凝固点逐渐降低。但过冷太厉害或寒剂温度过低,则凝固热抵偿不了散热,此时温度不能回升到凝固点,在温度低于凝固点时完全凝固,就得不到正确的凝固点。上述也可从相律分析,溶剂与溶液的冷却曲线形状不同。对纯溶剂两相共存时,自由度f * =1-2+1=0,冷却曲线出现水平线段,其形状如图3-1(a)所示。对溶液两相共存时,自由度f * =2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,但回升到最 M B W A △T f W A K f W B
凝固点降低法测定相对分子质量
西安交通大学实验报告 课程:物理化学实验 系别: 专业班号: 组别:第二大组 实验日期:2015年4月3日 姓名: 学号: 交报告日期:2015年4月10日 同组者: 实验名称:凝固点降低法测定相对分子质量 一、实验目的 1.用凝固点降低法测定萘的相对分子量。 2.掌握步冷曲线法测定液体凝固点的方法。 3.掌握数字贝克曼温度计的使用方法。 二、实验原理 稀溶液中溶剂的蒸气压下降、凝固点降低(析出固态纯溶剂)、沸点升高(溶质不挥发)和渗透压的数值,仅与一定量溶液中溶质的质点数有关,而与溶质的本性无关,故称这些性质为稀溶液的依数性。 固体物质和它的液体成平衡时的温度称为凝固点。加一溶质于纯溶剂中,其溶液的凝固点必然较纯溶剂的凝固点低,其降低的数值与溶液中溶质的质量摩尔浓度成正比。 对于在溶液中不离解、不缔合的溶质的稀溶液有如下关系式: 0T T T kc ?=-= ① 式中:0T —纯溶剂的凝固点; T —浓度为C 的溶液的凝固点; k —比例常数。 如果C 以质量摩尔浓度(B m :每千克溶剂所含溶质的物质的量)来表示,k 则为溶剂的摩尔凝固点降低常数,今以f K 表示这个常数,于是①示可改写为: 0f B T T T K m ?=-= ② 若取一定量的溶质()B W 和溶剂()A W 配制成稀溶液,则此溶液的质量摩尔浓度B m 为: /1000B B B A W M m W = ? ③
式中:B m 为溶质的相对分子质量。 如果已知溶剂的f K 值,则测定此溶液的凝固点降低值即可按下式计算溶质的相对分子质量。 01000f B B A K W M T T W = ? - ④ 纯溶剂的凝固点是它的液相和固相共存的平衡温度。若将纯溶剂逐步冷却,其冷却曲 线如图1中Ⅰ的曲线图形。但实际过程中往往发生过冷现象,即在过冷时开始析出固体后,温度才回升到稳定的平衡温度,当液体全部凝固后,温度再逐渐下降,其冷却曲线呈现如图1中Ⅱ的形状。 溶液的凝固点是该溶液的液相与溶剂的固相共存的平衡温度。若将溶液逐步冷却,其冷却曲线与纯溶剂不同,见图9中Ⅲ、Ⅳ。由于部分溶剂凝固而析出,使剩余溶液的浓度逐渐增大,因而剩余溶液与溶剂固相的平衡温度也逐渐下降。本实验所要测定的是浓度已知的溶液的凝固点。因此,所析出的溶剂固相的量不能太多,否则要影响原溶液的浓度。如稍有过冷现象如图9中Ⅳ所示,对相对分子质量的测定,无显著影响;如过冷严重,则冷却曲线如图9中Ⅴ所示,测得之凝固点将偏低,影响相对分子质量的测定结果。因此在测定过程中必须设法控制适当的过冷程度,一般可控制寒剂的温度、搅拌速度等方法来达到。 由于稀溶液的凝固点降低值不大,因此温度的测量需要用较精密的仪器,在本实验中采用精密温差测量仪。 做好本实验的关键:一个是控制搅拌速度,每次测量时的搅拌条件和速度尽量一致。二是寒剂的温度,过高则冷却太慢,过低则测不准凝固点,一般要求较溶剂的凝固点低3~4℃,因此本实验中采用冰—水混合物作冰浴。 图1冷却曲线
凝固点降低法测定物质的相对分子质量_纯萘、环己烷
华南师范大学实验报告 【实验目的】 ①测定环己烷的凝固点降低值,计算萘的分子量。 ②掌握溶液凝固点的测定技术。 ③技能要求:掌握冰点降低测定管、数字温差仪的使 用方法,实验数据的作图处理方法。 【实验原理】 1、凝固点降低法测分子量的原理 化合物的分子量是一个重要的物理化学参数。用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。稀溶液有依数性,凝固点降低是依数性的一种表现。稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中物质的摩尔分数的关系式为: ΔT f = T f * - T f = K f m B (1) *式中,T f * 为纯溶剂的凝固点,T f 为溶液的凝固点,m B 为溶液中溶质B 的质量摩尔浓度,K f 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。 已知某溶剂的凝固点降低常数K f,并测得溶液的凝固点降低值ΔT ,若称取一定量的溶质W B (g)和溶剂 W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为: 3A B B B 10W M W m ?= mol/kg (2) 将(2)式代入(1)式,则: 3A f B f B 10W T W K M ??= g/mol (3) 表1 几种溶剂的凝固点降低常数值 因此,只要称得一定量的溶质(WB )和溶剂(WA )配成一稀溶液,分别测纯溶剂和稀溶液的凝固点,求得ΔT f ,再查得溶剂的凝固点降低常数,代入(3)式即可求得溶质的摩尔质量。 * 当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于强电解质稀溶液。 2、凝固点测量原理 纯溶剂的凝固点是它的液相和固相共存时的平衡温度。若将纯溶剂缓慢冷却,理论上得到它的步冷曲线如图中的 A , 但但实际的过程往往会发生过冷现象,液体的温度会下降到凝固点以下,待固体析出后
物化实验报告_凝固点降低法测定摩尔质量
凝固点降低法测定摩尔质量 丛乐 2005011007 生51 实验日期:2007年10月13日星期六 提交报告日期:2007年10月27日星期六 助教老师:马林 1 引言 1.1实验目的 1. 用凝固点降低法测定萘的摩尔质量 2. 学会用步冷曲线对溶液凝固点进行校正 3. 通过本实验加深对稀溶液依数性的认识 1.2 实验原理 稀溶液具有依数性,凝固点降低是依数性的一种表现,它与溶液质量摩尔浓度的关系为: *×f f f f B T T T K b ?=-= 其中,f T ?为凝固点降低值,*f T 、f T 分别为纯溶剂、溶液的凝固点,B b 为溶液质量摩尔浓度,f K 为凝固点降低常数,它只与所用溶剂的特性有关。如果稀溶液是由质量为B m 的溶质溶于质量为A m 的溶剂中而构成,则上式可写为: 1000××B f f A m T K M m ?= 即 310B f f A m M K T m =? (*) 式中: f K ——溶剂的凝固点降低常数(单位为1 K kg mol -g g ); M ——溶质的摩尔质量(单位为1 g mol -g )。 如果已知溶液的f K 值,则可通过实验测出溶液的凝固点降低值 f T ?,利用上式即可求出溶质的摩尔质量。 常用溶剂的f K 值见下表。 表1 常用溶剂的f K 值 于新相形成需要一定的能量,故结晶并不析出),温度降低至一定值时出现结晶,当晶体生成时,放出的热量使体系温度回升,而后温度保持相对恒定。对于纯溶剂来说,在一定压力下,凝固点是固定不变的,直到全部液体凝固成固体后才会下降。相对恒定的温度即为凝固点。 对于溶液来说,除温度外还有溶液浓度的影响。当溶液温度回升后,由于不断析出溶剂晶体,所以溶液的浓度逐渐增大,凝固点会逐渐降低。因此,凝固点不是一个恒定的值。如把回升的最高点温度作为凝固点,这时由于已有溶剂晶体析出,所以溶液浓度已不是起始浓度,而大于起始浓度,这时的凝固点不是原浓度溶液的凝固点。要精确测量,应测出步冷曲线,按下一页图1(b )所示方法,外推至f T 校正。
实验八凝固点降低法测定摩尔质量
实验八凝固点降低法测定摩尔质量 一、实验目的 1. 用凝固点降低法测定萘的摩尔质量。 2. 掌握溶液凝固点的测量技术,加深对稀溶液依数性质的理解。 二、实验原理 当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。即 ΔT=T f* -T f = K f m B(1) 式中,M B为溶质的分子量。将该式代入(1)式,整理得: (2) 若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值ΔT,即可计算溶质的分子量M B。通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。此固液两相共存的平衡温度即为溶液的凝固点。 图1. 溶剂(1)与溶液(2)的冷却曲线 三、仪器药品 1. 仪器 凝固点测定仪1套;烧杯2个;精密温差测量仪1台;放大镜1个;普通温度计(0℃~
50℃)1支;压片机1台;移液管(25mL)1支。 2. 药品 环已烷(或苯),萘,粗盐,冰。 四、实验步骤 1.按图2所示安装凝固点测定仪,注意 测定管、搅拌棒都须清洁、干燥,温差测量 仪的探头,温度计都须与搅拌棒有一定空 隙。防止搅拌时发生摩擦。 2. 调节寒剂的温度,使其低于溶剂凝固 点温度2~3℃,并应经常搅拌,不断加入碎 冰,使冰浴温度保持基本不变。 3. 调节温差测量仪,使探头在测量管中 时,数字显示为“0”左右。 4. 准确移取2 5.00mL溶剂,小心加入测定管中,塞紧软木塞,防止溶剂挥发,记下溶剂的温度值。取出测定管,直接放入冰浴中,不断移动搅拌棒,使溶剂逐步冷却。当刚有固体析出时,迅速取出测定管,擦干管外冰水,插入空气套管中,缓慢均匀搅拌,观察精密温差测量仪的数显值,直至温度稳定,即为苯的凝固点参考温度。取出测定管,用手温热,同时搅拌,使管中固体完全熔化,再将测定管直接插入冰浴中,缓慢搅拌,使溶剂迅速冷却,当温度降至高于凝固点参考温度0.5℃时,迅速取出测定管,擦干,放入空气套管中,每秒搅拌一次,使溶剂温度均匀下降,当温度低于凝固点参考温度时,应迅速搅拌(防止过冷超过0.5℃),促使固体析出,温度开始上升,搅拌减慢,注意观察温差测量仪的数字变化,直至稳定,此即为溶剂的凝固点。重复测量三次。要求溶剂凝固点的绝对平均误差小于±0.003℃。 5. 溶液凝固点的测定,取出测定管,使管中的溶剂熔化,从测定管的支管中加入事先压成片状的0.2~0.3g的萘,待溶解后,用上述方法测定溶液的凝固点。先测凝固点的参考温度,再精确测之。溶液凝固点是取过冷后温度回升所达到的最高温度,重复三次,要求凝固点的绝对平均误差小于±0.003℃。 五、注意事项 1. 搅拌速度的控制是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致。
凝固点降低法测定分子量
凝固点降低法测定分子量 一、实验目的及要求 1)用凝固点降低法测定物质的摩尔质量。 2) 掌握自冷式凝固点测定仪的使用方法。 二、实验原理 非挥发性溶质二组分溶液,其稀溶液具有依数性,凝固点降低就是依数性的一种表现。根据凝固点降低的数值,可以求溶质的摩尔质量。对于稀溶液,如果溶质和溶剂不生成固溶体,固态是纯的溶剂,在一定压力下,固体溶剂与溶液成平衡的温度叫做溶液的凝固点。溶剂中加入溶质时,溶液的凝固点比纯溶剂的凝固点低。那么其凝固点降低值ΔT f 与溶质的质量摩尔浓度b 成正比。 ?T f = T f 0-T f =K f b 式中:T f 0纯溶剂的凝固点、T f 浓度为b 的溶液的凝固、K f 溶剂的凝固点降低常数。 若已知某种溶剂的凝固点降低常数K f ,并测得溶剂和溶质的质量分别为m A , m B 的稀溶液 的凝固点降低值?T f ,则可通过下式计算溶质的摩尔质量M B 。 A f B f B m T m K M ?= 式中K f 的单位为K · kg ·mol -1 纯溶剂的凝固点为其液相和固相共存的平衡温度。若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降,开始凝固后因放出凝固热而补偿了热损失,体系将保持液一固两相共存的平衡温度而不变,直至全部凝固,温度再继续下降。其冷却曲线如图1中1所示。但实际过程中,当液体温度达到或稍低于其凝固点时,晶体并不析出,这就是所谓的过冷现象。此时若加以搅拌或加入晶种,促使晶核产生,则大量晶体会迅速形成,并放出凝固热,使体或加入晶种,促使晶核产生,则大量晶体会迅速形成,并放出凝固热,使体系温度迅速回升到稳定的平衡温度;待液体全部凝固后温度再逐渐下降。冷却曲线如图1中2。
凝固点降低法测相对分子质量
凝固点降低法测相对分子质量;实验注意事项;1、将已调好并擦干的贝克曼温度计插入冷冻管时;再;晶全部溶化时;把萘加入体系并使其溶解时;请注意:;2、每组(三次)数据测定时过冷程度要一致;3、使用贝克曼温度计时请先阅读教材P44的注意事;4、量取苯时应先读室温;思考题;1、凝固点降低法测相对分子质量的公式,在什么条件;2、在冷却过程中,冷冻管内固液相之间和寒剂之 凝固点降低法测相对分子质量 实验注意事项 1、将已调好并擦干的贝克曼温度计插入冷冻管时;再次测量之前将体系温热、搅拌而使苯结 晶全部溶化时;把萘加入体系并使其溶解时;请注意:绝不能让温度计中的水银柱与贮槽中的水银相接! 2、每组(三次)数据测定时过冷程度要一致。搅拌应无摩擦。 3、使用贝克曼温度计时请先阅读教材P44的注意事项,一定要小心! 4、量取苯时应先读室温。 思考题 1、凝固点降低法测相对分子质量的公式,在什么条件下才能适用?答:非挥发性溶质的稀溶液,适用于稳定的大分子化合物,浓度不能太大也不能太小。 2、在冷却过程中,冷冻管内固液相之间和寒剂之间有哪些热交换?它们对凝固点的测定有何影响? 答:凝固点测定管内液体与空气套管、测定管的管壁、搅拌棒以及温差测量仪的传感器等存在热交换。因此,如果搅拌棒与温度传感器摩擦会导致测定的凝固点偏高。测定管的外壁上粘有水会导致凝固点的测定偏低。 3、当溶质在溶液中有离解,缔合和生成络合物的情况时,对相对分子质量测定值的影响如何?答:溶质在溶液中有解离、缔合、溶剂化和形成配合物时,凝固点降低法测定的相对分子质量为溶质的解离、缔合、溶剂化或者形成的配合物相对分子质量,因此凝固点降低法测定出的结果反应了物质在溶剂中的实际存在形式。 4、影响凝固点精确测量的因素有哪些? 答:影响测定结果的主要因素有控制过冷的程度和搅拌速度、寒剂的温度等。本实验测定凝固点需要过冷出现,过冷太甚会造成凝固点测定结果偏低,因此需要控制过冷程度,只有固液两相的接触面相当大时,固液才能达到平衡。实验过程中就是采取突然搅拌的方式和改变搅拌速度来达到控制过冷程度的目的;寒剂的温度,寒剂温度过高过低都不利于实验的完成。 5、.根据什么原则考虑加入溶质的量?太多或太少影响如何? 答:溶质的加入量应该根据它在溶剂中的溶解度来确定,因为凝固点降低是稀溶液的依数性,所以应当保证溶质的量既能使溶液的凝固点降低值不是太小,容易测定,又要保证是稀溶液这个前提。如果加入量过多,一方面会导致凝固点下降过多,不利于溶液凝固点的测定,另一方面有可能超出了稀溶液的范围而不具有依数性。过少则会使凝固点下降不明显,也不易测定并且实验误差增大。 6.空气套筒的作用是什么?本实验应注意哪些问题?答:使降温速度缓慢,有利于相平衡 7.为什么要先测近似凝固点? 答:为了控制过冷深度。过冷太小,温度回升不明显,不易测量。过冷太大,测量值偏低。
实验 凝固点降低法测定分子量
1 实验9 凝固点降低法测分子量 一、实验目的及要求 1、用凝固点降低法测定环己烷的摩尔质量。 2、正确使用数字贝克曼(Beckmann )温度计,掌握溶液凝固点的测量技术。 3、通过本实验加深对稀溶液依数性的理解。 二、实验原理 化合物的分子量是一个重要的物理化学参数。用凝固点降低法测定物质的分子量是一种简单又比较准确的方法。 固体溶剂与溶液成平衡的温度称为溶液的凝固点。含非挥发性溶质的双组分稀溶液的凝固点低于纯溶剂的凝固点。凝固点降低是稀溶液依数性质的一种表现。当确定了溶剂的种类和数量后,溶剂凝固点降低值仅取决于所含溶质分子数目。对于理想溶液,根据相平衡条件,稀溶液的凝固点降低与溶液成分关系由范霍夫(van’t Hoff )凝固点降低公式给出 B A A m f f f n n n A H T R T +? = ) ()(2 *?? (2.1) 式中,△T f 为凝固点降低值;T f *为纯溶剂的凝固点;△f H m (A )为摩尔凝固点热;n A 和n B 分别为溶剂和溶质的物质的量。当溶液浓度很稀时,n B ≤n A ,则 B f B A m f f A B m f f f m K m M A H T R n n A H T R T ≡?=?=) ()()()(2*2 *??? (2.2) 式中,M A 为溶剂的摩尔质量;m B 为溶质的质量摩尔浓度;K f 即称为质量摩尔凝固点降低常数。 如果已知溶剂的凝固点降低常数K f ,并测得此溶液的凝固点降低值△T f ,以及溶剂和溶质的质量W A 、W B ,则溶质的摩尔质量由下式求得 f B K m =A f B W T W ? (2.3) 应该注意,如溶质在溶液中有解离、缔合、溶剂化和配合物形成等情况时,不能简单地运用公式(2.3)计算溶质的摩尔质量。显然,溶液凝固点降低法可用于溶液热力学性质的研究,例如电解质的电离度、溶质的缔合度、溶剂的渗透系数和活度系数等。 凝固点测定方法是将已知浓度的溶液逐步冷却成过冷溶液,然后促使溶液结晶;当晶体生成时,放出的凝固热使体系温度回升,当放热与散热达成平衡时,温度不再改变,此固液两相达成平衡的温度,即为溶液的凝固点。本实验测定纯溶剂和溶液的凝固点之差。 纯溶剂的凝固点是它的液相和固相共存的平衡温度。若将纯溶剂逐步冷却,理论上其冷却曲线(或称步冷曲线)应如图2—1(Ⅰ)所示。但是实际过程中往往发生过冷现象,即在过冷而开始析出固体时,放出的凝固热才使体系的温度回升到平衡温度,待液体全部凝固后,温度再逐步下降,其步冷曲线呈图2—1(Ⅱ)形状。过冷太甚,会出现如图2—1(Ⅲ)的形状。 溶液凝固点的精确测量,难度较大。当将溶液逐步冷却时,其步冷曲线与纯溶剂不同,见图2—1(Ⅳ)、(Ⅴ)、(Ⅵ)。由于溶液冷却时有部分溶剂凝固而析出,使剩余溶液的浓度逐渐增大,因而剩余溶液与溶剂固相的平衡温度也在逐渐下降,出现如图2—1(Ⅳ)的形状。通常发生稍有过冷现象,则出现如图2—1(Ⅴ)的形状,此时可将温度 回升的最高值 t 图2—1 步冷曲线示意图
凝固点降低实验报告
华 南 师 范 大 学 实 验 报 告 学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验 实验项目凝固点降低法测定物质的相对分子质量 实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 蔡跃鹏 实验评分 【实验目的】 1、明确溶液凝固点的定义及获得凝固点的正确方法。 2、确定环己烷的凝固点降低值,计算萘的相对分子质量。 3、掌握凝固点将定分子量的原理,加深对稀溶液依数性的理解。 4、掌握贝克曼温度计的使用方法。 【实验原理】 物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有许多种。凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都具有重要意义。 凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f 比纯溶剂的凝固点T f * 下降,其降低值△T f =T f * -T f 与溶液的质量摩尔浓度成正比,即 △T f =K f m (3-1) 式中,△T f 为凝固点降低值;m 为溶液质量摩尔浓度;K f 为凝固点降低常数,它与溶剂的特性有关。表3-1给出了部分溶剂的凝固点降低常数值。 表3-1 几种溶剂的凝固点降低常数值 若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为 m B = ×103 mol/kg (3-2) 式中,M B 为溶质的相对分子质量。将式(3-2)代入式(3-1),整理得 M B = ×103 mol/kg (3-3) 若已知某溶剂的凝固点降低常数K f 值,通过实验测定此溶液的凝固点降低值△T f ,即可计算溶质的相对分子质量M B 。 通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。本实验采用后者。其基本原理是 M B W A W B △T f W A K f W B
实验一凝固点降低法测分子量
31页 实验一 凝固点降低法测定溶质的摩尔质量 一、目的要求 1.根据稀溶液的依数性质,利用凝固点降低法测定非电解质溶质摩尔质量。 2.掌握SWC-Ⅱ型精密数字温度温差测量仪的使用方法。 二、实验原理 将一不挥发、非电解质溶于某溶剂时,溶液上方溶剂的蒸气压会比纯溶剂的蒸气压低,导致溶液的沸点升高,凝固点降低,并导致产生渗透压。对于稀溶液,这些物理量的变化仅仅与溶液中溶质的质点的数目有关,而与溶质的本性无关,故称这些性质为稀溶液的“依数性”。 在纯溶剂中加入不挥发非电解质后,形成二组分溶液。设纯溶剂的凝固点为T f *,溶液的凝固点为T f 。如果溶液很稀,溶液凝固时可认为是固态纯溶剂的化学势μ1S (T ,p )和溶液中的溶剂的化学势μ1L (T ,p ,x 1)相等,即: 上式改写为:: RT G RT p T p T x S m *111) ,(),(ln ?=-=μμ 式中,?G m -液态纯溶剂凝固为固态纯溶剂时的摩尔吉布斯能变化。对上式求微分,根据吉布斯-亥姆霍兹公式可得: 式中,?fus H m -纯溶剂的摩尔熔化焓。对上式积分,得: 由于T f *和T f 相差不大,可将?fus H m 看着常量 设:?T f = T f *-T f ,T f *T f ≈ (T f *)2,稀溶液时(x 2很小),将对数项展开: 则: *2*f B f f f fus m A B ()R T n T T T H n n ?=-=??+ (1-1) 式中,T f *-纯溶剂的凝固点,K ;T f -溶液的凝固点;ΔT f -溶液的凝固点降低值;n A -溶剂的物质的量,mol ; n B -溶质物质的量;Δfus H m -溶剂摩尔熔化焓,J/mol 。上式可改写成: *2*2 f B f f A B f B fus m A fus m ()()R T n R T T M m K m H n H ?≈?=?=?? (1-2) M A -溶质的摩尔质量,kg/mol ;m B -溶液的质量摩尔浓度,mol/kg ;K f -溶剂的凝固点降低常数,K ?mol -1?kg ,它是溶剂的特征常数,其数值只与溶剂的性质有关。 根据质量摩尔浓度的定义,由式(1-2)可得:f f /B B B A W M T K m W ?==,因此: f B B f A K W M T W ?= ?? (1-3) 式中,W B -溶质的质量,kg ;WA -溶剂的质量;MB -溶质的摩尔质量,kg/mol 。 由式(1-3)可知,已知溶剂的K f 后,只要测得ΔT f 即可计算MB 。一些常见溶剂的凝固点和凝固点降低常数列在表1-1中,其他溶剂的凝固点降低常数可在有关化学手册中查找。 表1-1 常见溶剂的凝固点和凝固点降低常数 溶剂 水 苯 环己烷 萘 三溴甲烷 醋酸
凝固点降低法测定物质的相对分子质量
华南师范大学实验报告学生姓名学号 专业化学(师范)年级班级 课程名称物理化学实验实验项目凝固点降低法测定物质的相对分子质量实验类型□验证□设计√综合实验时间2013年11月19日 实验指导老师肖信实验评分 【实验目的】 1、明确溶液凝固点的定义及获得凝固点的正确方法。 2、测定环己烷的凝固点降低值,计算萘的相对分子质量。 3、掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。 4、掌握贝克曼温度计的使用方法。 【实验原理】 物质的相对分子质量是了解物质的一个最基本且重要的物理化学数据,其测定方法有很多种。凝固点降低法测定物质的相对分子质量是一个简单又比较准确的方法,在溶液理论研究和实际应用方面都有重要意义。 凝固点降低法是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。由于溶质的加入,使固态纯溶剂从溶液中析出的温度T f比纯溶剂的凝固点T*f下降,其降低值△T f=T*f-T f与溶液的质量摩尔浓度成正比,即 △T f=K f m (1) 式中,△T f为凝固点降低值,m为溶液质量摩尔浓度,K f为凝固点降低常数,它与溶液的特性有关。 下表给出了部分溶剂的凝固点降低常数值。
若称取一定量的溶质W B(g)和溶剂W A(g),配成稀溶液,则次溶液的质量摩尔浓度m B为: m B=[W B/(M B W A)]×103 mol/kg (2) 式中,M B为溶质的相对分子质量,将式(2)代入式(1)整理得 M B=[(K f W B)/△T f W A] ×103 g/mol (3) 若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值△T f,即可计算溶质的相对分子质量M B。 通常测定凝固点的方法有平衡法和贝克曼法(或步冷曲线法)。本实验采用后者。其基本原理是将纯溶剂或溶液缓慢匀速冷却,记录体系温度随时间的变化,绘制出步冷曲线,用外推法求得纯溶剂或稀溶液中溶剂的凝固点。 通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。从相律看,溶剂与溶液的冷却曲线形状不同。对纯溶剂,固-液两相共存时,自由度f=1-2+1=0,冷却曲线出现水平线段,其形状如图1(1)所示。对溶液,固-液两相共存时,自由度f=2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段此时应按图1(3)所示方法加以校正。 (1)理想状态下的溶剂(2)有过冷的溶剂(3)有过冷的溶液 【仪器和试剂】 一、仪器:凝固点测定仪、贝克曼温度计、普通温度计、25mL移液管、
(完整版)凝固点降低法测定摩尔质量的思考题及答案
实验一 凝固点降低法测定摩尔质量 1、简述凝固点降低法测定摩尔质量的基本原理 答:化合物的分子量是一个重要的物理化学参数。非挥发性溶质溶解在溶剂中后,其稀溶液的蒸气压下降、沸点升高、冰点降低、渗透压等值只与溶质的分子数有关而与溶质的种类无关,这四种性质称为稀溶液的依数性。凝固点降低是依数性的一种表现。用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。稀溶液有依数性,稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中溶质B 的质量摩尔浓度的关系为:B f f f m K T T T =-=?*,式中T f * 为纯溶剂的凝固点,T f 为溶液的凝固点,m B 为溶液中溶质B 的质量摩尔浓度,f K 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。 已知某溶剂的凝固点降低常数K f 并测得溶液的凝固点降低值ΔT ,若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为: m B =1000W B /M B W A, 式中,M B 为溶质的分子量。代入上式,则: M B = 1000K f W B /ΔTf W A (g/mol) 因此,只要取得一定量的溶质(W B )和溶剂(W A )配成一稀溶液,分别测纯溶剂和稀溶液的凝固点,求得ΔT f ,再查得溶剂得凝固点降低常数,代入上式即可求得溶质的摩尔质量。 2、在凝固点降低法测定摩尔质量实验中,当溶质在溶液中有离解,缔合和生成络合物的情况下,对摩尔质量的测定值各有什么影响? 答:用凝固点降低法测分子质量靠的是依数性,即依靠溶质在溶液中粒子的数目。注意,依靠的是粒子的数目而不是分子的数目。如果发生缔合或解离,自然是导致所测得的粒子所并不等同于分子数,那测出来的相对分子质量自然有偏差。解离使粒子数增多,表观上是分子数增加,于是测得的分子量变小。缔合和生成络合物使粒子数减少,于是测得的分子量比实际的要大。 3、在凝固点降低法测定摩尔质量实验中,根据什么原则考虑加入溶质的量,太多太少影响如何? 答:根据溶液凝固点的下降值考虑加入溶质的量,加入的溶质的量约使溶液的凝固点降低0.5℃左右。加入太多,因为浓度大了,就不是稀溶液,就不满足依数性了。加入太少,会使溶液的凝固点降低不明显,测量误差会增大。 4、凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液? 答:凝固点降低公式适用于难挥发非电解质稀溶液和强电解质稀溶液。其次溶剂凝固点不应太高或太低,应在常温下易达到。如:水、苯、环己烷等。当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,会使测出来的相对分子质量,所以在电解溶液中不适用上式计算。 5、在凝固点降低法测定摩尔质量实验中,为什么会产生过冷现象?过冷太甚对结果有何影响?如何控制过冷程度? 答:过冷现象是由于溶解在溶液中的溶质在温度降到凝固点以后,没有晶体析出而达到过饱和状态的现象,原因一般是由于寒剂温度过低,降温过快或溶液中较干净,没有杂质晶核。 在冷却过程中,如稍有过冷现象是合乎要求的,但过冷太厉害或寒剂温度过低,则凝固热抵偿不了散热,此时温度不能回升到凝固点,在温度低于凝固点时完全凝固,就得不到正确的凝固点。因此,实验操作中必须注意掌握体系的过冷程度。对于溶液而言,过冷太甚还会导致溶剂大量析出,m B 变大,T f 变小,显然回升的最高温度不是原浓度溶液的凝固点,引起测量误差。 控制过冷程度的方法:调节寒剂的温度以不低于所测溶液凝固点3℃为宜;为了判断过冷程度,本实验先测近似凝固点;当溶液温度降至高于近似凝固点的0.5℃时,迅速取出冷冻管,擦去水后插入空气套管中,以防止过冷太甚。 6、在凝固点降低法测定摩尔质量实验中,为了提高实验的准确度,是否可用增加溶液浓度的办法来
凝固点降低法测定物质的摩尔质量_纯萘、环己烷
【实验目的】 ①测定环己烷的凝固点降低值,计算萘的分子量。 ②掌握溶液凝固点的测定技术。 ③技能要求:掌握冰点降低测定管、数字温差仪的使 用方法,实验数据的作图处理方法。 【实验原理】 1、凝固点降低法测分子量的原理 化合物的分子量是一个重要的物理化学参数。用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。稀溶液有依数性,凝固点降低是依数性的一种表现。稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中物质的摩尔分数的关系式为: ΔT f = T f * - T f = K f m B (1) *式中,T f * 为纯溶剂的凝固点,T f 为溶液的凝固点,m B 为溶液中溶质B 的质量摩尔浓度,K f 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。 已知某溶剂的凝固点降低常数K f,并测得溶液的凝固点降低值ΔT ,若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为: 3A B B B 10W M W m ?= mol/kg (2) 将(2)式代入(1)式,则: 3A f B f B 10W T W K M ??= g/mol (3) 表1 几种溶剂的凝固点降低常数值 求得ΔT f ,再查得溶剂的凝固点降低常数,代入(3)式即可求得溶质的摩尔质量。 * 当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于强电解质稀溶液。 2、凝固点测量原理 纯溶剂的凝固点是它的液相和固相共存时的平衡温度。若将纯溶剂缓慢冷却,理论上得到它的步冷曲线如图中的 A , 但但实际的过程往往会发生过冷现象,液体的温度会下降到凝固点以下,待固体析出后会慢慢放出凝固热使体系的温度回到平衡温度,待液体全部凝固之后,温度逐渐下降,如图中的B 。 图中平行于横坐标的CD 线所对应的温度值即为纯溶剂的凝固点 T f*。溶液的凝固点是该溶液的液相与纯溶剂的固相平衡共存的温度。溶液的凝固点很难精确测量,当溶液逐渐冷却时,其步冷曲线与纯溶剂不同,如图中III 、IV 。由于有部分溶剂凝固析出,使剩余溶液的浓度增大,因而剩余溶液与溶剂固相的平衡温度也在下降,冷却曲线不会出现“平阶”,而是出现一转折点,该点所对应的温度即为凝固点(III 曲线的形状)。当出现过冷时,则出现图IV 的形状,此时可以将温度回升的最高值近似的作为溶液的凝固点。 3、测量过程中过冷的影响
凝固点降低法测定摩尔质量的思考题及答案
第一部分:思考题 实验七十三凝固点降低法测定摩尔质量 1、简述凝固点降低法测定摩尔质量的基本原理 2、在凝固点降低法测定摩尔质量实验中,当溶质在溶液中有离解,缔合和生成络合物的情况下,对摩尔质量的测定值各有什么影响? 3、在凝固点降低法测定摩尔质量实验中,根据什么原则考虑加入溶质的量,太多太少影响如何? 4、凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液? 5、在凝固点降低法测定摩尔质量实验中,为什么会产生过冷现象?过冷太甚对结果有何影响?如何控制过冷程度? 6、在凝固点降低法测定摩尔质量实验中,为了提高实验的准确度,是否可用增加溶液浓度的办法来增加ΔT值?为什么? 7、什么是稀溶液依数性质?稀溶液依数性质和哪些因素有关? 8、测定溶液凝固点时若过冷程度太大对结果有何影响?两相共存时溶液系统和纯溶剂系统的自由度各为多少? 9、什么叫凝固点?凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液? 10、在凝固点降低法测定摩尔质量实验中,为什么要使用空气夹套?过冷太甚有何弊病? 11、在凝固点降低法测定摩尔质量实验中,实验测量成败的关键是什么? 12、在凝固点降低法测定摩尔质量实验中,加入萘的时候,不小心将萘附着在内管壁上,对实验结果有何影响? 13、在凝固点降低法测定摩尔质量实验中,为什么要先测近似凝固点? 14、当溶质在溶液中有解离、缔合、溶剂化和形成配合物时,测定的结果有何意义? 15、在凝固点降低法测定摩尔质量实验中,测定环已烷和萘丸质量时,精密度要求是否相同?为什
么? 16、用凝固点降低法测定摩尔质量在选择溶剂时应考虑哪些因素? 17、为什么纯溶剂和稀溶液的的凝固曲线不同? 18、在凝固点降低法测定摩尔质量实验中,寒剂温度的温度应控制在什么范围?为什么? 19、在凝固点降低法测定摩尔质量实验中,为什么实验所用的内套管必须洁净、干燥? 20、在凝固点降低法测定摩尔质量实验中,搅拌速度的控制是做好本实验的关键,在实验过程中怎样控制搅拌速度? 第二部分:参考答案 实验七十三 凝固点降低法测定摩尔质量 1、简述凝固点降低法测定摩尔质量的基本原理 答:化合物的分子量是一个重要的物理化学参数。非挥发性溶质溶解在溶剂中后,其稀溶液的蒸气压下降、沸点升高、冰点降低、渗透压等值只与溶质的分子数有关而与溶质的种类无关,这四种性质称为稀溶液的依数性。凝固点降低是依数性的一种表现。用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。稀溶液有依数性,稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中溶质B 的质量摩尔浓度的关系为:B f f f m K T T T =-=?* ,式中T f *为纯溶剂的凝固点,T f 为溶液的凝固点,m B 为溶液中溶质B 的质量摩尔浓度,f K 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。 已知某溶剂的凝固点降低常数K f 并测得溶液的凝固点降低值ΔT ,若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为: m B =1000W B /M B W A, 式中,M B 为溶质的分子量。代入上式,则:
凝固点降低法测定相对分子质量
凝固点降低法测定相对分子质量 一、实验目的 1、了解凝固点降低法测定相对分子质量的原理,计算萘的相对分子质量; 2、掌握溶液凝固点的测定技术; 3、通过本实验加深对稀溶液依数性的理解。 二、实验原理 理想稀薄溶液具有依数性。凝固点降低就是依数性的一种表现。即对一定量的某溶剂,其理想稀薄溶液凝固点下降的数值只与所含溶质的粒子数目有关,而与溶质的特性无关。 1、凝固点降低法测相对分子质量的原理 假设溶质在溶液中不发生缔合和分解,也不与固态纯溶剂生成固溶体,则由热力学理论出发,可以导出理想稀薄溶液的凝固点降低?T f 与溶质质量摩尔浓度m B 之间的关系: ΔT f =T f * - T f = K f m B (1) 式中,T f *为纯溶剂的凝固点;T f 为溶液的凝固点;K f 为溶剂的质量摩尔凝固点降低常数,仅与溶剂性质有关;m B 为溶液中溶质B 的质量摩尔浓度。 若称取一定量的溶质W B (g)和溶剂W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为: 由此可导出计算溶质摩尔质量M B 的公式 若已知K f ,测得 ?T f ,便可用(3)式求得M B 。 2、凝固点测量原理 (1)纯溶剂的凝固点测量 纯溶剂的凝固点是其液相和固相共存时的平衡温度。若纯溶剂缓慢冷却,理论上得到的步冷曲线图1。实际实验过程中,纯溶剂缓慢冷却过程中常会发生过冷现象,液体的温度会降到凝固点以下,待固体析出后会慢慢放出凝固热使体系的温度回到平衡温度。液体全部凝固后温度逐渐下降。如图2中纯溶剂步冷曲线。两种情况下,平行于横坐标的线所对应的温度值即为纯溶剂的凝固点T f *。 (2)溶液的凝固点测量 溶液的凝固点是该溶液的液相与纯溶剂的固相平衡共存的温度。对于稀溶液来说,由于溶剂析出后,剩余溶液的浓度逐渐增大,因而剩余溶液与溶剂固相平)2()(1013??××=kg mol W M W m A B B B )3(103××?=A f B f B W T W K M
凝固点降低法测分子量
实验二 凝固点降低法测分子量 1.摘要 1888年,E .Beckmann [1]首先设计出了精确测量装置,并沿用至今。1903年,他又设计出了电磁搅拌器。随后,贝克曼温度计可读到0.001K ,按误差理论分析,分子量测量的精度取决于温度读数的精度[2],测得分子量的误差约为3%。现代则采用各种温度传感器。 据凝固点降低法,测苯( C 6H 6)? 萘(C 10H 8)体系的凝固点,求得萘的分子量。 固体溶剂与溶液成平衡时的温度称溶液的凝固点。在无固溶体形成时,稀溶液的凝固点较纯溶剂的凝固点低,简称凝固点降低。凝固点降低值?T f 由下述公式给出: f A B B f K W M W ) 1000 ( )( = 表2.2..1纯溶剂凝固点降低常数的比较 关键词:凝固点降低 过冷 反推法 分子量 温度传感器 2. 仪器与药品 凝固点测定仪 1套 压片机 1台 0.1?C 分度水银温度计 1支 25mL 移液管 1支 JDW —3P 精密电子温差测量仪 1台带PC 串行接口可接微机 环已烷(C ?P )萘(C ?P )碎冰 (2.2.1)
3.预习提问 (1) 什么叫凝固点?凝固点降低法测分子量是研究哪一类相平衡体系(析出纯溶剂还是固溶体)?能否用于电解质溶液?你还知道哪些测分子量的方法。 (2) 纯溶剂和溶液的步冷曲线有什么差异?为什么会出现过冷现象?过冷现象对于本实验有无利弊? (3)为什么使用空气夹套?搅拌在实验中起何作用? (4) 称量纯溶剂及溶质时,精密度要求应否相同? (5) 如何设置纯溶剂与溶液凝固点的参照点?电子数显仪置零的意义何在? 4.操作注意 5.数据处理 (1)溶剂的密度
