烟草中游离氨基酸的测定

烟草中游离氨基酸的测定
王娟,张华,郭国宁,李琳
(湖北中烟工业有限责任公司技术中心,湖北武汉430051)
摘要 [目的]探讨用氨基酸自动分析仪建立一种测定烟草中游离氨基酸的方法。[方法]用氨基酸分析仪法测定烟叶中的游离氨基酸并对这些游离氨基酸分别定性定量检测。[结果]氨基酸分析仪法能够分离检测烟叶中的23种游离氨基酸(除了蛋氨酸),其回收率均在78.86%~101.46%,标准偏差均在8%以内,具有较好的重现性和回收率。最优的氨基酸提取方法是:样品过60目筛,用0.005mol/L 的盐酸超声萃取30m i n 。对不同的烟叶样品进行检测,发现不同种类烟叶所含有的氨基酸具有一定的规律性。烤烟和香料烟中所含的游离氨基酸以Pro 为主,而白肋烟以Asn 为主;只有白肋烟中含有氨基酸Tau ,而烤烟和香料烟里面几乎检测不到。[结论]氨基酸分析仪法是测定烟叶中游离氨基酸较好的方法。关键词 烟草;游离氨基酸;氨基酸分析仪
中图分类号 S572 文献标识码 A 文章编号 0517-6611(2008)26-11413-04
Detectio n of Free Amino Aci ds i n Tobacco WANG Juan et al (Ch i na Tobacco H ube i Industr i a lCo .lt d .R &D Center ,W uhan ,H ube i 430051)Abstract [Objecti ve]A method establi shed f or t he de t ecti on of free a m i no ac i ds i n t obacco usi ng a m i no aci d ana l yzer was discussed .[M e t hod]The free a m i no aci ds in tobacco were de t ected using t he a m i no aci d analyzer and t hese free a m i no aci dswere detected qualitati vel y and quantit a ti ve l y resp .[R es u lt ]23ki nds of free a m i no aci ds exceptm et hioni ne i n t obacco l eaves were separated and detected by the a m i no aci d anal y z er m et hod ,t he reproduci b ilit y were bet w een 78.86%and 101.46%,and the standard dev i ati on va l uesw ere bel ow 8%.The me t h od had better reproduc i bility and recovery .The optm i u m ex traction m et hod o f a m i no aci d w as as f o ll ows :t he sa mples w ere sieved by 60m e s hes trea t m ent and treated by u l trasonic extracti on w it h 0.005mo l/L hydroch l oride for 30m i n .The contents o f a m i no aci ds i n different varie ti es of tobacco leaves s ho w ed s ome l a w after t he det ecti ng tobacco sa mples .The f ree a m i no aci d cont a i ned i n flue cured tobacco and orient a l tobacco w asma i nl y pro li ne ,while t hat i n bur l ey tobacco was ma i nl y as paragine .The tauri ne was onl y cont a i ned i n burley tobacco and itw as nearl y not detected i n fl ue cured tobacco and orient a l tobacco .[Conc l usion]The a m i no aci d ana l yzerm et hod was t he bett er me t hod for detec ti ng t he free am i no aci ds i n t obacco l eaves .K ey words Tobacco ;F ree a m i no ac i d ;Am i no ac i d analyzer
基金项目 国家烟草专卖局资助项目。
作者简介 王娟(1979-),女,湖北武汉人,硕士,工程师,从事天然植
物烟用研究。
收稿日期 2008 06 20
烟草中的氨基酸是重要的致香前体物质,在烟草调制、醇化或发酵、加工乃至燃烧过程中,游离氨基酸与还原糖之间可发生酶催化及非酶催化的棕色化反应,生成多种具有蒸煮、烤香、爆米花等不同香味特征的杂环化合物[1-2]
。某些氨基酸如苯丙氨酸还可自身分解成香味化合物(如苯甲醇、苯乙醇等)。氨基酸在烟草生长和加工(如调制、陈化、发酵、加料等)的不同阶段也会发生不同的变化,从而对烟草的品质产生较大影响。一般说来,适量的氨基酸有助于提高烟气劲头和增加丰满度。若氨基酸含量太高,烟气辛辣、味苦、刺激性强烈,这是由于在燃烧过程中氨基酸通常生成NH 3等含氮化合物,个别氨基酸还产生H CN 等危害健康的烟气成分;若氨基酸含量太低,烟气则平淡无味缺少丰满度
[3-5]。因此
对不同时期氨基酸含量及其变化情况的分析,可为卷烟配
方、烟叶加料、调制、发酵程度等提供理论指导。建立准确可靠的烟叶中游离氨基酸的分析方法,无疑是一项非常有意义且十分必要的工作。
氨基酸分析,按分离方法可分为纸色谱法、离子交换法、反相高效液相色谱法、气相色谱法等;按检测方法可分为化学分析法、电化学方法(包括电导检测、安培检测)、分光光度法(包括可见光分光光度法、紫外分光光度法和荧光分光光度法)等;按衍生反应的先后,可分为柱前衍生和柱后衍生法。目前,文献上报道较多的测定烟草中氨基酸的方法主要
是分光光度法[6]和柱前衍生反相高效液相色谱法[4,7-8]
。分光光度法只能测定烟草中游离氨基酸的总量;高效液相色谱
法虽然能够对不同种类的氨基酸定性定量,但是所测定的氨基酸的种类最多只有15~17种,且无法将H i s 和G l y 分开[4]
。笔者用氨基酸自动分析仪建立了一种测定烟草中游离氨基酸的方法,该方法能够对烟草中所含有的23种游离氨基酸分别定性定量检测。1 材料与方法1.1 试验材料
1.1.1 仪器。旋风式样品磨(60目);万分之一天平(德国赛多利斯);移液器(吉尔森);超声波(上海弘兴);试管浓缩仪(东京理化器械株式会社);氨基酸自动分析仪(德国S YKAM );0.45 m 滤膜(上海安谱)。
1.1.2 试剂。去离子水;盐酸(分析纯,上海);样品稀释液(德国SYKA M );不同p H 和离子强度的洗脱液(德国S YKAM );茚三酮溶液(德国S YKA M );混合氨基酸标准溶液(德国SYK AM )。1.2 试验方法 将烟叶置于40 下干燥2h ,粉碎过筛,混合均匀后,密封保存备用。称取1g 样品(精确至0.0001g)于100m l 磨口三角瓶中,加入50.0m l 一定浓度的盐酸溶液,塞上塞子、超声、过滤。准确移取2m l 滤液浓缩蒸干(温度不超过60 ),加入1m l 样品稀释液,摇匀。溶液经0.45 m 滤膜过滤后上机分析。用外标法测定样品溶液中各游离氨基酸的含量。其中脯氨酸在440nm 波长下检测,其他氨基酸在570n m 波长下检测。
1.3 仪器条件 分析柱温度:37 ;反应管温度:130 ;进样量:50 ;l 缓冲溶液:不同p H 值的柠檬酸锂缓冲溶液。2 结果与分析
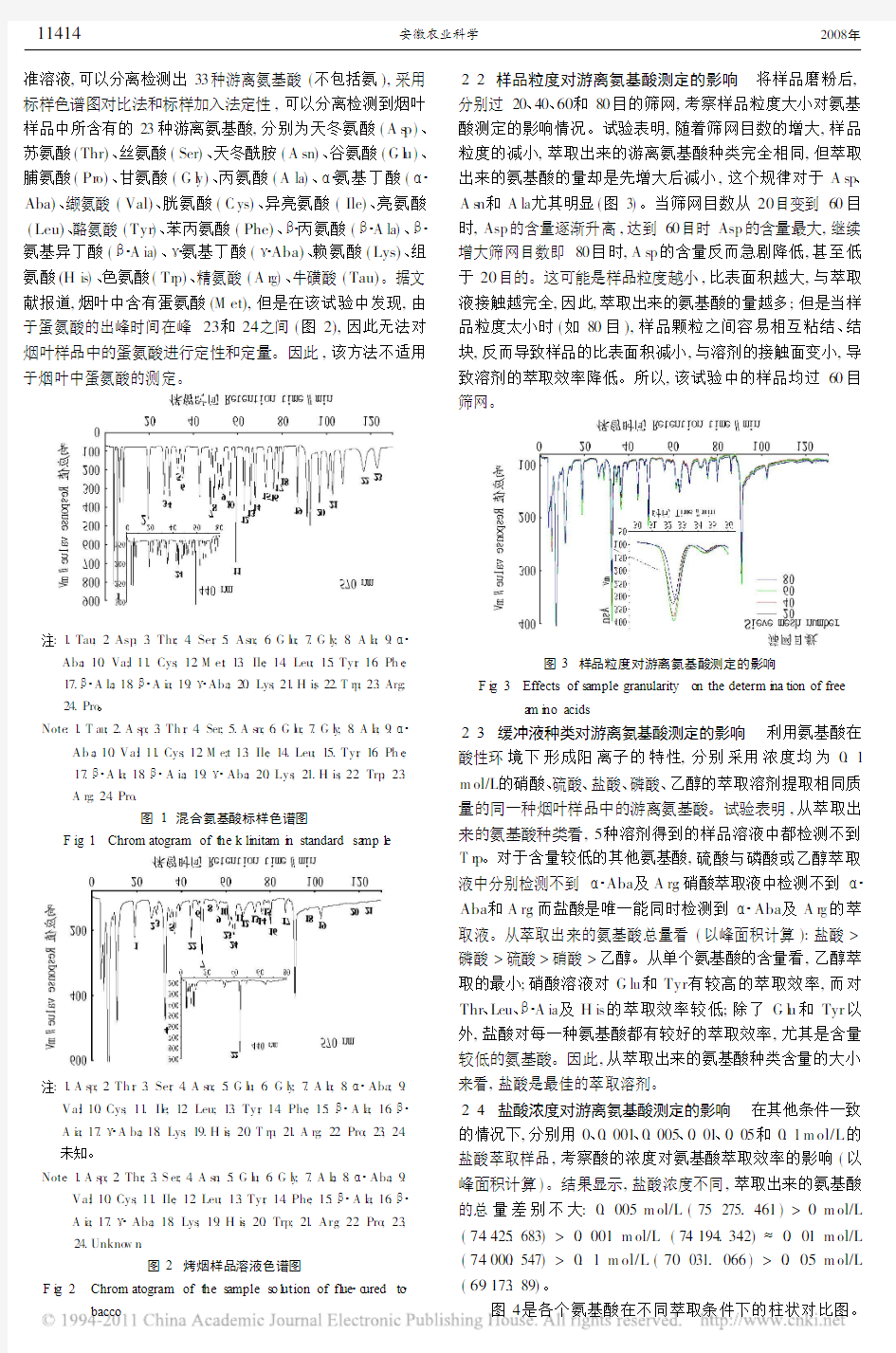
2.1 氨基酸色谱图 图1、2分别是混合氨基酸标样以及样品溶液的氨基酸分析色谱图。用氨基酸自动分析仪分析标
安徽农业科学,Jou r n al ofAnhu iAgr.i Sc.i 2008,36(26):11413-11416责任编辑 罗芸 责任校对 李洪
准溶液,可以分离检测出33种游离氨基酸(不包括氨),采用标样色谱图对比法和标样加入法定性,可以分离检测到烟叶样品中所含有的23种游离氨基酸,分别为天冬氨酸(A s p )、苏氨酸(Thr)、丝氨酸(Ser)、天冬酰胺(A sn)、谷氨酸(G l u )、脯氨酸(Pr o)、甘氨酸(G l y)、丙氨酸(A la)、 氨基丁酸( Aba)、缬氨酸(Val)、胱氨酸(C ys)、异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr )、苯丙氨酸(Phe)、 丙氨酸( A la)、 氨基异丁酸( A ia)、 氨基丁酸( Aba)、赖氨酸(Lys)、组氨酸(H is)、色氨酸(Tr p)、精氨酸(A r g)、牛磺酸(Tau)。据文献报道,烟叶中含有蛋氨酸(M et),但是在该试验中发现,由于蛋氨酸的出峰时间在峰23和24之间(图2),因此无法对烟叶样品中的蛋氨酸进行定性和定量。因此,该方法不适用
于烟叶中蛋氨酸的测定。
注:1.Tau ;2.Asp ;3.Thr ;4.Ser ;5.As n ;6.G l u ;7.G l y ;8.A l a ;9.
Aba ;10.Va;l 11.Cys ;12.M e;t 13.Ile ;14.Leu ;15.Tyr ;16.Ph e ;17. A la ;18. A i a ;19. Aba ;20.Lys ;21.H is ;22.T rp ;23.Arg ;24.Pro 。
Note :1.T au ;2.A s p ;3.Th r ;4.Ser ;5.A s n ;6.G l u ;7.G l y ;8.A l a ;9.
Ab a ;10.Va;l 11.Cys ;12.M e;t 13.Ile ;14.Leu ;15.Tyr ;16.Ph e ;17. A l a ;18. A ia ;19. Aba ;20.Lys ;21.H is ;22.Trp ;23.A rg ;24.Pro .
图1 混合氨基酸标样色谱图
F ig .1 Chro m atogra m of t he k li nita m i n sta ndard sa mp l
e
注:1.A s p ;2.Th r ;3.Ser ;4.A s n ;5.G l u ;6.G l y ;7.A l a ;8. Aba ;9.
Va;l 10.Cys ;11.Il e ;12.Leu ;13.Tyr ;14.Phe ;15. A l a ;16. A i a ;17. A ba ;18.Lys ;19.H i s ;20.T rp ;21.A rg ;22.Pro ;23,24.未知。
Note :1.A s p ;2.Thr ;3.S er ;4.A s n ;5.G l u ;6.G l y ;7.A l a ;8. Aba ;9.
Va;l 10.Cys ;11.Ile ;12.Leu ;13.Tyr ;14.Phe ;15. A l a ;16. A i a ;17. Aba ;18.Lys ;19.H i s ;20.Trp ;21.Arg ;22.Pro ;23,24.Unkno w n .
图2 烤烟样品溶液色谱图
F i g .2 Chro m atogra m of t he s a mple s o l uti on of fl ue c ured to
bacco
2.2 样品粒度对游离氨基酸测定的影响 将样品磨粉后,分别过20、40、60和80目的筛网,考察样品粒度大小对氨基酸测定的影响情况。试验表明,随着筛网目数的增大,样品粒度的减小,萃取出来的游离氨基酸种类完全相同,但萃取出来的氨基酸的量却是先增大后减小,这个规律对于A sp 、A s n 和A la 尤其明显(图3)。当筛网目数从20目变到60目时,Asp 的含量逐渐升高,达到60目时Asp 的含量最大,继续增大筛网目数即80目时,A sp 的含量反而急剧降低,甚至低于20目的。这可能是样品粒度越小,比表面积越大,与萃取液接触越完全,因此,萃取出来的氨基酸的量越多;但是当样品粒度太小时(如80目),样品颗粒之间容易相互粘结、结块,反而导致样品的比表面积减小,与溶剂的接触面变小,导致溶剂的萃取效率降低。所以,该试验中的样品均过60目筛网。
图3 样品粒度对游离氨基酸测定的影响
F i g .3 Effects of s a mple granularity o n the deter m i na tio n of free
a m i no a cids
2.3 缓冲液种类对游离氨基酸测定的影响 利用氨基酸在酸性环境下形成阳离子的特性,分别采用浓度均为0.1m ol/L 的硝酸、硫酸、盐酸、磷酸、乙醇的萃取溶剂提取相同质量的同一种烟叶样品中的游离氨基酸。试验表明,从萃取出来的氨基酸种类看,5种溶剂得到的样品溶液中都检测不到
T r p 。对于含量较低的其他氨基酸,硫酸与磷酸或乙醇萃取液中分别检测不到 Aba 及A rg ;硝酸萃取液中检测不到 Aba 和A rg ;而盐酸是唯一能同时检测到 Aba 及A r g 的萃取液。从萃取出来的氨基酸总量看(以峰面积计算):盐酸>磷酸>硫酸>硝酸>乙醇。从单个氨基酸的含量看,乙醇萃取的最小;硝酸溶液对G lu 和Tyr 有较高的萃取效率,而对Thr 、Leu 、 A ia 及H is 的萃取效率较低;除了G l u 和Tyr 以外,盐酸对每一种氨基酸都有较好的萃取效率,尤其是含量较低的氨基酸。因此,从萃取出来的氨基酸种类含量的大小
来看,盐酸是最佳的萃取溶剂。
2.4 盐酸浓度对游离氨基酸测定的影响 在其他条件一致的情况下,分别用0、0.001、0.005、0.01、0.05和0.1m ol/L 的
盐酸萃取样品,考察酸的浓度对氨基酸萃取效率的影响(以峰面积计算)。结果显示,盐酸浓度不同,萃取出来的氨基酸的总量差别不大:0.005m ol/L (75275.461)>0m ol/L (74425.683)>0.001m ol/L (74194.342) 0.01m ol/L (74000.547)>0.1m ol/L (70031.066)>0.05m ol/L (69173.89)。
图4是各个氨基酸在不同萃取条件下的柱状对比图。
11414
安徽农业科学 2008年
按照各氨基酸响应值(峰面积)的大小,将其分为3类:第一类是峰面积小于或等于500的氨基酸(包括G ly 、 Aba 、Cys 、Il e 、 A l a 、Lys 、A rg);第二类是峰面积在1000到6000之间的氨基酸(包括Asp 、Thr 、Ser 、G l u 、A la 、V al 、M et 、Le u 、Tyr 、Phe 、 A i a 、 A ba 、H i s);第三类是峰面积大于15000的氨基酸(包括A sn 、Pr o)。由图4可见,对于含量较大的氨基酸,如第二类和第三类,盐酸浓度对氨基酸萃取量的影响不大,仅对Leu 有明显差别:即0m ol/L 萃取出来的量最多,0.05和0.1m ol/L 萃取出来的量最少,而0.001、0.005和0.01m ol/L 的相差不大。但是对于含量较低的氨基酸,即第一类氨基酸,盐酸浓度对氨基酸的萃取量有较大影响:在0、0.05和0.1m ol/L 3种浓度的盐酸萃取液中检测不到T r p ,而在0.01
m ol/L 的盐酸萃取液中检测不到A r g 。考虑到尽可能多地萃取出不同种类的游离氨基酸,以上4种浓度的盐酸均不适合
作萃取溶剂。由图4a 可知,0.001m ol/L 的萃取溶剂对G ly 的萃取效率高于0.005m ol/L 的;但对于 Aba 和Lys 两种氨基酸,0.005m ol/L 的萃取效率又高于0.001m ol/L 的;而对于其他几种氨基酸,两种浓度的萃取溶剂差别不大。同时,采用SPSS 软件对这两种方法进行统计分析,通过对配对样本进行t 检验,得出这两种方法的显著水平为0.275,该值大于0.05,所以这两种方法的差异不显著。因此,0.001~0.005m ol/L 浓度范围内的盐酸都适合作为样品的萃取溶剂。该试验中采用0.005m ol/L 的盐酸作为萃取溶剂。2.5 萃取时间对游离氨基酸测定的影响
不同的超声萃取
图4 盐酸浓度对游离氨基酸测定的影响
Fig .4 Effects of hydroc hlori c aci d co ncentra tio n o n the deter m i na tio n o f free a m ino acids
时间15、30、45和60m i n 对各氨基酸萃取量略有影响。结果
显示,当萃取时间为15m i n 时,大多数氨基酸的绝大部分已经萃取出来;当超声时间延长至30m i n 时,氨基酸萃取量增大,尤其是Lys 、A r g 、A sn 、Pr o 4种氨基酸较为明显;继续延长超声时间,除了Ile 、 A ba 的萃取量在60m i n 有明显增加外,其他氨基酸变化不明显。由此可见,当萃取时间为30m in 时,各氨基酸基本已经提取完全。结合时间成本考虑,选择超声时间30m i n 为最佳萃取时间。2.6 工作曲线、重复性与回收率 分别制备6个不同浓度的同一样品的测试液,在氨基酸分析仪上检测,得到每种氨基酸的相对标准偏差(表1)。表1显示,所有氨基酸的标准
表1 相对标准偏差
Tabl e 1 Relati ve standard deviati on
氨基酸Am i no aci d 标准偏差 %S t an dard devi ati on
氨基酸Am i no aci d
标准偏差 %Standard deviati on
T au 2.58Il e 5.97Asp 4.81Leu 2.09Th r 0.38Tyr 4.58Ser 1.30Ph e 3.43Asn 1.67 A l a 7.68G l u 4.94 A i a 1.66Pro 2.33 Aba 0.66G l y 6.43Lys 0.90A la 1.66H i s 2.44 Aba 0.63Trp 7.96Val 2.49A rg
7.92
Cys
5.78
表2 回归方程及检测限
Ta ble 2 R egressi on equati on and detecti on li m it 氨基酸Am i no acid 回归方程
Regressi on eq uati on R
2
空白回收率 %B l ank recovery rate 样品回收率 %Sa mp le recovery rate Tau Y =984.44X +138.470.
999999.08
92.56Asp Y =1362.65X +48.680.999998.42101.46Thr Y =1093.41X +18.650.999998.2297.07Ser Y =1265.97X +18.870.999998.0190.00Asn Y =520.64X +2.880.999997.64110.86G l u Y =884.71X +4.000.999998.5586.31Pro Y =238.04X +15.990.999996.41103.89G l y Y =1768.26X +6.280.999997.2496.64A l a Y =1518.24X +10.670.999995.4199.59 Aba Y =1321.62X +33.220.999996.9791.65Val Y =1124.00X -2.370.999999.8794.12Cys Y =609.83X +36.380.9999100.2994.92Ile Y =1005.48X +7.330.999999.1178.86Leu Y =995.39X -15.470.999995.4895.79Tyr Y =710.17X +57.220.999996.2598.06Phe Y =754.33X +8.360.999997.6585.00 A la Y =435.82X -10.680.999897.9495.32 A s ba Y =380.16X -13.360.999997.94100.00 Aba Y =1076.60X +28.650.999998.5088.97Lys Y =912.42X -31.800.999997.9693.41H is Y =811.87X +107.860.999897.1988.40Trp
Y =
416.77X -150.58
0.
999
9
98.
74
85.
34
注:Y 为峰面积(mV s);X 为浓度( g/m l)。 Not e :Y .Peak area(mV s);X .Con centrati on( g/m l ).
偏差都在8%以内,除了响应值特别低的几种氨基酸,如Ile 、
11415
36卷26期 王娟等 烟草中游离氨基酸的测定
G l y、Cys、 A la、T r p、A r g,其他氨基酸的标准偏差都在5%以内,说明该方法具有较好的重复性。
将5个不同浓度的混合氨基酸标准溶液分别进行检测,用各氨基酸的峰面积对应其相应的浓度进行回归分析,得到回归方程及其相关系数(表2)。结果表明,在样品中氨基酸的含量范围内,响应值与对应的各氨基酸的浓度呈良好的线性关系。采用标样加入法测定空白溶液和样品溶液中各氨基酸的回收率(表2)。空白溶液中样品的回收率在95.41% ~100.29%,且多数氨基酸的回收率在97%~99%。而样品溶液中23种氨基酸的回收率均在75.71%~101.46%,除了Il e和Leu以外,其他氨基酸的回收率均在85%以上,结果令人满意。
2.7 样品检测 选取3种有代表性的烟叶:烤烟、白肋烟和香料烟,分别测定其中所含的23种游离氨基酸的含量(表3)。表3显示,只有白肋烟中含有氨基酸Tau,而烤烟和香料烟里面几乎检测不到。对于其他氨基酸,大部分的游离氨基酸都是白肋烟中的含量高于烤烟和香料烟中的,以氨基酸A s p、A sn、G ly、Ile、 A la和 Aba尤为显著;而只有少数氨基酸,如Pr o、Leu、Tyr、Phe、 A ia是烤烟高于白肋烟。烤烟和香料烟中所含的游离氨基酸以Pr o为主,而白肋烟中以Asn 为主。这种规律性对烟叶的加工调制和卷烟配方、研究美拉德反应、提高烟叶内在品质都具有一定的指导意义。
表3 各类氨基酸在样品中的含量
Tabl e3 Content o f a m i no aci ds i n sa mples m g/g
氨基酸Am i no aci d
烤烟F l ue cu red tobacco
123
白肋烟Bu rley t ob acco
123
香料烟Orie n tal tobacco
12
T au---0.01900.02200.0237--Asp0.17870.11710.08263.19463.28634.20140.10220.4069 Th r0.21090.18110.09590.26720.25310.27690.06870.1051 Ser0.07680.04950.03470.61810.60390.37990.01920.0624 Asn1.76331.00101.063513.390021.26407.82720.66412.7806 G l u0.08740.05110.04540.72080.75981.89760.03900.1304 Pro4.86973.82182.29332.61221.73008.70733.63991.2434 G l y0.01720.01240.01020.19360.21030.21310.01320.0337 A la0.24720.20280.13820.68780.77240.95690.21090.1591 Aba0.00540.00520.00410.00330.00270.00550.00380.0056 Val0.05930.04640.02240.15010.13230.17620.03460.0843 Cys0.00910.00620.00870.01790.02360.07490.00330.0118 Il e0.00150.0010-0.05470.04280.07650.00110.0191 Leu0.19940.18630.09330.08590.08020.14320.04830.0624 Tyr0.13900.10530.05760.04520.07850.11510.04940.2383 Phe0.13860.09290.05510.42060.58250.45200.09560.2715 A l a0.00790.00520.00560.24430.23170.13380.00710.0230 A i a0.32040.27240.11120.01280.01210.02480.03900.0658 Aba0.05860.03560.02960.45740.49031.00480.03300.0837 Lys0.01390.01290.00760.24600.25910.33140.00600.0483 H i s0.10230.05370.03720.21980.32890.28740.02360.1068 T rp0.09790.0557-0.18570.32340.2901--
A rg0.02290.02010.01410.18580.19270.2880-0.0596 注: - 表示未检出;1、2、3分别表示不同种类的烟草样品。
Note:-st ands for not d etected.1,2and3stan d f or d i ff erent k i nds of t obacco sa mp l es.
3 结论
目前已有文献报道的烟叶中氨基酸的测定方法仅能测定烟叶中15~17种氨基酸,而该试验建立的一种用氨基酸分析仪法测定烟叶中游离氨基酸的方法,能够分离检测烟叶中的23种游离氨基酸(除了蛋氨酸),摸索出来的最优的氨基酸提取方法是:样品过60目筛,用0.005m ol/L的盐酸超声萃取30m i n,该方法具有较好的重现性和回收率。对不同样品进行检测,发现烟叶种类不同,所含有的氨基酸有一定的规律性,即烤烟和香料烟中所含的游离氨基酸以Pr o为主,而白肋烟以A sn为主;只有白肋烟中含有氨基酸Ta u,而烤烟和香料烟里面几乎检测不到。参考文献
[1]HEC HT S S.N itroge nous co mpounds i n ci garette s m oke and thei r possi b le
p recursors[J].Rec Adv Tob S c,i1997,3:59-93.
[2]BURTO N H R.E ffect of curi ng on the che m i cal co mpositi on of burl ey t o
baccos[J].RecAdv Tob Sc,i1983,9:91-153.
[3]杨德廉,王树声,王宝华,等.烟草中氨基酸变化规律及其与烟叶品质
关系研究进展[J].中国烟草科学,1998(3):11-13.
[4]李丹,黄龙,朱巍,等.反相高效液相色谱法测定烟叶中的游离氨基酸
[J].烟草科技,2003(2):20-24.
[5]肖协忠.烟草化学[M].北京:中国农业科学出版社,1997.
[6]王文平.植物样品中游离氨基酸总量测定方法的改进[J].北京农学院
学报,1998,13(3):9-13.
[7]冯雷,陈章玉,王保兴,等.柱前衍生化反相高效液相色谱法测定烟草
中的游离氨基酸[J].云南大学学报:自然科学版,2003(S1):241-245.
[8]王文领,郝辉,李彦周,等.制丝过程中烤烟内游离氨基酸含量的变化
[J].烟草科技,2005(9):20-28.
11416 安徽农业科学 2008年
氨基酸检测
氨基酸检测 氨基酸是构成蛋白质的基本单位,在食品、医药、 饲料添加剂、化妆品及工农业等诸多方面有着广泛 的应用。随着生物工程技术产业的发展逐渐成为21 世纪全球的主要产业之一,氨基酸的需求量越来越 大,品种变更越来越快,工艺改革越来越新。 科标检测中心在氨基酸检测方面具有资深经验,为 广大客户提供专业、全面的检测服务,并出具权威的检测报告。 1、脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺 2、芳香族氨基酸:苯丙氨酸、酪氨酸 3、杂环族氨基酸:组氨酸、色氨酸 4、杂环亚氨基酸:脯氨酸 检测对象 豆类谷物、药材、鱼类、肉类、饲料、食用菌类、保健品、化妆品等等。 检测项目 甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、丝氨酸、酪氨酸、蛋氨酸、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸、胱氨酸、色氨酸、谷氨酰胺、天冬酰胺。 相关标准 标准代号标准名称 GB/T14924.10-2008实验动物配合饲料氨基酸的测定 GB/T15399-1994饲料中含硫氨基酸测定方法--离子交换色谱法 GB/T15400-1994饲料中色氨酸测定方法--分光光度法 GB/T17419-1998含氨基酸叶面肥料 GB/T18246-2000饲料中氨基酸的测定 科标检测致力于推动检测行业的规范化、科学化发展,秉承“敢为人先、开拓创新、同心协力、勇承重载”
GB/T18654.11-2008 养殖鱼类种质检验第11部分:肌肉中主要氨基酸含量的测定 GB/T23296.12-2009 食品接触材料高分子材料食品模拟物中11-氨基十一酸的测定高效液相色谱法 GB/T28722-2012氨基酸中铁和铅的测定原子吸收光谱法GB/T5009.124-2003食品中氨基酸的测定 GB/T8314-2013茶游离氨基酸总量的测定 NY1429-2010含氨基酸水溶肥料 NY/T1618-2008鹿茸中氨基酸的测定氨基酸自动分析仪法NY39-1987饲料级L-赖氨酸盐酸盐 NY/T56-1987谷物籽粒氨基酸测定的前处理方法 QB/T2409-1998化妆品中氨基酸含量的测定 QB/T4356-2012黄酒中游离氨基酸的测定高效液相色谱法 SN/T0930-2000 进出口花粉中全氨基酸的测定方法氨基酸自动分析仪法 YC/T282-2009烟叶游离氨基酸的测定氨基酸分析仪法 YC/T448-2012 烟草及烟草制品游离氨基酸测定离子色谱-积分脉冲安培法 科标检测致力于推动检测行业的规范化、科学化发展,秉承“敢为人先、开拓创新、同心协力、勇承重载”
实验 一游离氨基酸测定
实验一:游离氨基酸测定 实验学时:3学时 实验类型:验证 实验要求:必修 一、实验目的 1、掌握甲醛法测定游离氨基酸的测定原理和方法。 二、实验内容 使用甲醛滴定法测定游离氨基酸 三、实验原理 氨基酸中的NH2基的pK值常在9.0以上,不能和NaOH标准溶液直接滴定,需使这些含氮化合物(包括有机含氮化合物)都转化为氨态氮,然后进行测定。但可以用甲醛法测量。在pH中性和常温条件下,甲醛迅速与氨基酸中的 -氨基相互作用,使滴定终点移至pH值9.0左右,可以用酚酞批示剂,以NaOH标准溶液来滴定NH3+基上的H+,每释放一个氢离子,就相当于有一个氨基氮 R-NH3+→H++R-NH2 R-NH2+2HCHO→R-N(CH2H)2 4 NH4+ + 6 HCHO == (CH2)6N4H+ + 3 H+ + 6 H2O 滴定的结果表示游离a—氨基的含量,其精确度可达理论量的90%。如果样品中只某一种已知的氨基酸,从甲醛法结果可求得该氨基酸的含量。如果样品中是多种氨基酸的混合物(如蛋白水解液),则测定结果不能作为氨基酸的定量依据。一般常用此法测定蛋白质水解程度,随着水解程度的增加滴定值增加,当水解完全后,滴定值即保持恒定。甲醛滴定法采用的甲醛浓度为2.0-3.0mol/L,即滴定后最终浓度为6 %-9 %。 四、实验组织运行要求 集中授课形式 五、实验条件 1.试剂 (1)40%中性甲醛溶液: 在50mL 36 % ~ 37 %甲醛中加入5滴5g/L酚酞乙醇溶液,然后 用0.2mol/L NaOH溶液滴定到微红(使用前需重新中和) (2)酚酞指示剂: 5g/L酚酞的50%乙醇溶液 (3)0.01mol/L氢氧化钠标准溶液 (4)10%(体积分数)乙酸溶液 2.玻璃仪器 ⑴50ml容量瓶 ⑵20ml移液管 ⑶碱式滴定管 ⑷50ml量杯 ⑸250ml三角瓶 六、实验步骤 (1)样品处理称取试样0.2g(准确至1mg),置入研钵中,加5ml 10%乙酸溶液研磨至均匀,用水转移到50mL容量瓶中并定容至刻度,摇匀、过滤(弃去最初部份溶液)。 (2)样品滴定在三角瓶中加入2mL样品滤液,加水4mL,3滴酚酞指示剂,摇匀后用0.01mol/L NaOH标准溶液滴定到微红色。然后加入2mL中性甲醛溶液,摇匀,放置片刻,再用0.01mol/L NaOH标准溶液滴定回到微红色中点,记下甲醛加入后样品消耗NaOH标准溶液的体积。同样,取6mL水按以上操作做空白实验。 七、计算
氨基酸含量测定
茚三酮比色测定氨基酸含量 一、实验原理 氨基酸在碱性溶液中能与茚三酮作用,生成蓝紫色或黄色化合物(除脯氨酸外均有此反应),可用吸光光度法测定。生成的蓝紫色或黄色化合物颜色深浅与氨基酸含量成正比,其最大吸收波长分别为570nm或350nm,故据此可以测定样品中氨基酸含量。 二、实验试剂 (1)1.2%茚三酮溶液:称取茚三酮1g于盛有35mL热水的烧杯中使其溶解,加入40mg氯化亚锡(SnCl2?H2O),搅拌过滤(作防腐剂)。滤液置冷暗处过夜,加水至50mL,摇匀备用。 (2)pH 8.04磷酸缓冲液: Ⅰ、准确称取磷酸二氢钾(KH2PO4)4.5350g于烧杯中,用少量蒸馏水溶解后,定量转入500mL容量瓶中,用水稀释至标线,摇匀备用。 Ⅱ、准确称取磷酸氢二钠(Na2HPO4)11.9380g于烧杯中,用少量蒸馏水溶解后,定量转入500mL容量瓶中,用水稀释到标线,摇匀备用。 Ⅲ、取上述配好的磷酸二氢钾溶液10.0mL与190mL磷酸氢二钠溶液混合均匀即为pH8.04的磷酸缓冲溶液。 (3)氨基酸标准溶液:准确称取干燥的氨基酸(如异亮氨酸)0.2000g于烧杯中,先用少量水溶解后,定量转入100mL容量瓶中,用水稀释到标线,摇匀,准确吸取此液10.0mL于100mL容量瓶中,加水到标线,摇匀,此为200μg/mL 氨基酸标准溶液。 三、实验方法及步骤 (1)标准曲线绘制 准确吸取200μg/mL的氨基酸标准溶液0.0、0.5、1.0、1.5、2.0、2.5、3.0mL (相当于0、100、200、300、400、500、600μg 氨基酸),分别置于25mL 容量瓶或比色管中,各加水补充至容积为 4.0mL,然后加入茚三酮溶液(20g/L)和磷酸盐缓冲溶液(pH为8.04)各1mL,混合均匀,于90℃水浴上加热至显色恒定为止(该加热过程至少需要25分钟),取出迅速冷至室温,加水至标线,摇匀。静置15min后,若生成蓝紫色化合物,在570nm波长下,以试剂空白为
游离氨基酸的测定实验报告
游离氨基酸的测定实验方案 (茚三酮比色法) 一、实验目的 茚三酮比色法测定发酵液中游离氨基酸含量,利用氨基酸含量这个参数,控制发酵过程。 二、实验原理 游离氨基酸的游离氨基可与水合茚三酮作用,产生蓝紫色的化台物二酮茚一二酮茚胺,产物的颜色深浅与游离氨基酸含量成正比,用分光光度计在570nm 下测其含量。因蛋白质中的游离氨基酸也会产生同样反应,在测定前必须用蛋白质沉淀剂将其除掉。 三、实验材料 发酵液样品; 实验试剂:水合茚三酮;氨基酸标准液;0.1%抗坏血酸 实验仪器:100ml容量瓶;漏斗;三角瓶;研钵;移液器;枪头;沸水浴;具塞刻度试管20 ml×10;分光光度计 四、实验方法 1.溶液配制 (1)水合茚三酮称取0.6g重结晶的茚三酮放烧杯中,加入15ml 正丙醇、30ml正丁醇、60ml乙二醇及9 ml PH4.54的醋酸盐缓冲液混匀,棕色瓶中冰箱内保存,10天内有效。 (2)氨基酸标准液称取80℃烘干的亮氨酸23.4mg,以10%的异丙醇溶解定溶至50ml(含氮为50ug/ ml),取此液5ml,用水定容至50 ml,此为含氮量5ug/ ml工作液。 (3)0.1%抗坏血酸称取0.1g抗坏血酸定容100 ml,随用随配。
2.标准曲线绘制 取6支20ml 试管,按下表加剂: 试剂 管号 1 2 3 4 5 6 亮氨酸标准液(ml) 0 0.2 0.4 0.6 0.8 1.0 无氨蒸馏水(ml) 2.0 1.8 1.6 1.4 1.2 1.0 水合茚三酮(ml) 3.0 3.0 3.0 3.0 3.0 3.0 抗坏血酸(ml) 0.1 0.1 0.1 0.1 0.1 0.1 氨基氮量(ug/管 ) 1.0 2.0 3.0 4.0 5.0 将各管溶液混合均匀,封口,在沸水中加热15min ,取出后立即用冷水摇 动冷却,用60%乙醇定容至20 ml ,摇匀。 λ=570nm 处测定吸 光度 0 0.025 0.055 0.099 0.146 0.186 以吸光度为纵坐标,氨基氨ug 数为横坐标,绘标准曲线如图: 茚三酮比色法测定游离氨基氮标准曲线 y = 0.0382x - 0.0103 R 2 = 0.9882 -0.05 00.05 0.10.15 0.20123456 氨基氮(ug) 吸光度A 3.样品中游离氨基酸的测定 取20ml 试管,取待测液1ml ,加蒸馏水l ml ,水合茚三酮3.0 ml ,坏血酸0.1ml ,混匀,封口。沸水浴加热1 5分钟,冷水中摇动冷却,用 60%乙醇定溶至20ml ,摇匀,于570mn 测定吸光度。
游离氨基酸测定(完整版)
总游离氨基酸测定(完整版) 实验原理:游离氨基酸的游离氨基可与水合茚三酮作用,产生蓝紫色的化合物二酮茚-二酮茚胺,产物的颜色深浅与游离氨基酸含量成正比,用分光光度计在570nm下测其含量。因蛋白质中的游离氨基酸也会产生同样反应,在测定前必须用蛋白质沉淀剂将其除掉. 仪器与用具:100ml容量瓶;漏斗;三角瓶研钵;刻度吸管:0.1ml×1、1ml×2、2ml×2、5ml×1;沸水浴;具塞刻度试管20ml×10;分光光度计. 一、试剂 1.水合茚三铜:称重结晶的茚三铜0.6g,装入烧杯,加入正丙醇15ml,使其溶 解加入正丁醇30 ml、乙二醇60 ml、乙酸-乙酸钠缓冲液(pH=5.4)9 ml,混匀,棕色瓶冰箱保存,10天内有效。 2.乙酸-乙酸钠缓冲液(pH5.4):称取化学纯乙酸钠54.4g,加入无氨蒸馏水 100 ml,电炉加热至沸,使其体积减半,冷却后加冰乙酸30 ml,加蒸馏水定容至100 ml。 3.氨基酸标准溶液:精确称取80℃烘干至恒重的亮氨酸0.0234g溶于10%异 丙醇并定容至50ml。取此液5ml蒸馏水稀释到50ml,即为5μg/ml氨基酸标液。 4.0.1%抗坏血酸:称取0.050g抗坏血酸,溶于50 ml蒸馏水中,即配即用。 5.10%乙酸 二、标准曲线制备 加塞子密封于沸水中加热15分钟,取出后用冷水迅速冷却并不时摇动使加热时形成的红色被空气逐渐氧化褪去,待呈现兰紫色时,用60%乙醇定容至20ml,摇匀于570nm波长下比色。以吸光
度为纵坐标,氨基氮ug数为横坐标,绘标准曲线 三、实验步骤: 1.烟末0.5g于研钵中加入5 ml10%乙酸,研磨匀浆后用蒸馏水定容 100 ml,用滤纸过滤到三角瓶中备用。 2.1ml滤液加入到20ml 干燥试管中,加1 ml蒸馏水,水合茚三铜 3ml, 0.1%抗坏血酸0.1ml, 加塞子密封于沸水中加热15分钟,取出后用冷水迅速冷却并不时摇动使加热时形成的红色被空气逐渐氧化褪去,待呈现兰紫色时,用60%乙醇定容至20ml,摇匀于570nm波长下比色。 四. 计算: 求三重复的平均值,由标准曲线得知各样的氨基酸ug数,代入公式计算。 氨基酸含量(mg/g干样)={氨基酸ug数×(提取液总体积/测定体积)}/(样品g数×1000)
测定茶叶中游离氨基酸总量研究
测定茶叶中游离氨基酸总量研究 采用茚三酮比色法测定茶叶中游离氨基酸总量。确定采用沸水萃取,以0.2mg/ml的谷氨酸标准溶液在吸取系列工作液后不加水,加入0.5ml的PH8.0的磷酸盐缓冲液和0.5ml2%茚三酮溶液,采用数显电热恒温水浴锅沸水浴15min加热,冷却后蒸馏水定容至25ml,在570nm处测定吸光度。所得线性方程A=4.312X-0.017,相关系数r=0.99955,回收率达到92.2%左右,精确度为0.8%,试验操作简单,重复性和稳定性良好。 茶叶游离氨基酸茚三酮比色法茶叶中游离氨基酸含量是用来描述茶叶鲜爽程度的一个重要品质指标,还是人体所必需的营养物质,同事对人体疾病的康复和预防起着极重要的保健作用。测定茶叶中游离氨基酸含量对茶叶的开发利用具有一定的指导意义。以谷氨酸为标准品,采用分光光度计为测定仪器,探索一种适合于茶叶游离氨基酸含量的分析方法。本试验对该方法的主要影响因素,精密度和回收率等进行研究,确定了茶叶中游离氨基酸总量的测定方法。 1材料与方法1.1仪器和用具数显电热恒温水浴锅,型号电子分析天平:感量为0.0001g,型号紫外可见分光光度计。可调式电炉。1.2试剂和溶液所用试剂应为分析纯(AR),水为蒸馏水。PH8.0磷酸盐缓冲液:1/15mol/L磷酸氢二钠溶液95ml和1/15mol/L磷酸二氢钾溶液5ml,混匀。2%茚三酮溶液:称取水合茚三酮(纯度不低于99%)2g,加50ml水和80mg氯化亚锡搅拌均匀。分次加少量水溶解,放在暗处,静置一昼夜,过滤后加水定容至100ml。1.3试验方法1.3.1标准贮备液及标准溶液的配制准确称取100mg谷氨酸(纯度不低于99%)溶于100ml水,定容作为母液。(1ml含谷氨酸1mg)。配制成0.1mg/ml,0.2mg/ml,0.3mg/ml,0.4mg/ml,0.5mg/ml浓度的标准溶液。采用GB/T8314-2002中茶游离氨基酸的测定方法进行测定。1.3.2样品处理称取3g(精确到0.0001g)粉碎混合均匀过60目筛样品于500ml的锥形瓶中,加450ml煮沸的蒸馏水,沸水浴浸提45min,每10min震摇一次,减压过滤至500ml容量瓶中,残渣用热蒸馏水洗涤2-3次,冷却,定容。 2结果与讨论2.1反应条件加水与不加水的比较本试验选择反应条件加水和不加水两种标准系列的比较:分别吸取两组0,1.0,1.5,2.0,2.5,3.0mL浓度0.1mg/ml谷氨酸工作液于一组25mL容量瓶中,一组加水4ml,另一组水4ml再分别加入0.5ml的PH8.0的磷酸盐缓冲液+0.5ml2%茚三酮溶液,沸水浴15min 加热,冷却蒸馏水定容至25ml,在570nm处测定吸光度。试验结果显示加水的标准系列显色效果不理想,标准曲线线性很差。而不加水的标准曲线线性好,相关系数R2=0.9991。 2.2标准工作液浓度的选择本试验通过对配制的不同浓度的标准溶液(0.1mg/ml,0.2mg/ml,0.3mg/ml,0.4mg/ml)测定加标回收率进行比较。本实验分别选取4份茶粉一份作为本底,另3份加入不同量的氨基酸标准液进行样品处理。取1ml的茶汤测定其游离氨基酸总量作为本底量,另3份分别内含1mg、2mg、3mg的茶氨酸的加标量。按GB/T8314-2002方法测定,试验结果表明
绿豆芽中游离氨基酸的测定
绿豆芽中游离氨基酸总量的测定 一、实验目的:掌握茚三酮显色法测定氨基酸含量的方法。 二、实验原理:游离氨基酸的氨基可与水合茚三酮反应,产生蓝紫色化合物,其颜色的深浅与游离氨基酸的含量成正比。 三、材料、仪器设备及试剂 材料:绿豆芽 仪器设备:722型分光光度计,分析天平,研钵,容量瓶,移液管,水浴锅,三角瓶,漏斗 试剂:水合茚三酮试剂、乙酸-乙酸钠缓冲液、标准氨基酸、0.1%抗坏血酸、10%乙酸 四、实验步骤 1.样品的制备 用剪刀将绿豆芽剪碎、混匀,称取1g 放入研钵中加入5mL 10%乙酸,研磨匀浆后,用蒸馏水稀释至100mL 。混匀,并用干滤纸过滤到三角瓶中备用。 2.标准曲线的制作 取6支20ml 具塞刻度试管,下表操作 试剂 管号 1 2 3 3 5 6 标准氨基酸/mL 0 0.2 0.4 0.6 0.8 1 无氨蒸馏水/mL 2.0 1.8 1.6 1.4 1.2 1.0 水合茚三酮/mL 3.0 3.0 3.0 3.0 3.0 3.0 抗坏血酸/mL 0.1 0.1 0.1 0.1 0.1 0.1 每管含氮量/μg 1 2 3 4 5 加完试剂后混匀,盖上大小合适的玻璃球,置沸水中加热15min ,取出后用冷水迅速冷却,并不时摇动,使加热时形成的红色被空气逐渐氧化而褪去,进而呈现蓝紫色时,用60%乙醇定容至20 ml 。混匀后用1cm 光径比色皿在570 nm 波长下测定吸光度,绘制标准曲线。 3.样品的测定 吸取样品滤液1.0ml ,放入20mL 干燥试管中,加无氨蒸馏水1.0ml ,其他操作与制作标准曲线相同。根据样品吸光度在标准曲线上查得含氮量。 四、结果计算 按下式计算样品中氨基态氮的含量。 100V V C 100s T ???= W 克样品中氨基态氮含量 式中:C 为从标准曲线上查得的氨基态氮含量,/μg;V T 为样品稀释总体积,mL ;Vs 为测定时样品体积,mL ;W 为样品鲜重。 五、实验结论与误差分析 六、思考题 1.茚三酮与所有氨基酸的反应产物颜色都相同吗?为什么? 2.抗坏血酸的作用是什么?
游离氨基酸总量的测定
植物体内游离氨基酸总量的测定 方法一: 一、原理 游离氨基酸的氨基可与水合茚三酮反应,产生蓝紫色化合物,其颜色的深浅与游离氨基酸的含量成正比。 二、仪器设备 分光光度计;电子天平;容量瓶25ml或50ml 3个;漏斗(直径6厘米)3个、滤纸适量;20ml刻度试管 7支;移液管0.5ml 3支、5ml 1支;试管架;玻棒;吸耳球;剪刀;移液管架;橡皮筋、塑料薄膜(封试管口);吸水纸;擦镜纸适量;电炉;水浴锅(含铁丝筐)。 三、试剂 1. 3%茚三酮试剂 称3g茚三酮用95%乙醇溶解定容到100ml容量瓶里,贮于棕色瓶中。此试剂应放在冷凉处,不宜久放,使用期约10天。 2. 氰酸盐缓冲液(按以下方法配制): (1)NaCN贮备液0.01mol/L(490mg/L)。 (2)醋酸缓冲液:称360g醋酸钠(含三分子结晶水)溶于约300ml无氨蒸馏水中,加66.67ml冰醋酸再用无氨蒸馏水稀释至1L。 取溶液(1)20ml,用溶液(2)定容到1L。 3. 标准氨基酸 精确称取在80℃下烘干的亮氨酸13.1mg(或α-丙氨酸8.9mg)溶于10%的异丙醇中,并在100ml容量瓶中用10%异丙醇稀释至刻度,混匀,即为1mmol/L 的标准氨基酸贮备液,置冰箱中保存。为了制备工作液,可取贮备液与等量无氨蒸馏水混合,此液浓度为0.5mmol/L,即1ml含氨基酸0.5μmol,或氨基氮7μg。
4. 95%乙醇;异丙醇(分析纯)。 四、操作步骤 1. 标准曲线的制作取20ml刻度试管18支,按下表1加入各试剂。加完 试剂后混匀,在100℃水浴中加热12min(加热时封口),取出在冷水中迅速冷却,立即于每管中加入5ml 95%乙醇,塞好塞子,猛摇试管,使加热时形成的红色产物被空气中的氧所氧化而褪色,此时溶液呈蓝紫色。于570nm 波长下测其光密度(以空白管为参比),以氨基酸浓度为横坐标,光密度为纵坐标,绘制标准曲线,求出直线方程。 2. 样品提取选取有代表性的植物叶片(或其它组织),洗净擦干,剪碎混 匀,迅速称取0.10~0.20g(视氨基酸含量多少而定),共称3份,分别加入20ml刻度试管中,再加蒸馏水10ml盖塞(或系上塑料薄膜),置沸水浴中20min以提取游离氨基酸,到时取出在自来水中冷却,把上清液滤入25ml 容量瓶中,之后再往试管中加5ml蒸馏水,置沸水浴上再加热10min,过滤并反复冲洗残渣,最后定容至刻度,摇匀。 3. 样品测定另取4支洁净干燥的试管,其中3支分别加入0.5ml提取液, 另一支加0.5ml蒸馏水,然后在上述4支试管中分别加入NaCN缓冲液、水合茚三酮各0.5ml,加完试剂后盖塞,置沸水浴上加热12min,冷却后,再分别加5ml 95%乙醇,摇匀,以空白作参比,在波长570nm下测其光密度。 根据光密度查标准曲线(或用回归方程计算)即可求出提取液中氨基酸的浓度。 方法二: 一、原理 游离氨基酸的氨基可与水合茚三酮反应,产生蓝紫色化合物,其颜色的深浅与游离氨基酸的含量成正比。 二、仪器设备
烟叶游离氨基酸的测定 氨基酸分析仪法
烟叶游离氨基酸的测定氨基酸分析仪法(YC/T 282—2009) 日期:2009/6/2 10:39:18 作者:来源: 烟叶游离氨基酸的测定氨基酸分析仪法(YC/T 282—2009)由国家烟草专卖局于2009年3月30日批准发布,自2009年5月1日起实施。 前言 本标准的附录A、附录B、附录C为资料性附录。 本标准由国家烟草专卖局提出。 本标准由全国烟草标准化技术委员会卷烟分技术委员会(TC144/SC1)归口。 本标准起草单位:湖北中烟工业有限责任公司、中国烟草总公司郑州烟草研究院。 本标准主要起草人:王娟、李丹、刘建锋、马舒翼、宋旭艳、郭国宁、刘克建。 烟叶游离氨基酸的测定氨基酸分析仪法 1 范围 本标准规定了烟叶中游离氨基酸的氨基酸分析仪测定方法。 本标准适用于烟叶中天冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、天冬酰胺(Asn)、谷氨酸(Glu)、脯氨酸(Pro)、甘氨酸(Gly)、丙氨酸(Ala)、缬氨酸(Val)、胱氨酸(Cys)、异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr)、苯丙氨酸(Phe)、β-丙氨酸(β-Ala)、β-氨基异丁酸(β-Aia)、γ-氨基丁酸(γ-Aba)、赖氨酸(Lys)、组氨酸(His)、色氨酸(Trp)、精氨酸(Arg)等21种游离氨基酸的测定。 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 YC/T 31-1996 烟草及烟草制品试样的制备和水分测定烘箱法 3 术语和定义 下列术语和定义适用于本标准。 3.1 烟叶中游离氨基酸 dissociated amino acid(free amino acid)in tobacco leaf 烟叶的盐酸浸出物中,以游离状态存在、未结合在蛋白质分子中的氨基酸。 4 原理 氨基酸为两性电解质,在酸性环境下形成阳离子。烟叶中的游离氨基酸经酸溶液萃取后,经氨基酸分析仪的磺酸型锂离子交换柱分离,然后与茚三酮混合,通过加热反应,伯胺与之生成蓝紫色化合物,仲胺与之生成黄色化合物。两种衍生物使用波长分别为570 nm和440 nm的双通道紫外检测器同时进行定性定量分析测定(氨基酸分析仪管路图参见附录A)。 5 试剂 除特别要求以外,本标准所使用的试剂均为分析纯试剂,水为去离子水。 5.1盐酸溶液,0.005 mol/L。
烟草中游离氨基酸的测定
烟草中游离氨基酸的测定 王娟,张华,郭国宁,李琳 (湖北中烟工业有限责任公司技术中心,湖北武汉430051) 摘要 [目的]探讨用氨基酸自动分析仪建立一种测定烟草中游离氨基酸的方法。[方法]用氨基酸分析仪法测定烟叶中的游离氨基酸并对这些游离氨基酸分别定性定量检测。[结果]氨基酸分析仪法能够分离检测烟叶中的23种游离氨基酸(除了蛋氨酸),其回收率均在78.86%~101.46%,标准偏差均在8%以内,具有较好的重现性和回收率。最优的氨基酸提取方法是:样品过60目筛,用0.005mol/L 的盐酸超声萃取30m i n 。对不同的烟叶样品进行检测,发现不同种类烟叶所含有的氨基酸具有一定的规律性。烤烟和香料烟中所含的游离氨基酸以Pro 为主,而白肋烟以Asn 为主;只有白肋烟中含有氨基酸Tau ,而烤烟和香料烟里面几乎检测不到。[结论]氨基酸分析仪法是测定烟叶中游离氨基酸较好的方法。关键词 烟草;游离氨基酸;氨基酸分析仪 中图分类号 S572 文献标识码 A 文章编号 0517-6611(2008)26-11413-04 Detectio n of Free Amino Aci ds i n Tobacco WANG Juan et al (Ch i na Tobacco H ube i Industr i a lCo .lt d .R &D Center ,W uhan ,H ube i 430051)Abstract [Objecti ve]A method establi shed f or t he de t ecti on of free a m i no ac i ds i n t obacco usi ng a m i no aci d ana l yzer was discussed .[M e t hod]The free a m i no aci ds in tobacco were de t ected using t he a m i no aci d analyzer and t hese free a m i no aci dswere detected qualitati vel y and quantit a ti ve l y resp .[R es u lt ]23ki nds of free a m i no aci ds exceptm et hioni ne i n t obacco l eaves were separated and detected by the a m i no aci d anal y z er m et hod ,t he reproduci b ilit y were bet w een 78.86%and 101.46%,and the standard dev i ati on va l uesw ere bel ow 8%.The me t h od had better reproduc i bility and recovery .The optm i u m ex traction m et hod o f a m i no aci d w as as f o ll ows :t he sa mples w ere sieved by 60m e s hes trea t m ent and treated by u l trasonic extracti on w it h 0.005mo l/L hydroch l oride for 30m i n .The contents o f a m i no aci ds i n different varie ti es of tobacco leaves s ho w ed s ome l a w after t he det ecti ng tobacco sa mples .The f ree a m i no aci d cont a i ned i n flue cured tobacco and orient a l tobacco w asma i nl y pro li ne ,while t hat i n bur l ey tobacco was ma i nl y as paragine .The tauri ne was onl y cont a i ned i n burley tobacco and itw as nearl y not detected i n fl ue cured tobacco and orient a l tobacco .[Conc l usion]The a m i no aci d ana l yzerm et hod was t he bett er me t hod for detec ti ng t he free am i no aci ds i n t obacco l eaves .K ey words Tobacco ;F ree a m i no ac i d ;Am i no ac i d analyzer 基金项目 国家烟草专卖局资助项目。 作者简介 王娟(1979-),女,湖北武汉人,硕士,工程师,从事天然植 物烟用研究。 收稿日期 2008 06 20 烟草中的氨基酸是重要的致香前体物质,在烟草调制、醇化或发酵、加工乃至燃烧过程中,游离氨基酸与还原糖之间可发生酶催化及非酶催化的棕色化反应,生成多种具有蒸煮、烤香、爆米花等不同香味特征的杂环化合物[1-2] 。某些氨基酸如苯丙氨酸还可自身分解成香味化合物(如苯甲醇、苯乙醇等)。氨基酸在烟草生长和加工(如调制、陈化、发酵、加料等)的不同阶段也会发生不同的变化,从而对烟草的品质产生较大影响。一般说来,适量的氨基酸有助于提高烟气劲头和增加丰满度。若氨基酸含量太高,烟气辛辣、味苦、刺激性强烈,这是由于在燃烧过程中氨基酸通常生成NH 3等含氮化合物,个别氨基酸还产生H CN 等危害健康的烟气成分;若氨基酸含量太低,烟气则平淡无味缺少丰满度 [3-5]。因此 对不同时期氨基酸含量及其变化情况的分析,可为卷烟配 方、烟叶加料、调制、发酵程度等提供理论指导。建立准确可靠的烟叶中游离氨基酸的分析方法,无疑是一项非常有意义且十分必要的工作。 氨基酸分析,按分离方法可分为纸色谱法、离子交换法、反相高效液相色谱法、气相色谱法等;按检测方法可分为化学分析法、电化学方法(包括电导检测、安培检测)、分光光度法(包括可见光分光光度法、紫外分光光度法和荧光分光光度法)等;按衍生反应的先后,可分为柱前衍生和柱后衍生法。目前,文献上报道较多的测定烟草中氨基酸的方法主要 是分光光度法[6]和柱前衍生反相高效液相色谱法[4,7-8] 。分光光度法只能测定烟草中游离氨基酸的总量;高效液相色谱 法虽然能够对不同种类的氨基酸定性定量,但是所测定的氨基酸的种类最多只有15~17种,且无法将H i s 和G l y 分开[4] 。笔者用氨基酸自动分析仪建立了一种测定烟草中游离氨基酸的方法,该方法能够对烟草中所含有的23种游离氨基酸分别定性定量检测。1 材料与方法1.1 试验材料 1.1.1 仪器。旋风式样品磨(60目);万分之一天平(德国赛多利斯);移液器(吉尔森);超声波(上海弘兴);试管浓缩仪(东京理化器械株式会社);氨基酸自动分析仪(德国S YKAM );0.45 m 滤膜(上海安谱)。 1.1.2 试剂。去离子水;盐酸(分析纯,上海);样品稀释液(德国SYKA M );不同p H 和离子强度的洗脱液(德国S YKAM );茚三酮溶液(德国S YKA M );混合氨基酸标准溶液(德国SYK AM )。1.2 试验方法 将烟叶置于40 下干燥2h ,粉碎过筛,混合均匀后,密封保存备用。称取1g 样品(精确至0.0001g)于100m l 磨口三角瓶中,加入50.0m l 一定浓度的盐酸溶液,塞上塞子、超声、过滤。准确移取2m l 滤液浓缩蒸干(温度不超过60 ),加入1m l 样品稀释液,摇匀。溶液经0.45 m 滤膜过滤后上机分析。用外标法测定样品溶液中各游离氨基酸的含量。其中脯氨酸在440nm 波长下检测,其他氨基酸在570n m 波长下检测。 1.3 仪器条件 分析柱温度:37 ;反应管温度:130 ;进样量:50 ;l 缓冲溶液:不同p H 值的柠檬酸锂缓冲溶液。2 结果与分析 2.1 氨基酸色谱图 图1、2分别是混合氨基酸标样以及样品溶液的氨基酸分析色谱图。用氨基酸自动分析仪分析标 安徽农业科学,Jou r n al ofAnhu iAgr.i Sc.i 2008,36(26):11413-11416责任编辑 罗芸 责任校对 李洪
基于AQC衍生和液质联用的茶叶游离氨基酸分析
基于AQC衍生和液质联用的茶叶游离氨基酸分析 陈思肜1,赵峰1,2*,王淑燕1,金珊1,周鹏3,危赛明4,叶乃兴1*【摘要】摘要:【目的】开发一种能快速、准确、可靠地对各茶叶中蛋白质氨基酸和低含量非蛋白质氨基酸进行测定的方法,为分析茶叶氨基酸组分提供新途径。【方法】质控样品经提取和氨基喹啉-N-羟基丁二酰氨基甲酸酯(AQC)衍生后,通过三重四极杆液质联用仪进行测定,优化质谱条件,评估35种氨基酸的线性范围、检出限、定量限、重现性和回收率,并应用该方法对市售的六大茶类(红茶、绿茶、白茶、黄茶、乌龙茶和黑茶)共50批次样本的游离氨基酸含量进行测定。【结果】采用AQC衍生—液相色谱串联三重四极杆质谱法可在20 min内完成35种氨基酸的定性定量检测,线性回归良好(R>0.9900);定量限在2.1×10-6~1.8×10-2 mg/L,检出限在6.3×10-7~5.5×10-3 mg/L;日内重现性≤4.6%,日间重现性≤5.4%;加标回收率81.0%~99.9%,相对标准偏差(RSD)≤9.5%。对六大茶类游离氨基酸的测定结果显示,除绿茶和黄茶的氨基酸构成相似外,其他茶类的氨基酸构成均呈现出各自的规律性特征,氨基酸的定量结果可通过3个主成分(累积方差为66.5%)实现茶类区分。其中,蛋氨酸、苯丙氨酸、肌氨酸、茶氨酸、瓜氨酸、3-甲基-L-组氨酸、精氨酸、色氨酸、组氨酸和1-甲基-L-组氨酸的变量权重值(VIP)大于1.0,对茶类判别贡献较大。【结论】AQC衍生结合液相色谱质谱联用是一种快速、可靠、有效的分析方法,能对茶叶中的蛋白质氨基酸和低含量非蛋白质氨基酸进行高灵敏度定量。 【期刊名称】《南方农业学报》 【年(卷),期】2019(050)010
植物组织中游离氨基酸总量的测定
【试剂】 1、 3%茚三酮试剂 称3g茚三酮用95%乙醇溶解定容到100ml容量瓶里,贮于棕色瓶中.此试剂应放在冷凉处,不宜久放,使用期约10天. 2、氰酸盐缓冲液(按以下方法配制): (1)NaCN贮备液0.01mol/L(490mg/L). (2)醋酸缓冲液:称360g醋酸钠(含三分子结晶水)溶于约300ml无氨蒸馏水中,加66.67ml 冰醋酸再用无氨蒸馏水稀释至1L. 取溶液(1)20ml,用溶液(2)定容到1L. 3、标准氨基酸精确称取在80℃下烘干的亮氨酸13.1mg(或α-丙氨酸8.9mg)溶于10%的异丙醇中,并在100ml容量瓶中用10%异丙醇稀释至刻度,混匀, 即为1mmol/L的标准氨基酸贮备液,置冰箱中保存.为了制备工作液,可取贮备液与等量无氨蒸馏水混合,此液浓度为0.5mmol/L,即1ml含氨基酸0.5μmol,或氨基氮7μg. 4、 95%乙醇; 5、异丙醇(分析纯). 【操作步骤】 1. 标准曲线的制作 取20ml刻度试管18支,按下表15-1加入各试剂.加完试剂后混匀,在100℃水浴中加热12min(加热时封口),取出在冷水中迅速冷却,立即于每管中加入5ml 95%乙醇,塞好塞子,猛摇试管,使加热时形成的红色产物被空气中的氧所氧化而褪色,此时溶液呈蓝紫色.于570nm波长下测其光密度(以空白管为参比),以氨基酸浓度为横坐标,光密度为纵坐标,绘制标准曲线,求出直线方程. 表15-1 各试管加入试剂量 2. 样品提取
选取有代表性的植物叶片(或其它组织),洗净擦干,剪碎混匀,迅速称取0.10~0.20g(视氨基酸含量多少而定),共称3份,分别加入20ml刻度试管中,再加蒸馏水10ml盖塞(或系上塑料薄膜),置沸水浴中20min以提取游离氨基酸,到时取出在自来水中冷却,把上清液滤入25ml容量瓶中,之后再往试管中加5ml蒸馏水,置沸水浴上再加热10min,过滤并反复冲洗残渣,最后定容至刻度,摇匀. 3. 样品测定 另取4支洁净干燥的试管,其中3支分别加入0.5ml提取液,另一支加0.5ml蒸馏水,然后在上述4支试管中分别加入NaCN缓冲液、水合茚三酮各 0.5ml,加完试剂后盖塞,置沸水浴上加热12min,冷却后,再分别加5ml 95%乙醇,摇匀,以空白作参比,在波长570nm下测其光密度. 根据光密度查标准曲线(或用回归方程计算)即可求出提取液中氨基酸的浓度. 4. 计算 游离氨基酸含量 式中 C-由直线方程计算的值,即0.5ml试样中氨基酸的微摩尔数(μmol); V-样品提取液经稀释后的总体积(ml); W-样品重(g). 测定结果按表15-2记录. 表15-2 游离氨基酸总量测定记载表 测定日期:
氨基酸总量的测定
氨基酸总量的测定 (茚三酮比色法) 一、方法原理: 氨基酸的游离氨基与水合茚三酮作用后,可产生二酮茚一二酮茚胺的取代盐等蓝紫色化合物,其颜色深浅与氨基酸含量成正比,据此可以比色测定氨基酸含量。 二、试剂: 1.2%茚三酮溶液:1g茚三酮(C9H403·2H2O)溶于25ml热水中,加入40mg氯化亚锡;(SnCl2·2H2O),搅拌溶解,滤去残渣,滹液放在冷暗处过夜,用水定容为50ml,保存声冷暗处。 如茚三酮有微红色,配成的溶液也带红色,将影响比色测定,需将茚三酮重结晶后再用方法是:取5g茚三酮溶于20ml热水中,加入0.2g活性炭,轻轻摇动,放三十分钟后过滤,滤液置冰箱中过夜,次日过滤,用1ml冷水淋洗结晶,然后放在干燥器中干燥,装瓶保存。2。磷酸盐缓冲液(pH8.0): ①1/15mol/l磷酸二氢钾溶液:取KH2P04 0.9070g溶于lOOml水中。 ②1/15mol/l磷酸氢二钠溶液:取磷酸氢二钠(Na2HP04·12H20)23.876g溶于水,加水至1000ml。 取①50ml与②95ml混匀即得。 3.10%醋酸:取lOml冰醋酸加水至lOOml。 4,氨基酸标准溶液(200ppm):称取干燥的氨基酸(白氨酸,或其它的氨基酸)0.2000g溶解于水,定容为1000ml。 三、仪器: 水浴,721分光光度计。 四、操作步骤: (一)标准曲线绘制: 分别吸取氨基酸标准溶液(200ppm)0、0.5、1.0、1.5、2.0、2.5ml各置于25ml容量瓶中,加水补充至4.0ml,各加入缓冲液lml,加入茚三酮lml,摇匀。置沸水浴中加热15分钟,取出迅速冷却至室温,—用水定容。放置15分钟,在570nm波长下测定,绘制标准曲线。氨基酸浓度分别为0,4.0,8.0,12.0,16.0,20.Oppm。 (二)样品测定: l提取样品:称取1.0 ~2.0g植物样品(新鲜样或干样),加5m1 10%醋酸,在研钵中研碎,用水洗移入lOOml容量瓶,水定容,过滤到三角瓶中,取滤液测定。 2.样品液测定:移取样品待测液l ~4毫升,放人25ml容量瓶中,加水至4.Oml,加缓冲液1ml,加茚三酮1ml,摇匀。置沸水浴中加热15分钟,取出用冷水迅速冷却至室温,加水定容。放置15分钟后,测定。 同时测定待测液空白值,扣除空白值后,从标准曲线上查得氨基酸的浓度。 五、结果计算: 氨基酸总量(mg%) =(ppm * l00 * 25 * 100)/(W * V * 1000) = (ppm * 250)/(W * V) 式中:ppm--由标准曲线查得样品测定液氨基酸浓度; W——称样品重(g) V——吸取样品待测液体积(ml) 六。注意事项:
氨基酸分析仪测定功能性饮料中游离氨基酸
[作者简介]姜荷(1976-),博士,工程师,主要从事食品检验工作。=化学测定方法> 氨基酸分析仪测定功能性饮料中游离氨基酸 姜荷,王红青,孙岚,林赛君,潘向荣 (杭州质量技术监督检测院,杭州310019) [摘要]目的:建立同时测定功能性饮料中游离牛磺酸和赖氨酸的定量测定方法。方法:氨基酸分析仪定量测定。结果:同时测定功能性饮料中游离牛磺酸和赖氨酸的含量,牛磺酸和赖氨酸的最低检出限都为2nmo l/m,l线性范围都为6 ~100nmo l/m,l相关系数均大于019997,RS D均小于5%,回收率在9817%~10012%。结论:此方法灵敏度高,操作简单,重复性好,切实可行。 [关键词]氨基酸分析仪;功能性饮料;牛磺酸;赖氨酸 [中图分类号]R15515[文献标识码]A[文章编号]1004-8685(2010)04-0763-02 Detecting free a m ino acids in functional drinks by AAA J I ANG H e,WANG H ong-q ing,SUN L an,LI N Sai-jun,PAN X ian g-rong (H ang z hou Insti tute o f T est and Cali brati on fo r Q uality and T echno l ogy Superv i s i on,H ang zhou310019,Ch i na) [Ab stract]Ob jec ti ve:To estab lish a quantitati ve m ethod for detecti ng si m u ltaneously the free am ino acids i n functi onal dr i nks1M ethod s:Q uantitati v e deter m i nation w as per f o r m ed by am ino ac i ds analyzer1R esu lts:T he LOD o f tau ri ne and lysi ne we re 2n m ol/m l1The ca libration cu rve w ere li near i n the range of6~100n m o l/m lw it h corre lati on coe fficients above0199971The rela-ti ve standard dev i a tion w as under5%and the recovery bet ween9817%and10012%1Conc l u si on:T he m et hod is sensiti ve,si m-p l e,stab l e,and have good recurrence1A s a m ethod t o detect taurine and lysi ne i n f uncti ona l dri nks,this m ethod is prac tica l and use f u11 [K ey words]Am i no acids ana l yzer(AAA);Functiona l dr i nks;T aur i ne;L ysi n 目前,市场上的功能性饮料种类繁多,但配料大同小异,一般都是在水中添加了维生素、牛磺酸、赖氨酸、葡萄糖、矿物质、电解质等成分。牛磺酸和赖氨酸是现在国内功能性饮料中仅添加的两种氨基酸类营养强化剂。目前,对氨基酸的分析主要集中在柱前和柱后衍生-反相高效液相色谱法研究[1~6],前者具有成本低、选择性好、分离度高的优点,但稳定性差,后者对仪器的要求很高。氨基酸分析仪专为氨基酸分析而设计,选择性强、分离度高、稳定性好,在功能性饮料中的应用尚未见报道。本文建立了用氨基酸分析仪测定功能性饮料中游离牛磺酸和赖氨酸的方法。 1材料与方法 111仪器与试剂 日立氨基酸分析仪L-8900,离子交换柱:416mm@ 60mm填料为3L m磺酸型阳离子树脂分离柱,交换树脂型号:N o12622(日本公司生产的氨基酸分析专用树脂)。 真空干燥箱,天平(0101g,010001g),M illi Q超纯水仪。 盐酸(优级纯),实验室用水为超纯水,氨基酸分析仪配套的流动相(缓冲液和茚三酮溶液)。 牛磺酸对照品,s i gma公司提供,纯度99%;其他氨基酸由氨基酸分析仪的仪器商提供。112标准溶液 11211标准储备液的配制准确称取适量上述标准物质,用011mo l/L HC l溶液溶解,使成为215L m o l/m l的标准储备液。11212混合标准过渡液的配制临用时用0102mo l/L H C l 将标准储备液稀释,配成100n m ol/m l过渡溶液。 113前处理方法 含乳功能性饮料取样品5m,l加入2倍样品体积的无水乙醇,在旋转混合器上充分混合,然后于4e和15000r/m in条件下离心5m i n,取上清液2m,l50e减压干燥至近干,用0102m o l/L的H C l定容,过0122L m水相微孔滤膜后待测。 非含乳的功能性饮料,直接取样品2m,l50e减压干燥至近干,用0102mo l/L的H C l定容,过0122L m水相微孔滤膜后待测。 114AAA测定条件 梯度洗脱,cycle时间53m i n,分离柱柱温57e,反应柱柱温135e,缓冲液流速014m l/m in,茚三酮流速0135m l/m i n,通道1:检测波长570nm,采集时间32m i n;通道2:检测波长440n m,采集时间10m i n。进样量20L l。 2结果与讨论 211前处理方法 在参考文献[7~9]的基础上,对于非含乳的功能性饮料,选择了直接过微孔滤膜、80e水浴蒸干、50e减压干燥3种方式。结果发现直接过微孔滤膜的样品,因为样品p H值的原因,保
