100种有机化学反应集锦
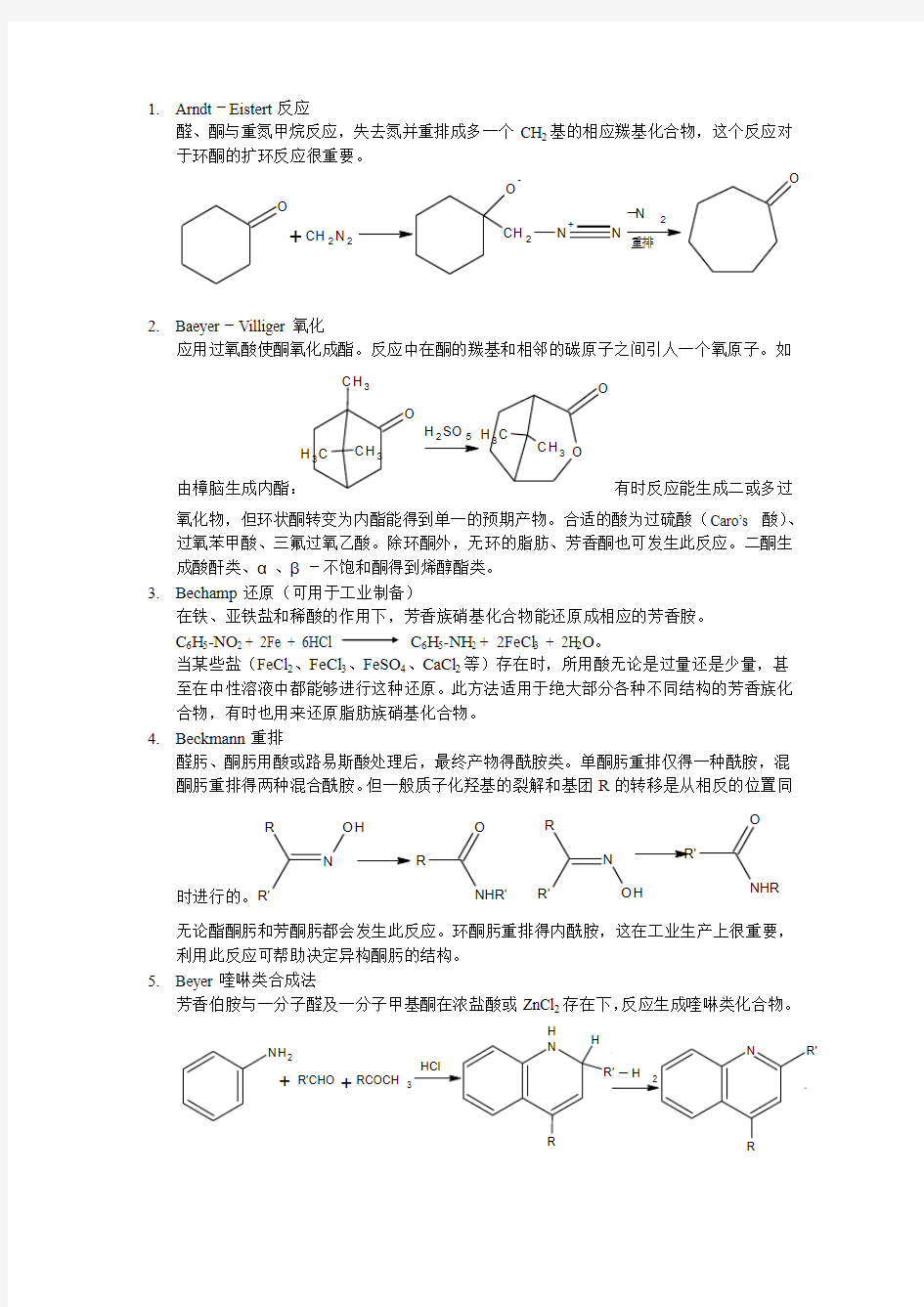
1. Arndt -Eistert 反应
醛、酮与重氮甲烷反应,失去氮并重排成多一个CH 2基的相应羰基化合物,这个反应对于环酮的扩环反应很重要。
O
+CH 2N 2
-
2
N
+
N -N 2
O
2. Baeyer -Villiger 氧化
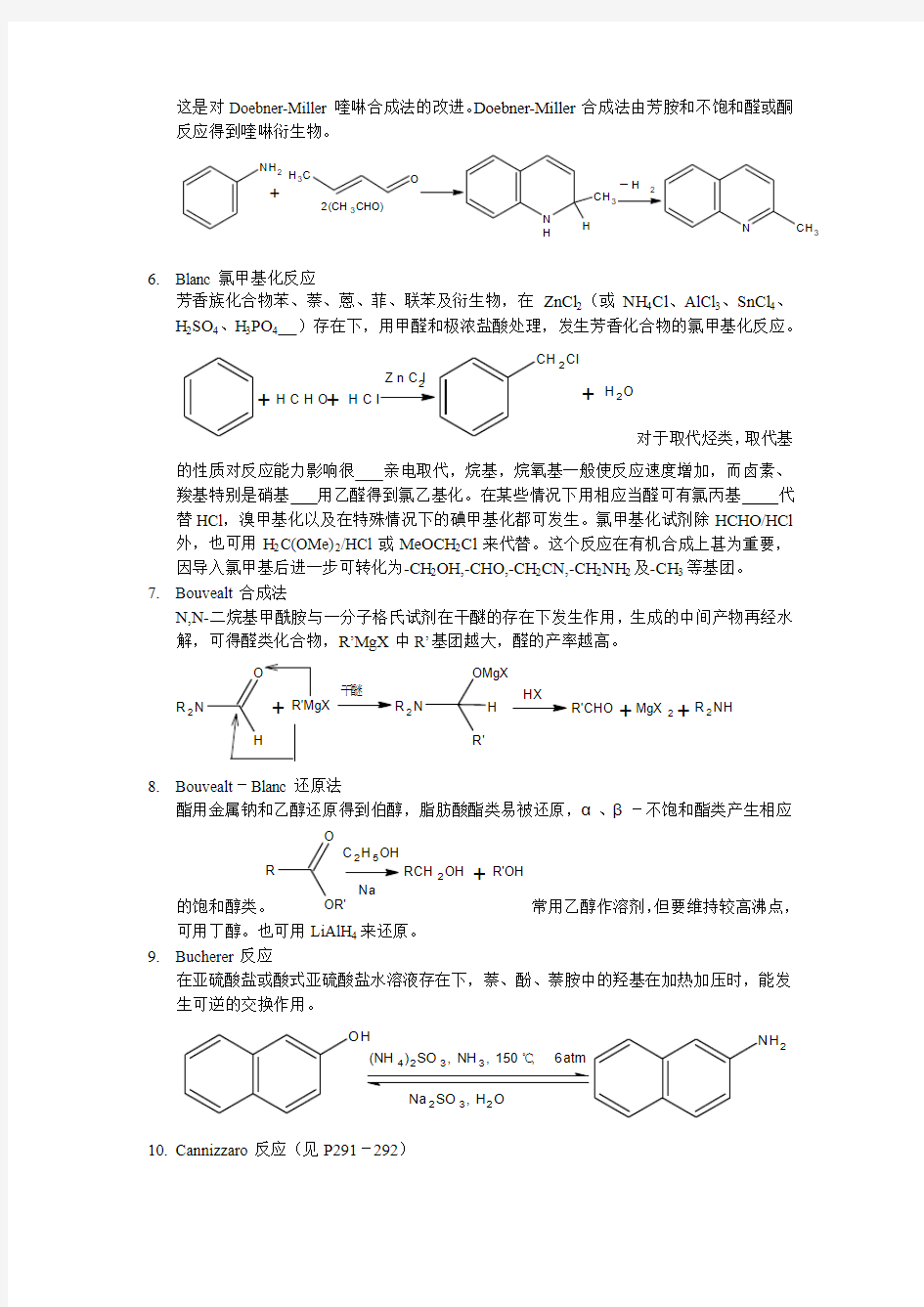
应用过氧酸使酮氧化成酯。反应中在酮的羰基和相邻的碳原子之间引人一个氧原子。如
由樟脑生成内酯:O
C H 3
C
H 3C H 3
O
O
C
H 3C H 3H SO
有时反应能生成二或多过
氧化物,但环状酮转变为内酯能得到单一的预期产物。合适的酸为过硫酸(Caro’s 酸)、过氧苯甲酸、三氟过氧乙酸。除环酮外,无环的脂肪、芳香酮也可发生此反应。二酮生成酸酐类、α、β-不饱和酮得到烯醇酯类。 3. Bechamp 还原(可用于工业制备)
在铁、亚铁盐和稀酸的作用下,芳香族硝基化合物能还原成相应的芳香胺。 C 6H 5-NO 2
+ 2Fe + 6HCl C 6H 5-NH 2 + 2FeCl 3 + 2H 2O 。
当某些盐(FeCl 2、FeCl 3、FeSO 4、CaCl 2等)存在时,所用酸无论是过量还是少量,甚至在中性溶液中都能够进行这种还原。此方法适用于绝大部分各种不同结构的芳香族化合物,有时也用来还原脂肪族硝基化合物。 4. Beckmann 重排
醛肟、酮肟用酸或路易斯酸处理后,最终产物得酰胺类。单酮肟重排仅得一种酰胺,混酮肟重排得两种混合酰胺。但一般质子化羟基的裂解和基团R 的转移是从相反的位置同
时进行的。N O H
R'R
R
NHR'
O
N R'
R
O H
R'
NHR O
无论酯酮肟和芳酮肟都会发生此反应。环酮肟重排得内酰胺,这在工业生产上很重要,利用此反应可帮助决定异构酮肟的结构。 5. Beyer 喹啉类合成法
芳香伯胺与一分子醛及一分子甲基酮在浓盐酸或ZnCl 2存在下,反应生成喹啉类化合物。
N H 2
H
+
+
R'CHO
RCOCH
这是对Doebner-Miller喹啉合成法的改进。Doebner-Miller合成法由芳胺和不饱和醛或酮反应得到喹啉衍生物。
N H2
H
H
H3
+
C
H3
2
(CH3CHO)
6.Blanc氯甲基化反应
芳香族化合物苯、萘、蒽、菲、联苯及衍生物,在ZnCl2(或NH4Cl、AlCl3、SnCl4、H2SO4、H3PO4)存在下,用甲醛和极浓盐酸处理,发生芳香化合物的氯甲基化反应。
+++
H C H O H C
Z n C l2
H2O
CH2Cl
对于取代烃类,取代基的性质对反应能力影响很亲电取代,烷基,烷氧基一般使反应速度增加,而卤素、羧基特别是硝基用乙醛得到氯乙基化。在某些情况下用相应当醛可有氯丙基代替HCl,溴甲基化以及在特殊情况下的碘甲基化都可发生。氯甲基化试剂除HCHO/HCl 外,也可用H2C(OMe)2/HCl或MeOCH2Cl来代替。这个反应在有机合成上甚为重要,因导入氯甲基后进一步可转化为-CH2OH,-CHO,-CH2CN,-CH2NH2及-CH3等基团。
7.Bouvealt合成法
N,N-二烷基甲酰胺与一分子格氏试剂在干醚的存在下发生作用,生成的中间产物再经水解,可得醛类化合物,R’MgX中R’基团越大,醛的产率越高。
R2N
H
O
R'MgX
干醚
R2N
R'
OMgX
H
HX
R'CHO++
MgX2R2NH
+
8.Bouvealt-Blanc还原法
酯用金属钠和乙醇还原得到伯醇,脂肪酸酯类易被还原,α、β-不饱和酯类产生相应的饱和醇类。
R
OR'
O
C2H5OH
Na
RCH2OH R'OH
+
常用乙醇作溶剂,但要维持较高沸点,可用丁醇。也可用LiAlH4来还原。
9.Bucherer反应
在亚硫酸盐或酸式亚硫酸盐水溶液存在下,萘、酚、萘胺中的羟基在加热加压时,能发生可逆的交换作用。
O H N H
2
(NH4)2SO3, NH3, 150℃, 6atm
Na2SO3, H2O
10.Cannizzaro反应(见P291-292)
11. Chichibabin 吡啶类合成法
醛、酮类与氨或胺类在Al 2O 3等催化剂存在下,加压加热,脱氢脱水,生成吡啶类化合
物。
N
CH 3
3CH 3CHO
+++NH 3
3H 2O H 2
此法不易得纯产物,
还有其他化合物生成。
12. Chichibabin 对称合成法
碳酸二乙酯与三分子格氏试剂反应,中间产物经水解得到对称叔醇类。
H 5C 2O
OC 2H 5
O
+3RMgX
R
O H
R
R
如果格氏试剂用量不足,与一分
子RMgX 反应生成酸,与二分子RMgX 反应生成酮。
H 5C 2O
OC 2H 5
O
+
RMgX R H 5C 2O
H 5C 2O
OMgX
R
OC 2H 5
O
H 2O
RCOOH
+C 2H 5OH
R
R
O
RMgX
R
H 5C 2O
R
OMgX
R
OC 2H 5
O
-MgXOC
2H 5
13. Chichibabin 胺化反应
含氮杂环碱类,如吡啶,喹啉或其衍生物与金属胺基化物在一起加热,则起胺化反应,
生
成
氨
基
衍
生
物
。
产
率
一
般
为
50
%~100%。
N
N
N
H N
a N
N H 2
N a
N H 2
溶剂105-
110℃,
66-
76%
H 2O
水解
反应中副产物很多:4-氨基吡啶,2,6-二氨基吡啶,2,4,6-三氨基吡啶,2,2’-联吡啶等。产物随温度、溶剂性质、氨基钠用量而异。Bechamp 还原法不适用于制备氨基吡啶
类,因为吡啶类在一般情况下很难硝化,所以此反应是吡啶环中直接引入氨基的有效方法。
14. Chugaev 反应
该反应制备烯烃类。黄原酸酯在120~200℃时热解,顺利产生烯烃,相应 醇和氧硫化碳。黄原酸酯在热解前制备不须离析 除黄原酸酯外,其他的酯氨基甲酸酯,碳酸酯和羧酸酯 热解。特别是使用大分子量的羧酸酯(棕榈酸酯)的烯烃提供了有利条件。因为这些酯本身沸点高,而热解温度较低(约300℃),在液相中简单加热即可。 15. Claisen 重排
烯醇或酚类的烯丙醚在加热时,易起重排反应。烯丙基由氧原子上转移到碳原子上,这与弗利斯重排有相似之处。
CH 2CH=CH
2
O H OCH 2CH=CH
2
200℃
OCH 2CH=CH
2
O H
CH 2CH=CH
2
200℃
;
C l
OCH 2CH=CH
2
C l
O H
CH 2CH=CH
2
250℃
醚分子中,
如临位未被取代则不起重排反应,产生复杂的热分解作用。此反应是在苯环引入丙基的
简易方法,因为烯丙基可还原成丙基。 16. Claisen 缩合反应(P352~354) 17. Claisen -Schmidt 反应(P287) 18. Clemmensen 还原(P291) 19. Cope 消除反应
这个反应是由氧化叔胺消除羟胺来产生烯烃。反应在低温进行且产量较高,当加热到120℃时,具有光学活性的纯氧化叔胺1-(N,N-二甲氨基)-3-苯基丁烷就得到具有旋光性的纯3-苯基丁烯-1,而且总是定量进行。
C H
-
65
H 3
C
H 3C H 2
H 5C 6
+(CH 3)2NOH
*
△
20. Criegee 氧化法
乙二醇类在稀醋酸或苯溶液中,室温时用四乙酸铅进行很温和的氧化,两个相连的各带
有游离羟基的碳原子之间的碳链就断裂,得到定量的醛酮类。此法用于研究醇类结构及制备醛酮类且产率很高。
R 2C
CR'2
O H O H ++
+Pb(AcO)
4
R
R
O
R'
R'
O
RHC
CHR'
O H
O H
+Pb(AcO)4
RCHO
R'CHO
21. Curtius 降解
库尔修斯降解是羧酸的迭氮化合物经加热脱氮重排成异氰酸酯,再经水解得伯胺类。若反应在惰性溶剂中进行,可以得到异氰酸酯,并能将它分离出来。
R
N
-
O
N
+
N -N 2
△
重排
O=C=N-R
H 2O
RNHCOOH
RNH
2
- CO
2
R
N
O
22.Darzens-Claisen反应
在无水惰性溶剂中,在碱性缩合剂的作用下,酸性强的α-卤代脂肪酸酯作为亚甲基部分和醛、酮反应,首先生成氯代醇酸酯,随即裂解放出氯化氢得到2,3-环氧酸酯,其再经水解脱羧便得到醛:
O
+
H2C COOR Cl
C
OH
H
C
Cl
COOR
-HCl
C CH
COOR
C CH
COOH
CH CHO
-CO2
除α-氯代酸酯外,其他的C-H酸性化合物如邻和对硝基甲苯,环戊二烯等也能作为亚甲基部分与醛、酮反应。无水惰性溶剂为醚、苯或二甲苯。醛、酮可以是脂肪族、芳香族,也可以是α、β-不饱和醛酮,此反应对于形成C-C键的制备上很重要。23.Delepine反应
六亚甲基四胺与卤代烷反应,生成季胺盐。在稀酸作用下,其水解为伯胺。
C6H12N4 + RCH22-NC6H12N3
2
2
-3I + 6HCHO + 3NH4Cl RCH2-NH2NH2
溶剂为氯仿。卤代烷的反应活性为:RI>RBr>RCl,水解用95%乙醇和稀盐酸,最后能得到纯伯胺。
24.Dieckmann缩合
含有δ或ε位活泼亚甲基的二羧酸二酯在碱性催化剂存在下,分子内起“Claisen缩合”
反应,环化成β-酮酸酯类,其再经水解、脱羧而生成环酮类,当n=2,3时收率最高,高级二羧酸酯的缩合产率很低。
(CH2)n
2
COOR
CH2COOR
(CH2)n
H
C
C
H2
C2H5ONa
COOR
C
水解
2
(CH2)n
H
C
C
H2
COOH
C
(CH2)n
H2
C
C
H2
C O
25.Diels-Alder反应P83-84
26.Etard反应
具有侧链的芳烃,特别是甲基芳烃,在CS2中用二分子铬酰氯氧化,中间产物经水解得芳醛。
C H3CHO
CrO2Cl2
如果分子中有多个甲基,只可氧化一个,这是本反应的特征。
27.Favorskii重排
α-卤代酮用碱处理,消除卤素重排得羧酸:
X-CH 2-COR + NaOH
R-CH 2-COOH + NaX
环状α-卤代酮也可得到羧酸,
同时缩环:
O
H
C l
H COOH
NaOH -NaCl 环氧醚类和羟基缩酮类为副产
物。在此条件下,二卤代酮也可发生重排,产生α、β-不饱和酸 28. Feist -Benary 合成法
此法用来合成呋喃类化合物,在吡啶或氨存在下,α-氯化羰基化合物或α,β-氯醚类与1,3-二羰基化合物发生缩合反应,生成呋喃类化合物。
R
C CH 2Cl O
H 2C COOR'
C CH 3
O
O
R
COOR'
CH 3
H
OC 2H 5Cl CH 2Cl
HC O
CH 2Cl
O
COOC 2H 5
CH 3
-C 25
CH 3COCH 2COOC 2H 5
-H 2O, -HCl
2+
29. Fischer 吲哚类合成法
醛和酮的苯腙类与ZnCl 2一起加热,发生重排,分子内缩合,脱氨环化等作用,最后生
成吲哚类化合物。
N H
CH H 2R NH
CH HC
R 2C
CH R 大量脂肪醛酮和醛酸、酮酸及其酯的芳腙都能发生这个反应。但用这个方法,由乙醛的苯腙不能制得吲哚。通常,β-酮酯的苯腙的能得到吡唑啉酮。ZnCl 2、CuCl 和溴代物或其他重金属卤代物,H 2SO 4、HCl-酒精溶液或冰醋酸都可用作催化剂。 30. Friedel -Crafts 酰基化反应P276, P131-132 31. Friedel -Crafts 烷基化反应P130-131
芳烃与烷基卤试剂在路易斯酸存在下,生成烷基芳烃。
RCl
+
AlCl 3
R
+HCl
烷基化试剂除卤代烷外,醇类、烯烃、甲
苯磺酸烷基酯亦可。各种路易斯酸的催化效应:AlCl 3>FeCl 3> SbCl 5>SnCl 4>BF 3>TiCl 4>ZnCl 2。醇类至少需1mol 路易斯酸作催化剂。因为反应中生成的水使等摩尔的催化剂失去活性,对于卤代烷和烯烃来说,催化量就已足够。酚类的反应较令人满意(P258~259),而低碱度的芳烃如硝基苯、吡啶都不能反应。 32. Fries 重排
在当量数AlCl 3存在下,加热脂肪或芳香羧酸苯基酯,酰基发生重排反应,脂肪酸苯基酯比芳香酸苯基酯更易进行。根据反应条件,重排可以到邻位,也可以到对位。在低温(100℃以下)时主要形成对位产物,在高温时一般得到邻位产物。
3C
OH
COCH 3
OH
H 3C
COCH 3
H 3C
O
CH O
催化剂除AlCl 3外,也可用BF 3、ZnCl 2、FeCl 3。催化剂不同,生成邻、对位异构体的比例也不同。用硝基苯作溶剂有利于重排,可在低温时进行。氯苯、CS 2、CCl 4可用作溶剂。但没有溶剂反应也可以进行。原料结构影响异构体的相对比例。此反应对于合成酰基酚类很重要。
33. Gabriel 氨基酸合成法P454
邻苯二甲酰亚胺钾与α-卤代脂肪酸作用,生成物经水解得到氨基酸。
NK
O
O N
O
O
R
COOC
2H 5
+X
R
COOC
2H 5
-KX
3H 2O(H +
)△
+
+
COOH
COOH
C 2H 5OH
R
N H 2
COOH
34. Gabriel 伯胺合成法P372-373
35. Gattermann 醛类合成法
酚类或酚醚类与无水HCN 和HCl 混合物在无水AlCl 3或ZnCl 2存在下发生反应,生成的
中间物经水解,醛基便导入羟基、烷氧基的邻位或对位。
O H CHO
O
H OHC
O
H +
HCN
+
HCl
AlCl 3
OCH
3
H 3CO
CHO
HCN
HCl
+
+
AlCl
3
40 - 50℃
Gattermann 合成法不仅适用于酚类和酚醚类,也适用于某些杂环化合物,如呋喃、吡咯和吲哚的衍生物(但未经取代的不能反应),也适用于噻吩。醛基总是优先进入活化基团的对位,具有明显的选择性,只有对位被占据才发生邻位取代。
C
H 3C
H 3CHO
N
H
N
H CHO
HCN
HCl +AlCl 3
100℃,
39%
HCN
HCl
+40℃
36. Gattermann -Adams 合成法
这是Gattermann 醛类合成法的改进。由盐酸作用于Zn(CN)2,从而释放出HCN ,避免使用无水氰化氢。
O H
C
H 3CH(CH
3)2
O H
CH(CH
3)2
CHO
C
H 3Zn(CN)
2
+HCl +AlCl 3
99%
37. Gattermann -Koch 合成法P276 38. Grignard 反应P185-186
39. Hantzsch 吡咯类合成法
在氨或伯胺类作用下,α-卤代甲基酮和乙酰乙酸乙酯进行环化反应,再消除HCl 和
H 2O ,产生吡咯羧酸酯。
COOC 2H 5CH 2
C
H 3C
O
Cl
CH 2
C
O
R
+
NH 3-H 2O
N H
R
H 3C
C 2H 5OOC
40. Hantzsch 吡啶类合成法
CH 2
ROOC
H 3C
O
R'
O
H
H
N H
H
COOR CH 2
CH
O COOR CH
3C
NH 2R'H
COOR
O
CH 3
N H
N
R'
H
ROOC
COOR
CH 3
H 3C
R'
ROOC
COOR
CH 3
H 3C
2++
+
乙酰乙酸酯和氨或伯胺及醛类反应,可得到二氢吡啶,其再用亚硝酸脱氢,产生吡啶类衍生物。此反应对吡啶类衍生物的合成是非常有用的。
41. Hinsberg 反应P378 42. Hoesch 合成法
这是Gattermann 醛类合成法的改进。Hoesch 用腈代替氢氰酸,便得到酮。
O
H O H
O H
O
H R
NH.HCl
O
H O H
R
O
N
H N
H R
NH.HCl
N
H R
O
HCl
43. Hoffmann 胺降解
胺类经过彻底甲基化后,生成季胺盐。其再经AgOH 作用,生成相应的季胺氢氧化物。
将此在100~200℃时加热分解,产生叔胺、烯烃。反应中通过亲核羟基离子的作用,使带有最少数烷基的β-碳原子上失去一个质子而生成水,裂解出叔胺得到烯烃。
H 3C
H 2C
H 2C
N
C H 2
CH 3
CH 3H 3C
2C
CH 2H 3C
N
CH 3
CH 2CH 2CH 3H 2O
OH
++在各种取代的季胺化合物中,甲基比具有两个或多个碳原子的烷基有较大的韧性。因此一般不能被消除。对于没有β-者也不发生消除,而是取代。
(CH 3)43)3N + CH 3OH 130~135℃
44. Hoffmann 烷基化反应
卤代烷与氨或胺的反应。反应最后产物是一个复杂的混合物。如果混合物的沸点有一点的差距,可用分馏的方法将其一一分离,这适用于工业上大规模的制备。 H
3N + RX H 3RNH 3 + NH RNH 24RNH 22NH 2 + X R 2NH 2 + NH 2NH + NH 4R 2NH + RX
R 3NH + X R 33
R 3N + NH 4
也可利用原料摩尔比不同,控制反应温度、时间和其他条件,使其中某一个胺为主要产物。脂肪卤代烷的反应速度:RI>RBr>RCl 。仲、叔卤代烷易与氨作用失去一分子卤化氢成为烯。芳香卤代物一般不易与氨或胺发生反应,只有在高温高压及催化剂存在时或卤素的邻、对位有一个或多个强吸电子基团存在时,才可发生此反应。
C 6H 5Cl
NH 3
C 6H 5NH 2
C l
NO 2
NHCH
3
NO 2
+
+
CH 3NH 2
CU O, 200℃C 2H 5OH 160℃
此法可制备一级、二级、三级胺,但不易得到纯化合物。
45. Hoffmann 酰胺降解P339 46. Hoffmann 消除反应
仲烷基、叔烷基进行消除反应时,被消除对质子系来自带有最少烷基的β-碳原子上,
产生的烯烃在其双键上具有最少数目的烷基。
H 3C
H 2C
C CH CH 3
OH
H 3C
H 2C
C
CH 2
CH 3
- H 2O
这种消除叫Hofmann 消除或Hofmann 定向。这种烯烃叫Hofmann 烯烃。 47. Knoevenagel 反应P354
48. Kolbe 烃合成法
此法通过电解羧酸盐制备烷烃。一般使用高浓度羧酸钠盐,在中性或弱酸性溶液中进行电解。用铂电极于较高的分解电压和较低的温度下进行反应,阳极处产生烷烃和二氧化
碳,阴极处产生NaOH 和H 2。羧酸原子数不宜太多或太少,最好在10个左右。
2CH 3COONa + 2H 22H 6 + 2CO 2 + 2NaOH + H 2如果用两种羧酸钠的混
合溶液进行反应,生成三种不同的烷烃,其性质相近,难以分离,故无制备意义。用二元羧酸酯盐的水溶液进行电解,可得到二元羧酸酯,这在制备上是可行的。H 2C
H 2C
COONa COONa
H 2C H 2C
H 2C COOR
H 2C
COOR
2
+ 2CO 2
49. Kolbe 腈合成法
碱性氰化物与卤代烷的无水醇溶液在一起加热,便生成腈。通常利用此反应合成多一个
碳原子的羧酸。RCN + NaX 反应中异腈为副产物,可由其特殊
气味识别。形成异腈的量取决于所用金属氰化物的性质。如AgCN 得到100%异腈,
CuCN :56%,Ca(CN)2:11%,Zn(CN)2:2.6%,用KCN 、NaCN 仅有少量的异腈产生。烷基化试剂反应速度:RI>RBr>RCl ,伯烷基>仲烷基,叔烷基易发生异构反应,一般不用。
50. Kolbe -Schmitt 反应
在绝对无水的情况下,干燥的CO 2和苯酚钠在压热器中加热180~200℃,生成大约25%
水杨酸钠盐,其再酸化即得水杨酸。
ONa
O H
O H
COOH
+
CO 2
+
+
Schmitt 对此反应进行改良,在低温125℃、4~7atm 时反应,几乎可得理论量的水杨酸。 51. Kucherov 反应
乙炔在Hg 2+
盐和稀硫酸存在下直接水合生成乙醛,单取代乙炔可生成甲基酮。
C
H C H
+
+
H 2O
CH 3CHO
RC
C H
Hg
++
/ H 2SO
4
Hg
++
/ H SO
H 2O
RCOCH
3
52. Lebedeff 合成法
在高温下(400~500℃)乙醇与特种催化剂硅酸盐、Al 2O 3、ZnO 混合物作用,脱氢脱
水得1,3-丁二烯。
++
2CH 3CH 2OH
C
2CH 2
H 2H 2O
丁二烯的产
率大约为20%,其他副产物如戊烷、己烷、己烯、己二烯、丁醇、醛、酮都有,所以此反应制备意义不大。 53. Leuckart 反应
在甲酸(甲酰胺、甲酸铵)作还原剂的情况下,加热胺和羰基化合物,就发生胺的烷基
化反应。R
N H
R'
O
R'"R"
N
R
R'R'"R"
++
+
+
HCOOH
CO 2
H 2O
通过
这种反应可使伯胺、仲胺及氨发生烷基化反应,但以叔胺为最妥。因为伯胺、仲胺总是
有多烷基化副产物形成。特别是很活泼的甲醛,同时总是生成完全甲基化的胺。高沸点芳香醛和酮产物为40~90%,低分子量脂肪醛和酮不能得到满意大结果。反应中由少量MgSO 4或MgCl 2催化,起还原作用的甲酸经常是过量,每摩尔羰基化合物需2~4mol 甲酸。
54. Lieben 碘仿试验P289 55. Lossen 降解
氧肟酸或其酰基衍生物,在惰性溶剂或最好在亚硫酰氯、乙酸酐、P 2O 5存在下加热分解
而得到异氰酸酯。
O
OR
R
O
N
R
H O H +NH 2OH
(Ac)
56. Mannich 反应
这是具有α-活泼氢化合物的胺甲基化反应。一般是甲醛与胺及具有α-活泼氢化合物
同时反应,胺甲基取代一个α-活泼氢:反应一般在水、醇或醋酸溶液中进行。
N
H CH 3
CH 3
H 3CCOCH
2CH 2N
CH 3
CH 3
2CH 2COCH
3C
CH 3
CH 3
CH 3COCH
3
+
+
HCHO
.HCl .HCl 甲醛可以是甲醛溶液、三聚或多聚甲醛,胺一般是仲胺盐酸盐,如二甲胺、六氢吡啶等等盐酸盐,反应中生成单一产物。伯胺或氨副产物多不常使用。此反应合成范围广,不但醛和酮的活泼氢可以进行反应,其他化合物如羧酸、酯、酚或其他杂环化合物(如噻吩、吡咯、吲哚等)的活泼氢也都可以,特别值得注意的是在合成体系及氨基酸方面的应用。
57. Meerwein -Ponndorf -V eriey 还原
醛、酮与醇镁或醇铝反应,醛酮被还原成醇,而醇盐则被氧化成相应的羰基化合物。
O R
O
R'
H
Al
O
R
R
H
Al O
R'
R'
+
_3
/3
3
+
反应中,醇盐与加入的醇处于平衡状态,当催化量的醇盐存在时,用醇作还原剂也可发
生反应,醇铝溶于有机溶剂,在蒸馏时不被分解。它的螯合倾向较大,所以醇铝特别适合Meerwein -Ponndorf -V eriey 还原。仲醇盐比伯醇盐更好,产生的副反应当可能性更小。上式为平衡反应,要得到好的收率必须不断从平衡中出去由醇铝所生成的羰基化合物。丙酮易挥发,可以蒸出,使平衡破坏,促使反应向右移动,所以用异丙醇作还原剂。如果用乙醇作还原剂,最好用氮气流把生成的乙醛从反应混合物中带走。此反应特点:(1)双键(即使是与羰基共轭的双键)能够保留而不被还原;(2)硝基与卤素不被还原;(3)β-二羰基化合物通常不能进行此反应,因为会生成酸性较强的铝化物沉淀。 58. Meyer 合成法
卤代烷与金属亚硝酸盐反应,合成硝基烷。亚硝酸酯为副产物。用碘代甲烷、乙烷、正
丙烷、异丙烷反应很顺利。但用高分子量卤代物容易发生副反应。伯、仲、叔烷基不同,
得到不同的主要产物:
+RCH 2X
NaNO
2
RCH 2NO 2
NaX
(主要产物硝基烷),
++R 2CHX
NaNO 2
NaX
2CHONO
(亚硝酸酯较多),
++NaNO 2
NaX
3CONO
R 3CX
(全为亚硝酸酯)。
59. Meyer -Schuster 重排
在酸性催化剂存在下,乙炔甲醇类重排成α、β-不饱和酮类。芳基取代的乙炔甲醇最
易重排:H 5C 6C
C
C 6H 5
H 5C 6
O H
C CH
H 5C 6
H 5C 6
C O
C 6H 5
H
+
60. Michael 加成
在碱性催化剂(哌啶、二乙胺、NaOR 等)存在下,活泼酸性CH 2基与活泼碳碳双键(α、β-不饱和羰基化合物、酯、腈)发生亲核加成。
H 5C 6
CH
CH
COOR
5C 6
HC
CH 2COOR
COOR
COOR
+
H 2C
COOR
COOR
H 5C 6
CH 2COOH
CH 2COOH
活泼CH 2基化合物可用通式
R
A
B 来表示。其中A ,B 可以是-COOR 、-COR 、-
CN 、-CONH 2、―NO 2、―SO 2R 、―CHO 等。亚甲基越容易放出质子,就越容易发生加成反应。活泼碳碳双键化合物可用通式-RC =CH -来表示。R 为-COOR 、-COR 、-CN 、-CONH 2、―NO 2、―SO 2R 。乙炔类和醌类也可以发生这种反应。反应活性随双键极性增加而增大,在反应中常发生醇醛缩合和Claisen 缩合,使反应复杂。若使用相应的烯胺作为酸性亚甲基部分,反应中由碱性引起的副反应便可预先避免。 61. Nef 合成法
乙炔钠与羰基双键加成,水解即得乙炔醇类:
O
C
H 3C H 3
+NaC
C H
C ONa
C
H 3C H 3
H O
C H
OH
C
H 3C H 3
苯乙酮和苯基乙炔钠在醚溶液中作用能发生相似的反应。
62. Oppenauer 氧化P274
在叔丁醇铝存在下,伯、仲醇用过量的酮或醌类使之氧化成相应的醛或酮。
R
R'
O H
+
+(H 3C)2C
O
[(CH 3)3C-O]3Al
(CH 3)2CHOH
R
R'
O
常用的酮为丙
酮、2-丁酮、环己酮。在特殊情况下可同时加入适量的苯、甲苯或1,4-二氧六环作为稀释剂,以减少生成物发生缩合反应的机会。本法也适用于氧化不饱和甾族醇类及由不饱和醇制备不饱和酮。
63. Pechmann 反应
在浓硫酸、AlCl 3、P 2O 5等脱水剂存在下,酚类与β-酮酸酯类进行缩合反应,产生香
豆素类。
O
H O H
O H
O
H O H
O O H O
C H 3
O
O
H O H
C H 3
O
O
CH
RO C O
H C H 3
+
CH COCH COOC H -H 2O, -C
2H 5OH
改变酚为酮酯的结构可以合成具有各种取代基地香豆素类。取代基可以在苯环上、杂环
上,也可同时在二者之上。酚间位有给电子基团能加速缩合,相反,吸电子基团则减缓反应进行。
64. Perkin 脂环化合物合成法
在乙醇钠存在下,含有活泼亚甲基化合物与二卤代物反应,生成环状羧酸酯,再经水解、加热、脱羧即得环烷烃及其衍生物。
H 2C H 2C
Br
Br
H 2
C
COOR
+除三元环外,也可制得四、五、六、七元环,产率高低取决于环的大小。 65. Perkin 反应
芳香醛和酸酐,在此酸的碱性盐存在下,发生醇醛缩合反应,生成α、β-不饱和羧酸。
C 6H 5-CHO
(CH 3CO)2O CH 3COONa
C 6H 5-CH=CH-COOH
170-180℃
+除简单芳香醛外,某些取代
芳香杂环醛也可用作羰基组分。甚至二芳基、芳基烷基酮与强活性亚甲基化合物也能够反应。脂肪醛反应产率很低。酸酐的α-碳原子上有两个氢原子方可作为亚甲基组分。高分子量比低分子量酸酐好。
66. Prileschajew 反应
烯烃与有机过氧酸作用,发生双键的过氧化作用。最常用的氧化剂为过氧苯甲酸,过氧
苯乙酸。通常反应在丙酮、乙醚。氯仿中进行。反应条件温和,对于制备很有用。
R H
H
R
O
R H
R H
OOH
O
COOH
O
CH
C
2+
+
CH 2=CH-CH=CH
反应活性:R 2C=CR 2>RHC=CR 2>R 2C=CH 2≈RCH=CHR>RCH=CH 2>H 2C=CH 2.羧基和羰基起相反作用。反应如在水溶液中进行,环氧化物将进一步水解成1,2-二醇类。 67. Prins 反应
在酸催化下,甲醛与烯烃加成,生成m -二噁烷类和1,3-二醇类。反应中也可生成不饱
和醇。
C
H 3C H
C H CH 2
C
H 3C 3O H
CH 2O H
CH 2
O CH 2
CH 2
O
C H 3C
H 3+
2CH 2O, H
稀硫酸是最好的催化剂。
磷酸、BF 3也可用。叔基取代烯烃和不对称烯烃,如丙烯或1-丁烯最容易反应,m -二噁烷通过酸解可以转变成1,3-二醇类,再经脱水即可形成共轭二烯类。 68. Reformatsky 合成法P322
69. Reimer -Tiemann 合成法
在碱性水溶液中,苯酚与氯仿作用,产生邻、对位取代醛类。两种产物的比例取决于取
代基和溶剂,如果在吡啶中进行,仅产生邻位醛,产率20~30%,很少超过50%。酚本
身可得到60%水杨醛。
O H
O H
CHO
CHCl
HO
+
苯环上有吸电
子取代基,如-SO 3H 、-CN 、-COOH 、-NO 2能使苯环钝化,产率大约降为25%。只有含有游离酚式羟基的化合物,才能转变成醛。溴仿、碘仿及三氯乙酸同氯仿一样,容易进行反应。此法产率虽低,但操作简单,仍为合成酚醛的重要方法。 70. Riley 氧化法
活泼甲基或亚甲基化合物用二氧化硒氧化,甲基或亚甲基被氧化成羰基。羧酸为进一步
氧化副产物。溶剂为乙醇、冰醋酸、乙酸酐、苯、二甲苯等,活泼甲基、亚甲基化合物除一般醛、酮(R(H)COCH 3)外,酯环酮、杂环重键结构及稠环体系也可以。
RCH 2CHO
C H H 2
H 2
RCOCHO
CH 3COCH
CH 3COCHO
SeO
SeO
本氧化剂具有选择性,广泛用于有机合成和有机物结构研究方面。
71. Rosenmund 还原
纯的芳香或脂肪类酰氯在Pa -BaSO 4催化剂存在下,常压氢化得到相应醛类。
RCOCl
RCHO
H 2(Pd-BaSO 4)
本法主要缺点是生成的醛类易进一步被还原成醇或烃类。
为了防止这个副反应的发生,在反应体系中可加入适量“抑制剂”,硫脲、异氰酸苯酯、喹啉-硫等最为适用。它既能防止副反应发生,又使酰氯的氢化不受到阻抑。本法广泛用于制备醛类,收率可达50~80%,有时达90%以上,但还原二酰氯制二元醛结果不好。在还原的化合物中,如有双键结构、硝基、卤素及酯基存在时不发生影响。但若有羟基存在,应预先酰化加以保护。
72. Rosenmund -Braun 芳腈合成法
芳香族溴化物和CuCN 在高温下反应,溴原子被氰基取代,生成芳腈类化合物。用稍过量的氰化物可获得极高产率的芳腈。加入少量的苄腈或CuSO 4能增进反应速度,对苯二
酚能抑制反应。Br CN
CuCN
CuBr
+
+
73. Sandmeyer 反应
芳香族重氮盐在亚铜盐催化剂存在下,重氮基(-N 2X )被-Br 、-Cl 、-CN 等置换,生成芳香族取代物。反应副
产物为二苯基衍生物。由于铜阳离子只起给予或接受电子的作用,所
以当用容易氧化或还原的取代基时便不需要使
用亚铜盐作催化剂。如用碘化物阴离子时,碘
离子本身即成为催化剂。此反应产率高,范围广。其重要性在于可以通过硝基使不能直接引入或不能引入预期位置的取代基到苯环上。 74. Saytzeff 消除反应
就仲烷基和叔烷基而言,消除反应可能按两种方向进行,导致双键位置不同的烯烃。双键上具有最多数目烷基的烯烃称为Saytzeff 烯烃。在Saytzeff 消除时,也有Hofmann 消除产物。一般来说,单分子消除反应主要产生Saytzeff 产物,如仲卤代烷和叔卤代烷以
C
C C C H X
H
C C C C H
C C H
αβ
βCH 3CH 2
CH 3
CH 3
OH
H 3C
C H
CH 3CH 3
CH 3CH 2
CH 2
CH 3
+87.5%
12.5%
15%H 2SO 4
2
甲苯磺酸酯作溶剂脱卤化氢,以及仲醇和叔醇的脱水反应。在双分子消除反应中,反应取向主要取决于α位和β-位上取代基地性质以及脱去基团X 的性质。一般规则是:容易消去的基团有利于Saytzeff 倾向。 75. Schiemann 反应
Schiemann 反应是芳环上导入氟原子的反应。反应分两步进行,首先,芳香伯胺制成氟硼酸重氮盐,然后将其干燥后在适当条件下加热分解,生成芳香族氟化物。
N +
N
R
r
N
+++++
+++C 6H 5-NH 2
2HCl NaNO
2
C 6H 5-N 2
Cl
NaCl 2H 2O
HBF
4
C 6H 5
N 2BF 4
HCl
C 6H 5-F
N 2BF 3
重氮化
C 6H 5-N
2Cl
C 6H 5N 2BF 分解
△
氟硼酸重氮盐极
为安定,在大量制备时无危险。它大都具有一定的分解温度,分解速度很容易控制。氟
化物收率一般为65%,有时达80~90%。 76. Schmidt 反应
在苯中,含羰基的化合物能被叠氮酸降解。一元羧基降解为胺,在两个羧基之间具有一个以上亚甲基的二元酸得到二元胺,醛类产生腈和胺的甲酰基衍生物,酮产生酰胺。
RCOOH +
+++++++
+
+
HN 3
H SO
R-NH
2
CO 2N 2
HOOCCH 2CH 2COOH
2HN 32NCH 2CH 2NH 2
2CO 22N 2
RCHO
RCN RNHCHO
RCOR RCONHR
H 2SO
4
24
H 2SO
4
HN 3
HN 3
N 2
77. Schotten -Baumann 反应
在碱性化合物存在下,酰氯类使醇、酚等活泼氢化合物的酰化作用称为Schotten -Baumann 反应。芳香酰氯一般不如脂肪酰氯活泼,不易发生反应,对于易水解的酰氯类不适用于此法。上述反应中,生成的苯甲酸酯(分子量较高者)一般稍溶于水,结晶良好,具有固定熔点,所以Schotten -Baumann 反应常用来分离、鉴定醇和酚。
C 6H 5C O C l
+
+++++N a C l H 2O ++N a C l H 2O
+
+
N a C l
H 2O ++N a C l H 2O
N a O H N a O H N a O H
N a O H
C 6H 5C O C l
C 6H 5C O C l C 6H 5C O C l
R O H
Ar O R N H 2
R S H
6H 5
C O O R
C 6H 5C O O Ar
6H 5C O N H R 6H 5C O S R
78. Skraup 反应
在浓硫酸和氧化剂(硝基苯、As 2O 5、Fe 2O 3、苦味酸等)的存在下,苯胺和甘油反应合
成喹啉。NH
2
2
CH CH
O
H
+
式中丙烯醛是甘油由硫酸脱水而形成的,所用苯胺只要邻位无取代基者均可进行此反应。苯胺和甲基乙烯基酮缩合,生成4-甲基喹啉。
NH 2
CH 2
CH C
O
N
CH 3
CH 3
+
此反应对于制备取代喹啉类应用范
围极其广泛。 79. Sommelet 反应
卤代烷和六次甲基四胺作用,生成的季胺盐不需分离,再用60%稀醇液水解,生成醛类。
RCH 2X + (CH 2)6N H 2O
△
3 + CH 3NH 2
C 6H 5CH 2X + (CH 2)6N 4
C 6H 5CHO + NH 3H 2
O
△
2(CH 2)6N 4]X
6H 5CH 2(CH 2)6N 4]X
80. Stephen 合成法
将干燥的HCl 气体通入腈类及无水SnCl 2的干醚饱和溶液中,氰基还原得到醛。
RCH + HCl
SnCl 2
反应结果好坏取决于腈的结构,邻甲苯腈和邻硝基苯甲腈
得到相应醛的收率都很低。 81. Stobbe 缩合反应
在醇钠作用下,丁二酸酯与醛酮缩合,得到烷叉丁二酸酯。丙酮和丁二酸酯缩合,产生
异丙叉丁二酸单酯:H 3C
H 3O COOR H 2C
H 2
C
C C
H 3H 3C
COOR
CH 2COOH
+
NaOR'
亚甲基组分为丁二酸二甲(乙,t -丁)酯及其芳基、烷基、烷叉基衍生物。羰基组分除醛、酮氰酮外,在某些情况下,α、β-不饱和醛和酮、酮酯及二苯基乙二酮也可应用。 82. Stvecker 氨基酸合成法
在氨存在下,无水HCN 与醛的羰基加成,生成的α-氨基腈再经水解,产生α-氨基酸,产率75%。为方便起见也可用NaCN 代替HCN ,此法的缺点是氰化物剧毒,而且许多醛类难以得到。
R
CHO
+CH (R R
C
CH 3
N R
NH 2
COOH
NH HCN
H 2O H
+
83. Thorpe 反应
在乙醇钠催化下,腈与活泼亚甲基化合物加成,生成亚胺化合物。如果一个分子内具有
二个所需的官能团则发生环化反应。 ROOC
CH 2
CN C
N
H 2C
COOR
ROOC
H C CN
C
NH
CH 2COOR
H 2C H 2C
CH 2
CN
CH
C COOR
O
C 2H 5ONa
+
84. Tollens 缩合
在Na 2CO 3或Ca(OH)2催化剂存在下,甲醛与含有α-H 的醛和酮反应,生成多元醇类。
HCHO + CH 3CHO + H 2O
2OH)4 + HCOOH 此反应实际上是醇醛缩
合与交叉Cannizzaro 反应的合并,利用此反应可制备多元醇类。 85. Ulmann 反应
芳基卤代物在高温下(100~360℃)用铜粉处理,发生二芳基缩合反应。反应活性:
ArI>ArBr>ArCl 。碘化物特别适合。应用此法可制备对称和不对称二芳基类。
I
I
++
+Cu CuI 2
为
调节反应,可用硝基苯、甲苯、苯或DMF 作溶剂。
86. Ultee 羟腈合成法
在微量KCN 存在下,低温(0℃)时,醛、酮与无水HCN 作用,产生羟腈化合物。
O R
R'
OH
CN R'
R
+ HCN
87. Urech 羟腈合成法
金属氰化物在乙酸存在下,生成的氰化氢与醛、酮的羰基起加成反应生成羟腈。
O R
R'
OH
CN
R'
R
+ KCN + CH 3COOH
+ CH 3COOK
丙酮的羟腈
产物可得78%。利用此反应可制得氨基酸、羟基酸。
88. Vilsmeier 反应
芳香化合物、杂环化合物及活性烯烃化合物用取代甲酰胺和磷酰氯处理,发生甲酰化作
用得到醛类。常用的甲酰化试剂为N -甲基甲酰替苯胺。但DMF 和甲酰哌啶也可应用。
N
CHO
C H 3
C H 3
3)2N +
POCl
3
在某些情况下,可用光气来代替磷酰氯,如烷基苯胺用N -甲基甲酰替苯胺和磷酰氯等克分子混合物处理,形成烷基氨基苯甲醛。该合成法应用范围较广,使用插烯的酰胺也可进行甲酰化,生成不饱和醛。常用溶剂为苯、氯苯和邻二氯苯,也可使用过量的DMF 。 89. V olhard -Erdmann 噻吩类合成法
丁二酸二钠盐衍生物在硫化磷的作用下,环化成噻吩类:此法可用来合成芳烷基噻吩,
并可控制取代位置,产率25~30%。
ONa
ONa
O
O
R
R'
S
R
R'
P2S3
90.Wagner-Meerwein重排
此重排好像是片那酮重排的逆转。醇、卤代烷等进行消除反应时,位于季碳原子α-位的取代基(如羟基、卤素等)发生消除,同时烷基进行重排,生成Saytzeff烯烃。如仲
醇的脱水反应:
H
C CH3
OH
H3C
H3C
H3
H
C CH
H3C
3
C
H3
H
C CH3
CH3
H3C
H3
H3
H3C CH3
3
+
CH3-重排
-H+
91.Willaruson合成法P236~237
92.Willgerodt-Kindler反应
在高压下,烷基芳基酮被多硫化铵溶液氧化成碳原子数相同的ω-芳基烷基羧酸。
ArCO(CH2)nCH3(NH4)2Sx H2Ar(CH2)n+1COOH
++式中甲基被氧化成羧基,羰基被还原成次甲基。Rindler进行改良,不用加压,用硫磺和仲胺(一般是吗啉)
Ar C CH3
O
Ar
H2
C C NR2
S
Ar
H2
C C OH
O
+ H2S + R2NH S, R2NH2H
2
O
代替多硫化物溶液,此法甚为重要,特别是用于从芳基甲基酮制备芳基乙酸,因为所用原料很容易由傅氏酰基化制得。
93.Wittig反应P478~481
94.Wold-Ziegler反应
在CCl4中,不饱和化合物与N-溴代丁二酰亚胺一起加热,发生烯丙基溴代,而不发生
双键加成:C
H
C
H
H2
C N C
H
C
H
H
C
Br
+
N-溴代丁二酰亚胺是烯丙基型溴代的特种试剂。一般来说,亚甲基比甲基反应更快。本法适用于含有孤立的或共轭双键的单烯烃类、脂肪和脂环烯烃类、异戊二烯衍生物,甾族化合物等。另外羰基化合物、芳环侧链及杂环化合物都可以烯丙基溴代。
基础有机化学反应总结【超级全面】
基础有机化学反应总结 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 X +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH -
【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】 CH 2 C H 33H 32 3H 32 CH CH 2C H 3 2 CH CH=CH (CH 3CH 2CH 2)3 - H 3CH 2CH 2C 22CH 3 CH 2B O CH 2CH 2CH 3 H 3CH 2CH 2C 2CH 2CH 3 + O H - O H B - OC H 2CH 2CH 3CH 2CH 2CH 3 H 3CH 2CH 2B OC H 2CH 2CH 3 CH 2CH 2CH 3H 2CH 2CH 3 HOO -B(OCH 2CH 2CH 3)3 B(OCH 2CH 2CH 3)3 + 3NaOH 3NaOH 3HOC H 2CH 2CH 33 + Na 3BO 3 2 【例】 CH 3 1)BH 32)H 2O 2/OH -CH 3 H H OH 3、X 2加成 C C Br /CCl C C Br 【机理】
有机化学人名反应机理
1.Arbuzov 反应 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 一般认为是按 S N2 进行的分子内重排反应: 2.Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 3.Baeyer----Villiger 反应
过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排: 不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 4.Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
化学:2.1有机化学反应类型 教案
化学:2.1有机化学反应类型教案
————————————————————————————————作者:————————————————————————————————日期:
有机化学反应类型教学案 课标研读: 1、根据有机化合物组成和结构的特点,认识加成、取代和消去反应; 2、学习有机化学研究的基本方法。 考纲解读: 1、了解加成、取代和消去反应; 2、运用科学的方法,初步了解化学变化规律。 教材分析: 有机化学反应的数目繁多,但其主要类型有加成反应、取代反应、消去反应等几种。认识这些有机化学反应的主要类型,将有助于学生深入学习研究有机化合物的性质和有机化学反应。本节课的知识是建立在《化学2(必修)》和本模块教材第一章第3节以烃为载体的具体反应事实,以及本模块教材第一章第2节有关有机化合物的结构讨论的基础上的。本节的理论知识和思想方法为后面三节有关烃的衍生物的性质的学习提供了很好的理论和方法平台。本节教材在全书中处于非常重要的地位,可谓本模块教材的学习枢纽。 教学重点、难点:对主要有机化学反应类型的特点的认识;根据有机化合物结构特点分析它能与何种试剂发生何种类型的反应生成何种产物。 学情分析: 通过对《化学2(必修)》第三章及本模块第一章的学习,已经对取代反应和加成反应有了初步的了解,对各类有机化合物的基本结构和各种官能团有了初步的认识。这些都为本节课的学习奠定了基础。 教学策略: 1、结合已经学习过的有机反应,根据有机化合物组成和结构的特点,认识加成、取代和消去反应,初步形成根据有机化合物结构特点分析它能与何种试剂发生何种类型的反应生成何种产物的思路,能够判断给定化学方程式的反应的类型,也能书写给定反应物和反应类型的反应的化学方程式。 2、分别从加(脱)氧、脱(加)氢和碳原子氧化数变化的角度来认识氧化反应(还原反应),并能够根据氧化数(给定)预测有机化合物能否发生氧化反应或还原反应。 3、从不同的视角来分析有机化学反应,了解研究有机化合物的化学性质的一般程序。教学计划: 第一课时:有机化学反应的主要类型 第二课时:有机化学中的氧化反应和还原反应 第三课时:典型题目训练,落实知识 导学提纲: 第一课时 课堂引入: 写出下列化学方程式,并注明化学反应类型。 乙烯与氯化氢反 应:; 丙烯通入溴的四氯化碳溶 液:; 乙炔通入溴的四氯化碳溶液: ;
大学有机化学反应方程式总结(较全)
有机化学 一、烯烃 1、卤化氢加成 (1) CH CH 2 R HX CH CH 3R X 【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。 【机理】 CH 2 C H 3+ CH 3 C H 3X + CH 3 C H 3 +H + CH 2 +C 3X + C H 3X 主 次 【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。 【注】碳正离子的重排 (2) CH CH 2 R CH 2CH 2 R Br HBr ROOR 【特点】反马氏规则 【机理】 自由基机理(略) 【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。 【本质】不对称烯烃加成时生成稳定的自由基中间体。 【例】 CH 2 C H 3Br CH CH 2Br C H 3CH + CH 3 C H 3HBr Br CH 3CH 2CH 2Br CH CH 3 C H 3 2、硼氢化—氧化 CH CH 2 R CH 2CH 2R OH 1)B 2H 62)H 2O 2/OH - 【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。 【机理】
2 C H3 3 H3 2 3 H3 2 CH CH2 C H3 2 CH CH=CH (CH3CH2CH2)3 - H3CH2CH2C 22 CH3 CH2 B O CH2CH2CH3 3 CH2CH2C 2 CH2CH3 +O H- O H B-OCH2CH2CH3 CH2CH2CH3 H3CH2CH2 B OCH2CH2CH3 CH2CH2CH3 2 CH2CH3 HOO- B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOCH2CH2CH33+Na3BO3 2 【例】 CH3 1)BH 3 2)H 2 O 2 /OH- CH3 H H OH 3、X2加成 C C Br 2 /CCl 4 C C Br Br 【机理】 C C C C Br Br C Br +C C Br O H2+ -H+ C C Br O H
高中化学选修5常见有机反应的十大类型
常见有机反应的十大类型 1. 取代反应 有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。(1)卤代: (2)硝化: (3)磺化: (4)卤代烃水解: (5)酯水解: (6)羟基()取代: (7)分子间脱水:
2. 加成反应 有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应。 (1)碳碳双键的加成: (2)碳碳三键的加成: (3)醛基的加成: (4)苯环的加成: 3. 加成聚合(加聚)反应 相对分子质量小的不饱和化合物聚合成相对分子质量大的高分子化合物的反应。 (1)丙烯加聚: (2)二烯烃加聚:
4. 缩合聚合(缩聚)反应 单体间相互反应而生成高分子化合物,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。 (1)制酚醛树脂: (2)缩聚制酯: (3)氨基酸缩聚: 5. 消去反应 有机化合物在一定条件下,从一个分子中脱去一个小分子(如水、卤化氢等)而生成不饱和(含双键或三键)化合物的反应。 6. 氧化还原反应 在有机化学中,通常把有机物得氧或去氢的反应称为氧化反应;反之,加氢或去氧的反应称为还原反应。 (1)氧化反应:
(2)还原反应: 7. 酯化反应(亦是取代反应) 酸和醇起作用,生成酯和水的反应 8. 水解反应(亦是取代反应,其中卤代烃、酯的水解见取代反应部分) 化合物和水反应生成两种或多种物质的反应(有卤代烃、酯、酰胺、糖等)。 麦芽糖葡萄糖 9. 脱水反应(又叫碳化) 有机物分子脱去相当于水的组成的反应。
10. 裂化反应 在一定条件下,把相对分子质量大、沸点高的长链烃,断裂为相对分子质量小、沸点低的短链烃的反应。 (责任编辑:化学自习室)
有机化学完成反应练习
第一部分:烯烃 1. 2hv 2. 2 3.Br 4.2 5. 2 6. Cl -H O 7. ICl H ICl H 8. 9. CH 3CHCH CH 2 3 D 2 Pt 10. 11. 4 12. (1)OsO 4 吡啶 (2)NaHSO 3 (1) (2) 13. CF 3CO 3H H 3O + (1) (2) 14. CF 3CO 3H H 3O + (1) (2) 15. F 3C H 2SO 4 浓 H 2O 16. 17. HBr ROOR 18.
(1) (2)19. B 2H 6 H 2O 2/OH (1) (2) 20. O 3 Zn/H 2O 21. KMnO 4 + 22. CF CO H 23. CF CO H 24. CF CO H 第二部分:炔烃和二烯烃 1. Na NH 3(l) 2. H 2 Lindlar 3. H O HgSO 4/H 2SO 4 4. (1) B 2H 6 (2) H 2O 2/OH 5. HCN 6. (1) B 2H 6 (2) CH 3COOH - 7.3OH 3 C 2H 5ONa 8. 9. Br 10. 11. 12.H Lindlar KMnO 13. H 2
14. Br 3 15. Br 2 16.2 Cu Cl / NH Cl 17. 2NH 3(l) 25 18. 19. 2低温 20. 2 高 温 Br Cl 21. 22. CN CN + 23. COOCH 3 + H 3COOC 24. + 25.+ O O 26. (1)O 32 +Cl 2 27. 第三部分:脂环烃 NBS 1. 2. 2 Ni 3. HBr 4. (1)(2) H 2 SO 4 浓 H 2O
高级中学化学有机收集五有机反应类型
有机专题五——有机反应类型 1.取代反应 (1)定义:有机物分子里的某些原子或原子团被其他原子或原子团所代替的反应。 (2)能发生取代反应的物质:烷烃、芳香烃、醇、酚、酯、羧酸、卤代烃。 (3)典型反应 2.加成反应
(1)定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合生成别的物质。 (2)能发生加成反应的物质:烯烃、炔烃、苯及同系物、芳香烃、醛、酮、单糖、不饱和高级脂肪酸的甘油脂及不饱和烃的衍生物等。 (3)典型反应 3.加聚反应 (1)定义:通过加成聚合反应形成高分子化合物。 (2)特征: ①是含C=C双键或叁键物质的性质。 ②生成物只有高分子化合物,因此其组成与单体相同。
(3)能发生加聚反应的物质:烯、二烯、含C=C的其他类物质。 (4)典型反应 4.缩聚反应* (1)定义:通过缩合反应生成高分子化合物,同时还生成小分子(如H2O、NH3等)的反应。 (2)特征:有小分子生成,因此高分子化合物的组成与单体不同。 (3)能发生缩聚反应的物质 ①苯酚与甲醛 ②二元醇与二元酸 ③羟基羧酸 ④氨基酸 ⑤葡萄糖 (4)典型反应
5.加聚反应与缩聚反应的区别 (1)加聚反应与缩聚反应,虽是合成高分子化合物的两大反应,但区别很大。 (2)加聚反应是由不饱和的单体聚合成高分子的反应,其产物只有—种高分子化合物。 (3)参加缩聚反应的单体一般含有两种或两种以上能相互作用的官能团(两个或两个以上易断裂的共价键)的化合物,产物中除一种高分子化合物外,还生成有小分子。如H2O、HCl、NH3等。产物的组成与参加反应的任何一种单体均不相同。 (4)从反应机理上看,加聚反应是不饱和分子中的双键或叁键发生的,实质还是加成反应。所以,双键、叁键是发生加聚反应的内因。缩聚反应是通过单体中的官能团相互作用经缩合生成小分子,同时又聚合成大分子的双线反应。发生缩聚反应的内因是相互能作用的官能团(或较活动的原子)。 (5)发生加聚反应的单体不一定是一种物质,也可以是两种或两种以上。如丁苯橡胶就是由单体1,3-丁二烯和苯乙烯加聚而成,缩聚反应的单体不一定就是两种,也有一种的,如单糖缩聚成多糖、氨基酸缩聚成多肽,也可以是两种以上的。
大学有机化学总结习题及答案-最全69767
有机化学总结 一.有机化合物的命名 1. 能够用系统命名法命名各种类型化合物: 包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。 2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。 立体结构的表示方法: 1 )伞形式:COOH OH 3 2)锯架式:CH 3 OH H H OH C 2H 5 3) 纽曼投影式: 4)菲舍尔投影式:COOH 3 OH H 5)构象(conformation) (1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。 (2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。 (3) 环己烷构象:最稳定构象是椅式构象。一取代环己烷最稳定构象是e 取代的椅 式构象。多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。 立体结构的标记方法 1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。 CH 3C H C 2H 5 CH 3 C C H 2H 5 Cl (Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯 2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。 CH 3 C C H CH 3H CH 3C H H CH 3顺-2-丁烯 反-2-丁烯3 3 3顺-1,4-二甲基环己烷反-1,4-二甲基环己烷 3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。然后将最不优先的基团放在远离观察者,再以次观察其它三个基
高中化学有机化学反应类型全总结
有机化学反应类型全总结一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团 所代替的反应称为取代反应. 取代反应的类型很多, 中学化学中主要有下面几类: 1.卤代反应烷烃、芳香烃、苯酚等均能发生卤代反应如: 2.硝化反应苯及其同系物、苯酚、烷烃等均能发生硝化反应如:
3.磺化反应苯、苯的衍生物, 几乎均可磺化.如: (邻、对位产物为主)4. 酯化反应 (1)羧酸和醇的反应.如: (2)无机含氧酸和醇的反应.如: 5.水解反应: 卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应.如: 6. 与活泼金属的反应: 醇、酚、羧酸等均能与活泼金属如钠反应生成氢气.如:
7.醇与卤化氢(HX)的反应.如: 8.羧酸或醇的分子间脱水. 如:? 二、加成反应 定义有机物分子里不饱和的碳原子跟其它原子或原子团直接结合,生成别的 物质的反应, 叫加成反应分子结构中含有双键或叁键的化合物, 一般能与H 2、X 2 (X为Cl、Br、I)、HX、H 2 O、HCN等小分子物质起加成反应. 如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等. 说明: 1.羧基和酯基中的碳氧双键不能发生加成反应。 2.醛、酮的羰基只能与H 2 发生加成反应。 3.共轭二烯有两种不同的加成形式。 1.和氢气加成. 2.和卤素加成
3.和卤化氢加成 4.和水加成 三、消去反应 定义:有机化合物在适当条件下, 从一个分子相邻两个碳原子上脱去一个小分子(如O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除H 2 反应 发生消去反应的化合物需具备以下两个条件: (1)是连有一OH(或一X)的碳原子有相邻的碳原子; (2)是该相邻的碳原子上还必须连有H原子. 1.醇的消去反应.如: 2.卤代烃的消去反应.如: 四、聚合反应 定义:由许多单个分子互相结合生成高分子化合物的反应叫聚合反应. 聚合反应有两个基本类型:加聚反应和缩聚反应. 1.加聚反应. 由许多单个分子互相加成, 又不缩掉其它小分子的聚合反应称为加成聚合反应简称加聚反应. 烯烃、二烯烃及含的物质均能发生加聚反应.如: 2.缩聚反应
有机化学十种反应类型详细小结精美版
有机化学十种反应类型详细小结 复习方法提示: 1、全面了解有机物所具有得反应类型有哪些?熟记相关名词,确保表达准确。 2、把握准每一类反应得概念,牢牢掌握反应中得结构变化特点。这就是分析判断得依据! 3、认识相似得同一种反应类型得“归属”关系,如取代反应可以包括什么?区分相近得不同反应类型在结构变化上得“差异”性及规律,如消去反应与氧化反应,加成反应与加聚反应等等。 以下概要回顾有机得五大反应,包括:取代反应、加成反应、消去反应、聚合反应(包括加聚反应与缩聚反应),以及氧化-还原反应。 一、取代反应 定义:有机物分子里得某些原子或原子团被其它原子或原子团所代替得反应称为取代反应。 在中学化学中,取代反应包括卤代、酯化、水解、硝化与磺化等很多具体得类型。分例如下: 1、与卤素单质得取代------发生该类反应得有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: (1).(在适当得条件下,烷烃得取代反应就是可以逐步进行得,得到一系列得混合物)。 (2). (3).CH 2=C H-CH 3 + Cl 2CH 2=CH-CH 2-Cl + HCl (4). (5).+ 2HCl 2、与混酸得硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (1). + HNO 2 -NO 2 + H 2O (2). (3). 环己烷对酸、碱比较稳定,与中等浓度得硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上得封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温与条件下则异构化为甲基环戊烷。 低碳硝基烷得工业应用日益广泛。在使用原料上,以丙烷硝化来制取就是合理得途径。在工艺方面,国外较多得就是以硝酸为硝化剂得气相硝化工艺,已积累了较丰富得工业经验。有代表性得反应器则就是多室斯登该尔反应器。国内迄今有关硝基烷得生产与应用研究均进行得不多,这就是应该引起我们充分注意得。 (4).CH 3-CH 2-CH 3(气) + H NO 3(气) CH 3-CH2-CH 2-N O2 + H 2O 3、与硫酸得磺化反应(苯、苯得衍生物, 几乎均可磺化)。如: (1). (2). (邻、对位产物为主) 4、羧酸与醇得酯化反应 (1).羧酸与醇:CH 3COOH + CH 3CH 2OH CH 3C OOCH 2C H3 + H 2O + 浓硫酸 △ + 100℃ 浓硫酸 △ 光照
常见有机化学方程式归纳
常见有机化学方程式归纳 物质类别性质反应方程式 一、烷烃 1、燃烧 CH4 + 2O2CO2 + 2H2O 2、取代反应 CH4 + Cl2CH3Cl + HCl CH3Cl + Cl2CH2Cl2 + HCl(或CH4 + 2Cl2CH2Cl2 + 2HCl) CH2Cl2 + Cl2CHCl3 + HCl(或CH4 + 3Cl2CHCl3 + 3HCl) CHCl3 + Cl2CCl4 + HCl(或CH4 + 4Cl2CCl4 + 4HCl) CH3CH3 + Br2CH3CH2Br + HBr 3、高温分解CH4 C + 2H2↑ 二、烯烃 1、燃烧 C2H4 + 3O22CO2 + 2H2O 2、加成反应
3、加聚反应 4、氧化反应 三、炔烃 1、燃烧 2C2H2 + 5O24CO2 + 2H2O 2、加成反应 四、芳香烃 1、卤代 2、硝化
3、加成 4、氧化 五、醇 1、与活泼金属反应2CH3CH2OH +2 Na2CH3CH2ONa + H2↑ 2、消去反应 3、脱水成醚 4、取代反应 5、氧化
6、酯化反应 六、醛1、氧化 2C2H4O + 5O24CO2 + 4H2O
2、还原 七、酮1、加氢还原 八、羧酸 1、酸性 2CH3COOH + 2Na = 2CH3COONa + H2↑ CH3COOH + NaOH = CHCOONa + H2O 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑ CH3COOH + NaHCO3 = CH3COONa + H2O + CO2↑ 2、酯化反应参考醇的性质 九、酯1、水解 十一、卤代烃 1、水解反应 2、消去反应 十二、酚1、弱酸性
高中化学—有机化学10种反应类型
一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。 分例如下:1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: 2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温和条件下则异构化为甲基环戊烷。 低碳硝基烷的工业应用日益广泛。在使用原料上,以丙烷硝化来制取是合理的途径。在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。有代表性的反应器则是多室斯登该尔反应器。国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。 3、与硫酸的磺化反应(苯、苯的衍生物, 几乎均可磺化)。如:
4、羧酸和醇的酯化反应 5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。如: 6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。如: 7、醇与卤化氢(HX)的反应。如: 8、羧酸或醇的分子间脱水。如:
二、加成反应定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。 在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。通常参与加成反应的无机试剂包括H 2 、 X 2(X为Cl、Br、I)、HX、H 2 O、HCN等小分子(对称或不对称试剂) 起加成反应。 说明:i.羧基和酯基中的碳氧双键不能发生加成反应。 ii.醛、酮的羰基只能与H 2 发生加成反应。iii.共轭二烯有两种不同的加成形式。 1、和氢气加成 2、和卤素加成 3、和卤化氢加成 4、和水加成 三、消去反应定义:有机化合物在适当条件下,从一个分子相邻两个碳 原子上脱去一个小分子(如:H 2 O、HX等)而生成不饱和(双键或叁键)化合物的反应称为消去反应, 又称消除反应。 发生消去反应的化合物需具备以下两个条件: i.是连有一OH(或一X)的碳原子有相邻的碳原子;ii.是该相邻的碳原子上还必须连有H原子。中学里常见的两类有机物是醇和卤代烃。1、
高中有机化学反应类型归纳总结
★取代反应 烷:CH4+Cl2→(光)CH3Cl+HCl 苯:苯+Br2→(Fe)苯-Br+HBr(液溴) 苯+HO-NO2→(浓H2SO4;△)苯-NO2+H2O(硝化反应) 甲苯:苯-CH3+3HO-NO2→(浓H2SO4;△)三硝基甲苯(TNT)+3H2O 苯-CH3+Cl2→(光)苯-CH2Cl+HCl 醇:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 卤代烃:CH3CH2Br+NaOH→(△)CH3CH2OH+NaBr(水解反应) 另有酯化,硫化,水解等 ★加成反应 烯:CH2=CH2+Br2→CH2BrCH2Br CH2=CH2+H2O→(催化剂;△)CH3CH2OH CH2=CH2+H2→(Ni)CH3CH3 炔:CH≡CH+2Br2→CHBr2CHBr2 苯:苯+3H2→(Ni)C6H6(环已烷) 苯+3Cl2→C6H6Cl6(六六六) 醛:CH3CHO+H2→(Ni;△)CH3CH2OH(加氢还原) 另有加聚 ★消去反应 卤代烃:CH3CH2Br+NaOH→(醇;△)CH2=CH2↑+NaBr+N2O 醇:CH3CH2OH→(浓H2SO4;△)CH2=CH2↑+H2O (乙醇为170℃,其它醇不用记) ★水解反应(取代反应)
卤代烃:CH3CH2Br+H2O→(NaOH)CH3CH2OH+HBr 酯:CH3COOC2H5+H2O(可逆;稀H2SO4;△)CH3COOH+C2H5OH 另有多糖二糖蛋白质的水解 ★氧化反应 1 燃烧:CxHyOz+(x+y/4-z/2)O2→(点燃)xCO2+y/2H2O (有机物燃烧通式) 2 催化反应 醇:2CH3CH2OH+O2→(Cu;△)2CH3CHO+2H2O CH3CH2OH+CuO→(△)CH3CHO+H2O+Cu 醛:2CH3CHO+O2→(催化剂;△)2CH3CHO 烯:2CH2=CH2+O2→(催化剂)2CH3CHO 烷:2CH3CH2CH2CH3+5O2→(催化剂)4CH3COOH+2H2O 3 被酸性KMnO4氧化 烯炔苯的同系物(与苯环相连的C上要有H)醇醛 4 与新制Cu(OH)2反应 醛:CH3CHO+2Cu(OH)2→(△)CH3COOH+Cu2O↓+2H2O 5 银镜反应 (1)甲醛甲醛过量时:HCHO+2[Ag(NH3)2]OH→(△)HCOONH4+2Ag↓+3NH3+H2O 银氨溶液过量:HCHO+4[Ag(NH3)2]OH→(△)(NH4)2CO3+4Ag↓+6NH3↑+2H2O (2)乙醛 CH3CHO+2[Ag(nh3)2]OH→(△)CH3COONH4+2Ag↓+3NH3+H2O 另有HCOOR(甲酸盐甲酯某酯)葡萄糖麦芽糖果糖 ★还原反应 1 加H2加成:醛:CH3CHO+H2→(Ni;△)CH3CH2OH
有机化学常用反应方程式汇总
光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 △ 催化剂 有机化学方程式汇总 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 23 12. nCH 2 = CH 2 ] n 13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2O
NaOH H 2 O 醇 △ 催化剂 △ 浓硫酸 170℃ 浓硫酸 140℃ 催化剂 △ 24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr 29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O 30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 3 37 38. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O 41CH 3O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑
高中有机化学反应类型小结
高中有机化学反应类型小结 有机化学反应一直是教学的重点也是高考的热点,对化学反应进行科学的分类是研究化学首先要解决的问题,高考考查的重要有机反应有:取代反应、加成反应、消去反应、氧化反应、还原反应、聚合反应、水解反应、酯化反应等,考查的方式有:对陌生的有机反应类型的判断;根据各类有机反应的机理书写有机化学反应方程式。本文对常见的有机化学反应类型列举如下: 一、取代反应 定义:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。 典例:(1)卤代反应:如甲烷、苯的卤代反应。 (2)硝化反应:如苯、甲苯硝化反应。 (3)水解反应:卤代烃的水解、酯的水解、油脂的水解(包括皂化反应)、二糖和多糖的水解、蛋白质的水解。 (4)酯化反应:酸和醇作用生成酯和水的反应。 注意点:①取代与置换不同,置换中一定有单质参加反应,并生成一种新的单质,而取代则不一定有单质参加反应或生成。②被取代的一定是有机物分子中的原子或原子团,而用来取代的原子或原子团可以是有机物分子中的原子或原子团,也可以是无机物分子中的原子或原子团。 二、加成反应 定义:有机物分子中不饱和碳原子跟其它原子和原子团结合生成新物质的反应。通常不饱和碳原子主要指C=C、C=O(一般不含羧酸或酯中的C=O)、碳碳叁键以及具有一定不饱和性的苯环。 典例: (1)在催化剂的作用下,烯烃、炔烃、苯和苯的同系物、醛、酮及油脂及氢气发生的加成反应。 (2)常温下含有不饱和碳原子的有机物与卤素单质、卤代氢的加成反应:如烯、炔、油脂等有机物。如乙烯→氯乙烷。
(3)与水的加成反应:烯、炔等含有不饱和碳原子有机物在催化剂作用下,可以跟水发生加成反应。如乙烯水化生成乙醇。 注意点:①发生加成反应的主体都是含有不饱和键的有机物,加成的物质往往是非金属单质(H2、Cl2等)或小分子化合物(H2O、HX等)。②不饱和键是发生加成反应的前提条件下,不饱和键含碳碳之间的双键、三键,还有碳氧之间的双键、碳氮之间的三键。 三、消去反应 定义:有机物在适当的条件下,从一个分子内脱去小分子(如水、HX等),生成不饱和(双键或叁键)化合物的反应。 典例: (1)醇的消去:如实验室用乙醇制取乙烯。 (2)卤代烃的消去反应:如溴乙烷在氢氧化钠的醇溶液中加热发生消去可得到乙烯。 注意点:①卤代烃发生消去反应的条件是与强碱的醇溶液共热,(若与强碱的水溶液共热发生水解反应)②卤代烃发生消去反应结构条件是连接卤原子的碳原子还有一个相邻的带有氢原子的碳原子,否则不能发生消去反应。③醇的消去是在浓硫酸、加热条件下,如乙醇制乙烯,温度控制在170°C、浓硫酸做催化剂。④醇的消去也是要具备结构上的一个条件即连接羟基的碳原子还有一个相邻的带有氢原子的碳原子,否则不能发生消去反应。 四、聚合反应 定义:由相对分子质量小的化合物分子相互结合成相对分子质量大的高分子的反应叫聚合反应。聚合反应分为加聚反应和缩聚反应。聚合反应中的小分子叫单体,反应后生成的高分子称聚合体。 1.加聚反应:是指不饱和的单体加成聚合成高分子化合物的反应。发生加聚反应的单体可以是一种,也可以是多种,单体可以含一个C=C双键,也可含两个C=C双键。 典例:单烯烃的加聚、炔烃的加聚、二烯烃的加聚等。 2.缩聚反应:单体间通过缩合反应生成高分子化合物,同时生成小分子(如H2O、HX、NH3等)的反应。 典例:酚醛缩聚、醇酸缩聚(如乙二酸和乙二醇)、羟酸缩聚(如乳酸)、氨基酸缩聚等。
有机化学10种反应类型
有机化学10种反应类型 一、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。在中学化学中,取代反应包括卤代、酯化、水解、硝化和磺化等很多具体的类型。 分例如下: 1、与卤素单质的取代------发生该类反应的有机物包括:烷烃、烯烃、芳香烃、醇、酚等。例如: 2、与混酸的硝化反应(苯及其同系物、苯酚、烷烃等均能发生硝化反应)。如: (3)注:环己烷对酸、碱比较稳定,与中等浓度的硝酸或混酸在低温下不发生反应,与稀硝酸在100℃以上的封管中发生硝化反应,生成硝基环己烷。在铂或钯催化下,350℃以上发生脱氢反应生成苯。环己烷与氧化铝、硫化钼、古、镍-铝一起于高温下发生异构化,生成甲基戌烷。与三氯化铝在温和条件下则异构化为甲基环戊烷。 低碳硝基烷的工业应用日益广泛。在使用原料上,以丙烷硝化来制取是合理的途径。在工艺方面,国外较多的是以硝酸为硝化剂的气相硝化工艺,已积累了较丰富的工业经验。有代表性的反应器则是多室斯登该尔反应器。国内迄今有关硝基烷的生产和应用研究均进行得不多,这是应该引起我们充分注意的。
3、与硫酸的磺化反应(苯、苯的衍生物,几乎均可磺化)。如: 4、羧酸和醇的酯化反应 5、水解反应(卤代烃、酯、多糖、二糖、蛋白质都能在一定条件下发生水解反应)。如: 6、与活泼金属的反应:(醇、酚、羧酸等均能与活泼金属如钠反应生成氢气)。如: 7、醇与卤化氢(H X)的反应。如: 8、羧酸或醇的分子间脱水。如:
二、加成反应 定义:有机物分子里不饱和碳原子跟其它原子或原子团直接结合生成化合物的反应叫加成反应。 在中学化学中,分子结构中含有“双键”或“叁键”的化合物均能发生加成反应。如烯烃、二烯烃、炔烃、苯及其同系物、醛、酮、不饱和高级脂肪酸及其甘油脂、单糖等。通常参与加成反应的无机试剂包括H2、X2(X为C l、B r、I)、H X、H2O、H C N等小分子(对称或不对称试剂)起加成反应。 说明:i.羧基和酯基中的碳氧双键不能发生加成反应。i i.醛、酮的羰基只能与H2发生加成反应。i i i.共轭二烯有两种不同的加成形式。 1、和氢气加成 2、和卤素加成 3、和卤化氢加成 4、和水加成 三、消去反应 定义:有机化合物在适当条件下,从一个分子相邻两个碳原子上脱去一个小分子(如:H2O、H X等)而生成不饱和(双键或叁键)化合物的反应称为消去反应,又称消除反应。 发生消去反应的化合物需具备以下两个条件: i.是连有一O H(或一X)的碳原子有相邻的碳原子;i i.是该相邻的碳原子上还必须连有H原子。中学里常见的两类有机物是醇和卤代烃。1、醇的消去反应
有机化学反应类型总结
有机化学反应类型总结 1、取代反应 定义:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应称为取代反应。 (1)能发生取代反应的官能团有:醇羟基(-OH)、卤原子(-X)、羧基(-COOH)、酯基(-COO-)、肽键(-CONH-)等。 (2)能发生取代反应的有机物种类如下图所示: 2、加成反应 定义:有机物分子里不饱和的碳原子跟其他原子或原子团直接结合,生成别的物质的反应,叫加成反应。分子结构中含有双键或三键的化合物,一般能与H2、X2(X为Cl、Br、I)、HX、H2O、HCN等小分子物质起加成反应。 1.能发生加成反应的官能团:双键、三键、苯环、羰基(醛、酮)等。 2.加成反应有两个特点: ①反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。 ②加成反应后生成物只有一种(不同于取代反应)。 说明: 1.羧基和酯基中的碳氧双键不能发生加成反应。 2.醛、酮的羰基只能与H2发生加成反应。 3.共轭二烯有两种不同的加成形式。 3、消去反应 定义:有机化合物在适当条件下,从一个分子相邻两个碳原子上脱去一个小分子(如H2O、HX等)而生成不饱和(双键或三键)化合物的反应称为消去反应。发生消去反应的化合物需具备以下两个条件: (1)是连有—OH(或—X)的碳原子有相邻的碳原子。 (2)是该相邻的碳原子上还必须连有H原子。
(1)能发生消去反应的物质:醇、卤代烃;能发生消去反应的官能团有:醇羟基、卤素原子。 (2)反应机理:相邻消去 发生消去反应,必须是与羟基或卤素原子直接相连的碳原子的邻位碳上必须有氢原子,否则不能发生消去反应。如CH3OH,没有邻位碳原子,不能发生消去反应。 4、聚合反应 定义:有许多单个分子互相结合生成高分子化合物的反应叫聚合反应。 聚合反应有两个基本类型:加聚反应和缩聚反应 (1)加聚反应: 由许多单个分子互相加成,又不缩掉其它小分子的聚合反应称为加成聚合反应。烯烃、二烯烃及含C=C的物质均能发生加聚反应。 烯烃加聚的基本规律: (2)缩聚反应: 单体间相互结合生成高分子化合物的同时,还生成小分子物质的聚合反应,称为缩合聚合反应。 酚和醛、氨基酸(形成多肽)、葡萄糖(形成多糖)、二元醇与二元酸、羟基羟酸等均能发生缩聚反应。 (1)二元羧酸和二元醇的缩聚,如合成聚酯纤维: (2)醇酸的酯化缩聚: (3)氨基与羧基的缩聚 (1)氨基酸的缩聚,如合成聚酰胺6: (2)二元羧酸和二元胺的缩聚: nHOOC-(CH2)4-COOH+nNH2(CH2)6NH2 =[CO(CH2)4CONH(CH2)6NH]n+2nH2O 5、氧化反应与还原反应 1.氧化反应就是有机物分子里“加氧”或“去氢”的反应。 能发生氧化反应的物质和官能团:烯(碳碳双键)、醇、酚、苯的同系物、含醛基的物质等。
常见的有机化学反应类型
三、常见的有机化学反应类型: 1、取代反应:有机分子里的某些原子或原子团被其它原子或原子团所代替的反应,即原子或原子团“有进有出”。 常见取代反应: ①烷烃的卤代 ②苯的卤代、硝化、磺化 ③卤代烃的水解 ④醇和钠反应 ⑤醇分子间脱水 ⑥酚和浓溴水反应 ⑦羧酸和醇的酯化反应 ⑧ 酯的水解反应 发生取代反应的基/官能团 2、加成反应:有机分子里的不饱和碳原子跟其它原子或原子团直接结合成一种新有机物的反应,即原子或原子团“只进不出”。 目前学习到的不饱和碳原子主要存在于碳碳双键、碳碳三键、苯环、碳氧双键等基团中,发生加成反应的物质主要有烯烃、炔烃、芳香族化合物、醛等物质。其中烯、炔常见的加成物质是氢气、卤素单质、卤化氢和水。 醛常见的加成物质是氢气,而羧酸、酯、肽键中的碳氧双键一般不能加成。 3、消去反应:有机化合物在适当条件下,从一分子中脱去一个小分子(如水、卤化氢),而生成不饱和(含双链或叁键)化合物的反应,即原子或原子团“只出不进”。 能发生消去反应的有机物有:卤代烃、醇。 发生消去的结构要求:有机物分子中与官能团(—OH ,—X )相连碳原子的邻碳原子必须要有氢原子。 4、聚合反应 加聚反应:含有碳碳双链等的不饱和有机物,以加成的方式相互结合,生成高分子化合物的反应。发生加聚反应的有烯烃以及它们的衍生物如:丙烯酸、甲基丙烯酸甲酯等。 缩聚反应:单体间的相互反应生成高分子,同时还生成小分子副产物(如H 2O 、 有机物 无机物/有机物 反应名称 烷,芳烃,酚 X 2 卤代反应 苯的同系物 HNO 3 硝化反应 苯的同系物 H 2SO 4 磺化反应 醇 醇 脱水反应 醇 HX 取代反应 酸 醇 酯化反应 酯 醇 酯交换反应 酯/卤代烃 酸溶液或碱溶液 水解反应 二糖、多糖 H 2O 水解反应 蛋白质 H 2O 水解反应 羧 酸 盐 碱石灰 脱羧反应
详细有机化学常见反应机理分析
常见的有机反应机理 Arbuzov 反应 亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷: 卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。 本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则 Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。 除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如: 反应机理 一般认为是按 S N2 进行的分子内重排反应: 反应实例
Arndt-Eister 反应 酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。 反应机理 重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。 反应实例 Baeyer----Villiger 反应 反应机理 过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。因此,这是一个重排反应 具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:
不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。 反应实例 酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。这类氧化剂的特点是反应速率快,反应温度一般在 10~40℃之间,产率高。 Beckmann 重排 肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺: 反应机理 在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
