氮化学方程式
氮及其化合物+ O放电
高中化学方程式大全非金属单质
高中化学方程式大全非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性: F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N N2+6Rb===2Rb3N P2+6H2===4PH3
人教版必修一化学第四章非金属及其化合物化学方程式总结
第四章非金属及其化合物方程式总结 ----------加粗的是对应的离子方程式 一、硅及其化合物 1、硅单质 物理性质:有金属光泽的灰黑色固体,熔点高,硬度大,质地脆,导电性介于导体和绝缘体之间。 化学性质:常温下化学性质稳定 硅的还原性:Si+O 2SiO2 粗硅的制取:2C+SiO 2Si+2CO(制得粗硅) 粗硅的提纯:Si(粗)+2Cl 2SiCl4SiCl4+2H 2Si(纯)+4HCl 硅与强碱的反应:Si+2NaOH+H2O =Na2SiO3+2H2↑ 2OH-+ Si+H2O =SiO32–+2H2↑ 硅与氢氟酸反应:4HF+Si=SiF4↑+2H2↑ 硅的用途:硅可制造集成电路、电子芯片、太阳能电池板等。 2、二氧化硅及硅酸 存在:结晶形和无定形。通称硅石。 性质:化学性质稳定,除氢氟酸外,一般不与其他酸反应,可以与强碱、碱性氧化物发生反应,属酸性氧化物。 用途:SiO2是光导纤维的主要原料,以SiO2为主要原料的物质大多都有石英、水晶;玛瑙。 ①Si(粉)+O 2SiO2 ②与碱性氧化物反应:SiO2+CaO CaSiO3 ③与碱的反应:SiO2+2NaOH=Na2SiO3+H2O 2OH-+SiO2=SiO32–+H2O ④硅酸盐与酸生成硅酸的反应: Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl SiO32-+2H+=H2SiO3(胶体) Na2SiO3+CO2(少量)+H2O=H2SiO3↓+Na2CO3SiO32-+CO2(少量)+H2O=H2SiO3↓+CO32- ⑤与氢氟酸反应:SiO2+4HF =SiF4↑+2H2O 硅酸易受热分解:H2SiO 3 SiO2↓+H2O 3、硅酸盐:硅酸盐是由硅、氧和金属组成的化合物的总称,在自然界分布极广,种类极多,是一类结构复杂的固体物质,大多不溶于水,化学性质很稳定。 硅酸钠:(最简单的硅酸盐)可溶于水,其水溶液俗称水玻璃,可做粘合剂和防火剂,是制备硅胶和木材防火剂等的原料。 制备途径:SiO2+2NaOH=Na2SiO3+H2O 2OH-+SiO2=SiO32–+H2O(贮存NaOH溶液的试剂瓶要用橡胶塞) 常见的硅酸盐产品:陶瓷、玻璃、水泥 二、氯及其化合物1、氯气(Cl2) Cl2的制取:原理:4HCl(浓)+MnO 2MnCl2+Cl2↑+2H2O 4H++2Cl–+MnO 2Mn2++Cl2↑+2H2O 发生装置:固液加热型实验装置:(见右图) 气体收集装置:向上排空气法(或排饱和食盐水法) 尾气处理装置:用碱液(NaOH)吸收 物理性质:①黄绿色②气体③有刺激性气味④有毒⑤密度比空气大 ⑥2:1体积溶于水⑦易液化 化学性质:a、与水(H2O)的反应:Cl2 + H2O = HCl + HClO Cl2 + H2O = H++Cl—+ HClO 用途:可用于自来水的杀菌、消毒 新制氯水中的粒子:Cl2;H2O;HClO;H+;Cl-;ClO-;OH-(极少量) (三“分”四“离”)久置氯水中的粒子:H+;Cl-;H2O;OH-(极少量) b、与碱反应:氯气+碱==氯酸盐+次氯酸盐+水(此反应中氯气既作氧化剂又作还原剂)与NaOH反应:Cl2+2NaOH=NaCl+NaClO+H2O Cl2+2OH–=Cl–+ClO–+H2O (产物NaClO:漂白液的有效成分) 与Ca(OH)2反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 石灰乳离子方程式不拆 2Cl2+2Ca(OH)2=4Ca2++2Cl–+2ClO–+H2O (产物Ca(ClO)2:漂白粉、漂白精的有效成分) 注:漂白粉产生作用的原因:Ca(ClO)2+CO2+H2O= 2HClO +CaCO3↓(弱酸制更弱的酸,“强”制“弱”)且次氯酸易分解(现制现用):2HClO2HCl+O2↑ c、与金属的反应: 与Na的反应:2Na+ Cl 22NaCl 现象:产生黄色火焰,燃烧,产生白烟 与Fe的反应:3Cl2+2Fe2FeCl3现象:燃烧,产生棕黄色的烟 与Cu的反应:Cu + Cl 2CuCl2现象:燃烧,产生棕黄色的烟 d、与非金属的反应:与H2的反应:H2+Cl22HCl 现象:安静地燃烧,产生苍白色火焰,瓶口有大量白雾 2、氯离子(Cl-)的检验 原理:Ag++Cl- = AgCl 试剂:AgNO3溶液和稀硝酸(HNO3) 操作:(加稀硝酸的作用是除去干扰离子:CO32-) 方法一:在被检验的溶液中加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。 方法二:在被检验的溶液中滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。 3、附加:氯气的强氧化性:氯气将非金属最低价离子氧化为单质 氯气与溴化钠反应Cl2+2NaBr=2NaCl+Br2Cl2+2Br—=2Cl—+Br2 氯气与碘化钾反应Cl2+2KI=2KCl+I2Cl2+2I-=2Cl-+I2 氯气与硫化钠反应Cl2+Na2S=2NaCl+S↓ Cl2+S2–=2Cl–+S↓ 氯气与硫化氢反应Cl2+H2S=2HCl+S↓ Cl2+H2S=2H++2Cl–+S↓ 三、硫及其化合物 1、硫单质(S)
氮循环的有关化学方程式 Microsoft Word 文档 (2)
1.一氧化氮与氧气的反应2NO+O2=== 2NO2 2.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO 3.氮气与氢气的反应N2+3H2========= 2NH3 4.氨气与水的反应NH3+H2O==== NH3·H2O 5.氨气与盐酸的反应NH3+HCl==== NH4Cl 6.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO4 7.氨气与强酸的离子的反应NH3+H+==== NH4+ 8.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O 9.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O 10.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑ 11.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O 14.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O 13.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O 14.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O 15.碳酸氢铵与氢氧化钙的反应 NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O 16.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O 17.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O 18.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O 19铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O 20.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O 21.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O 22.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO3 23.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO3 24.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2 25.氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N2 26.二氧化氮生成四氧化二氮的反应2NO2==== N2O4
氮族元素化学方程式1
氮元素化学方程式 1.氮气与氢气合成氨: 2.氮气与氧气放电: 3.一氧化氮与氧气反应: 4.二氧化氮与水反应: 6.镁带在氮气中燃烧: 7.实验室用氯化铵与熟石灰反应制取氨气: 10. 碳酸氢铵与熟石灰反应: 11.氨水中的电离平衡: 12.氨气与氯化氢反应: 13.氨气与硫酸反应: 15.氨气与二氧化碳的水溶液反应: 16.氨的催化氧化: 17.加热氯化铵: 18.加热碳酸氢铵: 19.氯化铵溶液与氢氧化钠溶液加热反应的离子方程式: 20.常温下氯化铵溶液与氢氧化钠溶液反应的离子方程式: 23.浓硝酸的分解:
24.铜和浓硝酸反应: 25.铜和稀硝酸反应: 26.硫化氢和稀硝酸反应: 27.加热时铝和浓硝酸反应: 28.加热时铝和稀硝酸反应: 29.硝酸亚铁和稀盐酸反应的离子方程式: 30.加热时铁和浓硝酸加热反应: 32.过量的铁与稀硝酸反应: 33.碘化钾和稀硝酸反应: 34.碳与浓硝酸反应; 35.实验室制取硝酸: 36二氧化氮与氧气通入水中: 37.一氧化氮与氧气通入水中: 38.过量的氨与氯气反应: 40.亚硫酸钠和稀硝酸反应:
氮元素化学方程式 1. N 2+3H 2 2NH 3 2. N 2+O 2=2NO 3. 2NO+O 2=2NO 2 4. 3NO 2+H 2O=2HNO 3+NO 5. 3Mg+N 2==Mg 3N 2 6. 2NH 4Cl+Ca(OH)2加热 CaCl 2+2NH 3↑+2H 2O 10. NH 4HCO 3+Ca(OH)2加热 NH 3↑+2H 2O+ CaCO 3 11. NH 3+H 2O NH 3· H 2 O NH 4++OH - 12. NH 3+HCl=NH 4Cl 13. 2NH 3+H 2SO 4=(NH 4)2SO 4 14. NH 3+HNO 3=NH 4NO 3 15. NH 3+CO 2+H 2O=NH 4HCO 3 16. 4NH 3+5O 2 4NO+6H 2O 17. NH 4Cl 加热NH 3 ↑+HCl ↑ 18. NH 4HCO 3加热NH 3 ↑ +CO 2↑+H 2O 19. NH 4++OH 加热-NH 3↑+H 2O 20. NH 4++OH -=NH 3·H 2O 21. 4HNO 3加热 4NO 2 ↑+O 2 ↑+2H 2O 22. Cu+4HNO 3=Cu(NO 3)2+2NO 2↑+2H 2O 23. 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO ↑点燃 放电
高中化学方程式大全(完整版)[1]2
第一章 卤素 第一节 氯气 1、NaCl 2Cl Na 22??→?+点燃 2、22CuCl Cl Cu ??→?+点燃 3、32FeCl 2Cl 3Fe 2??→?+点燃 4、HCl 2Cl H 22????→?+点燃(光照) 5、32PCl 2Cl 3P 2??→?+点燃 6、523PCl Cl PCl →+ 7、HClO HCl O H Cl 22+→+ 8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++?→? +?2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+??→?见光
第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 44 2(浓) 15、↑+?→? +?HCl SO Na NaCl NaHSO 424 16、↑+?→?+?HCl 2SO Na SO H NaCl 2424 2(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+ 18、33NaNO AgCl AgNO NaCl +↓→+ 19、33KNO AgCl AgNO KCl +↓→+ 20、↑++→+2223CO O H CaCl CaCO HCl 2 第三节 氧化还原反应 21、O H Cu H CuO 22+?→? +? 22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++?→?+?)((极稀) 24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++?→?+?)((极稀)
酸和碱化学方程式总结
2 32//*CO SO SO 非金属氧化物特指:绿色 溶液颜色由无色变为浅*澄清石灰水变浑浊 *无色变为棕黄色 铁锈逐渐消失,溶液由*?????↑+=+↑+=+++2342342233)(323262H SO Al SO H Al H Cl Al HCl Al ?????↑+=+↑+=+++24242222Fe 2Fe H SO Fe SO H H Cl Fe HCl ???+=++=+O H SO Fe SO H O O H FeCl HCl O 2342423223323)(3Fe 326Fe 第十章 酸和碱 化学方程式总结 一、酸的有关化学方程式:酸根酸+→+H 1.酸和活泼金属反应:↑+→+2H 盐酸活泼金属(置换反应) (固体逐渐消失,产生均匀气泡) ?????↑+=+↑+=+244222g 2g H MgSO SO H M H MgCl HCl M ?????↑ +=+↑+=+2442222n H ZnSO SO H Zn H ZnCl HCl Z 2.酸与金属氧化物反应:O H 2+→+盐酸金属氧化物 ???+=++=+O H MgSO SO H O M O H MgCl HCl O M 244222g 2g ? ??+=++=+O H CaSO SO H O O H CaCl HCl O 244222Ca 2Ca 二、碱的有关化学方程式:-OH +→金属离子碱 碱与非金属氧化物反应:O H 2+→+盐非金属氧化物碱 ?????+=++=++=+O H SO Na SO OH N O H SO Na SO OH N O H CO Na CO OH N 242323222322a 2a 2a 2 ?????+↓=++↓=++↓=+O H CaSO SO OH O H CaSO SO OH O H CaCO CO OH 243223222322)Ca()Ca()Ca(
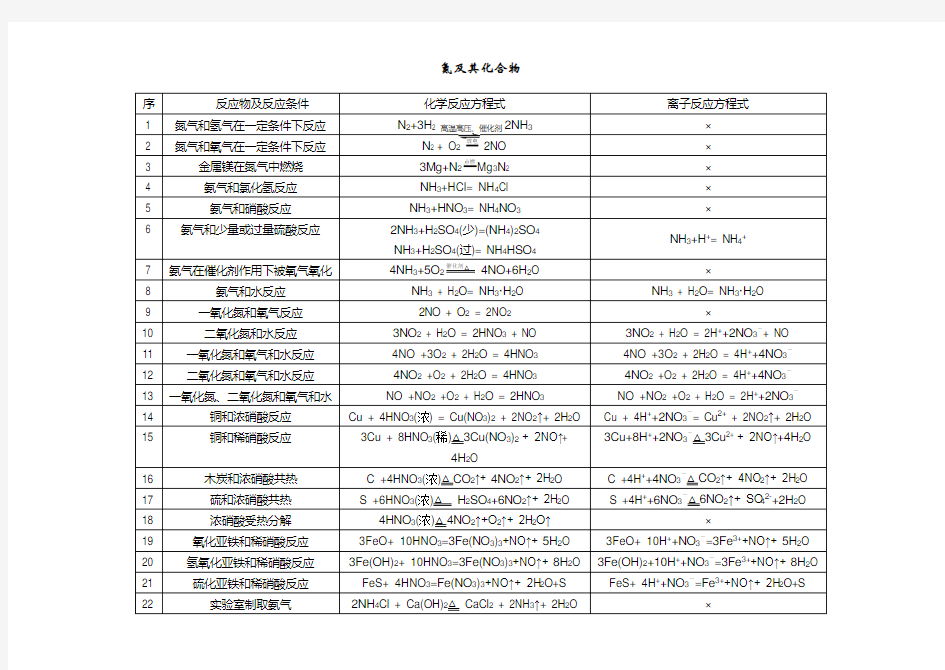
氮及其化合物的化学方程式和离子方程式
氮及其化合物的化学方程式和离子方程式 (注:带*的不要求记住,但要求能理解) 一、氮气 1、镁在氮气中燃烧:3Mg+N2Mg3N2 放电 2、氮气在放电的条件下与氧气反应:N 2+O 22NO 2NH3 3、合成氨反应:N2+3H2催化剂 高温高压 二、氨气 1、氨的催化氧化:4NH3+5O24NO+6H2O *2、少量氨在氯气中燃烧:2NH3+3Cl2N2+6HCl *3、足量的氨和氯气反应:8NH3+3Cl2N2+6NH4Cl *4、氨气在纯净的氧气中燃烧:4NH3+3O22N2+6H2O *5、氨气通过灼热的氧化铜:2NH3+3CuO N2+3Cu+3H2O 6、氨气和水反应:NH3+H2O NH3·H2O NH4++OH- 7、氨水与盐酸反应:NH3·H2O+HCl NH4Cl+H2O NH3·H2O+H+NH4++H2O 8、氨水与醋酸反应:NH3·H2O+CH3COOH CH3COONH4+H2O NH3·H2O+CH3COOH CH3COO-+NH4++H2O 9、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4Cl Mg2++2NH3·H2O Mg(OH)2↓+2NH4+ 10、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4 Al3++3NH3·H2O Al(OH)3↓+3NH4+ 11、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl Fe2++2NH3·H2O Fe(OH)2↓+2NH4+ 12、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl
金属及其化合物化学方程式汇总
必修一金属及其化合物化学方程式 一、金属钠及其化合物 1、钠在空气中 (1)钠块在空气中变暗:2Na + O2=Na2O(白色固体)(钠长时间露置在空气中最终变为碳酸钠)(2)在空气中加热4Na+2O2 =2Na2O2(淡黄色固体) 现象:钠融化成小球,然后剧烈燃烧,产生黄色火焰,生成淡黄色固体 (3)2Na2O+O2=2Na2O2 2、钠与水反应(浮、熔、游、响、红) 2Na + 2H2O = 2NaOH + H2↑ 2Na + 2H2O = 2Na++ 2OH-+ H2↑ 3、钠与盐溶液反应(先水后盐) (1)与氯化钠溶液:本质上就是与水反应 (2)与硫酸铜溶液: 2Na + 2H2O = 2NaOH + H2↑ 2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4 总:2Na + 2H2O + CuSO4= Cu(OH)2↓+ Na2SO4+ H2↑ 2Na + 2H2O+ Cu2+ = Cu(OH)2↓+H2↑+ 2Na+ (3)与氯化铁溶液: 6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑ 6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na+ +3H2↑ 4、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白) 2Na2O2+ 2H2O = 4NaOH + O2 ↑ 2Na2O2+ 2H2O = 4Na++4OH -+O2↑ 现象:产生大量气泡,带火星的木条复燃,试管外壁发热,滴加酚酞后溶液变红(振荡后褪色)碱性氧化物Na2O与水的反应Na2O+H2O=2NaOH Na2O + H2O = 2Na++2OH -5、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na2O2+ 2CO2= 2Na2CO3+ O2 碱性氧化物Na2O与二氧化碳的反应 Na2O+CO2===Na2CO3 6、过氧化钠与盐酸的反应 2Na2O2+ 4HCl = 4NaCl + 2H2O+O2 ↑ 2Na2O2+ 4H+= 4Na++2H2O+O2↑ 碱性氧化物Na2O与盐酸的反应 Na2O + 2HCl = 2NaCl + H2O Na2O + 2H+= 2Na++H2O 7、氢氧化钠 (1)与酸性氧化物反应 a向NaOH中通入少量CO2:2NaOH+ CO2 (少量)== Na2CO3 + H2O OH -+ CO2 (少量)= CO32-+H2O b 继续向该溶液中通入 CO2: Na2CO3+ H2O +CO2=2NaHCO3 CO32-+H2O +CO2=2HCO3- c向NaOH中通入过量CO2:NaOH+ CO2(过量)== NaHCO3 a+b OH -+ CO2 (过量)= HCO3- d向Ca(OH)2中通入少量CO2:CO2+Ca(OH)2(过量)===CaCO3↓+H2O Ca2++ 2OH -+ CO2 (少量)= CaCO3↓+H2O e继续向该溶液中通入 CO2:CaCO3+H2O +CO2=Ca(HCO3)2 CaCO3+H2O +CO2=Ca2++ 2HCO3- f向Ca(OH)2中通入过量CO2:2CO2(过量)+Ca(OH)2===Ca(HCO3)2 d+e OH -+ CO2 (过量)= HCO3- CaCl2不与CO2反应:因为一般情况下弱酸不能制强酸 8、苏打(纯碱)与盐酸反应(根据滴加顺序不同,现象不同,所以可以鉴别盐酸和碳酸氢钠) ①向盐酸中滴加纯碱溶液 Na2CO3+ 2HCl = 2NaCl + H2O+CO2↑ CO32-+ 2H+= H2O + CO2↑ △△
最新高中硫、氮化学方程式总结知识讲解
第五章 评说硫、氮的功与过化学方程式总结 1. S +K 2S +3CO 2↑+N 2↑(黑火药爆炸) 2. 3. 2Cu 4. Hg +S HgS 5. H 2+S 2S 6. S +O 2 (在氧气中发出蓝紫色火焰) 7. 2H 2S +3O +2H 2O (发出淡蓝色火焰) 8. 2H 2S +O 2(不足)2S +2H 2O (H 2S 不完全燃烧) 9. 2H 2S +SO 2 3S +2H 2O 10. H 2S + CuSO 4 = CuS ↓(黑)+ H 2SO 4 (检验H 2S ) 11. H 2S + Pb(NO 3)2 = PbS ↓(黑)+ 2HNO 3 (检验H 2S ) 12. SO 2+H 2O H 2SO 3 (二元中强酸) 13. 2H 2SO 3+O 22H 2SO 4 14. 2SO 2 + O 2 催化剂 加热 2SO 3 (SO 2的催化氧化) 15. SO 3+H 2O H 2SO 4 16. SO 2 + Br 2 + 2H 4 + 2HBr (使溴水或高锰酸钾溶液褪色) 17. NaCl +H 2SO 4(浓) 4+HCl ↑ 18. NaNO 3 + H 2SO 4+HNO 3↑ 19. Cu +2H 2SO 4(浓) CuSO 4+SO 2↑+2H 2O 剧烈反应,铜片表面产生气泡,溶液变成绿色,品红溶液褪色 20. C + 2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O 21. BaCl 2 + H 2SO 4BaSO 4↓+2HCl 22. BaCl 2 + Na 2SO 4BaSO 4↓+2NaCl 23. BaCl 2 + Na 2CO 3BaCO 3↓+2NaCl 24. BaCO 3 +2HCl BaCl 2+H 2O +CO 2↑ 25. Ba 2+ + SO 42- BaSO 4↓ 在实验室里检验溶液中是否含有SO 42-时,常常先用盐酸把溶液酸化,以排除CO 32- 、SO 32-、Ag +等干扰,再加入BaCl 2溶液,如果有白色沉淀出现,则说明原溶液中肯定存在SO 42-。
氮及其化合物的化学方程式和离子方程式集锦
氮及其化合物的化学方程式和离子方程式 (注:带*的不要求记住,但要求能理解) 一、氮气 1、镁在氮气中燃烧:3Mg+N 2Mg3N2 放电 2、氮气在放电的条件下与氧气反应:N2+O 22NO 2NH3 3、合成氨反应:N2+3H2催化剂 高温高压 二、氨气 1、氨的催化氧化:4NH3+5O24NO+6H2O 2、氨气和水反应:NH3+H2O NH3·H2ONH4++OH- 3、氨水与盐酸反应:NH3·H2O+HCl NH4Cl+H2O NH3·H2O+H+NH4++H2O 4、氨水与醋酸反应:NH3·H2O+CH3COOH CH3COONH4+H2O NH3·H2O+CH3COOH CH3COO-+NH4++H2O 5、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4 Al3++3NH3·H2O Al(OH)3↓+3NH4+ 6、氨气和氯化氢气体产生白烟:NH3+HClNH4Cl 7、氨气和水反应 NH3 + H2O NH3·H2O 8、氨气和盐酸反应 NH3 + HCl==NH4Cl(NH3与HCl不共存) 9、氨气和硝酸反应 NH3+HNO3==NH4NO3(白烟) 11、氨气和硫酸反应 2NH3+H2SO4==(NH4)2SO4(浓硫酸不能干燥NH3) 三、氯化铵 1、氯化铵溶液与硝酸银溶液反应:NH4Cl+AgNO3AgCl↓+NH4NO3
Cl -+Ag + Ag Cl ↓ 2、向氯化铵溶液加入氢氧化钠溶液并加热:N H4Cl+NaOH NaCl+NH 3 ↑+H2O NH 4++OH - NH 3 ↑+H 2O (该反应常用于NH 4+的检验) 4、氯化铵固体和消石灰共热:2N H4Cl +Ca(OH)2 CaCl 2+2N H3 ↑+2H 2O (试验室制氨气,用碱石灰干燥) 5、加热氯化铵:NH 4Cl NH 3 ↑+HC l↑ 6、加热碳酸氢铵:NH 4HCO 3N H3 ↑+CO 2 ↑+H2O * 7、加热硝酸铵:5NH 4NO 34N 2 ↑+2HNO 3+9H 2O 四、一氧化氮 1、一氧化氮和氧气反应:2NO +O 2 2NO2 2、一氧化氮和氧气的混合气体通入水中的总反应:4NO+3O 2+2H2O 4H NO3 *3、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO 2+2N aOH 2NaNO 2+H 2O N O+NO 2+2OH -2N O2- + H2O 5、NO 和O 2反应 2NO + O 2==2NO 2 6、NO 2 和 H 2O 反应 2 + H + N O 7、雷雨肥田三部曲 N 2 + O2 2N O 2N O + O 2==2NO 2 3NO 2 + H 2O==2HN O3 + N O 五、二氧化氮 失2×e 得 2e 放电
金属及其氧化物化学方程式总结
一、金属 2Na+H2=2NaH 4Na+O2=2Na2O 2Na2O+O2△ 2Na2O2 2Na+O2=Na2O2 2Na+S=Na2S(爆炸) 2Na+2H2O=2NaOH+H2↑2Na+2NH3=2NaNH2+H2 4Na+TiCl4(熔融)=4NaCl+Ti Mg+Cl2=MgCl2 Mg+Br2=MgBr2 2Mg+O2点燃 2MgO Mg+S=MgS Mg+2H2O=Mg(OH)2+H2↑ 2Mg+TiCl4(熔融)=Ti+2MgCl2 Mg+2RbCl(熔融)=MgCl2+2Rb 2Mg+CO2点燃 2MgO+C 2Mg+SiO2点燃 2MgO+Si Mg+H2S=MgS+H2 Mg+H2SO4=MgSO4+H2↑ 2Al+3Cl2△ 2AlCl3 4Al+3O2点燃 2Al2O3(钝化) 4Al(Hg)+3O2+2xH2O=2(Al2O3.xH2O)+4Hg 4Al+3MnO2高温 2Al2O3+3Mn 2Al+Cr2O3 高温 Al2O3+2Cr 2Al+Fe2O3 高温 Al2O3+2Fe 2Al+3FeO △ Al2O3+3Fe 2Al+6HCl=2AlCl3+3H2↑ 2Al+3H2SO4=Al2(SO4)3+3H2↑ 2Al+6H2SO4(浓) △ Al2(SO4)3+3SO2↑+6H2O (Al、Fe、C在冷、浓的H2SO4、HNO3中钝化) Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Fe+3Br2=2FeBr3 Fe+I2 △ FeI2 Fe+S △ FeS 3Fe+4H2O(g) 高温 Fe3O4+4H2 Fe+2HCl=FeCl2+H2↑ Fe+CuCl2=FeCl2+Cu 二、金属氧化物 (1)、低价态的还原性 6FeO+O2 △ 2Fe3O4 FeO+4HNO3=Fe(NO3)3+NO2↑+2H2O (2)、氧化性 Na2O2+2Na=2Na2O(此反应用于制备Na2O) MgO、Al2O3几乎没有氧化性、很难被还原为 Mg、Al. 一般通过电解熔融态的MgCl2和Al2O3制Mg和Al. Fe2O3+3H2=2Fe+3H2O (制还原铁粉)
高中化学方程式大全(整理)
郑州四中高中化学方程式汇编2012-12-3 温州市第十五中学高三化学备课组Petros Xn. 无机化学部分 非金属单质(F 2 ,Cl 2 , O 2 , S, N 2 , P , C , Si ) 1. 氧化性: F 2 + H 2 === 2HF 2F 2 +2H 2O===4HF+O 2 Cl 2 +2FeCl 2 ===2FeCl 3 2Cl 2+2NaBr===2NaCl+Br 2 Cl 2 +2NaI ===2NaCl+I 2 Cl 2+SO 2 +2H 2O===H 2SO 4 +2HCl 2. 还原性 S+6HNO 3(浓)===H 2SO 4+6NO 2↑+2H 2O 3S+4 HNO 3(稀)===3SO 2+4NO ↑+2H 2O PX 3+X 2===PX 5 C+CO 2===2CO (生成水煤气) (制得粗硅) Si+2NaOH+H 2O===Na 2SiO 3+2H 2↑ 3.(碱中)歧化 Cl 2+H 2O===HCl+HClO (加酸抑制歧化,加碱或光照促进歧化) Cl 2+2NaOH===NaCl+NaClO+H 2O 2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 金属单质(Na ,Mg ,Al ,Fe )的还原性 4Na+O 2===2Na 2O 2Na+S===Na 2S (爆炸) 2Na+2H 2O===2NaOH+H 2↑ Mg+H 2SO 4===MgSO 4+H 2↑ 2Al+6HCl===2AlCl 3+3H 2↑ 2Al+3H 2SO 4===Al 2(SO 4)3+3H 2↑ 2Al+6H 2SO 4(浓、热)===Al 2(SO 4)3+3SO 2↑+6H 2O (Al,Fe 在冷,浓的H 2SO 4,HNO 3中钝化) Al+4HNO 3(稀)===Al(NO 3)3+NO ↑+2H 2O 2Al+2NaOH+2H 2O===2NaAlO 2+3H 2↑ Fe+2HCl===FeCl 2+H 2↑ Fe+CuCl 2===FeCl 2+Cu 非金属氢化物(HF,HCl,H2O,H2S,NH3) 1.还原性: 16HCl+2KMnO 4==2KCl+2MnCl 2+5Cl 2↑+8H 2O (实验室常用) 2H 2S+SO 2===3S ↓+2H 2O 2NH 3+3Cl 2===N 2+6HCl 8NH 3+3Cl 2===N 2+6NH 4Cl 4NH 3+3O 2(纯氧)===2N 2+6H 2O 4NH 3+6NO===5N 2+6H 2O(用氨清除NO) 2.酸性: 4HF+SiO 2===SiF 4+2H 2O (HF 保存在塑料瓶的原因,此反应广泛应用于测定矿样或钢样中SiO 2的含量) H 2S+CuCl 2===CuS ↓+2HCl H 2S+FeCl 2===(不反应) 3.碱性: NH 3+HCl===NH 4Cl NH 3+HNO 3===NH 4NO 3 2NH 3+H 2SO 4===(NH 4)2SO 4 NH 3+NaCl+H 2O+CO 2===NaHCO 3+NH 4Cl (此反应用于工业制备小苏打,苏打) 4.不稳定性: 2H 2O 2===2H 2O+O 2↑ 非金属氧化物 1.低价态的还原性: 2SO 2+O 2+2H 2O===2H 2SO 4 (这是SO 2在大气中缓慢发生的环境化学反应) SO 2+Cl 2+2H 2O===H 2SO 4+2HCl 2NO+O 2===2NO 2 2CO+O 2===2CO 2 2.氧化性: NO 2+2KI+H 2O===NO+I 2↓+2KOH (不能用淀粉KI 溶液鉴别溴蒸气和NO 2) (CO 2不能用于扑灭由Mg,Ca,Ba,Na,K 等燃烧的火灾) 3.与水的作用: SO 2+H 2O===H 2SO 3 SO 3+H 2O===H 2SO 4 3NO 2+H 2O===2HNO 3+NO N 2O 5+H 2O===2HNO 3 P 2O 5+H 2O (冷)===2HPO 3 P 2O 5+3H 2O (热)===2H 3PO 4 (P 2O 5极易吸水,可作气体干燥剂) 4.与碱性物质的作用: SO 2+(NH 4)2SO 3+H 2O===2NH 4HSO 3 (这是硫酸厂回收SO 2的反应.先用氨水吸收SO 2,再用 H 2SO 4处理: 2NH 4HSO 3+H 2SO 4=== (NH 4)2SO 4 + 2H 2O + 2SO 2 生成的硫酸铵作化肥,SO 2循环作原料气) SO 2+Ca(OH)2===CaSO 3+H 2O (不能用澄清石灰水鉴别SO 2和CO 2.可用品红鉴别) SO 3+Ca(OH)2===CaSO 4+H 2O CO 2+2NaOH(过量)===Na 2CO 3+H 2O CO 2(过量)+NaOH===NaHCO 3 CO 2+Ca(OH)2(过量)===CaCO 3↓+H 2O 2CO 2(过量)+Ca(OH)2===Ca(HCO 3)2 CO 2+2NaAlO 2+3H 2O===2Al(OH)3↓+Na 2CO 3 CO 2+C 6H 5ONa+H 2O===C 6H 5OH ↓+NaHCO 3 SiO 2+2NaOH===Na 2SiO 3+H 2O (强碱缓慢腐蚀玻璃) 金属氧化物 1.低价态的还原性: FeO+4HNO 3===Fe(NO 3)3+NO 2↑+2H 2O 2。氧化性: MgO ,Al 2O 3几乎没有氧化性,很难被还原为Mg ,Al.,一般通过电解制Mg 和Al. (制还原铁粉) 3.与水的作用: Na 2O+H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH+O 2↑ 4.与酸性物质的作用: Na 2O+CO 2===Na 2CO 3 2Na 2O 2+2CO 2===2Na 2CO 3+O 2 Na 2O 2+H 2SO 4(冷,稀)===Na 2SO 4+H 2O 2 MgO+SO 3===MgSO 4 MgO+H 2SO 4===MgSO 4+H 2O Al 2O 3+3H 2SO 4===Al 2(SO4)3+3H 2O Al 2O 3+2NaOH===2NaAlO 2+H 2O (Al 2O 3是两性氧化物) FeO+2HCl===FeCl 2+3H 2O Fe 2O 3+6HCl===2FeCl 3+3H 2O Fe 3O 4+8HCl===FeCl 2+2FeCl 3+4H 2O 含氧酸 1.氧化性: HClO+H 2SO 3===H 2SO 4+HCl (X 2表示F 2,Cl 2,Br 2)
《金属及其化合物》化学方程式总结
金属及其化合物化学方程式 1、钠放置在空气中 4Na + O 2 = 2Na 2O 2、钠在空气中燃烧(黄色的火焰)2Na + O 2 Na 2O 2(淡黄色固体) 4Li + O 2 △ 2Li 2O 3、铝箔被氧气氧化 4Al + 3O 2 △ 2Al 2O 3 4、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2NaOH + H 2 ↑ 【2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑】 5、高温下铁与水反应 3Fe + 4H 2O (g) 高温 Fe 3O 4 + 4H 2 6、铝片与稀盐酸反应 2Al + 6HCl = 2AlCl 3 + 3H 2↑ 【2Al + 6H + = 2Al 3+ +3H 2↑】 7、铝与氢氧化钠溶液反应 2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑ 【2Al + 2OH - + 2H 2O = 2AlO 2- + 3H 2↑】 8、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,用于漂白) 2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 【2Na 2O 2 + 2H 2O = 4Na + + 4OH - +O 2↑】 9、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2 10、苏打(纯碱)与盐酸反应 Na 2CO 3 +2HCl=2NaCl+H 2O +CO 2↑ 【 CO 32- + 2H + = H 2O + CO 2↑】 11、小苏打溶液与盐酸反应 NaHCO 3 + HCl= NaCl+H 2O +CO 2↑ 【HCO 3- + H + = H 2O + CO 2↑】 12、小苏打受热分解 2NaHCO 3 △ Na 2CO 3 + H 2O +CO 2 ↑ 13、氢氧化钠溶液和碳酸氢钠溶液反应 NaHCO 3+NaOH= Na 2CO 3 + H 2O 【HCO 3-+ OH - = H 2O + CO 32- 】 14、氧化铝溶于氢氧化钠溶液 Al 2O 3 + 2NaOH ===2NaAlO 2 +H 2O 【Al 2O 3 + 2OH - === 2AlO 2- + H 2O 】 15、氧化铝溶于硫酸 Al 2O 3+ 3H 2SO 4==Al 2(SO 4)3+3H 2O 【Al 2O 3 +6H + = 2Al 3+ +3H 2O 】
硫和氮的化学方程式
硫和氮的化学方程式 一、硫 1.硫与金属的反应 (1)硫与铜反应:2Cu+S → Cu2S (硫化亚铜,难溶于水的黑色固体) (2)硫与铁反应:Fe + S →FeS (硫化亚铁, 难溶于水的黑色固体) (3)硫还可以与钠、镁、铝等金属反应: 2 Na + S 研磨 Na2S Zn + S △ZnS Mg + S △MgS Hg + S △HgS 2Al + 3S △ Al2S3 2.硫与非金属的反应 (1)硫与氢气反应:H2 + S △ H2S (硫的氧化性) (2)硫与氧气反应:S + O2→SO2(硫的还原性) 3.硫与化合物反应 S + 2H2SO4 (浓) △ 3SO2↑+ 2H2O S + 6HNO3 (浓) △ 6NO2↑+ H2SO4 + 2H2O 3S + 6 NaOH→ 2Na2S + Na2SO3 + 3H2O S + 2KNO3+ 3C → K2S + N2↑+3CO2↑(黑火药) 4.硫的性质 硫是淡黄色晶体,俗称硫磺,不溶于水,微溶于酒精,易溶于二硫化碳 (CS2);由于硫易溶于二硫化碳,所以粘在试管上的硫可用二硫化碳除 去。硫在火山口以游离态形式存在。 5.硫的用途 (1)用于制造硫酸。 (2)用于制造黑火药、焰火、火柴。 (3)用于制造农药(如石灰硫黄合剂) (4)医学上用于制硫黄软膏。
二、硫化氢 (一)、气体性质 1.可燃性 (1)不完全燃烧:2H2S + O2→ 2H2O + 2S↓ (2)完全燃烧:2H2S + 3O2→ 2H2O + 2SO2 2.不稳定性 H2S→H2 + S(把H2S加热到300℃左右,就会分解) 3.强还原性 (1) H2S+Cl2→ S↓+2HCl 现象:H2S能使氯水褪色,并有淡黄色沉淀生成 (2) H2S+Br2→ S↓+2HBr 现象:H2S能使溴水褪色,并有淡黄色沉淀生成 (3) H2S+I2→ S↓+2HI 现象:H2S能使碘水褪色,并有淡黄色沉淀生成 (4) 5H2S+2KMnO4+3H2SO4→ K2SO4+2MnSO4+5S↓+8H2O 现象:H2S能使酸性KMnO4溶液褪色,并有淡黄色沉淀生成 (5) H2S+H2SO4(浓) →S↓+SO2↑+2H2O 现象:有淡黄色沉淀生成 (6) H2S+8HNO3(浓) →H2SO4+8NO2↑+4H2O 现象:有棕色NO2气体产生 (7) 3H2S+2HNO3(稀) →3S↓+2NO↑+4H2O 现象:有淡黄色沉淀生成 (8) H2S+2FeCl3→FeCl2+S↓+2HC1 现象:通入H2S后,溶液由黄色变成浅绿色,有淡黄色沉淀生成 (9) 2H2S+SO2→3S↓+2H2O 现象:两种气体混合后,瓶壁有淡黄色沉淀生成 4.H2S气体与某些重金属盐溶液反应产生硫化物沉淀 (1) H2S+CuSO4 →CuS↓+H2SO4 现象:通入H2S后,生成黑色沉淀 (2) H2S+2AgNO3→ Ag2S↓+2HNO3 现象:通入H2S后,生成黑色沉淀 (3) H2S+Pb(NO3)2→PbS↓+2HNO3 现象:通入H2S后,生成黑色沉淀 (PbS为黑色沉淀,用湿润的醋酸铅试纸检验H2S气体)
高一化学方程式大全
高一化学方程式 一、碱金属: 1. 新切的钠有银白色光泽,但很快发暗;方程式:4Na+O2=2Na2O; 钠在空气中燃烧时,同时生成淡黄色的固体,方程式:2Na+O2点燃==== Na2O2。 锂燃烧方程式:4Li+O2点燃==== 2Li2O; 2.硫的化学性质不如氧气活泼,将钠粒与硫粉混合时爆炸,方程式:2Na+S=Na2S 3. 钠与水剧烈反应后滴有酚酞的水变成红色,方程式:2Na+2H2O=2NaOH+H2↑; 钾与水反应更剧烈,甚至爆炸,为了安全,常在小烧杯上盖一块小玻璃片。 4. 过氧化钠粉末滴几滴水,燃烧;方程式:2Na2O2+2H2O=4NaOH+O2↑; 用玻璃管吹气,脱脂棉也燃烧;有关的方程式:2Na2O2+2CO2=2Na2CO3+O2↑; 5.碳酸钠和碳酸氢钠两种固体物质都可以与盐酸反应放出气体,有关离子方程式分别为:CO32-+2H+=H2O+CO2↑;HCO3-+H+=H2O+CO2↑; 7. 碳酸钠和碳酸氢钠的热稳定性较差的是碳酸氢钠,其加热时发生分解,方程式是:2NaHCO3=Na2CO3+H2O+C O2↑ 。 (1)高锰酸钾分解: 2KMnO4△==== K2MnO4+MnO2+O2↑ (2)碳酸铵或碳酸氢铵分解: (NH4)2CO3△==== 2NH3↑+H2O+CO2↑ 8. 除去碳酸钠固体中的少量NaHCO3的方法是加热;除去碳酸氢钠溶液中混有的少量Na2CO3溶液的方法是: 通入足量CO2气体:Na2CO3+CO2+H2O=2NaHCO3 。 9. 从NaOH溶液得到纯净的Na2CO3溶液的方法是把NaOH溶液分为二等份,一份通入足量CO2使之全部成为NaHCO3;然后把另份NaOH溶液加入到此溶液中,摇匀即可。两个方程式分别为:NaOH+CO2=NaHCO3; NaHCO3+NaOH=Na2CO3+H2O 10. 往稀的碳酸钠溶液中加入几滴稀盐酸,离子方程式为H++CO32-=HCO3-。 11. 碳酸钠和碳酸氢钠分别滴入澄清石灰水中,反应的离子方程式分别为: CO32-+Ca2+=CaHCO3-+Ca2++OH-=CaCO3↓+H2O 。 两溶液中只有Na2CO3 可以使CaCl2溶液出现白色沉淀,离子方程式为:CO32-+Ca2+=CaCO3↓。 二、卤素: 12. 氟气是浅黄绿色;氯气是黄绿色;液溴是深红棕色;固态碘是紫黑色。常用的有机萃取剂四氯化碳无色,密度比水大;苯也是无色液体,密度比水小。液溴常用水封存,液溴层是在最下层。 13. 闻未知气体气味,方法是: 用手在瓶口轻轻扇动,仅使极小量的气体飘入鼻孔。 14. 铜丝红热后伸进氯气瓶中:铜丝剧烈燃烧,发红发热,同时生成棕色烟;加少量水,溶液蓝绿色,方程式:Cu+Cl2点燃==== CuCl2。铁丝红热后也可以在氯气中剧烈燃烧,方程式:2Fe+3Cl2点燃==== 2FeCl3。高压干燥的大量氯气用钢瓶保存,因为常温下干燥氯气不与铁反应。 15. 氢气与氯气混合后见强光爆炸,但H2也可以在Cl2中安静燃烧,在集气瓶口出现大量酸雾,火焰是苍白色,方程式:H2+Cl2点燃==== 2HCl。
