高一无机推断题专题练习及答案
高一无机推断题专题练习
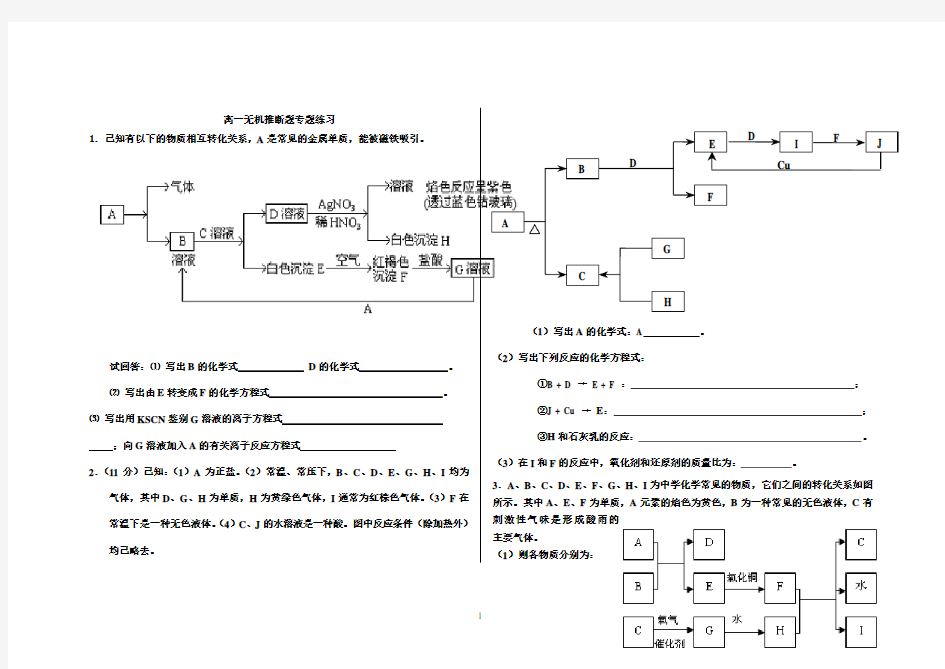
1.已知有以下的物质相互转化关系,A 是常见的金属单质,能被磁铁吸引。
试回答:⑴ 写出B 的化学式 D 的化学式 。
⑵ 写出由E 转变成F 的化学方程式 。
⑶ 写出用KSCN 鉴别G 溶液的离子方程式
;向G 溶液加入A 的有关离子反应方程式
2.(11分)已知:(1)A 为正盐。(2)常温、常压下,B 、C 、D 、E 、G 、H 、I 均为
气体,其中D 、G 、H 为单质,H 为黄绿色气体,I 通常为红棕色气体。(3)F 在常温下是一种无色液体。(4)C 、J 的水溶液是一种酸。图中反应条件(除加热外)均已略去。
(1)写出A 的化学式:A 。
(2)写出下列反应的化学方程式:
①B + D → E + F : ; ②J + Cu → E : ; ③H 和石灰乳的反应: 。
(3)在I 和F 的反应中,氧化剂和还原剂的质量比为: 。
3.A 、B 、C 、D 、E 、F 、G 、H 、I 为中学化学常见的物质,它们之间的转化关系如图
所示。其中A 、E 、F 为单质,A 元素的焰色为黄色,B 为一种常见的无色液体,C 有刺激性气味是形成酸雨的主要气体。
(1)则各物质分别为:
五种物质的相互转化关系Array A→E分别为(写化学式)A ;B ;
E 。
A→E分别为(写化学式)A ;
D ;
E 。
E→C
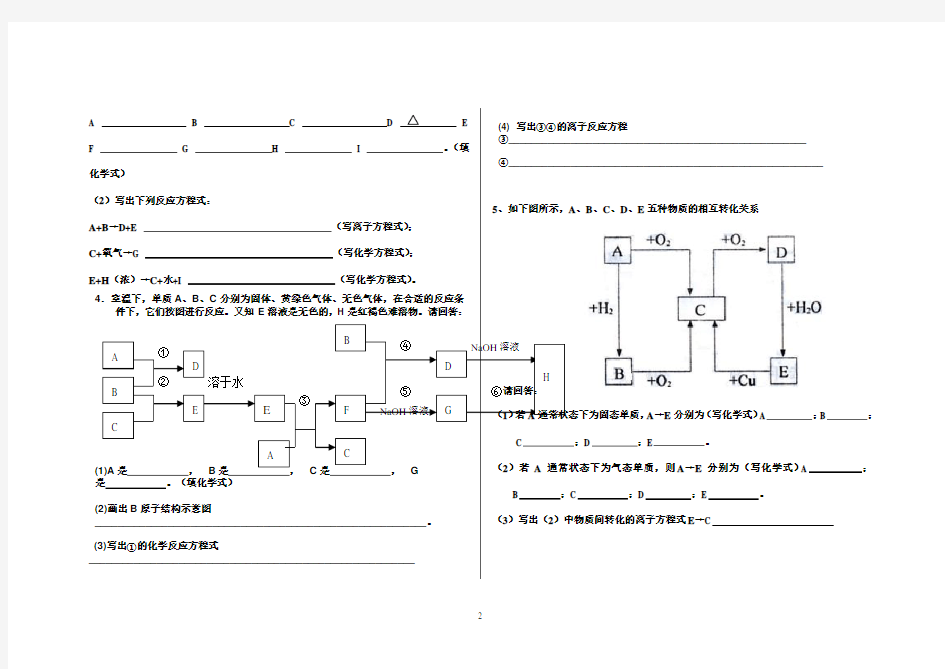
6、根据如下转化关系
回答下列问题:
(1)物质的分子式:A 、B 、C 、
D 、
E 、
F 。
(2)写E→F的离子方程式。
7.物质有以下转化关系:
根据上图和实验现象,回答下列问题:(用化学式表示)
(1)A是,B是,C是,X粉末是。
(2)确认A中阳离子的实验方法是。
(3)写出反应Ⅰ的化学方程式。
(4)写出反应Ⅱ的离子方程式。
8.现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A、F。
(2)说出黄绿色气体乙的一种用途。
(3)区别E、F两种溶液最简单的方法是,实验室检验G中所含的金属离子时,常在G的溶液中加入溶液。
(4)反应①的离子方程式为。(5)反应⑦的化学方程式为。
高一无机推断题专题练习答案
1、⑴ FeCl2,KCl;
⑵ 4 F e(O H)2 + O2 + 2H2O == 4 Fe(OH)3。
⑶ Fe3+ +3SCN -== Fe(SCN)3,2Fe3+ +Fe == 3Fe2+。
2. (11分)(1)A:NH4Cl
(2)
①4NH3 + 5O2====== 4NO + 6H2O
②3Cu + 8HNO3(稀)== 3Cu(NO3)2 + 2NO↑ + 4H2O
③2Cl2 + 2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O (各2分)
(3)1︰2 (3分)
3.(1)Na、H2O、SO2、NaOH、H2、Cu、SO3、H2SO4、CuSO4
(2)2Na+2H2O==2Na++2OH—+H2↑
2SO2+O22SO3
Cu+2H2SO4(浓) CuSO4+ 2H2O+SO2↑
4.
(1)A是Fe ,B是Cl2,C是H2,G 是Fe(OH)2。
(2) B原子结构示意图:___________
点燃
(3) ①2Fe+3Cl2 ==2FeCl3
(4) ③_Fe+2H+ =H2↑+Fe2+
④2Fe2+ +Cl2= 2Cl--+ 2Fe3+
5、(1)S、H2S、SO2、SO3、H2SO4(2)N2、NH3、NO、NO2、HNO3
(3)3Cu+8H++2NO3—3Cu2++2NO↑+4H2O
6、(1)(NH4)2SO3(或NH4HSO3); (NH4)2SO4(或NH4HSO4); SO2; NH3; K2SO3; K2SO4
(2)SO32—+Br2+H2O SO42—+2Br—+2H+
7.(共11分,)
(1)A是Na2O2,B是O2,C是Na2CO3,X粉末是Cu 。(2)确认A中阳离子的实验方法是焰色反应。
(3)写出反应Ⅰ的化学方程式2Na2O2+2CO2 =2Na2CO3+O2。
(4)写出反应Ⅱ的离子方程式Cu2++2OH- =Cu(OH)2↓ 。
8、
(1)Na 、FeCl2。(2)自来水消毒或制造盐酸(合理答案均可给分)。
(3)观察两种溶液颜色,硫氰化钾溶液或氢氧化钠溶液。
(4)2Na+2H2O==2Na++2OH-+H2↑
(
5)4Fe(OH)2+O2+2H2O==4Fe(OH)3催化剂
△
高三专题复习_无机化学推断题方法与常见的物质归纳(1)
无机推断题复习 一、无机推断题复习方法和策略。 推断题融元素化合物、基本概念和理论于一体,侧重考查学生思维能力和综合应用能力。在解无机推断题时,读题、审题相当重要,在读题审题过程中,要认真辩析题干中有关信息,抓住突破口,分析无机推断中的转化关系,仔细推敲,挖掘出隐含条件。 (一)基本思路 读题(了解大意)→审题(寻找明显条件、挖掘隐含条件与所求)→解题(抓突破口)→推断(紧扣特征与特殊)→得出结论→正向求证检验 读题:读题的主要任务是先了解题目大意,寻找关键词、句,获取表象信息。切勿看到一点熟悉的背景资料就匆匆答题,轻易下结论,这样很容易落入高考试题中所设的陷阱。 审题:对读题所获信息提炼、加工,寻找明显的或潜在的突破口,更要注意挖掘隐含信息-“题眼”。“题眼”常是一些特殊的结构、状态、颜色,特殊的反应、反应现象、反应条件和用途等等。审题最关键的就是找出”题眼”。 解题:找到“题眼”后,就是选择合适的解题方法。解无机推断题常用的方法有:顺推法、逆推法、综合推理法、假设法、计算法、实验法等。通常的思维模式是根据信息,大胆猜想,然后通过试探,验证猜想;试探受阻,重新阔整思路,作出新的假设,进行验证。一般来说,先考虑常见的规律性的知识,再考虑不常见的特殊性的知识,二者缺一不可。 验证:不论用哪种方法推出结论,都应把推出的物质代入验证。如果与题设完全吻合,则说明我们的结论是正确的。最后得到正确结论时还要注意按题目要求规范书写,如要求写名称就不要写化学式。 (二)相关知识储备 解答无机推断题需要一定的背景知识为基础。下面以“考纲”为核心,以教材出发,结合对近几年高考试题的分析和对未来的预测,对常考的热点知识作如下归纳:
高三无机推断专题(附答案)
高三无机推断专题 1、A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图: 填写下列空白: (1)物质A是,B是,C是。 (2)F中加入NaOH溶液,并在空气中放置的化学方程式是, 。 2、A、B、C是3种短周期元素的单质,甲、乙是两种常见的化合物。这些单质和化合物之间存在如下图所示的关系:据此为判断: 若单质A是,则单质B、C分别为、。 若单质A是,则单质B、C分别为、。 若单质A是,则单质B、C分别为、。 3、 上图反应中,加入或生成的水及其它物质及分离操作均已略去。写出: (1)化学式:(a) (b) A K (2)化学方程式: C与D的反应: A生成J:
G生成H: I+J K: 4、下图中的每一方格表示有关的一种反应物或生成物,其中粗框表示初始反应物(反应中加入或生成的水以及与沉淀J同时生成的其他产物均已略去)。 (1)物质B是____,F是____,J是____ (2)写出反应①的离子方程式________________ 5、根据下图记录的实验现象,推断A、B各是什么物质。 (1)A是,B是(写化学式) (2)写出A、B等物质的量在水溶液中反应的离子方程式。 6、下图表示某些化工生产流程(有的反应条件和产物已略去)
试回答: (1)C 的化学式是 ,L 的名称是 。 (2)E →G 的化学方程式是 。 (3)G →H 的反应中,氧化剂与还原剂的物质的量之比为 。 (4)写出饱和食盐水+F +E →J +K (沉淀)的化学方程式 。 (5)写出由上述流程图中出现的元素组成的5种铵盐的化学式 。 8.下图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的 物质均已略去),图中A 是单质,D 在常温下呈气态,F 可用作化肥,也可用来作炸药。 (1)写出A 的电子式 和F 的化学式 (2)写出下列变化的化学方程式: B → C E →C 9.在下列物质的转化关系中,A 是一种固体物质,E 是一种白色沉淀,据此填写下列空白: (1)B 的化学式是 ,B 在固态时属于 晶体。 (2)B 和a 溶液反应的离子方程式是 (3)A 和a 溶液反应的化学方程式是 参考答案 1、(1)Fe 、Cl 2、H 2 (2)FeCl 2+2NaOH===Fe(OH)2↓+2NaCl 4Fe(OH)2+O 2+2H 2O===4Fe(OH)3 2、A :Cl 2;O 2;F 2;(Mg ;Al) B :S ;C ;O 2;(C ;Fe) C :H 2;H 2;H 2;(O 2;O 2) 3、(1)HCl ;NaOH ;Al 2O 3;Al(OH)3 (2)2Al +Fe 2O 3 Al 2O 3+2Fe Al 2O 3+2NaOH==2NaAlO 2+H 2O
高三化学无机推断题专项练习
高三化学无机推断题专项练习 高三化学无机推断题专项练习为黑色已知B~H都是初中化学中常见的物质,1.A溶液中为红色固体,HD为红色固体单质,F固体,的溶质是一种盐.它们的转化关系如图所示.请回答:
请填写下列空白: 第于位素元的I质单成组,中表周期在)1(、E 、B 的化学式为F和E、B物质)1(族。F ; ___________________周期在反应⑦中氧化剂与还原剂的物质的量之比为2(程学的)(2反应①化方式),其反应类型 ___________________。为: )在②、③、⑥、⑨中既属于化合反应又属于非( 3。为 .2下图是无机物__________氧化还原反应的是MA~在一定条件下的转化关系(部(填序号)是离④反(4)应的子是由第三周期。其中,分产物及反应条件未列出)I方程式。是一种红棕 __________________________________ K元素组成的单质中熔点最高的金属,可制得一种“绿与将化合物)DKNO共融,KOH色气体。、5(3,同时还生(高铁酸钾)FeOK色”环保高效净水剂42化应反该OH和KNO成。的学是式方程22页12共页4第◎页12共页3第
分别A、B、C、AD四种短周期元素现有4.(8_________________________。分), 且甲、, D结合生成甲、乙、丙三种化合物C与B、123.(分)以下均为中学化学常见物质,存在如下、结合生、D为气体单质,CG分子中含相同数目的质子数,乙、丙3C 部分产物已省略转化关系()。通常成化合物丁。有关元素的单质和甲、乙、丙、丁四在为紫黑色固体单质。实验室中,常用固体EB 的。种化合物的转化关系如下图:H催化下加热制取气体单质 式反应程方→(1)写出B+乙甲+C的化学。______________________四种元素、D)根据以上条件可以确定(2A、B、C 中的三种G,不能被 确定的第四种元素是_______的电子式。的化学式( ;填F)(1(2)反应②的离子方程
无机化学推断题做题方法
无机化学推断题做题方法 解题方法:解无机推断题的关键是找突破口,这是解无机推断题的根本方法。根据突破口的类型不同,解题方法可分为如下几种: 1. 特征现象(1)火焰颜色苍白色:H2在Cl2中燃烧。蓝色:CO在空气中燃烧。淡蓝色:H2S、CH4、H2在空气中燃烧。焰色反应:Na元素解题方法: 解无机推断题的关键是找突破口,这是解无机推断题的根本方法。根据“突破口”的类型不同,解题方法可分为如下几种: 1. 特征现象 (1)火焰颜色 苍白色:H2在Cl2中燃烧。 蓝色:CO在空气中燃烧。 淡蓝色:H2S、CH4、H2在空气中燃烧。 焰色反应:Na元素(黄色)、K元素(紫色)。【口诀:紫钾黄钠。紫钾可记为“指甲”】(2)有色溶液 含有的离子Fe2 Fe3 Cu2 MnO4 - 颜色浅绿 色 黄色蓝色紫红色 (3)有色固体
黑色:CuO FeO Fe Fe3O4Mn 红色:Cu、Cu2O、Fe2O3 红褐色:Fe(OH)3 白色:CaCO3、BaSO4、AgCl、BaSO3 (4)有色气体: 黄绿色:Cl2 红棕色:NO2 、Br2 (5)沉淀颜色:氯化银(白色)、溴化银(浅黄色)、碘化银(黄色)【颜色逐渐加深】氢氧化铜(蓝色絮状)磷酸银(黄色) ②铵盐: (2)与酸反应产生气体 ① ②
(3)Na2S2O3(硫代硫酸钠)与酸反应既产生沉淀又产生气体:S2O32- 2H=S↓ SO2↑ H2O (4)与水反应产生气体 ①单质 ②化合物 (5)强烈双水解 (6)既能酸反应,又能与碱反应 ①单质:Al ②化合物:Al2O3、、弱酸弱碱盐、弱酸的酸式盐、氨基酸。 (7)与Na2O2反应 (8)2FeCl3+ H2S=2FeCl2+ S↓ +2HCl (9)电解
无机化学推断题专题
无机化学推断题专题 无机化学推断题专题 高考化学推断题包括实验推断题、有机物推断题和无机物推断题,它对考生的思维能力和知识网络构造提出了较高的要求,即要求考生有较深厚的化学功底,知识网络清晰,对化学的所有知识点(如元素、化合物的性质)了如指掌。一、找到突破口进行联想:推断题首先要抓住突破口,表现物质特征处大都是突破口所在,所以考生在掌握化学知识概念点上,要注意总结它的特征。在推断题的题干中及推断示意图中,都明示或隐含着种种信息。每种物质都有其独特的化学性质,如物质属单质还是化合物,物质的颜色如何,是固体、液体还是气体,有怎样的反应条件,反应过程中有何现象,在生活中有何运用等,同时还要注意表述物质的限制词,如最大(小)、仅有的等。考生看到这些信息时,应积极联想教材中的相关知识,进行假设重演,一旦在某一环节出错,便可进行另一种设想。 二、在训练中找感觉:一般而言,推断题的思维方法可分三种:一是顺向思维,从已有条件一步步推出未知信息;第二种是逆向思维,从问题往条件上推,作假设;第三种则是从自己找到的突破口进行发散推导。解推断题时,考生还可同时找到几个突破口,从几条解题线索着手,配合推断。可以说化学推断题没有捷径可谈,它需要考生在训练中总结经验、寻找规律,发现不足后再回归课本,再进行训练,螺旋上升。如此而为,做推断题便会有“感觉”。 无机推断题既能考查元素及其化合物知识的综合应用,又能对信息的加工处理、分析推理、判断等方面的能力加以考查,因此此类题型应是考查元素及其化合物知识的最佳题型之一。 无机物的综合推断,可能是对溶液中的离子、气体的成分、固体的组成进行分析推断,可以是框图的形式,也可以是文字描述的形式(建议考生有时可以先在草稿纸上把文字描述转换成框图形式,这样可以一目了然)。不管以哪种方式出题,解题的一般思路都是:迅速浏览→产生印象→寻找突破口→注意联系→大胆假设→全面
高考化学无机推断题专题
第二轮复习无机推断题专题讲座 [命题趋向] 推理能力是高考测试的五项能力之一。《考试大纲》中对推理能力是这样界定的:“通常根据已知的知识和题目给定的事实和条件,抽象、归纳相关信息,对自然科学问题进行逻辑推理和论证,得出正确的结论或做出正确的判断,并能把推理过程正确地表达出来”。 无机物质推断题既可以综合考查元素化合物方面的基础知识、还可联系到化学基础理论、化学基本计算、化学实验现象等等,另外无机物质推断题可以较好地测试推断能力,所以近几年的高考试题中,无机物质推断题成了每年高考中考查推理能力的保留题型。分析今高考中物质推断题,主要可分成以下三类:选择型推断题、文字叙述型推断题、框图型推断题。 从推理能力考查的特点分析,高考无机推断题中主要表现了以下几个特点: ①单信息、多信息并重。同一道推断题中,有的结论只要分析单个信息就可以得出,有的结论需要同时综合多条信息才能得出。 ②正向、逆向、统摄三种形式的推理并重。有些结论的得出过程中,需要正向、逆向、统摄等三种推理形式。 ③定性、定量分析并重。推断过程中既需要定性分析、又需要定量分析。 ④计算和逻辑推理(讨论)并重。 [知识体系和复习重点] 《考试大纲》中对元素化合物知识的综合要求较高,具体要求如下: ①了解在生活和生产中常见无机化合物的性质和用途。 ②能够运用无机化合物各部分知识进行综合推断,解决有关的综合问题。 ③能够综合运用无机化合物、有机化合物知识进行综合分析,解决有关的综合问题。[知识指津] 无机物的相互反应(见下图所示) (1)无机物间能否反应,主要决定于反应物的性质及反应时的客观条件。左边所示的无机物间的相互反应指其主要性质而言,至于各个具体物质间能否反应,还有一些具
无机化学推断题
无机推断题 1 . X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的 不稳定的二元酸,该酸的化学式是_______________ ;Y和X的组成元素相同,Y的化学式 是_________ ; 1 mol Z在加热时跟水反应的产物需要用 6 mol的氢氧化钠才能完全中和,Z 的化学式是________ ,其中和产物的化学式是_________________ 。在一定条件下,Y可以跟 非金属单质A反应生成X和Z,其反应的化学方程式是______________________________________ 。 2 ?根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验 室鉴定化合物E的反应。03广东化 (1)单质L是 ______________ 。 (2)化合物B是_______________ 。 (3) ________________________________________________________ 图中除反应①以外,还有两个用于工业生产的反应,是____________________________________ 和_______ (填代 号)。 它们的化学反应方程式分别是 ____________ 和 _____________ 。 3 .已知:02MCE、天津理综 ①A、B、C、D四种物质均含兀素X,有的还可能含有兀素Y、Z。兀素Y、X、Z的原 子序数依次递增。 ②X在A、B、C、D中都不呈现它的最高化合价。 ③室温下单质A与某种常见一兀强碱溶液反应,可得到B和C。 ④化合物D受热催化分解,可制得兀素Y的单质。 1 兀素X是,Z是。 2 写出③中反应的化学方程式:。 3 写出④中反应的化学方程式:________________________________________________ 。 4?甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们 两两混合后,观察到的现象是:① 甲与乙或丙混合都产生沉淀;② 丙与乙或丁混合也产生沉淀;③ 丁与乙混合产生无色气体。回答下面问题:01广东化
高考化学高无机综合推断(大题培优)
高考化学高无机综合推断(大题培优) 一、无机综合推断 1.现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质。 (1)在这8种物质中,属于电解质的有_____________(用相应的化学式表示,下同)。 (2)这8种物质中的某5种存在下面的相互关系,选择适当的物质填入①~⑤,使有连线的两种物质能发生反应,并回答下列问题。 ①它们的化学式分别为:①______________;③____________;⑤______________。 ②如果连线对应的反应分别用A、B、C、D、E表示。五个反应中属于氧化还原反应的有________________个;反应A的离子方程式为________________________,反应D的化学方程式为_________________________。 【答案】(1)Na2CO3、NaCl、CaO; (2)①Fe ②H2SO4③CO2④CaO ⑤Na2CO3②1 Fe+2H+===Fe2++H2↑ 不属于 H2SO4+Na2CO3===Na2SO4+H2O+CO2↑ 【解析】 试题分析:(1)电解质指的是在水溶液或熔融状态下能够导电的化合物,因此属于电解质的有Na2CO3、NaCl、CaO;(2)单质①能够和酸②,则单质①为Fe,酸②为H2SO4;盐⑤能够和H2SO4反应,因此盐⑤为Na2CO3;氧化物④能够和H2SO4反应,因此氧化物④为碱性氧化物CaO;氧化物③能够和CaO反应,则氧化物③为CO2;故答案:①Fe ②H2SO4③CO2④CaO ⑤Na2CO3;②有化合价升降的反应为氧化还原反应,在五个反应中,只有反应A为氧化还原反应;反应A的离子方程式为Fe+2H+===Fe2++H2↑;反应B 为CO2和CaO的反应,不属于离子反应;反应D是Na2CO3和H2SO4的反应,反应的化学方程式为:H2SO4+Na2CO3===Na2SO4+H2O+CO2↑。 考点:考查物质的分类与性质。 2.氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回
无机推断专题练习
无机推断专题练习 1、对从太空某星球外层空间取回的气体样品分析如下: (1)将样品溶于水,发现其主要成分气体A极易溶于水,水溶液呈酸性;(2)将A的浓溶液与KMnO4反应产生一种黄绿色气体单质B,将B通入石灰乳可生成两种钙盐的混合物D。 (3)A的稀溶液与锌粒反应生成气体C,C与B的气体充分混合经光照发生爆炸又生成气体A,实验测得反应前后气体体积不变。 据此回答下列问题:(1)写出A、B、C、D的化学式: A________;B________C_________D___________。 (2)气体B与Ca(OH)2的化学反应方程式____________________,混合物D俗名是__________________,它的有效成分是____________________,其有效成分与空气里的二氧化碳和水蒸气反应的方程式是________________________________。 2、列物质间有如下转化关系 浅黄色固体W E ③ ② 气体甲 E ① 气体乙 白色悬浊液C 固体A 溶液B 点燃 液B 溶 ④ 液体E 气体丙液D 溶 溶液B (1)W为__________ (2)固体A是一种重要的工业原料,1mol气体乙完全燃烧时生成1molE和2mol丙,则 乙的分子式为____________ (3)C溶液中的溶质和丙以物质的量之比1:2反应时,离子方程式为 __________________________________________________________。 (4)利用图中有关物质实现C→B的转变,该物质是___________(填化学式) (5)若甲和乙恰好完全反应,则A和W的物质的量之比为__________ 3、有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系。已知:○1A、 B、C、D含同一种元素; ○2A、B、C、D、E、F、G都不是氧化物; ○3D、G是钠盐; ○4A、E、F、G含同一种元素,且F为单质, E在常温下为气体。 回答下列问题: (1)写出A、F的化学式:A_______F________ (2)写出下列反应的离子方程式: ○1D→C_______________________________ ○2C+D→B_____________________________ 4、A、B、C、D、E几种常见的化合物或单质之间有如下转化关系: A B E C D F G H2O
大学本科无机推断题
1、有一种白色固体A,加入油状无色液体B,可得紫黑色固体C, C微溶于水,加入A后C的溶解度增大,成棕色溶液D。将D分成两份,一份中加一种无色溶液E,另一份通入气体F,都褪色成无色透明溶液,E溶液遇酸有淡黄色沉淀,将气体F通入溶液E,在所得的溶液中加入BaCl2溶液有白色沉淀,后者难溶于HNO3,问A至F各代表何物质?用反应式表示以上过程. 答:A:KI B:浓H2SO4C:I2D:KI3E:Na2S2O3F:Cl2 六、综合题: 化合物A是白色固体,不溶于水,加热时剧烈分解,产生固体B和气体C。固体B不溶于水或盐酸,但溶于热的稀硝酸,得溶液D及气体E。E无色,但在空气中变红。溶液D用盐酸处理时得一白色沉淀F。气体C与普通试剂不起反应,但与热的金属镁反应生成白色固体G。G与水反应得另一种白色固体H及气体J。J使润湿的红色石蕊试纸变蓝,,固体H可溶于稀硫酸得溶液I。化合物A以硫化氢溶液处理时得黑色沉淀K及无色溶液L和气体C,过滤后,固体K 溶于硝酸得气体E及黄色固体M和溶液D。D以盐酸处理得沉淀F,滤液L以NaOH溶液处理又得气体J。请指出A至M表示的物质名称。并用反应式表示以上过程. 答:A─AgN3B─Ag C─N2 D─AgNO3E─NO F─AgCl G─Mg3N2 H─Mg(OH)2I─MgSO4J─NH3K─Ag2S L─(NH4)2S M─S 五、综合题: 14mg某黑色固体A,与浓NaOH共热时产生无色气体B 22.4ml(标况下).A燃烧的产物为白色固体C,C与氢氟酸反应时,能产生一无色气体D,D通入水中时产生白色沉淀E及溶液F.E用适量的NaOH溶液处理可得溶液G.G中加入氯化铵溶液则E重新沉淀. 溶液F 加过量的NaCl时得一无色晶体H.试判断各字母所代表的物质.用反应式表示. 答:A─Si B─H2C─SiO2D─SiF4E─H2SiO3 F ─H2SiF6 G─Na2SiO3H─Na2SiF6 五、综合题: 对含有三种硝酸盐的白色固体进行下列实验:①取少量固体A加入水溶解后, 再加NaCl溶液,有白色沉淀;②将沉淀离心分离,取离心液三份,一份加入少
无机化学推断题
无机化学推断题 1 / 4 无机推断题 1.X 、Y 、Z 是短周期元素的三种常见氧化物。X 跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是 ;Y 和X 的组成元素相同,Y 的化学式是 ;1 mol Z 在加热时跟水反应的产物需要用6 mol 的氢氧化钠才能完全中和,Z 的化学式是 ,其中和产物的化学式是 。在一定条件下,Y 可以跟非金属单质A 反应生成X 和Z ,其反应的化学方程式是 。 2.根据下列反应框图填空,已知反应①是工业上生产化合物D 的反应,反应⑤是实验室鉴定化合物E 的反应。(03广东化) (1)单质L 是 。 (2)化合物B 是 。 (3)图中除反应①以外,还有两个用于工业生产的反应,是 和 (填代号)。 它们的化学反应方程式分别是 和 。 3.已知:(02MCE 、天津理综) ① A 、B 、C 、D 四种物质均含元素X ,有的还可能含有元素Y 、Z 。元素Y 、X 、Z 的原子序数依次递增。 ② X 在A 、B 、C 、D 中都不呈现它的最高化合价。 ③ 室温下单质A 与某种常见一元强碱溶液反应,可得到B 和C 。 ④ 化合物D 受热催化分解,可制得元素Y 的单质。 (1) 元素X 是 ,Z 是 。 (2) 写出③中反应的化学方程式: 。 (3) 写出④中反应的化学方程式: 。 4.甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:① 甲与乙或丙混合都产生沉淀;② 丙与乙或丁混合也产生沉淀;③ 丁与乙混合产生无色气体。回答下面问题:(01广东化) (1)写出丁与乙反应的离子方程式:________________________________________。 (2)这四种溶液分别是甲:_________、乙:_________、丙:_________、丁:_________。 5.室温下,单质A 、B 、C 分别为固体、黄绿色气体、无色气体,在合适反应条件下,
高考热点专题测试卷 无机推断题(附答案)
高考热点专题测试卷:专题五 无机推断题 说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答. 第Ⅰ卷(共83分) 一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中. 1.1995年美国教授Lagow 报道,他制得了碳的第四种同素异形体——链式炔碳: ΛΛ C C C C C C 该物质的一个分子中含300-500个碳原子,性质很活泼.据此判断链式炔碳的 熔点,估计比石墨( ) A .高 B .低 C .相等 D .无法判断 2.过氧化氢与硫酸酸化的高锰酸钾溶液进行反应生成硫酸钾、硫酸锰、水和氧气.如果过氧化氢中的氧原子是示踪原子(O 18 ),当反应完全后,含有示踪原子的物质是( ) A .硫酸钾 B .硫酸锰 C .氧气 D .水 3.在含有不同离子的四种溶液中,加过量盐酸得到了白色沉淀,过滤,在滤液中加过量氨水又得到白色沉淀,过滤,在滤液中加入3NaHCO 溶液仍得到白色沉淀的是( ) A .+ Ag 、+ 2Cu 、+ 2Ca B .+Ag 、+ 2Ba 、+ 2Ca C .+ 2Ba 、+Ag 、-2AlO D .+ 3Al 、+ 2Mg 、+ 2Ba 4.欲同时对农作物施用含N 、P 、K 三种元素的化肥,现有:( ) ①32CO K ②KCl ③242)PO Ca(H ④424SO )(NH ⑤氨水,最适合的组合是 A .①③④ B .②③④ C .①③⑤ D .②③⑤ 5.下列各组物质中,两者互为同分异构体的是( ) ①O 5H CuSO O 3H CuSO 2424??和 ②224)CO(NH CNO NH 与 ③COOH CH NH NO H C 22252和 ④342]Cl )O [Pu(H 与Cl O 2H ]Cl )O [Pu(H 2222?? A .①②③ B .②③④ C .②③ D .③④ 二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中. 6.右图示为白磷在空气中充分燃烧后,生成物分子的结构示意图.其中圆圈表示原子,实线表示化学键.下列关于该生成物的叙述中不正确的是( ) A .生成物的化学式为104O P B .分子中磷原子排列成正四面体型
必修一无机化学推断题(二)
必修一无机化学推断题(二) 1、由短周期元素组成的单质A 、B 、C 和甲、乙、丙、丁、戊五种化合物有下图所示转换 关系,工业上电解熔融的甲可制取金属A 。请回答: (1)写出下列物质的化学式:A 甲 。 (2)写出乙物质的溶液中通入过量CO 2的现象: ; (3)写出丁与过量氨水反应的离子方程式: 。 2、下图中A ~H 均为中学化学中常见的物质,它们之间有如下转化关系。其中A 为金属单质, B 为非金属单质,A 与水反应生成 C 和最轻的气体 D ,C 的焰色反应呈黄色。 请回答以下问题: (1)C 的电子式为_____________。 (2)F 的化学式为_____________。 (3)写出某种金属与C 反应生成D 的化 学方程式________________________。 (4)写出H 与G 的稀溶液反应生成F 的离子方程式________________________。 3、下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质 未列出。已知:A 、C 、D 、F 均为单质,C 、E 、F 、G 常温下是气体,J 为白色沉淀,既能溶于B ,又能溶于E ;物质B 、G 可以使湿润的红色石蕊试纸变蓝,且B 的焰色反应呈黄色。反应④是化肥工业的重要反应。 请回答下列问题: (1)A 的元素在元素周期表中的位置是 ,物质B 的电子式为 。 (2)上述反应①~⑥中,属于化合反应的是 。 (3)反应⑤的离子方程式为 。 (4)在I 的水溶液滴加B 溶液至过量的过程中,所观察到的现象为 。 通过量CO 2 通过量NH 3 C 乙 NaOH 溶液 A +B 甲 NaOH 溶液 HCl 溶液 乙 丁 丙 戊
2013高考化学常见难题大盘点:无机推断题
2013高考化学常见难题大盘点:无机推断题 1、常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示 (1)分别写出A 、B 、C 、D 的化学式: A B C D (2) 试写出有关化学方程式: A →B D →A 。 2、现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图 中有些反应的产物和反应的条件没有全部标出)。 请根据以上信息回答下列问题: ⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式: 反应① 反应⑤ 3、A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出) (1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍, 所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体 生成,则A 的原子结构示意图为____ _____,反应④的化学方程式为__________ __________. (2)若A 为常见的金属单质,D 、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式___ _____.
(3)若A 、D 、F 都是短周期非金属元素单质,且A 、D 所含元素同主族,A 、F 所含元素同周期,则反应①的化学方程式为_________ ___________,B 固体属于__________晶体. 4.短周期常见元素形成的纯净物A 、B 、C 、D 、E 的转化关系如下图所示,物质A 与物质B 之间的反应不在溶液中进行(E 可能..与A 、B 两种物质中的某种相同)。 请回答下列问题: (1)若C 是离子化合物,D 是一种强碱,写出C 的化学式 。 (2)若C 与水发生复分解反应,E 的水溶液呈弱酸性,D 是既能溶于强酸、又能溶于强碱的化合物。 ①用电离方程式解释D 既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。 。 ②用等式表示E 与NaOH 溶液反应生成的正盐溶液中所有离子..浓度之间的关系 ______________________________________________________。 (3)若C 是一种气体,D 是一种强酸。 ①C 与水反应的化学方程式_________________________。 ②有人认为“浓H 2SO 4可以干燥气体C”。某同学 为了验证该观点是否正确,用右图装置进行实验。 实验过程中,浓H 2SO 4中未发现有气体逸出,且变为红棕色,则你得出的结论是 __________________________________________________________________________。 5、已知A 、B 均是由两种短周期元素组成的化合物,A 中某元素的质量分数为75%,C 、J 是同周期元素的气态氢化物,X 为无色液体,D 具有两性。反应生成的水均已略去。它们有如下图所示的关系。 (1)写出化学式:A . ,B . ,C . 。 (2)反应③中每生成lmolF ,转移电子的数目为: 。 (3)反应④的化学方程式为: 。 (4)写出离子方程式分别为:反应② ; 反应⑤ 。 (5)反应①中,每1.00g C 与足量的F 作用,恢复到25℃放出55.6kJ 热量,写出反应①的热化学方程式。 。 6、下图是由短周期元素组成的物质之间的转化关系。其中,A 的相对分子质量为144,反应①中生成C 、D 物质的量之比为3 :1,D 是不溶于水的白色固体,除反应③⑤外其它反应
2019年高考新型无机推断题训练
1、A、B、C、D均为中学化学常见的纯净物,A是单质。它们 之间有如下的反应关系: (1)若A是当前最常用的太阳能转换为电能的材料。C的水 溶液俗称水玻璃,D为硅酸。则:写出反应②的化学方程 式。 (2)若A是应用最广泛的金属。反应①、⑤均用盐酸,D物质是红褐色。则: 写出反应③的化学方程式。B溶液中加入NaOH溶液的现象是,沉 淀颜色发生变化对应的化学方程式是。 (3)若D物质是常见的两性氢氧化物,反应②③⑤均要用强碱溶液,反应④是通入 过量的CO2。则:反应②的离子方程式为。反应④的离子方程式 为。 2、A、B、C是大家熟悉的与生命运动密切相关的三种化合物,它们所含元素不超过三种,并有如图所示关系: 回答下列问题: (1)A、B、C、D的化 学式分别为A________, B________,C________, D________。 (2)在常温下A、B通过________途径转化为C,而人体内的蛋白质是由各种________ 通过缩聚而成。 (3)工业上制备D有两种方法,一是乙烯合成法,二是农作物秸秆发酵法,请写出有关的化学反应方程式及反应类型_________________。 (4)油脂水解生成的醇与D是否为同系物________(填“是”或“否”),请写出硬脂酸甘 油在碱性条件下发生皂化反应的化学方程式________ ___。 (5)目前,化合物B在自然界中的含量呈上升趋势,对环境产生了不良影响,发生这种变化的原因是_________________。 3、a、b、c、d、e是含有一种相同元素的五种物 质,可发生如下转化: 其中:a是单质;b是气体且为含氢化合物;c、d 是氧化物;e是最高价含氧酸。 (1)如果a是一种淡黄色粉末固体,试推断:(用化学式表示):a ;b ; e 。写出由c生成d的化学方程式____________________________ (2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):a ; b ; c ;并写出由d生成e的化学方程式________________________
2020届高三化学二轮复习题型必刷——【无机化学推断题型【能力提升】
2020届届届届届届届届届届届届届 ——届届届届届届届届届届届届届届届 一、单选题(本大题共20小题,共40分) 1.某常见金属的结晶水化合物MCl3?6H2O有如下转化关系:下列推断正确的是() A. 固体1一定是既能与盐酸反应,又能与强碱反应 B. 气体1通过五水硫酸铜晶体,固体变蓝色 C. 常温下,溶液2能溶解铜 D. 固体2浊液中滴加Na2S溶液,白色固体变黄色 【答案】C 【解析】解:A.M可能是Fe、Al,若固体1为Fe2O3,不能和NaOH反应,故A错误; B.气体1为HCl和H2O混合物,用无水硫酸铜检验水蒸气,故B错误; C.溶液2为HNO3溶液,常温下能溶解Cu,故C正确; D.固体2为AgCl,加入Na2S溶液,AgCl转化为Ag2S,而Ag2S是黑色的,故D错误。故选:C。 M为3三价金属,可以发生水解,M可能是Fe、Al,固体1为Fe2O3或Al2O3,气体1为HCl和H2O混合物,气体2为HCl,溶液1为稀硫酸,溶液2为HNO3,固体2为AgCl。本题考查无机物的推断,关键是对盐类水解的理解,熟练掌握元素化合物知识,侧重考查学生分析推理能力、知识迁移运用能力。 2.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由 其中的两种或三种元素组成的化合物,已是由Z元素形成的单质。已知:甲+乙→丁+己,甲+丙→戊+己;25℃时,0.1mol/L丁溶液的pH为13.下列说法不正确的是() A. 1mol中与足量的乙完全反应共转移1mol电子 B. Y元素位于第2周期第IVA族,它可以形成自然界中硬度最高的天然矿物 C. 化合构戊中既有离子键又有非极性共价键 D. 原子半径:W>Y>Z>X 【答案】C
高考化学推断题专题整理(精)
化学推断题专题 高考化学推断题包括实验推断题、有机物推断题和无机物推断题,它对考生的思维能力和知识网络构造提出了较高的要求,即要求考生有较深厚的化学功底,知识网络清晰,对化学的所有知识点(如元素、化合物的性质了如指掌。 一、找到突破口进行联想:推断题首先要抓住突破口,表现物质特征处大都是突破口所在,所以考生在掌握化学知识概念点上,要注意总结它的特征。在推断题的题干中及推断示意图中,都明示或隐含着种种信息。每种物质都有其独特的化学性质,如物质属单质还是化合物,物质的颜色如何,是固体、液体还是气体,有怎样的反应条件,反应过程中有何现象,在生活中有何运用等,同时还要注意表述物质的限制词,如最大(小、仅有的等。考生看到这些信息时,应积极联想教材中的相关知识,进行假设重演,一旦在某一环节出错,便可进行另一种设想。 二、在训练中找感觉:一般而言,推断题的思维方法可分三种:一是顺向思维,从已有条件一步步推出未知信息;第二种是逆向思维,从问题往条件上推,作假设;第三种则是从自己找到的突破口进行发散推导。解推断题时,考生还可同时找到几个突破口,从几条解题线索着手,配合推断。可以说化学推断题没有捷径可谈,它需要考生在训练中总结经验、寻找规律,发现不足后再回归课本,再进行训练,螺旋上升。如此而为,做推断题便会有“感觉”。 无机推断题既能考查元素及其化合物知识的综合应用,又能对信息的加工处理、分析推理、判断等方面的能力加以考查,因此此类题型应是考查元素及其化合物知识的最佳题型之一。 无机物的综合推断,可能是对溶液中的离子、气体的成分、固体的组成进行分析推断,可以是框图的形式,也可以是文字描述的形式(建议考生有时可以先在草稿纸上把文字描述转换成框图形式,这样可以一目了然。不管以哪种方式出题,解题的一般思路都是:迅速浏览→产生印象→寻找突破口→注意联系→大胆假设→全面分析(正推和逆推→验证确认。解题的关键是依物质的特性或转移特征来确定突破口(题眼,顺藤摸瓜,进而完成全部未知物的推断。因此首先应熟练掌握各种常见元素及其
高中化学无机推断题带答案
1、(14分) 常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示 (1)分别写出A 、B 、C 、D 的化学式: A B C D (2) 试写出有关化学方程式: A → B D →A 。 2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________; ②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。 3、(8分)现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些 反应的产物和反应的条件没有全部标出)。 请根据以上信息回答下列问题: ⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式: 反应① 反应⑤ 4、(13分)A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出) (1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.
的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________. (3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应 ①的化学方程式为____________________,B固体属于__________晶体. 5.(10分)短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的 反应不在溶液中进行(E可能 ..与A、B两种物质中的某种相同)。 请回答下列问题: (1)若C是离子化合物,D是一种强碱,写出C的化学式。 (2)若C与水发生复分解反应,E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。 ①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。 。 ②用等式表示E与NaOH溶液反应生成的正盐溶液中所有离子 ..浓度之间的关系 ______________________________________________________。 (3)若C是一种气体,D是一种强酸。 ①C与水反应的化学方程式_________________________。 ②有人认为“浓H2SO4可以干燥气体C”。某同学 为了验证该观点是否正确,用右图装置进行实验。 实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出 的结论是__________________________________________________________________________。 6、已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性。反应生成的水均已略去。它们有如下图所示的关系。 (1)写出化学式:A.,B.,C.。 (2)反应③中每生成lmolF,转移电子的数目为:。 (3)反应④的化学方程式为:。 (4)写出离子方程式分别为:反应②; 反应⑤。 (5)反应①中,每1.00g C与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程 式。。 7、下图是由短周期元素组成的物质之间的转化关系。其中,A的相对分子质量为144,反应①中生成C、D 物质的量之比为3 :1,D是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,F、G是气态非金属单质,K是一种常见的非极性有机溶剂,密度比水大。(某些生成物和反应条件已略去)
无机化学试题与答案
无机化学试题 一、选择题(20分,每题2分) 1.已知:298K时,反应 C(石墨)+O2(g)→CO2(g)⊿r H mΘ=-393.5kJ ·mol-1 CO(g)+1/2O2(g)→CO2(g) ⊿r HmΘ=-283.0kJ ·mol-1 则反应C(石墨)+ 1/2O2(g)→CO(g)的⊿r H mΘ等于( )。 A.110.5kJ·mol-1 B.- 110.5 kJ ·mol-1 C.-676.5 kJ·mol-1D.676.5 kJ ·mol-1 2.已知反应A(g)+2B(l) ? 4C(g)的平衡常数kθ=0.123,则反应4C(g)?A(g)+2B(l)的平衡常数为() A.0.123 B. -0.123 C.8.31 D. 6.47 3.根据下列反应:2Fe3++ Fe →3Fe2+ 2FeCl 3 + Cu →2FeCl 2 + CuCl 2 2KMnO 4 + 10FeSO 4 + 8H 2 SO 4 →2MnSO 4 + 5Fe 2 (SO) 3 + K 2 SO 4 + 8H 2 O 判断电极电势最大的电对是( ) A.MnO 4 -/Mn2+ B.Fe3+/Fe2+ C.Fe2+/Fe D.Cu2+/Cu 4.BCl3分子中,B以SP2杂化轨道成键,则该分子的空间构型是( ) A.三角形 B.平面三角形C.直线形 D.四面体 5.对于主量子数n=3的电子层,可以容纳的轨道数n2和电子数是( ) A.3和6 B.3和9 C.9和18 D.3和18 6.在配合物K3[C O C13(NO 2 )3]中,中心离子的电荷是( ) A. +5 B. +4 C.+3 D.+2 7.下列氧化物中,熔点最高的是( ) A. CaO B. MgO C.SO3 D. P2O5 8.原电池符号为: (-)Zn∣ZnS0 4(c 1 )‖Fe 2 (S0 4 ) 3 (c 2 ), FeS0 4 (c 3 )∣Pt(+)
