手性农药合成研究进展

手性农药合成研究进展
车超覃兆海*
摘要手性农药是农药化学中一个非常活跃的研究领域
不对称合成的研究进展
手性是一个非常重要的概念以及医药工业需求的
推动在农药研究中
但由于生产技术和使用成本等原因
但随着人们环保意识的增强
除了发展新的高效显然目前
外消旋体的拆分以及高立体选择性
手性农药的合成成为一个颇富挑战性的目标
一类是外消旋体的拆分
本文从这两方面综述了近年来这一领域的研究进展
优先结晶法酶及微生物的动力学拆分等方法
其中被拆分的对映体要略为过量
则该对映体便优先结晶
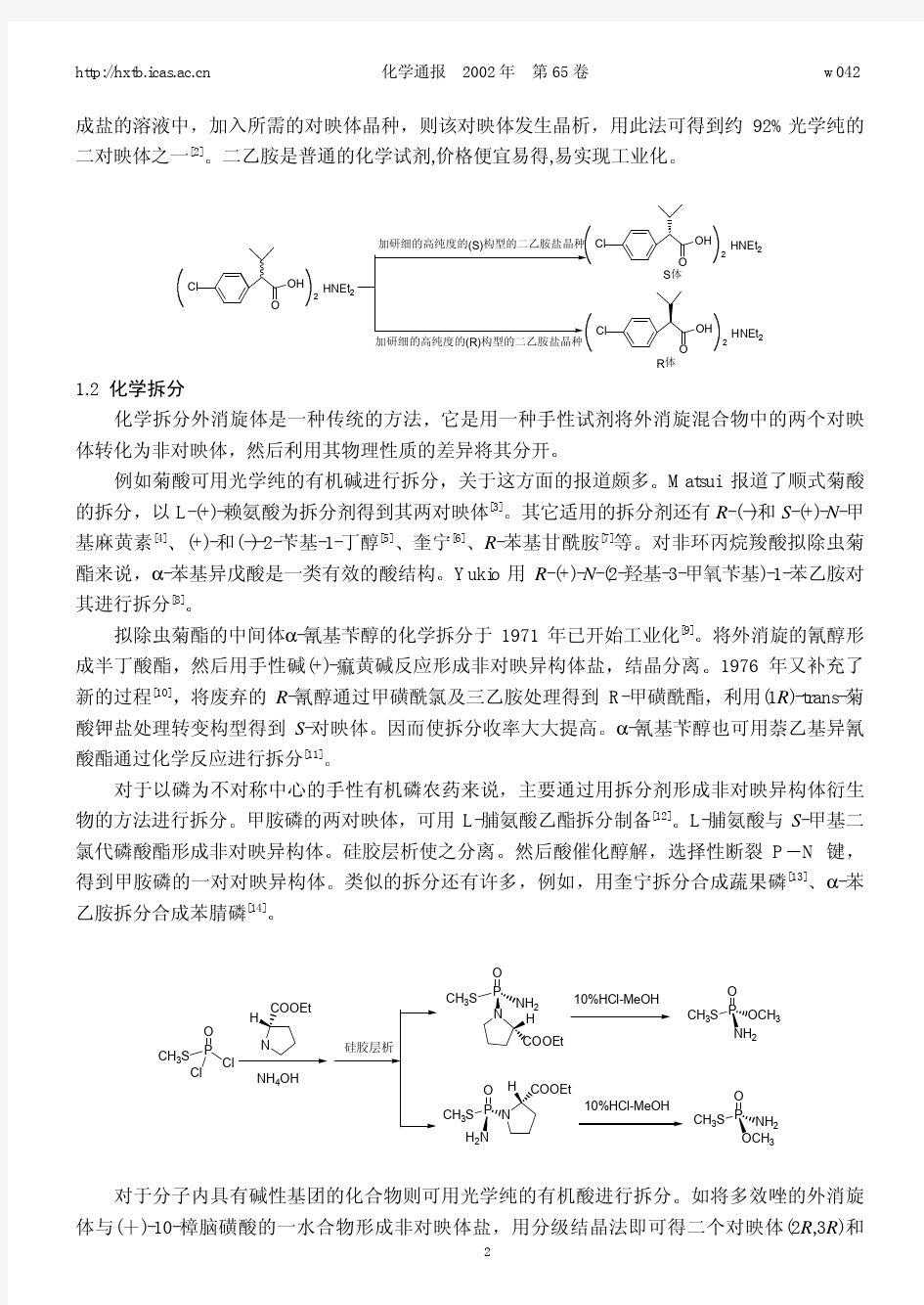
目前已工业化生产
其二分子外消旋体与一分子二乙胺车 超 25岁硕士生E-mail:ccinfanta@https://www.360docs.net/doc/a99791445.html, *联系人
成盐的溶液中则该对映体发生晶析
二乙胺是普通的化学试剂,价格便宜易得,易实现工业化
它是用一种手性试剂将外消旋混合物中的两个对映体转化为非对映体
例如菊酸可用光学纯的有机碱进行拆分Matsui报道了顺式菊酸的拆分其它适用的拆分剂还有R-(-)和S-(+)-N-甲
基麻黄素[4]奎宁[6]??·??·±?íé?è?á?a3y3???
?¥à′?μYukio用R-(+)-N-(2-羟基-3-甲氧苄基)-1-苯乙胺对
其进行拆分[8]
将外消旋的氰醇形成半丁酸酯黄碱反应形成非对映异构体盐1976年又补充了
新的过程[10]à?ó?(1R)-trans-菊
酸钾盐处理转变构型得到S-对映体α-氰基苄醇也可用萘乙基异氰酸酯通过化学反应进行拆分[11]
?÷òaí¨1yó?2e·??áD?3é·???ó3òì11ì??üéú
??μ?·?·¨??DD2e·??éó?L-脯氨酸乙酯拆分制备[12]
1è?o2???ê1??·?à?????D???á?P
μ?μ??×°·á×μ?ò?????ó3òì11ì?àyè?α-苯
乙胺拆分合成苯腈磷[14]
è????àD§?òμ?ía??Dy
ì?ó?(
(2S ,3S )[15]
μ?
μ?
(1S ,2R )
异构体可制得(4R ,5R )-噻螨酮
咪唑啉酮类除草剂灭草喹
也可用L-酒石酸进行成盐拆分
[17]
H 3C
2
OH
Cl
COS (4R,5R)
DL-赤式
2
(1S,2R)
Et 3N
25% NH 4OH
L-酒石酸/EtOH
1.3 利用酶及微生物的动力学拆分及外消旋化
酶或微生物能高效区别对映体
其原理是
而拆分获得两个光学活性产物
在酶催化水解中拆分率近于100
±?è2??′?
1988年Mitsuda 等[18]用Arthrobacter sp.脂酶处理
(
R -
体的醋酸酯被选择性水解的R -丙炔菊醇
将由酶反应所得的S -酯和R -醇的混合物与甲磺酰氯反
应随后进行水解
而S -醋酸酯则保持其立体构
型
OAc
O
OAc
OH
2CH 3
S
RS
CaCO 1995年Nishizawa 等[20]从Arthrobacter globiformis
克隆了酯酶基因
高立体选择性催化水解反式-菊酸乙酯
的
反式-(1R ,3R )菊酸在特丁基过氧化物的存在
下
溴化硼等溴化物再用酶催化拆分[21]
ê1???á2e·?2úéúá?·é??
?á1???ê?
的立体选择性水解
之后
而未被水
解的R -体通过加入三乙胺在
70
′ó′óìá??á?ê??ê
?è?è???¥??òaμ??D??ì?
ìá3?
2ú??1a?§′??è?a80%
产率可达90%
在离子交换树脂催化下生成外消旋的氰醇
发生对映体选择性酯交换反应而得到S 构型的氰醇乙酸酯
为
维持可逆平衡
RCHO
离子交换树脂
HO
CN
R
CN OH Lipase AcO
(±)
(S)
其中R=
O
etc.
对非环丙烷羧酸拟除虫菊酯来说关于它的酶拆分也有
报道
)-α-苯基异戊腈进行立体选择性水解,显示PNH S
专一性差
Cl
CONH 2
PAD S 专一性强
2
S
对于其它类农药前体的拆分也有报道
1987年
该水解在四氯化碳和脂酶的水溶液中进行大大提高了立
体选择性[25]
′ó2?·???ê????a??
??á?ò×μ?
可对反应起催化作用
被酶作用的底物比较稀薄费力,大部分的
研究尚处于小规模的阶段
使得酶催化反应的工业化成为可能酶催化丙炔菊醇的生产已实现工业化
以光学活性化合物为手性源的手性合成子法
不对称催化
2.1 手性合成子法
从易于取得的光学活性化合物两对映体出发这
一方法在手性农药的开发中显示了巨大的活力
一些容易得到的天然化合物均可作为这些手性合成子D/L 酒石酸
据报道
顺式菊酸可从(+)-3-蒈烯
[28]
·???±??áàà3y2Y?á?é′ó
S -乳酸出发,经化学反应合成[30]
?-
11Dí×a?ˉ
马拉硫磷的二个对映体
随这不对称碳的构型翻转而合成[31]
(S )-(+)-缬氨酸和亚硝酸
钠
得到构型保持的(S )-2-溴-3-甲基丁酸
在特定条件下
(95
仍得到构型保持的(S )-2-(4-三氟甲基苯胺)-3-
甲基丁酸
H 2NaNO 2HBr
1. KOH/MeOH
3. HCl
CF 3
CF 3
Cl
CCl 4
L-草铵膦的合成也可从天然氨基酸出发经几步反应得
到乙烯基甘氨酸的衍生物膦酸酯和其发生区域选择性
加成生成L-
草铵膦的衍生物
光学纯度为99.4%[34]
H3
2
2
L-蛋氨酸
L-谷氨酸
1
H2
23
P
O
H3C H
H31
23
H3
O CH
3
EtOH/H2O
H3
2
从(S)-α-羟基戊酸出发再将其与苯乙酮衍生物反应而生成酮缩醇
衍生物经柱层析分离而得(2R,4S)及(2S,4S)-丙环唑[35]
?′
′?μ???μ?oó?ù3yè¥?a??·?·¨?ú??ò?o?3éμ?ó|ó???éù
用D-
缬氨酸甲酯作为手性辅基
在其6
位发生立体有择的烷基化正丁基作用下完成的
得到L-草铵膦的酯和手性辅基D-缬氨酸甲酯L-草铵膦的酯进一步用HCl2-环氧丙烷处理得到L-
草铵膦
N
N
O
O
CH3
CH3
ClCH2CH2P(CH3)(O)OCH2CH(CH3)2
C4H9Li/THF/-78℃
O
CH3
CH3
3
HCl
C
NH2
2
CH3
D-Val-OCH3
3
H3
2
H3
(L)93.5%e.e.
Vladimir 通过曼尼希反应来高立体控制合成了丁苯吗啉[37]òyè?L-脯氨酸
的二级胺衍生物R-(-)-2-甲氧甲基吡咯为手性辅基
该亚胺在-78°C下和2,6-二甲基吗啉亚甲基四氯化铝的铵盐发生不对称曼尼希反应
使得立体选择性相当高e.e.值的丁苯吗啉前体
光学纯度为95.1%
1??ü?D??ì?ê?D?μ?S-2-甲基癸酸是通过乙基噁唑啉与正辛基碘反应制备 e.e.值达72
òò′?′ó1??£1¤òμ?ˉéú2úμ??é?üD??1è???óúê?D??¨?ù??ê??ùà?ó?μ?D§?ê
Aratani和Lowenthal分别用手征性西佛碱催化剂[39]和手性双噁唑啉的铜络合物[40]作为催化剂实现了烯烃的不对称环丙烷化和95
Danda等[41]采用组氨酸的环状二肽作催化剂催化氢氰酸对苯醚醛的不对称氢氰化反应R,R
e.e.值大于96??ò×óú??μ?
的天然氨基酸的二肽
和四乙氧基钛形成手性配合物
高立体选择性催化氢氰酸对醛的加成
它在工业上的应用取决于催化剂的
催化效率和回收利用的效率
2-戊二醇的合成用RuCl 2
[
S
R
HO
O 2HO
O
在众多合成L-草铵膦的方法中
等量的[(BND)RhCl]2催化剂前体和手性双膦配体形成的配合物对α-酰胺基丙烯酸进行不对称催化氢化
(R,R)-NORPHOS/[(NBD)RhCl]2表现出较好的催化活性
催化剂的回收率为
88%
P OH
H 3C
OH
O HN
O H 3C
HN
O
H 33Cl
-[(NBD)RhCl]2L*/H 2
L*=H 3O O
H 3C
H 3C
(S,S)-DIOP R-PROPHOS
(R,R)-NORPHOS
71.6%e.e.
83.2%e.e.
90.8%e.e.
O
在这方面最成功的例子可能是Novartis 公司开发的不对称催化氢化合成S -异丙甲草胺和R -
甲霜灵的技术用38g [Ir(COD)Cl]2催化剂前体和62g
手性二茂铁配体
e.e.值超过
80
已经超过了生物酶
Me-Duphos
作为手性配体
通过高选择性的催化氢化合成R-
甲霜灵104[44]
?é·??a???ˉ?1?-??·¨oí???üò?D???ò×ó|ó?μ???·¨
???-àíê??ò?ú??Dy?ˉo???μ?è¥??3?
??·?ê?D?μ?2-氧代戊酸用L-乳酸脱氢
酶可还原为(S)-2-羟基戊酸
[45]光学纯度在
99
2-戊二醇可作为丙环唑的手性合成原料还有通过发酵立体选择性获得两对映体的报道[47]
AVdagi?1995年报道了其化学酶法的不对称合成[49]
1a?§′??è?a
99%
1:1
OH
OH CH3
(S)
t -C4H9
PS. Species Lipase
Vinyl acetate
t- C4
99%e.e.(R)
.....t -C
4
Schulz等[50]对草铵膦微生物及Escherichia coli 的代谢研究发现
他们从该菌中分离出可将α-酮酸变为α-氨酸那样的转氨酶该酶与2-酮基戊二酸4-氨基丁酯氨基转移酶相一致
可得光学纯度为99.9%以上的S-草铵膦
HO C
O
CH 2CH 2C NH 2
HO C
O
CH 2CH 2CH 2COOH P
HO O CH 3
CH 2CH 2
C
COOH
O P
HO O CH 3
CH 2CH 2
NH 2
(S)-谷氨酸
戊二酸
(S)-草铵膦
氨基转移酶
(S)-谷氨酸氨基转移酶催化氨基转移为(S)-草铵膦
在氢氰酸对醛的加成反应中通常使用醇氰酶步骤简便
离析的醇氰酶催化氰离
子对各种芳族或脂肪族醛的对映选择性加成生成氰醇
在手性农药开发中的应用已取得了显
著的进展生物酶催化技术普遍具有立体选
择性高
将在手性农药的开发中显示广阔的应用前景
依赖于催化剂的活性随
着金属催化的蓬勃发展
可以预料
参 考 文 献
[1] 史 坚蒋木庚. 南京农业大学学报, 1992, 15 (4): 95~99.[2] 蒋木庚
王鸣华. 南京农业大学学报, 1990
3é??è?11: 1193~1195.
[7] Faigi F, Fogassy E, Nagy L. PCT.Int.Appl.WO: 9008126, 1990.[8] Yoneyoshi Y , Kudo J, Nishioka T. Eur.Pat.Appl. EP: 508307, 1992.[9] Roussel U. Pranch Patent: 2106503, 1971.[10] Roussel U. Pranch Patent: 2364191, 1976.
[11] Anderson R J, Adams K G, Henrick C A. J. Agric. Food Chem., 1985, 33 (3): 508~514.
[12] Miyazaki A, Nakamura T, Kawaradani M et al. J. Agric. Food Chem., 1988, 36 (4): 835~837.[13] Wu S Y, Casida J E. Phosphorus Sulfur Silicon Relat. Ele., 1994, 8: 129-131.[14] Puranand B S Batra, Lai G. Tetrahedron Lett., 1994, 35 (26): 4641~4644.[15] Balasubramanyan S. Pestic. Sci., 1984, 15: 296~302.
[16] Mitsuda S, Umemura T, Hirohara H. Appl. Microbiol. Biotechnol., 1988, 29: 310~314.[17] Nippon Sodn Co.Ltd. Jpn.kokai Tokkyo koho JP: 58110577, 1983.[18] Gastrock W H, Wepplo P J. US: 5683324, 1987.
[19] Hideo H, Masako N. Biosci. Biotechnol.Biochem., 1998, 62 (1): 1~9.
[20] Nishizawa M, Shimizu M, Ohkawa H et al. Appl. Environ. Microbiol., 1995, 61 (9): 3208~3215.[21] Suzukamo G, Fukao M. US: 4644080, 1987.
[22] Mitsuda S, Yamamoto H, Umemura T et al. Agric. Biol. Chem., 1990, 54: 2907~2912.
[23] Inagaki M, Hiratake J. J. Am. Chem. Soc., 1991, 113 (24): 9360~9361.
[24] Matsumoto S, Inoue A, Kucmagai K. Biosci. Biotech. Biochem., 1995, 59: 720~722.
[25] Samun K, Dahod P S. Biotech. Bioeng., 1987, 30: 995~999.
[26] Ho T L, Din Z L. Synth. Commun., 1982, 12 (4): 257~258.
[27] Torii S, Inokuchi T. J. Org. Chem., 1983, 48 (12): 1944~1951.
[28] Naik R H, Kulkarni G H. Indian J. Chem. Sect. Y B, 1983, 22B (9): 859~861.
[29] Yadav J S, Mysorekar S R. Tetrahedron, 1989, 45 (23): 7353~7360.
[30] Sakata G, Makiao K, Morimoto K. Nippon Noyaku Gakkaishi, 1985, 10 (
手性药物拆分的研究进展
手性药物拆分的研究进展 许多药物具有光学活性(opitical activeity)。一般显示光学活性的药物分子,其立体结构必定是手性(chirality)的,即具有不对称性。手性是指其分子立体结构和它的镜像彼此不能重合。互为镜像关系而又不能重合的一对分子结构称为对映体(enantiomer)。虽然对映异构体药物的理化性质基本相同,但由于药物分子所作用的受体或靶位是由氨基酸、核苷、膜等组成的手性蛋白质和核酸大分子等,后者对与之结合的药物分子的空间立体构型有一定的要求。因此,对映异构体在动物体内往往呈现出药效学和药动学方面的差异。鉴于此,美国食品药品监督管理局规定,今后研制具有不对称中心的药物,必须给出手性拆分结果,欧盟也提出了相应的要求。因此,手性拆分已成为药理学研究和制药工业迫切需要解决的问题。 目前,利用酶法、超临界流体色谱(SFC)法、化学法、高效液相色谱(HPLC)法、气相色谱(GC)法、毛细管电泳(capillary electrophoreisis,CE)法和分子烙印法拆分对映体,已成为新药研究和分析化学领域的重要课题。笔者在本文综述了近年来利用上述方法拆分手性药物的研究进展。 1酶法 酶的活性中心是一个不对称结构,这种结构有利于识别消旋体。在一定条件下,酶只能催化消旋体中的一个对映体发生反应而成为不同的化合物,从而使两个对映体分开。该法拆分手性药物已有较久的历史,反应产物的对映过剩百分率可达100%。酶催化的反应大多在温和的条件下进行,温度通常在0~50℃,pH 值接近7.0。由于酶无毒、易降解、不会造成环境污染,适于大规模生产。酶固定化技术、多相反应器等新技术的日趋成熟,大大促进了酶拆分技术的发展。脂肪酶、酯酶、蛋白酶、转氨酶等多种酶已用于外消旋体的拆分。脂肪酶是最早用于手性药物拆分的一类酶,是一类特殊的酯键水解酶,具有高度的选择性和立体专一性,反应条件温和,副反应少,适用于催化非水相递质中的化学反应,在B 一受体阻滞药、非甾体类抗炎药和其他多种药物的手性拆分中都有广泛的应用。意大利的Batlistel等用固定于载体Amberlite AD-7上的脂肪酶对萘普生的乙氧基乙酯进行酶法水解拆分,对温度、底物浓度和产物抑制等进行了研究,最后使用500 mL的柱式反应器,在连续进行了1200h的反应后,得到了l8kg的光学纯S-萘普生,且酶活性几乎无损失。另外,酯酶具有很高的工业价值,其应用前景也极为广阔。Jiaxin等利用pseudomaonas cepacia脂肪酶拆分了一类酰基取代的1.环己烯衍生物,通过酶催化酯交换反应,得到产率较高的光学纯化合物,且提供了反应过程监测方法。这种方法可推广到该类化合物系列衍生物的合成与拆分。 2 SFC法 根据手性选择剂种类不同,该分离方式主要包括氨基酸和酰氨类手性固定相、Prikle型手性固定相、环糊精型键合固定相如聚甲基异丁烯酯等。由于SFC 法尚处于发展阶段,各种参(如温度、压力、流动相的组成和密度等) 对分离度的影响机制还未完全清楚。SFC法具有简单、高效、易于变换操作条件等优点,已成为与HPLC法和GC法互补的拆分方法,因其具有独特的优越性,应用前景极为广阔。Nozal等用Chiralpak AD柱和Chiralcel OD柱在SFC条件下拆分了驱肠蠕虫药阿苯唑亚砜化合物,并研究了甲醇、乙醇、乙丙醇及乙腈等有机溶剂对立体构型的影响。结果表明,在以Chiralpak AD柱为固定相时,用2丙醇可以获得最好的拆分效果;而在Chiralcel OD柱上用甲醇效果最好。
隐身材料的研究进展及存在问题
隐身斗篷的研究进展及存在问题 摘要:隐身斗篷,由硅纳米材料制造而成,利用该特殊材料折射或吸收大部分光线,从而达到隐形的目的。本文主要总结归纳现如今应用于隐身斗篷的各种主要材料,详细论述了基于超材料特殊电磁特性的隐身技术,简单介绍部分材料应用原理。 关键词:影身斗篷,超材料,限元分析软件,均匀介质 1. 隐身斗篷的应用前景 隐形斗篷我其实是在电影Harry Potter 中第一次知道,它常被哈利拿来干一些从霍格华兹魔法学校里偷跑出来如此的事情。现实中科学家们也一直在研究它。在不远的将来,隐身斗篷将会真的存在于现实世界中了。而且隐身斗篷的应用前景非常广。隐身技术在外科手术,军事航空等多个领域中获得广泛的应用。例如, “地震斗篷”——能够让冲击波、暴风浪或者海啸在所遮蔽的物体面前变成“瞎子”,进而达到保护建筑物的目的。同时为提高战场生存能力, 隐身技术越来越多地应用于军用装备上。随着军用探测技术的不断进步, 对军用装备隐身性能的要求不断提高, 传统的隐身技术已经不能满足要求。 2. 隐身材料及其隐身原理 2.1 超材料 众所周知,介电常数和磁导率是用于描述物质电磁特性的基本物理量,决定着电磁波在物质中的传播特性。迄今为止,自然界中天然物质的介电常数和磁导率均大于或等于1。2000年,Smith 等人利用金属铜的开环共振器和导线组成2 维周期性结构,首次在实验室制造出微波频段具有负介电常数和负磁导率的介质材料,引起科学界的轰动。随后,双负材料、单负材料、手性材料、理想磁导体和理想电导体等材料成为科学研究的热点,并将这些材料统称为超材料(metamaterials)。由于超材料具有一系列特殊的电磁特性,因而具有广阔的应用前景。 2.1.1超材料椭圆柱电磁斗篷 文献[1] 利用有限元分析软件Comsol Multip hysics 分析了超材料介电常数偏差、磁导率偏差 和损耗对电磁斗篷场分布的影响,并讨论了在电 磁斗篷内放置不同电磁特性的物体后斗篷外电 场分布的变化。 图1 为TE 波辐射下超材料椭圆柱电磁斗篷 的计算模型。超材料椭圆柱是沿z 轴放置的无限 长空心柱,其横截面为xOy 平面,椭圆中心为坐标 原点,内外径短轴分别为a 和b ,长轴分别为ka 和 kb ,其中, k 为长轴与短轴之比,仿真时取k = 6 , a =0. 1 m ,b = 0. 2 m 。在图1 所示的左边完全匹配 层( PML) 的内表面施加沿z 轴方向电流,激励起 沿x 轴方向(水平) 传播的频率为2 GHz 的TE 波。计算区域四周是PML 吸收层,斗篷内外均为空气。 通过文献[1]计算可知,超材料介电常数和磁导率空间分布如图2所示。图2 (a) 为介电常数分量在xOy 平面上的空间分布,由图可以看出,在x = 0 或y = 0 的平面上 xx 最小,同时在两图1 TE 波辐射下超材料椭圆柱电磁斗篷的计
手性药物的合成与拆分的研究进展
手性药物的合成与拆分的研究进展 手性是自然界的一种普遍现象,构成生物体的基本物质如氨基酸、糖类等都是手性分子。手性化合物具有两个异构体,它们如同实物和镜像的关系,通常叫做对映异构体。对映异构体很像人的左右手,它们看起来非常相似,但是不完全相同。 目前市场上销售的化学药物中,具有光学活性的手性药物约占全部化学药40% } 50%,药物的手性不同会表现出截然不同的生物、药理、毒理作用,服用对映体纯的手性药物不仅可以排除由于无效(不良)对映体所引起的毒副作用,还能减少药剂量和人体对无效对映体的代谢负担,对药物动力学及剂量有更好的控制,提高药物的专一性,因而具有十分广阔的市场前景和巨大的经济价值[Dl 1由天然产物中提取 天然产物的提取及半合成就是从天然存在的光活性化合物中获得,或以价廉易得的天然手性化合物氨基酸、菇烯、糖类、生物碱等为原料,经构型保留、构型转化或手性转换等反应,方便地合成新的手性化合物。如用乳酸可合成(R)一苯氧基丙酸类除草剂[}z}。天然存在的手性化合物通常只含一种对映体用它们作起始原料,经化学改造制备其它手性化合物,无需经过繁复的对映体拆分,利用其原有的手性中心,在分子的适当部位引进新的活性功能团,可以制成许多有用的手性化合物。 2手性合成 手性合成也叫不对称合成。一般是指在反应中生成的对映体或非对映体的量是不相等的。手J险合成是在催化剂和酶的作用下合成得到过量的单一对映体的方法。如利用氧化还原酶、合成酶、裂解酶等直接从前体化合物不对称合成各种结构复杂的手性醇、酮、醛、胺、酸、酉旨、酞胺等衍生物,以及各种含硫、磷、氮及金属的手性化合物和药物,其优点在于反应条件温和、选择性强、不良反应少、产率高、产品光学纯度高、无污染。 手性合成是获得手性药物最直接的方法。手J险合成包括从手性分子出发来合成目标手性产物或在手性底物的作用下将潜在手性化合物转变为含一个或多个手性中心的化合物,手性底物可以作为试剂、催化剂及助剂在不对称合成中使用。如Yamad等和Snamprogetti等在微生物中发现了能催化产生N-氨甲酞基一D-氨基酸的海因酶( Hy-dantoinase)。海因酶用于工业生产D一苯甘氨酸和D一对轻基苯甘氨酸。D一苯甘氨酸和D一对轻基苯甘氨酸是生产重要的临床用药半合成内酞胺抗生素(氨节青霉素、轻氨节青霉素、氨节头炮霉素、轻氨节头炮霉素)的重要侧链,目前国际上每年的总产量接近SOOOto 3外消旋化合物的拆分 外消旋拆分法是在手性助剂的作用下,将外消旋体拆分为纯对映体。外消旋体拆分法是一种经典的分离方法,在工业生产中己有100多年的历史,目前仍是获得手性物质的有效方法之一。拆分是用物理化学或生物方法等将外消旋体分离成单一异构体,外消旋体拆分法又可分为结晶拆分法;化学拆分法;生物拆分法;色谱拆分法;膜拆分和泳技术。 3. 1结晶拆分法 3.1.1直接结晶法 结晶法是利用化合物的旋光异构体在一定的温度下,较外消旋体的溶解度小,易拆分的性质,在外消旋体的溶液中加入异构体中的一种(或两种)旋光异构体作为晶种,诱导与晶种相同的异构体优先(分别)析出,从而达到分离的目的。在。一甲基一L一多巴的工业生产中就是使两种对映体同时在溶液中结晶,而母液仍是外消旋的,把外消旋混合物的过饱和溶液通过含有各个对应晶种的两个结晶槽而达到拆分的目的[3]。结晶法的拆分效果一般都不太理想,但优点是不需要外加手性拆分试剂。若严格控制反应条件也能获得较纯的单一对应体。 3. 1. 2非对映体结晶法 非对映体结晶法适用于拆分外消旋化合物,利用天然旋光纯手性拆分试剂与消旋化合物
手性表面活性剂研究进展
手性表面活性剂的研究进展 摘要:简介手性表面活性剂的分类、结构,重点综述胆汁盐类、皂苷类手性表面活性剂的研究与应用,以及氨基酸型、季铵盐型、烷基糖苷型和松香型手性表面活性剂的合成与研究现状。 关键词:手性表面活性剂;进展;手性分离;立体合成 手性表面活性剂(chiral surfactant)是指一类性质上具有一般表面活性剂特性——具有油水两亲性,结构上含有手性中心的手性分子。由于分子结构中有手性中心的存在,该类表面活性剂具有良好的区域选择性、不对称催化能力和手性识别能力。尤其是在特定的手性拆分中的手性识别能力,使得手性两亲分子在立体选择性合成和手性药物分离领域逐渐成为一大热点。此外,近年来,在无机材料科学方面,利用手性表面活性剂合成无机介孔材料的研究也有迅速的进展。 随着医药科学和材料科学等领域的发展,手性表面活性剂由于其独特的分子结构特性而具有的不可替代性使得它的需求日益增加,因而引起了化学、材料等学科对手性表面活性剂的普遍关注。 目前获得手性两亲分子的途径还比较少,而且只局限于应用已有的手性源来合成,因此手性表面活性剂的类型并不多。主要可从来源分为天然手性表面活性剂和合成手性表面活性剂两大类。 1.天然手性表面活性剂 天然手性表面活性剂可细分为胆汁盐类和皂苷类两类。 1.1胆汁盐(Bile salts)类 胆汁(酸)盐类手性表面活性剂属于阴离子表面活性剂,具有光学活性,可用于手性对映体的拆分,最早由Terabe等[1]在1989年应用在几种氨基酸和药物的胶束电动色谱(MEKC 法)手性分离中。其基本结构式如图1,主体结构由四个饱和稠环构成。表1列举了几种常见的胆汁盐类手性表面活性剂。 图1 胆汁盐类结构式 表1 几种常见的胆汁盐类手性表面活性剂
手性超材料研究进展
手性超材料研究进展 钟柯松 2111409023 物理 1. 引言 超材料是有特殊电磁性质的人造结构性材料,其中一个典型的性质就是负折射率。第一种负折射率材料1两个部分组成:一个是连续的金属线,它来实现负介电常数2,另一个是开环谐振器,来实现负的磁导率3。在同时实现复介电常数和负磁导率的时候,负折射率就是实现了。后来,人们大多数以这个原则4-5来设计负折射率材料。虽然负磁导率在微波段很容易实现,但是在光频区域却极其困难7,8。与此同时,Pendry9,Tretyakov10,11和Monzon12等人从理论上提出了另一种利用手性实现负折射率的途径。而手性材料层作为完美透镜也从理论上实现了9-13。在这些报告中,Pendry提出了一种3D螺旋线结构来实现负折射率的手性超材料9。Tretyakov等人则在理论上研究了在手性和偶极粒子手性复合材料中得到负折射率的可能性11。理论表明,负折射率是可以在以3D螺旋对称为晶格的金属球超材料中可以得到14。同时也表明,周期上的手性散射是3D和各向同性负折射率的原因15。实际上,Bose曾经在1898年利用螺旋结构研究了平面偏振电磁波的旋转16。Lindman也是研究微波段人造手性介质的先驱17。最近,Zhang等人在实验上实现了一个3D手性超材料在THz波段的负折射率18。Wang等人则在微波段同时实现了3D手性超材料的负折射率和巨大的光学活性和圆二色性19,20。但是,这些提到的3D手性超材料都很难构建。同时,平面手型超材料显示了光学活性也被报道了21-24。这里需要指出的是,平面手性结构是正真的3D手性结构是不同的。Arnaut和Davis第一次把平面手性结构引入到了电磁波的研究中25,26。一个结构如果被定义为手性结构,那么它应该是在任何平面是没有镜面对称的,然而,一个平面结构被认为是手性的,则它是不能和它在该平面上的镜像重叠的,除非它不在这个平面上。实际上,一个平面手性结构还是和镜像镜面对称的。在垂直入射的情况下,在光传播方向上镜面对称的结构是没有光学活性的27。除非在这个结构上增加衬底来打破传播方向上的镜面对称,这样光学活性就能得到了22-24。然而,手性在这些结构是非常微弱的。后来,Rogacheva等人进一步地提出了双层的手性结构,展现出了很强的光学活性28。这个两层的花环状的平面金属层相互平面扭和在两个平面中,它们也不像3D手性原胞一样连接在一起18-20,二是通过电磁场来相互耦合。它的光学活性强到了整个结构都显示出了负折射率。在这个开创性的工作下,一些不同的双层手性结构,从微波段到近红外波段被相继的提出。如双层花环结构29,30,双层十字线结构31,32,金属切线对33,卍字结构34,四个‘U’型结构35-37,互补性手性结构38等等。另外,多层的平面手性结构也被提了出来29,39。它表明,在构建体手性超材料时,邻近原胞之间的耦合效应也应该考虑在内。由于存在这个耦合效应,体手性超材料和单原胞手性超材料的性质存在差异39。当手性超材料在负折射率带中工作是,品质因素(FOM)来评估它的损耗级别40。FOM被定义为折射率实部和虚部比值的绝对值。在一个波长对应的介质中波振幅衰竭为exp(-2π/FOM)。为了得到高的FOM,一种复合的手性超材料在最近提了出来41。另外,可调节的手性超材料也有报道42。 基于传输和反射参数的有效折射率的提取是一种在表征设计的超材料是的方便有用的手段43-47。随着手性超材料研究的进展,负折射率用其他提取方法中也得到了18,29,48,49。Zhao 等人总结了这些提取方法,简练出了几个简单的公式,这在手性超材料的研究中是非常有用的50。非互易式传输在信息处理中起到了至关重要的作用,点偶极子就是一个典型的例子,它在电
茚酮类化合物的研究进展
2010年第30卷 有 机 化 学 V ol. 30, 2010 * E-mail: jlliu@https://www.360docs.net/doc/a99791445.html, Received November 19, 2009; revised December 25, 3009; accepted February 1, 2010. ·综述与进展· 茚酮类化合物的研究进展 段义杰 刘建利* 王翠玲 (西北大学生命科学学院 西部资源生物与现代生物技术教育部重点实验室 西安 710069) 摘要 茚环结构存在于天然产物、合成药物、农药等分子中. 茚酮作为原料用于生物活性化合物的合成具有很强的工业应用前景. 同时在有机发光材料、染料合成方面也有应用, 还作为可光除去的有机保护基团. 对此类化合物的合成、应用进行了总结, 以促进相关的研究进展. 关键词 茚酮; 合成; 应用 Progress in the Studies of Indanones Duan, Yijie Liu, Jianli * Wang, Cuiling (Key Laboratory of Resource Biology and Biotechnology in Western China , Ministry of Education , School of Life Science , Northwest University , Xi'an 710069) Abstract Indan ring frameworks are ubiquitous in a large number of natural products, bioactive and phar-maceutically interesting molecules. Indanones therefore are very useful molecules as starting building blocks for the synthesis of biologically active compounds and thus are of tremendous industrial interest. It is also very useful in organic light-emitting devices, dyes and photoremovable protecting groups. The synthetic methods and application of this kind of molecules are reviewed in this paper. Keywords indanone; synthesis; application 茚酮的基本结构有1-茚酮、2-茚酮、1,2-茚二酮、1,3-茚二酮、茚三酮(Scheme 1). 其中茚三酮(Ninhydrine)非常有名, 又称水合茚三酮、水合茚满三酮. 茚酮结构广泛存在于天然产物、药物、农药等生物活性分子中, 也是有机发光、光致变色、染料等材料中的结构单元. 因此此类化合物具有广泛的应用前景[1]. 1 天然存在的茚酮及其衍生物 天然存在的茚酮化合物有 100多个, 其中重要的化合物有pterosin P (1), mukagolactone (2)和monachosorin A (3). 这些及相关结构的分子显示出多种生物活性, 例如平滑肌松弛活性、环氧化酶抑制活性等. 从海洋藻青菌中分离的化合物4显示抑制人血管内皮因子生长的 Scheme 1 活性, 在肿瘤血管生成调节方面具有应用前景[2] (Scheme 2). 一个新的茚酮类化合物2,6-dimethyl-1-oxo-4-indan- ecarboxylic acid (5)最近被从植物中分离出来, 虽然它的结构中有一个手性碳, 但该化合物不显示旋光性, 可能
手性药物
我报告的题目是手性技术与手性药物。 首先让我和大家一起来回忆一下药物给人类带来空前灾难的反应停事件。1953年,联邦德国Chemie制药公司研究了一种名为“沙利度胺”的新药,该药对孕妇的妊娠呕吐疗效极佳,Chemie公司在1957年将该药以商品名“反应停”正式推向市场。两年以后,欧洲的医生开始发现,本地区畸形婴儿的出生率明显上升,此后又陆续发现12000多名因母亲服用反应停而导致的海豹婴儿!这一事件成为医学史上的一大悲剧。 后来研究发现,反应停是一种手性药物,是由分子组成完全相同仅立体结构不同的左旋体和右旋体混合组成的,其中右旋体是很好的镇静剂,而左旋体则有强烈的致畸作用。 到底什么是手性药物?用什么技术或方法能够分别获得左旋体和右旋体来进行研究和安全有效地使用呢? 这就是今天我要报告的主题——手性技术和手性药物。 要阐明这一主题,首先我们要认识什么是手性药物。手性药物分子有一个共同的特点就是存在着互为实物和镜像关系两个立体异构体,一个叫左旋体,另一个叫右旋体。就好比人的左手和右手,相似而不相同,不能叠合。 目前临床上常用的1850多种药物中有1045多种是手性药物,高达62%。像大家所熟知的紫杉醇、青蒿素、沙丁胺醇和萘普生都是手性药物。 手性是宇宙的普遍特征。早在一百多年前,著名的微生物学家和化学家巴斯德就英明地预见“宇宙是非对称的……,所有生物体在其结构和外部形态上,究其本源都是宇宙非对称性的产物”。 因此,科学家推断,由于长期宇宙作用力的不对称性,使生物体中蕴藏着大量手性分子,如氨基酸、糖、DNA和蛋白质等。绝大多数的昆虫信息素都是手性分子,人们利用它来诱杀害虫。很多农药也是手性分子,比如除草剂Metolachlor,其左旋体具有非常高的除草性能,而右旋体不仅没有除草作用,而且具有致突变作用,每年有2000多万吨投放市场,其中1000多万吨是环境污染物。Metolachlor自1997年起以单旋体上市,10年间少向环境投放约1亿吨化学废物。研究还发现,单旋体手性材料可以作为隐形材料用于军事领域。 左旋体和右旋体在生物体内的作用为什么有这么大的差别呢?由于生物体内的酶和受体都是手性的,它们对药物具有精确的手性识别能力,只有匹配时才能发挥药效,误配就不能产生预期药效。正如“一把钥匙开一把锁!”因此,1992年美国FDA规定,新的手性药物上市之前必须分别对左旋体和右旋体进行药效和毒性试验,否则不允许上市。2006年1月,我国SFDA也出台了相应的政策法规。 怎样才能将非手性原料转变成手性单旋体呢?从化学角度而言,有手性拆分和手性合成两种方法。经典化学反应只能得到等量左旋体和右旋体的混合物,手性拆分是用手性拆分试剂将混旋体拆分成左旋体和右旋体,其中只有一半是目标产物,另一半是副产物,而且需要消耗大量昂贵的手性拆分试剂。化学家一直在探索,是否有更经济的方法,将非手性原料直接转化为手性单旋体呢? 上世纪60年代初,科学家们开始研究在极少量的手性催化剂作用下获得大量的单旋体,这就是手性合成
含氟农药、含杂环农药和手性农药将是未来农药发展方向
含氟农药、含杂环农药和手性农药将是未来农药发展方向 2015年6月10-12日,“第四届农药行业知识产权与科技创新高峰论坛”在中科院上海有机化学研究所顺利召开。在会议上,来自于中国化工信息中心的胡笑形教授作了一篇题为《2015至2019年专利过期农药的剖析与开发利用》的报告。在这份报告中,胡教授通过对2015~2019年专利过期农药的结构特性分析,提出未来农药将向含杂环、含氟及手性农药等方向发展。 胡教授指出,2015~2019年专利过期农药品种有28个,其中杀虫剂5个,杀菌剂12个,除草剂10个及安全剂1个。在这27个农药品种(不含安全剂)中,含杂环农药高达20个,占74%。含氟农药有14个,占51.9%。含氟、含杂环的多特性农药有10个,占37%。另外,胡教授也提到近年来手性农药得到了较大发展,27个农药中有4个手性农药,占14.8%。而集3种特性(杂环、含氟和手性)于一体的情况较少,仅有2个,分别为苯噻菌胺和噁唑酰草胺。 表一:2015~2019年专利过期农药品种 活性成分结构特性类别研发公司吲唑磺菌胺(Amisulbrom) 含杂环、含氟杀菌剂日产化学 苯噻菌胺(Benthiavalicard)含杂环、含氟、手性杀菌剂日本组合化学环氟菌胺(Cyflufenamid)含氟杀菌剂日本曹达 胺苯吡菌酮(Fenpyrazamine)含杂环杀菌剂住友化学氟吡菌胺(Fluopicolide)含杂环、含氟杀菌剂拜耳 氟嘧菌酯(Fluoxastrobin)含杂环、含氟杀菌剂拜耳精甲霜灵(Metalaxyl-M)手性杀菌剂先正达苯菌酮(Metrafenone)/ 杀菌剂巴斯夫 吡噻菌胺(Penthiopyrad)含杂环、含氟杀菌剂三井化学 丙硫菌唑(Prothioconazole)含杂环杀菌剂拜耳 吡唑醚菌酯(Pyraclostrobin)含杂环杀菌剂巴斯夫霜霉威(Valifenalate)/ 杀菌剂意赛格 四唑酰草胺(Fentrazamide)含杂环除草剂拜耳 氟吡磺隆(Flucetosulfuron)含杂环、含氟除草剂LG生命科学甲酰胺磺隆(Foramsulfuron)含杂环除草剂拜耳噁唑酰草胺(Metamifop)含杂环、含氟、手性除草剂东部韩农 嘧苯胺磺隆(Orthosulfamuron)含杂环除草剂意赛格 五氟磺草胺(Penoxsulam)含杂环、含氟除草剂陶氏益农唑啉草酯(Pinoxaden)含杂环除草剂先正达环磺酮(Tembotrione)含氟除草剂拜耳 噻酮磺隆(Thiencarbazone)含杂环除草剂除草剂拜耳苯唑草酮(Topramezone)含杂环除草剂巴斯夫
手性药物拆分技术的研究进展
手性药物拆分技术的研究进展 摘要:简要阐述了手性药物的世界销售市场。综述了目前实验室和工业生产领域手性药物的拆分方法,包括:结晶拆分法,化学拆分法,动力学拆分法,生物拆分法,色谱拆分法,手性萃取拆分法和膜拆分法等,并简要介绍了每种方法的应用情况及优缺点。 关键词:手性药物; 外消旋体; 手性拆分 自然界存在各种各样的手性现象,比如蛋白质、氨基酸、多糖、核酸、酶等生命活动重要基础物质,都是手性的。据统计,在研发的1200种新药中,有820种是手性的,占世界新药开发的68%以上[ 1 ]。美国FDA在1992年发布了手性药物指导原则,该原则要求各医药企业今后在新药研发上,必须明确量化每一对映异构体的药效作用和毒理作用,并且当两种异构体有明显不同作用时,必须以光学纯的药品形式上市。随后欧共体和日本也采取了相应的措施。此项措施大大促进了手性药物拆分技术的发展,手性药物的研究与开发,已经成为当今世界新药发展的重要方向和热点领域[ 2 ]。当前大多数药物是以外消旋体的形式出现,即药物里含有等量的左右两种对映体。但是近年来单一对映体药物市场每年以20%以上的速度增长。1993年全球100个热销药中,光学纯的药物仅仅占20%;然而到了1997年, 100个中就有50个是以单一对映体形式存在,手性药物已占到世界医药市场的半壁江山。在1993年,手性药物的全球销售额只有330亿美元;到了1996年,手性药物世界市场已增长到730亿美元; 2002年总销售额更是达到1720亿美元, 2010年可望超过2500亿美元[ 3~5 ]。广阔的应用前景和巨大的市场需求触发了更多的医药企业和学者探索更新更高效地获得单一手性化合物的方法。 不同的立体异构体在体内的药效学、药代动力学和毒理学性质不同,并表现出不同的治疗作用与不良反应,研究与开发手性药物是当今药物化学的发展趋势。随着合理药物设计思想的日益深入,化合物结构趋于复杂,手性药物出现的可能性越来越大;另一方面,用单一异构体代替临床应用的混旋体药物,实现手性转换,也是开发新药的途径之一[ 1 - 3 ]。1985~2004年上市的550个新化学合成药物中,有313个药物具有手性中心,其中以单一异构体上市的手性药物为167个,手性药物数量呈逐年上升趋势; 2005年世界药物的销售总额为6 020亿美元,而手性药物的销售总额为 2 250亿美元,占全球制药市场销售总额的37% , 2010年可望超过 5 000亿美元[ 4 - 6 ]。总之, 手性药物大量增长的时代已经来临,手性药物制备技术的发展亦日趋完善,这为以制备和生产手性药物为主要内涵的手性工业的建立和发展奠定了基础。 手性药物的制备技术由化学控制技术和生物控制技术两部分组成。手性药物的化学控制技术可分为普通化学合成、不对称合成和手性源合成3类;手性药物的生物控制技术包括天然物的提取分离技术和控制酶代谢技术。以前手性化合物为原料,经普通化学合成可得到外消旋体,再将外消旋体拆分制备手性药物中间体或手性药物,这是工业生产手性药物的主要方法。1985~2004年上市的58个含有一个手性中心的手性药物中,有27个手性药物是通过手性拆分法生产的[ 4 ]。 1结晶法拆分 结晶法拆分包括直接结晶法拆分( direct crys ta llization resolution )和非对映异构体拆分( dias te reom er crys tallization resolution) ,分别适用于外消旋混合物( conglom e rate)和外消旋化合物( racem ic compound)的拆分。在一种外消旋混合物的过饱和溶液中,直接加入某一对映体的晶种,即可得到一定量的该对映体,这种直接结晶的拆分方法仅适用于外消旋混合物,其应用几率不到10%。外消旋化合物较为常见,大约占所有外消旋体的90%。通过与非手性的酸或碱成盐可以使部分外消旋化合物转变为外消旋混合物,扩大直接结晶法拆分的应用范围。 对于外消旋化合物,可采用与另一手性化合物(即拆分剂, reso lving agent)形成非对映异
手性农药发展趋势
农药发展两大新趋势——手性农药和水分散粒剂 人的左、右手貌似相同,却不能重叠,而是互为镜像,这是最简单意义上的“手性”。化学物质的三维结构因碳原子连接的4个原子或基团在空间排布上可以以两种形式形成不同结构的对映体,而具有手性。手性是自然界中最重要的属性之一,同一化合物的两个对映体之间不仅具有不同的光学性质和物理化学性质,甚至可能具有截然不同的生物活性。最典型的例子是20世纪50年代末期发生在欧洲的“反应停”药害事件,孕妇因服用酞胺哌啶酮(Thalidomide,俗称反应停,具镇痛功效)而导致海豹畸形儿的惨剧。后来,研究人员通过对该药物进行拆分,发现这种化合物的S型对映体具有致畸作用,而只有R型对映体具有镇痛作用。 同样,农药也表现强烈的立体识别方面作用。有些化合物一种对映体是高效的杀虫剂、杀螨剂、杀菌剂和除草剂,而另一种却是低效的,甚至无效或相反。例如,芳氧基丙酸类除草剂Fluazi-fop-butyl,只有R型是有效的;而除草剂Metolachlor的四种异构体中只有两种异构体有活性,另外两种异构体则无活性。杀虫剂Asana的4个对映体中,只有一个是强力杀虫剂,另三个则对植物有毒。杀菌剂Paclobutrazol,RR型有高杀菌作用,低植物生长控制作用,而SS型有低杀菌作用、高植物生长控制作用。 在意识到必须注意药物不同的构型之后,手性药物的开发逐渐引起了人们的注意。同时,由于单一手性农药具有药效高、用药量省、三废少、对作物和环境生态更安全、相对成本更低和极具市场竞争力等优点,手性农药已成为21世纪新农药开发的热点。农药行政管理部门出于对环境保护的考虑,也趋向于只选择所需异构体,只认可单一光活性异构体注册,不允许把无效体施放到环境中去污染环境,迫使生产商生产光学异构体的有效体。 过去,人们只是把价值昂贵的农药(如菊酯类),采取拆分开不同的光学异构体,并把无效体转化为有效体;而迄今,世界上已有的650种农药中,已有173种已商品化的手性农药,另有22种手性农药正在开发之中。其中,年销售额超过1亿美元的有30余种,超过2500万美元的有60余种;高活性对映体成分的手性农药年销售额超过100亿美元,纯手性对映体手性农药年销售额接近30亿,手性农药占全球市场的35%。目前,手性农药主要有以下化合物:拟除虫菊酯类、有机磷类杀虫剂;三唑类、酰胺类杀菌剂;芳基苯氧基丙酸酯类、咪唑啉酮类、环己二酮类、酰胺类除草剂等。
手性药物的检测方法研究进展
2 019年第3期分析仪器Analy tical InstrumentationNo.3May .2019 1 基金项目:江苏省高等学校自然科学研究项目(18KJD150003 )。檱檱檱檱檱檱檱檱檱檱檱檱檱檱檱檱殗 殗 殗 殗 综 述 手性药物的检测方法研究进展 李周敏* 曾 韬 姚开安 李心爱 宣 婕 (南京大学金陵学院,南京210089 )摘 要:对手性药物的分析一直是药学领域的一个研究热点,近年来各种检测新方法也不断应用于手性药物的分析中。本文主要介绍了近十年来手性药物的检测方法。比较目前已有的手性药物检测方法的优势与不足,并对手性药物检测方法的发展趋势进行了展望。 关键词:手性药物 对映异构体 手性检测 综述DOI:10.3969/j .issn.1001-232x.2019.03.001Research on progress in detection methods of chiral drugs.Li Zhoumin*,Zeng Tao,Yao Kaian,Li Xi'nai,Xuan Jie(Nanjing University Jingling College,Nanjing2 10089,China)Abstract:This article introduced detection methods of chiral drugs in the past decade,compared theadvantages and disadvantages of these methods,and prospected the trends.Key words:Chiral drugs;Enantiomer;Chiral detection;Review1 前言 手性药物即在药物分子结构中引入手性中心所得到的一对互为镜像与实物的对映异构体。目前,临床上使用的药物约有三分之一是手性药物。在药代动力学方面,手性药物也可能在体内的吸收、分布、代谢和排泄中表现出一定程度的立体选择性。因此手性药物的检测在新药研发、活性化合物筛选和药物检验中均十分重要。本文就手性药物的检测方法进行综述。 2 手性药物的检测方法 近年来各种检测新方法不断应用于手性药物的分析中,包括旋光法(polarimetry)和旋光色散法(optical rotation dispersion method,ORD)、圆二色性法(电子圆二色性法electron circular dichroism,ECD、振动圆二色性法vibration circular dichroism,VCD)、手性拉曼光谱法(Raman optical activity ,ROA)、质谱法(mass sp ectrum,MS)、核磁共振法(nuclear magnetic resonance,NMR),电化学法(Electrochemical)、光学传感器等。2.1 旋光法和旋光色散法 旋光法(polarimetry)一直是人们最常用来检测手性分子的方法,以其操作简单、检测价格低而极受欢迎,也是现在《中国药典》中广泛使用的方法。虽然影响因素较多,包括温度、检测光波长、样本杂质等,但其在一定条件下满足手性分析基本需求。在实验中通常以光学纯度来对样品进行分析。通常将供试品在钠光谱D线处的旋光度与相同条件下同种纯品旋光度的比值定义为光学纯度(opticalpurity ,O.P),其值某种意义上反映了供试品纯度。戴月华等人[1] 用旋光法测定硫酸西索米星氯化钠注 射液中西索米星的含量。郝玲花等人[2]用旋光度法 测定布洛芬注射液中精氨酸的含量,主药布洛芬不 干扰精氨酸测定。杨振林等人[3]用旋光法测定氯霉素滴耳液中氯霉素的含量。董杰[4]用旋光法测定盐
浅谈手性化合物与现代医学
浅谈手性化合物与现代医学 一、手性化合物简介 手性化合物(chiral compounds)是指分子量、分子结构相同,但左右排列相反,如实物与其镜中的映体。人的左右手、结构相同,大姆至小指的次序也相同,但顺序不同,左手是由左向右,右手则是由右向左,所以叫做“手性”。也就是指一对分子。由于它们像人的两只手一样彼此不能重合,又称为手性化合物。判断分子有无手性的可靠方法是看有没有对称面和对称中心。 手性问题与我们的日常生活密切相关。天然存在的手性化合物品种很多,并且通常只含有一种对映体,手性问题还牵涉到农业化学、食品添加剂、饮料、药物、材料、催化剂等诸多领域。它的研究已经成为科学研究和很多高科技新产品开发的热点。在过去20年里,手性研究具有戏剧性的发展,已从过去的少数几个专家的学术研究发展到大面积科学研究的需要,在一些领域并已带来了巨大的经济效益。物质的手性已经变成越来越需要考虑的问题,其对我们的日常生活正在起到越来越重要的作用。 手性化合物主要从天然来源、不对称合成和外消旋体拆分3个方面得到。由天然来源获得手性化合物,原料丰富,价廉易得,生产过程简单,产品的纯度一般都较高,因此很多量大的产品都是从天然物中获得。在药物工业中由于对手性药物的要求不断增加,其大大激发了不对称有机合成的发展,使一些生物技术、生物催化剂也迅速扩展到该领域产生纯的的手性中间体和手性产品。 二、手性药物 由于自然界的生命体存在有手性,因而也就产生了手性药物。手性药物指分子结构中存在手性因素的药物。通常是指由具有药理活性的手性化合物组成的药物,或者是只含有效对映体或是以有效对映体为主的药物。按药效方面的简单划分,手性药物可能存在以下几种不同的情况:①只有一种对映体具有所要求的药理活性,而另一种对映体没有药理作用或活性很小。②一对对映体中的两个化合物具有等同或近乎等同的同一药理活性。③一对对映体具有完全不同的药理活性。 ④一对对映体之间一个有药理活性,另一个不但没有活性,甚至表现出一定的毒副作用。⑤一对对映体之间药理活性相近,但存在个体差异。⑥一对对映体中,一个有活性,另一个却发生拮抗作用。 三、手性药物未来展望 手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予在分子不对称催化反应中做出杰出贡献的三位科学家。目前,世界单一对映体手性药物的销售额持续增长。1998年销售额已达到964亿美元。2000年的销售额为1330亿美元,并估计2008年达到2000亿美元。手性药物以其疗效高、毒副作用小、用药量少的优点满足了市场的需求,因而成为未来新药研发的方向。
手性超材料研究进展.
手性超材料研究进展 钟柯松2111409023 物理 1. 引言 超材料是有特殊电磁性质的人造结构性材料,其中一个典型的性质就是负折射率。第一种负折射率材料1两个部分组成:一个是连续的金属线,它来实现负介电常数2,另一个是开环谐振器,来实现负的磁导率3。在同时实现复介电常数和负磁导率的时候,负折射率就是实现了。后来,人们大多数以这个原则4-5来设计负折射率材料。虽然负磁导率在微波段很容易实现,但是在光频区域却极其困难7,8。与此同时,Pendry9,Tretyakov10,11和Monzon12等人从理论上提出了另一种利用手性实现负折射率的途径。而手性材料层作为完美透镜也从理论上实现了9-13。在这些报告中,Pendry提出了一种3D螺旋线结构来实现负折射率的手性超材料9。Tretyakov 等人则在理论上研究了在手性和偶极粒子手性复合材料中得到负折射率的可能性11。理论表明,负折射率是可以在以3D螺旋对称为晶格的金属球超材料中可以得到14。同时也表明,周期上的手性散射是3D和各向同性负折射率的原因15。实际上,Bose曾经在1898年利用螺旋结构研究了平面偏振电磁波的旋转16。Lindman也是研究微波段人造手性介质的先驱17。最近,Zhang 等人在实验上实现了一个3D手性超材料在THz波段的负折射率18。Wang等人则在微波段同时实现了3D手性超材料的负折射率和巨大的光学活性和圆二色性19,20。但是,这些提到的3D手性超材料都很难构建。同时,平面手型超材料显示了光学活性也被报道了21-24。这里需要指出的是,平面手性结构是正真的3D手性结构是不同的。Arnaut和Davis第一次把平面手性结构引入到了电磁波的研究中25,26。一个结构如果被定义为手性结构,那么它应该是在任何平面是没有镜面对称的,然而,一个平面结构被认为是手性的,则它是不能和它在该平面上的镜像重叠的,除非它不在这个平面上。实际上,一个平面手性结构还是和镜像镜面对称的。在垂直入射的情况下,在光传播方向上镜面对称的结构是没有光学活性的27。除非在这个结构上增加衬底来打破传播方向上的镜面对称,这样光学活性就能得到了22-24。然而,手性在这些结构是非常微弱的。后来,Rogacheva等人进一步地提出了双层的手性结构,展现出了很强的光学活性28。这个两层的花环状的平面金属层相互平面扭和在两个平面中,它们也不像3D手性原胞一样连接在一起18-20,二是通过电磁场来相互耦合。它的光学活性强到了整个结构都显示出了负折射率。在这个开创性的工作下,一些不同的双层手性结构,从微波段到近红外波段被相继的提出。如双层花环结构29,30,双层十字线结构31,32,金属切线对33,卍字结构34,四个‘U’型结构35-37,互补性手性结构38等等。另外,多层的平面手性结构也被提了出来29,39。它表明,在构建体手性超材料时,邻近原胞之间的耦合效应也应该考虑在内。由于存在这个耦合效应,体手性超材料和单原胞手性超材料的性质存在差异39。当手性超材料在负折射率带中工作是,品质因素(FOM)来评估它的损耗级别40。FOM被定义为折射率实部和虚部比值的绝对值。在一个波长对应的介质中波振幅衰竭为exp(-2π/FOM)。为了得到高的FOM,一种复合的手性超材料在最近提了出来41。另外,可调节的手性超材料也有报道42。 基于传输和反射参数的有效折射率的提取是一种在表征设计的超材料是的方便有用的手段43-47。随着手性超材料研究的进展,负折射率用其他提取方法中也得到了18,29,48,49。Zhao等人总结了这些提取方法,简练出了几个简单的公式,这在手性超材料的研究中是非常有用的50。非互易式传输在信息处理中起到了至关重要的作用,点偶极子就是一个典型的例子,它在电流回
手性药物的不对称合成90 (3)
手性药物及其不对称合成 [摘要]近年来不对称合成法应用在手性药物及药物中间体的制备中,使手性药物得到了快速的发展,不少手性药物及其中间体已经实现了工业化生产。本文介绍了手性药物及获取手性药物的方法,对不对称合成法尤其是不对称催化法在手性药物工业制备中的应用进行了综述。 [关键词]手性药物;制备;不对称合成;不对称催化 Chiral Drugs and Asymmetric Synthesis Abstract: In recent years ,since the asymmetric synthesis has been used in preparation of the chiral drugs and pharmaceutical intermediates ,there has been fast development in preparation of chiral drugs ,some of which has been already synthesed in industry scale .What is chiral drugs and the ways to abtain the chiral drugs are introduced .The methods of asymmetric synthesis,especially asymmetric catalytic reaction used in synthesis chiral drugs are reviewed . Key words :chiral drugs ,preparation , asymmetric synthesis;asymmetric catalytic synthesis 1 引言 2001 年10 月10 日,瑞典皇家科学院决定将2001年度诺贝尔化学奖授予在催化不对称反应领域做出突出贡献的3 位科学家:威廉·诺尔斯,野依良治与巴里·夏普赖斯。他们利用手性催化剂大大提升了单一对映异构体的产率,为手性药物的制备以及其他行业的发展都做出了突出的贡献。【1】 :2手性药物 手性药物(chiral drug)是指其分子立体结构和它的镜像彼此不能够重合的
