造血干细胞分化图
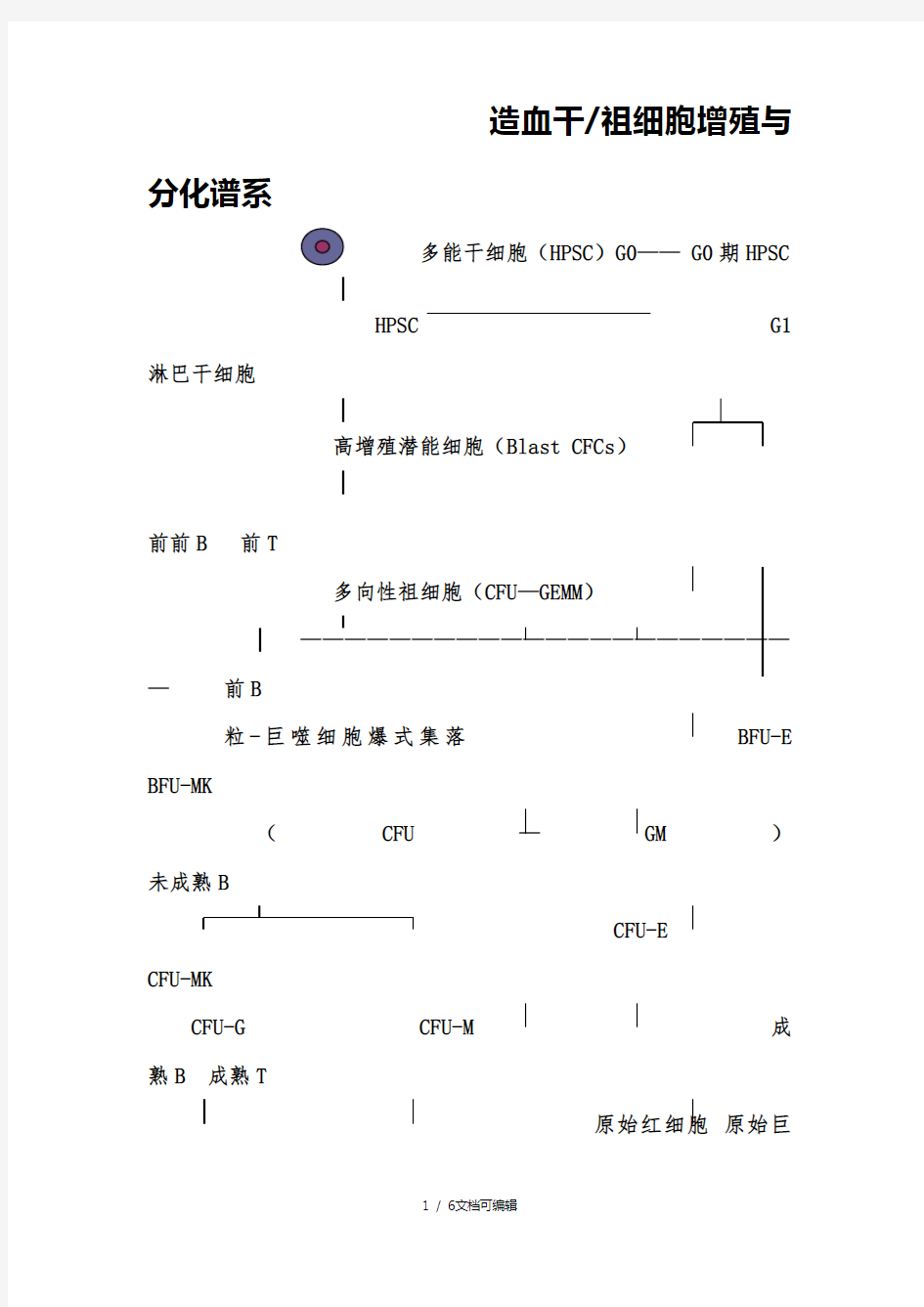

造血干/祖细胞增殖与
分化谱系
多能干细胞(HPSC)G0—— G0期HPSC
HPSC G1 淋巴干细胞
高增殖潜能细胞(Blast CFCs)
前前B 前T
多向性祖细胞(CFU—GEMM)
——————————————————————
—前B
粒-巨噬细胞爆式集落BFU-E
BFU-MK
(CFU—GM)
未成熟B
CFU-E
CFU-MK
CFU-G CFU-M 成
熟B 成熟T
原始红细胞原始巨
核细胞
原始粒细胞原始单核细胞原始浆细胞
早幼红细胞幼稚巨核细胞
早幼粒细胞幼稚单核细胞幼稚浆细胞
中幼红细胞成熟巨核细胞
单核细胞浆细胞
中性中幼嗜酸性中嗜碱性中晚幼红细胞
粒细胞幼粒细胞幼粒细胞
成熟红细胞
中性晚幼嗜酸性晚嗜碱性晚
粒细胞幼粒细胞幼粒细胞
中性成熟嗜酸性成嗜碱性成
粒细胞熟粒细胞熟粒细胞
缺铁性贫血巨幼红细胞性贫血
再生障碍性贫血
珠蛋白生成障碍性贫血异常血红蛋白病
遗传性球形红细胞增多症遗传性椭圆形红细胞增多症遗传性口形红细胞增多症
葡萄糖-6-磷酸脱氢酶缺乏症丙酮酸激酶缺乏症
阵发性睡眠性血红蛋白尿症自身免疫性溶血性贫血冷凝集素综合征
高铁血红蛋白症硫化血红蛋白症
真性红细胞增多症
白细胞减少症中性粒细胞减少症和粒细胞缺乏症传染性单核细胞增多症
急性微分化性白血病(M0)急性粒细胞白血病未分化性(M1)
急性粒细胞白血病部分分化性(M2a) M2b
(M2b)急性颗粒增多的早幼粒细胞白血病(M3a)
M3b 急性粒-单核细胞白血病(M4a M4b M4c M4EO)
急性单核细胞白血病(M5a) M5b
红白血病(M6)急性巨核细胞白血病(M7)
急性淋巴细胞白血病(ALL)
T-细胞型:(Ⅰ、Ⅱ、Ⅲ型)
B-细胞型:前前B、前B、Common型、B-ALL
急性混合细胞白血病(HAL) 浆细胞白血病
嗜酸粒细胞白血病嗜碱粒细胞
白血病
多毛细胞白血病(HCL) 慢性淋巴细胞白血病 (CLL)
慢性粒细胞白血病(CML)
肥大细胞白血病
大颗粒淋巴细胞白血病幼淋细胞白血病
骨髓增生异常综合征(MDS:RA RAS RAEB RAEBT)
造血干细胞与白血病的关系
造血干细胞与白血病的关系 1995年以来我国造血干细胞工程与相关的生物学领域的研究发展迅速。有关造血干/祖细胞基因表达的研究,上海国家人类基因组研究中心陈竺、陈赛娟等为正常和急性白血病人骨髓造血干祖细胞cDNA文库的基因表达建立了一套先进的工作体系。他们在许多白血病细胞系的干/祖细胞中发现了300个新的相关基因。中山大学医学院李树浓、黄绍良等从人的桑葚期胚胎干细胞成功地诱导出造血细胞等。北京输血研究所裴雪涛等从成人和胎儿的骨髓分离出成年源干细胞,又进一步诱导分化为骨、软骨、脂肪和神经原细胞等。他们成功地构建了胎儿和成人间充质干细胞cDNA扣除文库,获得了胎儿和成人间充质干细胞的差异表达基因及在胎儿特异表达基因。中国医学科学院天津血液学研究所、国家血液学重点实验室赵春华等证实从胚胎胰腺、骨髓和肝脏中都可以分离出人间充质干细胞,又证明G-CSF可以使输注的间充质干细胞在体内促造血重建。北京基础医学研究所毛宁等的实验不支持间充质干细胞可以“横向分化“。最近他们发现小鼠胚胎干细胞的体外分化重现了胚胎早期造血发生的生物学程序以及Smad5基因调控在胚胎造血发生中的必要性和多样性,又表明其上游配体TGF-beta家族分子在胚胎发生中的作用和特点。本文针对干细胞可塑性研究作了评论。国际上曾风靡一时的“横向分化“有关的实验都没有用完全纯化的胚层干细胞或组织干细胞来证实。然而,完全纯的胚层或组织定向的干细胞克隆是无法制备的。成年或胎儿全身各类组织中混有一些定向某胚层的或某组织的干细胞,甚至还混有桑葚胚干细胞。它们是胚胎发育过程的每个阶段中停止参与胚胎发育而残留下来的。它们在体内处于静止期,寿命长,长期存留在成人的各种组织中。各胚层和组织干细胞混杂在一起,它们都没有特异的形态、表型和功能,无法分离纯化,甚至和成人组织细胞也很难分开。它们在体外实验适当的条件诱导下可分化为各种组织细胞。在那些想证明组织干细胞“横向分化“的实验中,都无法排除上述可能。本专论指出,只有桑葚胚干细胞是全能的胚胎干细胞,具有向各个胚层分化的
造血干细胞分化图
造血干/祖细胞增殖与分化谱系 多能干细胞(HPSC)G0——G0期HPSC G1 淋巴干细胞高增殖潜能细胞(Blast CFCs) 前前B前T 多向性祖细胞(CFU—GEMM) ———————————————————————前B 粒-巨噬细胞爆式集落BFU-E BFU-MK (CFU—GM)未成熟B CFU-E CFU-MK CFU-G CFU-M 成熟B成熟T 原始红细胞原始巨核细胞原始粒细胞原始单核细胞原始浆细胞 早幼红细胞幼稚巨核细胞早幼粒细胞幼稚单核细胞幼稚浆细胞 中幼红细胞成熟巨核细胞 单核细胞浆细胞 中性中幼嗜酸性中嗜碱性中晚幼红细胞 粒细胞幼粒细胞幼粒细胞 成熟红细胞 中性晚幼嗜酸性晚嗜碱性晚 粒细胞幼粒细胞幼粒细胞 中性成熟嗜酸性成嗜碱性成 粒细胞熟粒细胞熟粒细胞
缺铁性贫血巨幼红细胞性贫血 再生障碍性贫血 珠蛋白生成障碍性贫血异常血红蛋白病 遗传性球形红细胞增多症遗传性椭圆形红细胞增多症遗传性口形红细胞增多症 葡萄糖-6-磷酸脱氢酶缺乏症丙酮酸激酶缺乏症 阵发性睡眠性血红蛋白尿症自身免疫性溶血性贫血冷凝集素综合征 高铁血红蛋白症硫化血红蛋白症 真性红细胞增多症 白细胞减少症中性粒细胞减少症和粒细胞缺乏症传染性单核细胞增多症 急性微分化性白血病(M0)急性粒细胞白血病未分化性(M1) 急性粒细胞白血病部分分化性(M2a)M2b
(M2b)急性颗粒增多的早幼粒细胞白血病(M3a) M3b 急性粒-单核细胞白血病(M4a M4b M4c M4EO) 急性单核细胞白血病(M5a)M5b 红白血病(M6)急性巨核细胞白血病(M7)
急性淋巴细胞白血病(ALL) T-细胞型:(Ⅰ、Ⅱ、Ⅲ型) B-细胞型:前前B 、前B 、Common 型、B-ALL 急性混合细胞白血病(HAL) 浆细胞白血病 嗜酸粒细胞白血病 嗜碱粒细胞白血病 多毛细胞白血病(HCL) 慢性淋巴细胞白血病 (CLL)
造血干细胞
造血干细胞 一定义 造血干细胞是骨髓中的干细胞,具有自我更新能力并能分化为各种血细胞前体细 胞,最终生成各种血细胞成分,包括红细胞、白细胞和血小板。也是存在于造血组 织中的一群原始多能干细胞。可分化成各种血细胞,也可转分化成神经元、少突胶 质细胞、星形细胞、骨骼肌细胞、心肌细胞和肝细胞等。 干细胞可以救助很多患有血液病的人们,最常见的就是白血病。虽其配型成功率相 对较低,且费用高昂,但其治疗效果好且捐献造血干细胞对捐献者的身体并无很大 伤害。 二特征 人体内所有的血细胞都来自造血干细胞(hematopoieticstemcells,HSC)的定向分化。HSC又称多能干细胞,是存在于造血组织中的一群原始造血细胞,有两个重要特性: (1)高度的自我更新或自我复制能力; (2)可定向分化、增殖为不同的血细胞系,并进一步生成血细胞。造血干细胞采用不对称的分裂方式:由一个细胞分裂为两个细胞。其中一个细胞仍然保持干细胞的一切生物特性,从而保持身体内干细胞数量相对稳定,这就是干细胞自我更新。而另一个则进一步增殖分化为各类血细胞、前体细胞和成熟血细胞,释放到外周血中,执行各自任务,直至衰老死亡,这一过程是不停地进行着的。 三造血干细胞的造血原理 1 造血干细胞具有多潜能性,即具有自身复制和分化两种功能。在胚胎和迅速再生的骨髓中,HSC多处于增殖周期之中;而在正常骨髓中,则多数处于静止期,当机体需要时,其中一部分分化为成熟血细胞,另一部分进行分裂增殖,以维持HSC的数量相对稳定。人类HSC首先出现于胚龄第2~3周的卵黄囊,在胚胎早期(第2~3个月)迁至肝、脾,第5个月又从肝、脾迁至骨髓。从胚胎末期一直到出生后,骨髓成为HSC的主要来源。造血干细胞进一步分化发育成不同血细胞系的定向干细胞。定向干细胞多数处于增殖周期之中,并进一步分化为各系统的血细胞系,如红细胞系、粒细胞系、单核-吞噬细胞系、巨核细胞系以及淋巴细胞系。2由造血干细胞分化出来的淋巴细胞有两个发育途径,一个受胸腺的作用,在胸腺素的催化下分化成熟为胸腺依赖性淋巴细胞,即T细胞;另一个不受胸腺,而受腔上囊(鸟类)或类囊器官(哺乳动物)的影响,分化成熟为囊依赖性淋巴细胞或骨髓依赖性淋巴细胞,即B细胞。并分别由T、B细胞引起细胞免疫及体液免疫。如机体内造血干细胞缺陷,则可引起严重的免疫缺陷病。
造血干细胞分化图
多能干细胞(HPSC)G0—— G0期HPSC HPSC G1 淋巴干细胞 高增殖潜能细胞(Blast CFCs) 前前B前T 多向性祖细胞(CFU—GEMM) ———————————————————————前B 粒-巨噬细胞爆式集落 BFU-E BFU-MK (CFU—GM)未成熟B CFU-E CFU-MK CFU-G CFU-M 成熟B成熟T 原始红细胞原始巨核细胞原始粒细胞原始单核细胞原始浆细胞 早幼红细胞幼稚巨核细胞早幼粒细胞幼稚单核细胞幼稚浆细胞 中幼红细胞成熟巨核细胞 单核细胞浆细胞 中性中幼嗜酸性中嗜碱性中晚幼红细胞 粒细胞幼粒细胞幼粒细胞 成熟红细胞 中性晚幼嗜酸性晚嗜碱性晚 粒细胞幼粒细胞幼粒细胞 中性成熟嗜酸性成嗜碱性成 粒细胞熟粒细胞熟粒细胞
缺铁性贫血巨幼红细胞性贫血 再生障碍性贫血 珠蛋白生成障碍性贫血异常血红蛋白病 遗传性球形红细胞增多症遗传性椭圆形红细胞增多症遗传性口形红细胞增多症 葡萄糖-6-磷酸脱氢酶缺乏症丙酮酸激酶缺乏症 阵发性睡眠性血红蛋白尿症自身免疫性溶血性贫血冷凝集素综合征 高铁血红蛋白症硫化血红蛋白症 真性红细胞增多症 白细胞减少症中性粒细胞减少症和粒细胞缺乏症传染性单核细胞增多症 急性微分化性白血病(M 0)急性粒细胞白血病未分化性(M 1 ) 急性粒细胞白血病部分分化性(M 2a ) M 2b (M2b)急性颗粒增多的早幼粒细胞白血病(M3a) M3b 急性粒-单核细胞白血病(M4a M4b M4c M4EO)
急性单核细胞白血病(M5a) M5b 红白血病(M6)急性巨核细胞白血病(M7) 急性淋巴细胞白血病(ALL) T-细胞型:(Ⅰ、Ⅱ、Ⅲ型) B-细胞型:前前B、前B、Common型、B-ALL 急性混合细胞白血病(HAL) 浆细胞白血病 嗜酸粒细胞白血病嗜碱粒细胞白血病 多毛细胞白血病(HCL) 慢性淋巴细胞白血病 (CLL)慢性粒细胞白血病(CML) 肥大细胞白血病 大颗粒淋巴细胞白血病幼淋细胞白血病 骨髓增生异常综合征(MDS:RA RAS RAEB RAEBT)
一、什么是造血干细胞它能再生吗
一、什么是造血干细胞?它能再生吗? 造血干细胞是一类可以产生各种类型血细胞的细胞,它具有自我更新和很强的再生与分化发育能力,它来源于红骨髓,可以经血流迁移到外周血液循环中,适量的造血干细胞就能维持正常的血液成份平衡。 二、什么是造血干细胞移植? 患者因疾病或其它原因导致造血或免疫功能异常时,将他人的正常造血干细胞移植到患者体内,重建患者的正常造血等相关功能,达到治疗某些疾病的目的。 三、造血干细胞移植的分类? 根据造血干细胞来源可分为骨髓移植、外周血造血干细胞移植、脐带血造血干细胞移植及胎肝造血干细胞移植。 四、造血干细胞移植能治疗哪些疾病? 造血干细胞移植是治疗白血病、再生障碍性贫血、重症免疫缺陷症、地中海贫血、急性放射病、某些恶性实体瘤、淋巴瘤等造血及免疫系统功能障碍性疾病的成熟技术和重要手段,对有些疾病有根治性疗效。 五、健康者在多大年龄适合捐献造血干细胞? 年龄在18-40岁的健康者均可登记成为捐献造血干细胞的志愿者18-55岁健康者可采集造血干细胞。 六、捐献造血干细胞影响身体健康吗? 人体内的造血干细胞具有很强的再生能力。正常情况下,人体各种细胞每天都在不断新陈代谢,进行着生成、衰老、死亡的循环往复,当指出部分造血干细胞后,造血干细胞会很快增殖,一般健康者在十天左右即可补足所捐的细胞量。因此,捐献造血干细胞不仅不会影响自身的造血功能反而使自身的造血系统得到了锻炼,增强了生命的活力。 七、从外周血采集造血干细胞,对捐献者有危险、痛苦吗? 至今没有因采集外周血造血干细胞引起对指献者伤害的报道,在采集完成后,一些轻微疼痛感和不适将会消失,所用的器材都经严格消毒并一次性使用,所在的采集医院都是由卫生部认定、在中华骨髓库备案的有移植和采集资质的三甲医院,安全是有保障的。 八、捐献造血干细胞需多长时间?捐献者大约需采集多少造血干细胞?捐献期间正常工作怎么办? 约1个星期,注射动员剂4天(皮下注射,2次/日),第5天采集,大约需采集100ml~200ml 含1%左右浓度造血干细胞的混悬液。一旦确定捐献,我们红会工作人员将会为您请假,并尽量帮您解决捐献期间的生活问题。 九、在采集造血干细胞前,为什么要对捐献者使用动员剂?对人体有副作用吗?有什么样的不适症状? 在正常生理条件下,外用血的造血干细胞量极少,不能满足移植的需要,药物动员之后,加速骨髓造血干细胞的生成并释放到外周血中,可使外用血造血干细胞增加20-30倍,以满足移植需要。据多年的临床观察和目前国际上的报道,动员剂(国际上公认的G-CSF)对人体健康没有副作用。 注射动员剂期间可能会有腰酸背痛、食欲;减退、低热等不适症状,因人而异,停药后这些不适症状就会消失。 十、捐献造血干细胞后会影响生育吗? 不会影响。志愿者指完造血干细胞后可正常怀孕生育。 十一、怎样加入中国造血干细胞捐献者资料库江苏省分库,成为一名捐献造血干细胞志愿者? 如果您适龄、身体健康、有过无偿献血经历、家人支持、在当地有比较固定的工作或住
什么是造血干细胞
什么是造血干细胞 近三十年来,血细胞生成的研究发展很快,现已证明人类骨髓中存在造血多能干细胞,它们具有高度自我更新的能力,并且能分化为各血细胞系统的祖细胞(如淋巴系干细胞、粒系干细胞),再大量分化、增殖为各种原始和成熟血细胞,最后这些成熟的血细胞通过骨髓进入血液中,发挥各自的生理作用。人体造血干细胞的一半存在于干细胞池,是人体造血细胞的储备库,以适应和满足各种状态下造血的需要;另一半存在于增殖池,这些造血干细胞不断增殖、自我复制,以弥补因细胞衰老或丢失所致的血细胞不足,维持人体血细胞的平衡。 人体的造血组织有很强的代偿功能,当抽取部分造血干细胞后,会很快增殖,一般健康者在1-2周左右即可补足所捐的造血干细胞量。因此,捐献者不仅不会影响自身的造血功能,反而使自身的造血系统得到了锻炼,更具备了生命的活力。 什么是骨髓 骨髓是存在于长骨(如肱骨、股骨)的骨骺和扁平骨(如髂骨)的骨髓腔中,是一种海绵状的组织。能产生血细胞的骨髓呈红色,称为红骨髓。人出生时,红骨髓充满全身骨髓腔,随着年龄增大,脂肪填充了所有的长骨的骨髓腔(呈
淡黄色,称黄骨髓),最后几乎只有扁平骨和长骨骨骺中才有红骨髓。此种变化可能是由于成人不需要全部骨髓腔造血,部分骨髓腔造血已足够补充所需血细胞。当机体严重缺血时,部分黄骨髓可转化为红骨髓,骨髓的造血能力可显著提高。骨髓的造血功能极强,骨髓最高的造血能力可达到正常造血情况的9倍,如果只保留骨髓的1/10,就能完成正常的造血功能,所以少量骨髓捐献对身体没有什么影响。 造血干细胞移植的过程是怎样的 常规的移植前,只需HLA—A、B、DR三个座位六个基因相同即可。由于HLA—A、B的多样性最明显,所以上海分库原先是对志愿者先做HLA—A、B分型,待检索后供、受者HLA —A、B相配后,再对供者作HLA—DR分型检测,看是否相配?现在已采用基因检测法,不分一、二类了。如果供、受者HLA 完全相配,同时供者健康检查合格,就可以着手准备移植手术。先用化学药物和放射治疗摧毁患者身上癌细胞,这时患者的正常造血干细胞也会被杀死,人体的免疫力下降,易发生感染,必须在无菌病房(层流室)中接受移植。移植方法如同输血,植入的造血干细胞在患者体内繁殖,重建造血和免疫系统,患者逐渐恢复健康。造血干细胞移植对白血病的有效治愈率可达到70%左右。 造血干细胞采集的方式是什么
第十二章造血干细胞及免疫细胞的生成
第十二章造血干细胞及免疫细胞的生成 免疫细胞都属于血细胞,所有血细胞都来源于造血干细胞。因此在一定意义 上讲,免疫细胞的发育分化就是造血干细胞分化成熟的过程。 第一节 造血干细胞的特性和分化 一、造血干细胞的起源和表面标记 (一)造血干细胞的起源 哺乳动物的造血最早发生在卵黄囊,随后转移到胎肝,胚胎发育中期以后以 及出生后,骨髓成为主要的造血场所,并为B细胞发育的中枢免疫器官;胸腺 是T淋巴细胞的分化成熟的中枢免疫器官。 早期的造血干细胞是多能造血干细胞(pluripotent hematopoietic stem cell), 具有自我更新(self?renewing)和分化(differentiation)两种重要的潜能,赋予 机体在整个生命过程中始终保持造血能力。多能造血干细胞最初分化为共同淋巴 样祖细胞和共同髓样祖细胞等等。 (二)造血干细胞的表面标记 白细胞分化抗原和单克隆抗体技术的应用,为造血干细胞表面标记的研究及其分离纯化提供了重要的理论和实验依据。人造血干细胞的主要表面标记为CD34和c-kit (CD117),不表达谱系(lineage)特异性标记。 (1)CD34:CD34是一种高度糖基化跨膜蛋白,有1%~4%骨髓细胞表达 CD34,其中包括了造血干细胞,是造血干细胞的一种重要标记,应用CD34单 克隆抗体可从骨髓、胎肝或脐血中分离、富集造血干细胞。随着造血干细胞的分 化成熟,CD34表达水平逐渐下降,成熟血细胞不表达CD34。 (2)CD117:CD117是干细胞因子(stem cell factor,SCF)的受体,是原 癌基因c?kit的编码产物Kit。CD117是属于含有酪氨酸激酶结构的生长因子受体,胞膜外区结构属IgSF。CD117+细胞约占骨髓细胞的1%~4%,50%~70% CD117+骨髓细胞表达CD34,因此,CD117也是多能造血干细胞的重要标记。 (3)Lin-细胞:应用针对T细胞、B细胞、NK细胞、单核细胞、巨噬细 胞、巨核细胞、髓系以及红系等多种谱系相应单克隆抗体的混合抗体(CD2、CD3、CD14、CD16、CD19、CD24、CD56、CD66b和血型糖蛋白A等抗体)结合免
造血干细胞的特性
造血干细胞的特性 一、造血干细胞的起源 造血干细胞(hemopoietic stem cell,HSC)是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞在人胚胎2周时可出现于卵黄囊,第4周开始转移至胚肝,妊娠5个月后,骨髓开始造血,出生后骨髓成为干细胞的主要来源。在造血组织中,所占比例甚少,如在小鼠骨髓中105核细胞中的有10个,在脾中105有核细胞中只有0.2个。 二、造血干细胞的形态 干细胞是一种嗜碱性独核细胞,其大小约为8μm,呈圆形,胞核为圆形或肾形,胞核较大,具有2个核仁,染色质细质而分散,胞浆呈浅蓝色不带颗粒,在形态上与小淋巴细胞极其相似,但淋巴细胞体积较小,染色质浓染,核仁不明显且有细胞器。因此很难用形态学识别干细胞,并与其它独核细胞相区别。 造血干细胞可包括三级分化水平,即多能干细胞(pleuripotent stem cell),定向干细胞(Committed stem cell)及其成熟的子代细胞。 关于对造血干细胞的功能分析,长期以来仅限于对小鼠干细胞的研究,而对人干细胞的存在只是来自间接证据,因为不能在人体内进行如鼠体内的功能分析法。70年代以来,由于建立了新的体外细胞培养技术,大大促进了对人干细胞的直接研究。 三、造血干细胞的表面标志 由于造血组织中造血干细胞在形态学方面无法与其它单核细胞区别,而且数量极少,这为造血干细胞的分离纯化并对其功能分析和分化的研究造成极大困难。 近年来由于单克隆抗体技术的进步,流式细胞仪(FACS)的应用,以及对小鼠和人造血干细胞表面标志的研究,取得了很大进展,为造血细胞的分离纯化及鉴定创造了条件。 1.Thy-1与丝裂原(wheat germ agglutinin,WGA)Visseer等发现小鼠骨髓中造血干细胞对WGA有高亲和性。利用这一特性,应用FACS自骨髓中分离造血干细胞应及核系Mac-1等谱系抗原与WGA反应性相结合,即可自骨髓中Lin-/WGA+细胞群中分离造血干细胞,也获得良好结果。 也有学者发现正常小鼠骨髓细胞中,也能表达低密度Thy-1抗原(Thy-11。)。如与上述标志组合,即自骨髓Thy-11。Lin-,WGA+细胞群中,分离造血干细胞,可用于对造血细胞的功能分析。 2.干细胞抗原(stem cellantigen-1,Sca-1)有学者制备一种抗原前T细胞杂交瘤的单克隆抗体,用这种单抗检出的抗原分子称为干细胞抗原-1(Sca-1)。其后有人自骨髓中Thy-1Io、Lin-、Sca-1+细胞群中,可分离纯人造血干细胞。 3.原癌基因(c-kit)最近证明造血干细胞与c-kit基因密切相关。C-kit可编码一种穿膜酪氨酸激酶受体分子。应用单克隆抗体证明此分子可存在于造血干细胞膜上,其后证明它的配体分子是造血干细胞因子(stem cell factor,SCF)。它是信号传导分子,对造血干细胞的分化具有重要作用。目前,小鼠多能干细胞表面分子标志可视为Thy-1Io、WGA+、c-kit+、Lin-。 c-kit分子可高频率表达于多能干细胞表面,但骨髓中c-kit+细胞可分化为各种血细胞,而胸腺中c-kit细胞可分化为淋巴细胞,不能分化为髓系细胞,所以胸腺内c-kit+细胞,可能是淋巴样干细胞(如下表)。 胸腺及骨髓中c-kit+细胞分化机制
造血干细胞的提取
造血细胞分离、集落培养及表型分析所谓造血干细胞(hematopoietic stem cells,HSC,)是指具有自我更新和多向分化能力的一类细胞。它的基本特性是具有自我更新能力,即经过一个细胞周期活动之后,可以产生两个与分裂前性质相同的造血干细胞,同时又具有多向分化能力,即在一定的环境条件下,造血干细胞具有向各系血细胞分化的能力。 图1 造血系统和造血干细胞分化图 Fig。1 hematopoietic system and hematopoietic stem cell differentiation. 造血干细胞主要存在于骨髓、动员的外周血、脐血中,与骨髓和动员的外周血相比,脐血来源丰富、受病毒污染的几率小、富含造血干细胞且所含的造血干细胞具有更高的增殖潜能,同时脐血中的淋巴细胞幼稚,具有较低的免疫排斥活性,是优良的造血干细胞来源。 造血干/祖细胞鉴别的传统方法还是应用集落分析方法,它可检测粒-巨嗜细胞集落形成单位(colony - forming unit-granulocyte/ macrophage,CFU-GM)、红系爆式集落形成单位(burst-forming unit-erythroid,BFU-E)、巨核细胞集落形成单位(
colony-forming unit-megakaryocyte,CFU-MK)、红系-粒系-巨嗜系-单核系集落形成单位(multipotent colony-forming units,CFU-GEMM或mixed colony-forming unit,CFU-Mix),等等,它是在半固体培养基上培养14天,然后在显微镜下计数集落。 造血干细胞的表面标志随着个体发育的不同时期不同,CD34+、CD38-、HLA-DR-、Thy-1+、c-kit+、LFA-1-、CD45RA-、CD71-、lin-已经普遍被认为是造血干细胞的标志。此外,1997年发现一个新的造血干细胞标志是AC133,但具CD34抗原是目前公认的造血干细胞和祖细胞的共同标志。 一、实验原理 1、用流式细胞仪分析细胞表型 待测细胞被制成单细胞悬液,经特异性荧光染 料染色后加入样品管中,在气体压力推动下进入 流动室,流动室内充满鞘液,在鞘液的约束下, 细胞排成单列出流动室喷嘴口,并被鞘液包绕形成细胞液柱。这种同轴流动的设计,使得样品流和鞘液流形成的流束始终保持着一种分层鞘流的状态。鞘液和样品流组成一个圆形的流束,一起自喷嘴的圆形宝石孔喷射出来,进入流动室,与水平方向的激光光束垂直相交。该区称为测量区。利用样品流和鞘流的气压差的层流原理,使细胞依次排列成单行,每个细胞以均等的时间依次通过测量区,被荧光染料染色的细胞受到强烈的激光照射后发出荧光,同时产生散射光。细胞发出的荧光信号和散射光信号,同时被荧光光电倍增管接收,被积分放大反转换为电子信号输入电子信息接收器、
造血干细胞研究进展
造血干细胞研究进展 摘要:造血干细胞是具有自我更新、高度增殖和多向分化潜能的细胞群体,在人体造血系统中起着至关重要的作用。本文介绍了造血干细胞的生物学特征、表面标志以血干细胞在干细胞移植、细胞治疗和基因治疗等方面的临床应用和前景。 造血干细胞(hematopoietic stem cell,HSC)又称多能干细胞,是存在于造血组织中的一群原始造血细胞。也可以说它是一切血细胞的原始细胞,即由造血干细胞定向分化、增殖为不同的血细胞系,并进一步生成血细胞。人类造血干细胞首先出现于胚龄第2~3周的卵黄囊,在胚胎早期(第2~3月)迁至肝、脾,第5个月又从肝、脾迁至骨髓。在胚胎末期一直到出生后,骨髓成为造血干细胞的主要来源。造血干细胞是干细胞中研究最早、最多、最深入的一种,近年来在造血干细胞的多个研究领域均取得了重要进展。 1 造血干细胞的发现 造血干细胞的发现源于第二次世界大战后放射医学的研究,Jacobson 等[1-3]发现小鼠与豚鼠的脾脏与骨髓中存在有一类细胞,即造血干细胞,能够重建经致死剂量射线照射过的小鼠与豚鼠的造血系统。随着单克隆抗体技术与流式细胞分选技术的出现,人们利用多种针对细胞表面抗原的抗体组合,分离到相对较纯的小鼠与人骨髓与胚胎组织中的造血干细胞与造血前体细胞群(hematopoietic progenitorcell)。其中,美国斯坦福大学Weissman 实验室在分离与鉴定小鼠与人的造干细胞方面所做的工作最为杰出[4-9]。长期以来,对于造血干细胞是由多种不同的、可以分化成不同种类成熟细胞所组成,还是由一类可以分化成所有造血系统成熟细胞所组成,人们存有争论。直到1996 年,Osawa 等[10]通过单个细
(整理)造血干细胞活动总结
造血干细胞采样活动总结 2011年11月11日,大理学院红十字会携手大理州红十字会在大理学院学生超市门口开展了造血干细胞采样活动。活动当天,众多的学生积极参与了此次活动,在大理学院红十字会干事和大理州红十字会的共同努力下,在大理学院热情的大学生的积极参与和支持下,本次活动取得了圆满的成功。 (一)造血干细胞的简介 做好造血干细胞采样活动的第一步应当要知道什么是造血干 细胞,它的特征,功能作用,以及采样过程的安全问题。造血干细胞是存在于造血组织中的一群原始造血细胞,它不是组织固定细胞,可存在于造血组织及血液中。造血干细胞是血细胞的鼻祖,是高度未分
化细胞,具有良好的分化增殖能力,干细胞可以救助很多患有血液病的人们(如白血病),因为有了造血干细胞移植技术,世界各地成千上万患有以上疾病的患者,重新燃起了生命的希望。目前国际上通用的干细胞保存技术是将获得的干细胞储存在-196℃深低温状态,医学研究与临床实践证明保存一百多年的细胞仍然具有活性。 造血干细胞具有高度的自我更新、自我复制的能力,可分化生成各种血细胞。造血干细胞有很强的再生能力,失血或捐献造血干细胞后,可刺激骨髓加速造血,1-2 周内,血液中各种成分可恢复到原来水平。 实践安全:据多年的临床观察和国际上的报道,至今还没有因采集外周血造血干细胞引起对捐献者伤害的案例。在采集完成后,一些轻微疼痛感和不适将很快消失。从外周血采集造血干细胞简单、省事,
故我国捐献造血干细胞较多采用此种方法。在整个采取过程中所用的器材都经过严格消毒,并一次性使用,确保了捐献者的安全。一般造血干细胞来源于三个渠道:1 、骨髓造血干细胞 2 、外周造血干细胞 3 、脐带血造血干细胞。 中华骨髓库目前主要开展外周血造血干细胞采集。造血干细胞是血液成分之一,是生成各种血细胞的最起始细胞,又称造血多能干细胞,存在于骨髓、胚胎肝、外周血及脐带血中。它既具有高度自我更新能力,又具有进一步分化各系统祖细胞的能力。 (二)活动前期准备
造血干细胞分化图
造血干/祖细胞增殖与 分化谱系 多能干细胞(HPSC)G0—— G0期HPSC HPSC G1 淋巴干细胞 高增殖潜能细胞(Blast CFCs) 前前B 前T 多向性祖细胞(CFU—GEMM) —————————————————————— —前B 粒-巨噬细胞爆式集落BFU-E BFU-MK (CFU—GM) 未成熟B CFU-E CFU-MK CFU-G CFU-M 成 熟B 成熟T 原始红细胞原始巨
核细胞 原始粒细胞原始单核细胞原始浆细胞 早幼红细胞幼稚巨核细胞 早幼粒细胞幼稚单核细胞幼稚浆细胞 中幼红细胞成熟巨核细胞 单核细胞浆细胞 中性中幼嗜酸性中嗜碱性中晚幼红细胞 粒细胞幼粒细胞幼粒细胞 成熟红细胞 中性晚幼嗜酸性晚嗜碱性晚 粒细胞幼粒细胞幼粒细胞 中性成熟嗜酸性成嗜碱性成 粒细胞熟粒细胞熟粒细胞
缺铁性贫血巨幼红细胞性贫血 再生障碍性贫血 珠蛋白生成障碍性贫血异常血红蛋白病 遗传性球形红细胞增多症遗传性椭圆形红细胞增多症遗传性口形红细胞增多症 葡萄糖-6-磷酸脱氢酶缺乏症丙酮酸激酶缺乏症 阵发性睡眠性血红蛋白尿症自身免疫性溶血性贫血冷凝集素综合征 高铁血红蛋白症硫化血红蛋白症 真性红细胞增多症 白细胞减少症中性粒细胞减少症和粒细胞缺乏症传染性单核细胞增多症 急性微分化性白血病(M0)急性粒细胞白血病未分化性(M1) 急性粒细胞白血病部分分化性(M2a) M2b
(M2b)急性颗粒增多的早幼粒细胞白血病(M3a) M3b 急性粒-单核细胞白血病(M4a M4b M4c M4EO) 急性单核细胞白血病(M5a) M5b
造血干细胞的研究进展
造血干细胞的研究进展 常灏 (中央民族大学 生命与环境科学学院 生物科学 北京 100081)? 摘要 干细胞研究是一门新兴的学科。经过50多年的努力,造血干细胞的研究已经成为当今生物医学领域中发展最快的领域。文章从造血干细胞的生物学特征入手,介绍了造血干细胞的来源、分离纯化和检测方法、以及“可塑性”等方面的研究情况,并详细说明了一些主要的造血干细胞表面标志。最后,着重阐述了造血干细胞在干细胞移植、细胞治疗和基因治疗等方面的临床应用和前景。 关键词 干细胞 造血干细胞 表面标志 造血干细胞移植 基因治疗 引言 造血干细胞是发现最早、研究最深入、应用最广泛的一种成体干细胞,具有自我更新和多向分化潜能。从造血干细胞的生物学特征、来源、分离纯化和检测方法、“可塑性”研究,以及造血干细胞的临床应用等方面,概述了造血干细胞的研究进展,并对造血干细胞的表面标志和造血干细胞移植做了较为详细的阐述。从而使读者对造血干细胞的研究情况有一个整体的了解。 1 造血干细胞的生物学特征 目前,大多数生物学家和医学家认为,干细胞是来自于胚胎、胎儿或成体内具有在一定条件下无限制自我更新与增殖分化能力的一类细胞,能够产生表现型与基因型和自己完全相同的子细胞,也能产生组成机体组织、器官的已特化的细胞,同时还能分化为祖细胞。[1] 造血干细胞(Hematopoietic Stem Cell,HSC)是一小群具有高度的自我复制和多向分化潜能的最原始的造血细胞。[1]这就是说,造血干细胞具有两个重要的特征:其一,高度的自我更新或自我复制能力;其二,可分化生成所有类型的血细胞。[2]在发生学上,造血干细胞属于成体干细胞的一种。又因其可分化出至少12种血细胞,所以造血干细胞是一种多能的干细胞。 正常情况下,造血干细胞经过不对称性有丝分裂形成两个子代细胞。其中一个仍维持造血干细胞的全部特征,即自我更新(self-renewal)。自我更新使得干细胞池的大小(干细胞数量)和质量维持不变,因而又称为自我维持(self-maintenance)。另一个子细胞可能由于基因表达模式发生改变而使得细胞特征出现变化,从而逐步走上分化的道路。现已知道,造血干细胞不是纯一的细胞群体,而是由不同年龄等级的干细胞组成。这些不同年龄等级的干细胞的表面抗原、免疫表型和粘附分子的表达不一,生物学特性也有一定的差异。[3] 2 造血干细胞的来源 胚胎造血与出生后的较单一、固定的骨髓造血不同,它伴随着生长发育而不断变换造血部位。一般认为,随着胚胎发育过程中造血中心的转移,其造血过程相继分为三个阶段,即胚胎外造血期——卵黄囊造血期(人胚第13~16天)、胎肝造血期(人胚第6周至第5个月)和骨髓造血期(胚胎第四4个月开始至终生)。但有学者认为成体造血干细胞来源于胚胎的背主动脉区,因为能够重建成体各系造血的造血干细胞最早出现在鼠胚第10天的主动脉-性腺-中肾(AGM)区。而卵黄囊只是一种一过性的造血组织,不是胚胎发育过程中的第一个造血中心。至于骨髓造血干细胞,有人认为其来源于胎肝造血干细胞的迁移,也有人认为其来源于上述的AGM区,目前尚无定论。[2] 3 研究造血干细胞的技术 3.1 造血干细胞的表面标志 造血干细胞在细胞大小上类似于小淋巴细胞,细胞密度一般小于1. 066g/ml。[4]因此,至今仍不能单纯从形态学上来识别造血干细胞。而要对造血干细胞进行研究,首先必须能把它从造血组织中分离出来。最常用的方法就是利用造血干细胞表面的标志蛋白对其进行分离。 3.1.1 表面标志 人的造血干细胞表面标志包括CD34+、CD38-、Li n-、Thy-1+、Sca-1+、HLA-DR+、LFA-1+、CD45RA ?指导教师:王斌 Tutor: Wang Bin
造血干细胞的研究现状
造血干细胞的研究现状 造血干细胞的研究现状简介 造血干细胞(Hematopoietic Stem Cell,HSC)是一种成体干细胞,是具有高度自我更新能力和多向分化潜能的造血前体细胞,属于多能干细胞。造血干细胞主要来源于三个渠道:骨髓、外周血和脐带血。一般可将血细胞的生成过程划分为三个阶段:造血干细胞、造血祖细胞和在形态上可以辨认的各种幼稚血细胞。造血干细胞采用不对称的分裂方式,平均每57天分裂一次。它一方面可以再生,另一方面可以分化成髓红系干细胞和淋巴系干细胞,后两者又能分别分化成红细胞、巨核细胞、淋巴细胞、树突状细胞、NK细胞、粒细胞等一系列血细胞。造血系统不同阶段受不同基因表达调控,造血分化也受到若干个随机细胞因子的调控。 造血干细胞的生物学特征?:(一)自我更新和自我维持能力:正常情况下,造血干细胞经过不对称有丝分裂形成两个子代细胞,其中一个仍保持造血干细胞的全部特征,这称为造血干细胞的自我更新或自我维持。自我更新使造血干细胞的数量和质量维持不变。另一个子细胞在有丝分裂过程中特征发生改变,逐渐走向分化的途径,维持循环的各种血细胞的数量。(二)高度增殖潜能:在骨髓中,造血干细胞大约仅占骨髓0.05%,且大多数处于G0期。由于放、化疗造成造血细胞明显减少或在某些动员剂的作用下,造血干细胞能大量分裂,从而有更多的造血干细胞进入分裂周期。(三)多向分化潜能:造血干细胞不仅能分化为各系统的血细胞系,还具有可塑性,可向某些非造血细胞转化,如神经细胞、骨骼肌细胞、肝脏细胞、血管内皮细胞以及多种组织的上皮细胞等。造血干细胞的表面标志主要有CD34抗原、CD38抗原、CD90抗原、CD117抗原、Sca1抗原和AC133抗原等,其中CD34是分离纯化造血干细胞的主要标志。利用这些表面标志,可将造血干细胞从造血组织中分离出来,进行研究。
