氨基酸及保护基结构
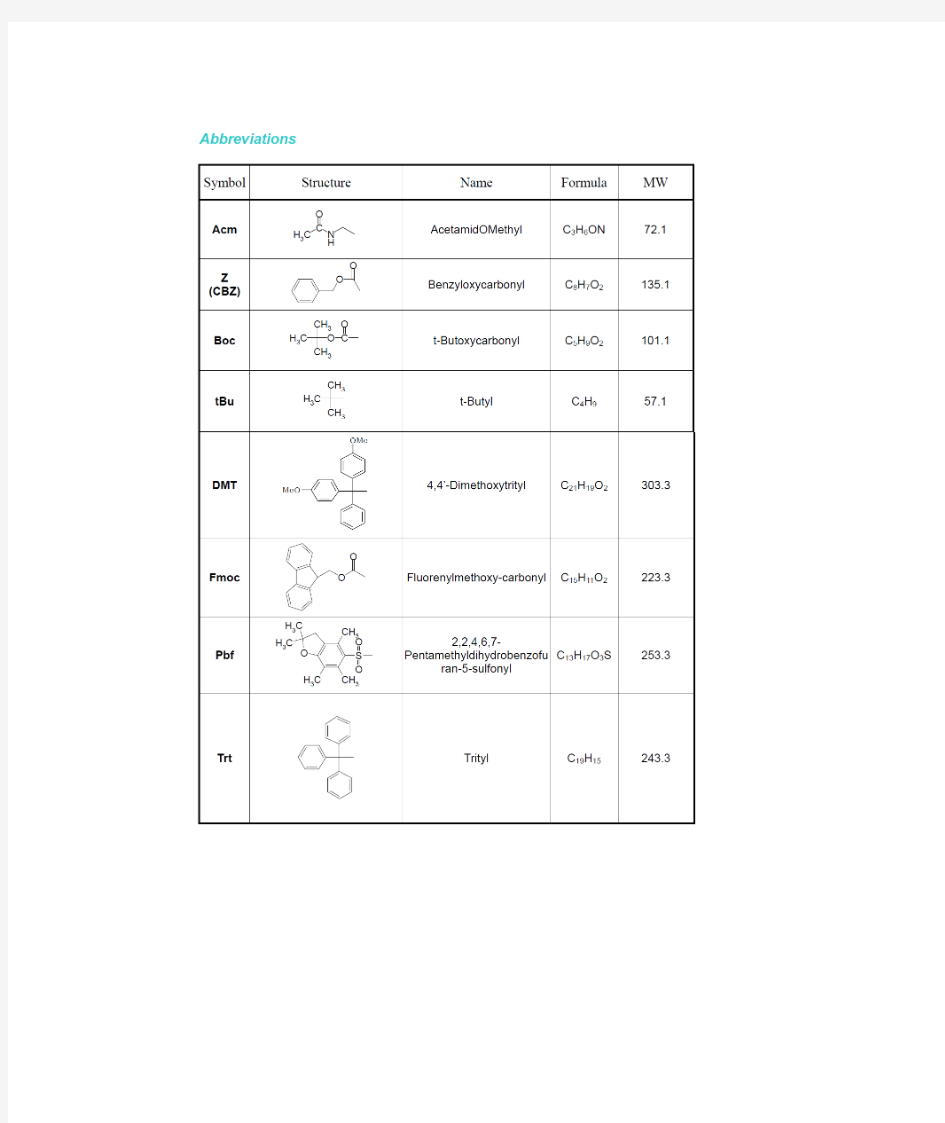
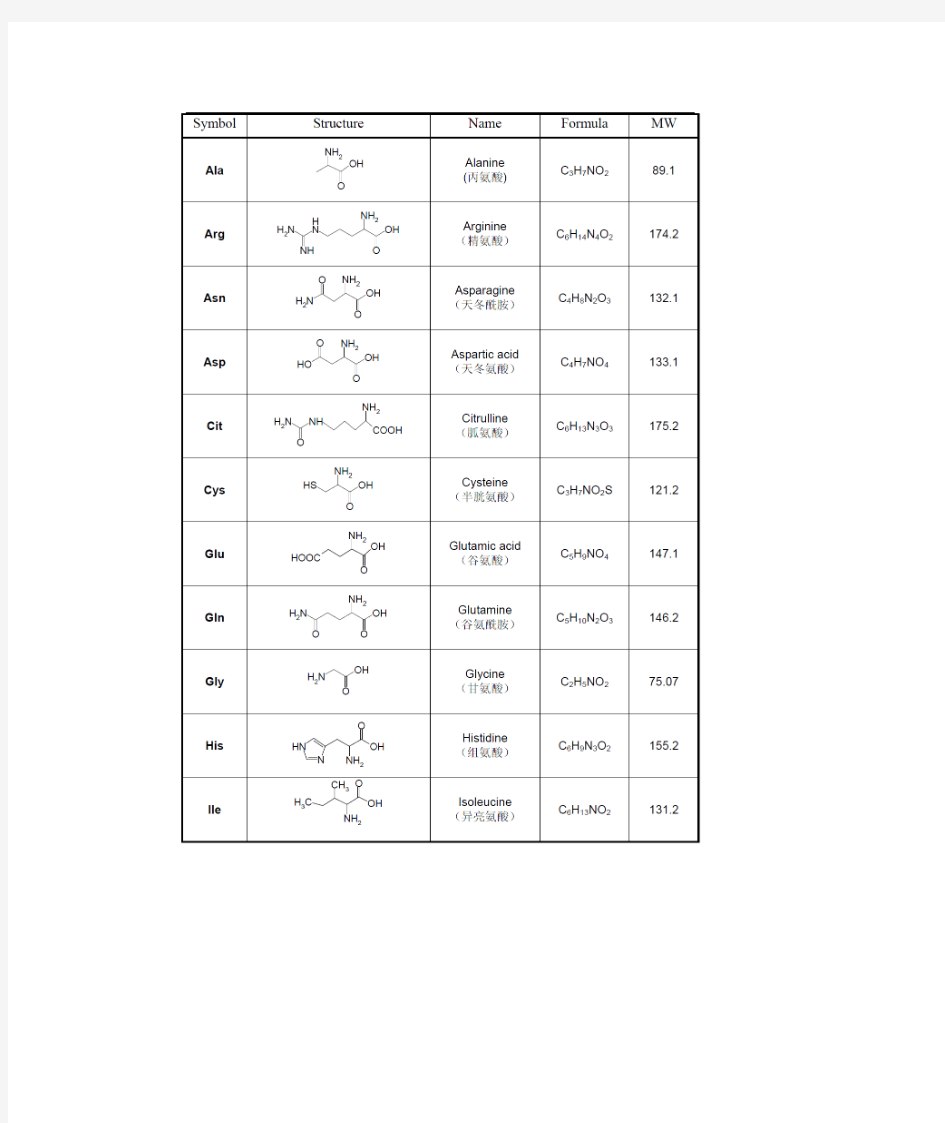
20种常见氨基酸的名称和结构式
20种常见氨基酸的名称和结构式 名称英文缩写结构式 非极性氨基酸 甘氨酸Glycine Gly G CH2COO NH3 丙氨酸Alanine Ala A CH COO NH3 CH3 亮氨酸* Leucine Leu L CHCOO NH3 (CH3)2CHCH2 异亮氨酸* Isoleucine Ile I CHCOO NH3 CH3CH2CH CH3 缬氨酸* Valine Val V CHCOO NH3 (CH3)2CH 脯氨酸Proline Pro P COO N H H 苯丙氨酸* Phenylalanine Phe F CHCOO NH3 CH2 蛋(甲硫)氨酸* Methionine Met M CHCOO NH3 CH3SCH2CH2 色氨酸*Tryptophan Trp W N CH2CH COO NH3 H 非电离的极性氨基酸 丝氨酸Serine Ser S CHCOO NH3 HOCH2
谷氨酰胺 Glutamine Gln Q CH 2CH 2CHCOO NH 3H 2N C O 苏氨酸* Threonine Thr T CHCOO NH 3 CH 3CH OH 半胱氨酸 Cysteine Cys C CHCOO NH 3HSCH 2 天冬酰胺 Asparagine Asn N CH 2CHCOO NH 3H 2N C O 酪氨酸 Tyrosine Tyr Y CHCOO NH 3CH 2HO 酸性氨基酸 天冬氨酸 Aspartic acid Asp D 3HOOCCH 2CHCOO 谷氨酸 Glutamic acid Glu E CHCOO NH 3HOOCCH 2CH 2 碱性氨基酸 赖氨酸* Lysine Lys K CHCOO NH 2CH 2CH 2CH 2CH 2NH 3 精氨酸 Arginine Arg R H 2N C CHCOO NH 2NHCH 2CH 2CH 2NH 2 组氨酸 Histidine His H N CH 2CH COO NH 3N * 为必需氨基酸
氨基酸的侧链保护基团.doc
氨基酸的侧链保护基团 氨基酸 侧链官能团 保护基 保护基结构式 保护基脱除条件 Asp/ Glu OH O OtBu O O 90%TFA ,30min OAll O O Pb(Ph 3P)4-AcOH-NMM ;Pb(Ph 3P)4-PhSiH 3 in DCM , 10-30min Asn/ Gln NH 2O Trt N H 90%TFA ,30-60min Cys SH Trt S 90%TFA ,30-60min Acm S N H O Hg(Ⅱ);Ag(Ⅰ); Tl(Ⅲ); Ph (SO )Ph-CH 3SiCl 3 tBu S HF (20℃);Hg(Ⅱ); Ph (SO )Ph-CH 3SiCl 3 StBu S S RSH ,Bu 3P Other reducing agents
Mmt 0.5-1%TFA in DCM-TES (95:5),30min ; 3%TFA ,5-10min Tmob MeO OMe OMe 5%TFA-3% TES in DCM His NH N τπ Trt N τ 50%TFA in DCM ,30min Lys/ Orn NH 2 Boc N H O 90%TFA ,30-60min Alloc O N H O Pb(Ph 3P)4(0.1eq )-PhSiH 3 (24eq )in DCM ,10min Mtt N H 1%TFA in DCM ,30min ; AcOH-TFE-DCM(1:2:7) Dde 2%水合肼 in DMF , 5-10min Ser/ OH tBu O 90%TFA ,30min
2021年二十种氨基酸结构式
20种常见氨基酸的名称和结构式 欧阳光明(2021.03.07) 名称中文缩 写 英文缩写结构式 非极性氨基酸 甘氨酸(a氨基乙酸) Glycine 甘Gly G 丙氨酸(a氨基丙酸) Alanine 丙Ala A 亮氨酸(g甲基a氨基戊酸)* Leucine 亮Leu L 异亮氨酸(b甲基a氨基戊酸)* Isoleucine 异亮Ile I 缬氨酸(b甲基a氨基丁酸)* Valine 缬Val V 脯氨酸(a四氢吡咯甲酸) Proline 脯Pro P 苯丙氨酸(b苯基a氨基丙酸)* Phenylalanine 苯丙Phe F 蛋(甲硫)氨酸(a氨基g甲硫基戊酸) * Methionine 蛋Met M
色氨酸[a氨基b(3吲哚基)丙酸]* 色Trp W Tryptophan 非电离的极性氨基酸 丝氨酸(a氨基b羟基丙酸) 丝Ser S Serine 谷氨酰胺(a氨基戊酰胺酸) 谷胺Gln Q Glutamine 苏氨酸(a氨基b羟基丁酸)* 苏Thr T Threonine 半胱氨酸(a氨基b巯基丙酸) 半胱Cys C Cysteine 天冬酰胺(a氨基丁酰胺酸) 天胺Asn N Asparagine 酪氨酸(a氨基b对羟苯基丙酸) 酪Tyr Y Tyrosine 酸性氨基酸 天冬氨酸(a氨基丁二酸) 天Asp D Aspartic acid 谷氨酸(a氨基戊二酸) 谷Glu E Glutamic acid 碱性氨基酸
赖氨酸(a,w二氨基己酸)* 赖Lys K Lysine 精氨酸(a氨基d胍基戊酸) 精Arg R Arginine 组氨酸[a氨基b(4咪唑基)丙酸] 组His H Histidine
20种氨基酸的缩写
20种氨基酸缩写,结构,特性,记忆口诀 体内20种氨基酸按理化性质可分为4组: ①非极性、疏水性氨基酸:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸和脯氨酸。 ②极性、中性氨基酸:色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺和苏氨酸。 ③酸性的氨基酸:天冬氨酸和谷氨酸。 ④碱性氨基酸:赖氨酸、精氨酸和组氨酸。 中文名称英文名称三字母缩写单字母符号 甘氨酸Glyc ine Gly G 丙氨酸Ala nine Ala A 缬氨酸Vali ne Val V 亮氨酸Leuc ine Leu L
异亮氨酸 Isoleuc ine Ile I 脯氨酸 Proli ne Pro P 苯丙氨酸 Pheny lala nine Phe F 酪氨酸 Tyros ine Tyr Y 色氨酸 Tryptophan Trp W 丝氨酸 Seri ne Ser S 苏氨酸 Thre onine Thr T 1 半胱氨酸 1 Cyst ine Cys C 蛋氨酸 Methio nine Met M 天冬酰胺 Asp arag ine Asn N 谷氨酰胺 Glutarni ne Gin Q
速记氨基酸英文缩写 2008-08-20 14:27 氨基酸记忆口诀 1、必须氨基酸:携一本蛋色书来[缬氨酸,异亮(亮)氨酸,苯丙
2、半必须氨基酸:半斤组[精(斤)氨酸,组氨酸] 3、含硫氨基酸:硫甲硫,胱半胱[甲硫氨酸,半胱氨酸,胱氨酸] 4、芳香族氨基酸:老芳本色[酪氨酸,苯丙氨酸,色氨酸] 5、支链氨基酸:支姐,亮一亮[缬氨酸,亮氨酸,异亮氨酸] 6、非极性疏水性氨基酸:非姐,脯亮一亮,(给你)本饼干[缬氨 7、酸性氨基酸:酸谷天(三伏天)[谷氨酸,天冬氨酸]
20种常见氨基酸的名称、结构及分类
20种常见氨基酸的名称和结构式 名称中文英文缩写结构式等电点非极性氨基酸 丙氨酸 (α-氨基丙酸) Alanine 丙Ala A CH COO NH3 CH3 6.02 缬氨酸 (β-甲基-α-氨基丁酸) *Valine 缬Val V CHCOO NH3 (CH3)2CH 5.97 亮氨酸 (γ-甲基-α-氨基戊酸) *Leucine 亮Leu L CHCOO NH3 (CH3)2CHCH2 5.98 异亮氨酸 (β-甲基-α-氨基戊酸) *Isoleucine 异亮Ile I CHCOO NH3 CH3CH2CH CH3 6.02 苯丙氨酸 (β-苯基-α-氨基丙酸) *Phenylalanine 苯丙Phe F CHCOO NH3 CH2 5.48 色氨酸 [α-氨基-β-(3-吲哚基)丙 酸] *Tryptophan 色Trp W N CH2CH COO NH3 H 5.89 蛋(甲硫)氨酸 (α-氨基-γ-甲硫基戊酸) *Methionine 蛋 (甲硫) Met M CHCOO NH3 CH3SCH2CH2 5.75 脯氨酸 (α-四氢吡咯甲酸) Proline 脯Pro P COO N H H 6.30 非电离的极性氨基酸 甘氨酸 (α-氨基乙酸) Glycine 甘Gly G CH2COO NH3 5.97 丝氨酸 (α-氨基-β-羟基丙酸) Serine 丝Ser S CHCOO NH3 HOCH2 5.68 苏氨酸 (α-氨基-β-羟基丁酸) *Threonine 苏Thr T CHCOO NH3 CH3CH OH 6.53
半胱氨酸 (α-氨基-β-巯基丙酸) Cysteine 半胱Cys C CHCOO NH3 HSCH2 5.02 酪氨酸 (α-氨基-β-对羟苯基丙 酸) Tyrosine 酪Tyr Y CHCOO NH3 CH2 HO 5.66 天冬酰胺 (α-氨基丁酰胺酸) Asparagine 天胺Asn N CH2CHCOO NH3 H2N C O 5.41 谷氨酰胺 (α-氨基戊酰胺酸) Glutamine 谷胺Gln Q CH2CH2CHCOO NH3 H2N C O 5.65 碱性氨基酸组氨酸 [α-氨基-β-(4-咪唑基)丙 酸] Histidine 组His H N CH2CH COO NH3 H N7.59 赖氨酸 (α,ω-二氨基己酸) *Lysine 赖Lys K CHCOO NH2 CH2CH2CH2CH2 NH39.74 精氨酸 (α-氨基-δ-胍基戊酸) Arginine 精Arg R H 2 N C CHCOO NH2 NHCH2CH2CH2 NH210.76 酸性氨基酸天冬氨酸 (α-氨基丁二酸) Aspartic acid 天冬Asp D NH3 HOOCCH2CHCOO 2.97 谷氨酸 (α-氨基戊二酸) Glutamic acid 谷Glu E CHCOO NH3 HOOCCH2CH2 3.22 带“*”为必需氨基酸
氨基酸的保护
保护氨基酸:是指氨基酸的功能基团与其它基团反应而封闭了氨基酸功能基 团活性的氨基酸衍生物,都能叫保护氨基酸。包括a氨基和羧基,以及侧链功能基团。 氨基保护基的选择策略: 选择一个氨基保护基时,必须仔细考虑到所有的反应物,反应条件及所设计的反应过程中会涉及的底物中的官能团。 最好的是不保护. 若需要保护,选择最容易上和脱的保护基,当几个保护基需要同时被除去时,用相同的保护基来保护不同的官能团是非常有效。要选择性去除保护基时,就只能采用不同种类的保护基。 要对所有的反应官能团作出评估,确定哪些在所设定的反应条件下是不稳定并需要加以保护的,选择能和反应条件相匹配的氨基保护基。 还要从电子和立体的因素去考虑对保护的生成和去除速率的选择性 如果难以找到合适的保护基,要么适当调整反应路线使官能团不再需要保护或使原来在反应中会起反应的保护基成为稳定的;要么重新设计路线,看是否有可能应用前体官能团(如硝基等);或者设计出新的不需要保护基的合成路线。 Ⅰ氨基酸的保护基(保护羧基) (一)叔丁基tBu - (tert-butyl) ester 标准保护程序: 在N-保护的氨基酸的溶液中,加入DMAP(0.5当量)和叔丁醇(1.2当量)在干燥的DCM (DCM是一氧化二碳?),0℃在惰性气氛下,加入EDCI(1.1当量),并搅拌2小时。然后将混合物在室温下,搅拌直到TLC通过(通常是14小时),在真空下浓缩。将残余物再溶解在乙酸乙酯中,用水萃取两次,然后用饱和碳酸氢钠水溶液萃取两次。将有机溶液干燥(硫酸镁)并真空浓缩。如果必要将残留物通过快速色谱法(SiO)纯化。 脱保护: 将该化合物溶解在甲酸中在室温下搅拌直至反应完成(TLC通过)(通常是12小时)。然后将溶液浓缩,并重复加入甲苯浓缩数次。如有必要,可以将所得残余物通过快速色谱法(SiO)进行纯化。 (二)苄基Bn - (benzyl) ester 标准保护程序: 氨基酸在惰性气氛下搅拌用无水THF和O的苄基N,N'-diisopropylisourea(见文献进行合成)在室温下,直到完成通过TLC(通常为2天)。将混合物冷却至-20℃,并过滤。将滤液真空浓缩,并在必要时通过快速色谱法(SiO)纯化。 去除 氨基酸衍生物溶解在1:1的甲醇:叔丁醇和Pd(OH)2-C在氢气气氛下加入。将混合物搅拌,直到完全通过TLC(通常>3小时),然后过滤并浓缩。将所得残余物然后可以通过快
20种常见氨基酸的名称和结构式
20种常见氨基酸的名称和结构式 名称中文 缩写 英文缩写结构式 非极性氨基酸 甘氨酸Glycine 甘Gly G CH2COO NH3 丙氨酸Alanine 丙Ala A CH COO NH3 CH3 亮氨酸* Leucine 亮Leu L CHCOO NH3 (CH3)2CHCH2 异亮氨酸* Isoleucine 异亮Ile I CHCOO NH3 CH3CH2CH CH3 缬氨酸* Valine 缬Val V CHCOO NH3 (CH3)2CH 脯氨酸Proline 脯Pro P COO N H H 苯丙氨酸* Phenylalanine 苯丙Phe F CHCOO NH3 CH2 蛋(甲硫)氨酸* Methionine 蛋Met M CHCOO NH3 CH3SCH2CH2
色氨酸* Tryptophan 色Trp W N CH2CH COO NH3 H 非电离的极性氨基酸 丝氨酸Serine 丝Ser S CHCOO NH3 HOCH2 谷氨酰胺Glutamine 谷胺Gln Q CH2CH2CHCOO NH3 H2N C O 苏氨酸* Threonine 苏Thr T CHCOO NH3 CH3CH OH 半胱氨酸Cysteine 半胱Cys C CHCOO NH3 HSCH2 天冬酰胺Asparagine 天胺Asn N CH2CHCOO NH3 H2N C O 酪氨酸Tyrosine 酪Tyr Y CHCOO NH3 CH2 HO 酸性氨基酸 天冬氨酸Aspartic acid 天Asp D NH3 HOOCCH2CHCOO 谷氨酸Glutamic acid 谷Glu E CHCOO NH3 HOOCCH2CH2
氨基酸保护
Carboxylic acid protection - [Bn ester] [Pfp ester] [Me ester] [Allyl ester] [tButyl ester] [PMB ester] [MEM ester] Amine protection (carbamates) - [Fmoc] [Boc] [Cbz] [Troc] Side Chain protections- [Boc] t Bu - (tert-butyl) ester Standard Protection Procedure To a solution of the N-protected amino acid, DMAP (0.5 eq), and tBuOH (1.2 eq) in dry DCM at 0° under an inert atmosphere, is added EDCI (1.1. eq) and stirred for 2 h. The mixture is then stirred at room temperature until complete by TLC (usually 14 h) and concentrated in vacuo. The residue is redissolved in ethyl acetate and extracted twice with water, then twice with aqueous saturated sodium bicarbonate. The organic solution is dried (magnesium sulfate) and concentrated in vacuo. The residue is purified by flash chromatography (SiO2) if necessary. Removal
二十种氨基酸结构式教学内容
20种常见氨基酸的名称和结构式 中文缩 名称 英文缩写结构式 写 非极性氨基酸 甘氨酸(α-氨基乙酸) 甘Gly G Glycine 丙氨酸(α-氨基丙酸) 丙Ala A Alanine 亮氨酸(γ-甲基-α-氨基戊酸)* 亮Leu L Leucine 异亮氨酸(β-甲基-α-氨基戊酸)* 异亮Ile I Isoleucine 缬氨酸(β-甲基-α-氨基丁酸)* 缬Val V Valine 脯氨酸(α-四氢吡咯甲酸) 脯Pro P Proline 苯丙氨酸(β-苯基-α-氨基丙酸)* 苯丙Phe F Phenylalanine 蛋(甲硫)氨酸(α-氨基-γ-甲硫基戊酸) * 蛋Met M Methionine
色氨酸[α-氨基-β-(3-吲哚基)丙酸]* 色Trp W Tryptophan 非电离的极性氨基酸 丝氨酸(α-氨基-β-羟基丙酸) 丝Ser S Serine 谷氨酰胺(α-氨基戊酰胺酸) 谷胺Gln Q Glutamine 苏氨酸(α-氨基-β-羟基丁酸)* 苏Thr T Threonine 半胱氨酸(α-氨基-β-巯基丙酸) 半胱Cys C Cysteine 天冬酰胺(α-氨基丁酰胺酸) 天胺Asn N Asparagine 酪氨酸(α-氨基-β-对羟苯基丙酸) 酪Tyr Y Tyrosine 酸性氨基酸 天冬氨酸(α-氨基丁二酸) 天Asp D Aspartic acid
谷氨酸(α-氨基戊二酸) 谷Glu E Glutamic acid 碱性氨基酸 赖氨酸(α,ω-二氨基己酸)* 赖Lys K Lysine 精氨酸(α-氨基-δ-胍基戊酸) 精Arg R Arginine 组氨酸[α-氨基-β-(4-咪唑基)丙酸] 组His H Histidine
20种氨基酸缩写,结构,特性,记忆口诀
20种氨基酸缩写,结构,特性,记忆口诀
速记氨基酸英文缩写 2008-08-20 14:27 氨基酸记忆口诀 1、必须氨基酸:携一本蛋色书来[缬氨酸,异亮(亮)氨酸,苯丙氨酸,蛋氨酸,色氨酸(甲硫氨酸),苏氨酸,赖氨酸,] 2、半必须氨基酸:半斤组[精(斤)氨酸,组氨酸] 3、含硫氨基酸:硫甲硫,胱半胱[甲硫氨酸,半胱氨酸,胱氨酸] 4、芳香族氨基酸:老芳本色[酪氨酸,苯丙氨酸,色氨酸] 5、支链氨基酸:支姐,亮一亮[缬氨酸,亮氨酸,异亮氨酸] 6、非极性疏水性氨基酸:非姐,脯亮一亮,(给你)本饼干[缬氨酸,脯氨酸,亮氨酸,异亮氨酸,苯丙氨酸,丙氨酸,甘氨酸]
7、酸性氨基酸:酸谷天(三伏天)[谷氨酸,天冬氨酸] 8、碱性氨基酸:碱组精赖[组氨酸,精氨酸,赖氨酸] 9、生糖氨基酸:姐,天天,哭哭(谷谷),脯(羟)脯,(要吃)半斤组蛋饼(和)钢丝[缬氨酸,天冬氨酸,天冬酰氨,谷氨酸,谷氨酰氨,脯(羟)脯氨酸,半胱氨酸,精氨酸,组氨酸,蛋氨酸,丙氨酸,甘氨酸,丝氨酸] 10、生酮氨基酸:酮赖亮[赖氨酸,亮氨酸] 11、生糖兼生酮氨基酸:一本老色书[异亮氨酸,苯丙氨酸,酪氨酸,色氨酸,苏氨酸] 12、生成一碳单位氨基酸:一组色钢丝[组氨酸,色氨酸,甘氨酸,丝氨酸] 生物化学 人体八种必须氨基酸(第一种较为顺口) 1.“一两色素本来淡些”(异亮氨酸、亮氨酸、色氨酸、苏氨酸、苯丙氨酸、赖氨酸、蛋氨酸、缬氨酸)。 2.“写一本胆量色素来”(缬氨酸、异亮氨酸、苯丙氨酸、蛋氨酸、亮氨酸、色氨酸、苏氨酸、赖氨酸)。 3.鸡旦酥,晾(亮)一晾(异亮),本色赖。 生糖、生酮、生糖兼生酮氨基酸: 生酮+生糖兼生酮=“一两色素本来老”(异亮氨酸、亮氨酸、色氨酸、苏氨酸、苯丙氨酸、赖氨酸、酪氨酸),其中生酮氨基酸为“亮赖”;除了这7个氨基酸外,其余均为生糖氨基酸。 酸性氨基酸: 天谷酸——天上的谷子很酸,(天冬氨酸、谷氨酸); 碱性氨基酸: 赖精组——没什么好解释的,(Lys、Arg、His)。 芳香族氨基酸在280nm处有最大吸收峰 色老笨---只可意会不可言传,(色氨酸、酪氨酸、苯丙氨酸),顺序一定要记清,色>酪>苯丙
醚氨基及氨基酸的各种保护基及去保护方法大全
醚、氨基及氨基酸的各种保护基及去保护方法大全 (整理有详细操作) [Acetate] [Benzoatel] [Pivaloate] [Levulinate] [Back to Carb. Synthesis] Ac - (acetate) ester Standard Protection Procedure To a solution of the glycoside in dry pyridine (25 eq) under an inert atmosphere at room temperature, acetic anhydride (10 eq) is added and stirred until complete by TLC (usually 16 h). The reaction mixture is then poured into ice/water and extracted three times with chloroform. The combined organic layers are extracted with 3% HCl, saturated aqueous sodium bicarbonate, and water. The organic layer is then dried and concentrated in vacuo. The resulting residue is purified by flash chromatography (SiO2) if necessary. Removal
The glycoside is dissolved in methanol and a solution of sodium methoxide in methanol (0.1 eq per -OAc) is added drop wise at 0°. The solution is warmed to room temperature and stirred under an inert atmosphere until complete by TLC (usually within a few hours). Amberlite cationic exchange resin is then added with vigorous stirring until the pH of the mixture is neutral. The mixture is then filtered and concentrated. The resulting residue is purified by flash chromatography (SiO2) if necessary. OR The Glycoside is dissolved in methanol and hydrazine hydrate (15 eq per -OAc) is added in two portions over 1.5 hours. The solution is stirred at room temperature under an inert atmosphere until complete by TLC (usually 6 hours). The solution is then neutralized with glacial acetic acid. The mixture is filtered through celite and concentrated. The resulting residue is purified by flash chromatography (SiO2) if necessary. References J. Org. Chem., 1996, 61, 6442-6445. "Synthetic Methods for Carbohydrates" Lemieux, Ch 6, pg. 90-115. J. Chem. Soc., Perkin Trans. 1, 1996, 985-993.
生物体内20种氨基酸的分子结构及英文缩写
生物体内20种氨基酸的分子结构及英文缩写 20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。通常根据R基团的化学结构或性质将20种氨基酸进行分类。 根据侧链基团的极性分类 1.非极性氨基酸:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸 2.极性氨基酸: (1)极性不带电荷氨基酸:甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺 (2)极性带正电荷的氨基酸(碱性氨基酸):赖氨酸、精氨酸、组氨酸 (3)极性带负电荷的氨基酸(酸性氨基酸):天冬氨酸、谷氨酸 根据氨基酸分子的化学结构分类 1.脂肪族氨基酸:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸、甘氨酸、丝氨酸、苏氨酸、半胱氨酸、天冬酰胺、谷氨酰胺; 2.芳香族氨基酸:苯丙氨酸、酪氨酸; 3.杂环族氨基酸:组氨酸、色氨酸; 4.杂环亚氨基酸:脯氨酸; 从营养学的角度分类 1.必需氨基酸( essential amino acid ) 指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给的氨基酸。成人必需氨基酸的需要量约为蛋白质需要量的20%~37%。共有8种,其作用分别是: 赖氨酸:促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化。 色氨酸:促进胃液及胰液的产生。 苯丙氨酸:参与消除肾及膀胱功能的损耗。 甲硫氨酸:参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能。 苏氨酸:有转变某些氨基酸达到平衡的功能。
异亮氨酸:参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺。 亮氨酸:作用平衡异亮氨酸。 缬氨酸:作用于黄体、乳腺及卵巢。 2.半必需氨基酸和条件必需氨基酸 精氨酸:精氨酸与脱氧胆酸制成的复合制剂(明诺芬)是主治梅毒、病毒性黄疸等病的有效药物。 组氨酸:可作为生化试剂和药剂,还可用于治疗心脏病,贫血,风湿性关节炎等的药物。 人体虽能够合成精氨酸和组氨酸,但通常不能满足正常的需要,因此,又被称为半必需氨基酸或条件必需氨基酸,在幼儿生长期这两种是必需氨基酸。人体对必需氨基酸的需要量随着年龄的增加而下降,成人比婴儿显著下降。 3.非必需氨基酸( nonessentialamino acid ) 指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。例如甘氨酸、丙氨酸等。
20种常见氨基酸的名称和结构式
20种氨基酸缩写 体内20种氨基酸按理化性质可分为4组: ①非极性、疏水性氨基酸:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸和脯氨酸。 ②极性、中性氨基酸:色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺和苏氨酸。 ③酸性的氨基酸:天冬氨酸和谷氨酸。 ④碱性氨基酸:赖氨酸、精氨酸和组氨酸。 中文名称英文名称三字母缩写单字母符号 甘氨酸Glycine Gly G 丙氨酸Alanine Ala A 缬氨酸Valine Val V 亮氨酸Leucine Leu L 异亮氨酸Isoleucine Ile I 脯氨酸Proline Pro P 苯丙氨酸Phenylalanine Phe F 酪氨酸Tyrosine Tyr Y 色氨酸Tryptophan Trp W 丝氨酸Serine Ser S 苏氨酸Threonine Thr T 半胱氨酸Cystine Cys C 蛋氨酸Methionine Met M 天冬酰胺Asparagine Asn N 谷氨酰胺Glutarnine Gln Q 天冬氨酸Asparticacid Asp D 谷氨酸Glutamicacid Glu E 赖氨酸Lysine Lys K 精氨酸Arginine Arg R 组氨酸Histidine His H 氨基酸单字母表示法和三字母表示法不一致的: 苯丙氨酸:笨——F ool……F 赖氨酸:赖皮——砍(K an)他……K 精氨酸:精子——人(R en)……R 色氨酸:色狼——W olf……W 酪氨酸:奶酪——黄色(Y ellow)……Y 天冬氨酸:天——地(D i)……D 谷氨酸:谷子里面有很多酶——E nzyme……E 天冬酰胺:As n……N Asp/Asn:两个A加一块= B Glu/Gln:总是低人一头,排老末吧:Z 谷氨酰胺:Gln,虽然也是n, 无奈总排在“天冬”的后面,只好整个不一样的Q
氨基保护方法
氨基保护方法 胺类化合物对氧化和取代等反应都很敏感,为了使分子其它部位进行反应时氨基保持不变,通常需要用易于脱去的基团对氨基进行保护。例如,在肽和蛋白质的合成中常用氨基甲酸酯法保护氨基,而在生物碱及核苷酸的合成中用酰胺法保护含氮碱基。化学家们在肽的合成领域内,对已知保护基的相对优劣进行了比较并在继续寻找更有效的新保护基。除了肽的合成外,这些保护基在其它方面也有很多重要应用。 下面介绍保护氨基的一些主要方法和基团。 1 形成酰胺法 将胺变成取代酰胺是一个简便而应用非常广泛的氨基保护法。单酰基往往足以保护一级胺的氨基,使其在氧化、烷基化等反应中保持不变,但更完全的保护则是与二元酸形成的环状双酰化衍生物。常用的简单酰胺类化合物其稳定性大小顺序为甲酰基<乙酰基< 苯甲酰基。 酰胺易于从胺和酰氯或酸酐制备,并且比较稳定,传统上是通过在强酸性或碱性溶液中加热来实现保护基的脱除。由于若干基质,包括肽类、核苷酸和氨基糖,对这类脱除条件不稳定,故又研究出了一些其他脱除方法,其中有甲酰衍生物的还原法,甲酰基以及对羟苯基丙酰基衍生物的氧化法,苯酰基和对羟苯基丙酰基衍生物的电解法,卤代酰基、乙酰代乙酰基以及邻硝基、氨基、偶氮基或苄基衍生物等“辅助脱除法”,等等。 为了保护氨基,已经制备了很多N2酰基衍生物,上述的简单酰胺最常用,卤代乙酰基衍生物也常用。这些化合物对于温和的酸水解反应的活性随取代程度的增加而增加:乙酰基< 氯代乙酰基< 二氯乙酰基< 三氯乙酰基< 三氟乙酰基。此外,在核苷酸合成的磷酸化反应中,胞嘧啶、腺嘌呤和鸟嘌呤中的氨基是分别由对甲氧苯酰基、苯酰基和异丁酰或甲基丁酰基予以保护的,这些保护基是通过氨解脱除的。另外,伯胺能以酰胺的形式加以保护,这就防止了活化的N2乙酰氨基酸经过内酯中间体发生外消旋化。 111 甲酰衍生物 胺类化合物很容易进行甲酰化反应,常常仅用胺和98 %的甲酸制备。甲酸乙酸酐也是一个有用的甲酰化试剂。对于某些容易发生消旋化的氨基酸可用甲酸和N ,N′2双环己基碳二亚胺(DCC) 在0 ℃时进行甲酰化反应,也可用酯类进行氨解。 甲酰胺类是相当稳定的化合物,因此广泛应用于肽的合成。甲酰基的脱除也有很多方法,氧化或还原法脱酰反应均可被采用。N2甲酰衍生物用15 %过氧化氢水溶液处理,可以顺利地进行氧化脱解。用氢化钠在二甲氧基乙烷中回流可以代替用酸或碱水解去除酰基。 112 乙酰基及其衍生物 胺类化合物的乙酰化或取代乙酰衍生物是用酰氯、酸酐进行酰化或在二环己基碳二亚胺(DCC) 或焦亚磷酸四乙基酯存在下,直接与酸综合加以制备,有时也可用酯或硫酯氨解的方法;制备乙酰胺另一好的方法是用胺和乙烯酮〔15〕或异丙烯乙酸酯反应。如果用双烯酮〔17〕反应,则得到的是乙酰乙酰基衍生物。 用乙酰基保护氨基比用其他保护基要多。由于它比甲酰基更稳定,因此,在进行亲电取代、硝化、卤代等反应时常选择乙酰基来保护芳香胺。乙酰胺丙二酸酯也可用于合成α2氨基酸,但在脱乙酰基时所需的酸或碱性条件,可使分子内其他
20种天然氨基酸中英对应及结构特性整理
20种氨基酸 脂肪侧链aliphatic side较大的氨基酸是疏水的氨基酸,它们在水中将簇合而不与水接触,可溶,但水溶性较差,脂溶性好。水溶性蛋白质三维结构的稳定性来自于蛋白质疏水氨基酸侧链簇合,即疏水效应。 名称英文结构特性 甘氨酸glycine/?ɡla??sin,/无手性C 丙氨酸alanine/??l??nin/ 颉氨酸valine/?v?l?in/大脂肪侧链 亮氨酸leucine/?lu?sin/大脂肪侧链 异亮氨酸isoleuc ine/?a?s??lu?sin/大脂肪侧链
甲硫氨酸 methionine/me ?θai ?ni:n/ 大脂肪侧链 脯氨酸 proline/?pro?lin/ 苯丙氨酸 phenylalanine/?f ?n ?l ??l ??nin/ 侧链有芳香环,疏水氨基酸 络氨酸 tyrosine/?ta ?r ??sin/ 色氨酸 tryptophan/?tr ?pt ??f?n/ 丝氨酸 serine/?s ?r ?in / 苏氨酸 threonine/?θri??nin/ 天冬酰胺 asparagine/??sp?r ??d ?in/ 谷氨酰胺 glutamine/?ɡlut ??min/ 酪氨酸的芳香环有一个羟基。与其他氨基酸侧链呈化学惰性相
半胱氨酸cysteine/ s?st??in/ 胱氨酸cystine/?s?s?tin/ 赖氨酸lysine/?la??sin/ 精氨酸arginine/?ɑrd???nin/ 组氨酸histidine/?h?st??din/ 天冬氨酸aspartate/??spɑrtet/ 谷氨酸glutamate/?ɡlut??met/
氨基的保护及脱保护
经典化学合成反应标准操作氨基的保护及脱保护策略 编者:彭宪 药明康德新药开发有限公司化学合成部
目录 1.氨基的保护及脱保护概要 (2) 2.烷氧羰基类 2-1. 苄氧羰基(Cbz) (4) 2-2. 叔丁氧羰基(Boc)……………………………………………… 16 2-3. 笏甲氧羰基(Fmoc) (28) 2-4. 烯丙氧羰基(Alloc)………………………………………… 34 2-5. 三甲基硅乙氧羰基(Teoc)…………………………………… 36 2-6. 甲(或乙)氧羰基…………………………………………… 40 3.酰基类 3-1. 邻苯二甲酰基(Pht)…………………………………………… 43 3-2. 对甲苯磺酰基(Tos)………………………………………… 49 3-3. 三氟乙酰基(Tfa)………………………………………… 53 4.烷基类
4-1. 三苯甲基(Trt)……………………………………………… 57 4-2. 2,4-二甲氧基苄基(Dmb)…………………………………… 63 4-3. 对甲氧基苄基(PMB) (65) 4-4. 苄基(Bn) (70)
1.氨基的保护及脱保护概要 选择一个氨基保护基时,必须仔细考虑到所有的反应物,反应条件及所设计的反应过程中会涉及的所有官能团。首先,要对所有的反应官能团作出评估,确定哪些在所设定的反应条件下是不稳定并需要加以保护的,并在充分考虑保护基的性质的基础上,选择能和反应条件相匹配的氨基保护基。其次,当几个保护基需要同时被除去时,用相同的保护基来保护不同的官能团是非常有效(如苄基可保护羟基为醚,保护羧酸为酯,保护氨基为氨基甲酸酯)。要选择性去除保护基时,就只能采用不同种类的保护基(如一个Cbz保护的氨基可氢解除去,但对另一个Boc保护的氨基则是稳定的)。此外,还要从电子和立体的因素去考虑对保护的生成和去除速率的影响(如羧酸叔醇酯远比伯醇酯难以生成或除去)。最后,如果难以找到合适的保护基,要么适当调整反应路线使官能团不再需要保护或使原来在反应中会起反应的保护基成为稳定的;要么重新设计路线,看是否有可能应用前体官能团(如硝基,亚胺等);或者设计出新的不需要保护基的合成路线。 在合成反应中,伯胺、仲氨、咪唑、吡咯、吲哚和其他芳香氮杂环中的氨基往往是需要进行保护的。已经使用过的氨基保护基很多,但归纳起来,可以分为烷氧羰基、酰基和烷基三大类。烷氧羰基使用最多,因为N-烷氧羰基保护的氨基酸在接肽时不易发生消旋化。伯胺、仲氨、咪唑、吡咯、吲哚和其他芳香氮氢都可以选择合适的保护基进行保护。下表列举了几种代表性的常用的氨基保护基。
氨基的保护
渡岸学术搜索网https://www.360docs.net/doc/b03990797.html, 繁體中文|加入收藏 首页 | 图文 | 医学 | 药学 | 生物 | 化学 | 理工 | 材料 | 经济 | 国内英语 | 检索 | IT&others | 当前位置: 首页 >> 化学 >> 有机&合成 >> 氨基的各种保护 氨基的各种保护 本文归类于: 氨基 来源:[网络搜索] 发表:2007-06-01 浏览:188188 字号:大 中 小 下载分卷附件前必看 ===氨基相关链接=== ● 氨基酸的背诵口诀 [2007/0725] ● L-8900 DATA\L8800氨基酸分析仪中文资料\L8800氨基... [2007/0404] ● 氨基酸分析仪常见问题 [2007/0403] ● 超临界流体提取氨基酸的一篇外文文献+SFE -MS 分析... [2007/0105] ● 洛美沙星注射液与3种氨基糖苷类药物配伍的稳定性 [2006/1226] 氨基的各种保护 t Bu - (tert -butyl) ester Standard Protection Procedure To a solution of the N-protected aminoacid, DMAP (0.5 eq), and tBuOH (1.2 eq) in dry DCM at 0° under an inert atmosphere, is added EDCI (1.1. eq) and stirred for 2 h. The mixture is then stirred at room temperature until complete by TLC (usually 14 h) and concentrated in vacuo . The residue is redissolved in ethyl acetate and extracted twice with water, then twice with aqueous saturated sodium bicarbonate. The organic solution is dried (magnesium sulfate) and concentrated in vacuo . The residue is purified by flash chromatography (SiO 2) if necessary. Removal The compound is dissolved in formic acid and stirred at room temperature until the reaction is complete by TLC (usually 12 hours). The solution is then concentrated and coconcentrated several times with toluene. The resulting residue can then be purified by flash chromatography (SiO 2) if necessary. References J. Chem. Soc., Perkin Trans. 1, 1996, 985-993. JOC, 1982, 47, 1962-1965. [Back to Top ] [Back to Synthetic Procedures] Bn - (benzyl) ester
20种氨基酸的名称--结构-及分类
15种氨基酸的名称结构及分类丙氨基酸 H 3 C- 缬氨基酸 H 3 C-CH – ∣ H 3 C 亮氨基酸H 3C-CH –CH 2 - ∣ CH 3 异亮氨基酸H 3C-CH 2 –CH- ∣ CH 3 蛋氨基酸(甲硫氨基酸)H 3C-S- CH 2 - CH 2 - 甘氨基酸 H- 丝氨基酸 HO- CH 2 - 苏氨基酸 H3C-CH – ∣ OH 半胱氨基酸HS- H3C-CH2– O ‖ 天冬酰胺 H2N-C- CH2- 谷氨酰胺O ‖ H 2N-C- CH 2 - CH 2 - 赖氨基酸 H3N-CH2- CH2- CH2- CH2- 精氨基酸 H2N-C- NH- CH2- CH2- CH2- ║ NH2 天冬氨基酸-OOC- CH2- 谷氨基酸-OOC- CH2-CH2- 氨基酸不能自由通过细胞膜,所以氨基酸在体内的分布也是不均
的。肌肉占一半,肝脏占10%,肾占4%,血浆占1%。由于肾脏肝脏体积较小,它们所含的游离氨基酸的浓度较高,氨基酸的代谢也很旺盛。 代谢能,除了一点体增热量以外余下的都是净 氨基酸随同血液运输到全身各组织去进行代谢,其主要去向是合成蛋白质和多肽,此外,也可以转变成嘌呤嘧啶卟啉儿茶酚胺。多余的氨基酸通常用于分解供能。 虽然不同的氨基酸由于结构不同,各有其自己的分解方式,但它们都有α–氨基和α–羧基,因此有共同的代谢途径。氨基酸的一般分解代谢就是指这种共同的分解途径。氨基酸分解时,在多数[68]大多数人95%,绝大多数人99—% 在大多数情况,96.5%情况下,是首先脱去氨基生成氨和α–酮酸。氨可转变成尿素、尿酸排出体外,而生成的α–酮酸则可以再转变为氨基酸、或者是彻底分解为二氧化碳和水并释放出能量,或是转变为糖或脂肪作为能量的储备,这是氨基酸分解的主要途径。 。在酶的作用下,氨基酸脱掉氨基的作用称脱氨基作用。动物的脱氨基作用主要在肝肾中进行,其主要方式有氧化脱氨基转氨基联合脱氨基。多数情况是氨基酸以联合脱氨基作用脱去氨基的。
氨基的保护方法
学号 西北师范大学 毕业论文(设计) 题目氨基的保护方法 学生姓名李启民 专业班级 2011级化学函授班 系别化学与生命科学系 指导教师 职称 日期 2013年7月
郑重声明 本人的毕业论文(设计)是在指导教师的指导下独立撰写完成的。如有剽窃、抄袭、造假等违反学术道德、学术规范和侵权的行为,本人愿意承担由此产生的各种后果,直至法律责任,并愿意通过网络接受公众的监督。特此郑重声明。 毕业论文(设计)学生签名:指导教师签名: 年月日年月日
氨基保护的研究方法 [摘要]由于氨基的氮原子上含有弧对电子,易作为亲核试剂,进攻带有部分正电荷的碳原子,从而发生卤代、酰化等反应,同时也容易被氧化生成氮氧化物,因此,氨基对氧化和取代等反应都很敏感。为了在分子其他部位反应时氨基不发生反应,通常需要用易于脱去的基团对氨基进行保护。目前,已开发出相当多的氨基保护基,并且已商品化。例如,在肽和蛋白质的合成中,通常用氨基甲酸酯(R1R2NCO2R)法保护氨基,而在生物碱的合成及基于腺嘌呤、胞嘧啶和鸟嘌呤的核苷酸的合成中,用酰胺(R1R2NCOR)法保护含氮碱基。化学家们在肽的合成领域内,对已知保护基的相对优劣了比较并在继续寻找更有效的新保护基。除了肽的合成外,这些保护基在其他方面也有很多重要应用。 [关键词] 氨基;官能团转化;保护基;氨基保护 ABSTRACT: Due to the amino nitrogen atom contains arc to electronic, easy as a nucleophile, attack with a part of the positive charge of carbon atoms, which happen halogenated, acylation reaction, but also easy to oxidation generating nitrogen oxides, and therefore, amino to oxidation and substitution reaction is very sensitive. In order to other parts of the molecular reaction time amino don't react, usually need to use easy to remove groups to protect amino. At present, have developed quite a number of amino protection base, and has been commercialized. For instance, in peptide and protein synthesis, the usually use carbamate (R1R2NCO2R) method to protect amino, and in the synthesis of alkaloids and based on adenine, cytosine and guanine nucleotide synthesis, using amide (R1R2NCOR) method to protect nitrogenous base . Chemists in peptide synthesis field, known to protect base of relative advantages and disadvantages compared and continue to look for more effective new protection base. In addition to peptide synthesis outside, these protection base in other ways also has many important applications. KEYWORDS: Nucleophile;Functional transformation;Protective group;the Protective of Nucleophile. 1、酰胺类保护法 (1)形成保护法 芳香胺在进行硝化反应时常采用甲酰基保护,因为易于引入和消去,所以在磺胺合成中用甲酰基保护比用其他酰基有明显的优势。
