参比制剂第十批
附件
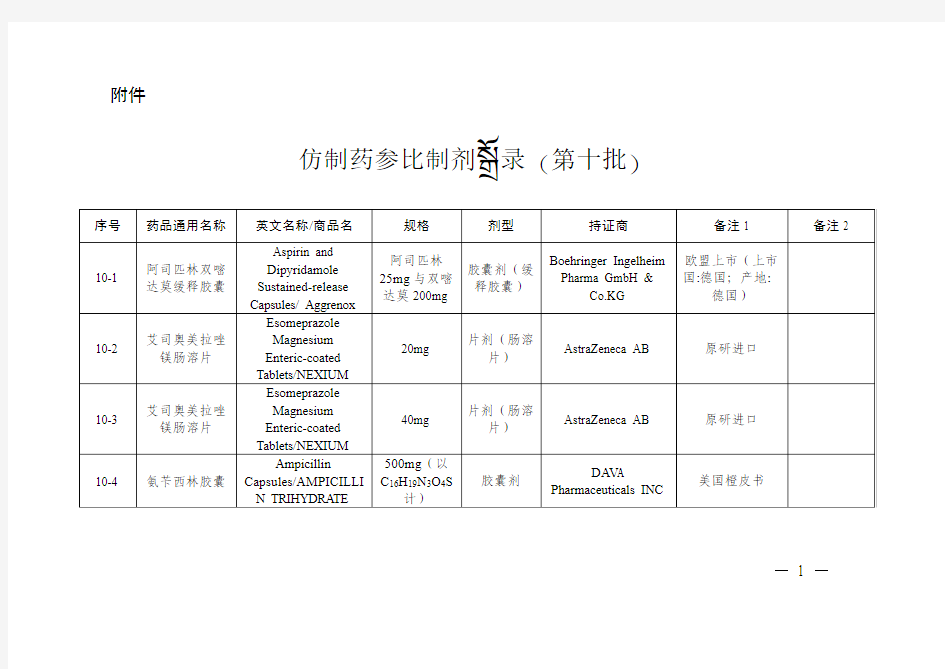
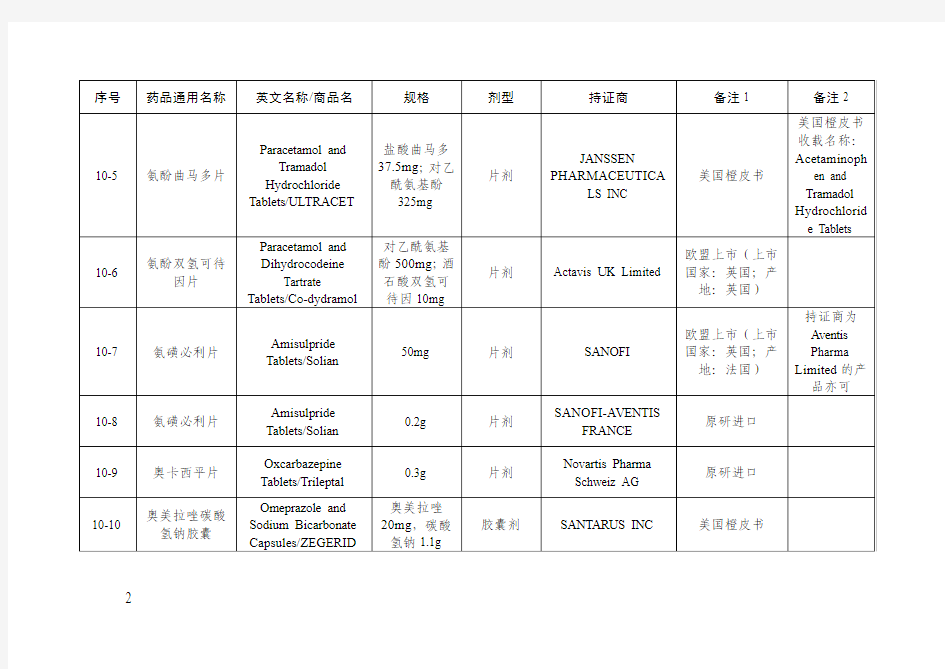
仿制药参比制剂目录(第十批)
—1 —
2
—3 —
4
—5 —
6
—7 —
8
—9 —
10
—11 —
12
—13 —
14
—15 —
16
—17 —
18
—19 —
20
参比制剂一次性进口申请要求
一、参比制剂一次性进口申请要求 1、许可条件:药品研发机构或药品生产企业在研究过程中,对已在中国境外上市但境内未上市的药品,拟用于下列用途的,可申请一次性进口: (一)以中国境内药品注册为目的的研究中用于对照药品的制剂或原料药; (二)以仿制药质量和疗效一致性评价为目的的研究中用于对照药品的化学药品制剂或原料药。 2、申请人限制:药品研发机构或药品生产企业。 3、申请用途:作为报批时证明原料药或者制剂是合法来源的资料。 4、申请资料:(一式两份) (一)申请人机构合法登记证明文件复印件(如营业执照、组织机构代码证等)。属于委托申请的,另须提供委托人的合法登记证明文件复印件及委托证明文件。 (二)申请报告。内容应包括:拟申请进口对照药品的境内外上市情况、拟申请进口对照药品的来源、具体用途、数量、使用计划及拟进口药品的口岸。申请人书面承诺所进口药品不得用于上市销售及申请用途以外的其他用途。 上述申请报告及承诺须加盖申请人公章,申请人属于委托代理的,由委托方提供上述材料。 (三)拟进口对照药品的国外获准上市证明材料(可提供上市国家药品监管部门核发的批准证明文件复印件、境外上市的药品说明书或上市国家药品监管部门网站公开信息等)。 (四)申请人属于委托代理的,提供委托方研发机构或生产企业所在地省级食品药品监管部门出具的审查意见表(附件3)。 ◆免检申请报告:根据公司实际情况,写明申请免检的原因,越详细越好,理由越充分越好。盖上公司公章。 ◆同时,需带上申请表的电子版(word 文档) 5、申请递交 由申请企业将申请资料提交到该企业所属省级食品药品监督管理局注册处审核,获得省局(一般是注册司)同意上报国家局的批复意见函后,申请企业才能将批复函和申请资料邮递或当面递交到国家药监局的行政受理中心;提倡当面递交,一是避免丢失,二是避免受理跟进的速度慢。 6、审批时限 筛选出拟定的参比制剂后,向国家局仿制药办公室进行参比制剂备案,约60个工作日。 递交后,国家药监局将进行审核,审核通过后一个星期左右会发出受理通知书和缴费通知书给贵司,拿到受理号后一个月左右获得一次性批件。 7、审批费用:大概2000元/个。
9001原料药物与制剂稳定性试验指导原则
9001 原料药物与制剂稳定性试验指导原则 稳定性试验的目的是考察原料药物或制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。 稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用1批原料药物或1批制剂进行;如果试验结果不明确,则应加试2个批次样品。生物制品应直接使用3个批次。加速试验与长期试验要求用3批供试品进行。(2)原料药物供试品应是一定规模生产的。供试品量相当于制剂稳定性试验所要求的批量,原料药物合成工艺路线、方法、步骤应与大生产一致。药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应通常为100 000片,胶囊剂至少应为100 000粒。大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,根据情况另定。(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。(4)加速试验与长期试验所用供试品的包装应与上市产品一致。(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视降解产物的检查。(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3 批规模生产的产品仍需进行加速试验与长期稳定性试验。(7)对包装在非渗透容器内的药物制剂可不考虑药物的湿敏感性或可能的溶剂损失,其稳定性研究可在任何湿度下进行。 制剂质量的“显著变化”通常定义为:①含量与初始值相差5%;或采用生物或免疫法测定时效价不符合规定;②任何降解产物超过标准限度要求;③外观、物理常数、功能试验(如颜色、相分离、再分散性、粘结、硬度、每揿剂量等)
普通口服固体制剂参比制剂选择和确定的指导原则
附件1 普通口服固体制剂参比制剂 选择和确定指导原则 一、概述 为推进仿制药与原研药品质量和疗效一致性评价工作的开展,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)要求,制定本指导原则。 仿制药是指与被仿制药具有相同的活性成分、剂型、给药途径和治疗作用的药品。 参比制剂是指用于仿制药质量一致性评价的对照药品,可为原研药品或国际公认的同种药物。 原研药品是指在全球市场率先上市的,拥有或曾经拥有相关专利、或获得了专利授权的原创性药品。国际公认的同种药物是指在欧盟、美国获准上市并获得参比制剂地位的仿制药。原研药品和国际公认的同种药物通常具有完善的临床研究数据或生物等效性研究数据。 本指导原则适用于普通口服固体制剂仿制药质量一致性评价研究用参比制剂的选择与备案。
二、选择原则 参比制剂首选原研药品,若确实无法获得原研药品或有证据证明原研药品不适合评价方法要求时,也可以选用国际公认的同种药物作为参比制剂。 (一)首选国内上市的原研药品作为参比制剂。如原研企业同时有进口和地产化药品的上市许可,优先选择进口原研药品作为参比制剂。若原研药品未在国内上市,可选择在国外上市的原研药品。优先选择在欧盟、美国上市并被列为参比制剂的原研药品。 (二)国际公认的同种药物首选国内上市药品。如企业同时有进口和地产化药品的上市许可,优先选择进口药品作为参比制剂。若国际公认的同种药物未在国内上市,则选择在欧盟、美国上市并被列为参比制剂的同种药物。 (三)参比制剂的质量及均一性应满足药品评价要求。 三、产生方式 (一)药品生产企业应按照上述要求,明确所产仿制药的参比制剂,报食品药品监管总局备案。 (二)行业协会可以组织同品种企业提出参比制剂的意见,报食品药品监管总局审核确定。 (三)食品药品监管总局可以推荐参比制剂,供药品生产企业参考。
原料药与药物制剂稳定性试验指导原则
附录ⅩⅠⅩ C原料药与药物制剂稳定性试验指导原则 稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。 稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用一批原料药或一批制剂进行。加速试验与长期试验要求用三批供试品进行。(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10 000片,胶囊剂至少应为10 000粒。大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,根据情况另定。(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。(4)加速试验与长期试验所用供试品的包装应与上市产品一致。(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视降解产物的检查。(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的三批规模生产的产品仍需进行加速试验与长期稳定性试验。 本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。 一、原料药 原料药要进行以下试验。 (一)影响因素试验 此项试验是在比加速试验更激烈的条件下进行。其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。供试品可以用一批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚薄层,进行以下试验。当试验结果发现降解产物有明显的变化,应考虑其潜在
普通口服固体制剂参比制剂选择和确定指导原则
附件1 普通口服固体制剂参比制剂选择和确定 指导原则 本指导原则适用于普通口服固体制剂仿制药质量和疗效一致性评价用参比制剂的选择和确定。 一、术语 仿制药是指与被仿制药具有相同的活性成分、剂型、给药途径和治疗作用的药品。 参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象,如原研药品或国际公认的同种药物。参比制剂应为处方工艺合理、质量稳定、疗效确切的药品。 原研药品是指境内外首个获准上市,且具有完整和充分的安全性、有效性数据作为上市依据的药品。 国际公认的同种药物是指在欧盟、美国、日本获准上市并获得参比制剂地位的仿制药。 二、选择原则 (一)参比制剂首选国内上市的原研药品。作为参比制剂的进口原研药品应与其原产国上市药品一致。若原研企业能证明其地产化药品与原研药品一致,地产化药品也可作为参比制剂使
用。 (二)若原研药品未在国内上市或有证据证明原研药品不符合参比制剂的条件,也可以选用在国内上市国际公认的同种药物作为参比制剂,其产品应与被列为参比制剂国家的上市药品一致。 (三)若原研药品和国际公认的同种药物均未在国内上市,可选择在欧盟、美国、日本上市并被列为参比制剂的药品。 三、提出和推荐 (一)药品生产企业应按照上述原则,自行选择参比制剂,报食品药品监管总局仿制药质量一致性评价办公室(以下简称一致性评价办公室)备案。参比制剂备案表见附1。 (二)行业协会可按照上述原则,组织同品种药品生产企业提出参比制剂的选择意见,向一致性评价办公室推荐。参比制剂推荐表见附2。 (三)原研药品生产企业、国际公认的同种药物生产企业其产品如可满足参比制剂的条件,可主动向一致性评价办公室申报作为参比制剂。参比制剂申报表见附3。 四、备案和审核 (一)药品生产企业应根据国家仿制药质量和疗效一致性评价的任务要求和拟评价品种的情况,开展先期研究,拟定参比制剂,报一致性评价办公室备案。一致性评价办公室在60个工作
化学原料药及制剂稳定性试验指导原则
附件2 化学药物(原料药和制剂)稳定性研究 技术指导原则(修订) 一、概述 原料药或制剂的稳定性是指其保持物理、化学、生物学和微生物学特性的能力。稳定性研究是基于对原料药或制剂及其生产工艺的系统研究和理解,通过设计试验获得原料药或制剂的质量特性在各种环境因素(如温度、湿度、光线照射等)的影响下随时间变化的规律,并据此为药品的处方、工艺、包装、贮藏条件和有效期/复检期的确定提供支持性信息。 稳定性研究始于药品研发的初期,并贯穿于药品研发的整个过程。本指导原则为原料药和制剂稳定性研究的一般性原则,其主要适用于新原料药、新制剂及仿制原料药、仿制制剂的上市申请(NDA/ANDA,New Drug Application/Abbreviated New Drug Application)。其他如创新药(NCE,New Chemical Entity)的临床申请(IND,Investigational New Drug Application)、上市后变更申请(Variation Application)等的稳定性研究,应遵循药物研发的规律,参照创新药不同临床阶段质量控制研究、上市后变更研究技术指导原则的具体要求进行。
本指导原则是基于目前认知的考虑,其他方法如经证明合理也可采用。 二、稳定性研究的基本思路 (一)稳定性研究的内容及试验设计 稳定性研究是原料药或制剂质量控制研究的重要组成部分,其是通过设计一系列的试验来揭示原料药和制剂的稳定性特征。稳定性试验通常包括影响因素试验、加速试验和长期试验等。影响因素试验主要是考察原料药和制剂对光、湿、热、酸、碱、氧化等的稳定性,了解其对光、湿、热、酸、碱、氧化等的敏感性,主要的降解途径及降解产物,并据此为进一步验证所用分析方法的专属性、确定加速试验的放置条件及选择合适的包装材料提供参考。加速试验是考察原料药或制剂在高于长期贮藏温度和湿度条件下的稳定性,为处方工艺设计、偏离实际贮藏条件其是否依旧能保持质量稳定提供依据,并根据试验结果确定是否需要进行中间条件下的稳定性试验及确定长期试验的放置条件。长期试验则是考察原料药或制剂在拟定贮藏条件下的稳定性,为确认包装、贮藏条件及有效期/复检期提供数据支持。 对临用现配的制剂,或是多剂量包装开启后有一定的使用期限的制剂,还应根据其具体的临床使用情况,进行配伍稳定性试验或开启后使用的稳定性试验。
粗基准选择及使用原则
粗基准选择及使用原则 选择粗基准时,主要要求保证各加工面有足够的余量,使加工面与不加工面间的位置符合图样要求,并特别注意要尽快获得精基准面。具体选择时应考虑下列原则: (1) 选择重要表面为粗基准 为保证工件上重要表面的加工余量小而均匀,则应选择该表面为粗基准。所谓重要表面一般是工件上加工精度以及表面质量要求较高的表面,如床身的导轨面,车床主轴箱的主轴孔,都是各自的重要表面。因此,加工床身和主轴箱时,应以导轨面或主轴孔为粗基准。如图所示。 床身加工粗基准选择
a) 导轨面为粗基准加工床腿底面 b) 底面为精基准加工导轨面 (2) 选择不加工表面为粗基准 为了保证加工面与不加工面间的位置要求,一般应选择不加工面为粗基准。如果工件上有多个不加工面,则应选其中与加工面位置要求较高的不加工面为粗基准,以便保证精度要求,使外形对称等。另外,如果是壳体类零件,还需要考虑壳体装配后内腔的干涉问题,粗基准尽量选用与装配零件之间空间小、易干涉的表面。 例如毛坯孔与外圆之间偏心较大,应当选择不加工的外圆为粗基准,将工件装夹在三爪自定心卡盘中,把毛坯的同轴度误差在镗孔时切除,从而保证其壁厚均匀。
粗基准的选择 1-外圆2-孔 (讲PS05的后盖工艺的2-2工序,找正铸造的油腔端面,这样才能使后续精加工的表面与铸造的油腔端面衔接好) (3) 选择加工余量最小的表面为粗基准 在没有要求保证重要表面加工余量均匀的情况下,如果零件上每个表面都要加工,则应选择其中加工余量最小的表面为粗基准,
以避免该表面在加工时因余量不足而留下部分毛坯面,造成工件废品。 (4) 选择较为平整光洁、加工面积较大的表面、无浇、冒口及飞边的 表面作为粗基准,以便工件定位可靠、夹紧方便。这样可以在加工中,把其它不好的表面以及浇、冒口及飞边加工掉。 (5) 粗基准在同一尺寸方向上只能使用一次 因为粗基准本身都是未经机械加工的毛坯面,其表面粗糙值大且尺寸精度低,若重复使用将产生较大的误差。 实际上,无论精基准还是粗基准的选择,上述原则都不可能同时满足,有时还是互相矛盾的。因此,在选择时应根据具体情况进行分析,权衡利弊,保证其主要的要求。
参比制剂进口操作流程
参比制剂进口操作流程 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
一、参比制剂进口申请要求 1、许可条件:药品研发机构或药品生产企业在研究过程中,对已在中国境外上市但境内未上市的药品,拟用于下列用途的,可申请一次性进口: (一)以中国境内药品注册为目的的研究中用于对照药品的制剂或原料药; (二)以仿制药质量和疗效一致性评价为目的的研究中用于对照药品的化学药品制剂或原料药。 2、申请人限制:药品研发机构或药品生产企业。 3、申请用途:作为报批时证明原料药或者制剂是合法来源的资料。 4、申请资料:(一式两份) (一)申请人机构合法登记证明文件复印件(如营业执照、组织机构代码证等)。属于委托申请的,另须提供委托人的合法登记证明文件复印件及委托证明文件。 (二)申请报告。内容应包括:拟申请进口对照药品的境内外上市情况、拟申请进口对照药品的来源、具体用途、数量、使用计划及拟进口药品的口岸。申请人书面承诺所进口药品不得用于上市销售及申请用途以外的其他用途。 上述申请报告及承诺须加盖申请人公章,申请人属于委托代理的,由委托方提供上述材料。 (三)拟进口对照药品的国外获准上市证明材料(可提供上市国家药品监管部门核发的批准证明文件复印件、境外上市的药品说明书或上市国家药品监管部门网站公开信息等)。 (四)申请人属于委托代理的,提供委托方研发机构或生产企业所在地省级食品药品监管部门出具的审查意见表(附件3)。 免检申请报告:根据公司实际情况,写明申请免检的原因,越详细越好,理由越充分越好。盖上公司公章。 同时,需带上申请表的电子版(word文档) 5、申请递交 由申请企业将申请资料提交到该企业所属省级食品药品监督管理局注册处审核,获得省局(一般是注册司)同意上报国家局的批复意见函后,申请企业才能将批复函和申请资料邮递或当面递交到国家药监局的行政受理中心;提倡当面递交,一是避免丢失,二是避免受理跟进的速度慢。 6、审批时限 筛选出拟定的参比制剂后,向国家局仿制药办公室进行参比制剂备案,约60个工作日。 递交后,国家药监局将进行审核,审核通过后一个星期左右会发出受理通知书和缴费通知书给贵司,拿到受理号后一个月左右获得一次性批件。 7、审批费用:大概2000元/个。 参比制剂进口操作流程: 1、参比制剂的选择、备案 协助企业查找项目的参比制剂,并进行参比制剂的备案工作。。 2、一次性进口批件申请 协助企业填写一次性进口批件,。 3、参比制剂采购 通过境内、境外的合作伙伴以合法、合规的专业渠道获得不同批号的一到三批参比制剂(批次不同,价格不同,个别品种难以短时间内获得三批),并采用与样品保存条件相适应的运输途径转交给企业,保证运输途径不影响制剂的稳定性。
定位粗基准选择解析
定位粗基准的选择 以未加工过的表面进行定位的基准称为粗定位基准,简称粗基准。当毛坯加工完成后,零件进入机械加工过程的第一道工序,其定位基准必然时毛坯表面,即粗基准。选择粗基准时应遵循以下基本原则: 一、选择重要表面为粗基准 图1 如图所示,在床身加工中,导轨面时最重要的工作表面,要求加工时切去薄而均匀的一层金属,使其保留铸造时在导轨面所形成的均匀而细密的金相组织,以便增加导轨的耐磨性。因此,在第一道工序中,应选择导轨面作为车床床身的粗基准加工床脚。在第二道工序中,再以已加工的床脚底平面作为精基准加工导轨面,这样导轨面的加工余量可以小而均匀,加工后表层金相组织均匀,力学性能基本相同,在使用过程中表面的磨损就会比较均匀。 二、选择加工余量小的表面为粗基准 图2
如图阶梯轴毛坯,毛坯大小头的同轴度误差为3mm,小头的加工余量为5mm.而大头的加工余量为8mm,以加工余量最小的小头作粗基准加工大头,则加工余量足够。如果反过来采用大头作粗基准加工小头,则小头的加工余量不足,继续加工会导致工件报废。 三、选择不需加工并且与加工表面有相互位置精度要求的表面为粗基准。 图3 如图所示,如果采用不加工的A面作粗基准加工内孔,则加工后内孔与不加工表面A面的同轴度好;如果采用内孔B面做粗基准加工内孔,则加工后内孔与不加工表面A面的同轴度不好。 四、选择比较光洁、平整、面积足够大、装夹稳定的表面作粗基准,不允许有锻造飞边和铸造浇道、冒口或其他缺陷,以确保定位准确,加紧可靠。 五、粗基准在同一尺寸方向上只允许在第一道工序中使用一次,不得重复使用,以避免产生较大的定位误差。 图4 如图所示,工件以表面B为粗基准加工表面A之后,如果仍以表面B为粗基准加工表面C,由于不能保证工件轴心线在前后两次装夹中位置的一致性,就必然导致加工出来的表面A 与C之间产生较大的同轴度误差。 六、在处理上述由粗基准向精基准过渡的问题时,在下列情况下可以例外:
生物仿制药开发面临参比制剂选择困境
中国医药报/2012年/4月/5日/第007版 研发平台 生物仿制药开发面临参比制剂选择困境 编译伊遥 目前,多个国家已经建立了法律和监管的途径,为专利到期生物治疗产品的仿制品上市奠定政策基础。然而,与小分子仿制药不同,那些大分子、复杂的蛋白质仿制药与原研产品不可能完全相同,因此大分子仿制药物必须通过与原研产品的比较研究,来证明其与参比制剂类似;制造商必须克服多种挑战(包括当地法律、监管、非临床和临床研究)才能够开发出生物仿制药进入市场。而其中需要跨过的第一道障碍也许就是参比制剂的选择。 2010年3月23日,美国总统奥巴马签署了美国《保护患者与廉价医疗服务法案》,此外,美国还通过了《生物制剂的价格竞争和创新法案》(BPCIA)为生物仿制药提供监管途径。而欧盟早在2005年便发布了“类似的生物医药产品”(即生物仿制药)指导原则,实际上是为生物仿制药的试验提供支持。随后,日本于2009年发布了“后续生物制剂”的指导方针。而巴西、澳大利亚、土耳其、马来西亚、阿根廷、墨西哥、加拿大、南非等目前也都建立了以欧盟模式为基础的生物仿制药监管途径。 这些国家和地区制定的相关指导原则都有一个共同的主题:分阶段实施。生物仿制药与原研产品直接进行广泛比较(包括物理、化学和生物学特性,以及非临床和临床研究),以证明其与参比制剂具有相同的安全性和有效性。所有指导原则都提到“在整个分析表征、非临床和临床研究阶段使用相同的参比制剂”,而在各个国家发布的指导原则中,关于参比制剂的选择却具有不同的特异性。 例如,包括国际协调会议(ICH)的三个主要成员(即欧盟、日本、美国),要求选择的参比制剂应是已在有关的国家或地区批准应用的。欧洲药品管理局(EMA)指导原则要求参比制剂必须是在欧盟授权使用的,并且提交了完整档案;来自欧盟以外的可比性研究数据也可以接受,但只用于支持的目的。 在美国,BPCIA对《公共健康安全法》第351(K)节补充,要求通常批准的参比制剂需要参考之前的安全、纯度和疗效进行比较。美国食品药品管理局(FDA)于2012年2月颁布的生物仿制药批准指导意见草案,在开展生物仿制药与参比蛋白产品比较时需进行的科学和质量考虑方面展现出了一定程度的灵活性。该草案声称,在某些情况下,通过事先协商,申请者可能会利用非美国许可参比制剂的动物或临床研究数据。然而,在这种情况下,必须提供足够的“桥接数据”。 然而,世界卫生组织制定的《类似生物治疗产品的评价指导原则》认为,只要是国家监管当局授权,无需在特别批准产品时接受另一个司法管辖区建立的监管框架内提供的参比生物制剂。加拿大卫生署的指导原则更具有一定的灵活性,比如参比制剂是来自人用药品注册技术规范国际协调会(ICH)成员国的产品。 实际上,任何欲在全球范围内销售其产品的生物仿制药生产商都面临着多个难题,如如何开展生物仿制药和目标市场的不同来源的参比制剂的对比研究等。从一个市场采购适当的参比制剂是一项艰巨而昂贵的行动,因为这需要建立在对很长一段时间内生产的多个批次产品的质量属性变化进行研究的基础之上。 这个问题比较复杂,因为原研产品或是在全球各地生产并向多个市场供应的。现有的可比性指导原则(例如,ICH Q5E生物技术/生物产品的可比性)已经授权使用的参比制剂,虽然由不同的主管部门许可,实际上可能在不同国家高度相似,然而,生物仿制药生产厂家不一定了解这些
数控基准选择原则
1:分析零件的工艺性2:选择毛胚3:选择定位基准4:拟定工艺路线5:确定各工序的设备、刀具、量具和夹具等6:确定各工序的切削用量7:填写工艺卡片 有色金属的精加工不宜采用磨削因为有色金属易使砂轮堵塞,因为常采用高速精细车削或金刚镗等切削加工方法。 形状复杂、尺寸较大的零件,其上的孔一般不宜采用拉削或磨削;直径大于∮60mm的孔 工件的四种定位形式 1:安全定位与不安全定位 工件的六个自由度完全被限制的定位称为安全定位 按加工要求允许有一个或几个自由度不被限制的定位称为不完全定位。 2:欠定位与过定位 按工序的加工要求,工件应该限制的自由度而未予限制的定位,称为欠定位。 在确定工件定位方案时,欠定位时绝对不允许。 工件的同一自由度被二个或二个以上的支撑点重复限制的定位,称为过定位。 在通常情况下,应尽量避免出现过定位。 3:工件的基准 工件的基准:在零件的设计和制造中,要确定一些指定点、线或面的位置,必须以一些指定点、线或面作为依据,这些作为依据的点、线或面,称为基准。 按照作用的不同,常把基准分为设计基准和工艺基准两类。 设计基准:即设计零件的基准。 工艺基准:在制造零件是所使用的基准,它又分为工序基准、定位基准、测量基准、装配基准。 1、工序基准:在工艺文件上用以标定加工表面位置的基准。 2、定位基准:在机械加工中,用来使工件在机床或夹具中占有正确位置的点、线或面。它是工艺基准中最主要的基准。定位基准是否合理,对保证工件加工后的尺寸精度和形位精度、安排加工顺序、提高生产率以及降低生产成本起着决定性的作用,它是制定工艺过程的主要任务之一。定位基准分为粗基准和精基准两种。 3、测量基准:用以测量已加工表面尺寸及位置基准。 4、装配基准:用来确定零件或部件在机器中的位置基准。 4:定位基准的选择 选择定位基准是为了保证工件的位置精度,因此,选择定位基准总是凑个有位置精度要求的表面开始进行选择的。 粗基准:毛胚表面的定位基准。 1、选取不加工的表面作粗基准:这样可使加工表面具有教正确的相对位置,并有可能在一次安装中把大部分加工表面加工出来。 2、选取要求加工余量均匀的表作为粗基准:这样可以保证作为粗基准的表面加工时余量均匀。 3、对于所有表面都要加工的表面,选取余量和公差最小的表面做粗基准,以避免余量不足而造成废品。 4、选取光洁、平整、面积大的表面作粗基准; 5、粗基准不应重复使用。一般情况下,粗基准只允许使用一次。 5:精基准的选择原则 对于形位公差精度要求较高的零件,应采用已加工过的表面作为定位基准。这种定位基准叫精基准。 精基准的选择原则:
参比制剂进口操作流程
一、参比制剂进口申请要求 1、许可条件:药品研发机构或药品生产企业在研究过程中,对已在中国境外上市但境内未上市的药品,拟用于下列用途的,可申请一次性进口: (一)以中国境内药品注册为目的的研究中用于对照药品的制剂或原料药; (二)以仿制药质量和疗效一致性评价为目的的研究中用于对照药品的化学药品制剂或原料药。 2、申请人限制:药品研发机构或药品生产企业。 3、申请用途:作为报批时证明原料药或者制剂是合法来源的资料。 4、申请资料:(一式两份) (一)申请人机构合法登记证明文件复印件(如营业执照、组织机构代码证等)。属于委托申请的,另须提供委托人的合法登记证明文件复印件及委托证明文件。 (二)申请报告。内容应包括:拟申请进口对照药品的境内外上市情况、拟申请进口对照药品的来源、具体用途、数量、使用计划及拟进口药品的口岸。申请人书面承诺所进口药品不得用于上市销售及申请用途以外的其他用途。 上述申请报告及承诺须加盖申请人公章,申请人属于委托代理的,由委托方提供上述材料。 (三)拟进口对照药品的国外获准上市证明材料(可提供上市国家药品监管部门核发的批准证明文件复印件、境外上市的药品说明书或上市国家药品监管部门网站公开信息等)。 (四)申请人属于委托代理的,提供委托方研发机构或生产企业所在地省级食品药品监管部门出具的审查意见表(附件3)。 免检申请报告:根据公司实际情况,写明申请免检的原因,越详细越好,理由越充分越好。盖上公司公章。 同时,需带上申请表的电子版(word 文档) 5、申请递交 由申请企业将申请资料提交到该企业所属省级食品药品监督管理局注册处审核,获得省局(一般是注册司)同意上报国家局的批复意见函后,申请企业才能将批复函和申请资料邮递或当面递交到国家药监局的行政受理中心;提倡当面递交,一是避免丢失,二是避免受理跟进的速度慢。 6、审批时限 筛选出拟定的参比制剂后,向国家局仿制药办公室进行参比制剂备案,约60个工作日。 递交后,国家药监局将进行审核,审核通过后一个星期左右会发出受理通知书和缴费通知书给贵司,拿到受理号后一个月左右获得一次性批件。 7、审批费用:大概2000元/个。 参比制剂进口操作流程: 1、参比制剂的选择、备案 协助企业查找项目的参比制剂,并进行参比制剂的备案工作。。 2、一次性进口批件申请 协助企业填写一次性进口批件,。 3、参比制剂采购 通过境内、境外的合作伙伴以合法、合规的专业渠道获得不同批号的一到三批参比制剂(批次不同,价格不同,个别品种难以短时间内获得三批),并采用与样品保存条件相适应的运输途径转交给企业,保证运输途径不影响制剂的稳定性。 4、一次性进口入关 通过专业、合规的进出口药品批发企业协助入关,补交关税、增值税,获取相关证明性文件,申请直接免检通过。
《药典》原料药与药物制剂稳定性试验指导原则
附录ⅩⅠⅩC 原料药与药物制剂稳定性试验指导原则 稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。 稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用一批原料药或一批制剂进行。加速试验与长期试验要求用三批供试品进行。(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10 000 片,胶囊剂至少应为10 000 粒。大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,根据情况另定。(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。(4)加速试验与长期试验所用供试品的包装应与上市产品一致。(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视降解产物的检查。(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的三批规模生产的产品仍需进行加速试验与长期稳定性试验。 本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。 一、原料药 原料药要进行以下试验。 (一)影响因素试验 此项试验是在比加速试验更激烈的条件下进行。其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。供试品可以用一批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚薄层,进行以下试验。当试验结果发现降解产物有明显的变化,应考虑其潜在的危害性,必要时应对降解产物进行定性或定量分析。 (1)高温试验供试品开口置适宜的洁净容器中,60℃温度下放置10 天,于第5 天和第10天取样,按稳定性重点考察项目进行检测。若供试品含量低于规定限度则在40℃条件下同法进行试验。若60℃无明显变化,不再进行40℃试验。 (2)高湿度试验供试品开口置恒湿密闭容器中,在25℃分别于相对湿度90%±5% 条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检测,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。若吸湿增重5% 以上,则在相对湿度75%±5%条件下,同法进行试验;若吸湿增重5%以下,其他考察项目符合要求,则不再进行此项试验。恒湿条件可在密闭容器如干燥器下部放置饱和盐溶液,根据不同相对湿度的要求,可以选择NaCl饱和溶液(相对湿度75%±1%,15.5~60℃),KNO3饱和溶液(相对湿度92.5%,25℃)。 (3)强光照射试验供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,于照度为4500 lx±500 lx的条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测,特别要注意供试品的外观变化。 关于光照装置,建议采用定型设备“可调光照箱”,也可用光橱,在箱中安装日光灯数支使达到规定照度。箱中供试品台高度可以调节,箱上方安装抽风机以排除可能产生的热量,箱上配有照度计,可随时监测箱内照度,光照箱应不受自然光的干扰,并保持照度恒定,同
1定位基准的选择
定位基准的选择 在制定零件加工的工艺规程时,正确地选择工件的定位基准有着十分重要的意义。定位基准选择的好坏,不仅影响零件加工的位置精度,而且对零件各表面的加工顺序也有很大的影响。本节先建立一些有关基准和定位的概念,然后再着重讨论定位基准选择的原则。 (一)基准的概念 零件都是由若干表面组成,各表面之间有一定的尺寸和相互位置要求。模具零件表面间的相对位置要求包括两方面:表面间的距离尺寸精度和相对位置精度(如同轴度、平行度、垂直度和圆跳动等)要求。研究零件表面间的相对位置关系离不开基准,不明确基准就无法确定零件表面的位置。基准就其一般意义来讲,就是零件上用以确定其他点、线、面的位置所依据的点、线、面。基准按其作用不同,可分为设计基准和工艺基准两大类。 1、设计基准 在零件图上用以确定其他点、线、面的基准,称为设计基准。例如图9-1所示的零件,其轴心线O-O是各外圆表面和内孔的设计基准;端面A是端面B,C的设计基准;内孔表面D体现的轴心线O-O是φ40h外圆表面径向圆跳动和端面B端面圆跳动的设计基准。 2、工艺基准 零件在加工和装配过程中所使用的基准,称为工艺基准。工艺基准按用途不同,又分为定位基准、测量基准和装配基准。 (1)定位基准加工时使工件在机床或夹具中占据正确位置所用的基准,称为定位基准。例如图9-1所示零件,零件套在心轴上磨削φ40h外圆表面时,内孔即为定位基准。 (2)测量基准零件检验时,用以测量已加工表面尺寸及位置的基准,称为测量基准。如图9-1所示,当以内孔为基准(套在检验心轴上)检验φ40h外圆的径向圆跳动和端面B的端面圆跳动时,内孔即为测量基准。 (3)装配基准装配时用以确定零件在部件或产品中位置的基准,称为装配基准。例如, 图9-1所示零件φ40h及端面B即为装配基准。 (二)工件的安装方式 为了在工件的某一部位上加工出符合规定技术要求的表面,在机械加工前,必须使工件在机床上相对于工具占据某一正确的位置。通常把这个过程称为工件的“定位”。工件定位后,由于在加工中受到切削力、重力等的作用,还应采用一定的机构将工件“夹紧”,使其确定的位置保持不变。工件从“定位”到“夹紧”的整个过程,统称为“安装”。 工件安装的好坏是模具加工中的重要问题,它不仅直接影响加工精度、工件安装的快慢、稳定性,还影响生产率的高低。为了保证加工表面与其设计基准间的相对位置精度,工件安装时应使加工表面的设计基准相对机床占据一正确的位置。如图9-1所示,为了保证加工表面φ40h径向圆跳动的要求,工件安装时必须使其设计基准(内孔轴心线O-O)与机床主轴的轴心线重合。 在各种不同的机床上加工零件时,有各种不同的安装方法。安装方法可以归纳为直接找正法、划线找正法和采用夹具安装法等3种。
Q1-b新原料药和制剂的光稳定性试验(中文)
稳定性试验: 新原料药和制剂的光稳定性试验 1.通则 新原料药和新药制剂的I01 稳定性试验指导原则(以下称总指导原则)指出光照试验是强 力破坏试验中的重要组成部分。本文是总指导原则的附加说明,提出了光稳定性试验的一些 建议。 A.序言 新原料药和新药制剂应经过适当的光稳定特征考察,证明其本身的光稳定性,即光照不 能引起不可接受的变化。按照总指导原则中“批号选择”,光稳定性试验只须选做一批样品。在某些情况下如当这个产品发生变更或变化时(如处方、包装),这些研究应再重复进行。这 些研究是否必须重复进行取决于起始文件中所测定的该物质的光稳定特征及变更或变化的 类型。 本指导原则主要阐述注册申报新化合物及其制剂时所需报送的光稳定性试验资料,不包 括已发放的药物(如在使用中的)的光稳定性试验和总指导原则中未包括其用法的药物的申 报内容。如果有科学合理的其他替代方法也可采用。 光稳定性试验研究包括: Ⅰ对原料药试验; Ⅱ对除去内包装的制剂试验(如需要); Ⅲ对除去外包装的制剂试验(如需要); Ⅳ上市包装的制剂试验。 按判断图指示进行药物光稳定性试验,可根据到哪一步发生了可以接受的变化来决定试 验到哪一步即可停止,“可接受的变化”是指经申报者论证合理的限度内的变化。 光敏性药物和制剂是否要在标签上标记要求,由国家地区来定。 B.光源 以下所述的光源可用于光稳定性试验。申报者可控制合适的温度以减少局部温度变化效 应,也可在相同环境中作一暗度控制(避光对照)(除另有规定外)。对方法1 和2,药物生产者 /申报者可根据光源的光谱分布来选择。 方法1 采用任何输出相似于D65/ID65 发射标淮的光源,如具有可见紫外输出的人造日光荧 光灯、氙灯或金属卤化物灯。D65 是国际上认可的室外日光标淮[IS010977(1993)]o。ID65 相当于室内间接日光标准。若光源发射光低于320nm,应滤光除去。 方法2 对于选择方法2,相同样品应同时暴露在日光灯和近紫外灯下。 1.冷白荧光灯应具有(ISO10977) (1993)所规定的输出功率。 2.近紫外荧光灯,其光谱范围为320~400nm,在350~370nm 有最大发射能量;在 320~360nm 及360~400nm 谱带范围内紫外光应具显著的比例。 C.方法 在确认研究中,样品应暴露在总照度不低于1.2×106Lux·hr,近紫外能量不低于200w·hr /m2,直接在药物和制剂之间进行比较。 样品可与经论证过的光化强度系统并排暴露于有效的光化强度下,以确保获得指定的光 暴露,或在用经校正的测光仪/照度仪监测的条件下,持续相当的时间。附录中提供了光化 强度测定方法的例子。
橙皮书及参比制剂选择
橙皮书及参比制剂选择 橙皮书及参比制剂选择 2016-02-29原创 亦度正康 亦度正康 橙皮书简介 美国橙皮书 《Hatch-Waxman 法案》规定专利药企业必须将其专利药物的专利信息提交FDA,FDA橙皮书办公室对其汇总编辑,每月增订,年终出版成册,即称之为橙皮书。 收录范围包括根据《食品、药品、化妆品法案》第505 条批准的药品。橙皮书中记录了药物的活性成分、剂型和规格,在每类药物中指定一个参比药物,并规定通用名药只能将其作为进行评价体内或体外治疗等效性的标准。 某些情况下,如果一个通用名药希望申请一个上市的仿制药作为为参比药物,就要递交公民请愿书。申请通过后此仿制药就可以作为相应种类药物下的第二个参比药物。此外,橙皮书中还明确列出了新药所涉及的所有专利以及市场专营保护信息。 日本橙皮书 日本曾前后进行过3次再评价,于1998 年起,厚生劳动省医药局审查管理科开始编著出版《日本医疗用医药品品质情报集》(即日本参比制剂目录、橙皮书、Orange Book)。 收录范围包括1995年以前批准并进行品质再评价的药品。橙皮书中记录了药物的活性成分、剂型、规格、药效分类、参比制剂及其生产厂家、4条溶出曲线、溶出条件等,供全国药品生产企业参照。 面向不同的使用者,日本橙皮书分为面向医疗领域的综合版和面向保险领域的保险版两个版本。 中国目前尚无《橙皮书》,此次仿制药质量一致性评价为建立我国药品参比制剂目录(橙皮书)提供了契机。 参比制剂 参比制剂是指已经上市的用于评价仿制药品或同类药品临床疗效或等效性的对照药物制剂。美国和日本对参比制剂都有明确的规定,并收录在各自颁布的橙皮书中,而我国尚未建立参比制剂目录。 原研企业对原研制剂的安全性、有效性和质量控制方面进行过细致的、系统的研究,故理论上讲,原研制剂是较为理想的参比制剂。 但仿制药若能证明其内在质量与原研制剂一致,也同样应该具有作为参比制剂的资格。 参比制剂选择 参比制剂的选择是一致性评价中的重要工作,唯有确定了参比制剂才能评价该药品与谁相一致。 若橙皮书中有相同剂型相同规格的RLD(Reference Listed Drug),则优选原研或进口原研RLD,次选本地生产的原研品。若原研已撤市或不再生产,也可考虑可选择在ICH成员国上市的仿制药作为参比制剂。 最终标准还需等待CFDA对于仿制药一致性评价技术指导原则或《普通口服固体制剂参比制剂选择和确定指导原则(修订稿)》的出台。 橙皮书的检索
注射剂原研参比制剂使用规范
注射剂参比制剂使用标准操作规程 目的:建立注射剂参比制剂使用的标准操作规程,为质量研究人员进行参比制剂的质量研究工作提供参考。 范围:质量研究人员。 规程: 一、参比制剂的选择 首选原研厂家,或美国橙皮书、日本橙皮书公布的厂家,同剂型同规格不同时间段生产的(效期内前中后)三批样品。 二、参比制剂的购买与存储 购买的参比制剂在核对无误后应建立台帐,置冷库(或按制剂标注的存储条件)保存,保管好说明书、外包装、标签和发票。 三、参比制剂的使用 1、参比制剂的使用应填写领用记录。 2、参比制剂对比前检验(即0天检验):取三批参比样品各1瓶,按以下项目顺序进行检验,直到1瓶参比制剂的内容物用完为止,每个项目在保证检验准确的条件下尽可能减少供试品用量:性状、有关物质、异构体(或光学异构体)、pH值、水分、溶液澄清度与颜色、含量、可见异物。 3、专属性研究(破坏试验):取一批参比制剂2瓶,分别进行高温、光照、酸、碱、氧化破坏试验,与一批自研产品同步进行,对比参比制剂和自研产品各强制降解条件下产生的杂质数量、种类和含量是否一致。 4、影响因素试验:取一批参比制剂6瓶,分别于高温、高湿、光照条件下各放2瓶,于试验5天和10天每个分别取1瓶进行检测(按以下项目顺序进行检验,直到1瓶参比制剂的内容物用完为止,每个项目在保证检验准确的条件下尽可能减少供试品用量:性状、有关物质、异构体、pH值、水分、溶液澄清度与颜色、含量、可见异物),与一批自研产品同步进行,对比参比制剂和自研产品在影响因素条件下各项检测结果和变化趋势的异同,产生的杂质数量、种类和含量是否一致。如果参比制剂比较昂贵,试验5天的点可以不做。 5、加速试验:取三批参比制剂各4瓶,分别置于加速试验条件下的稳定性
ICH Q1A新原料药和制剂的稳定性试验
新原料药和制剂的稳定性试验 ICH 三方协调指导原则 (1993年10月27日 ICH 指导委员会通过) 前言 本指导原则是为在欧盟、日本和美国申请新药注册而制定的稳定性试验要求。它不包括到世界其他国家和地区注册或出口所要求的试验内容。 本指导原则旨在列举新原料药及其制剂稳定性试验主要资料的要求。如有足够的科学依据也可使用其他方法,并不要求完全遵循本原则。 本指导原则对稳定性试验要求提供了一个总原则,它对实际情况中要求有特定的技术和具有特殊性的药品保留了充分的灵活性。 对欧盟、日本和美国中任何一方提供的稳定性资料,只要它满足本原则的要求,而且其标签符合国家/地区的规定,则该资料可被其他两方接受。 本原则不涵盖对取样和特殊的剂型/包装等试验的具体要求。 目的 稳定性试验的目的是提供原料药或制剂在各种环境因素如温度、湿度和光等条件影响下,其质量随时间变化的情况,并且由此建立所推荐的贮存条件、复验期和货架寿命。范围 本指导原则主要阐述新化合物及其制剂注册申请时要提交的稳定性资料。 本原则目前尚不包括简略申请、变更申请及临床试验申请等所要求的资料。 本原则是根据欧盟、日本和美国的气候条件对分析的影响来选择试验条件的。世界上任何地区的平均动力学温度可从气候资料获得。 (Grimm, W. Drugs Made in Germany,1985,28:196—202 和1986,29:39—47)。 原料药 总则 原料药稳定性的资料是评价稳定性的一个组成部分。 强力破坏试验 强力破坏试验是通过建立降解途径,鉴定可能的降解产物,以确定分子的内在稳定
性,并论证所使用的分析方法是否能反映产品的稳定性。 正规研究 主要稳定性研究旨在说明原料药在推荐的贮藏条件下贮存,在复验期内其质量仍符合规范。 批的选择 加速试验和长期试验的稳定性资料至少应包括三批以上样品的数据。在申报时,长期试验的稳定性资料应至少提供三批样品的数据,试验时间至少12 个月。 试产规模 生产的批次,应与在最终规模生产时的合成路线和生产工艺相同。 用于稳定性研究的各批次原料药的总体质量应既能代表临床前研究的质量,又能代表临床研究以及规模生产时的质量。 实验室规模生产的原料药所得的稳定性数据,可作为辅助性资料。 如果在最初注册申请时的资料不完整,则批准后生产的最初三批原料药,应按已批准的稳定性方案进行长期稳定性研究。 试验步骤和试验标准 试验项目包括那些在贮存时易变化,且有可能影响质量、安全性和(或)有效性的内容。稳定性资料应当包括物理、化学和微生物试验方面的内容。应使用已论证的、能反映稳定性的试验方法。重复的程度取决于论证研究的结果。 规范 根据临床前和临床研究中所用样品的总体研究的结果来制订可接受的限度。这些限度需包括单个及总的杂质和降解产物的上限,并依据对临床前和临床试验中所用药物的杂质水平,来证明限度的合理性。 试验放置条件 研究时间的长短及放置条件应当充分考虑到今后的贮藏、运输及其使用的整个过程。采用与制剂相同的放置条件,将易于作比较和评价。也可使用经确证合理的其他放置条件。对温度敏感的原料药可选择一个较低的温度,并可作为长期试验放置的温度。6 个月的加速试验应当在比设计的长期放置温度至少高15℃的条件下进行,并采用和这个温度相适应的湿度。所设长期试验的放置条件,将在标签和再试验日期上反映出来。
