有机物分子中原子共线、共面问题(带答案)

有机物分子中原子共线、共面问题
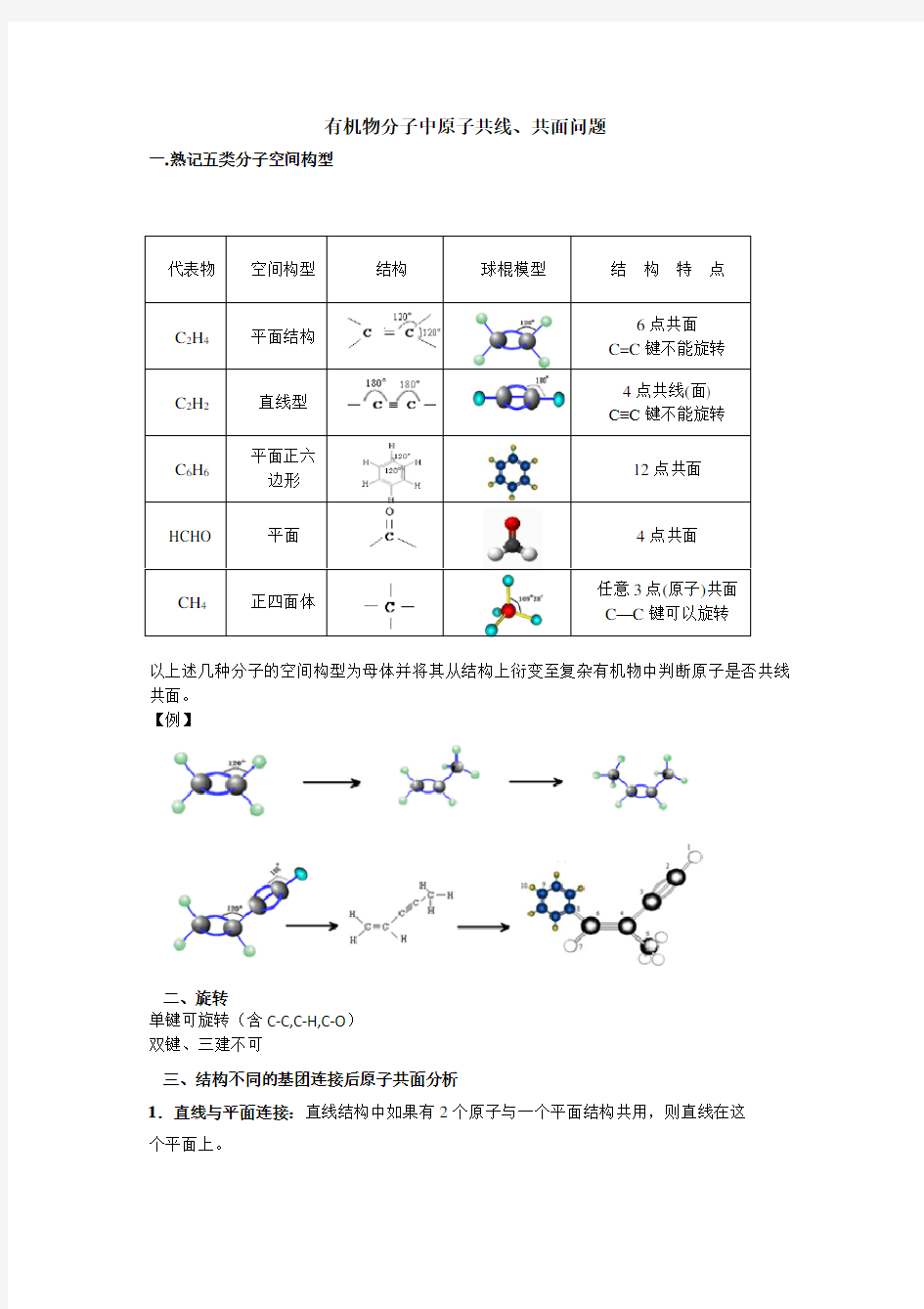
一.熟记五类分子空间构型
以上述几种分子的空间构型为母体并将其从结构上衍变至复杂有机物中判断原子是否共线共面。 【例】
二、旋转
单键可旋转(含C-C,C-H,C-O ) 双键、三建不可
三、结构不同的基团连接后原子共面分析
1.直线与平面连接:直线结构中如果有2个原子与一个平面结构共用,则直线在这个平面上。
代表物 空间构型 结构 球棍模型 结 构 特 点 C 2H 4 平面结构
6点共面 C=C 键不能旋转 C 2H 2 直线型
4点共线(面) C≡C 键不能旋转 C 6H 6
平面正六边形
12点共面
HCHO
平面
4点共面
CH 4 正四面体
任意3点(原子)共面C —C 键可以旋转
如CH 2=CH-C≡CH ,其空间结构为 ,所有原子共平面。
2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。
如苯乙烯分子
中共平面原子至少12个,最多16个。
3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。
如丙烯分子
中,共面原子至少6个,最多7个。
4.直线、平面与立体连接:
如图所示的大分子中共平面原子至少12个, 最多19个。分析时要注意两点:①观察大 分子的结构,先找出甲烷、乙烯、乙炔和 苯分子的“影子”,再将甲烷“正四面体”、乙
烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。 强化练习:
1.描述CH 3-CH =CH -C≡C -CF 3分子结构的叙述中,正确的是( BC ) A .6个碳原子有可能都在一条直线上 B .6个碳原子不可能都在一条直线上 C .6个碳原子有可能都在同一平面上 D .6个碳原子不可能都在同一平面上 2.下列有机化合物分子中的所有碳原子不可能...
处于同一平面的是( D ) A . B . C . D .
3.在 分子中,处于同一平面上的原子数最多 可能是( D )
A .12个
B .14个
C .18个
D .20个 4.在
分子中,处于同一平面上碳原子数最少是( A )
A .10个
B .8个
C .14个
D .12个
HC
C —CH 3 —CH 3 CH 3 —CH — C H 3 CH 3
CH 2 C CH 3
—CH 3
5.甲烷分子中的4个氢原子全部被苯基取代,得如图所示分子,对该分 子描述不正确的是 ( D ) A .分子式为C 25H 20 C .此物质属于芳香烃类物质 D .分子中所有碳原子有可能处于同一平面
6.某烃的结构简式为
。分子中含有四面体结构的碳原子(即饱和碳原子)数为
a ,在同一直线上的碳原子数为
b ,一定在同一平面内的碳原子
数为c ,则a ,b ,c 分别为( B )
A .4,3,5
B .4,3,6
C .2,5,4
D .4,6,4 7.下列分子中的14个碳原子不可能处在同一平面上的是(BD)
A .
B .
C
H 3CH 3
CH 3 C .
CH 3
C
H 3 D .
CH 3
8.在右面的分子结构式中,说法是正确的(AC)
A .所有的碳原子有可能处在同一个平面上
B .所有的碳原子不可能处在同一个平面上
C .所有的氧原子有可能同时处在苯环平面上
D .所有的氢原子有可能同时处在苯环平面上
9
.环戊二烯( )分子中最多有 9 原子共平面。
10.已知甲醛分子的所有原子均共平面,某分子具有如下结构: C 6H 5—CO —C≡C—CH 3,试回答下列问题: (1)在同一直线上的原子最多有__4_____个; (2)一定在同一平面上的原子最多有__12_____个; (3)可能在同一平面上的原子最多有____ 17___个。
专题:有机物共线共面解析
分子中原子共线、共面问题 一.熟记五类分子空间构型 掌握上述几种分子的空间构型,以其为母体并将其从结构上衍变至复杂有机物中判断原子是否共线共面。
二、结构不同的基团连接后原子共面分析 1.直线与平面连接:直线结构中如果有2个原子(或者一个共价键)与一个平面结构共用,则直线在这个平面上。如CH 2=CH-C≡CH ,其空间结构为 ,中间两个碳原子既在乙烯平面上, 又在乙炔直线上,所以直线在平面上,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。如苯乙烯分子 中共平面原子至少12个,最多16个。 3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。如丙烯分子 中,共面原子至少6个,最多7个。 4.直线、平面与立体连接:如图所示的大分子中共平面原子至少12个,最多19个。分析时要注意两点:①观察大分子的结构,先找出甲烷、乙烯、乙炔和苯分子的“影子”,再将甲烷“正四面体”、乙烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。不要忽视8号碳原子对位上的9 1. 描述CH 3-CH =CH -C≡C -CF 3分子结构的下列叙述中,正确的是 A .6个碳原子有可能都在一条直线上 B .6个碳原子不可能都在一条直线上 C .6个碳原子有可能都在同一平面上 D .6个碳原子不可能都在同一平面上 2.(2010年西城期末)下列有机化合物分子中的所有碳原子不可能... 处于同一平面的是 A . B . D . 3.在分子中,处于同一平面上的原子数最多可能是 A .12个 B .14个 C .18个 D .20个 4.在分子中,处于同一平面上碳原子数最少是 A .10个 B .8个 C .14个 D .12个 HC C —CH 3 —CH 3 CH 3 —CH — CH 3 CH 3 C CH 3 —CH 3
(完整版)有机物分子中原子共线、共面问题(带答案)
有机物分子中原子共线、共面问题 一.熟记五类分子空间构型 以上述几种分子的空间构型为母体并将其从结构上衍变至复杂有机物中判断原子是否共线共面。 【例】 二、旋转 单键可旋转(含C-C,C-H,C-O ) 双键、三建不可 三、结构不同的基团连接后原子共面分析 1.直线与平面连接:直线结构中如果有2个原子与一个平面结构共用,则直线在这个平面上。 代表物 空间构型 结构 球棍模型 结 构 特 点 C 2H 4 平面结构 6点共面 C=C 键不能旋转 C 2H 2 直线型 4点共线(面) C≡C 键不能旋转 C 6H 6 平面正六边形 12点共面 HCHO 平面 4点共面 CH 4 正四面体 任意3点(原子)共面C —C 键可以旋转
如CH 2=CH-C≡CH ,其空间结构为 ,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。 如苯乙烯分子 中共平面原子至少12个,最多16个。 3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。 如丙烯分子 中,共面原子至少6个,最多7个。 4.直线、平面与立体连接: 如图所示的大分子中共平面原子至少12个, 最多19个。分析时要注意两点:①观察大 分子的结构,先找出甲烷、乙烯、乙炔和 苯分子的“影子”,再将甲烷“正四面体”、乙 烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。 强化练习: 1.描述CH 3-CH =CH -C≡C -CF 3分子结构的叙述中,正确的是( BC ) A .6个碳原子有可能都在一条直线上 B .6个碳原子不可能都在一条直线上 C .6个碳原子有可能都在同一平面上 D .6个碳原子不可能都在同一平面上 2.下列有机化合物分子中的所有碳原子不可能... 处于同一平面的是( D ) A . B . C . D . 3.在 分子中,处于同一平面上的原子数最多 可能是( D ) A .12个 B .14个 C .18个 D .20个 4.在 分子中,处于同一平面上碳原子数最少是( A ) A .10个 B .8个 C .14个 D .12个 HC C —CH 3 —CH 3 CH 3 —CH — C H 3 CH 3 CH 2 C CH 3 —CH 3
初中化学知识点总结:分子和原子
初中化学知识点总结:分子和原子初中化学的分子和原子是化学这一门科目的基础,要学好化学,首先就要弄懂分子和原子的定义,以及了解物质、元素、分子、原子的区别和联系。 一、分子 1.分子定义:物质分别是由分子、原子、离子三种微粒构成的,其中分子又是由原子构成的。物质由元素组成。如:水分子是由氢原子、氧原子组成;而水分子构成了水; 2.分子的特点: (1)分子在不断地运动;如:在厨房炒菜,在其他地方可以闻到香味。 (2)分子之间有间隙;如:100ml酒精加100ml水得到的溶液小于200ml。 (3)分子的体积和质量都非常小;如:1ml水中大约有 1.67×1021 个水分子。 (4)同种物质的分子性质相同,不同种物质的分子性质不同。 (5)分子在化学变化中可以再分。 注:说明分子在运动的离子很多,比如能闻到的各种香味,就是各种分子在空气中不停的运动造成。分子间有间隔的例子有:气体可以压缩存于钢瓶中,气体热胀冷缩的额现象。 3.应用: (1)分子是构成物质的一种微粒。
(2)解释物质的三态变化。 二、原子 1.定义:分子可以分为原子。由此我们便知道原子的性质和分子很相似。原子是化学变化中的最小粒子。 2.原子的特点: (1)原子的质量和体积都很小;这点和分子很相似。 (2)原子总是不停的运动着;和分子一样。 (3)原子之间有间隔。和分子一样。 (4)原子是构成物质的一种微粒。 (5)原子在化学变化中不可再分,只是发生重新组合。 3、原子结构:原子是化学变化中的最小颗粒 原子核所带的正电量=核外电子所带的负电量 原子核内的质子数=核电荷数=核外电子数 我们可以把一个原子想成一个鸡蛋,原子核就是蛋黄,核外电子是蛋白,质子、中子是组成蛋黄的东西。 注:① 从上图我们可以看出来整个原子不带电。 ② 一个质子的质量与一个中子的质量相近,它们的质量比电子大得多! ③ 原子的质量几乎集中在原子核上,所以可以说决定原子质量大小的主要粒子是质子和中子。 4、原子的性质 (1)原子种类不同,质子数也不同(电子数不同,中子数也不
(完整版)有机物共线共面问题专题突破
有机化学查漏补缺专题 专题一:原子共线共面问题 一.基本空间构型 1、甲烷——正四面体型 在甲烷分子中,1个碳原子和任意2个氢原子可确定一个平面,其余的2个氢原子位于该平面的两侧。 2、乙烯——平面型 平面型结构,键角为120度,C=C 所连的四个氢原子与这两个碳原子同在一个平面上。当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。需要注意的是:C=C不能转动,而C-H键可以转动。 3、乙炔——直线型 乙炔分子中的2个碳原子和2个氢原子一定在一条直线上,键角为180°。当乙炔分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定和乙炔分子的其他原子共线。四个原子共直线,C≡C不能转动,而C-H键可以转动。 4、苯——平面六边型键角:120度 苯分子所有的原子共平面。当苯分子中的一个氢原子被其他原子或原子团取代时,代替该氢原子的原子一定在苯环所在平面内。 以上4种分子中的H被其他原子(如C、O、N、Cl等)所取代,取代后分子构型基本不变。 二、旋转问题 形成共价单键的原子可以绕轴旋转,双键、叁键的原子不能绕轴旋转。 三、判断规律 1.任意两个直接相连的原子在同一直线上
2.任何满足炔烃结构的分子,若只含一个碳碳三键,与其三键相连的所有原子均在同一直线上。 3.中学学的有机物中,全部原子能够共面的有乙烯、乙炔、苯、苯乙烯、1,3-丁二烯、苯乙炔等。 四、分割法(例题1) 1.一点定面:分子中有一个碳形成4个单键,则该分子中所有原子不可能共面。 2.分割组合:若有机物中碳原子的共线、共面问题,要进行单元分割,必要时兼顾分子对称性。分割后结合键的旋转性确定共线或共面的原子个数,注意题目要求。 五.注意关键字 审题时注意“碳原子”“所有原子”“可能”“一定”“最少”“最多”“共线”“共面”。 【例题】 1、下列关于CH3—CH=CH—C≡C—CF3分子结构的叙述中正确的是()。 A.6个碳原子有可能都在一条直线上 B.6个碳原子不可能都在一条直线上 C.6个碳原子一定都在同一平面上 D.6个碳原子不可能都在同一平面上 【答案】B、C 【解析】根据(1)乙烯分子中的6个原子共平面。键角120°;(2)乙炔分子中的4个原子共直线,键角180°,可推知题给有机物的碳链骨架结构如下: 由上面的碳链骨架结构很容易看出:题给有机物分子中的6个碳原子不可能都在一条直线上,而是一定都在同一平面上。 2、某烃的结构简式为 分子中处于四面体结构中心的碳原子数为a,一定在同一平面内的碳原子数为b,一定在同一直线上的碳原子数为c,则a、b、c依次为()。 A.4、5、3 B.4、6、3 C.2、4、5 D.4、4、6 【答案】B 【解析】四面体结构为饱和烃的特点,如—CH2—CH3,共4个,共线以碳碳三键为基础,有3个,共面一双键为基础,又因为其中包含一个三键,故共有6个碳。 巩固练习: 1.某烃的结构简式如右图所示,若分子中共线碳原子数为a,可能共面的碳原子最多为b,含四面体结构碳原子数为c,则a、b、c分别是()
分子和原子经典习题
初三化学 分子和原子经典习题 【典型例题】 例1:下列操作或现象与分子对应的特性不一致的选项是 选项操作或现象分子的特性 A 给篮球充气分子间有间隙 分子是有质量的 B 100mL酒精和100mL水混合在一起,体积小于 200mL C 在花园中可闻到花的香味分子是运动的 D 加热氧化汞可得到金属汞和氧气分子是可以再分的 【解析】本题主要考查分子的基本性质与宏观现象的联系。宏观现象或操作可以反映分子的某些性质,同时分子的某些性质又可以解释宏观现象,二者是相互对应的。“100mL 酒精和100mL水混合在一起,体积小于200mL”对应分子的基本性质是:分子间有间隙。 【答案】B 例2:下列关于分子、原子的说法正确的是 A. 分子能构成物质,原子不能构成物质 B. 分子能保持物质的化学性质,原子不能 C. 分子大,原子小 D. 分子在化学反应中可以再分,而原子则不能再分 【解析】有些物质由分子构成,如水、氧气,也有物质是由原子直接构成的,如汞、硅;故A错。物质的化学性质由分子保持,原子构成的物质,物质的化学性质由原子保持,故B 错。分子由原子构成,分子肯定比构成它的原子大,但是,毫无联系的分子和原子没有可比性,如汞原子比氢分子大,故C错。分子在化学反应中要改变,而原子则不能再分,只是重新排列组合形成新的分子或直接构成新的物质。 【答案】D 例3:微观模拟题:通过下图反应示意图回答下列问题: (1)丙物质属于纯净物中的___________(填物质分类)。 (2)该反应的基本反应类型为_____________反应。 (3)用分子和原子的观点来解释化学反应的实质____________。 【解析】试题通过模拟图示较为直观、形象地将有关粒子的构成情况展示出来,使本来很抽象的微观概念具体化、形象化。甲是由同种分子构成的纯净物,甲的分子又是由不同种原子构成的,发生化学变化后,观察分子和原子的变化情况以及生成物的分子构成。 【答案】(1)单质(2)分解(3)在化学变化中,分子可以再分,原子不能再分,只是重新组合形成其他物质的分子。 例4:科学研究发现:氮气不活泼,在3000℃时仅有0.1%的分子分裂。在0℃常压下,向密闭容器M中充入一定量的氮气,而后升高温度(不超过3000℃,压强不变),若该密闭容器的体积增大了一倍,则M内分子变化的示意图合理的是 【解析】温度升高后气体的体积增大了一倍,并不是分子的数目增多了,也不是分子的种类改变了,而是分子在温度升高时运动速率加快,分子间的间隔增大,但分子并没有破裂,数目、大小都没有改变。A表示分子变大了,C、D表示分子都破裂了,B表示分子间的间隔增大了。 【答案】B 例5:下列图示中,表示纯净物的,表示混合物的是,由原子直接构
有机化学原子共面共线判断
有机分子中原子的共面、共线 有机分子结构中由于碳原子形成不同价键,造成空间构型存在差异,成为高考命题的采分点之一,也是同学们的“难以捉摸”的点,掌握有机物分子的空间构型的基准点和判断技巧会使问题迎刃而解。 一.有机分子中原子的共面、共线基准点 1.甲烷的正四面体结构 如图1所示,在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三个原子共面(称为三角形规则)。 当甲烷分子中某个氢原于被其他原子取代时,讨论取代该氢原子的其他原子的共面问题时,可将与甲基碳原子直接相连的原子看做代替了原来的氢原子。 CH3CH2CH3的结构如图2所示,左侧甲基和②C构成“甲烷”分子,此分子中⑤H、①C、②C构成三角形。中间亚甲基和①C、③C构成“甲烷”分子,此分子中①C、②C、③C构成三角形。同理②C、③C、④H 构成三角形,即丙烷分子中最多有三个碳原子(①C、②C、③C)和两个氢原子(④H、⑤H)可能共面。 2.乙烯的平面结构 乙烯分子中的所有原子都在同一平面内,键角为120°(如图3所示)。当乙烯分子中某个氢原子被其他原子取代时,则代替该氢原子的原子一定在乙烯的平面内。 如图4所示是CH3CH=CH2的分子结构。由图可知,三个氢原子(①②③)和三个碳原子(④⑤⑥)一定共面。根据三角形规则(⑤C、⑥C、⑦H构成三角形),⑦H也可能在这个平面上。同理(CH3)2C=C(CH3)2中至少有6个原子(6个碳原子)共平面,至多有10个原子共平面:6个碳原子和4个氢原子(每个甲基可提供一个氢原子)共平面。
提示:羰基碳原子也是平面形碳原子,如甲醛即为平面型结构: 3.苯的平面结构 苯分子的所有原子在同一平面内,键角为120°,结构式为 ,当苯分子中的一个氢原子被其他原子取代时,代替该氢原子的原子一定在苯环所在平面内。如甲苯中的7个碳原子(苯环上的6个碳原子和甲基上的1个碳原子)和苯环上的5个氢原子一定共面,此外甲基上的1个氢原子也可以转到这个平面上,其余两个氢原子分布在平面两侧。故甲苯分子中最多有13个原子共面。同理可分析萘 中10个碳原子、8个氢原子均共面,蒽分子 中14个碳原子、10个氢原子共面。 4.乙炔的直线结构 乙炔分子中的2个碳原子和2个氢原子一定在一条直线上。键角为180°,结构式为: H—C≡C— H。当乙炔分子中的一个氢原子被其他原子取代时,代替该氢原子的原子一定和乙炔分子中的其他原子共线。如
高中化学有机物共面共线专题及练习(含答案)
高中有机物分子中原子的共面、共线专题 一、知识归纳 有机分子结构中由于碳原子形成不同价键,造成空间构型存在差异,成为高考命题的采分点之一,也是同学们的“难以捉摸”的点,掌握有机物分子的空间构型的基准点和判断技巧会使问题迎刃而解。 一.有机分子中原子的共面、共线基准点 1.甲烷的正四面体结构 如图1所示,在甲烷分子中,一个碳原子和任意两个氢原子可确定一个平面,其余两个氢原子分别位于平面的两侧,即甲烷分子中有且只有三个原子共面(称为三角形规则)。当甲烷分子中某个氢原于被其他原子取代时,讨论取代该氢原子的其他原子的共面问题时,可将与甲基碳原子直接相连的原子看做代替了原来的氢原子。 CH3CH2CH3的结构如图2所示,左侧甲基和②C构成“甲烷”分子,此分子中⑤H、①C、②C构成三角形。中间亚甲基和①C、③C构成“甲烷”分子,此分子中①C、②C、③C构成三角形。同理②C、③C、④H构成三角形,即丙烷分子中最多有三个碳原子(①C、②C、③C)和两个氢原子(④H、⑤H)可能共面。 2.乙烯的平面结构 乙烯分子中的所有原子都在同一平面内,键角为120°(如图3所示)。当乙烯分子中某个氢原子被其他原子取代时,则代替该氢原子的原子一定在乙烯的平面内。 如图4所示是CH3CH=CH2的分子结构。由图可知,三个氢原子(①②③)和三个碳原子(④⑤⑥)一定共面。根据三角形规则(⑤C、⑥C、⑦H构成三角形),⑦H也可能在这个平面上。同理(CH3)2C=C(CH3)2中至少有6个原子(6个碳原子)共平面,至多有10个原子共平面:6个碳原子和4个氢原子(每个甲基可提供一个氢原子)共平面。 提示:羰基碳原子也是平面形碳原子,如图5甲醛即为平面型结构:
初三化学:分子和原子知识点汇总一
初三化学:分子和原子 知识点汇总一 TTA standardization office【TTA 5AB- TTAK 08- TTA 2C】
初三化学:分子和原子知识点汇总一 一、构成物质的微粒:分子、原子等微粒 1、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质 2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质 3、物质构成的描述:物质由××分子(或原子)构成。例如:铁由铁原子构成;氧气由氧分子构成。 二、分子 1、基本性质:⑴质量、体积都很小; ⑵在不停地运动且与温度有关。温度越高,运动速率越快例:水的挥发、品红的扩散; ⑶分子间存在间隔。同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。 ⑷同种物质间分子的性质相同,不同物质间分子的性质不同。 2、分子的构成:分子由原子构成。 分子构成的描述:①××分子由××原子和××原子构成。 例如:水分子由氢原子和氧原子构成 ②一个××分子由几个××原子和几个××原子构成。 例如:一个水分子由一个氧原子和二个氢原子构成
3、含义:分子是保持物质化学性质的最小微粒。 例:氢分子是保持氢气化学性质的最小粒子 4、从分子和原子角度来区别下列几组概念 ⑴物理变化与化学变化 由分子构成的物质,发生物理变化时,分子种类不变。 发生化学变化时,分子种类发生了改变。 ⑵纯净物与混合物 由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。 ⑶单质与化合物 单质的分子由同种原子构成;化合物的分子由不同种原子构成。 三、原子 1、含义:原子是化学变化中最小的微粒。例:氢原子、氧原子是电解水中的最小粒子 2、分子与原子的比较 3、化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
专题:有机物共线共面解析
分子中原子共线、共面问题一.熟记五类分子空间构型 代表 物 空间构 型 结构球棍模型结构特点CH4 正四面 体 任意3点(原子)共面 C—C键可以旋转 C2H4 平面结 构 6点共面 C=C键不能旋转C2H2直线型 4点共线(面) C≡C键不能旋转C6H6 平面正 六边形 12点共面 HCH O 平面4点共面 掌握上述几种分子的空间构型,以其为母体并将其从结构上衍变至复杂有机物中判断原子是否共线共面。
二、结构不同的基团连接后原子共面分析 1.直线与平面连接:直线结构中如果有2个原子(或者一个共价键)与一个平面结构共用,则直线在这个平面上。如CH 2=CH-C≡CH,其空间结构为 ,中间两个碳原子既在乙烯平面上, 又在乙炔直线上,所以直线在平面上,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。如苯乙烯分子 中共平面原子至少12个,最多16个。 3.平面与立体连接:如果甲基与平面结构通过单键相连,则由于单键的旋转性,甲基的一个氢原子可能暂时处于这个平面上。如丙烯分子 中,共面原子至少6个,最多7个。 4.直线、平面与立体连接:如图所示的大分子中共平面原子至少12个,最多19个。分析时要注意两点:①观察大分子的结构,先找出甲烷、乙烯、乙炔和苯分子的“影子”,再将甲烷“正四面体”、乙烯“平面型”、乙炔“直线形”和苯“平面型”等分子构型知识迁移过来即可;②苯环以单键连接在6号不饱和碳原子上,不管单键如何旋转,8号和9号碳原子总是处于乙烯平面上。不要忽视8号碳 原子对位上的9 1. 描述CH 3-CH =CH -C≡C-CF 3分子结构的下列叙述中,正确的是 A .6个碳原子有可能都在一条直线上 B .6个碳原子不可能都在一条直线上 C .6个碳原子有可能都在同一平面上 D .6个碳原子不可能都在同一平面上 2.(2010年西城期末)下列有机化合物分子中的所有碳原子不可能... 处于同一平面的是 A . B . C . D . 3.在 分子中,处于同一平面上的原子数最多可能是 A .12个 B .14个 C .18个 D .20个 HC C —CH 3 —CH 3 CH 3 —CH — CH 3 CH 3 CH 2 C CH 3 —CH 3
最新九年级化学分子和原子知识点归纳大全
最新九年级化学分子和原子知识点归纳大全 【学习目标】 1.认识物质是由分子、原子等微小粒子构成的;掌握分子的性质;掌握用粒子的观点解释某些常见的现象。 2.认识分子是保持物质化学性质的最小粒子;原子是化学变化中的最小粒子。 3.能用分子的观点来区别物理变化和化学变化、纯净物和混合物。 【要点梳理】 知识点一、分子 1.分子是真实存在的: (1)能闻到花香酒香及品红的扩散等现象,充分说明物质是由分子等微粒构成的,分子在不断地运动。 (2)运用现代科学技术手段已观察到了一些分子和原子,也充分证明分子是真实存在的。 2.分子的定义:分子是保持物质化学性质的最小粒子。 (1)构成物质的每一个分子与该物质的化学性质是一致的,分子保持的是物质的化学性质,如氧气的化学性质由氧分子保持,二氧化碳的化学性质由二氧化碳分子保持。 (2)分子不保持物质的物理性质。物质的物理性质(如颜色、状态)是由大量分子聚集在一起才能表现出来的,是宏观现象,不是单个分子能表现出来的。 3.分子的性质: (1)分子的质量和体积都很小。 (2)分子在不断地运动。温度越高分子运动的速率越快,如阳光下湿衣物干得快。 (3)分子之间有间隔。气体的分子之间间隔较大,液体和固体的分子之间间隔较小。气体比液体和固体容易压缩,不同液体混合后的总体积小于二者的原体积之和,都说明分子之间有间隔。 (4)同种物质的分子性质相同,不同种物质的分子性质不同。我们都有这样的生活体验:若口渴了,可以喝水解渴,吃几块冰块也可以解渴,这就说明:水和冰都具有相同的性质,因为水和冰都是由水分子构成的,同种物质的分子,性质是相同的。 【要点诠释】 1.构成物质的微粒具有质量小、体积小、不断运动、有间隔等基本特征。 2.分子是构成物质的一种粒子,而不是唯一的微粒,构成物质的微粒还有原子、离子。 3.分子是由原子构成的,不同分子的构成是不同的。如1个水分子是由两个氢原子和一个氧原子构成
有机物分子共线共面问题
有机物分子共线、共面问题 分子内原子共线、共面的判定,仅为一维、二维想象,但存在线面、面面的交叉,所以有一定的难度。 一、几个特殊分子的空间构型 1.常见分子的空间构型: ①CH4分子为正四面体结构,其分子最多有3个原子共处同一平面。 甲烷型:正四面体结构,4个C—H健不在同一平面上凡是碳原子与4个原子形成4个共价键时,空间结构都是正四面体结构以及烷烃的空间构型5个原子中最多有3个原子共平面。 四乙烯基甲烷最多多少原子共面 最多有11个原子共面。见图,C-C单键旋转后,能使得中间的5个C原子共面,且使得6个H原子与这5个碳共面,共有11个原子共面。 ②乙烯分子中所有原子共平面。 乙烯型:平面结构。六个原子均在同一平面上凡是位于乙烯结构上的六个原子共平面 ③乙炔分子中所有原子共直线。更共面
乙炔型:直线型结构。四个原子在同一条直线上凡是位于乙炔结构上的四个原子共直线。 ④苯分子中所有原子共平面。 苯型:平面正六边形结构。六个碳原子和六个氢原子共平面凡是位于苯环上的12个原子共平面。 ⑤H—CHO分子中所有原子共平面。 (1)熟记四类空间构型 中学有机化学空间结构问题的基石是甲烷、乙烯、乙炔和苯的分子结构。 (2)理解三键三角 三键:C—C键可以旋转,而C=C键、C≡C键不能旋转。 三角:甲烷中的C—H键之间的夹角为109°28′,乙烯和苯环中的C—H键之间的夹角为120°,乙炔中的C—H 键之间的夹角为180°。 2.单键的转动思想
1.直线与平面连接:直线结构中如果有2个原子(或者一个共价键)与一个平面结构共用,则直线在这个平面上。如CH2=CH-C≡CH, 其空间结构为,中间两个碳原子既在乙烯平面上,又在乙炔直线上,所以直线在平面上,所有原子共平面。 2.平面与平面连接:如果两个平面结构通过单键相连,则由于单键的旋转性,两个平面不一定重合,但可能重合。如苯乙烯分 子中共平面原子至少8个,最多16个。 同理可分析萘分子中10个碳原子,8个氢原子18原子共面 和蒽分子中14个碳原子,10个氢原子,共24个原子共面问题。 再如:其结构简式可写成最少6个碳原子(因双键与双键之间的碳碳单键可以转动)6个原子,最多10个碳原子共面。16个原子
初三化学:分子和原子知识点汇总一
初三化学:分子和原子知识点汇总一 一、构成物质的微粒:分子、原子等微粒 1、由分子构成的物质:例如水、二氧化碳、氢气、氧气等物质 2、由原子构成的物质:金属、稀有气体、金刚石、石墨等物质 3、物质构成的描述:物质由××分子(或原子)构成。例如:铁由铁原子构成;氧气由氧分子构成。 二、分子 1、基本性质:⑴质量、体积都很小; ⑵在不停地运动且与温度有关。温度越高,运动速率越快例:水的挥发、品红的扩散; ⑶分子间存在间隔。同一物质气态时分子间隔最大,固体时分子间隔最小;物体的热胀冷缩现象就是分子间的间隔受热时增大,遇冷时变小的缘故。 ⑷同种物质间分子的性质相同,不同物质间分子的性质不同。 2、分子的构成:分子由原子构成。 分子构成的描述:①××分子由××原子和××原子构成。 例如:水分子由氢原子和氧原子构成
②一个××分子由几个××原子和几个××原子构成。 例如:一个水分子由一个氧原子和二个氢原子构成 3、含义:分子是保持物质化学性质的最小微粒。 例:氢分子是保持氢气化学性质的最小粒子 4、从分子和原子角度来区别下列几组概念 ⑴物理变化与化学变化 由分子构成的物质,发生物理变化时,分子种类不变。 发生化学变化时,分子种类发生了改变。 ⑵纯净物与混合物 由分子构成的物质,纯净物由同种分子构成;混合物由不同种分子构成。 ⑶单质与化合物 单质的分子由同种原子构成;化合物的分子由不同种原子构成。 三、原子 1、含义:原子是化学变化中最小的微粒。例:氢原子、氧原子是电解水中的最小粒子 2、分子与原子的比较
3、化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
九年级化学分子和原子知识点
分子和原子 (一). 认识分子 1、分子的基本性质 (1)分子是构成物质的一种粒子,其质量、体积都非常小。 自然界中大多数的物质是由分子构成的。如:氧气、氮气、氢气、二氧化碳、水等。(2)分子在不断地做无规则运动。 温度越高,分子的运动速度就越快。 (3)分子之间有一定的间隔:气态>液态>固态 (4)同种分子的化学性质相同;不同种分子的化学性质不同 2、分子的概念:保持物质化学性质的最小粒子。 3、应用分子的观点认识: (1)纯净物、混合物: 纯净物混合物 由分子构成的物质中,由同一种分子构成的是纯净物。如冰、水共存物实际为纯净物,因为其中的构成粒子只有一种——水分子,由不同种分子构成的是混合物,如红磷和白磷的混合体为混合物,区分纯净物和混合物的关键是把握“物质的种类”或“分子的种类”是否相同。 (2)物理变化、化学变化 水蒸发是发生了物理变化,而水分解是发生了化学变化。 水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。水的化学性质也没有改变。水分解时,水分子变成了氢分子和氧分子。分子变了,生成的氢分子和氧分子不具有水分子的化学性质。 注意:在化学变化中,分子的组成一定改变,分子的数目可能改变。 (二). 认识原子 1、原子定义:化学变化中的最小微粒。 2、化学反应的实质:化学变化中分子分裂成原子,原子重新组合成新分子。 3、分子、原子的主要区别:在化学反应中,分子可分,原子不可分 4、分子、原子的相互关系:①分子是由原子构成的。 ②分子和原子都可以直接构成物质。 5、原子的基本性质:同分子相似。 (1)原子也是构成物质的一种粒子,其质量、体积都非常小。 (2)原子同分子一样,也是时刻不停地做高速的无规则运动。
高考化学有机物的共线及共面练习题
1.对于CH3—CH=CH—C≡C—CF3分子结构的描述 (1)下列叙述中,正确的是( ). A、分子中含极性共价键和非极性共价键; B、所有碳原子均在一条直线上; C、碳碳三键键能是碳碳单键的3倍; D、分子中既有σ键又有 键; (2)一定在同一直线上的碳原子个数为______。 (3)位于同一平面内的原子数最多有______个。 2.(1)下列有机分子中,所有的原子不可能处于同一平面的是( ) =CHCN =CH—CH=CH2 C.苯乙烯 D. 异戊二烯 (2)上述分子中所有原子一定处于同一平面的是( ) 3.下列有机物分子中所有原子一定在同一平面内的是( ) 4.如图所示分子中14个碳原子不可能处在同一平面上的是( ) 5.(2013·中山)关于下列结论正确的是( )。 A.该有机物分子式为C13H16 B.该有机物属于苯的同系物
C.该有机物分子至少有4个碳原子共直线 D.该有机物分子的13个碳原子可能共平面 6.(08宁夏卷)在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是 ( ) A.①②B.②③C.③④D.②④ 7、已知C—C单键可以绕键轴旋转,其结构简式可表示为的烃,下列说法中不正确的是() A.该烃是苯的同系物 B.该烃的一氯代物最多有3种 C.分子中至少有10个碳原子处于同一平面上 D.分子中至少有6个碳原子处于同一直线上 8.某有机物分子的结构简式为 。下列说法中不正确的是 A.1mol该有机物最多能和6molH2发生加成反应 B.该有机物分子中在同一直线上的原子最多有4个 C.该有机物分子中可能在同一平面上的原子最多有16个 D.该有机物只能被还原不能被氧化(燃烧反应除外) 11、(09届盐城市摸底考试)经研究发现有白蚁信息素有: (2,4-二甲基-1-庚烯) ,,家蚕的性信息素为:CH3(CH2)2CH=CH—CH=CH(CH2)8CH3。下列说法正确的是。 A.以上三种信息素互为同系物 B.以上三种信息素均能使溴的四氯化碳溶液褪色 C.2,4-二甲基-1-庚烯与3,7-二甲基-1-辛烯互为同系物 D.家蚕信息素与1molBr2加成产物只有一种
分子和原子知识点总结
分子和原子知识点总结 物质分别是由分子、原子、离子三种微粒构成的。小编为大家整理的分子和原子知识点总结,喜欢的朋友不要错过了。 1.分子定义:物质分别是由分子、原子、离子三种微粒构成的,其中分子又是由原子构成的。物质由元素组成。如:水分子是由氢原子、氧原子组成;而水分子构成了水; 2.分子的特点: (1)分子在不断地运动;如:在厨房炒菜,在其他地方可以闻到香味。 (2)分子之间有间隙;如:100ml酒精加100ml水得到的溶液小于200ml。 (3)分子的体积和质量都非常小;如:1ml水中大约有×1021 个水分子。 (4)同种物质的分子性质相同,不同种物质的分子性质不同。 (5)分子在化学变化中可以再分。 注:说明分子在运动的离子很多,比如能闻到的各种香味,就是各种分子在空气中不停的运动造成。分子间有间隔的例子有:气体可以压缩存于钢瓶中,气体热胀冷缩的额现象。 3.应用:
(1)分子是构成物质的一种微粒。 (2)解释物质的三态变化。 1.定义:分子可以分为原子。由此我们便知道原子的性质和分子很相似。原子是化学变化中的最小粒子。 2.原子的特点: (1)原子的质量和体积都很小;这点和分子很相似。 (2)原子总是不停的运动着;和分子一样。 (3)原子之间有间隔。和分子一样。 (4)原子是构成物质的一种微粒。 (5)原子在化学变化中不可再分,只是发生重新组合。 3、原子结构:原子是化学变化中的最小颗粒 原子核所带的正电量=核外电子所带的负电量 原子核内的质子数=核电荷数=核外电子数 我们可以把一个原子想成一个鸡蛋,原子核就是蛋黄,核外电子是蛋白,质子、中子是组成蛋黄的东西。 注: ①从上图我们可以看出来整个原子不带电。 ②一个质子的质量与一个中子的质量相近,它们的质量比电子大得多! ③原子的质量几乎集中在原子核上,所以可以说决定原子质量大小的主要粒子是质子和中子。 4、原子的性质
有机物分子共线共面完整问题 答案
有机物分子共线、共面问题 例题: 1、丙烷中最多有 3 个碳原子共面,最多有 5 个原子共面。 2、① 丙烯中有 3 个C 原子共面和 3 个H 原子一定共面。 丙烯中至少有 3 个C 原子共面和 3 个H 原子共面。 丙烯中最多有 3 个C 原子共面和 4 个 H 原子共面。 丙烯中可能有 3 个C 原子共面和 4 个H 原子共面。 ②2,3—二甲基—2—丁烯至少有 6 个原子共面,最多有 10 个原子共面。 ③右上图的二烯烃至少有 6 个C 原子共面,最多有 10 个C 原子共面。 至少有 6 个原子共面,最多有 16 个原子共面。 3、甲苯有 12 个原子一定共面,最多有 13 个原子共面。 4、丙炔有 4 个原子一定共线,最多有 5 个原子共面。 5、①下图该有机物有 4 个原子一定在一条直线上,至少有 8 个原子共面,最多有 9 个原子共面。 CH 3-CH 2—CH =C(C 2H 5)-C ≡CH 中含四面体结构的碳原子数为 4 , 在同一直线上的碳原子数最多为 3 ,一定在同一平面内的碳原子数为 6 , 最少共面的原子数为 8 ,最多共面的原子数为 12 。 C=C CH 3 ╲ CH 3 ╱ H 3C ╱ ╲ H 3C C=C ╲ CH 3 ╱ ╱ H 3C C=C CH 3 ╲ CH 3 ╱ H 3C ╱ H 3C ╲
③CH3CH=CH-C≡C-CH3分子中,处于同一平面上的原子数最多可能是20 个。 【练习】 1、下列有机分子中,所有的原子不可能处于同一平面的是(D ) A.CH2=CH-CN B.CH2=CH-CH=CH2 C. CH=CH2 D.CH2=C-CH=CH2 CH3 2、(双选)描述CH3-CH=CH-C≡C-CF3分子结构的下列叙述中,正确的是(BC) A.6个碳原子有可能都在一条直线上B.6个碳原子不可能都在一条直线上 C.6个碳原子一定都在同一平面上D.6个碳原子不可能都在同一平面上 该分子结构中至少可以有8 个原子在同一个平面?最多可以有10 个原子在同一个平面 3、甲烷分子中四个氢原子都可以被取代。若甲烷分子中的四个氢被苯基取代,则可得到的分子如下图,对该分子的描述,不正确的是( B ) A.分子式为C25H20 B.所有碳原子都在同一平面上(中心碳原子甲烷型) C.此物质属于芳香烃 D.此分子最多有13个碳原子在一个平面上 (提示:有可能两个苯和一个中心碳原子,共一个平面。) 4、六苯乙烷为白色固体,其结构表示如图: 下列有关说法中不正确的是( C ) A.它是一种芳香烃,易溶于乙醚中 B.它的分子式为C38H30,是非极性分子 C.它的一氯代物只有一种 D.在同一平面上的原子最多有14个
有机物分子中的原子共线共面(学案)
有机物中的原子共线共面问题(学 案) 一、巩固练习 【练习1】(09年浙江高考题).一种从植物中提取的天然化合物α-damascone 可用于制作香水,其结构 为: O , 有关该化合物的下列说法不正确... 的是( ) A .分子式为C 13H 20O 。 B .该化合物可发生聚合反应。 C .1 mol 该化合物完全燃烧消耗19 mol O 2。 D .与Br 2的CCl 4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO 3溶液检验。 【练习2】(09年上海高考)奥运吉祥物福娃外材为纯羊毛线,内充物为无毒的聚酯纤维: 下列说法不正确... 的是 A .羊毛与聚酯纤维的化学成分不相同。 B .由单体合成聚酯纤维的反应属加聚反应。 C .该聚酯纤维单体为对苯二甲酸和乙二醇。 D .聚酯纤维和羊毛一定条件下均能水解。 二、基础知识的回顾 典型有机物的空间构型 空 间 结 构 典 型 代 表 物 正四面体结构 平面型结构 直线型结构 H '28109 H H H C C H H C H H 120° 120° 图3 乙烯结构 H C C H 180 180 三、知识的拓展 【问题1】 在丙烷分子中,最多有多少个原子共面? C H 图2 丙烷的分子结构 H H ① ⑤ H C H ② H C H H ④③
【问题2】在丙烯分子(23CH CH CH =)中,至少有多少个原子共面?最多有多少个原子共面?。 图4 丙烯的分子结构 ②H ①H ⑤④③ C H C H H ⑦⑥ C H 【问题3】 (1)2323)()(CH C C CH = (2) 3323()()(CH C CH C C CH =【问题4】 (1)在 C H H H ①③ ② 分子中,至少有多少个原子共面?最多有多少个原子共面? (2)CH 2 ② ③ ① 分子中,共面的原子有多少个? 【问题5】 (1) 在H C C CH C C H H 3 ② ③ ④ ① 分子中,至少有多少原子共面?最多有多少个原子共面? (2) 分子中,最多有多少个原子共面? 四、课堂练习
九年级上册化学 分子和原子知识点梳理
分子和原子知识点梳理 课题1、分子和原知识点梳理 知识点一:物质是由分子和原子构成的。 1.认识分子 1、分子的基本性质 (1)分子是构成物质的一种粒子,其质量、体积都非常小。 自然界中大多数的物质是由分子构成的。 (2)分子在不断地做无规则运动。 温度越高,分子的运动速度就越快。 (3)分子之间有一定的间隔:气态>液态>固态 (4)同种分子的化学性质相同;不同种分子的化学性质不同 2、分子的概念:保持物质化学性质的最小粒子 3、应用分子的观点认识: (1)纯净物、混合物: 纯净物混合物
由分子构成的物质中,由同一种分子构成的是纯净物。如冰、水共存物实际为纯净物,因为其中的构成粒子只有一种——水分子,由不同种分子构成的是混合物,如红磷和白磷的混合体为混合物,区分纯净物和混合物的关键是把握“物质的种类”或“分子的种类”是否相同。 (2)物理变化、化学变化 水蒸发是发生了物理变化,而水分解是发生了化学变化 水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。水的化学性质也没有改变。水分解时,水分子变成了氢分子和氧分子。分子变了,生成的氢分子和氧分子不具有水分子的化学性质。 注意:在化学变化中,分子的组成一定改变,分子的数目可能改变。 二)认识原子 1、原子定义:化学变化中的最小微粒 2、化学反应的实质:化学变化中分子分裂成原子,原子重新组合成新分子。 3、分子、原子的主要区别:在化学反应中,分子可分,原子不可分 4、分子、原子的相互关系: 5、原子的基本性质: (1)原子也是构成物质的一种粒子,其质量、体积都非常小。 (2)原子同分子一样,也是时刻不停地做高速的无规则运动。 温度越高,能量越大,运动速度就越快。 (3)原子之间也有一定的间隔 原子: 分子:
初三化学:分子和原子知识点汇总二
初三化学:分子和原子知识点汇总二 二、考点清单 1、认识物质的微粒性,知道分子、原子的区别与联系 2、能用分子的观点解释某些常见的现象 3、认识原子的构成。初步了解相对原子质量 三、全面突破 知识点1:分子和原子 一)认识分子 1、分子的基本性质 (1)分子是构成物质的一种粒子,其质量、体积都非常小。 自然界中大多数的物质是由分子构成的。 (2)分子在不断地做无规则运动。 温度越高,分子的运动速度就越快。
(3)分子之间有一定的间隔:气态>液态>固态 (4)同种分子的化学性质相同;不同种分子的化学性质不同 2、分子的概念:保持物质化学性质的最小粒子 3、应用分子的观点认识: (1)纯净物、混合物: 纯净物混合物 由分子构成的物质中,由同一种分子构成的是纯净物。如冰、水共存物实际为纯净物,因为其中的构成粒子只有一种——水分子,由不同种分子构成的是混合物,如红磷和白磷的混合体为混合物,区分纯净物和混合物的关键是把握“物质的种类”或“分子的种类”是否相同。 (2)物理变化、化学变化 水蒸发是发生了物理变化,而水分解是发生了化学变化 水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。水的化学性质也没有改变。水分解时,水分子变成了氢分子和氧分子。分子变了,生成的氢分子和氧分子不具有水分子的化学性质。 注意:在化学变化中,分子的组成一定改变,分子的数目可能改变。
二)认识原子 1、原子定义:化学变化中的最小微粒 2、化学反应的实质:化学变化中分子分裂成原子,原子重新组合成新分子。 3、分子、原子的主要区别:在化学反应中,分子可分,原子不可分 4、分子、原子的相互关系: 5、原子的基本性质: (1)原子也是构成物质的一种粒子,其质量、体积都非常小。 (2)原子同分子一样,也是时刻不停地做高速的无规则运动。 温度越高,能量越大,运动速度就越快。 (3)原子之间也有一定的间隔 原子: 分子:
有机物原子共面共线的判断技巧
有机物原子共面共线的判断技巧 基本理论: ①“等位代换不变”原则。以上基本结构上的H 原子,无论被什么原子替代,所处空间结构维持原状。如苯环上的H 被 甲基取代时,甲基中的C 的位置,与原来的H 的空间位置相同,即它与苯环共面。 ②单键可以沿键轴旋转,双键和三键不能沿轴转。若平面间靠单键相连,所连平面可以绕键轴旋转,可能旋转到同一平面上也 可能旋转后不在同一平面上。如 ③若平面间被多个点固定,且不是单键,则不能旋转,一定共平面。如右图: ④分拆原则。可把复杂的构型,分拆为几个简单构型,再分析单键旋转时可能的界面。如甲苯可分拆为甲烷(含苯环内与其相连的C ,替代甲烷的H )和苯(含与苯环相连的环外C ,替代苯环的H )来看。 原则:有机物分子中原子共平面的问题,解决方法是:由简单到复杂。 首先要掌握以下几种最简单有机物的空间构型: (1)乙烯(CH 2 CH 2)分子是“X ”型平面结构,2个碳原子、4个氢原子共平面; (2)乙炔(C C H H )分子是直线型结构,4个原子在同一直线上; (3)苯()分子是“O ”型平面正六边形结构,6个碳原子、6个氢原子共平面; (4)甲烷(CH 4)是“正三棱锥”型且C 藏于锥心的正四面体结构,任意3个原子共平面; (5)甲醛(C H H O )分子是“Y 型”平面结构,4个原子共平面。 ◆下列物质分子中的所有碳原子不可能在同一平面上的是 A 、 B 、 C 、 D 、 答案:B 解析:A 、任意三点必成一面。 B 环烷当碳原子大于3时,碳原子均不可能在同一平面。 C 、两个X 型相连,旋转相连的单键,可能在同一平面 D 甲基上的碳与苯环上的H 等位代换,必与苯环在同一平面。 ◆下列分子中的14个碳原子不可能处在同一平面上的是:( ) 答案: A 、C 解析:A 中R 基:中心碳均以单键连接四个原子(原子团),可视为甲烷的立体结构,它所连的四个点,不可能在一平面内。 B 、多点固定,且非单键,不可旋转。这样的结构均为同一平面。 C 、与CH 3相连的C 原子周围全部是单键。它外连的原子有(苯环上各一个C ,一个H 原子和一个甲基)形成立体结构。正四面体结构上任意三个点组成的面,必定不包含另外两个点(原子)。因此,甲基上的碳原子,必在该平面外。所以,14个碳原子不可能处在同一平面上。 D 、两个甲基C 均在相连的苯环平面内。两苯环单键连接,可旋转。有可能在同一平面内。 ◆甲烷分子中的4个H 原子全部被苯基取代,可得到如图所示的分子,对该分子的描述不正确的是:( ) A 分子式为C 25H 20 B 所有碳原子都在同一平面上 C 所有的碳原子和氢原子不可能在同一平面上 D 该物质为芳香烃 答案: B 分析:可把该物质视为甲烷分子。与中心碳相连的四个碳,为立体结构,不可能在同一平面。
