大鼠灌注固定的方法

大、小鼠灌注固定的方法
准备物品:
1、灌注针(灌注用的针可以是临床上的静脉套管针,便于穿刺)
2、医用输液器
3、500ml输液用玻璃瓶
4、血管钳
5、剪刀
6、生理盐水
7、4%多聚甲醛(4℃),0.1M的PB配制
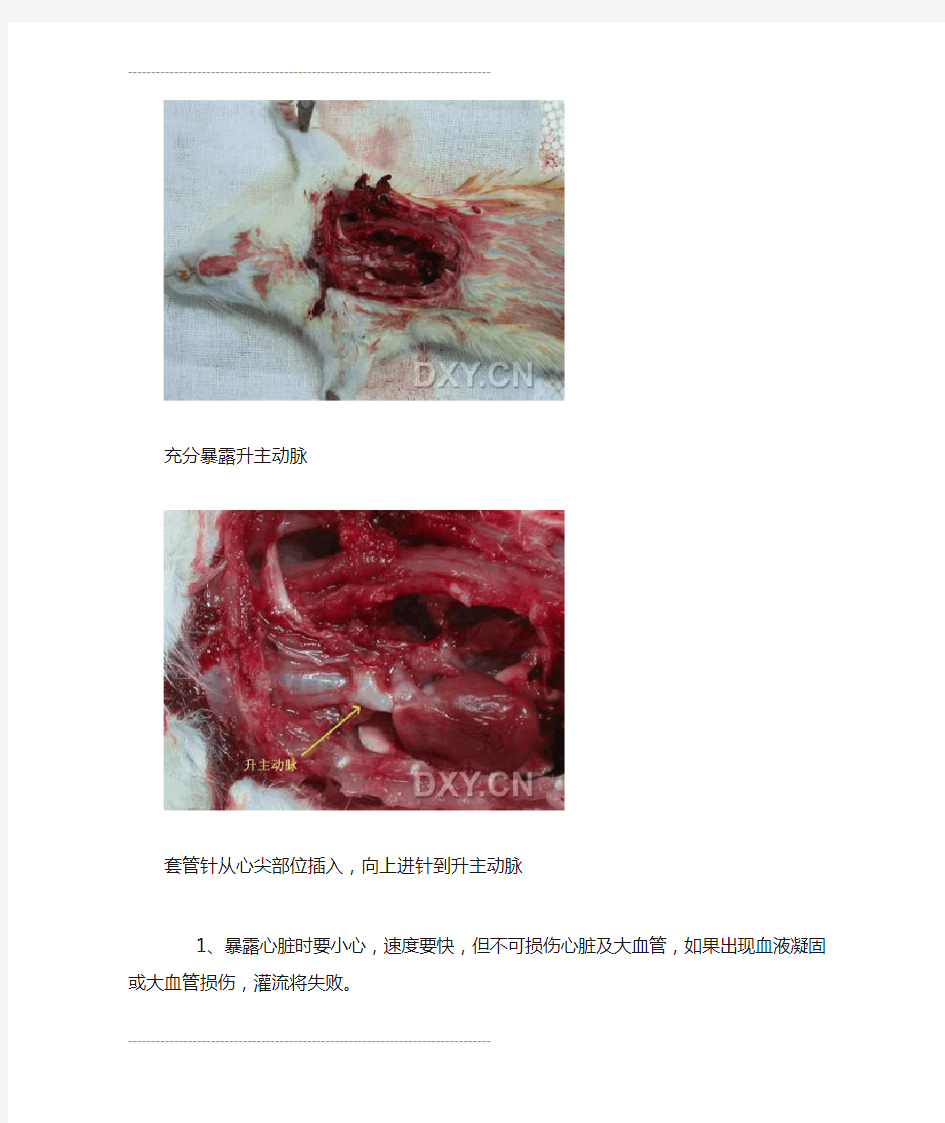
大鼠深度麻醉,迅速打开胸腔,暴露心脏,此时注意用血管钳钝性分离心包及周围软组织以便充分暴露心脏。左手持镊子捏住心脏,右手持套管针从心尖部位插入,向上进针到升主动脉。取出套管针内芯,连接生理盐水,打开输液开关,快速灌注,同时用剪刀在右心耳处剪一小口,待流出的液体无色后(约60ml即可)更换为多聚甲醛。多聚甲醛灌注速度为先快后慢,快速灌注50ml后放慢速度,缓慢滴注维持即可,每只大鼠约需100ml。如果多聚甲醛灌注充分,则动物四肢和全身肌肉会不停抽动。如此灌注约需1小时时间。
充分暴露升主动脉
套管针从心尖部位插入,向上进针到升主动脉
1、暴露心脏时要小心,速度要快,但不可损伤心脏及大血管,如果出现血液凝固或大血管损伤,灌流将失败。
2、最好是剖开右心室,但是因为暴露的问题,有误剪到左心室的可能。相对来说,剪开右心耳更为方便。我们就是这样做的。
3、灌流的效果:PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常。另外,大鼠耳尖,口唇,四肢掌部也会变苍白。
4、PBS或NS灌流需缓慢而持续,防止血液血管内凝固。有条件的话可加点肝素。
5、先主动脉插管,再右心耳放血,这样插管容易些。先剪右心耳的话,心脏会瘪下去的。小鼠灌注固定方法:
采用水合氯醛麻醉后剪开胸腔,动作要快,经左心室插入头皮针连接的20
mL注射器(头皮针磨钝,从与身体纵轴成45°角的方向进针,针尖插入升主动脉内,可以看见,动作要轻柔),同时剪开右心耳,推入20
mL 生理盐水。推完以后迅速换4 ℃多聚甲醛20 mL,灌完以后取材基本就可以了。
线栓法大鼠脑缺血再灌注模型(MCAO)制备方法.pdf
线栓法大鼠脑缺血再灌注模型制备 前言 相信不少神经内科的研究生都作过或将要作大鼠线栓模型,都有一个从查文献了解方法到跟师兄、师姐学习再到自己体会摸索直至熟练的过程,在模型制作的过程中可能的经历了从模型不成功的郁闷到熟练后成功的喜悦(我们是有这样的感觉)。为了缩短各位将要作或刚开始作MCAO模型的战友的摸索过程,提高模型制作的成功率,我们愿意将自己的经验与大家分享,相信各位战友看过后将对制作大鼠线栓模型有更深的认识,并以其为乐趣,同时欢迎各位熟练的战友与我们交流经验。 第一部分线栓模型制备理论及经验 ⒈ 插线法局灶性脑缺血模型简介 八十年代 Koizumi 和 Longa 创用了不开颅的大鼠 MCA 可逆性脑梗塞模型,此后,应用插线法制备大鼠局灶性脑缺血再灌注模型的方法不断改进和完善,已渐趋成熟,目前该法已逐渐取代开颅法而成为最流行的方法。该模型先阻断颈外动脉(ECA)及其分支,且阻断翼腭动脉(PPA),以切断颅外来源的侧副循环血流。从 ECA 插入尼龙线,经颈内动脉(ICA)到 大脑前动脉(ACA),机械性阻断大脑中动脉(MCA)发出处的血供来建立大脑中动脉缺血模型。此模型可在无麻醉状态下拔出尼龙线,恢复血流,实现再灌注。 1994 年 Huang 等[55]首次将线栓技术应用于小鼠局部永久性脑缺血模型。1997 年 Hara 等[56]将线栓技术改进后应用于小鼠局部暂时性脑缺血模型。此后不断有学者借助于显微技术和多功能生理监测手段建立小鼠局部线栓脑缺血模型[57,58]。国内蒋晓帆等[59],王芙蓉等[60] 也对该方法进行了研究。线栓法具有不开颅、效果肯定、可准确控制缺血及再灌注时间的优点,用于研究神经元 对缺血的敏感性、耐受性,药物疗效观察以及再灌注损害和治疗时间窗较为理想,同时也具有对全身影响小、动物存活时间长的特点,适于慢性脑损伤的研究。控制好易变因素,可避免实验结果的不稳定性。但线栓造模也并非完美无缺,存在着下列不足:①线栓造模过程是非直视下的手术,血流是否完全阻断不能即刻得知。②动物品系、体重、批次会影响结果。动物饲养条件好的单位所繁育的动物,可以使影响程度降低。③操作者的科研训练影响结果。严格的训练和足够例数的实践可以复制出稳定的结果。④血管破裂出血。操作不小心极易刺破血管或拔线栓时引起出血。轻柔、精细的操作可以减少血管破裂的发生。
取小鼠脑组织
丁香园上面总结的方法,排版有点乱。 其实过程与大鼠近似,我的经验是: 1. 材料准备;大剪刀、眼科剪、眼科镊、大镊子、滤纸、竹签等; 2. 步骤:处死小鼠,取头颅; 剪开皮肤,漏出颅骨; 用大尖镊子夹住两侧眼眶,用眼科剪稍剪除颅骨中线; 再用眼科镊夹住颅骨从内向外夹,从下向上逐步去除颅骨; 当全脑露出时,再用眼科镊去除脑膜和血管; 然后用竹签从嗅球处向下取出全脑,即可。 3. 注意事项:用力轻柔,否则容易弄破脑部; 用剪刀剪颅骨时,一定要贴壁向上剪,否则容易剪破脑部; 去除脑膜时,不能硬拉,否则容易弄破大脑; 取出全脑时应把头顶朝下,用竹签轻轻取出,离桌面也不要太远、高; 若留病理,建议一定要取完整无损的大脑。 做免疫组化的话,稍微麻烦一点儿,因为脑组织含水量多,要固定的好,就需要先灌注。先麻醉小鼠 剪开胸腔,找到心脏,从心尖入针,剪开右心耳 先用生理盐水灌注直到从心耳流出来的水清亮了 再改用固定液(一般是4%多聚甲醛)灌注至小鼠四肢僵硬 小鼠只需要用注射器就行了,我做的25~35g的小鼠一般用50mLNS+30mL多聚甲醛。具体步骤:常规麻醉小鼠,将其固定,用剪刀剪开胸部皮肤,暴露出皮下组织,剪开时注意钝性分离,以免误伤。然后用镊子提起剑突,用剪刀剪开胸腔,剪断两侧肋骨,暴露整个胸腔,小心误伤肺及心脏、大血管。用镊子撕开心包膜,暴露心脏,用眼科剪剪开右心耳,然后提起心尖将准备好的生理盐水注射器插入左心室,注射,注射时小心针头滑脱。生理盐水灌流至肺和肝的颜色都变成灰白色即可。然后用多聚甲醛灌流,针孔最好是同一个,多聚灌流时小鼠四肢会抽搐,待抽搐结束,小鼠僵硬即可。取下小鼠,用剪刀在颈部离断头颅,用剪刀在小鼠头颅中间皮肤剪一刀,将两边皮肤向下翻用手捏住,暴露整个颅骨,用眼科剪从脊髓端插入椎孔,沿着颅正中线剪开颅骨,注意剪刀向上翘一些,以免误伤脑组织,剪开后用弯眼科镊分离颅骨,小心分离,直至暴露整个大脑,然后用弯镊伸入颅底离断颅底神经,就可以取出整个脑子了。放多聚里固定24h后包埋切片即可。 具体操作如下: 实验操作步骤: 1) 小鼠称重,以每克小鼠0.0025ml 4%戊巴比妥钠剂量的实施腹腔麻醉。也可以用10%的水合氯醛,3-5ul/g腹腔注射麻醉。 2) 将麻醉的小鼠仰放在操作台上,去毛。 3) 解剖小鼠,暴露心脏。 4) 找到心尖部,左手用镊子提起心尖部,右手或左手将灌流针刺破心尖部进针约0.5cm(最好是用小点的针头,用止血钳固定针尖,剪开右心耳。 5) 将灌流器的导管部开口放到生理盐水中里,打开灌流器灌流,直到从右心耳流出的液体为无色,同时小鼠肝脏色淡,肠管肿胀为止,停止灌流。没有灌流器的用注射器或者吊瓶都可以。
大鼠灌注固定的方法
大、小鼠灌注固定的方法 准备物品: 1、灌注针(灌注用的针可以是临床上的静脉套管针,便于穿刺) 2、医用输液器 3、500ml输液用玻璃瓶 4、血管钳 5、剪刀 6、生理盐水 7、4%多聚甲醛(4℃),0.1M的PB配制 大鼠深度麻醉,迅速打开胸腔,暴露心脏,此时注意用血管钳钝性分离心包及周围软组织以便充分暴露心脏。左手持镊子捏住心脏,右手持套管针从心尖部位插入,向上进针到升主动脉。取出套管针内芯,连接生理盐水,打开输液开关,快速灌注,同时用剪刀在右心耳处剪一小口,待流出的液体无色后(约60ml即可)更换为多聚甲醛。多聚甲醛灌注速度为先快后慢,快速灌注50ml后放慢速度,缓慢滴注维持即可,每只大鼠约需100ml。如果多聚甲醛灌注充分,则动物四肢和全身肌肉会不停抽动。如此灌注约需1小时时间。 充分暴露升主动脉
套管针从心尖部位插入,向上进针到升主动脉 1、暴露心脏时要小心,速度要快,但不可损伤心脏及大血管,如果出现血液凝固或大血管损伤,灌流将失败。 2、最好是剖开右心室,但是因为暴露的问题,有误剪到左心室的可能。相对来说,剪开右心耳更为方便。我们就是这样做的。 3、灌流的效果:PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常。另外,大鼠耳尖,口唇,四肢掌部也会变苍白。 4、PBS或NS灌流需缓慢而持续,防止血液血管内凝固。有条件的话可加点肝素。 5、先主动脉插管,再右心耳放血,这样插管容易些。先剪右心耳的话,心脏会瘪下去的。小鼠灌注固定方法: 采用水合氯醛麻醉后剪开胸腔,动作要快,经左心室插入头皮针连接的20 mL注射器(头皮针磨钝,从与身体纵轴成45°角的方向进针,针尖插入升主动脉内,可以看见,动作要轻柔),同时剪开右心耳,推入20 mL 生理盐水。推完以后迅速换4 ℃多聚甲醛20 mL,灌完以后取材基本就可以了。
小鼠灌注取脑
成年小鼠心脏灌流及取脑组织步骤 实验步骤: 1、小鼠麻醉后立即将其用针头固定在泡沫板上(用针头插住四肢)。用镊子扯起胸部皮肤,另一只手用剪刀剪开胸腔的皮肤和肋骨,暴露出心脏和肝脏。 2、将注射针头插入小鼠左心室,同时将小鼠肝脏减掉,以使血液流出。灌注生理盐水,时间维持在1min(10~20ml)灌注液左右,血液排除后四肢、肝脏和舌头会变白。 3、待小鼠四肢、肝脏和舌头变白之后,用4%PFA#流固定,当PFA 流至大脑处可能会使小鼠尾巴略有反射现象(有时可能没有),此时可将灌流速度下调,以使固定更加充分。整个PFA灌流时间约为5min。 (固定原理:多聚甲醛可以使蛋白质交联)4、将导管始端从PFA中拿出,待管中液体流尽后,将心脏上的针头拔下,如果固定的较好,可发现小鼠眼球呈现白色。将托盘中的血液倒至废液桶内,并准备下一步的取脑操作。 取脑及脱水:
1、剪开头部皮肤,露出白色头盖骨。将延髓上包被的软骨剪开,除去多余的结缔组织。需要注意的时,眼睛要由剪刀剪下,不能够直接扯下来,因为眼睛后部连着视神经,如果扯的话有可能会损坏视交叉上核等其他脑部组织。 2、将头盖骨小心剥开,露出白色的脑部,在剥嗅球部位时要格外小心,必要的话可以先将嗅球前部的碎骨留着待进一步固定之后再去除。 3、将头盖骨剥开后,将脑下部连接的神经逐条剪短(可看到视神经交叉),待全部剪断后将脑整个剥离出来。 4、将剥离出来的脑浸泡在4%PF/中,过夜固定。 5、将PFA液换为30%蔗糖进行脱水(防止冷冻切片时形成冰晶和孔洞),初始脱水时脑会浮在蔗糖上面,待完全脱水后脑会沉底。此时可将脑取出进行冷冻切片。
灌流取脑
大鼠灌注固定取脑 准备物品: 37℃的温生理盐水500ml、10%的中性甲醛或4%的多聚甲醛固定液500 ml、500 ml的输液瓶2个、输液管2副、三通1个,镊子、剪刀、止血钳各2把、灌注针(将12号注射用针头的针尖掐断磨钝圆、光滑即可)1个、麻醉剂、步骤 1)将两个输液瓶中分别装满生理盐水和固定液并将输液管安装在生理盐水瓶上并调整好,使管内没有气泡。 2)将动物麻醉,数分钟后,待动物前后肢放松,即可准备灌注。 3)将已麻醉的动物仰卧在解剖台上,固定四肢,用左手持镊子夹起腹部皮肤,右手持剪刀自腹部剪一小口,由此沿腹中线和胸骨剑突中线向上将皮肤剪至下颌,分离皮下组织,将皮肤翻向两侧,再沿腹中线和胸骨中线向上剪开胸骨,沿膈肌向两侧剪开,并用止血钳将胸骨和胸部的皮肤钳紧,将止血钳翻向外侧以充分暴露心脏。小心用镊子将心包打开,滴一些生理盐水保持湿润。 4)分离出主动脉,穿一根丝线,准备结扎灌针。 5)将左心室尖用眼科剪刀剪开一小口,将灌注针插入心室并送至主动脉内,用丝线结扎牢固,使之不能退出,打调节阀,灌注生理盐水,灌注时的灌流量约20 ml/分钟。时,剪开右心耳,使血液排出。观察肝脏逐渐变为白色为止 6)旋转三通使之对准灌注液,开始灌注固定液。固定液进大鼠血管后,逐渐出现四肢抽动,表明灌注液进入大鼠大脑,待抽动完全停止,全身组织器官变硬后即可取材。 7)取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边地顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。取出的脑在同样固定液中4℃再固定4-6小时。 8)保存或切片注意事项: 1、将灌注针插入主动脉内是灌注固定的关键,也是难点。首先准确找到主动脉,这是此步骤的要点。可用温生理盐水将胸腔内的血液冲洗干净,用眼科镊子轻轻夹住心外膜(夹的越少越好,以免影响取材)将心脏向左上方提起,即可看清主动脉,又可使灌注针很容易地插入主动脉内。插入时动作要慢,针尖方向不要偏向右侧,以免刺入右心房,如果感到有阻力,则将针退后、调整方向重新进针,直到进入主动脉,灌注针进入主动脉后可在心脏的上方看到其位置,灌注针进入主动脉的长度最好为3~5毫米,然后用丝线扎紧。切勿将灌注针放在左心室内,这样由于主动脉瓣的关闭,灌注液很难进入主动脉,而是沿着心室的切口流出,致使灌注失败。另外,灌注针插入成功后,一定要用剪刀剪开右心耳而不是右心室,这是灌流液的出口。剪开心尖的位置一定要掌握好,不能偏右使灌注针插入右心室。 2、配4%多聚甲醛PBS缓冲液:称取40g PFA溶于装有500ml DEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L的NaOH直至7.0,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。 加热至60~65℃固然融解的快,只需要15分钟左右,不过容易挥发,气味难闻,需配置的量比较大的时候是较合适的方法。如果有通风厨的可在通风厨内配置,就基本没有气味散发的问题。在通风较好的地方配置也可以,但配置的时候配溶液的人一定要注意自我防护,味道确实很刺激!。如果不着急,可先配好pbs,称好相应的多聚甲醛,37℃水浴或温箱密
大鼠线栓(MCAO)模型+灌注取脑+TTC染色
第一部分 线栓模型制作 1、实验器材(从左到右): 第一行:干棉球、酒精棉球、10%水合氯醛+注射器、碘伏+棉签 第二行:三种不同粗细的鱼线(鱼线最好在2.0、2.5mm处各用记号笔作好标记,便于观察进入距离)、弯盘内为手术器材 第三行:记号笔、自制拉钩(皮筋+曲别针+大头针) 2、麻醉: 可用饮料瓶自制捕鼠器(适用于不敢手抓大鼠的),用于打麻药,根据大鼠的重量选择不同粗细的饮料瓶(太粗了大鼠可在瓶中回头)。 效果图
3、麻倒后绑在手术台上。 4、剪去颈前的鼠毛,碘伏消毒。 5、沿经部正中切开皮肤。 说明:切开皮肤前最好将结扎动脉的线事先剪好(后面会用到)。
6、钝性分离皮下组织。 如图:大鼠腹侧可见事先剪好的结扎线。 7、分离到气管前肌后,沿右侧胸锁乳突肌腱向下分离,见到颈动脉鞘后可上拉钩。
8、分离动脉鞘。 如图:分离好后见光滑的颈总动脉。 9、分离出颈总、颈外、颈内动脉,结扎颈总、颈外动脉,注意中间那根线不要系紧,用来插鱼线时防止出血的。
10、夹闭颈内动脉,用眼科剪将颈总动脉剪一小口。 11、插入鱼线,鱼线进入颈内动脉后按图中注释方法插(成功率在90%以上)。 说明: (1)这一步鱼线选择是关键,根据大鼠重量(作的多了后根据动脉粗细就可选择了)选鱼线。我们的经验是:250g以
下的选0.26mm的线,250-300g的选0.26mm蘸腊的或0.28的都可以。 (2)如果遇到鱼线怎么也查不进去的情况,可让大鼠休息一会,换细点的鱼线再试,这种情况不一定都是进到翼腭动脉了,我曾解剖过4例这种情况的大鼠,有三例都是在如颅的地方卡住了,可惜我们手里没有0.24mm的鱼线。 (3)通过实践,我们认为结扎或夹闭翼腭动脉没有必要,按我们的方法,熟练的话,从切开到缝合完毕也就是15分钟,算上准备工作(如麻醉、消毒等)半小时也可以搞定了,这样一上午两人作10只大鼠不成问题。 (4)我们体会最好用蘸腊的鱼线作模型,好处是进线深度控制的好,不容易出现蛛网膜下腔出血。我们曾试过0.26mm 的鱼线(不带腊)在250g以下的大鼠进入深度足有2.5cm 12、成功后结扎中间那根线,可见第一个标记距动脉分叉约2mm。 13、缝合。
小鼠急性脑缺氧实验
本文通过小鼠急性脑缺氧实验、大鼠大脑中动脉栓线法局灶性脑缺血(MCAO)损伤模型、对脑血流量影响实验、抑制血小板聚集及血栓形成实验、小鼠不完全脑缺血模型、沙土鼠全脑缺血再灌注损伤等实验和模型,分别从扩张脑血管、抑制血小板聚集及血栓形成、抗水肿、抗缺血再灌注损伤、抗自由基和兴奋性氨基酸损伤等角度,系统的研究了三七中人参三醇皂苷(PTS)对缺血性脑中风的防治作用及其机制。方法1.小鼠急性脑缺氧实验小鼠i.p.给药,每天一次,共3次,末次给药后30min 将小鼠逐只断头,立即按秒表记录小鼠断头后至张口喘气停止时间作为耐缺氧指标。 2.大鼠大脑中动脉栓线法局灶性脑缺血(MCAO)损伤模型雄性SD大鼠,i.p.预防给药两次,每天一次,造模前O.5h i.v.给药1次,造模后4h和10h i.p.给药两次。模型建立:分离、结扎右侧颈总动脉,参照Berdson法用4-0尼龙线阻断大脑中动脉。造模成功能够存活24h的大鼠确定为最后实验对象,并进行行为学评分后,快速取右脑,并切成三片,将脑前部用于脑含水量测定,中部用于脑梗死面积测定,后部用于病理组织学检查。 3.对脑血流量影响实验犬静脉滴注给药,分别在给药前和给药后5、10、15、30、60、120以及180min测定平均动脉血压(MAP)、心率(HR)、脑血流量(CBF)和脑血管阻力(CVR)等指标。4.抑制血小板聚集及血栓形成实验抑制血小板聚集:大鼠i.p.给药,共3次,每天1次。于末次给药30min后,分别自颈总动脉放血,在血样中加入5μl已稀释的ADP(终浓度为50μmol/L)反应5min后测定最大聚集度。抑制血栓形成:大鼠经4%戊巴比妥钠i.p.麻醉,舌下静脉给药后20min,分离右侧颈总动脉和左侧颈外静脉。把插入丝线的聚乙烯管的两端分别插入右侧颈总动脉和左侧颈外静脉,打开动脉夹开放血液15min后,中断血流,迅速取出聚乙烯管中的血栓,在分析天平上称重,求出血栓抑制率。5.双侧颈总动脉结扎的不完全脑缺血模型给小鼠i.p.给药,共3次,每天1次;于末次给药后30min,麻醉后分离双侧颈总动脉,各组经尾静脉注射1%伊文思蓝溶液,并分别在注射10min后结扎双侧颈总动脉。在结扎3h后断头取出脑组织,称重后测脑组织内伊文思蓝含量并计算脑指数。6.沙土鼠全脑缺血再灌注损伤模型采用结扎沙土鼠双侧颈总动脉15min再灌注24h制备全脑缺血再灌注损伤模型,动物随机分成假手术组、模型组、PTS 30mg/kg组、PTS 60mg
成年大鼠心肌细胞培养方法的建立和形态学观察
成年大鼠心肌细胞培养方法 的建立和形态学观察 北京心肺血管疾病研究所细胞免疫室 许秀芳 李温斌3 陈宝田3 吕燕宁 赵莉敏 陈 燕 提要:为探索稳定的成年大鼠心肌细胞的分离和培养方法,应用生物酶(5g/L胰蛋白酶及1g/L胶原酶)灌注法分离成年大鼠心肌细胞,用形态学及台盼蓝染色法鉴定分离的心肌细胞,并在光镜和电镜下观察和摄像记录。结果:心肌细胞的存活率为91.7%;存活的心肌细胞静止地贴在培养板底上,细胞完整,呈杆状,长宽比约为4~6∶1。结果提示:该方法是比较理想的心肌细胞培养法。 关键词:成年大鼠心肌细胞;胰蛋白酶;胶原酶;分离技术 中图分类号:Q253;R322.1+1 自从1953年Durrows和Moscona首次成功地应用生物酶分离出鸡胚心肌细胞后[1],其分离培养技术不断发展,逐渐发展为3种分离方法:离体心脏灌注法、心肌细胞浸泡法和贴块培养法。对动物而言,离体心脏生物酶灌注法分离心肌细胞的质量及数量最佳。成年心肌细胞的分离较幼年及新生动物心肌细胞的分离更为困难,但成年心肌细胞做为一种生物学实验工具是其他心肌细胞不可替代的。国内仅有少数单位分离培养成功成年动物心肌细胞。1992年1月至1998年12月,我们建立了成年大鼠心肌细胞分离培养方法并进行了形态学观察。 1 材料和方法 1.1 材料 实验动物为成年Wistar大鼠,体质量150~200g,由本研究所实验动物室提供。 DM EM培养液、胰蛋白酶均购自美国GIBC公司;胶原酶购自美国Sigma公司;牛血清白蛋白购自美国BM公司;胎牛血清由金华生物制品公司提供;淋巴细胞分离液由中科院血液学研究所出品;安贞Ⅱ号心脏停跳液由本院体外循环组提供。 实验药物及试剂的配制:2%胎牛血清20 mL加DM EM培养液100mL,青霉素100mg/ L,链霉素100万U/L,p H7.2~7.4,过滤除菌。酶消化液:胶原酶0.1g加胰蛋白酶0.5 g、牛血清白蛋白1g,加入DM EM培养液100 mL,于使用前配制。 1.2 方法 采用离体心脏灌注法分离心肌细胞[2,3]。 Wistar大鼠腹腔注射2%戊巴比妥钠麻醉(含1∶200肝素45mg/kg),麻醉满意后胸腹部用75%乙醇消毒,“U”字形切开腹壁,快速剪断左右前腔静脉及后腔静脉,经升主动脉根部灌注4℃高钾安贞Ⅱ号心脏停跳液30mL,待心脏停跳呈灰白色后取下心脏,接在Langendorff 灌注架上,按下列步骤进行实验: 1)清洗心脏:用无Ca2+、Mg2+的D2Hank 液灌洗心脏5min即可;目的是解离桥粒和细胞间连结。由于Ca2+在心肌细胞连结上起重要作用,用无Ca2+的液体灌洗心脏能带走大量的Ca2+,心肌细胞间糖蛋白被破坏,桥粒和连结随之解离。 2)溶解细胞外基质:应用酶消化液37℃灌注,保持灌注压在4.90~7.84kPa(50~80 cmH2O)。 3)心肌细胞的释放:经一定时间(30~90 min)酶消化后,心肌细胞外基质大部分被消化,但细胞间连结如缝隙连结并没有完全断开,心脏仍保持大体形态,松弛状,机械作用才能将细胞分开。见心脏变软、呈暗红色,取下心脏,轻揉搅拌几分钟后剪下心室肌,剪成1mm3大 2000年 6月第21卷 第2期 首都医科大学学报 Journal of Capital University of Medical Sciences J un.2000 Vol.21 No.2 收稿日期:1999203209 3首都医科大学附属北京安贞医院心外科
大鼠灌注取脑
大鼠灌注取脑 用途: 1.用于常规HE染色,免疫组化分析。 2.冰冻切片可以不做脑组织固定。 3.不可用于western blot和PCR。 4.如果观察脑组织的缺血、损伤或其它病变时,不作灌注固定,而是在取出脑组织后作固定,将大大影响效果。 原理: 心脏灌流术能够快速冲净血液并在动物死亡前进行组织的前固定,避免了组织的自溶现象,是脑组织切片观察的常用方法。多聚甲醛使组织蛋白发生交联,以保持蛋白的原位和表面结构不变,从而能使其对应的抗体准确检测其表达位置和量。 必要性: 1.脑组织较软,且细胞成分不易保留,脑组织是较易软化的组织之一,血供也较为丰富,所以最好是在取脑组织前用4%多聚甲醛灌注固。 2.经前固定后,取脑操作时,可减少脑组织损伤。 3.脑内血液都在,HE染色后,可去除红细胞背景影响。 大鼠灌注取脑标准操作规程(SOP): 流程: 1)麻醉2)开胸3)心脏左心室穿针,剪开右心耳4)生理盐水冲水5)4%多基甲醛固定6)取 脑7)保存或切片.
具体过程: 大鼠经深度麻醉后,固定于自制的手术木板上,置于解剖盘中,开胸暴露并游离出心脏,经左心室插入灌流针并固定, 切开右心耳,先灌注冰冻无菌生理盐水(4℃)XmL,直到肝和肺脏颜色转白及右心房流出液澄清,后再灌注冰冻(4℃)4%多聚甲醛XmL,断头取脑,多聚甲醛浸泡固定24小时。 Tips: 1.多聚甲醛的配置: 一般方法为:4%多聚甲醛PBS缓冲液配法:称取40g PFA溶于装有500mlDEPC水的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,使成乳白色悬液。用1.0mol/L 的NaOH值至7.4,使呈清亮状(滴加),再加入约500ml PBS,充分混匀(在冰浴或冷水浴中),可再检测一下pH,过滤后定容至1000ml,室温或4℃保存备用。 简便方法:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。若是很急,55℃水浴一天,期间不时震荡。注意,4%的多聚甲醛需临用前配制,配制后需过滤去除小的杂质,避免心脏灌流时造成栓塞影响灌流效果。 2.制作灌注装置,用两瓶塑料包装的输液瓶装灌注液。同时配好输液器备用。 3.10%水合氯醛按4mL/100g的剂量腹腔注射麻醉动物。 4.沿两侧肋弓剪开皮肤,打开腹腔,用一血管钳夹持剑突并向上提拉,用弯剪在膈肌与胸骨柄相连处剪一小口,造成人工气胸,然后向两侧顺延,剪断膈肌及肋骨,夹持剑突的血管钳将剑突连带胸廓上翻固定,充分暴露心脏,直视下穿刺针左心室心尖处,用血管钳固定。 5.快速滴注生理盐水(室温),同时剪开右心耳。约注入100~150mL,至流出液体血色较浅基本澄清,停止灌注。肝脏、眼珠、爪子迅速变白是排出血液的有效观察指标。
线栓法大鼠脑缺血再灌注模型改良与评价
万方数据
万方数据
万方数据
线栓法大鼠脑缺血再灌注模型改良与评价 作者:吴远华, 朱广旗, 胡蓉, 仲秀艳, 苏红梅, 欧阳泠星, 吴帮启, 舒遵华, 王强 作者单位:吴远华,朱广旗,胡蓉,仲秀艳(贵阳中医学院第一附属医院神经内科,贵阳,550002), 苏红梅(山东临沂市人民医院中医科,临沂,276000), 欧阳泠星(广东清远市人民医院中医科,清远 ,511500), 吴帮启(天津中医药大学第一附属医院针灸科,天津,300193), 舒遵华(长春中 医药大学附属医院,长春,130021), 王强(湖北襄樊市中医院,襄樊,441000) 刊名: 中国实用神经疾病杂志 英文刊名:CHINESE JOURNAL OF PRACTICAL NERVOUS DISEASES 年,卷(期):2010,13(18) 参考文献(11条) 1.Garcia JH A reliable method to occlusion a middle cerebral artery in wistar rats 1993(09) 2.Zea Longa E;Weinsten PR;Carlson S Reversible middle cerebral artery occlusion without craniectomy in rats 1989 3.Koizu mi J;Yoshida Y;Nakazawa T Experimental studies of ischemic brain edema:A new experimental model of cerebral embolis m in rats in which recirculation can be induced in the ische mic area[外文期刊] 1986 4.刘亢丁实验性局灶性脑缺皿再灌注动物模型的改进及评价 1997(02) 5.关云谦;孙明;徐超大鼠颈内动脉线栓法制备局灶性脑缺血模型及影响因素[期刊论文]-国外医学(脑血管疾病分册) 2001(03) 6.Belayev L;Alonso OF;Busto R Middle cerebral artery occlusion in the rat by intraluminal suture.Neurological and pathological evaluation of an improved model 1996(09) 7.Memezawa H;Minamisawa H;Smith ML Ischemic penumbra in a model of reversible middle cerebral artery occlusion in the rat 1992(01) 8.李小凤;孙圣刚;童萼塘大鼠可逆性局灶性脑缺血模型复制方法的改进[期刊论文]-华中医学杂志 2000(04) 9.何学令插线法制作大鼠局灶性脑缺血再灌流模型方法的改进[期刊论文]-四川动物 2003(03) 10.王春霞;刘春风;包仕尧大鼠局灶脑缺血再灌注模型改良后的实验研究[期刊论文]-苏州医学院学报 1999(02) 11.Holland JP;Sydserff SGC;Taylor WAS Rat models of middle cerebral artery ischemia 1993(09) 本文链接:https://www.360docs.net/doc/bb11667955.html,/Periodical_hnsysjjbzz201018002.aspx
小鼠pcr基因扩增及鼠灌注取脑操作
小鼠PCR基因鉴定 一、取材:小鼠出生后3-4周,给小鼠打耳标,并依照雌雄分笼饲养, 需要鉴定的小鼠剪尾部、脚趾或耳部边缘,放置好在印管中,并做好相应的标志,放置标本与标志混乱。 处理: (1)将A液一定量加入带有样本的印管中,在98℃孔板中煮1小时 (2)取出印管后,再加入B液75 μl 二、扩增 1.反应体系 Mix 5μl H20 3μl Primer1 0.5ml Primer2 0.5ml 2.加样 先计算出所需总量,加入印管中,混合均匀,离心,摆放好单个PCR管,将上述混合液放入PCR仪,每管9 μl盖紧。 3.扩增 打开PCR仪并设置好程序,将PCR管放入PCR仪,扩增,40多分钟可以完成。 4.保存 扩增后,取出PCR管,放入冰中保存。 三、琼脂糖凝胶电泳
1.制胶:电子天平称取计算后的琼脂糖,小心倒入干净的锥形瓶内(锥 形瓶内保持干净)。加入TAE缓冲液,盖上锡箔纸,加热。取制胶模具、梳子,安装固定,保证不会漏胶。戴上手套,取出锥形瓶,掀开锡箔纸,冷却3-4分钟,加入染色剂,贴着远梳子端的制胶模板壁缓慢倒入琼脂糖溶液,若有气泡。室温放置凝固。 2.上样:胶凝固后,双手缓慢垂直地拔出梳子,避免破坏梳孔。将胶 板放上电泳槽,注意正负极变化,加入1×TAE缓冲液,从胶表面开始缓慢倒入,自然流向两边,然后依次对孔加入对应的DNA样品,剩余样品放入冰箱储存。 3.电泳:合上电泳槽,正负极对好,检查底部是否有气泡升起。有气 泡则电泳开始。 4.成像:观察是否出现条带,若出现条带,则停止电泳,打开凝胶成 像系统,对结果进行比对、记录并拍照。关闭系统,登记实验记录,取出胶并清洗仪器器材。
线栓法大鼠脑缺血再灌注模型制备方法-图文并茂
线栓法大鼠脑缺血再灌注模型制备方法 Pipilulu 目录: 第一部分线栓模型制备理论及经验 1插线法局灶性脑缺血模型简介 2大鼠颈部及颅内动脉解剖及常用插线位置 3大鼠大脑中动脉阻断实验的总结和心得(zhuqing0506战友) 4 也谈大鼠MCAO模型的实验体会(bladeflyer战友) 5 我的做MCAO模型的一些体会(intelligentwang战友) 6 线栓法大鼠脑缺血再灌注模型(MCAO)制备技巧(ysf2k战友)第二部分线拴模型制作过程(雨后天晴战友) 第三部分灌注取脑(pipilulu战友) 第四部分 TTC染色(pipilulu战友)
前 言 相信不少神经内科的研究生都作过或将要作大鼠线栓模型,都有一个从查文 献了解方法到跟师兄、师姐学习再到自己体会摸索直至熟练的过程,在模型制作 的过程中可能的经历了从模型不成功的郁闷到熟练后成功的喜悦(我们是有这样 的感觉)。为了缩短各位将要作或刚开始作MCAO 模型的战友的摸索过程,提高模型制作的成功率,我们愿意将自己的经验与大家分享,相信各位战友看过后将对制作大鼠线栓模型有更深的认识,并以其为乐趣,同时欢迎各位熟练的战友与我们交流经验。 第一部分线栓模型制备理论及经验 ⒈插线法局灶性脑缺血模型简介 八十年代Koizumi和Longa创用了不开颅的大鼠MCA可逆性脑梗塞模型,此后,应用插线法制备大鼠局灶性脑缺血再灌注模型的方法不断改进和完善,已渐趋成熟,目前该法已逐渐取代开颅法而成为最流行的方法。该模型先阻断颈外动脉(ECA)及其分支,且阻断翼腭动脉(PPA),以切断颅外来源的侧副循环血流。从ECA插入尼龙线,经颈内动脉(ICA)到大脑前动脉(ACA),机械性阻断大脑中动脉(MCA)发出处的血供来建立大脑中动脉缺血模型。此模型可在无麻醉状态下拔出尼龙线,恢复血流,实现再灌注。 1994年Huang等[55]首次将线栓技术应用于小鼠局部永久性脑缺血模型。1997年Hara 等[56]将线栓技术改进后应用于小鼠局部暂时性脑缺血模型。此后不断有学者借助于显微技术和多功能生理监测手段建立小鼠局部线栓脑缺血模型[57,58]。国内蒋晓帆等[59],王芙蓉等[60]也对该方法进行了研究。 线栓法具有不开颅、效果肯定、可准确控制缺血及再灌注时间的优点,用于研究神经元对缺血的敏感性、耐受性,药物疗效观察以及再灌注损害和治疗时间窗较为理想,同时也具有对全身影响小、动物存活时间长的特点,适于慢性脑损伤的研究。控制好易变因素,可避免实验结果的不稳定性。但线栓造模也并非完美无缺,存在着下列不足:①线栓造模过程是非直视下的手术,血流是否完全阻断不能即刻得知。②动物品系、体重、批次会影响结果。动物饲养条件好的单位所繁育的动物,可以使影响程度降低。③操作者的科研训练影响结果。严格的训练和足够例数的实践可以复制出稳定的结果。④血管破裂出血。操作不小心极易刺破血管或拔线栓时引起出血。轻柔、精细的操作可以减少血管破裂的发生。
成年小鼠心脏灌流
成年小鼠心脏灌流 实验材料:需要观察脑切片的小鼠 试剂/试剂盒:乙醚;生理盐水(37℃水浴);4%PFA;30%蔗糖 仪器:蠕动泵;剪刀;镊子;针头;导管 实验步骤: 1、准备实验器材:两个锥形瓶(1个装生理盐水,一个装4%多聚甲醛,记得要用封口膜封口) 2、用生理盐水冲洗导管,并排除管内气体。(灌流时选用雄性动物比选用雌性动物要好,原因是雌性动物受其激素周期影响,雄性的结果更为可靠) 3、在密闭容器内加适量乙醚,麻醉小鼠。(需要注意的是,小鼠清醒一点比死掉要好,防止血液凝固给灌流带来阻力) 4、待小鼠麻醉后立即将其用针头固定在泡沫板上(用针头插住四肢)。 5、一只手用镊子扯起胸部皮肤,另一只手用剪刀剪开胸腔的皮肤和肋骨,暴露出心脏和肝脏。 6、将注射针头插入小鼠左心室(如针头不稳可用镊子将其固定在泡沫板上),同时将小鼠肝脏减掉,以使血液流出。灌流速度5.8rpm。(灌注生理盐水的时间维持在10min左右,血液排除后四肢、肝脏和舌头会变白) 7、对小鼠进行剪尾取样,以备测定其基因型。同时,将小鼠信息卡片上记录灌流信息,并将灌流小鼠的信息记录在自己的实验记录本上,以方便后续的重新基因型鉴定操作。 8、待小鼠四肢、肝脏和舌头变白之后,将导管始端从生理盐水中拿出,将其放入冰浴的4%PFA溶液(4℃)中,用4%PFA灌流固定时,当PFA流至大脑处可能会使小鼠尾巴略有反射现象(有时可能没有),此时可将灌流速度由5.8rpm调至4.8rpm,以使固定更加充分。整个PFA灌流时间约为20min。(固定原理:多聚甲醛可以使蛋白质交联) 9、将导管始端从PFA中拿出,待管中液体流尽后,将心脏上的针头拔下,如果固定的较好,可发现小鼠眼球呈现白色。将托盘中的血液倒至废液桶内,并准备下一步的取脑操作。 10、拿出一条纸巾,将小鼠尸体放在上面,沿颈部剪下头颅。 11、剪开头部皮肤,露出白色头盖骨。将延髓上包被的软骨剪开,除去多余的结缔组织。需要注意的时,眼睛要由剪刀剪下,不能够直接扯下来,因为眼睛后部连着视神经,如果扯的话有可能会损坏视交叉上核等其他脑部组织。 12、将头盖骨小心剥开,露出白色的脑部,在剥嗅球部位时要格外小心,必要的话可以先将嗅球前部的碎骨留着待进一步固定之后再去除。 13、将头盖骨剥开后,将脑下部连接的神经逐条剪短(可看到视神经交叉),待全部剪断后将脑整个剥离出来。 14,将剥离出来的脑浸泡在4%PFA中,过夜固定。 15、将PFA液换为30%蔗糖进行脱水(防止冷冻切片时形成冰晶和孔洞),初始脱水时脑会浮在蔗糖上面,待完全脱水后脑会沉底。此时可将脑取出进行冷冻切片。
线栓法大鼠脑缺血再灌注模型的制备
线栓法制备大鼠脑缺血再灌注模型的方法研究 马贤德1孙宏伟1 柴纪严1 赵金茹1 (1 辽宁中医药大学,辽宁沈阳 110032;) 摘要①目的建立一种比较系统,操作简单,成功率高的大鼠大脑中动脉缺血(MCAO)再灌注动物模型,达到只要读者根据本文所述的方法操作就能制作出MCAO再灌注模型的目的。 ②方法成年健康雄性 SD大鼠40只,参照Longa法并适当改进建立MCAO模型20只,假手术组20只。本文将详细叙述手术过程以及再灌注时间点的合理选择。最后利用行为学测试、四氮唑(TTC)染色对模型成功与否进行判定。③结论线栓法是一种操作简单的制备MCAO 再灌注动物模型的方法,并且此方法的再灌注效果较为明显。 关键词动物模型;脑缺血;再灌注;线栓法 Establishment a model of rat ischemia-reperfusion injury with intraluminal suture Ma Xian-de1 Sun Hong-wei1 Chai Ji-yan1 Zhao Jin-ru1 (1.Liaoning University of Chinese Traditional Medicine, Shenyang, 110032) Abstract: Objective To establish a model of rat ischemia-reperfusion injury, in terms of the model, the operation will be simple, and the achievement ratio will be high. Methods: 40 Male Sprague-Dawley ( SD ) rats were separated into two groups randomly: 20 were model of rat ischemia-reperfusion injury based on Longa method, and the other 20 were sham-operated group. The process of the operation and the selection of different time point following ischemic-reperfusion were discussed in the paper. What’s more , the model was appraised by behavioral test and Triphenyl Tetrazolium Choloride(TTC)Staining. Conclusion: The operation of intraluminal suture method is very simple for the establishment of model of rat ischemia-reperfusion, what’s more, the effect of reperfusion is very obvious. Key words: Animal Model, ischemia, reperfusion, intraluminal suture 脑缺血再灌注动物模型是研究缺血性脑血管病的一条重要途径,因为脑缺血再灌注动物模型具有很好的重复性并能最大程度模拟人类缺血性卒中的发生。早在1986年,日本学者Koizumi发明了线栓法制备局灶性脑缺血大鼠模型。1995年,我国也出现了相关的报道。目前人们比较公认的是Longa等建立的大鼠大脑中动脉缺血(MCAO)再灌注动物模型。国内一些学者对此方法又进行了改进,但仍存在一些问题,例如:手术操作过程复杂,实验动物死亡率较高,而模型成功率较低,并且在所发表的文章中普遍存在一个缺点,就是对该模型的制作过程描述得过于简单,读者往往不能按照此类文献完成模型的制备工作。本文旨在前人研究的基础上,建立一种操作简单,成功率高的 MCAO再灌注模型,并将此方法图文并茂的展现给读者,使读者只要根据本文所述的方法操作就能制作出MCAO再灌注模型。 1 材料与方法 1.1 实验材料、动物及分组健康雄性SD大鼠40只,体重280-320g,由辽宁中医药大学实验动物中心提供。随机分为模型组和假手术组,每组20只。四氮唑红(TTC)染料,由沈阳市博尔美试剂公司提供。 1.2 栓塞线的制备栓塞线采用 2.5号钓鱼线,直径0.25-0.28mm。将其剪成4cm长,一端用细砂纸打磨成半球形(需在显微镜下筛选),再用记号笔分别在距打磨端0.6cm处、1.8cm
大鼠灌注固定取脑
大鼠灌注固定取脑 具体方法: 1. 配4%多聚甲醛PBS缓冲液。配法:称取40g PFA溶于装有900ml PB或PBS的玻璃容器(烧杯或烧瓶)中,持续加热磁力搅拌至60~65℃,搅拌子速度从低到高,慢慢增加,至充分溶解。定容至1000ml,边搅拌边滴加1.0mol/L的NaOH直至7.0,过滤后室温或4℃保存备用。 2.制作灌注装置,一瓶生理盐水,一瓶灌入多聚甲醛,悬挂,输液器链接,远端结一个三通后到一个输液器粗针头端。 3.经心脏行灌注固定:麻醉,充分显露心脏(插针)和肝脏(判断),尽可能多暴露心脏,利于操作。首先快速滴入生理盐水或PBS,用止血钳(选把好的很关键)预夹住心尖少部,持针从心尖略偏左下进,插入有突破感即停(小鼠室壁厚约1mm),大头针或止血钳固定,若正确进入,右房充盈,剪破右房,此时液体较快下滴(调整针头朝向),红色血液从右房流出,快速冲尽全身血液(否则影响免疫反应),时间约4-5min,约40ml/只小鼠,80ml/只大鼠(取水冲洗切口,防血液凝固)。流出液变白即可,盐水过多细胞死亡多。正确的标志:右房充盈(但不是迅速充盈),肝脏逐渐变白,口鼻干燥。再注入4%多聚甲醛灌注30min 左右,多聚甲醛要偏快,100ml/只小鼠,200ml/只大鼠。大鼠不建议用灌注机(先排空管中空气,再行灌注。)它的灌流速度达不到。灌注正确标准:换多聚甲醛后身体反应,尤其尾巴竖起、四肢伸直变硬。PBS或NS灌流时,血流丰富的脏器如肝脾肾等的颜色会迅速转为灰白,此为灌流正常;另外,大鼠耳尖,口唇,四肢掌部也会变苍白。 4.取脑:枕骨大孔处用剪刀横断,小心地于枕骨大孔斜插入剪刀剪开顶骨,用止血钳掰断两边的顶骨,注意嗅球上地顶骨也要仔细去掉,用剪刀于一侧剪断视神经并探到颅底,就可以将整块的脑组织翘起。灌注成功则脑变白,无红色血管。 5. 最后在同样固定液中4℃固定12小时(包新民做的是一周),沉糖切片。 有几点体会:①. 4%多聚甲醛的配制:加热至60~65℃固然融解的快,不过容易挥发,气味难闻,不是好的选者。在此强烈推荐:先配好PBS,称好相应的多聚甲醛,37℃水浴或温箱密封放置2天,就能全溶。②.灌注时夹上腹主动脉只灌注上肢及头脑,固定的好又快,又省多聚甲醛。多聚甲醛用100ml以下即可。③.灌注时注意排空输液管中的气泡不然容易气栓,影响灌注效果。一定要看到大鼠较剧烈抽搐,不然证明灌注不好。 个人体会:1、多聚甲醛加热溶解很快,只需要15分钟左右,需配置的量比较大的时候是较合适的方法。如果有通风厨的可在通风厨内配置。在通风较好的地方配置也可以,但配置的时候配溶液的人一定要注意自我防护,味道确实很刺激!2、开胸时不要伤到心脏。3、心脏穿刺最好用留置针,软,不宜穿通室间隔,见血即退针芯。插针部位是心尖部,方向向中线(先主动脉插管,再右心耳放血,这样插管容易些。先剪右心耳的话,心脏会瘪下去的)。 4、生理盐水冲血管,到右心耳流出无色液体。 5、多基甲醛固定成功的表现是刚开始灌注时老鼠剧烈抽动;成功后老鼠后肢绷直,尾部竖起成一直线;所灌注的脑组织白而硬。5、根据你实验设计,,需要切片的部位,有重点的取,常见的体表标志是前囟和外耳道。 6、去颅骨后脑表面有一层硬脑膜,要去掉。 7、后固定:灌流后的脑组织置于4%PFA置4度冰箱内进行后固定,时间>2h,过夜最好。 恒流泵的方法 在心尖搏动明显的部位,朝向主动脉插入灌流针即从心尖插入灌流针,通过左心室直至主动脉;打开腹腔,结扎腹主动脉;剪开右心耳,插人聚乙烯管,用以液体回流。打开恒流泵以10 ml/min的速度开始从心脏灌注温生理盐水,以清除血液,并开始计时,直至回流管流出晶莹明亮的液体,记录时间和生理盐水的使用量。然后用4 % 多聚甲醛以5ml/min的速度灌流15min,并分别在第5 min、第10 min、第15min夹闭前腔静脉,暂停灌流1 min,
适用于Langendorff离体心脏灌流大鼠心肌梗死动物模型的建立
2007年1月 第17卷 第1期 中国比较医学杂志 CHINESE JOURNA L OF COMPARATIVE ME DICINE January,2007 V ol.17 N o.1 研究报告 适用于Langendorff离体心脏灌流大鼠心肌梗死 动物模型的建立 汪进益,范慧敏,刘中民 (同济大学附属东方医院心胸外科,上海 200120) 【摘要】 目的 建立适用于Langendor ff离体心脏灌流大鼠心肌梗死的动物模型,为评价干细胞移植对急性心肌梗死后的心功能变化提供基础。方法 选用S prague-Dawley(S D)大鼠16只,结扎其左冠状动脉前降支中远1Π3处,在结扎前后通过MPA多导生理记录仪连续描记心电图;4周后再次开胸进行Langendor ff离体心脏灌流测定左室心功能和心肌组织病理学检查;另选仅开关胸后存活的10只S D大鼠作为对照组。结果 造模成功率为62150% (10Π16);心电图动态监测在冠脉结扎后出现ST-T抬高的融合波,30min后可见病理性Q波;4周后Langendor ff离体心脏灌流装置系统检测显示左室收缩压峰值(LVSP)、左室内压等容相最大上升及下降速率(+dpΠdtmax,-dpΠdtmax)等指标较对照组降低,左室舒张末压峰值(LVE DP)则反之;病理组织切片可见结扎区域心肌纤维排列紊乱、坏死心肌被纤维组织取代。结论 通过结扎左冠脉前降支的方法,4周后能够形成稳定的适用于Langendor ff离体心脏灌流的心肌梗死动物模型,该模型能应用于干细胞移植对心脏功能影响的研究。 【关键词】 Langendor ff灌流;离体心脏;心肌梗死;大鼠;模型,动物 【中图分类号】Q95-33 【文献标识码】A 【文章编号】167127856(2007)0120022204 Establishment of Langendorff Perfusion of the Isolated H eart after Acute Myocardial I nfarction Model in R ats W ANGJin-yi,FAN Hui-min,LI U Zhong-min (Department of Cardiovascular and Thoracic Surgery of East H ospital A ffiliated T ongji University,Shanghai200120,China)【Abstract】 Objective T o create a standard rat m odel of Langendor ff per fusion of the is olated heart after acute my ocardial in farction(AMI)by silk suture ligation for the research of stem cell.Method 16adult S prague-Dawley(S D)rats in m odel group were established by ligating the middle-distal1Π3segment of left anterior discending artery with8~0sutures to shut the blood supply of my ocardium.E lectrocardiogram(ECG)were per formed both before the ligating and after the ligated by MPA system.The cardiac function were observed by langendor ff per fusion of the is olated heart methods and histogram study with HE stain was carried out4weeks late to see whether there were any tisse necrosis and its extension.10adult S D rats without ligating coronary artery in control group.R esults The rate of establishing m odel success fully was62150%(10Π16).A fter ligation of left anterior discending artery,ECG displayed ST elevated continuously immediately and pathologic Q wave after ligating30min.Pathologic section suggested my ofibers chaotically arranged,necro-my ocardium were superseded by fibrous tissue.Meanwhile,The cardiac function indicated by these parametes of LVSP,LVE DP and±dpΠdtmax descend markedly after ligating4weeks late.Conclusion S ilk surure ligating is a g oog method in creating a standard rat m odel of Langendor ff per fusion of the heart in4weeks after AMI,and the animal m odel w ould be conducive to the basic study on the treatment of stem cell for AMI. 【K ey w ords】 Langendor ff per fusion;Is olated heart;My ocardial in farction;Rats;M odels,animals [基金项目]国家自然科学基金资助项目(30471719)。 [作者简介]汪进益(1974-),男,博士,研究方向:离子通道与外科疾病、顽固性心衰的外科治疗及分子心脏病学。 [通讯作者]刘中民。E-mail:zhongm in-liu@https://www.360docs.net/doc/bb11667955.html,
