胶质瘤分级

肿瘤组别肿瘤类型Ⅰ
级
Ⅱ级
Ⅲ
级
Ⅳ级
胶质瘤病友群:249158778
《脑胶质瘤诊疗规范》要点
《脑胶质瘤诊疗规范》要点 一、概述 脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,世界卫生组织(WHO)中枢神经系统肿瘤分类将脑胶质瘤分为Ⅰ-Ⅳ级,Ⅰ、Ⅱ级为低级别脑胶质瘤,Ⅲ、Ⅳ级为高级脑胶质瘤。本规范主要涉及星形细胞、少突胶质细胞和室管膜细胞来源的高、低级别脑胶质瘤的诊治。 我国脑胶质瘤年发病率为5-8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。脑胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。 脑胶质瘤临床表现主要包括颅内压增高、神经功能及认知功能障碍和癫痫发作三大类。目前,临床诊断主要依靠计算机断层扫描(CT)及磁共振成像(MRI)检查等影像学诊断,磁共振弥散加权成像(DWI)、磁共振弥散张量成像(DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)、功能磁共振成像(fMRI)、正电子发射计算机断层显像(PET)等对脑胶质瘤的鉴别诊断及治疗效果评价有重要意义。 脑胶质瘤确诊需要通过肿瘤切除或活检获取标本,进行组织和分子病理学检查,确定病理分级和分子亚型。主要的分子病理
标记物(这些分子标志物)对脑胶质瘤的个体化治疗及临床预后判断具有重要意义。 脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。 二、影像学诊断 (一)脑胶质瘤常规影像学特点 神经影像常规检查目前主要包括CT和MRI。这两种成像方法可以相对清晰精确地显示脑解剖结构特征及脑肿瘤病变形态学特征,如部位、大小、周边水肿状态、病变区域内组织均匀性、占位效应、血脑屏障破坏程度及病变造成的其他合并征象等。在图像信息上MRI优于CT。 常规MRI扫描,主要获取T1加权像、T2加权像、FLAIR 像及进行磁共振对比剂的强化扫描。 脑胶质瘤可发生于脑内各部位。 不同级别脑胶质瘤的PET成像特征各异。目前广泛使用的示踪剂为18F-FDG。 临床诊断怀疑脑胶质瘤拟行活检时,可用PET确定病变代谢活性最高的区域。 (二)脑胶质瘤鉴别诊断 1. 脑内转移性病变:脑内转移性病变以多发病变较为常见,多位于脑皮层下,大小不等,水肿程度不一,表现多样,多数为环状或结节样强化影。
神经胶质瘤疾病研究报告
神经胶质瘤疾病研究报告 疾病别名:胶质细胞瘤,胶质瘤,神经外胚层肿瘤,神经上皮肿瘤 所属部位:头部 就诊科室:脑外科 病症体征:步态不稳,癫痫性头痛,颅内压增高,眩晕 疾病介绍: 神经胶质瘤是什么?肿瘤起源于神经间质细胞,即神经胶质,室管膜,脉 络丛上皮和神经实质细胞,即神经元,大多数肿瘤起源于不同类型的神经胶质,但根据组织发生学来源及生物学特征类似,对发生于神经外胚层的各种肿瘤, 一般都称为神经胶质瘤 症状体征: 神经胶质瘤有哪些症状? 神经胶质瘤的病程依其病理类型和所在部位长短不一,自出现症状至就诊 时间一般多为数周至数月,少数可达数年。恶性程度高的和后颅窝肿瘤病史多 较短,较良性的肿瘤或位于所谓静区的肿瘤病史多较长。肿瘤如有出血或囊肿 形成、症状发展进程可加快,有的甚至可类似脑血管病的发展过程。 症状主要有两方面的表现。一是颅内压增高和其他一般症状,如头痛、呕吐、视力减退、复视、癫痫发作和精神症状等。另一是脑组织受肿瘤的压迫、 浸润、破坏所产生的局部症状,造成神经功能缺失。 头痛大多由于颅内压增高所致,肿瘤增长颅内压逐渐增高,压迫、牵扯颅 内疼痛敏感结构如血管、硬膜和某些颅神经而产生头痛。大多为跳痛、胀痛, 部位多在额颞部或枕部,一侧大脑半球浅在的肿瘤,头痛可主要在患侧、头痛 开始为间歇性,多发生于清晨、随着肿瘤的发展,头痛逐渐加重,持续时间延长。 呕吐系由于延髓呕吐中枢或迷走神经受刺激所致,可先无恶心,是喷射性。在儿童可由于颅缝分离头痛不显著,且因后颅窝肿瘤多见,故呕吐较突出。 颅内压增高可产生视乳头水肿,且久致视神经继发萎缩,视力下降。肿瘤 压迫视神经者产生原发性视神经萎缩,亦致视力下降。外展神经易受压挤牵扯,常致麻痹,产生复视。 一部分肿瘤病人有癫痫症状,并可为早期症状。癫痫始于成年后者一般为 症状性,大多为脑瘤所致。药物不易控制或发作性质有改变者,都应考虑有脑 瘤存在。肿瘤邻近皮层者易发生癫痫,深在者则少见。局限性癫痫有定位意义。
脑胶质瘤诊疗规范2018年版
脑胶质瘤诊疗规范(2018年版) 一、概述 脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,世界卫生组织(WHO)中枢神经系统肿瘤分类将脑胶质瘤分为Ⅰ-Ⅳ级,Ⅰ、Ⅱ级为低级别脑胶质瘤,Ⅲ、Ⅳ级为高级别脑胶质瘤。本规范主要涉及星形细胞、少突胶质细胞和室管膜细胞来源的高、低级别脑胶质瘤的诊治。 我国脑胶质瘤年发病率为5-8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。脑胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。 脑胶质瘤临床表现主要包括颅内压增高、神经功能及认知功能障碍和癫痫发作三大类。目前,临床诊断主要依靠计算机断层扫描(CT)及磁共振成像(MRI)检查等影像学诊断,磁共振弥散加权成像(DWI)、磁共振弥散张量成像(DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)、功能磁共振成像(fMRI)、正电子发射计算机断层显像(PET)等对脑胶质瘤的鉴别诊断及治疗效果评价有重要意义。 脑胶质瘤确诊需要通过肿瘤切除或活检获取标本,进行组织和分子病理学检查,确定病理分级和分子亚型。目前主要的分子病理标记物包括:异柠檬酸脱氢酶(IDH)突变、染色体1p/19q联合缺失状态(co-deletion)、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子区甲基化、α地中海贫血伴智力低下综合征X连锁基因(ATRX)突变、端粒酶逆转录酶(TERT)启动子突变、人组蛋白H3.3(H3F3A)
K27M突变、BRAF基因突变、PTPRZ1-MET基因融合、miR-181d、室管膜瘤RELA基因融合等1,2。这些分子标志物对脑胶质瘤的个体化治疗及临床预后判断具有重要意义。 脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。手术可以缓解临床症状,延长生存期,并获得足够肿瘤标本用以明确病理学诊断和进行分子遗传学检测。手术治疗原则是最大范围安全切除肿瘤,而常规神经导航、功能神经导航、术中神经电生理监测和术中MRI实时影像等新技术有助于实现最大范围安全切除肿瘤。放疗可杀灭或抑制肿瘤细胞,延长患者生存期,常规分割外照射是脑胶质瘤放疗的标准治疗。胶质母细胞瘤(GBM)术后放疗联合替莫唑胺(TMZ)同步并辅助化疗,已成为成人新诊断GBM的标准治疗方案。 脑胶质瘤治疗需要神经外科、神经影像科、放射治疗科、神经肿瘤科、病理科和神经康复科等多学科合作,遵循循证医学原则,采取个体化综合治疗,优化和规范治疗方案,以期达到最大治疗效益,尽可能延长患者的无进展生存期(PFS)和总生存期(OS),提高生存质量。为使患者获得最优化的综合治疗,医师需要对患者进行密切随访观察,定期影像学复查,兼顾考虑患者的日常生活、社会和家庭活动、营养支持、疼痛控制、康复治疗和心理调控等诸多问题。 二、影像学诊断 (一)脑胶质瘤常规影像学特 神经影像常规检查目前主要包括CT和MRI。这两种成像方法可以相对清晰精确地显示脑解剖结构特征及脑肿瘤病变形态学特征,如部位、大小、周边水肿状态、病变区域内组织均匀性、占位效应、血脑屏障破坏程度及病变造成的其他合并征象等。在图像信息上MRI 优于CT。CT主要显示脑胶质瘤病变组织与正常脑组织的密度差值,
脑胶质瘤诊疗规范(完整版)
脑胶质瘤诊疗规范(完整版) 一、概述 脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,世界卫生组织(WHO)中枢神经系统肿瘤分类将脑胶质瘤分为Ⅰ-Ⅳ级,Ⅰ、Ⅱ级为低级别脑胶质瘤,Ⅲ、Ⅳ级为高级别脑胶质瘤。本规范主要涉及星形细胞、少突胶质细胞和室管膜细胞来源的高、低级别脑胶质瘤的诊治。 我国脑胶质瘤年发病率为5-8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。脑胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。 脑胶质瘤临床表现主要包括颅内压增高、神经功能及认知功能障碍和癫痫发作三大类。目前,临床诊断主要依靠计算机断层扫描(CT)及磁共振成像(MRI)检查等影像学诊断,磁共振弥散加权成像(DWI)、磁共振弥散张量成像(DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)、功能磁共振成像(fMRI)、正电子发射计算机断层显像(PET)等对脑胶质瘤的鉴别诊断及治疗效果评价有重要意义。 脑胶质瘤确诊需要通过肿瘤切除或活检获取标本,进行组织和分子病理学检查,确定病理分级和分子亚型。目前主要的分子病理标记物包括:异柠檬酸脱氢酶(IDH)突变、染色体1p/19q联合缺失状态
(co-deletion)、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子区甲基化、α地中海贫血伴智力低下综合征X连锁基因(ATRX)突变、端粒酶逆转录酶(TERT)启动子突变、人组蛋白H3.3(H3F3A)K27M突变、BRAF基因突变、PTPRZ1-MET基因融合、miR-181d、室管膜瘤RELA 基因融合等1,2。这些分子标志物对脑胶质瘤的个体化治疗及临床预后判断具有重要意义。 脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。手术可以缓解临床症状,延长生存期,并获得足够肿瘤标本用以明确病理学诊断和进行分子遗传学检测。手术治疗原则是最大范围安全切除肿瘤,而常规神经导航、功能神经导航、术中神经电生理监测和术中MRI实时影像等新技术有助于实现最大范围安全切除肿瘤。放疗可杀灭或抑制肿瘤细胞,延长患者生存期,常规分割外照射是脑胶质瘤放疗的标准治疗。胶质母细胞瘤(GBM)术后放疗联合替莫唑胺(TMZ)同步并辅助化疗,已成为成人新诊断GBM的标准治疗方案。 脑胶质瘤治疗需要神经外科、神经影像科、放射治疗科、神经肿瘤科、病理科和神经康复科等多学科合作,遵循循证医学原则,采取个体化综合治疗,优化和规范治疗方案,以期达到最大治疗效益,尽可能延长患者的无进展生存期(PFS)和总生存期(OS),提高生存质量。为使患者获得最优化的综合治疗,医师需要对患者进行密切随访观察,定期影像学复查,兼顾考虑患者的日常生活、社会和家庭活动、营养支持、疼痛控制、康复治疗和心理调控等诸多问题。 二、影像学诊断
脑胶质瘤诊疗规范(完整版)
脑胶质瘤诊疗规范(完整版) 12月21日,国家卫健委发布《关于印发原发性肺癌等18个肿瘤诊疗规范的通知》,其中的《脑胶质瘤诊疗规范》的全文如下: 一、概述 脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,世界卫生组织(WHO)中枢神经系统肿瘤分类将脑胶质瘤分为Ⅰ-Ⅳ级,Ⅰ、Ⅱ级为低级别脑胶质瘤,Ⅲ、Ⅳ级为高级别脑胶质瘤。本规范主要涉及星形细胞、少突胶质细胞和室管膜细胞来源的高、低级别脑胶质瘤的诊治。 我国脑胶质瘤年发病率为5-8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。脑胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。 脑胶质瘤临床表现主要包括颅内压增高、神经功能及认知功能障碍和
癫痫发作三大类。目前,临床诊断主要依靠计算机断层扫描(CT)及磁共振成像(MRI)检查等影像学诊断,磁共振弥散加权成像(DWI)、磁共振弥散张量成像(DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)、功能磁共振成像(fMRI)、正电子发射计算机断层显像(PET)等对脑胶质瘤的鉴别诊断及治疗效果评价有重要意义。 脑胶质瘤确诊需要通过肿瘤切除或活检获取标本,进行组织和分子病理学检查,确定病理分级和分子亚型。目前主要的分子病理标记物包括:异柠檬酸脱氢酶(IDH)突变、染色体1p/19q联合缺失状态(co-deletion)、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子区甲基化、α地中海贫血伴智力低下综合征X连锁基因(ATRX)突变、端粒酶逆转录酶(TERT)启动子突变、人组蛋白H3.3(H3F3A)K27M突变、BRAF基因突变、PTPRZ1-MET 基因融合、miR-181d、室管膜瘤RELA基因融合等。这些分子标志物对脑胶质瘤的个体化治疗及临床预后判断具有重要意义。 脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。手术可以缓解临床症状,延长生存期,并获得足够肿瘤标本用以明确病理学诊断和进行分子遗传学检测。手术治疗原则是最大范围安全切除肿瘤,而常规神经导航、功能神经导航、术中神经电生理监测和术中MRI实时影像等新技术有助于实现最大范围安全切除肿瘤。放疗可杀灭或抑制肿瘤细胞,延长患者生存期,常规分割外照射是脑胶质瘤放疗的标准治疗。胶质
_1H_MRS在脑胶质瘤诊断及分级中的应用
[作者简介]纪邦启(1970-),男,山东阳谷人,主治医师,研究 方向:影像诊断。 1 H 2MRS 在脑胶质瘤诊断及分级中的应用 纪邦启1,宋 磊2,刘 斌3 (11济南钢铁集团总公司总医院放射科,山东济南250101;21山东大学第二医院,山东济南250033; 3.山东中医药大学,山东济南250355) [摘要]目的:分析脑胶质瘤的氢质子磁共振波谱(proton magnetic resonance spectroscopy ,1H 2MRS )表现及其临床意义;探讨脑胶质瘤的1H 2MRS 特点与其病理级别相关性。方法:搜集经临床手术、病理证实的脑胶质瘤38例,按照W HO 分级 (2000)标准分成两组:低级别脑胶质瘤组、高级别脑胶质瘤组。所有患者在术前行1H 2MRS 检查,均在MR 非增强成像的基础上获得。使用GE Signa115T 超导磁共振扫描仪,多体素扫描,点分辨选择波谱法,检测不同区域代谢物变化。结果:脑胶质瘤的1H 2MRS 表现:肌酸(Cr )无明显变化;N 2乙酰天门冬氨酸(NAA )下降,胆碱(Cho )增高,变化的程度由肿瘤级别高低决定;低级别、高级别脑胶质瘤的肿瘤组织分别和对侧正常脑组织的NAA/Cr 、Cho/Cr 、NAA/Cho 比值存在显著性差异(P <0101);低级别脑胶质瘤和高级别脑胶质瘤的肿瘤组织的NAA/Cr 、Cho/Cr 、NAA/Cho 比值有统计学意义(P <0105),脑胶质瘤的NAA/Cho 、Cho/Cr 、NAA/Cr 比值与病理级别相关。结论:1H 2MRS 与MRI 相结合能提高脑胶质瘤术前诊断的准确性。 1 H 2MRS 可评价脑胶质瘤的分级,反映脑胶质瘤代谢特性以及肿瘤生长潜能。 [关键词]脑胶质瘤;氢质子磁共振波谱;磁共振成像;代谢 [中图分类号]R445.2;R739.41 [文献标识码]A [文章编号]167220512(2008)0420247204 Application of 1 H 2MRS in diagnosis and pathological grading of brain gliom as J I B ang 2qi ,S O N G L ei ,L IU B in.The Hospial of Jinan Steel Company ,Jinan ,250101,China. [Abstract]Objective :To evaluate the findings and clinical significance of 1 H 2MRS ,and to explore the correlation between the findings of 1 H 2MRS and the pathological grading of gliomas.Methods :Thirty 2eight patients of gliomas approved by pathology were reviewed ,all cases were categorized into two groups (low grade gliomas and high grade gliomas )according to W HO diag 2nostic criteria.The 38patients underwent 1H 2MRS before surgery on plain MRI scanning.Multiple voxel proton magnetic reso 2nance spectroscopy was performed on a 1.5T MR scanner using point resolved selective spectroscopy (PRESS ),the variety of metabolite peaks were detected in different areas.R esults :The Cr peak of the gliomas was normal ,while the NAA peak de 2creased and the Cho peak increased.Significant differences between low/high grade gliomas and normal tissue in contralateral brain hemispheres were found in the ratios of NAA/Cr ,Cho/Cr and NAA/Cho (P <0.01).Statistic differences between low grade gliomas and high grade gliomas were found in the ratios of NAA/Cr ,Cho/Cr and NAA/Cho (P <0.05).There was sig 2nificant correlation between the ratios of NAA/Cr ,Cho/Cr and NAA/Cho and the pathological grading of gliomas.Conclusion :The combination of 1H 2MRS and MRI improves preoperative diagnostic accuracy of gliomas ,1H 2MRS has made it possible to e 2valuate the grade of gliomas ,obtain metabolic information of gliomas and reflect the potential growth of tumor.[K ey w ords]Brain gliomas ;Proton magnetic resonance spectroscopy ;Magnetic resonance imaging ;Metabolite 脑胶质瘤是颅内肿瘤常见的疾病之一,本文按W HO 分级(2000)标准将其分为I ~Ⅳ级,并分成A 、B 组,A 组(星形胶质细胞瘤Ⅰ~Ⅱ级)17例,B 组(星形胶质细胞瘤Ⅲ~Ⅳ级和多形性胶质母细胞瘤)21例,以此来探讨脑胶质瘤的氢质子磁共振波谱(proton magnetic resonance spect ro scopy ,1H 2 MRS )特点与其病理级别的相关性。1 资料与方法 111 临床资料 收集2006年我院与山东大学第二 医院经手术及病理证实的胶质瘤病例38例,其中男21例,年龄23~72岁,平均4817岁;女17例,年龄29~66岁,平均5012岁。病灶直径:长径最大为618cm ,最小为215cm ,平均416±112cm ;短径最 大为513cm ,最小为212cm ,平均319±110cm 。患 7 42
中国脑胶质瘤分子诊疗指南(全文)
中国脑胶质瘤分子诊疗指南(全文) 胶质瘤是中枢神经系统最常见的原发脑肿瘤,也是目前神经肿瘤领域内的难点。传统上,胶质瘤主要通过形态学进行分类与分级。但越来越多研究显示,基于形态学的病理分类并不能很好的反映某些胶质瘤的生物学特性。例如,有些病理上诊断为低级别的胶质瘤(良性),短期内复发与进展,而有些高级别胶质瘤(恶性)却可以长期保持稳定。又如,部分胶质瘤对放化疗特别敏感,而同样是相同恶性度的胶质瘤却对治疗无效。如何准确的预测胶质瘤患者的预后及选择合适治疗方案,是目前基础与临床的工作重点。随着分子生物学的发展,我们已能够在分子水平对胶质瘤进行“解剖”,并且发现了一些能够预测胶质瘤患者预后及治疗反应的分子标记,如1p19q杂合性缺失(详见本网站相应博文)及MGMT。 为了能够科学规范的检测及使用分子标记物,中国胶质瘤协作组经过1年多的酝酿,组织国内胶质瘤领域内的专家撰写了《中国脑胶质瘤分子诊疗指南》,并发表于《中华神经外科杂志》2014年第5期。作为指南的编写组成员,我体会到,国内在胶质瘤诊疗方面上升到一个新的高度,基本达到欧美发达国家水平。以下是本指南的主要内容,供患者及医务人员参考。 指南编写组成员名单:马文斌(中国医学科学院北京协和医院神经外科)、于士柱(天津医科大学总医院、天津市神经病学研究所神经肿瘤研
究室)、王任直(中国协和医科大学北京协和医院神经外科)、王伟民(广州军区广州总医院神经外科)、王洪军(哈尔滨医科大学附属第二医院神经外科)、王永志(首都医科大学附属北京天坛医院神经外科、北京市神经外科研究所)、王政(首都医科大学附属北京天坛医院神经外科、北京市神经外科研究所)、王引言(首都医科大学附属北京天坛医院神经外科、北京市神经外科研究所)、毛颖(复旦大学附属华山医院神经外科)、毛庆(四川大学华西医院神经外科)、尤永平(南京医科大学第一附属医院神经外科)、史之峰(复旦大学附属华山医院神经外科)、白红民(广州军区广州总医院神经外科)、李文斌(北京市世纪坛医院神经肿瘤内科)、李学军(中南大学湘雅医院神经外科35病区)、李桂林(北京市神经外科研究所神经病理科)、吴安华(中国医科大学附属第一医院神经外科)、陈凌(解放军总医院神经外科、全军神经外科研究所)、陈忠平(中山大学附属肿瘤医院神经外科)、邱晓光(首都医科大学附属北京天坛医院放疗科)、杨学军(天津医科大学总医院神经外科)、周良辅(复旦大学附属华山医院神经外科)、周定标(解放军总医院神经外科)、林毅(中国医科大学附属第一医院神经外科)、赵继宗(首都医科大学附属北京天坛医院神经外科)、康春生(天津医科大学总医院神经外科、天津市神经病学研究所神经肿瘤实验室)、姚坤(首都医科大学北京三博脑科医院病理科)、蒋传路(哈尔滨医科大学附属第二医院神经外科)、秦智勇(复旦大学附属华山医院神经外科)、赛克(中山大学附属肿瘤医院神经外科)、樊小龙(北京师范大学生命科学院神经科学和脑发育实验室)、颜伟(南京医科大学第一附属医院神经外科)。
高级别胶质瘤
高级别胶质瘤的放化疗(指南版) 胶质瘤是指起源于神经胶质细胞的肿瘤,是十分常见的原发性颅内肿瘤,高级别胶质瘤的治疗以手术切除肿瘤为主,结合放疗、化疗等综合治疗方法。手术可以缓解临床症状,延长生存期,并获得足够标本用以明确病理学诊断和进行分子生物学研究。胶质瘤约占所有中枢神经系统肿瘤的 27%,约占恶性肿瘤的 80%;在原发性恶性中枢神经系统肿瘤中,胶质母细胞瘤(GBM,WHO Ⅳ级)的发病率很高,占 46.1%,且男性多于女性;其次是弥漫性星形细胞瘤。GBM 的发病率随着年龄的增长而增加,较高的发病年龄为 75~84 岁,新诊断的中位年龄是 64 岁。 高级别胶质瘤术后放疗可以取得显著的生存获益(1级证据)。放射治疗通常是在肿瘤大部分切除、明确肿瘤病理后,常规分次,择机进行,立体定向放疗(SRT)不适用于脑胶质瘤的初治。 (1)放疗时机
高级别胶质瘤生存时间与放疗开始时间密切相关,术后早期放疗能有效延长高级别胶质瘤患者的生存期,强烈推荐术后尽早(手术后2-6周)开始放疗(2级证据)。 (2)放疗技术 推荐采用三维适形(3D-CRT)或适形调强技术(IMRT),常规分次,适形放疗技术可提高靶区剂量的覆盖率、适形度及对正常组织保护,缩小不必要的照射体积,降低晚期并发症发生率(2级证据),放疗前图像验证(CBCT或EPID)是放疗质控不可缺少的环节。 INC国际神经外科相关专家表示,质子治疗是一种能够更有效地摧毁肿瘤细胞的新型放射疗法。就像一个杀灭肿瘤机器,这个庞然大物能以亚毫米的精确度瞄准患者肿瘤而不伤害周围健康组织,同时还能够将副作用降至最低。简言之,这就是质子治疗。世界范围内常见的放射治疗是借助于被称为光子的微小光粒子(通常是X射线)进行的。而与光子治疗不同的是,质子治疗使用的射线是由带电的氢原子核(氢离子)组成的。有赖于HIT高度精密复杂的设备,这些射线可以高精度地以75%以上的光速射入肿瘤,达到集中定向杀伤肿瘤的效果。而质子放射治疗对胶质瘤治疗具有以下优势: 1.对脑肿瘤进行高剂量放射治疗,以获得良好的治疗效果。
脑神经胶质瘤
脑神经胶质瘤 简介:恶性星形细胞瘤可扩散至邻近或远离原发灶的脑组织,手术很难将肿瘤组织彻底切除,术后放疗的作用已较明确,化疗及生物调节剂等治疗的疗效尚不能肯定。在不明显增加并发症的条件下,适形放疗等提高局控率的方法与全脑放疗及化疗等可能控制非局部病灶方法的有效配合,可能是今后发展的主要方向。低度恶性星形细胞瘤的儿童病例若肿瘤未全部切除,术后放疗及化疗的疗效较明确。 中文名称:脑神经胶质瘤 外文名称:Brain glioma 病理分级标准:约60%为神经胶质瘤 神经胶质瘤的分类 小脑半球胶质瘤 病理分级标准 在原发性脑肿瘤中,约60%为神经胶质瘤。WHO1997年的病理分级标准为①Ⅰ级:纤维型星形细胞瘤,好发年龄为8-13岁;②Ⅱ级:低度恶性星形细胞瘤(LGA),占所有神经胶质瘤的25%,好发年龄为30-40岁;③Ⅲ级:退变型星形细胞瘤(AA),易转化为Ⅳ级;④Ⅳ级:多形性胶质母细胞瘤(GBM),好发年龄为45-60岁。恶性星形细胞瘤(MA)主要包括AA及GBM,其中GBM占50%-80%。 分类 胶质瘤的分类方法有很多种,有人将儿童小脑半球胶质瘤、视神经胶质瘤归为良性胶质瘤。目前临床上胶质瘤分类系统常用的有两种,即WHO分类系统
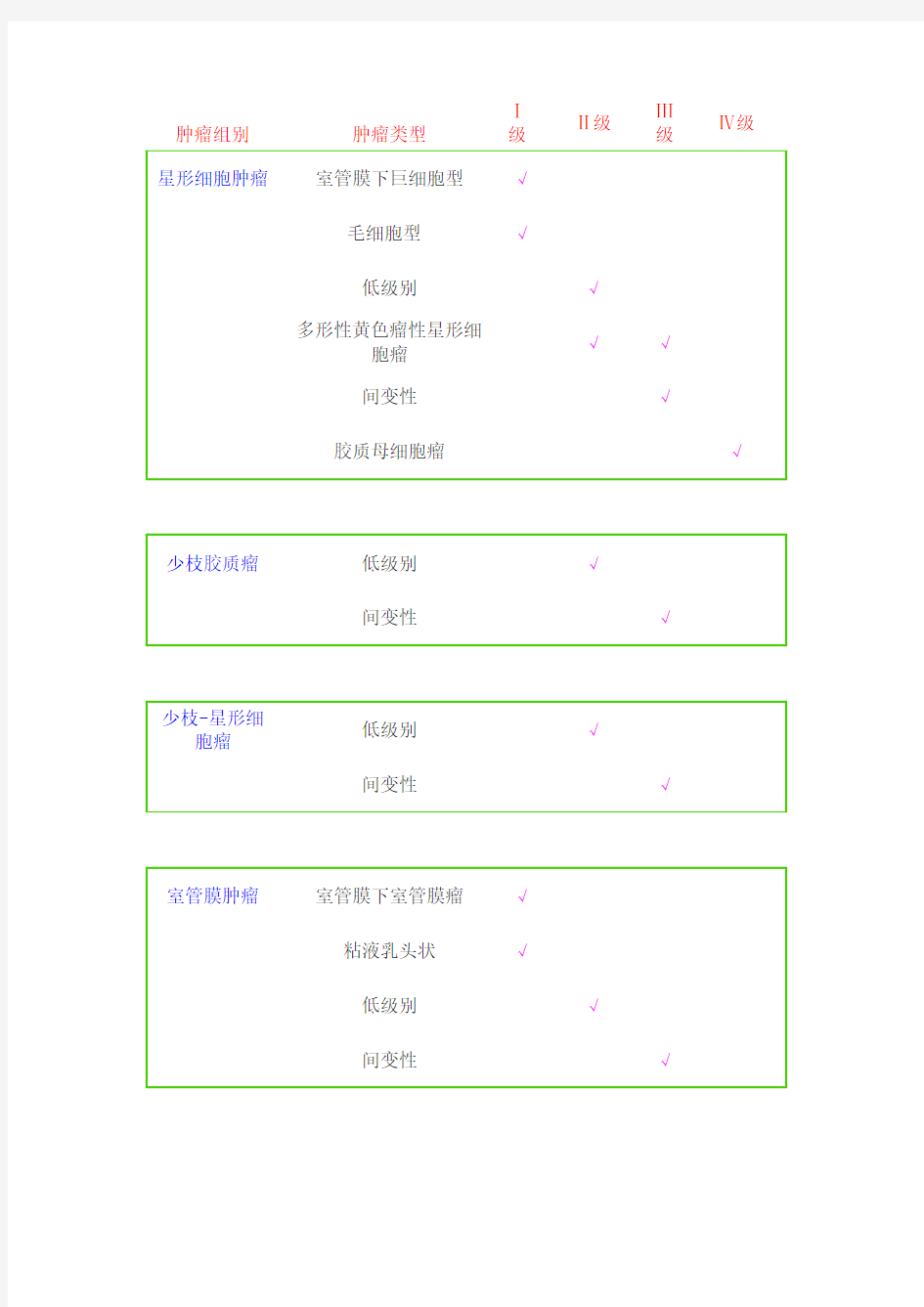
和Kernoban分类系统(如下表)。这两种分类系统都能简单明了的理解胶质瘤的恶性程度高低,但根据这两种分类仍不能准确判断胶质瘤患者的预后,因此这两种分类已不适应目前的临床治疗。但基于分子病理基础上的新的胶质瘤分类尚未制定,目前还只能参照这两种分类,指导胶质瘤的综合治疗,相信不久的将来会有分子水平的病理分级是胶质瘤的诊断及治疗个体化。 星形细胞瘤Ⅰ-Ⅳ级 室管膜瘤Ⅰ-Ⅳ级 少突胶质瘤Ⅰ-Ⅳ级 神经元-星形细胞瘤Ⅰ-Ⅳ级 髓母细胞瘤Ⅰ-Ⅳ级 预后因素 成人低恶度胶质瘤全切除后五年生存率达80%,而在部分切除后为50%;高恶度胶质瘤全切后病人生存期也明显长于近全切除和部分切除的,并且有助于神经功能障碍的恢复。幕上低级别(分化良好)星形细胞肿瘤的预后较好。临床观察发现,低级别星形细胞肿瘤总体上讲预后良好,但它的预后也受多种因素的影响,如病人年龄大于40岁,术前有癫痫、肿瘤的病理类型、手术全切肿瘤能明显的延长病人的生存期。丘脑或脑室肿瘤、肿瘤直径≥5cm,病人的生存率较低。分化不良的星形细胞肿瘤预后差,90%的病人于确诊后二年内死亡,临床上对此类肿瘤治疗困难。 恶性星形细胞瘤 中位生存期(MST)分别为18个月(Ⅲ级)及12个月(Ⅳ级);年龄50岁、KPS<70及智力异常者的MST<5个月。对于年龄<50岁、KPS≥70的病例,胼胝体受侵与
神经胶质瘤晚期死亡前的征兆
神经胶质瘤晚期死亡前的征兆 神经胶质瘤晚期死亡前的征兆?对于很多人来说,神经胶质瘤还是比较陌生的,再加上神经胶质瘤的初期症状不明显,很多神经胶质瘤患者都是到了神经胶质瘤晚期才有所察觉,这就会使治疗的难度加大,进入晚期之后,神经胶质瘤患者就会出现各种明显的症状。那么,神经胶质瘤晚期有什么表现?下面就为大家介绍一下。 神经胶质瘤晚期有什么表现? 胶质细胞瘤首发症状可为颅内压增高如头痛、呕吐,或为神经定位症状如肌力减退、癫痫等。数周、数月或数年之后,症状增多,病情加重。发病也有较急的,病人于数小时或数日内突然恶化,陷入瘫痪、昏迷。后者见于肿瘤囊性变、瘤出血(瘤卒中)、高度恶性的肿瘤或转移并发弥漫性急性脑水肿,或因瘤体(囊肿)突然阻塞脑脊液循环通路,以致颅内压急剧增高,导致脑疝危象。 (一)颅内压增高 当肿瘤体积超过颅内压调节代偿能力、或肿瘤周围反应性脑水肿时,脑脊液循环通路梗阻,静脉回流受阻。因而导致颅骨内压增高并逐渐加重,产生颅内压增高的三大主要临床症状和体征:头痛、呕吐、视神经乳头水肿。 1、头痛:头痛大多由于颅内压增高所致,肿瘤增长颅内压逐渐增高,压迫、牵扯颅内疼痛敏感结构如血管、硬膜和某些颅神经而产生头痛。大多为跳痛、胀痛,部位多在额颞部或枕部,一侧大脑半球浅在的肿瘤,头痛可主要在患侧、头痛开始为间歇性,多发生于清晨、随着肿瘤的发展,头痛逐渐加重,持续时间延长。 2、呕吐:与饮食无关,清晨多见。呕吐多与剧烈头痛相伴随,有时可呈喷射性,但非喷射性呕吐并不少见。 (二)神经定位 1.大脑星形细胞瘤 60%患者发生癫痫,约1/3患者以癫痫为首发症状。 2.小脑星形细胞瘤患侧肢体共济失调,动作笨拙,持物不稳,肌张力和腱反射低下等是其显著特征。 神经胶质瘤晚期死亡前的征兆?神经胶质瘤是生长在颅部的肿瘤,是会有变大的可能的,尤其是在病情发展的后期,如果治疗不得当的话就会使肿瘤增大,会严重的影响到患者的正常生活,因而患者一定要提高警觉,多了解一些相关的知识,不要等到疾病发展到晚期后才去采取治疗措施,那治疗的难度就很大了。
胶质瘤病理分类及诊断基础
胶质瘤病理分类及诊断基础 各位专家,各位老师大家晚上好。先自我介绍一下,我是广东三九脑科医院病理科李海南医生。师从中山大学附属第一医院李智教授学习神经病理。李智教授是我们国内知名的神经病理专家,今天晚上,我把在这一年时间所学的跟大家做一个汇报,并谈谈我的体会,谈不上讲课,仅仅是我们病理跟影像的跨专业的一个交流,讲的不对的,请大家批评指正。今天晚上谈的内容有四个:第一个是胶质瘤2016版WHO的分类,第二,是病理医生在诊断胶质瘤的组织学要素,第三个,是我们诊断胶质瘤常用的免疫组化及分子检测的项目以及结果解读。第四个呢,是我们常见的各型胶质瘤的病理学诊断要点。谈新版WHO分类前,先把背景向大家介绍一下,在去年的六月,中枢神经系统WHO第四版的升级版,应该来说是引起了神经肿瘤界的巨大震动。因为这个升级版颠覆了以前我们很多认识,WHO分类,第三第四版就把分子遗传学写入其中,但没有作为其分类的条件。过去在我们临床工作当中,常常会发现一些这样的情况:明明病理诊断是二级的肿瘤,但是一年或半年就复发了,而有一些我们诊断的四级的肿瘤,患者却活上了五年甚至更长。这种情况让我们临床医生很困惑,病理医生也很困惑。第四版的升级版为了更好地反映肿瘤的生物学行为,就把分子生物学
引入了病理分类当中去。新版WHO的分类他的显著特点有哪一些呢?我们说传统的病理学诊断,主要是根据HE的染色镜下形态、电镜、免疫组化染色来分类。但是新版分类就把组织学形态和基因表型整合起来,是种整合诊断模式。因此说,新版WHO分类出来以后,脑肿瘤的病理诊断的是进入了无分子,不诊断的时代。新版的分类当中,大致的结构跟旧版是一样的,但是把毛星、毛粘、管膜下巨细胞瘤和多形黄瘤归入到另外其它星形细胞瘤的目录之下。星形细胞瘤的分类有增有减,ppt里红色的是新增的分类,绿色的是删 除的分类。把纤维型星形细胞瘤、原浆型星形细胞瘤、大脑胶质瘤病、少突星形细胞瘤删除了。增加的分类包括上皮样胶质母细胞瘤,弥漫性中线胶质瘤和间变多形黄。除此之外,星形细胞瘤根据是否由IDH基因的突变分为IDH突变型、IDH野生型和NOS,IDH突变型是指肿瘤有IDH1或IDH2 的基因突变;IDH野生型,是指没有IDH基因突变;NOS,指的是目前没有条件检测,或者是虽然检测了但是效果不佳,不能够肯定IDH基因突变的情况。下面我们对删除的分类和新增的分类逐个介绍。首先,之所以删除纤维型星形细胞瘤,原浆型细胞瘤,第一、纤维性星形细胞瘤本身就是构成弥漫性细胞瘤的基本成分,因此没有必要再列出来。第二、原浆型星形细胞瘤与其他弥漫性细胞瘤,其实没有实质上的差异。其实更重要的是这两种星形细胞瘤在基因上,没有什么特殊
恶性胶质瘤的分类有哪些
恶性胶质瘤分为几类 胶质瘤会诊中心恶性胶质瘤分为几类?胶质瘤是发生于神经外胚层的肿瘤,故亦称神经外胚层肿瘤或神经上皮肿瘤。肿瘤起源于神经间质细胞,即神经胶质、室管膜、脉络丛上皮和神经实质细胞,即神经元。大多数肿瘤起源于不同类型的神经胶质,但根据组织发生学来源及生物学特征类似,对发生于神经外胚层的各种复查肿瘤病,一般都称为神经胶质瘤。恶性脑胶质瘤按组织发生原则进行分类,分为星形细胞瘤、成星形细胞瘤、成髓细胞瘤、少支胶质细胞瘤、室管膜瘤、松果体瘤、神经上皮瘤。 1.星形胶质细胞瘤 这是恶性脑胶质瘤中最多见者,占恶性脑胶质瘤的51.2%,本病在成人中最常见发生部位是额顶、颞叶等,儿童多发生在小脑半球。星形细胞瘤生长缓慢,病程较长,若肿瘤位于在大脑半球,其临床特点则多出现癫痫、肢体瘫痪及感觉障碍等,颅内压增高征出现较晚,故有长期癫痫发作而无其他体征者。 2.多形性成胶质细胞瘤 本病为成人大脑半球常见的肿瘤,占恶性脑胶质瘤的23.5%,多发生在40岁左右的成年人,常位于大脑半球,从白质长出伸展到皮质,甚至可达脑膜。儿童少见,且多生长在脑干。此种恶性脑胶质瘤是一种恶性度很高的肿瘤,其临床特征为病情进展快,病程常在1年
以内,由于肿瘤生长在大脑半球,可迅速出现偏瘫、失语及各种感觉障碍等。 3.室管膜瘤 此种脑瘤占恶性脑胶质瘤的11.3%,为恶性脑胶质瘤的第3位,较常见于儿童及成年人,本病的特点为绝大多数肿瘤位于第四脑室内,脑瘤位于幕上者,主要位于侧脑室和第三脑室,其症状因肿瘤所在部位不同而异,以头痛、呕吐、视力减退及视神经乳头水肿等颅内压增高症状最为多见。 4.成髓胶质细胞瘤 此种恶性脑胶质瘤为儿童颅后凹中线最常见的肿瘤,占恶性脑胶质瘤的4.2%,占儿童颅内肿瘤的15.1%至18%。临床特点为常迅速出现小脑中线的症状与体征。早期即出现头痛、呕吐、视力减退、视神经乳头水肿等颅内压增高症状。因肿瘤位于小脑蚓部,故多表现为躯干型共济失调,下肢比上肢严重,出现走路不稳、步态蹒跚、昂伯氏征阳等。 5.少支胶质细胞瘤 本病为成人少见的生长缓慢的肿瘤,仅占胶质瘤的2.99%。其临床特点为大多生长在大脑半球,因其生长很慢,颅内压增高征出现较晚,常表现有癫痫、失语、偏瘫、锥体束征及感觉障碍等,而无明显颅内压增高症状。X光片有68%可见到肿瘤钙化。个别恶性度高的病例可有头皮下、颈淋巴结等颅外转移,并可循蛛网膜下腔播散。
脑神经胶质瘤的研究进展_姚文敏
?综述? 脑神经胶质瘤的研究进展 姚文敏朴翔宇 【摘要】脑神经胶质瘤是由大脑胶质细胞癌变所产生的、最常见的原发性颅内肿瘤。年发病率约为3~ 8人/10万人口。目前脑神经胶质瘤的治疗主要是手术疗法配合放射治疗、化学治疗,但生存率极低,在传 统的治疗方法外,还有免疫学疗法和疫苗等诸多新兴治疗方法,所以脑神经胶质瘤已经成为神经科学与肿 瘤学的研究交叉热点,本文就脑神经胶质瘤的分类学,分子发病机制,多种治疗方法及效果进行综述。 【关键词】 神经胶质瘤;分子发病机制;治疗 Progress in glioma YAO Wen-min*, PIAO Xiang-yu. *Graduate School, Dalian University, Dalian 116600, China Corresponding author: PIAO Xiang-yu, Email: piao_2288@https://www.360docs.net/doc/c216682613.html, 【Abstract】Brain glioma is the most common primary brain tumor, the tumor is generated by the brain glial cell carcinogenesis. The annual incidence rate of the disease is about (3-8)/106 people. Now, the treatments of cerebral glioma are operation therapy combined with radiotherapy and chemotherapy, but the survival rate is extremely low, except the traditional treatment methods, immunological therapy, vaccine and many other new methods of treatments are on the study. So the brain glioma has become the research interaction focus of neuroscience and oncology science, the thesis reviewed brain glioma many areas, such as the disease classification, molecular pathogenesis, and effects of a variety of treatment methods. 【Key words】 Glioma; Molecular pathogenesis; Treatment 脑神经胶质瘤是由大脑胶质细胞癌变所产生的、最常见的原发性颅内肿瘤[1],是起源于脑神经胶质细胞的肿瘤,包括星形细胞肿瘤,少突胶质细胞肿瘤,混合性胶质细胞肿瘤和室管膜肿瘤。其中星形细胞瘤是胶质瘤中最常见者,WHO根据其生物学行为将其分为Ⅰ~Ⅳ级。即1997年分级标准[2]:Ⅰ级:纤维型星形细胞瘤,好发年龄为8~13岁;Ⅱ级:低度恶性星形细胞瘤(LGA),占所有神经胶质瘤的25%,好发年龄为30~40岁;Ⅲ级:退变型星形细胞瘤(AA),易转化为Ⅳ级;Ⅳ级:多形性胶质母细胞瘤(GBM),好发年龄为45~60岁[3]。恶性星形细胞瘤(MA)主要包括AA及GBM,其中GBM占50%~80%。 一、脑神经胶质瘤发病机制研究 如同其他肿瘤(疾病)一样,胶质瘤也是由于先天的遗传高危因素和环境的致癌因素相互作用所导致的。一些已知的遗传疾病,例如神经纤维瘤病(Ⅰ型)以及结节性硬化疾病等,为脑神经胶质瘤的遗传易感因素。有这些疾病的患者,其脑神经胶质瘤的发生机会,要比普通人群高很多。此外,一些环境的致癌因素也可能与胶质瘤的发生相关。 (一)基因变异与脑神经胶质瘤 Viotti等[4]的科研小组利用基因敲除小鼠实验发现,脑神经 DOI:10.3877/cma.j.issn.1674-0785.2013.24.142 作者单位:116600 辽宁省,大连大学研究生学院(姚文敏);大连大学附属中山医院神经内一科(姚文敏、朴翔宇) 通讯作者:朴翔宇,Email: piao_2288@https://www.360docs.net/doc/c216682613.html, 胶质瘤与P53存在密切的关系,他们的实验结果证实,脑神经胶质瘤的发生与肿瘤抑制因素TP53及由PARK2编码的Parkin 蛋白有关联,当Parkin的基因突变或缺失时,该蛋白与TP53的联系就会中断,导致脑神经胶质瘤发生,此外,该实验证实在肿瘤发生过程中,Bax和Bcl2分别与P53发生负相关和正相关。Sj?str?m等[5]的研究小组发现,人巨噬细胞病毒和疱疹病毒与脑神经胶质瘤也存在一定相关性。有研究通过统计学证实,脑神经胶质瘤的发生与遗传有关,不同民族的发病率存在很大差距[6],该实验采用SIR数据统计,发现德国(SIR=0.64),东欧(SIR=0.62),亚洲(SIR=0.71),智利(SIR=0.34),和非洲移民(SIR=0.52)。另外增加罹患脊髓室管膜瘤,星形细胞瘤风险的国家有:德国(SIR=3.66)、前南斯拉夫(SIR=8.89)。 (二)表观遗传学变异与神经胶质瘤 目前有人将研究的重点放在表观遗传学方面,这主要是因为随着对肿瘤研究的深入,人们发现DNA序列以外的调控机制异常,在肿瘤的发生、发展过程中更为普遍,该理论对神经胶质瘤的发病机制研究也起到重要作用[7]。胶质瘤亦是如此。在胶质瘤中,因异常的DNA甲基化所导致的抑癌基因的失活,几乎可见于每一个遗传学致瘤途径中,作为经典的“二次打击”理论的补充方式,与遗传学改变如突变与缺失一道在胶质瘤的发生发展中共同发挥作用,因此表观遗传学(Epigenetic)在胶质瘤的发病机制上越来越受到人们的重视。 1. 甲基化异常与脑神经胶质瘤:早在1983年Gama-Sosa 等[8]采用HPLC(high performance liquid chromatography)技术
神经胶质瘤能彻底治愈吗
神经胶质瘤能彻底治愈吗 神经胶质瘤能彻底治愈吗?神经胶质瘤的病程依其病理类型和所在部位长短不一,自出现症状至就诊时间一般多为数周至数月,少数可达数年,恶性程度高的和后颅窝肿瘤病史多较短,较良性的肿瘤或位于所谓静区的肿瘤病史多较长,肿瘤如有出血或囊肿形成,症状发展进程可加快,有的甚至可类似脑血管病的发展过程。 神经胶质瘤能彻底治愈吗?神经胶质瘤属于良性胶质瘤,如果全切,可以彻底治愈。 神经胶质瘤治疗方法: 治疗原则:尽量作肿瘤完全切除;难以全切的做次全切除;肿瘤不能切除或颅内压过高时,可行颞肌下减压术,去骨瓣减压或分流术。术后放疗。 1、手术:基于神经胶质瘤的生长特点为浸润性生长,与正常脑组织无明显界限,多数不限于一个脑叶,向肿瘤外呈指状深入破坏脑组织,理论上手术不可能完全切除,生长在脑干等重要部位的肿瘤有的则根本不能手术,所以手术的治疗目的只能局限于以下5个方面 (1)明确病理诊断。 (2)减少肿瘤体积降低肿瘤细胞数量。 (3)改善症状缓解高颅压症状。 (4)延长生命并为随后的其他综合治疗创造时机。 (5)获得肿瘤细胞动力学资料,为寻找有效治疗提供依据。 2、放疗:适合于术后有明确残留的45岁以上的2级神经胶质瘤病人;或者三级、四级的神经胶质瘤患者。对以45岁以下的二级神经胶质瘤患者,即使没有全切,仍然可以采取观望态度。 3、化疗:适合于复发的二级胶质瘤患者,三级和四级的神经胶质瘤患者的术后治疗。 化疗常用于恶性度较高的脑神经胶质瘤,对于转移性脑瘤,其治疗的敏感程度取决于它的中枢外原发病灶对化疗的敏感度,对中枢外原发病灶有效的化疗方案,对脑转移瘤同样敏感。 化疗药物两个问题:血脑屏障、肿瘤对药物的敏感性。
低级别胶质瘤
Glioma patients group:two four nine one five eight seven seven eight 胶质瘤病友群:249158778 1. In patients with low grade glioma and controlled epilepsy as the single symptom, surgery may be deferred until clinical or radiological progression. (Level of Evidence 4- Recommendation grade C) 当可控的癫痫作为唯一症状的低度恶性胶质瘤患者,在没有出现临床上或者影像上的进展的时候,手术可以推迟。上海东方医院神经外科魏社鹏 In one retrospective study by van Veelen et al, it was shown that in patients with controlled seizures as the single symptom, the prognosis is not influenced by the timing of the surgery. It could be, therefore, safe to defer surgery until clinical or radiological progression in patients with controlled epilepsy only. Veelen等一项回顾性研究发现,以癫痫发作为单一症状的胶质瘤病人,其预后并没有被手术的时机所影响,故建议在病人的临床症状和影像学结果没有出现进展之前,尽可能的推迟手术也是很安全的。 In 1994 Berger et al analyzed the effect of extent of resection on recurrence in patients with low grade gliomas. They found that for tumours greater than 10 cm3 a greater percent of resection and a smaller volume of residual disease convey a significant advantage in terms of recurrence, compared to those that had a less aggressive resection or biopsy. For tumours smaller than 10 cm3 no recurrence was detected over 3 to 4 years, regardless of percent of resection. 1994年,Berger等发现那些体积大于10立方厘米的肿瘤,术中切除越多,则复发越迟,而那些体积小于10立方厘米的肿瘤,切除程度和复发则没有联系。 2. In patients with increased intracranial pressure, neurological deficits, uncontrollable seizures, or in those who have clinical or radiological progression, maximal resection, when safe, should be attempted. (Level of Evidence 3- Recommendation grade B) 对于有颅内压增高症状的病人,以及有神经功能缺损,未控制的癫痫,或者临床或者影像上出现进展的病人,在安全的前提下,尽可能做根治性的切除。 3. Postsurgical radiation therapy may be deferred until clinical or radiological progression. When Radiation therapy is indicated, the dose should be between 45 and 54 Gy. (Level of Evidence 1- Recommendation grade A)
