大米出厂检验原始记录
大米出厂检验原始记录
检验员:
检验原始记录和出厂检验报告
出厂检验原始记录 化验:审批: 产品名称样品数量抽样基数 规格型号抽样地点生产日期 检验依据 检验项目实测数据检测仪器 酒精度,%(V/V) GB/T10345.3酒精计法 总酸(以乙酸计),g/L GB/T10345.4 总酯(以乙酸乙酯计),g/L GB/T10345.5 第一法 固形物/(g/L) 感官取100mL酒样经蒸馏后定容至100mL备用。 测定值: 测定温度:℃ 吸取50.00ml样液进行测定。 样品测定消耗氢氧化钠标液(ml):V= V’= 氢氧化钠标液的浓度:c= mol/L = ? ? = 0. 50 60 V c X ()() 0. 50 60 ? ? = = X ()() 2 + = 上述样品加入25.00ml氢氧化钠标准溶液,在100℃水浴锅上回流1h,用 盐酸标准溶液滴至终点 测定时,消耗硫酸标液的体积(ml):V= V’= 硫酸标液的浓度:c= mol/L () 0. 50 88 V c ? - ? = V X= X ()() 2 + = 取50mL酒样注入恒重100mL瓷蒸发皿,置于水浴至干,在将蒸发皿放 入103℃干燥箱直至恒重。 1000 0. 50 1 ? - = m m X X1= X 2= 色泽和外观: 香气: 口味: 风格: 酒精计 电子天平
出厂检验报告 化验: 审批: 产品名称 抽样人员 生产日期 抽样数量 检验日期 报告日期 检验依据 项 目 检验标准值 检验结果 判定 感 官 色泽和外观 无色或微黄,清亮透明,无悬浮物, 无沉淀; 香气 香气自然纯正清雅; 口味 酒体醇和、甘冽净爽; 风格 具有本品的典型风格。 酒精度/%vol 41-68 总酸/(g/L ) ≥0.3 总酯/(g/L ) ≥0.5 固形物/(g/L ) ≤0.5 甲醇/(g/L ) ≤0.6 结论 该批产品 □符合 □不符合 要求。 日期:
检验原始记录规范
检验原始记录规范 1 范围 本规范规定了检验原始记录(以下简称原始记录)的基本要求、格式和填写要求。 2 术语 2.1 测定值 测定时,从仪器仪表或量具上读取的数值。 2.2 给定值 为了得到测定值而按标准规定给出的标准试剂(或试样)特性的量值。 2.3 计算值 由给定值和测定值经计算公式,按有效数字运算规则计算所得到的数值。 2.4 灭菌 用物理或化学的方法杀灭传播媒介上所有的微生物,使其达到无菌。 2.5 消毒 用物理或化学的方法杀灭或清除传播媒介上的病原微生物,使其达到无害化。 3 基本要求 3.1 原始记录的内容应包括与检验有关的一切资料、数据和现象,完整地记 录全过程。 3.2 每一样品的原始记录应给出足够的信息以保证检验能够再现。 3.3 原始记录要格式化,每类样品应有固定的格式。 3.4 多个产品的同一检验项目的原始记录不准集中填写。
3.5 填写原始记录最好用钢笔(蓝色或黑色),也可使用碳素笔,禁止用铅笔。 3.6 字迹清晰、端正,尤其是0到9这10个阿拉伯数字和计量单位的书写。 3.7 改正错误的时要用“杠改法”(在需要改正的地方用红色笔划一横杠,在其右上方进行修改),并加盖改正人本人印章或签字确认。 3.8 记录应卷面整齐、洁净。同一页中不准使用两色或两色以上的墨水。 3.9 原始记录不允许重新抄写整理,要保持原始记录的原始属性。 3.10 对因检测、填写或其他原因造成得失误,使原始记录出现多处错误或卷面不洁欲作废的原始记录,不准撕毁废弃,应加盖“作废”(红色)章,仍与重新填写的原始记录一起存档。 4 填写要求 4.1 样品编号 样品编号为样品唯一性标识号,由业务室负责编写,原始记录样品编号应与检验报告及送样单编号一致。 4.2 共页第页 4.2.1 原始记录总页数等于手填原始记录页数与仪器设备自动记录页数之和。 4.2.2 手填写的原始记录应采用A4幅面纸,并算为1页:仪器设备自动记录纸不小于32开为1页;如小于32开,要粘贴在A4幅面原始记录纸上。 4.2.3 从第1起,按顺序排列。 4.3 检验项目 检验项目名称应与产品检验标准中规定的名称一致。如果一个检验项目需引用另一个检验项目的数据,在检验项目栏内应填写两个检验项目名称;本栏内还
检验原始记录规范标准[详]
检验原始记录规 1 围 本规规定了检验原始记录(以下简称原始记录)的基本要求、格式和填写要求。 2 术语 2.1 测定值 测定时,从仪器仪表或量具上读取的数值。 2.2 给定值 为了得到测定值而按标准规定给出的标准试剂(或试样)特性的量值。 2.3 计算值 由给定值和测定值经计算公式,按有效数字运算规则计算所得到的数值。 2.4 灭菌 用物理或化学的方法杀灭传播媒介上所有的微生物,使其达到无菌。 2.5 消毒 用物理或化学的方法杀灭或清除传播媒介上的病原微生物,使其达到无害化。 3 基本要求 3.1 原始记录的容应包括与检验有关的一切资料、数据和现象,完整地记 录全过程。 3.2 每一样品的原始记录应给出足够的信息以保证检验能够再现。 3.3 原始记录要格式化,每类样品应有固定的格式。 3.4 多个产品的同一检验项目的原始记录不准集中填写。
3.5 填写原始记录最好用钢笔(蓝色或黑色),也可使用碳素笔,禁止用铅笔。 3.6 字迹清晰、端正,尤其是0到9这10个阿拉伯数字和计量单位的书写。 3.7 改正错误的时要用“杠改法”(在需要改正的地方用红色笔划一横杠,在其右上方进行修改),并加盖改正人本人印章或签字确认。 3.8 记录应卷面整齐、洁净。同一页中不准使用两色或两色以上的墨水。 3.9 原始记录不允许重新抄写整理,要保持原始记录的原始属性。 3.10 对因检测、填写或其他原因造成得失误,使原始记录出现多处错误或卷面不洁欲作废的原始记录,不准撕毁废弃,应加盖“作废”(红色)章,仍与重新填写的原始记录一起存档。 4 填写要求 4.1 样品编号 样品编号为样品唯一性标识号,由业务室负责编写,原始记录样品编号应与检验报告及送样单编号一致。 4.2 共页第页 4.2.1 原始记录总页数等于手填原始记录页数与仪器设备自动记录页数之和。 4.2.2 手填写的原始记录应采用A4幅面纸,并算为1页:仪器设备自动记录纸不小于32开为1页;如小于32开,要粘贴在A4幅面原始记录纸上。 4.2.3 从第1起,按顺序排列。 4.3 检验项目 检验项目名称应与产品检验标准中规定的名称一致。如果一个检验项目需引用另一个检验项目的数据,在检验项目栏应填写两个检验项目名称;本栏还可填
大米出厂检验报告单.doc
大米出厂检验报告Q/HQ R-8.2.4-1-01 Q/HQ R-8.2.4-1-01
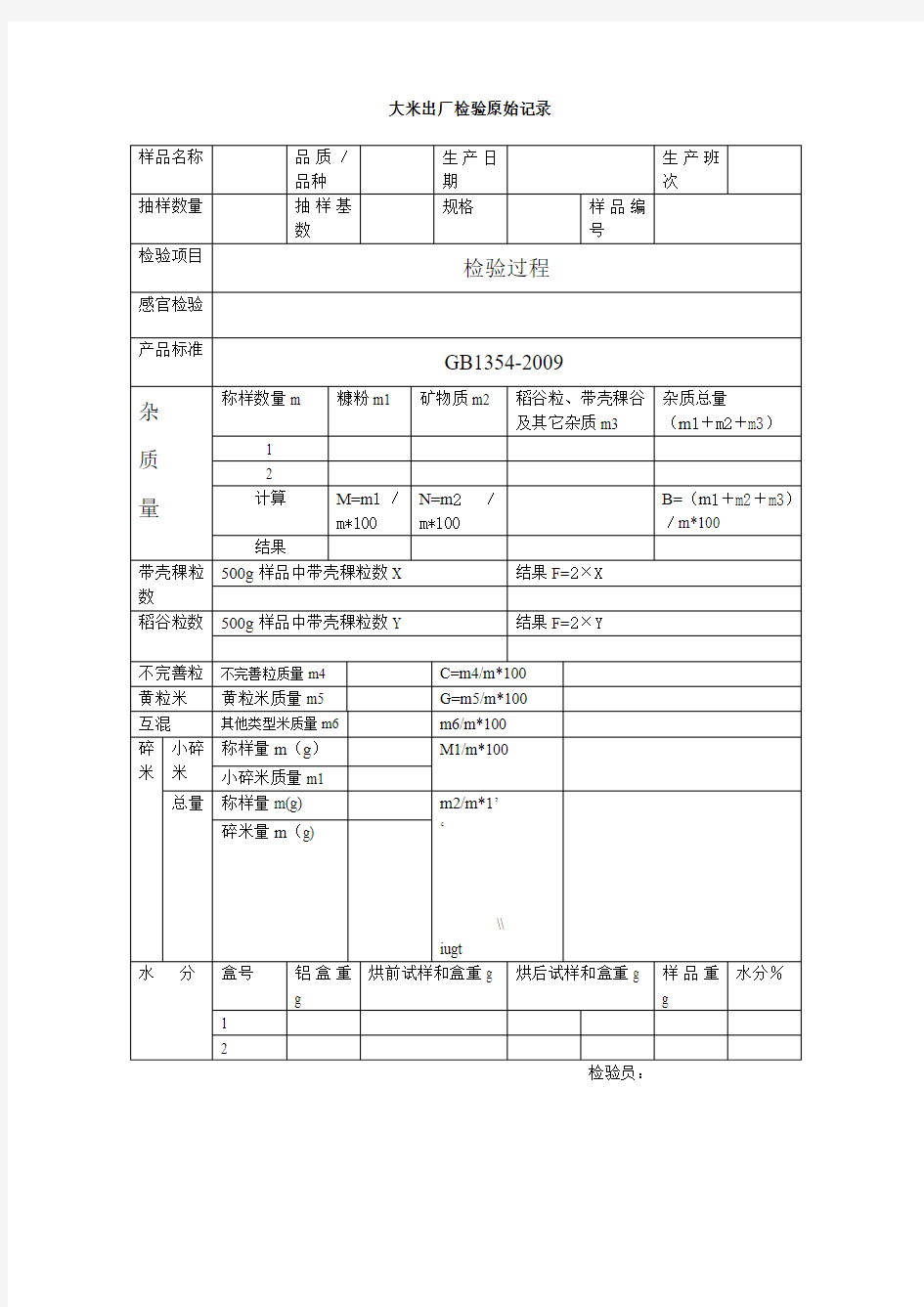
大米检验原始记录 1、色泽、气味、口味 2、加工精度 3、杂质检验(分样量M0:200g) 糠粉(W1)第一次:g 含量A(%)=W1/M0×100= 第二次:g 含量A(%)= W1/M0×100= 矿物质(W2)第一次:g 含量B(%)=W2/M0×100= 第二次:g 含量B(%)= W2/M0×100= 稻谷粒、带壳稗粒、其它杂质(W3)第一次:g 含量C(%)=W3/M0×100= 第二次:g 含量C(%)=W3/M0×100= 杂质总量=A+B+C= 4、稻谷粒和稗粒检验(分样量M1:500g ) 稻谷粒第一次:检出粒含量:粒/Kg 第二次:检出粒含量:粒/Kg 带壳稗粒第一次:检出粒含量:粒/Kg 第二次:检出粒含量:粒/Kg 5、水份单位:g
XXXX项目可行性研究报告报告日期XXXX年XXXX月XXXX日
目录 第一节项目概况 一、项目背景 二、投资方简介 三、目标公司简介 第二节拟投资行业及市场概况 第三节项目实施的必要性与可行性 一、项目实施的必要性 二、目标公司市场分析 三、项目实施的可行性 第四节项目内容及实施方案 第五节项目效益分析 一、经营收入估算 二、经营总成本估算 三、经营利润与财务评价 第六节项目风险分析及对策 一、市场风险及对策 二、技术风险及对策 三、财务风险及对策 …… 第七节投资方案 一、收购定价 二、预计投资总额
三、资金来源与支付 四、后续发展方案 第六节报告结论 第一节项目概况 一、项目背景 说明项目提出的背景、投资理由、拟投资国家的投资环境、在可行性研究前已经进行的工作情况及其成果、重要问题的决策和决策过程等情况。 二、投资方简介 1、投资方基本情况及经营情况 包括目标公司基本工商注册信息、产业布局、主要产品及用途、员工情况、股权结构及控股方信息、行业地位、历史沿革等。 2、投资方实力和优势分析 三、目标公司简介 1、基本信息 包括目标公司基本工商注册信息、产业布局、主要产品及用途、员工情况、股权结构及控股方信息、行业地位、历史沿革等。 2、经营情况 (1)经营情况 公司的产品在市场上进行销售、服务的发展现状,包括历年产量、销售收入等。 (2)资产负债情况
药材检验原始记录样本
XXXXX药业(饮片)有限公司 原药材检验报告单 XXXXX药业(饮片)有限公司
原药材检验记录 【性状】 结果: 【鉴别】(1)显微鉴别 横截面: 结果: 粉末: 结果: (2)薄层鉴别 供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液
蒸干,残渣加乙醇5ml使溶解。 对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。 温度:(℃) 相对湿度:(%) 展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液 (6:1:1:0.1) 薄层板:硅胶G 显色剂:稀碘化铋钾试液 灯光:白光、紫外光灯(365nm) 展距:(cm) 供试品色谱中,在与对照药材色谱相对应的位置 上,显相同颜色的荧光斑点。 S1为对照药材(对照品为中检所提供编号为) S2为对照品(对照品为中检所提供编号为) T为样品 结果: 【检查】杂质不得过 XX % (附录IX A) 杂质称重: g 杂质计算结果为: % (标准规定不得过 XX %) 结果: 膨胀度应不低于4.0(附录IX O) 温度:(℃)相对湿度:(%) 电子天平型号:CP214 溶剂:水 样品编号 1# 2# 3# 干燥品称重: g g g 第一次样品膨胀后体积: ml ml ml 第二次样品膨胀后体积: ml ml ml (两次差异不超过0.1ml) 膨胀度计算结果为:(标准规定不低于4.0)
结果: 水分不得过12.0% (附录Ⅸ H 第一法)。 温度:(℃)相对湿度:(%) 烘箱型号:DHG-91012SA型电子天平型号:CP214 样品编号 1# 2# 第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃ 5h) (g)(g)第二次称量瓶+样品恒重(105℃ 1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%) 结果: 总灰分不得过4.0%(附录Ⅸ K) 温度:(℃)相对湿度:(%) 马福炉型号:SX2.5-10 电子天平型号:CP214 样品编号 1# 2# 第一次坩锅称重(600℃ 3h) (g)(g)第二次坩锅恒重(600℃ 0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃ 3h) (g)(g)第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%) 结果: 酸不溶性灰分不得过3.0%(附录Ⅸ K)。 温度:(℃)相对湿度:(%) 马福炉型号 SX2.5-10 电子天平型号 CP214
大米出厂检验作业指导书
大米出厂检验作业指导 书 集团标准化小组:[VVOPPT-JOPP28-JPPTL98-LOPPNN]
大米出厂检验作业指导书1目的 使作业流程规范化,正确指导检验员进行检验作业,确保产品判定准确性。 2适用范围 适用于大米成品出厂检验作业。 3检验环境要求 除另有规定外,除有特殊要求外,在常温下进行 4工程程序 4.1质量指标 4.1.1大米质量指标见表1.其中加工精度、碎米与其中小碎米、不完善粒、杂质最大限量为定等指标。 表1大米质量指标
5、检验方法 5.1感官检验:具有正常粮食的色泽及气味,不得有发霉变质现象。 5.2色泽、气味检验: 5.2.1色泽鉴定 5.2.1.1分取20-50g样品,放在手掌中均匀地摊平,在散射光线下仔细观察样品的整体颜色和光泽。 5.2.1.2对色泽不易鉴定的样品,根据不同的粮种,取100~150g样品,在黑色平板上均匀地摊成15X20cm的薄层,在散射光线下仔细观察样品的整体颜色和光泽。5.2.2气味鉴定 5.2.2.1分取20~50g样品,放在手掌中用哈气或摩擦的方法,提高样品的温度后,立即嗅其气味。 5.2.2.2对气味不易鉴定的样品,分取20g样品,放入广口瓶,置于60~70度的水浴锅中,盖上瓶塞,颗粒状样品保温8~10min,粉末状样品保温3~5min,开盖嗅辨气味。 5.3互混检验:取净稻谷10g,经脱壳、碾米后称量(m2),按GB1350中有关的分类规定,拣出混入的异类型粒,称取其质量(m1)。 互混率计算: X=m1/m2X100………………………………(1)式中:X---互混率,即混入的异类型稻谷占试样总量的质量分数,%; m1---异类型稻谷的质量,单位为克(g)
医疗器械检查记录表精选范文
附件2 医疗器械生产企业日常监督检查表 企业名称: 条款检查内容及要求检查方式检查情况备注 生产企业许可证有效性1.生产企业许可证有效性 查看生产现场,核对企业工商营业执照与生产企业 许可证内企业名称、注册地址、生产地址一致性。 2.所生产产品是否与许可证核发 的产品范围相符合 查看企业生产现场,成品库房、销售台帐、与企业 许可证核定范围进行核对。 3.企业生产、质量管理人员有无 变化 查看企业人员名单,核对企业工商营业执照和生产 企业许可证内法人代表与负责人姓名的一致性。 4.企业管理层人员是否经过医疗 器械法规的培训 查看培训证书(各级食品药品监督管理部门或企业 内部培训)。 5.三类医疗器械生产企业是否有 内审员 查看证书。 生产条件的符合性检查1.生产、组装能力是否具备,设 备能否正常工作,维护保养是否 在有效期内 查看生产现场,看是否配备完成该工艺的生产设 备,核对企业工艺要求及设备维护保养记录。2.生产现场是否管理有序 查看现场及企业是否按产品注册标准的要求进行 生产,并查看是否制定了生产过程控制和管理文 件。 3.生产场地环境、照明是否与其 生产的产品及规模相适应 查看生产现场环境与照明情况,并查看环境监测记 录,查看生产面积是否拥挤。注:一次性无菌医疗 器械生产现场应符合《无菌医疗器具生产管理规
范》(YY0033)的要求。 医疗器械生产企业日常监督检查表 条款检查内容及要求检查方式检查情况备注 4.《生产实施细则》执行情况;有专项要求的,是否符合相应的《生产实施细则》的要求查看生产现场与生产记录是否符合相应的实施细则。尤其是生产输液器、注射器等一次性使用无菌医疗器械是否符合《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》;生产外科植入物的是否符合《外科植入物的生产实施细则》。 5.原材料、外协件和外购件等采购产品是否符合规定要求检查企业供方的评审记录。原材料、外协件和外购件的采购检验记录,采购合同/技术协议是否符合该产品的质量要求,检查物资供应方的资质证明,尤其是原材料必须是有医疗器械注册证的(如义齿等),要注意检查相关资质证明。 6.生产过程的控制,在产品形成过程中,是否有清晰的状态标识和可追溯标识检查企业生产工艺的验证报告(或记录)。检查生产过程的记录,按生产批号能否追溯到产品原材料的批号、每批产品关键工序及特殊过程的控制情况、每批产品生产过程中有关设备、人员情况和质量记录。 出厂检验记录1.检验设备的配置是否能够覆盖 标准中所规定的出厂检验项目。检 验人员是否经过培训持证上岗 查看检验现场,检验设备清单,查验出厂检验报告 (与注册产品标准的要求核对)查看检验人员的上 岗证及相关的证明培训记录。 2.企业是否对检验设备(含计量器 具)的管理建立制度 查检验设备管理制度,应包括采购、入库、首次检 定、使用保养、周期检定及停用报废等内容。 3.检验设备的精度是否符合检验 要求,检验记录是否真实有效,出 查看(技术监督局)检定合格证是否在有效期内, 查看检验设备上的检定标签是否在有效期内,查看
大米出厂检验作业指导书
大米出厂检验作业指导书 1 目的 使作业流程规范化,正确指导检验员进行检验作业,确保产品判定准确性。 2 适用范围 适用于大米成品出厂检验作业。 3 检验环境要求 除另有规定外,除有特殊要求外,在常温下进行 4 工程程序 4.1质量指标 4.1.1 大米质量指标见表1.其中加工精度、碎米与其中小碎米、不完善粒、杂质最大限量为定等指标。 表1 大米质量指标
品种籼米 二级三级四级等级一级对照标准样品检验留皮程度加工精度15.0 总量/%≤20.0 25.0 30.0 碎米其中小碎米2.5 2.0 1.0 1.5 /%≤6.0 不完善粒/%3.0 ≤4.0 0.4 0.25 ≤/%总量0.3 杂质最大限量≤/%糠粉0.2 0.15
矿物质/%≤0.02 5 3 7 )(/k稻谷4 68 /k)14.5水/1.0黄粒/ 5.0 /互无异常色泽和气色泽、气 5、检验方法5.1 感官检验:具有正常粮食的色泽及气味,不得有发霉变质现象。 5.2 色泽、气味检验:
5.2.1 色泽鉴定 5.2.1.1 分取20-50g样品,放在手掌中均匀地摊平,在散射光线下仔细观察样品的整体颜色和光泽。 5.2.1.2 对色泽不易鉴定的样品,根据不同的粮种,取100~150g样品,在黑色平板上均匀地摊成15X20cm的薄层,在散射光线下仔细观察样品的整体颜色和光泽。 5.2.2 气味鉴定 5.2.2.1 分取20~50g样品,放在手掌中用哈气或摩擦的方法,提高样品的温度后,立即嗅其气味。 5.2.2.2 对气味不易鉴定的样品,分取20g样品,放入广口瓶,置于60~70度的水浴锅中,盖上瓶塞,颗粒状样品保温8~10min,粉末,开盖嗅辨气味。3~5min状样品保温. 5.3 互混检验:取净稻谷10g,经脱壳、碾米后称量(m2),按GB1350中有关的分类规定,拣出混入的异类型粒,称取其质量(m1)。 互混率计算: X= X m1/m2 式中:100………………………………(1) %X---互混率,即混入的异类型稻谷占试样总量的质量分数,;m1---异类型稻谷的质量,单位为克(g)g)。m2---试样质量,单位为克(在重复性条件下,获
