5-溴乙酰基-2-羟基苯甲醛的合成
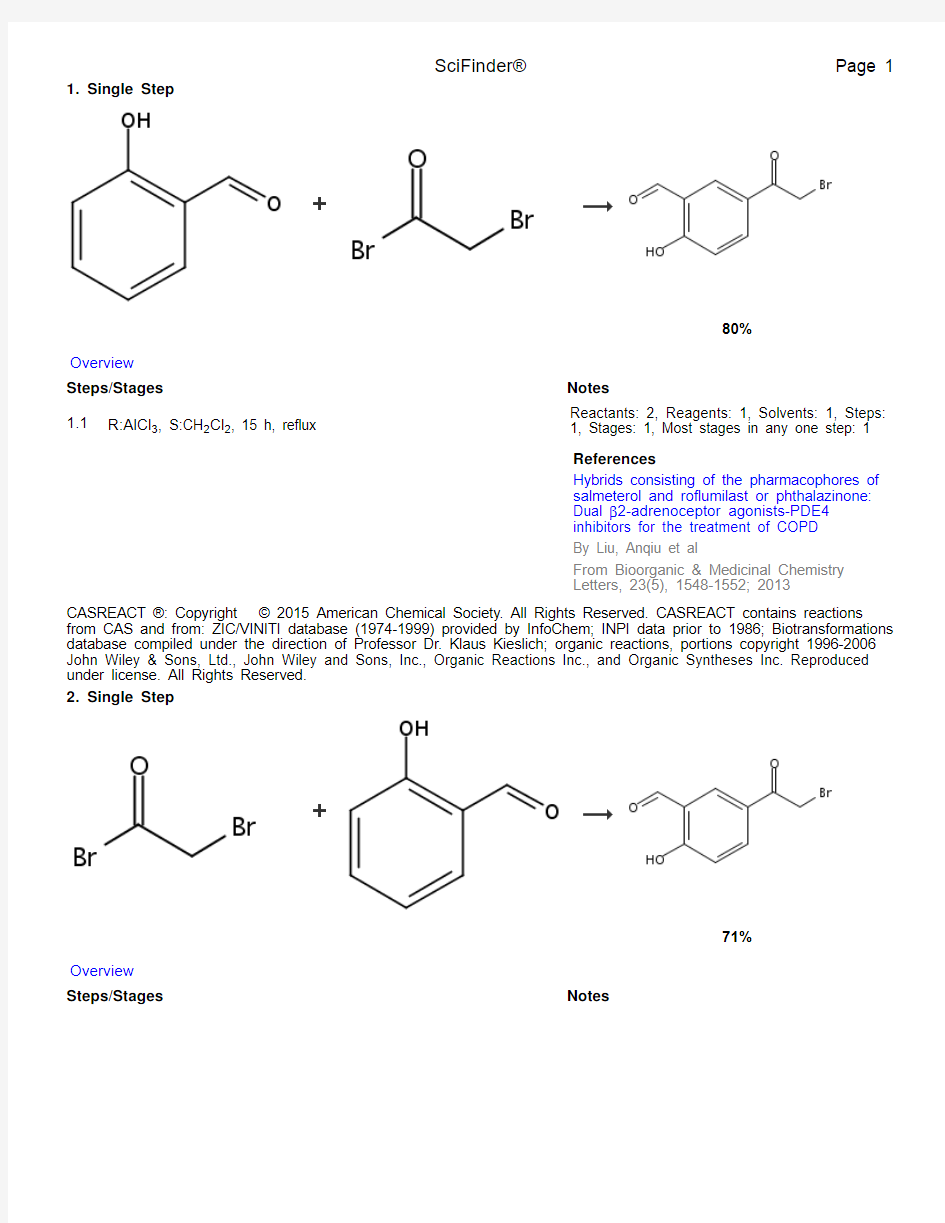

1. Single Step
80%
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, 15 h, reflux
Reactants: 2, Reagents: 1, Solvents: 1, Steps:
1, Stages: 1, Most stages in any one step: 1
References
Hybrids consisting of the pharmacophores of
salmeterol and roflumilast or phthalazinone:
Dual β2-adrenoceptor agonists-PDE4
inhibitors for the treatment of COPD
By Liu, Anqiu et al
From Bioorganic & Medicinal Chemistry
Letters, 23(5), 1548-1552; 2013
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
2. Single Step
71%
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, rt → reflux 1.2reflux; 14 h, reflux; reflux → rt Reactants: 2, Reagents: 1, Solvents: 1, Steps: 1, Stages: 2, Most stages in any one step: 2
References
Process for preparation of α-(aminomethyl)-4-hydroxy-1,3-benzenedimethanol and intermediates
By Xiao, Xuhua et al
From Faming Zhuanli Shenqing, 102584608, 18 Jul 2012
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
3. Single Step
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, 10 h, rt
1.2S:CH2Cl2, rt; 2 h, rt; 4 h, rt → reflux
1.3R:H2O, cooled
Reactants: 2, Reagents: 2, Solvents: 1, Steps:
1, Stages: 3, Most stages in any one step: 3
References
A new route for synthesis of salmeterol
xinafoate
By Wu, Xiaochun
From Xinan Shifan Daxue Xuebao, Ziran
Kexueban, 34(4), 85-88; 2009
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
4. Single Step
82%
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, 30 min, 0°C; 0°C → 10°C 1.210°C → 30°C; 1 h, 30°C
1.330°C → 40°C; 15 h, 40°C
1.4R:H2O Reactants: 2, Reagents: 2, Solvents: 1, Steps: 1, Stages: 4, Most stages in any one step: 4 References
Method for synthesis of (R)-Salmeterol by asymmetrical hydrogen transfer reaction
By Li, Xingshu et al
From Faming Zhuanli Shenqing Gongkai Shuomingshu, 101684074, 31 Mar 2010
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
5. Single Step
81%
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, 10°C; 10°C → 30°C; 1 h, 30°C
1.2S:CH2Cl2, 15 h, 30°C
Reactants: 2, Reagents: 1, Solvents: 1, Steps:
1, Stages: 2, Most stages in any one step: 2
References
New chiral ligand and its application in
synthesis of a key intermediate of salmeterol
By Li, Lichan et al
From Zhongguo Yaowu Huaxue Zazhi, 18(3),
175-179; 2008
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
6. Single Step
Overview
Steps/Stages Notes
1.1Go to Science of Synthesis, a critically
reviewed reference work of synthetic
methodology, for more information.,
Reactants: 2, Steps: 1, Stages: 1, Most stages
in any one step: 1
References
Arenecarbaldehydes: synthesis by C-C bond
formation
By Oestreich, M.
From Science of Synthesis, 25, 667-688;
2007
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
7. Single Step
80%
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, 10°C; 10°C → 30°C; 1 h, 30°C
1.230°C; 15 h, 35°C
1.3S:H2O, 0°C
Reactants: 2, Reagents: 1, Solvents: 2, Steps:
1, Stages: 3, Most stages in any one step: 3
References
A convenient synthesis of (R)-salmeterol via
Rh-catalyzed asymmetric transfer
hydrogenation
By Liu, Juntao et al
From Tetrahedron: Asymmetry, 19(15), 1824-
1828; 2008
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
8. Single Step
80%
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, rt → 50°C; 30 min, 50°C
1.212 h, reflux
Reactants: 2, Reagents: 1, Solvents: 1, Steps:
1, Stages: 2, Most stages in any one step: 2
References
Synthesis of levalbuterol
By He, Wei et al
From Zhongguo Yaowu Huaxue Zazhi, 16(4),
222-225; 2006
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
9. Single Step
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2, 10°C; 10°C → 30°C; 1 h, 30°C 1.2S:CH2Cl2, 30°C; 12-15 h, 35-40°C
1.3R:H2O, 0-5°C Reactants: 2, Reagents: 2, Solvents: 1, Steps: 1, Stages: 3, Most stages in any one step: 3
References
Process for preparation of salmeterol xinafoate
By Gore, Vinayak G. et al
From PCT Int. Appl., 2007045857, 26 Apr 2007
Experimental Procedure
Example 1: Preparation of 5-(Bromoacetyl)-2-hydroxybenzaldehyde (2a) (Synthetic Communications,
vol. 29(12a), pages 2155-2162, 1999; and US patent 5,011,993) To a suspension of aluminium
chloride (4 m/m) in dichloromethane (10 volumes), was added slowly bromoacetyl bromide (1.2 m/m)
at 10°C and then the temperature was brought to 30°C. The reaction mass was stirred at this
temperature for an hour and to this was added a solution of 2-hydroxybenzaldehyde (1) in
dichloromethane at 30°C. The reaction mixture was stirred at 35-40°C for 12-15 hours and then
quenched in water at 0-5°C. The dichloromethane layer was separated and distilled off. To the slurry
obtained, n-heptane was added and stirred for 15 minutes. This slurry was then filtered and the wet
cake was washed with n-heptane (2 volumes). The wet cake was dried at 50°C to constant weight to
obtain intermediate (2a). Yield: 55% w/w. HPLC purity: 97-99%
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
10. Single Step
66%
Overview
Steps/Stages Notes
1.1R:AlCl3, S:CH2Cl2
1.2S:CH2Cl2
1.3R:H2O
Reactants: 2, Reagents: 2, Solvents: 1, Steps:
1, Stages: 3, Most stages in any one step: 3
References
A new synthetic approach to salmeterol
By Rong, Yajing and Ruoho, Amold E.
From Synthetic Communications, 29(12),
2155-2162; 1999
Experimental Procedure
5-(Bromoacetyl)-2-hydroxybenzaldehyde 3 To a stirred mixture of anhydrous AlCl3 (53.2 g, 0.4 mol)
and CH2Cl2 (120 ml) was added a solution of bromoacetyl chloride (24.1 g, 0.12 mol) in CH2Cl2 (30 ml)
at room temperature, and after 30 min salicyladehyde (12.2 g, 0.1 mol) in CH2Cl2 (30 ml) was added
dropwise. The mixture was refluxed for 14-18 hr, and then carefully poured into a mixture of ice and
water. The aqueous layer was extracted with CH2Cl2, the organic fractions were combined, washed
with water (50ml) and brine (50 ml). The organic phase was dried (MgSO4), and evaporated under
reduced pressure to produce a residue which was recrystallized using CH2Cl2-hexane to give yellow
needles 16.0 g, yield 66%. 5-(Bromoacetyl)-2-hydroxybenzaldehyde 3, yield 16.0 g, 66%. mp:117.5-
118°C (lit.10 117-118°C) IR(KBr): 1650 cm-11H NMR (CDCl3, 300HMz): 4.50 (s, 2H), 7.10 (d, 1H, J
=9.0Hz), 8.18 (dd, 1H, J=3.0Hz, J=9.0Hz), 8.31 (d, 1H, J=3.0Hz), 10.0 (s, 1H), 11.50 (s, 1H)
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
11. Single Step
10%
Overview
Steps/Stages Notes
1.1C:AlBr3, S:CH2Br2
1.2
Reactants: 2, Catalysts: 1, Solvents: 1, Steps:
1, Stages: 2, Most stages in any one step: 2
References
A short synthesis of albuterol
By Babad, Esther et al
From Synthesis, (12), 966-8; 1988 Experimental Procedure
B. Using AlBr3 as Lewis Acid, Preparation of a Homogeneous Sample of2: AlBr , (26.7 g, 0.1 mol) in
CH2Br2 (100 mL) is treated with bromoacetyl bromide (5.1 g, 0.025 mol) with stirring and after 30 min,
salicylaldehyde (1; 2.4g, 0.02 mol) is added. The mixture is heated at 80-90 °C for 18 h, and then
carefully poured onto ice (800 g) with stirring. The organic layer is separated, and the aqueous layer is
extracted with CH2Cl2 (2x 100mL). The organic fractions are combined, washed with brine (2 x 250
mL), dried (MgSO4), and evaporated under reduced pressure. The resulting brown oil is purified by
chromatography on a silica gel column (15 x 2 cm; 230 -400 mesh) using hexane/EtOAc (6:1) as
eluent to give 2. Light crystalline solid; yield 0.46 g, 10%. mp 117-118°C; C9H7BrO3 (243.1), calc. C
44.24 H 2.90; found C 44.4 H 7 2.81; IR (KBr): v= 1650cm-1. UV (CH3CN): λmax = 243 nm (ε= 25082).
1H-NMR (CDCl3): δ = 4.4 (s, 2H); 7.05 (d, 1 H, J= 10 Hz); 8.00-8.30 (m, 2 H):9.90 (s, 1 H); 11.40 (s, 1
H).
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
12. Single Step
70% (86:14 )
70% (86:14 )
Overview
Steps/Stages Notes
1.1C:AlCl3, S:CH2Cl2 1.2S:CH2Cl2Reactants: 2, Catalysts: 1, Solvents: 1, Steps: 1, Stages: 2, Most stages in any one step: 2 References
A short synthesis of albuterol
By Babad, Esther et al
From Synthesis, (12), 966-8; 1988
Experimental Procedure
5-(Bromoacetyl)-2-hydroxybenzaIdehyde (2): A. Using Alcl3 as Lewis Acid: To a suspension of AlCl3
(333 g, 2.5 mol) in CH2Cl2 (350 mL) at reflux is added bromoacetyl chloride (99 g, 0.63 mol) in CH2Cl2
(75 ML), and after 30 min salicylaldehyde (1; 61.1 g, 0.5 mol) in CH2Cl2 (75 ML) is added drop wise.
The mixture is refluxed for 16 h, and then carefully poured into ice (3 kg), water (300 ML) and CH2Cl2
(500 ML) with stirring. Once addition is complete, the mixture is stirred for 15 min, and the organic
layer separated. The aqueous layer is extracted with CH2Cl2 (3 x 250 ML), the organic fractions are
combined, washed with water (2 X 250ML) and brine (500 ML). The organic phase is dried (MgSO4),
and evaporated under reduced pressure to give an oily solid (107 g). The solid is slurried with a
mixture of CH2Cl2 (20 ML) and ether (180 ML), and isolated by filtration. The residue is dried in vacuo
at 50° to give a 6:1 mixture of 2 and 5-(chloroacetyl)-2-hydroxybenzaldehyde (3). Yield 83 g, 70 %. 1H-
NMR (CDCl3): δ = 4.35, 4.65 (2 s, 2H); 7.05 (d, 1 H, J= 10 Hz); 8.00-8.30 (m, 2H); 9.90 (s, 1 H); 11.50
(s, 1 H).
CASREACT ?: Copyright ? 2015 American Chemical Society. All Rights Reserved. CASREACT contains reactions from CAS and from: ZIC/VINITI database (1974-1999) provided by InfoChem; INPI data prior to 1986; Biotransformations database compiled under the direction of Professor Dr. Klaus Kieslich; organic reactions, portions copyright 1996-2006 John Wiley & Sons, Ltd., John Wiley and Sons, Inc., Organic Reactions Inc., and Organic Syntheses Inc. Reproduced under license. All Rights Reserved.
对羟基苯乙酮的合成
科研探索 知识创新 与。对羟基苯乙酮在医药、农药、 染料、液晶材料等领域具有重要的应用价值 。 不同生产方法的主要区别在第二步。 方法1:苯酚和乙酐加氯化锌在一定温度下反应,经柱层析可得到对位异构体40%,邻位异构体38%;此方法得率较高, 但反应时间较长,且生成的邻位取代物较多。 方法2:采用三氯化铝——氯化钠复盐作催化剂 合成了对羟 基苯乙酮,收率58.5%纯度98.68%。 综上,我们采用方法3,即以苯酚和乙酐为原料,先进行酯化反应,再通过三氯化铝催化Fries 重排得到产物对羟基苯乙酮,并对酯化反应是否添加催化剂与第二步重排的最佳反应条件进行探究。此方法催化剂易得,产率较高,纯度经精制后很高,是可行的合成方法。3实验 3.1乙酸苯酯的合成 将一定比例的苯酚和已酐混合后加入到50mL 圆底烧瓶中,加入3滴浓硫酸,加热回流一定时间,反应结束后,将反应液冷却至室温,用蒸馏水洗涤至PH 值为6~7,分去水层,保留有机层,用无水硫酸镁干燥后,常压蒸馏,收集190~194℃的馏分,测折光率分析产品。3.2对羟基苯乙酮的合成 在烘干的装有电动搅拌器、温度计、和上部带有干燥管的冷凝管的三口烧瓶中加入一定量的乙酸苯酯和溶剂A ,在剧烈 搅拌下分三次加入一定量的无水三氯化铝,加完后开始加热使反应温度保持在t ℃左右反应一定时间,停止加热。搅拌下加入一定量的水分解多余的无水三氯化铝。将反应液进行水蒸气蒸馏至澄清,将其转移到敞开容器中,冷却至室温后加入 一定量的一定浓度的稀盐酸,至PH 值为1~2。冰盐浴冷却到-2℃析出白色晶体,过滤得对羟基苯乙酮粗品,干燥称重。将粗品转移至小烧杯中加入一定量的水,水浴加热,分去油层后冰盐浴冷却,过滤得白色针状晶体,再次称重,测熔点和红外。 3.3实验结果与讨论 3.3.1反应时间对乙酸苯酯收率的影响 采用酐醇摩尔比1.2,改变反应时间,当回流时间为2h 时, 产率为46.04%,2.5h 时,产率为60.95%,3h 时,产率为67.7%。可见,随着反应时间相对减少,收率逐渐降低。其原因可能是反应时间过短,反应不完全,反应时间过长,逆反应进行程度较大。 3.3.2反应温度对对羟基苯乙酮收率的影响 采用乙酸苯酯、氯苯、催化剂无水三氯化铝摩尔比1:1.2:1.1,改变反应温度,结果表示,随温度升高,对羟基苯乙酮的收率先增加后减少,在70℃时收率最高,大致成抛物线型变化。在相对较低的温度下, 随着温度的升高,单位体积内反应物的活化分子数增多,从而增加了单位时间内单位体积内反应物 分子的有效碰撞的频率,导致反应速率增大
对羟基苯甲醛
对羟基苯甲醛的合成技术 [摘要]本文介绍了对羟基苯甲醛的一些性质及应用,并讲述其应用发展。叙述了对羟基苯甲醛的合成方法与技术,并对方法的优缺点作了简要对比。其合成方法较多,以苯酚、对氨基苯甲醛、对硝基甲苯和对甲酚为原料均可合成对羟基苯甲醛。本文对其合成方法进行了探讨,当反应时间为6h,碱用量140g,反应压力19.6~24.5Pa为最佳。 [关键词]对羟基苯甲醛;应用;发展;合成; Synthesis of p-hydroxybenzaldehyde Abstract:This paper introduces some properties of hydroxyl benzene formaldehyde and its application, and describes its application and development. Narrated on the synthesis methods and technology, and the advantages and disadvantages of the methods are compared briefly. The synthesis method is more, phenol, amino benzaldehyde, p-nitrotoluene and p-cresol as raw material can be the synthesis of p-hydroxybenzaldehyde. In this paper, the synthesis method is discussed, when the reaction time was 6h,140g alkali dosage, reaction pressure is 19.6 ~24.5Pa is the best. Key words:P-hydroxybenzaldehyde; application; development; synthesis 一、绪论 1.1 对羟基苯甲醛的主要性质 对羟基苯甲醛又称对甲醛苯酚,4一羟基苯甲醛(简称PHBA),分子式CH6O2,为白色结晶性粉末,有芳香味。微溶于冷水,易溶于热水、醇和醚。熔点116℃,密度:1.129。在常压下升华而不分解。半数致死量(小鼠,腹腔)500mg/kg。有刺激性。水蒸气中不挥发。与氯化铁作用生成淡紫色;与钠汞齐作用生成4,4′-二羟基苯偶姻;与锌和盐酸作用生成对甲苯酚。它以苷的形式存在于多种植物中,经水解,从水中得针状体;或由苯酚与氯仿及吡啶反应获得。其合成方法较多,以苯酚、对氨基苯甲醛、对硝基甲苯和对甲酚为原料均可合成对羟基苯甲醛。以其为原料可以合成香兰素、丁香醛、茴香醇、茴香醛和覆盆子酮等香料。在医药工业中用于合成羟氨苄胺嘧啶、三甲氧基苯甲醛、对羟基苯甲醇葡萄糖、对羟基甘氨酸、祛痰药杜鹃素、人造天麻、艾司洛尔等。还用于杀菌剂、照像乳化剂、
对羟基苯乙酮的合成-20110617
实验七对羟基苯乙酮的合成 一、实验目的 1、掌握Fries重排重排反应的基本原理。 2、熟悉减压蒸馏和水蒸汽蒸馏基本操作。 二、实验原理 醇与酸作用生成酯的反应称作酯化反应。酚类化合物虽然也能起酯化反应, 但比醇困难。这是因为酚中存在的p-π共轭效应,降低了氧周围的电子云密度, 使其亲核性比醇弱。所以酚不能直接与酸成酯,而要与酸酐或酰氯作用才能成酯。 酚酯化在三氯化铝存在下加热,酰基可重排到羟基的邻位或对位,称Fries重排。 通常在低温下易于生成对位异构体。 三、实验材料与设备 1、实验设备与仪器 电动搅拌器、水蒸气发生器、长颈圆底烧瓶、量筒、梨形分液漏斗、蒸馏瓶、直 型冷凝器、球形冷凝器、空气冷凝器、三角烧瓶、尾接管、三口瓶、烧瓶、温度 计。 2、实验材料与试剂 苯酚、醋酐、四氯化碳、硝基苯、氢氧化钠、碳酸氢钠、无水三氯化铝、盐 酸、氢氧化钾、无水硫酸镁、三氯甲烷、无水氯化钙。 四、实验操作步骤 1.乙酰苯酚的制备 取500mL长颈锥形瓶(没有就用500mL三颈瓶替代),加入23.5g苯酚,再加入160ml (10%)NaOH溶液,后加入175g碎冰,最后加入32.5g(30mL)醋酐,猛烈振摇反应容器5min,反应液乳化,生成乙酰苯酚,将混合液倾入500 mL分液漏斗中,加入10 mL CCl 4振摇,静置,分层。水层再用10ml CCl 萃取、合并。酯层用5%~10% NaHCO3 40 mL 4
溶液洗涤至pH7到8,酯层(即CCl 4层)置于250mL三角锥瓶中。用适量无水CaCl 2 约 6克干燥,不时地振摇约1h,然后滤至100 mL蒸馏烧瓶中,旋蒸除去CCl 4 ,然后减压蒸馏收集常压下192~197℃的馏分,称重,计算收率。(油浴开始加热,阶段梯度加热(10+10+5+5+5…℃,当油浴锅指示温度为115℃,温度计指示温度为74℃时开始有馏出液溜出;馏出液呈无色透明。) 2.对羟基苯乙酮的制备(Fries重排反应) 在烘干的装有转子、温度计100mL的三口烧瓶中加入乙酸苯酚10g,硝基苯 25mL,剧烈搅拌下分数次缓慢加入无水三氯化铝16g,加完后开始油浴加热回流 升温至60℃反应2h,停止加热,慢慢倾入到150g冰水中,并迅速搅拌。滴加 6mol/L的盐酸(36%的浓盐酸:水=1:1)酸化至pH1~2,用500mL分液漏斗分出 硝基苯层,用5%~10%KOH溶液中和至微酸性或中性,然后进行水蒸气蒸馏, 至硝基苯蒸净为止(约1h),水层用CHCl 3 提取三次(20mL、15mL、10mL),合并 CHCl 3 提取液置于100mL干燥的三角烧瓶中,加适量的无水硫酸钠干燥,摇匀后 放置约20min,滤除硫酸钠,蒸馏除净CHCl 3 后得粗品。(棕黄色) 3.精制 将对羟基苯乙酮粗品和20 倍量的蒸馏水加入反应瓶中加热至沸腾。分去油 层后添加少量活性炭, 在沸腾状态下脱色 15 m in, 趁热过滤得无色透明液体, 室温下静置, 冷却, 结晶后过滤, 真空干燥得白色针状结晶对羟基苯乙酮。(文 献熔点,对羟基苯乙酮的熔点108~111℃) 五、实验注意事项和该思考的问题 1、(以下为一位同学针对其中一个现象的分析,同学可以思考以下,是否正确) 以硝基苯作溶剂乙酰苯酚在无水三氯化铝的催化作用下进行Fries重排,得 到对羟基苯乙酮;反应液倒入冰水中后,使反应液的温度降低,三氯化铝水解生 成氢氧化铝,溶于水相,对羟基苯乙酮形成其铝盐也溶于水相,这时,反应液分 成三层,上层为水层,中间为絮状的氢氧化铝,下层为硝基苯层,反应液呈酸性, pH为3左右,这是由于三氯化铝水解和对羟基苯乙酮酚羟基上的氢离子电离; 用盐酸酸化至pH1~2,这时,对羟基苯乙酮酚羟基上的铝离子离去而得到氢离子, 不溶于水相而溶于硝基苯;用KOH溶液调pH至中性或微酸性,通过水蒸气蒸馏 出去有机溶剂硝基苯,水层用三氯甲烷(对羟基苯乙酮易溶于三氯甲烷)萃取,
对羟基苯甲醛
对羟基苯甲醛对羟基苯甲醛分子式:C7H6O2 分子量:122.12 分子结构图: °H刺激性物品 风险术语R36/37/38lrritati ng to eyes, respiratory system and skin. 刺激眼睛、呼吸系统和皮肤
对羟基苯甲醛的性质 外观性状红棕色粉末 熔点114-118 °C 沸点191 ° 50mm 密度1,129 g/cm 3 闪点174 °C 水溶性13 g/L (30 C) 溶解性易溶于乙醇;乙醚;丙酮;乙酸乙酯, 稍溶于水(在30.5 C水中溶解度为 1.388g/100ml ),溶于苯(在65 C苯中溶解度为3.68g/ml )。 对羟基苯甲醛的用途 【用途一】用作医药、香料、农药的重要中间体,用于合成羟氨基苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品 【用途二】用作医药、香料、农药的重要中间体,用于合成羟氨苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品 【用途三】对羟基苯甲醛用于医药及有机合物的合成 【用途四】该品为医药、香料、液晶的中间体。对羟基苯甲醛用于生产抗菌增效剂TMP (甲氧苄氨嘧
啶)、羟氨苄青霉素、羟氨苄头孢霉素、人造天麻、杜鹃素、苯扎贝特、艾司洛尔;用于生产香料茴香醛、香兰素、乙基香兰素、覆盆子酮。 【用途五】对羟基苯甲醛『123-08-0』在医药工业中,主要用合成羟氨苄青霉素(阿莫西林)、抗菌增效剂甲甲氧苄胺嘧啶(TMP)、3,4,5-三甲氧基甲醛、对羟基苯酐氨酸、羟氨苄头抱霉素、人造天麻、杜鹃素、艾司洛尔等;在香料工业中用于合成香兰素、乙基香兰素、洋茉莉醛、丁香醛、茴香醛和覆盆子酮等香料;在农药中主要用作除草剂溴苯腈和羟敌草腈的合成;在化工中主要用于合成对羟基苯甲酸、对羟基甲酸苄酯、醋酸对羟基苯酚酯;在国外还用于生产杀菌剂、照相乳化剂、镀镍光泽剂、液晶等. 【用途六】用作医药、香料、农药的重要中间体,用于合成羟氨基苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品。高分子聚合物和制药原料。 应用领域 用作医药、香料、农药的重要中间体,用于合成羟氨基苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品 对羟基苯甲醛安全说明书(MSDS)
邻羟基苯乙酮生产工艺
邻羟基苯乙酮项目技术调查报告 有机0911 朱耀 43 第一章产品及原料介绍 1.1 邻羟基苯乙酮 中文名称:2-羟基苯乙酮;1-(2-羟苯基)-乙酮;邻羟基苯乙酮;邻乙酰基苯酚;英文名称:1-(2-hydroxyphenyl)-Ethanone;o-hydroxy-acetophenon;1-(2-hydroxyphenyl)ethanone;;2'-hydroxy-acetophenon CAS: 118-93-4 ,分子式: C8H8O2 ,分子质量:136.15 ,沸点: 213℃,熔点: 4-6℃,性质描述: 浅绿至黄色油状液体。沸点 213℃/95.6kPa(717mmHg),106℃/2.3kPa(17mmHg),相对密度 1.131,折光率 1.5584,闪点98。 用途: 心律平的中间体。 结构式: 1.2苯酚 相对分子量或原子量94.11,密度1.071,熔点(℃)40.3,沸点(℃)182 ,折射率1.5425(41),毒性LD50(mg/kg) 大鼠经口530。 性状:无色或白色晶体,有特殊气味。在空气中因为被氧化而显粉红色 溶解情况:溶于乙醇、乙醚、氯仿、甘油、二硫化碳等。易溶于有机溶
液,常温下微溶于水,当温度高于65℃时,能跟水以任意比例互溶。 用途:用于制染料合成树脂、塑料、合成纤维和农药、水杨酸等。作外科消毒,消毒能力大小的标准(石炭酸系数)。 制备或来源:由煤焦油经分馏,由苯磺酸经碱熔。由氯苯经水解,由异丙苯经氧化重排。 其他:加热至65℃以上时能溶于水(在室温下,在水中的溶解度是9.3g,当温度高于65℃时能与水混溶),有毒,具有腐蚀性如不慎滴落到皮肤上应马上用酒精(乙醇)清洗,在空气中易被氧化而变粉红色。在民间有土方用石炭酸来治皮肤顽疾,以毒攻毒,如用来治脚底起泡。 1.3乙酐 中文名称:乙酸酐,英文名称:Acetic Anhydride。别名:醋酸酐;醋酐;乙酐;Ac2O 无水醋酸; 分子式:C4H6O3;(CH3CO)2O。外观与性状:无色透明液体,有刺激性气味(类似乙酸),其蒸气为催泪毒气。分子量:102.09 。蒸汽压:1.33kPa/36℃ 闪点:49℃。熔点:-73.1℃。沸点:138.6℃ 溶解性:溶于苯、乙醇、乙醚,氯仿;渐溶于水(变成乙酸)。 密度:相对密度(水=1)1.08;相对密度(空气=1)3.52 。 折光率:n20D 1.450 。稳定性:稳定。 1.4氯苯 中文名称:氯苯、一氯代苯。英文名称:chlorobenzene、monochlorobenzene CAS: 108-90-7 。分子式: C6H5Cl 。分子量: 112.56 。熔点(℃): -45.2 沸点(℃): 132.2 。相对密度(水=1): 1.10 。相对蒸气密度(空气=1): 3.9 饱和蒸气压(kPa): 1.33(20℃) 。临界温度(℃): 359.2 。临界压力(MPa): 4.52 辛醇/水分配系数的对数值: 2.84 。闪点(℃): 28。引燃温度(℃): 590 爆炸上限%(V/V): 9.6。爆炸下限%(V/V): 1.3 。外观与性状:无色透明液体,具有不愉快的苦杏仁味。 溶解性:不溶于水,溶于乙醇、乙醚、氯仿、二硫化碳、苯等多数有机溶剂。主要用途:作为有机合成的重要原料。
3,4-二羟基苯甲醛改性的UiO-66-NH2
毕业论文 论文题目(中文)3,4-二羟基苯甲醛改性的UiO-66-NH2 对U(VI)的吸附行为研究 论文题目(外文)Adsorption of U(VI) on 3,4-dihydroxy benzaldehyde modified UiO-66-NH2
3,4-二羟基苯甲醛改性的UiO-66-NH2对U(VI)的吸附性能 研究 摘要 本文通过在120℃条件下在DMF中回流用ZrCl4和2-氨基对苯二甲酸合成了金属-有机骨架化合物UiO-66-NH2,再在氮气保护下在乙醇中回流用3,4-二羟基苯甲醛对UiO-66-NH2进行了功能化修饰,获得了UiO-66-OHBA。通过红外光谱、元素分析以及X射线粉末衍射实验证明了3,4-二羟基苯甲醛成功修饰了UiO-66-NH2,且修饰后获得的UiO-66-OHBA骨架结构并未发生改变。以UiO-66-NH2和UiO-66-OHBA为吸附剂吸附U(VI)并研究了pH、固液比、反应温度、离子强度、平衡时间等对吸附行为的影响,并对结果进行了分析。 实验结果表明UiO-66-NH2和UiO-66-OHBA均对U(VI)表现出比较良好的吸附能力,并且经修饰后的吸附剂吸附性能得到了提升。pH值对吸附性能有较大影响,两者均在pH为4.5处吸附速率最大。温度对UiO-66-OHBA吸附性能的影响要小于UiO-66-NH2,它们的吸附模型与Freundlich等温吸附模型吻合良好。 关键词:MOFs;UiO-66-NH2;3,4-二羟基苯甲醛;吸附;铀酰
ADSORPTION OF U(VI) ON 3,4-DIHYDROXY BENZALDEHYDE MODIFIED UiO-66-NH2 Abstract Using ZrCl4and 2-aminoterephthalic acid,the metal-organic frameworks UiO-66-NH2was synthesized in refluxing DMF at 120℃.Then under the protection of nitrogen UiO-66-NH2 was functionally modified by 3,4-dihydroxy benzaldehyde in refluxing ethanol,yielding UiO-66-OHBA.The obtained samples were characterized by powder X-ray diffraction,FT-IR and elemental analysis,the results showed that the modification was successful.We studied how different pH value,solid-to-liquid ratio,ionic strength,temperature and time would influence the adsorption effect of uranyl from aqueous solution by UiO-66-NH2 and UiO-66-OHBA. According to the experiment,both UiO-66-NH2and UiO-66-OHBA had good adsorption capacity for U(VI),and the adsorption performance of UiO-66-OHBA was better than UiO-66-NH2.The pH value had a great influence on the adsorption performance,both of them reached the largest adsorption rate at ph 4.5.The effect of temperature on the adsorption capacity of UiO-66-OHBA was less than UiO-66-NH2,and the adsorption model was in good agreement with the Freundlich isotherm adsorption model. Key words: MOFs; UiO-66-NH2; 3,4-dihydroxy benzaldehyde;absorption;uranyl
羟基苯甲醛的精细合成工艺研究
羟基苯甲醛的精细合成工艺研究 通过对羟基苯甲醛的合成工艺研究,能够进一步的确定羟基苯甲醛的工艺条件。以工艺生产开展状况特点进行试验,能够对羟基苯甲醛中间产物生成以及整体工艺效果进行确认。本文对羟基苯甲醛的精细合成工艺进行研究。 标签:羟基苯甲醛;精细;合成工艺 对羟基苯甲醛的研究需要确认基本特点,能够根据化工生产的需求进一步的实现精细化合成效果的提升。对于羟基苯甲醛的研究是化工生产工艺水平提升的关键。 1羟基苯甲醛特点 羟基苯甲醛有3种异构体,即邻羟基苯甲醛、对羟基苯甲醛和间羟基苯甲醛,对羟基苯甲醛又名对甲醛苯酚。从水中析出者为白色至浅黄色针状结晶。有芳香气味。在常压下可升华而不分解。分子量122.12。熔点115~116℃。相对密度1.129 (130/4℃)。折射率1.5705(130℃)。微溶于水和苯,易溶于乙醇、乙醚、丙酮、乙酸乙酯,30.5℃时在水中的溶解度为1.38,65℃时在苯中的溶解度为3.68。小鼠腹腔注射LD50500mg/kg。对羟基苯甲醛是医药、香料、液晶的重要中间体,与硫酸二甲酯反应可制得茴香醛,与乙醛作用可制得对羟基肉桂醛,进一步氧化可制得肉桂酸,本品直接氧化可制对羟基苯甲酸,还原制对羟基苯甲醇等,均可用作香料;医药中间体;液晶原料;其他有机合成中间体,用途较广泛。间羟基苯甲醛除直接用作香料外,还用制作其他香料的中间体;医药原料,生产盐酸脱羟肾上腺素、肾上腺素、奎宁等;镀镍光亮剂;化学分析试剂(糖定量分析);照相乳剂及杀菌剂等。 邻羟基苯甲醛又称水杨醛,无色透明油状液体,有特殊气味及苦杏仁味,化学性质活泼,可发生取代、缩合、氧化、维提希(Wittig)反应等。与硫酸作用呈桔红色,与金属离子可形成有色螯合物。遇三氯化铁溶液显紫色。可被还原成水杨醇。主要用于生产香料“香豆素”及“二氢香豆素”的原料,配制紫罗兰香料,还可用作杀菌剂。 对羟基苯甲醛制备方法:由苯酚为原料,使氯仿与苯酚钠盐在60℃反应。或由苯酚与三氯乙醛在碳酸钾催化下缩合,再经甲醇钠分解。还可在三氯化铝催化剂下将干燥氯化氢通入苯酚与氢氰酸的混合液,反应后再在冰水中分解制取对羟基苯甲醛。 2实验室制备对羟基苯甲醛方法 以苯酚和三氯甲烷为原料,在碱性溶液中加热,进行Reimer-Tiemann反应,同时生成对羟基苯甲醛及少量水杨醛(邻羟基苯甲醛)。在50 mL烧瓶中加入e (2 g,8 mmo1)和a(o.94 g,8 mmo|),以及20 mL乙醇,滴加几滴哌啶,回
2_3_4_4_四羟基二苯甲酮合成研究
2,3,4,4’2四羟基二苯甲酮合成研究 王振宇,谭卫宁,周志纯,唐 浩 (湖南化工研究院,湖南长沙410007) 摘 要:以焦性没食子酸和对羟基苯甲酸为原料合成2,3,4,4’2四羟基二苯甲酮,通过正交实验对影响反应的因素进行考察,确定了优惠反应工艺条件,结果表明反应收率为83%,产品纯度达98%以上。 关键词:2,3,4,4’2四羟基二苯甲酮;焦性没食子酸;对羟基苯甲酸 中图分类号:TQ22412 文献标识码:A 文章编号:1009-9212(2002)01-0018-02 2,3,4,4’2四羟基二苯甲酮[1,2]是一种重要的有机中间体,可用于微电子集成电路工业的光致抗蚀剂、医药中间体、紫外线吸收剂、树脂稳定剂、染料等,它在微电子工业方面主要是用作紫外正性光刻胶的感光剂中间体[3~5],此种光刻胶微细加工的芯片线宽达013~018μm。目前,我国是世界上集成电路产业主要生产国之一,1999年大规模集成电路产量为21亿块,占全球产量的1/8,需i线紫外正性光刻胶100t/a,相应需要2,3,4,4’2四羟基二苯甲酮约5t/a。我国一些科研院所已开发出i线紫外正性光刻胶,其产业化技术已列入“九五”国家攻关。2, 3,4,4’2四羟基二苯甲酮的开发生产具有良好的市场前景。 2,3,4,4’2四羟基二苯甲酮的合成是经典的Friedel2Crafts酰基化反应。文献报道的2,3,4,4’2四羟基二苯甲酮合成方法主要有氯化锌催化酰化法[6,7]、树脂催化法[8]、三氟化硼催化法[1,9]等。笔者考察研究了三氟化硼催化法。 1 实验部分 111 实验主要原料及其规格 焦性没食子酸、对羟基苯甲酸、三氟化硼乙醚溶液、1,1,2,22四氯乙烷均为化学纯。 112 实验方法 将焦性没食子酸、对羟基苯甲酸与1,1,2,22四氯乙烷混合,缓慢滴加三氟化硼乙醚溶液,加料毕,升温反应一定时间,析出黄色结晶,冷却后,中和,结晶过滤,水洗后干燥,得黄色结晶产物,即为本产品。113 产品分析 仪器型号:美国SSI2P4000型(带可变波长检测器)二元高压梯度液相色谱仪,保留时间测量和峰面积计算均由American Hi2Tech色谱工作站完成。 色谱柱:PRODIGY ODS(3)Φ4.60×250mm (5μm);柱温:室温;流动相:甲醇∶水=60∶40(V/ V)(少量H3PO4,1%二甲基甲酰胺);流速:0.8ml/ min;检测波长:300nm 2 实验结果及讨论 211 探索实验 按上述的实验方法,进行探索实验,实验结果如表1所示: 表1 探索实验结果表 编号产品含量(%)收率(%) TB2198108015 TB2298148112 TB2399108019 TB2498128016 从表1可知,该工艺路线技术上可行,产品收率可达80%以上。 212 正交实验及验证实验 由探索实验发现,影响2,3,4,4’2四羟基二苯甲酮合成的主要因素包括原料配比、催化剂量、反应温度、反应时间等,按4因素3水平进行正交实验,考查上述反应因素对反应结果的影响,优化反应条件,实验结果见表2~表4。 由表4正交实验分析方法计算所得的极差值(R)可知,4种反应因素对反应收率的影响顺序为: A(原料配比)、B(催化剂量)、D(反应时间)、C(反应温度),其中A(原料配比)的极差最大,表明其对反 第32卷第1期2002年2月 精细化工中间体 FIN E CHEM ICAL IN TERM EDIA TS Vol.32No.1 February2002 作者简介:王振宇(1970~),女,湖南长沙人,助理研究员,主要从事精细化工中间体开发研究。收稿日期:2001-11-20
对羟基苯甲醛
R36/37/38Irritating to eyes, respiratory system and skin. 刺激眼睛、呼吸系统和皮肤 对羟基苯甲醛的性质 外观性状红棕色粉末 熔点114-118°C 沸点 191°C 50mm 密度 1,129 g/cm3 闪点 174°C 水溶性13 g/L (30°C) 溶解性易溶于乙醇;乙醚;丙酮;乙酸乙酯,稍溶于水(在30.5℃水中溶解度为1.388g/100ml),溶于苯(在65℃苯中溶解度为3.68g/ml)。
对羟基苯甲醛的用途 【用途一】用作医药、香料、农药的重要中间体,用于合成羟氨基苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品 【用途二】用作医药、香料、农药的重要中间体,用于合成羟氨苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品 【用途三】对羟基苯甲醛用于医药及有机合物的合成 【用途四】该品为医药、香料、液晶的中间体。对羟基苯甲醛用于生产抗菌增效剂TMP(甲氧苄氨嘧啶)、羟氨苄青霉素、羟氨苄头孢霉素、人造天麻、杜鹃素、苯扎贝特、艾司洛尔;用于生产香料茴香醛、香兰素、乙基香兰素、覆盆子酮。 【用途五】对羟基苯甲醛『123-08-0』在医药工业中,主要用合成羟氨苄青霉素(阿莫西林)、抗菌增效剂甲甲氧苄胺嘧啶(TMP)、3,4,5-三甲氧基甲醛、对羟基苯酐氨酸、羟氨苄头孢霉素、人造天麻、杜鹃素、艾司洛尔等;在香料工业中用于合成香兰素、乙基香兰素、洋茉莉醛、丁香醛、茴香醛和覆盆子酮等香料;在农药中主要用作除草剂溴苯腈和羟敌草腈的合成;在化工中主要用于合成对羟基苯甲酸、对羟基甲酸苄酯、醋酸对羟基苯酚酯;在国外还用于生产杀菌剂、照相乳化剂、镀镍光泽剂、液晶等. 【用途六】用作医药、香料、农药的重要中间体,用于合成羟氨基苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品。高分子聚合物和制药原料。 应用领域 用作医药、香料、农药的重要中间体,用于合成羟氨基苄青霉素、甲氧苄氨嘧啶、三甲氧基苯甲醛等药品
大分子量二苯甲酮光引发剂的合成及动力学研究
研究简报 大分子量二苯甲酮光引发剂的 合成及动力学研究 王 营1,肖 浦2,戴明之1,吴刚强2,史素青2,聂 俊1,2 (1.北京化工大学材料科学与工程学院北京市新型高分子材料制备与加工重点实验室,北京100029; 2.武汉大学化学与分子科学学院生物医用高分子教育部重点实验室,湖北武汉430072) 摘 要:以4 羟基二苯甲酮(HBP)、甲苯 2,4 二异氰酸酯(TDI)、4,4 二羟基二苯甲酮(DHBP)为原料,通过两步反应,合成了一种大分子量二苯甲酮光引发剂:HBP TDI DH BP TDI H BP (H TDTH).通过实时红外研究了HTDTH 的光聚合动力学.结果表明,HTDTH 是一种有效的光引发剂.采用H TDTH/胺光引发体系引发二缩三丙二醇二丙烯酸酯(T PGDA)聚合时,随着胺和引发剂浓度的增大,反应速率(R p )和单体最终转化率(P )同时增大. 关键词:光聚合;二苯甲酮衍生物/胺;动力学 文章编号:1674 0475(2008)04 0280 05 中图分类号:O64 文献标识码:A 紫外光固化是指在紫外光的作用下,其体系中的光引发剂通过光化学反应生成活性粒子或基团,从而引发体系中的活性树脂进行交联聚合.它具有固化速度快、操作简单、对环境污染小、能耗相对较少等优点.目前紫外光固化主要应用于清漆、纸张、木材、金属等领域[1 4] .光引发剂作为光固化体系中的关键组分,对光固化涂料的光固化速度起决定性作用.目前,光引发剂的一个发展趋势就是在原有小分子光引发剂的基础上,通过化学改性的方法合成出多官能团的大分子量光引发剂[5,6].这类光引发剂具有以下几个特点: (1)具有比较高的分子量,残存引发剂分子或其光解产物在固化涂层中不容易向表面慢性迁移;(2)这类光引发剂的光解碎片相对分子量较大、挥发性较低、气味较弱,其光固化产品有应用在卫生、食品包装材料上的潜力;(3)与单官能团的光引发剂相比,相同分子量情况下,它含有两种或两种以上的自由基. 二苯甲酮(BP)由于结构简单、合成容易、价格低廉、在常用溶剂中的溶解性比较好,收稿日期:2007 09 06;修回日期:2008 01 13.通讯联系人:聂 俊,T el:010 ********,E mail:niejun @mail. https://www.360docs.net/doc/cf15091636.html,. 基金项目:国家自然科学基金(50473024). 作者简介:王 营(1982 ),男,硕士研究生,主要从事光引发剂的合成及光聚合动力学性质的研究.280 第26卷 第4期 影像科学与光化学Vo l.26 N o.4 2008年7月Imaging Science and Photochemistry July,2008
2,4-二羟基苯甲醛
2,4-二羟基苯甲醛化学品安 全技术说明书 第一部分:化学品名称 化学品中文名称:2,4-二羟基苯甲醛 化学品英文名称:2,4-dihydroxybenzaldehyde 技术说明书编码:1758 CAS No.:1995-1-2 分子式:C7H6O3 分子量:138.12 健康危害:吸入、摄入或经皮肤吸收本品,对身体有害。本品对眼睛、皮肤、粘膜和上呼吸道有刺激作用。 燃爆危险:本品可燃,有毒,具刺激性。 第四部分:急救措施 皮肤接触:脱去污染的衣着,用流动清水冲洗。 眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。 吸入:脱离现场至空气新鲜处。如呼吸困难,给输氧。就医。 食入:饮足量温水,催吐。就医。第五部分:消防措施 危险特性:遇明火、高热可燃。 有害燃烧产物:一氧化碳、二氧化碳。 灭火方法:消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。 第六部分:泄漏应急处理 应急处理:隔离泄漏污染区,限制出入。切断火源。建议应急处理人员戴防尘面具(全面罩),穿防毒服。避免扬尘,小心扫起,置于袋中转移至安全场所。若大量泄漏,用塑料布、帆布覆盖。收集回收或运至废物处理场所处置。 第七部分:操作处置与储存 操作注意事项:密闭操作,局部排风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。避免产生粉尘。避免与氧化剂、碱类接触。在氮气中操作处置。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。
紫外线吸收剂常见类型
紫外线吸收剂常见类型 本品为一高效光稳定剂,具有广泛的紫外线吸收特性,挥发性低,适用于聚苯乙烯,聚甲基丙烯酸甲酯,聚酯,硬质聚氯乙烯,聚碳酸酯,ABS树脂等。在透明制品及高温加工的工程塑料中尤具效果。与抗氧剂并用有优质的协同效应,可提高制品的耐候性和热氧稳定性。 结构式: 分子量:323 化学文摘登记号:3147-75-9 外观:白色粉末 熔点:103-105℃ 纯度:≥99%(GC) 透光率:440nm,≥98% 500nm,≥99% 挥发份:≤0.3% 包装:1kg,5kg,25kg,50kg。 紫外线吸收剂 具有吸叫紫外线能力,用来防止塑料、涂料等长期暴露在日光下产生光降解作用的物质。 CAS No.:1843-05-6 紫外线吸收剂应该具备以下条件:①可强烈地吸收紫外线(尤其是波长为 290-400nm);②热稳定性好,即使在加工中也不会因热而变化,热挥发性小;③化学稳定性好,不与制品中材料组分发生不利反应;④混溶性好,可均匀地分散在材料中,不喷霜,不渗出;⑤吸收剂本身的光化学稳定性好,不分解,不变色;⑥无色、无毒、无臭;⑦耐浸洗;⑧价廉、易得。紫外线吸收剂按化学结构可分为以下几类:水杨酸酯类、苯酮类、苯并三唑类、取代丙烯腈类、三嗪类和其他类。 紫外线吸收剂用于塑料、涂料、染料、汽车挡风玻璃、化妆品、药物、防晒剂等。 以下是几种常见的紫外线吸收剂 商品名水杨酯苯酯 成分邻羟基苯甲酸苯酯 性能及用途无色结晶粉末。具有令人愉快的芳香气味(冬青油气味)。密度1.250g/cm3,溶点43,沸点(1.6kPa)173。易溶于乙醚、苯和氯仿,溶于乙醇,几乎不溶于水和甘油。含量99%。 本品为一种紫外线吸收剂,用于塑料制品,但吸收波长范围较窄。美国食品药物管理局批准用于接触食品的丙烯酸树脂用品。 包装及贮运纸桶内衬塑料袋包装。按一般化学品规定贮运。 商品名紫外线吸收剂UV-P 成分邻硝基苯胺、对甲苯酚的反应产物
对羟基苯乙酮的合成_鲍继明
对羟基苯乙酮的合成 鲍继明,戴淑昌 (安徽省淮南市生产力促进中心,安徽淮南 232001) 摘要:以苯酚和乙酐为原料,经过酯化反应和Fr ies 重排反应合成了对羟基苯乙酮,收率58.5%,纯度98.68%。 关 键 词:对羟基苯乙酮;苯酚;乙酐;酯化反应;F r ies 重排反应;合成中图分类号:O 622.4,O625.4 文献标识码:A 文章编号:1005-1511(2002)03-281-02 Synthesis of 4-Hydroxy -acetophenone BAO Ji-ming , DAI Shu-chang (A n Hui Huainan P ro ductiv ity Center ,Huainan 232001,China) Abstract :4-Hy drox y -acetophenone w as synthesized fr om phenol and acetic anhydride by es-terification and Fr ies rearrangement reactio ns w ith the yield of 58.5%(content 98.68%of 4-hy drox y -acetophenone). Keywords :4-hydrox y-acetophenone;phenol;acetic anhydride;esterification;Fries rear-r angemeng reactio n ;sy nthesis . 对羟基苯乙酮是重要的精细有机化学品之一。它作为有机合成的中间体,可用于香料的生产,它 还是一种利胆的药品,适用于胆囊炎和急、慢性黄胆型肝炎的辅助治疗。 本文以苯酚和乙酐为原料进行酯化反应生成乙酸苯酯,再在无水三氯化铝作用下进行Fries 重排反应[1] ,通过控制反应温度,使酰基移位到对位生成对羟基苯乙酮[2] 。 HO +O O O HO O O AlCl 3 HO O 反应在无溶剂存在时进行,合成的对羟基苯乙酮经中国药科大学检验,确认其含量达97.04%~98.68%。 1 实验1.1 试剂 苯酚、乙酐、NaOH,无水硫酸钠为市售分析纯试剂;无水三氯化铝、活性炭为工业品。1.2 合成 1.2.1 酯化反应 在烘干的装有回流冷凝器的单口烧瓶中依次加入苯酚400g (4.25mol),乙酐480g (4.70mo l),小心混合,缓慢加热至沸腾,回流3h 后冷却至室温。分出有机相,蒸馏水洗至近中性,无水硫酸钠干 燥后常压蒸馏收集190℃~196℃馏分得无色透明液体乙酸苯酯。 1.2.2 Fr ies 重排反应 在烘干的装有电动搅拌器、温度计和加料漏斗的三口烧瓶中加入乙酸苯酯100g (0.73mo l),剧烈搅拌下分数次缓慢加入无水三氯化铝120g (0.90mol ),加完后开始升温至反应温度反应3h ,停止 — 281— 合成化学 Chinese Journal of Sy nthetic Chemistr y 收稿日期:2002-02-04;修订日期:2002-03-12 作者简介:鲍继明(1947-),男,汉族,高级工程师,主要从事技术开发和科技信息研究。
防晒化妆品中15种紫外线吸收剂的检测
防晒化妆品中紫外线吸收剂的检测 防晒剂即紫吸收剂。它能吸收紫外线中可引起人产生急性皮炎(红斑)和皮肤灼伤的波长为280~320nn的中波紫外线(即U.V.B)和(或)可使皮肤变黑的波长32~400nn的长波紫紫外线(即U.V.A)。化妆品中紫外线吸收剂用量过多对皮肤有不利影响,因此,化妆品卫生标准规定了防晒剂的使用量(见附录1中的表5) -、对甲氧肉桂酸乙氧乙酯 高效液相色谱法(HPLC) 对甲氧肉桂酸乙氧乙酯:(4-甲氧肉桂酸-2-乙氧乙酯,C 14H 18 O 4 ,分子量250.29)是淡黄色透明的 粘稠性液体,266Pa时沸点为184~187℃;在水中溶解度为0.05%,在甘油中为0.5%,在丙二醇中约5%,能经任意比例与其它醇类、植物油相混合;吸收波长280~320nm,常作紫外吸收剂。我国化妆品卫生标准规定最大允许浓度为10%。 1 应用范围 本方法适用于化妆品中对甲氧肉桂酸乙氧乙酯的测定。 2 原理 样品中的对甲氧肉桂酸乙氧乙酯溶解于四氢呋喃等有机溶剂,有机溶剂提取后用高效液相色谱定性、定量。 3 试剂 3.1 四氦呋喃:色谱纯。(1) 3.2 乙腈。 3.3 对甲氧肉桂酸乙氧乙酯标准溶液:精确称取对甲氧肉桂酸乙氧酯0.5g,用少量四氢呋喃溶解,移入100.0ml容量瓶中并定容至刻度。移取10.0ml置于50.0ml容量瓶中,用四氢呋喃定容至刻度。此溶液1.00ml含1000?g对甲氧肉桂酸乙氧乙酯。 4 仪器 4.1 高效液相色谱仪:具紫外分光光度检测器 4.2超声波仪。 5 分析步骤 5.1 样品预处理
5.1.l 液体、乳液、膏霜(2):称取约0.1~2.0g(3)样品于50m1离心管中,加20m1四氢呋喃。用超声波充分溶解混匀后加四氢呋喃至50.0ml。溶液中有不溶物时离心分离。取上清液用。(4) 5.1.2 指甲油:称取约1.0g样品(3)于50ml离心管中,加15ml乙腈,搅拌均匀,加水至25.0ml,3000r/min离心10min,或用聚四氟乙烯滤膜过滤,取上清液备用。(4)(5) 5.2 色谱条件 色谱柱:碳十八结合硅胶(4.0mm id×250mm)。(6) 流动相:乙腈+水(6+4)。(7) 流速:1.0m1/min。 检测器波长:310nm。 5.3测定 5.3.1 定性 取标准溶液2.0ml,加四氢呋喃稀释至50.0m1,取5μl注入HPLC,求出保留时间,取样品溶液5?l 同样操作,以保留时间进行比较和定性。(8) 5.3.2 定量 移取标准溶液用四氢呋喃稀释,配制成1ml相当于0.0、20.0、40.0、60.0、80.0?g的标准系列,依次取5μl注入HPLC,绘制浓度-峰高(或峰面积)标准曲线。 取样品溶液5?l注入HPIC,记录峰高或峰面积,从标准曲线查出对应的对甲氧肉桂酸乙氧乙酯的含量A(μg/m1)。 6 计算 c=A×V/m×1/1000 式中:c一一对甲氧基肉桂酸乙酸乙酯含量,%; A一-由标准曲线查出的样液中对甲氧基肉桂酸乙氧乙酯含量,μg/ml; V-一样品溶液总体积,m1; m――样品质量,g。 注解: (1)四氢呋喃中常常加入抗氧化剂,必须采用色谱纯试剂。
对羟基苯甲醛的生产工艺及下游产品的开发
对羟基苯甲醛的生产工艺及下游产品的开发 来源:中国化工信息网 2007年7月3日 对羟基苯甲醛(PHB)分子式为C7H6O2,呈白色或浅黄色针状结晶,微溶于水,溶于甲醇、丙酮和苯等有机溶剂。是重要的有机化工原料,是精细化学品的重要中间体,广泛应用于医药、农药、香料等领域,其需求量呈不断增长趋势。 1 生产工艺 国内主要生产厂家有辽宁新民有机化工厂、南京晶美化学有限公司、安徽潜山药物化工厂、山东淄博大华化工公司、山东春光化工有限公司、盐城隆达公司农药厂、高邮市康乐精细化工厂、上海宝山月浦化工厂等十余家企业。对羟基苯甲醛合成路线较多,国内多采用苯酚-甲醛法,而国外则多采用空气氧化对甲酚法。目前国内对羟基苯甲醛与国外先进水平和国内精细化学品工业发展的要求尚存在较大差距,近年来虽然国内有多家企业计划采用对甲酚路线建设该项目,如大庆萨南实业有限公司、湖州市加成石油化工厂、嘉兴市华杰精细化工有限公司等数家企业。但是技术不甚成熟,尤其是对甲酚氧化产物分离技术不过关,导致产品质量较差,不能满足下游精细化学品对纯度的要求。下面介绍一下各种合成工艺的概况。 1.1 苯酚法 (1)苯酚-甲醛法 苯酚和液体氢氧化钠混和反应物形成钠盐,在50℃下慢慢加入甲醛,得到邻和对位的羟甲基苯酚;产物不需分离,在50℃下通入氧气,并加入苯酚质量分数5%的Pt/C催化剂和Bi2(SO4)3,反应1.5h后过滤催化剂,再经酸化、蒸馏得到PHB。以间硝基苯磺酸为催化剂时产率为55%左右,若以氟硼酸作催化剂,产率则可达80%以上。 该法对设备要求不高,合成路线较短,技术成熟,但产率和选择性高,环境污染比较严重,目前国内多采用该法生产。 (2)氯仿法(Reimer-Tiemann法) 在碱金属氢氧化物作用下,苯酚与氯仿反应生成邻羟基苯甲醛和PHB。将三氯甲烷加入苯酚碱溶液中,在80℃下反应4h,得到PHB和邻羟基苯甲醛,混合物经酸化、蒸馏、分离、纯化,得到PHB,收率50%左右。 该法原料价廉易得,但缺点是反应时间长、反应收率低,对羟基苯甲醛的选择性较低,一般对、邻位之比约为1:5,高者可达1:10。不过因其反应温度比较低,也容易控制,故国内目前主要采用此法生产水杨醛。近几年国外对该反应条件进行了改进,主要是从缩短反应时间,提高设备利用率等方面考虑。国外还对采用该法制备高选择性的PHB进行了研究,主要是在氢氧化钾存在下,通过加入α-或β-环状糊精作为催化剂,使PHB的选择性可达100%。 (3)苯酚与三氯乙醛法 在碳酸钾的催化下,苯酚与三氯乙醛缩合,得到的中间体经甲醇钠分解得到PHB。
