食品中细菌总数的测定

食品中细菌总数的测定方法
一、目的:
1.学习并掌握细菌的分离和活菌技术的原理和基本方法
2.了解菌落总数测定在对备件样品进行卫生学评价中的意义
二、原理:
菌落总数是指食品经过处理并在一定条件下培养后,所得1g或1 mL检验中所含细菌菌落的总数。菌落总数主要作为判别食品污染程度的标志,也可以应用这一方法观察细菌在食品中繁殖的动态过程,以便在对杯件样品进行卫生学评价是提供依据。
三、仪器:
超净工作台、电炉、培养箱、试管、10ml移液管、1ml移液管、洗耳球、试管架、锥形瓶、平皿
四、试剂:样品:酱油,无菌水,营养琼脂
五、实操过程:
1、溶解培养基:将固体培养基放在电炉上煮沸,然后冷却至41~ 43℃待用
2、取10ml移液管分别吸取9ml水放入3支试管中
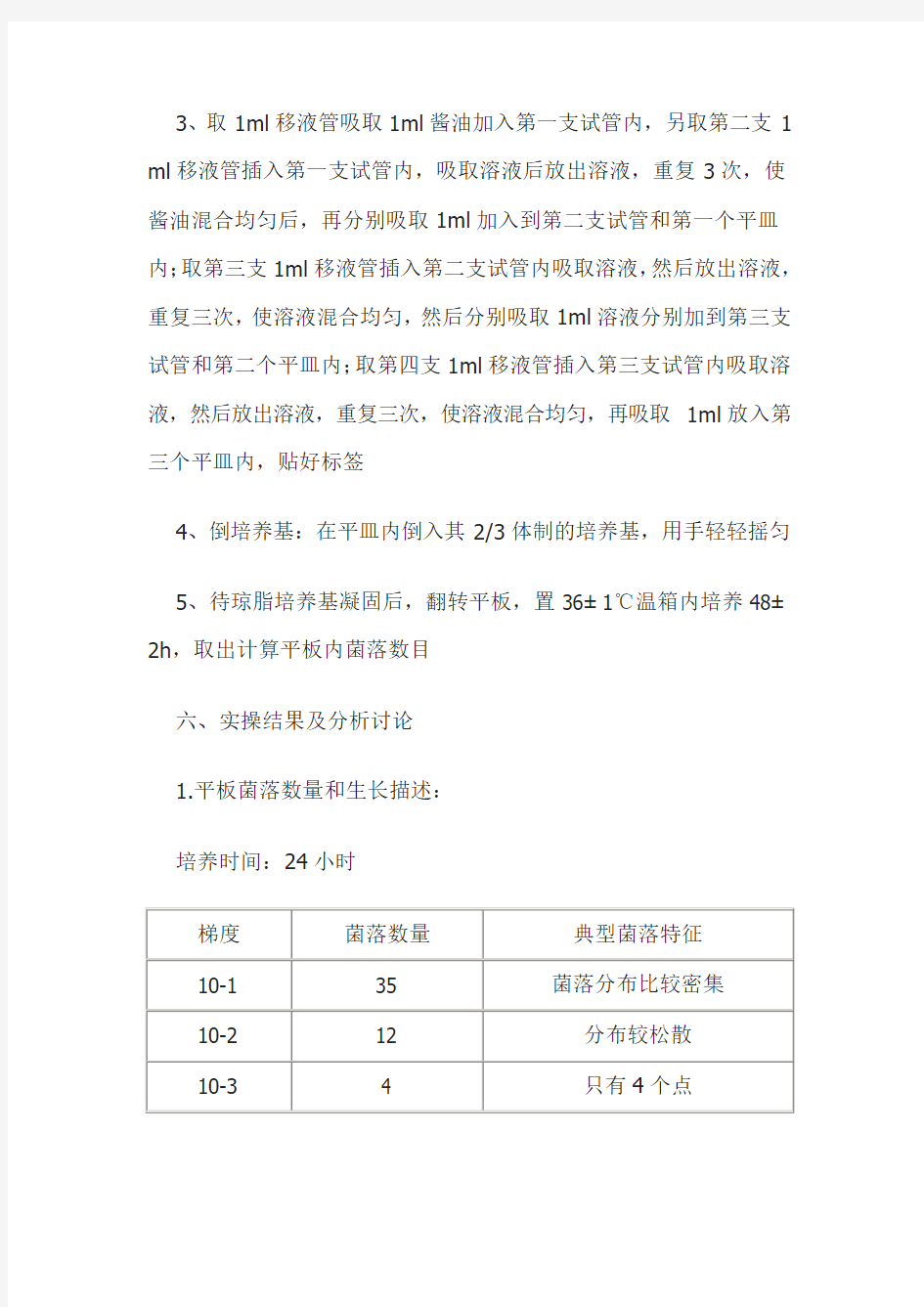
3、取1ml移液管吸取1ml酱油加入第一支试管内,另取第二支1 ml移液管插入第一支试管内,吸取溶液后放出溶液,重复3次,使酱油混合均匀后,再分别吸取1ml加入到第二支试管和第一个平皿内;取第三支1ml移液管插入第二支试管内吸取溶液,然后放出溶液,重复三次,使溶液混合均匀,然后分别吸取1ml溶液分别加到第三支试管和第二个平皿内;取第四支1ml移液管插入第三支试管内吸取溶液,然后放出溶液,重复三次,使溶液混合均匀,再吸取1ml放入第三个平皿内,贴好标签
4、倒培养基:在平皿内倒入其2/3体制的培养基,用手轻轻摇匀
5、待琼脂培养基凝固后,翻转平板,置36±1℃温箱内培养48±2h,取出计算平板内菌落数目
六、实操结果及分析讨论
1.平板菌落数量和生长描述:
培养时间:24小时
细菌总数的测定
细菌总数的测定 水与人类的生产活动和日常生活息息相关。经济建设的高速发展,往往会使生活用水的水源水受到水中有害有毒物质的污染;而生活污水、人、畜粪便会使甚或用水的水源水受到腐生性微生物的污染。被污染的水都不宜饮用。当水体中含大量的病原问生物是往往会引起传染病的发生,人体和动物体的肠道中大约有400多种细菌,虽然,其中的腐生菌进入水体不会引发人类的疾病,但随着粪便一起排除的致病菌,如霍乱弧菌、伤寒沙门氏菌、痢疾志贺氏菌、阿米巴虫、脊髓灰质炎病毒和传染性感染病毒等致病性微生物,则会引发人体的肠道传染病。为保护人体健康,防止因水源水污染而造成的疾病发生和流行,必须对生活用水及其水源水进行严格的水中细菌学检查。 测定水样是否合乎引用标准,一般包括:水中细菌总数测定和大肠菌群测定。本实验以自来水和天然水为水样进行细菌总数的测定 一、实验目的 (1)学习水样的采取和水样中细菌总数测定的方法 (2)了解和掌握平板菌落计数的原则 二、试验原理 水中的细菌数可反映出水体被有机物污染的程度。细菌总数越多,说明水中有机物的含量就越高,本试验应用平板菌落计数来测定水样中的细菌总数。由于水中细菌的种属不一,它们对营养成分和生长条件的要求差别很大,不可能设计出一种培养基在同一固定的条件下,能满足水中所有细菌的营养要求使其都能生长繁殖,形成菌落。然而,肠道中的绝大多数腐生性和致病性的细菌,可在营养丰富的牛肉膏蛋白胨培养基上进行生长,出现肉眼可见的菌落,虽然这样设计出来的水中细菌的总数实际上是一种近似值,但它基本上能代表水样中细菌的数量。故而水中的细菌总数的测定和计算是指:在牛肉膏蛋白胨琼脂培养基上,1ml水样,经37℃,24h培养后所生出来的总菌数(包括腐生和致病细菌),我国饮用水的 卫生学指标规定:在1ml自来水中细菌总数不得超过100个(1×102)。 三、试验材料和用具 (1)培养基牛肉膏蛋白胨琼脂培养基 (2)用具灭菌三角烧杯(体积为50ml或100ml),具玻塞的试剂瓶(体 积为250ml,需灭菌),灭菌培养基(Ф=9cm ),灭菌吸管或灭菌的 塑料吸嘴,稀释水样用无菌水(在Ф16mm×160mm试管中加9ml 蒸馏水,灭菌),酒精 四、试验方法 (1)以无菌操作、用10倍稀释法稀释水样。 (2)用平皿倾注制备待测水样平皿。 五、实验内容 1、水样的采取 (1)自来水先将自来水龙头用火焰(酒精灯火用长柄镊子夹酒精棉球)灼烧2-3min灭菌,再开启水龙头水水流出5min。以灭菌三角烧杯接取水样,待测(为节约用水,自来水龙头一次灭菌后,试验者依次采取水样)。 (2)池塘水、河水或湖水应取距水面10-15cm的深层水样。先将已灭菌具玻
菌落总数、大肠菌群测定方法
菌落总数和大肠菌群测定(固体样品) 药品: 1、平板计数琼脂 2、月桂基硫酸盐胰蛋白胨肉汤(LST) 3、煌绿乳糖胆盐肉汤(BGLB) 4、氯化钠 设备材料: 烧杯、三角瓶、广口瓶、培养皿、刻度吸管、倒气管、玻璃 棒、试管、硅胶塞、洗耳球、棉花、布或报纸等。 一、准备工作 (指导书是按一个样品所需物品准备的,实验室可按样品量增加) 1、平板计数琼脂培养基准备----用于菌落总数测定 将三角瓶放在电子称上,去皮,按平板计数琼脂使用说明称量,加 200ml蒸馏水搅拌,放电炉上煮沸加热煮沸,充分溶解,盖上硅胶塞,用报纸或布包好,再用橡皮筋扎紧。 2、月桂基硫酸盐胰蛋白胨(LST)肉汤----用于大肠菌群测定 (a)将烧杯放在电子称上,去皮,按使用说明称量,加100ml蒸馏水搅拌,放电炉上煮沸,充分溶解。 (b)用10ml(毫升)的吸管分装到9支(18*180规格)试管中,每支试管加10ml的月桂基溶液LST (合计90毫升)。 (c)9支试管分别放入倒气管(开口向下),排气,盖上硅胶塞。
3、0.85%的生理盐水----用于样品稀释 将广口瓶去皮,称取氯化钠1.91g加225ml蒸馏水,摇匀,用报纸 或布包好,再用橡皮筋扎紧;同样配制第二瓶。 4、准备2个空试管,盖上硅胶塞----用于样品稀释。 5、准备8个培养皿,用布包扎好。 6、准备至少3支5ml和1支10ml带有刻度的吸管,用布包扎好(顶部可用棉球塞住,防止吸液时,液体不慎吸入洗耳球)。 7、准备操作的工具:剪刀1把、镊子1个、勺子等打开产品包装所需工具,用布包扎好。 二、使用灭菌锅灭菌 1、检查灭菌锅底部加热管水位是否正常,水位要高过加热丝。 2、将上面准备好的7步骤物品逐一放入锅内,注意:滴定管吸口向下,有棉球的向上。 3、盖上火菌锅盖子时,将排气管插到排气口内,注意从对角线开始拧紧螺丝,将排气阀打开(安全阀始终关闭),通电后,待排气阀放气3分钟后(锅内冷空气已经排完),关闭排气阀。 4、查看灭菌锅的压力表,当温度升到121°,压力升到0.1MP(兆帕)时,灭菌维持15分钟后(温度和压力不能过高或者过低),断电自然冷却到接近“ 0”度后,慢慢打开排气阀,再对角拧开灭菌锅。 三、无菌操作 进无菌室前的准备:放好工具(酒精灯,记号笔,消毒用75%酒精棉球,洗耳球,电子称),打开紫外线杀菌灯,杀菌30分钟后关闭,再等
水中细菌总数的测定
水中细菌总数的检测 1.实验目的 1、学习并掌握水的细菌学检测方法 2、了解水质状况与细菌数量在饮用水检测中的重要性。 2.菌落总数standard plate-count bacteria 水样在营养琼脂上、有氧条件下37°C培养48 h后,所得1 mL水样所含菌落的总数。 细菌总数是评价水质污染程度的主要卫生指标,所测定的细菌总数增多说明水被生活废弃物污染。由于结果不能说明污染的来源,因此必须结合总大肠菌群数来判断污染源和安全程度。 3.培养基与试剂 营养琼脂成分 制法:根据实际需要量,按照上述配方称取各成分混合后,加热溶解,调整pH为~,分装于玻璃容器中(如用含有较多杂质的琼脂,应先过滤。),经 kPa(121°C,15 lb)湿热灭菌20 min,储存于冷暗处备用。 4.仪器和材料 4.1仪器:高压蒸汽灭菌器、干热灭菌箱、水热恒温培养箱、电炉、天平、冰箱。 4.2材料:灭菌平皿(直径9 cm)、灭菌试管、刻度吸管、三角烧瓶、采样瓶、酒精灯、消毒水、 镊子、试管架等。 4.3放大镜或菌落计数器、pH计或精密pH试纸、火柴或打火机。 5.样品采集 5.1自来水的取样:先将自来水龙头用酒精棉擦拭,再用酒精灯火焰灭菌,打开龙头放水3-5 min, 用无菌空三角瓶接取水样200 ml。 5.2纯净水取样:用消毒酒精棉擦拭纯水机出口后,先放走部分水,再用无菌空三角瓶接取水样 200毫升。 5.3地表水的取样:应取距水面10—15 cm的深层水样,先将灭菌的带玻璃塞瓶,瓶口向下浸入 水中,然后翻转过来,除去玻璃塞,水即流入瓶中,盛满后,将瓶塞盖好,再从水中取出,最好立即检查,否则需放入冰箱中保存。 6.检验步骤 6.1生活饮用水(自来水、纯净水):以无菌操作方法用灭菌吸管吸取1 mL充分混匀的水样,注 入灭菌培养皿中,倾注约15 ml已融化并冷却到45°C左右的营养琼脂培养基,并立即旋摇平皿,使水样与培养基充分混匀。每次检验时应做一平行接种,同时另用一个平皿只倾注培养基作为空白对照。 待冷却凝固后,翻转平皿,使底面向上,置于36°C±1°C条件下连续培养48 h,进行菌落计数,即为1 ml水样中的菌落总数。 6.2水源水:以无菌操作方法吸取1 ml充分混匀的水样,注入盛有9 ml灭菌生理盐水的试管中,
医院感染监控中常用的检测方法
医院感染监控中常用的检测方法 采样及检查原则:采样后必须尽快对标本进行相应指标的检测,送检时间不得超过6 h;若标本4 ℃保存时,送检时间可延长,但不得超过24 h。 1.医务人员手的微生物学监测 (1)采样时间:在接触患者或从事医疗活动前进行采样。 (2)采样面积及方法:被检人五指并拢,将浸有无菌9g/L氯化钠溶液的棉拭子一支在双手曲面从指根到指端来回涂擦各两次(一只手涂擦面积约30cm2),并随之转动采样棉拭子,剪去手接触部位,将棉拭子放入装有10ml采样液的试管内送检。采样面积按平方厘米cm2) 计算。 (3)细菌菌落总数检查:1ml采样液放入灭菌平皿内,用普通营养琼脂作倾注培养,放35℃温箱内培养24~48 h计数菌落。 手细菌菌落总数(cfu/ cm2)= 平板上菌落数×采样液稀释倍数30×2 (4)判断标准:见表6-3-1。 2.物体表面的微生物学监测 (1)采样时间:消毒处理后4 h内采样。 (2)采样面积:被采表面<100 cm2,取全部表面;被采表面≥100 cm2,取100 cm2。 (3)采样方法:用5cm×5 cm的标准灭菌规格板,放在被检物体表面,用浸有灭菌9g/L氯化钠溶液的棉拭子1支,在规格板内横竖
往返各涂抹5次,并随之转动棉拭子,连续采样式1~4个规格板面积,剪去手接触部分,将棉拭子入装10ml采样液的试管内送检。门把手等小型物体则采用棉拭子直接涂抹物体的方法采样。 (4)细菌菌落总数检查:1ml采样液放入灭菌平皿内,用普通营养琼脂作倾注培养,放35℃温箱内培养24~48 h计数菌落。 物体表面细菌菌落总数(cfu/ cm2)= 平板上菌落数×采样液稀释倍数 采样面积(cm2) (5)判断标准:见表6-3-1。 3.空气的微生物学监测 (1)采样时间:选择消毒处理后与进行医疗活动之前期间采样。(2)采样高度:与地面垂直高度80~150 cm。 (3)布点方法:室内面积≤30 m2,设一条对角线上取3点,即中心一点、两端各距墙1m处取一点;室内面积>30 m2,设东、西、南、北、中5点,其中东、西、南、北点均距墙1m。 (4)采样方法:用90mm直径普通营养琼脂平板在采样点暴露5~30 min后送检培养。 (5)细菌菌落总数检查:将平板置37℃温箱内培养24 h计数菌落。空气细菌菌落总数(cfu/ m3)= 50000NAT 式中:A—平板面积(cm2) T—平板暴露时间(min) N—平均菌落数(cfu/平板)
水中细菌总数的检测
水中细菌总数的检测 Revised by Jack on December 14,2020
水中细菌总数的检测 1.实验目的 1、学习并掌握水的细菌学检测方法 2、了解水质状况与细菌数量在饮用水检测中的重要性。 2.菌落总数standardplate-countbacteria 水样在营养琼脂上、有氧条件下37°C培养48h后,所得1mL水样所含菌落的总数。细菌总数是评价水质污染程度的主要卫生指标,所测定的细菌总数增多说明水被生活废弃物污染。由于结果不能说明污染的来源,因此必须结合总大肠菌群数来判断污染源和安全程度。 3.培养基与试剂 营养琼脂成分 制法:根据实际需要量,按照上述配方称取各成分混合后,加热溶解,调整pH为~,分装于玻璃容器中(如用含有较多杂质的琼脂,应先过滤。),经kPa(121° C,15lb)湿热灭菌20min,储存于冷暗处备用。 4.仪器和材料 仪器:高压蒸汽灭菌器、干热灭菌箱、水热恒温培养箱、电炉、天平、冰箱。材料:灭菌平皿(直径9cm)、灭菌试管、刻度吸管、三角烧瓶、采样瓶、酒精灯、消毒水、镊子、试管架等。放大镜或菌落计数器、pH计或精密pH试纸、火柴或打火机。 5.样品采集 自来水的取样:先将自来水龙头用酒精棉擦拭,再用酒精灯火焰灭菌,打开龙头放水3-5min,用无菌空三角瓶接取水样200ml。
纯净水取样:用消毒酒精棉擦拭纯水机出口后,先放走部分水,再用无菌空三角瓶接取水样200毫升。 地表水的取样:应取距水面10—15cm的深层水样,先将灭菌的带玻璃塞瓶,瓶口向下浸入水中,然后翻转过来,除去玻璃塞,水即流入瓶中,盛满后,将瓶塞盖好,再从水中取出,最好立即检查,否则需放入冰箱中保存。 6.检验步骤 生活饮用水(自来水、纯净水):以无菌操作方法用灭菌吸管吸取1mL充分混匀的水样,注入灭菌培养皿中,倾注约15ml已融化并冷却到45°C左右的营养琼脂培养基,并立即旋摇平皿,使水样与培养基充分混匀。每次检验时应做一平行接种,同时另用一个平皿只倾注培养基作为空白对照。 待冷却凝固后,翻转平皿,使底面向上,置于36°C±1°C条件下连续培养48h,进行菌落计数,即为1ml水样中的菌落总数。 水源水:以无菌操作方法吸取1ml充分混匀的水样,注入盛有9ml灭菌生理盐水的试管中,混匀呈1:10稀释液。 吸取1:10稀释液1ml,注入盛有9ml灭菌生理盐水的试管中,混匀呈1:100稀释液。按同法依次稀释成1:1000、1:10000稀释液备用。如此递增稀释一次,必须更换一支刻度吸管。 用灭菌吸管吸取1ml未稀释的水样和2~3个适宜稀释度的水样,分别注入灭菌培养皿内,其余操作同生活饮用水的检验步骤。 7.菌落计数及报告方法 作平皿菌落计数时,可用眼睛直接观察,必要时用放大镜检查以防遗漏。在记下各平皿的菌落数后,应求出同稀释度的平均菌落数,供下一步计算时应用。在求同稀释度的平
微生物总数检测方法(真菌)
微生物总数检测方法(真菌) 一、检测用培养基配方与培养条件 1.培养基:马铃薯葡萄糖琼脂(PDA培养基) 配制:以北京路桥PDA培养基为例,按说明上配制需称取培养基4克,加水100毫升。 2. 培养条件:25℃-30℃;时间:72-96小时。 二、检测与计数方法 1. 梯度稀释 称取适量的样品,加入带玻璃珠的三角瓶中,加入100mL的无菌水(无菌水中事先加入了分散剂3—5滴,分散剂可以是吐温,OP—80,用来分散菌团),用玻璃棒搅拌使之溶解吸水均匀后,上旋转式摇床200 r/min充分振荡60 min,,即成母液菌悬液(基础液)。 2. 用10mL无菌移液管分别吸取10mL上述母液菌悬液加入90 mL无菌水中,按1:10进行系列稀释,分别得到1:1×101,1:1×102,1:1×103,1:1×104……1:k稀释的菌悬液(每个稀释度应更换无菌移液管,每一个稀释度瓶种应放有适量的玻璃珠,以保证菌液分布均匀)。 3. 加样及培养 取1个适宜的稀释度,用移液枪吸取菌悬液0.1 mL,加至预先制备好的固体培养基平板上,用无菌玻璃涂布棒将菌悬液均匀地涂于琼脂表面。此稀释度重复3次,同时以空白作对照,于适宜的条件下培养。 4. 菌落识别 根据所检测菌种的技术资料,每个稀释度取不同类型的代表菌落通过涂片、染色、镜检等技术手段确认有效菌。当空白对照培养皿出现菌落数时,检测结果无效,应重做。 5. 菌落计数 以出现20—70个菌落数的稀释度的平板为计数标准,分别统计有效活菌数目和杂菌数目。 有效活菌数按式(1)计算,同时计算杂菌数: nm = x kv1/(m0v2) ×10-8或 nv = x kv1/(v0v2) ×10-8(1) 式中:
细菌的各种计数法
1、计数器测定法: 即用血细胞计数器进行计数。取一定体积的样品细胞悬液置于血细胞计数器的计数室内,用显微镜观察计数。由于计数室的容积是一定的(O.1mm3),因而根据计数器刻度内的细菌数,可计算样品中的含菌数。本法简便易行,可立即得出结果。 本法不仅适于细菌计数,也适用于酵母菌及霉菌孢子计数。 2、电子计数器计数法: 电子计数器的工作原理是测定小孔中液体的电阻变化,小孔仅能通过一个细胞,当一个细胞通过这个小孔时,电阻明显增加,形成一个脉冲,自动记录在电子记录装置上。 该法测定结果较准确,但它只识别颗粒大小,而不能区分是否为细菌。因此,要求菌悬液中不含任何碎片。 3、活细胞计数法 常用的有平板菌落计数法,是根据每个活的细菌能长出一个菌落的原理设计的。取一定容量的菌悬液,作一系列的倍比稀释,然后将定量的稀释液进行平板培养,根据培养出的菌落数,可算出培养物中的活菌数。此法灵敏度高,是一种检测污染活菌数的方法,也是目前国际上许多国家所采用的方法。使用该法应注意:①一般选取菌落数在30~300之间的平板进行计数,过多或过少均不准确;②为了防止菌落蔓延,影响计数,可在培养基中加入O.001%2,3,5一氯化三苯基四氮唑(TTC);③本法限用于形成菌落的微生物。 广泛应用于水、牛奶、食物、药品等各种材料的细菌检验,是最常用的活菌计数法。 4、比浊法 比浊法是根据菌悬液的透光量间接地测定细菌的数量。细菌悬浮液的浓度在一定范围内与透光度成反比,与光密度成正比,所以,可用光电比色计测定菌液,用光密度(OD值)表示样品菌液浓度。 此法简便快捷,但只能检测含有大量细菌的悬浮液,得出相对的细菌数目,对颜色太深的样品,不能用此法测定。 5、测定细胞重量法 此法分为湿重法和干重法。湿重法系单位体积培养物经离心后将湿菌体进行称重;干重法系单位体积培养物经离心后,以清水洗净放人干燥器加热烘干,使之失去水分然后称重。 此法适于菌体浓度较高的样品,是测定丝状真菌生长量的一种常用方法。 6、测定细胞总氮量或总碳量 氮、碳是细胞的主要成分,含量较稳定,测定氮、碳的含量可以推知细胞的质量。此法适于细胞浓度较高的样品。 7、颜色改变单位法(colour change unit,简称CCU) 这种方法通常用于很小,用一般的比浊法无法计数的微生物,比如支原体等,因为支原体的液体培养物是完全透明的,呈现为清亮透明红色,因此无法用比浊法来计数,由于支原体固体培养很困难,用cfu法也不容易计数,因此需要用特殊的计数方法,即CCU法。它是以微生物在培养基中的代谢活力为指标,来计数微生物的相对含量的,下面以解脲脲原体为例,简单介绍其操作: (1).取12只无菌试管,每一管装1.8ml解脲脲原体培养基。 (2).在第一管加入0.2ml待测解脲脲原体菌液,充分混匀,从中吸取0.2ml加入第二管,依次类推,10倍梯度稀释,一直到最末一管 (3).于37度培养,以培养基颜色改变的最末一管作为待测菌液的CCU,也就是支原体的最大代谢活力,比如第六管出现颜色改变,他的相对浓度就是10的6次方CCU/ml. 一般来说,比浊法和菌落计数法就可以满足绝大多数细菌的计数,但是对支原体这样比较特殊的微生物,用CCU法比较合适。
纯化水中需氧菌总数检测方法
纯化水微生物限度检测 计数方法适用性试验 1.供试液制备 根据供试品的理化特性与生物学特性,采取适宜的方法制备供试液。供试液制备若需加温时,应均勻加热,且温度不应超过45#C。供试液从制备至加人检验用培养基,不得超过1小时。 常用的供试液制备方法如下。如果下列供试液制备方法经确认均不适用,应建立其他适宜的方法。 (1)水溶性供试品取供试品,用PH7.0无菌氣化钠-蛋白胨缓冲液,或PH7.2磷酸盐缓冲液,或胰酪大豆胨液体培养基溶解或稀释制成1:10供试液。若需要,调节供试液pH值至6?8。必要时,用同一稀释液将供试液进一步1 0倍系列稀释。水溶性液体制剂也可用混合的供试品原液作为供试液。 2.接种和稀释 按下列要求进行供试液的接种和稀释,制备微生物回收试验用供试液。所加菌液的体积应不超过供试液体积的1%。为确认供试品中的微生物能被充分检出,首先应选择最低稀释级的供试液进行计数方法适用性试验。 (1)试验组取上述制备好的供试液,加入试验菌液,混勻,使每lm l供试液或每张滤膜所滤过的供试液中含菌量不大于100cfu。 (2 )供试品对照组取制备好的供试液,以稀释液代替菌液同试验组操作。 (3)菌液对照组取不含中和剂及灭活剂的相应稀释液替代供试液,按试验组操作加人试验菌液并进行微生物回收试验。若因供试品抗菌活性或溶解性较差的原因导致无法选择最低稀释级的供试液进行方法适用性试验时,应采用适宜的方法对供试%液进行进一步的处理。如果供试品对微生物生长的抑制作用无法以其他方法消除,供试液可经过中和、稀释或薄膜过滤处理后再加人试验菌悬液进行方法适用性试验。 供试品检查
检验量即一次试验所用的供试品量(g、m l或cm2)。 一般应随机抽取不少于2个最小包装的供试品,混合,取规定量供试品进行检验。除另有规定外,一般供试品的检验量为10g或10ml;膜剂为100cm2;贵重药品、微量包装药品的检验量可以酌减。检验时,应从2个以上最小包装单位中抽取供品,大蜜丸还不得少于4丸,膜剂还不得少于4片。 供试品的检査 按计数方法适用性试验确认的计数方法进行供试品中需氧菌总数、霉菌和酵母菌总数的测定。 胰酪大豆胨琼脂培养基或胰酪大豆胨液体培养基用于测定需氧菌总数;沙氏葡萄糖琼脂培养基用于测定霉菌和酵母菌总数。 阴性对照试验以稀释液代替供试液进行阴性对照试验,阴性对照试验应无菌生长,如果阴性对照有菌生长,应进行偏差调査。 1.平皿法 平皿法包括倾注法和涂布法。除另有规定外,取规定量供试品,按方法适用性试验确认的方法进行供试液制备和菌数测定,每稀释级每种培养基至少制备2个平板。 培养和计数除另有规定外,胰酪大豆胨琼脂培养基平板在30?35°C培养3?5天,沙氏葡萄糖琼脂培养基平板在20?25°C培养5?7天,观察菌落生长情况,点计平板上生长的所有菌落数,计数并报告。菌落蔓延生长成片的平板不宜计数。点计菌落数后,计算各稀释级供试液的平均菌落数,按菌数报告规则报告菌数。若同稀释级两个平板的菌落数平均值不小于15,则两个平板的菌落数不能相差1倍或以上。 菌数报告规则需氧菌总数测定宜选取平均菌落数小于300cfu的稀释级、霉菌和酵母菌总数测定宜选取平均菌落数小于lOOcfu的稀释级,作为菌数报告的依据。取最髙的平均菌落数,ij*算lg 、lm l或10cm2供试品中所含的微生物数,取两位4效数字报告。
细菌数量的测定方法
细菌数量的测定方法 1、计数器测定法: 即用血细胞计数器进行计数。取一定体积的样品细胞悬液置于血细胞计数器的计数室内,用显微镜观察计数。由于计数室的容积是一定的(O.1mm3),因而根据计数器刻度内的细菌数,可计算样品中的含菌数。本法简便易行,可立即得出结果。 本法不仅适于细菌计数,也适用于酵母菌及霉菌孢子计数。 2、电子计数器计数法: 电子计数器的工作原理是测定小孔中液体的电阻变化,小孔仅能通过一个细胞,当一个细胞通过这个小孔时,电阻明显增加,形成一个脉冲,自动记录在电子记录装置上。 该法测定结果较准确,但它只识别颗粒大小,而不能区分是否为细菌。因此,要求菌悬液中不含任何碎片。 3、活细胞计数法 常用的有平板菌落计数法,是根据每个活的细菌能长出一个菌落的原理设计的。取一定容量的菌悬液,作一系列的倍比稀释,然后将定量的稀释液进行平板培养,根据培养出的菌落数,可算出培养物中的活菌数。此法灵敏度高,是一种检测污染活菌数的方法,也是目前国际上许多国家所采用的方法。使用该法应注意:①一般选取菌落数在30~300之间的平板进行计数,过多或过少均不准确;②为了防止菌落蔓延,影响计数,可在培养基中加入O.001%2,3,5一氯化三苯基四氮唑(TTC);③本法限用于形成菌落的微生物。 广泛应用于水、牛奶、食物、药品等各种材料的细菌检验,是最常用的活菌计数法。 4、比浊法 比浊法是根据菌悬液的透光量间接地测定细菌的数量。细菌悬浮液的浓度在一定范围内与透光度成反比,与光密度成正比,所以,可用光电比色计测定菌液,用光密度(OD值)表示样品菌液浓度。 此法简便快捷,但只能检测含有大量细菌的悬浮液,得出相对的细菌数目,对颜色太深的样品,不能用此法测定。 5、测定细胞重量法 此法分为湿重法和干重法。湿重法系单位体积培养物经离心后将湿菌体进行称重;干重
菌落总数测定
菌落总数的测定 基础知识: 菌落是指细菌在固体培养基上生长繁殖而形成的能被肉眼识别的生长物,它是由数以万计相同的细菌集合而成。当样品被稀释到一定程度,与培养基混合,在一定培养条件下,每个能够生长繁殖的细菌细胞都可以在平板上形成一个可见的菌落。 菌落总数是指在一定条件下(如需氧情况、营养条件、pH、培养温度和时间等)每g(mL)检测样品所生长出来的细菌菌落总数。由于厌氧或微需氧菌、有特殊营养要求的以及非嗜中温的细菌,现有条件不能满足其生理需求,故难以繁殖生长。因此菌落总数并不表示实际其中的所有细菌总数,也不能区分其中细菌的种类,所以有时被称为杂菌数、需氧菌数等。 菌落总数测定是用来判定食品被细菌污染的程度及卫生质量,它反映食品在生长过程中是否符合卫生要求,以便对被检样品做出适当的卫生学评价,菌落总数的多少在一定程度上标志着食品卫生质量的优劣。中国国家标准是国内常用的检验方法。 菌落总数测定的卫生学意义: 食品本身的新鲜程度 加工、贮存运输过程中是否受到污染 卫生学指标:食品中菌落总数越多,则食品含有致病菌的可能性越大,食品质量越差;菌落总数越小,则食品含有致病菌的可能性越小。须配合大肠菌群和致病菌的检验,才能对食品做出较全 面的评价。 细菌在平板计数琼脂上的菌落特征蔓延菌在平板计数琼脂上的菌落特征方法来源:
GB 4789.2-2016 食品安全国家标准食品微生物学检验菌落总数测定 1、范围 本标准规定了食品中菌落总数(Aerobic plate count)的测定方法。 本标准适用于食品中菌落总数的测定。 2、术语和定义 菌落总数aerobic plate count 食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每g(mL)检样中形成的微生物菌落总数。 3、设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 3.1 恒温培养箱:36℃±1℃。 3.2 冰箱:2℃~5℃。 3.3 恒温水浴箱:46℃±1℃。 3.4 天平:感量为0.1g。 3.5 无菌袋。 3.6 无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)。 3.7 无菌培养皿:直径90mm。 3.8 放大镜或/和菌落计数器。 4、培养基和试剂 4.1 平板计数琼脂培养基 按照称取23.5g培养基溶于1000mL蒸馏水的比例进行配置,分装到锥形瓶,121℃高压灭菌15min。 4.2 0.85%无菌生理盐水 称取8.5g氯化钠溶于1000mL蒸馏水。一般用1000mL锥形瓶配置,称取6.8g的氯化钠,加入800mL蒸馏水,121℃高压灭菌15min。
食品中微生物细菌总数的测定
食品中微生物细菌总数的测定 一、实验目的 1学习并掌握细菌的分离和活菌计数的基本方法和原理; 2了解菌落总数测定在对被样品进行卫生学评价中的意义。 二、实验原理 菌落总数是指食品经过处理,在一定条件下培养后,所得1g或1ml检样中所含细菌菌落总数。菌落总数主要作为判别食品被污染程度的标志,也可以应用这一方法观察细菌在食品中繁殖的动态,以便对被检样品进行卫生学评价时提供依据。 菌落总数并不表示样品中实际存在的所有细菌总数,菌落总数并不能区分其中细菌的种类,所以有时被称为杂菌数,需氧菌数等。 三、器材 食品检样营养琼脂培养基无菌生理盐水无菌培养皿,无菌移液管酒精灯等。 四、实验步骤 1取样、稀释和培养 1.1以无菌操作取检样25g(或ml),放于225mL灭菌生理盐水的灭菌玻璃瓶内(瓶内预置适量的玻璃珠)或灭菌乳钵内,经充分振要或研磨制成1:10的均匀稀释液。固体检样在加入稀释液后,最好置灭菌均质器中以8000~10000r/min的速度处理1min,制成1:10的均匀稀释液。
1.2用1ml灭菌吸管吸取1:10稀释液1ml,沿管壁徐徐注入含有9ml 灭菌生理盐水的试管内,振摇试管混合均匀,制成1:100的稀释液。 1.3另取1ml灭菌吸管,按上项操作顺序,制10倍递增稀释液,如此每递增稀释一次即换用1支10ml吸管。 1.4根据标准要求或对污染情况的估计,选择2~3个适宜稀释度,分别在制作10倍递增稀释的同时,以吸取该稀释度的吸管移取1ml 稀释液于灭菌平皿中,每个稀释度做两个平皿。 1.5稀释液移入平皿后,将凉至46℃营养琼脂培养基注入平皿约 15ml,并转动平皿,混合均匀。同时将营养琼脂培养基倾入加有1ml 稀释液(不含样品)的灭菌平皿内作空白对照。 1.6待琼脂凝固后,翻转平板,置36±1℃温箱内培养48±2h,取出计算平板内菌落数目,乘以稀释倍数,即得每克(每毫升)样品所含菌落总数。 2菌落计数方法 作平皿菌落计数时,可用肉眼观察,必要时用放大镜检查,以防遗漏。在记下各平皿的菌落总数后,求出同稀释度的各平皿平均菌落数。到达规定培养时间,应立即计数。如果不能立即计数,应将平板放置于0-4℃,但不要超过24h。 3菌落计数报告方法 3.1平皿菌落数的选择 选取菌落数在30~300之间的平皿作为菌落总数测定标准。每一个稀释度应采用两个平皿平均数,其中一个平皿有较大片状菌落生长
水 中 细 菌 总 数 的 检 测
水中细菌总数的检测 一、实验的目的要求 1、学习并掌握水的细菌学检测方法 2、了解水质状况与细菌数量在饮用水检测中的重要性。 二、实验原理 细菌总数是指1ml水样在营养琼脂培养基中,于37℃经24h培养后,所生长的细菌菌落的总数。细菌总数是评价水质污染程度的主要卫生指标。我国现行的生活饮用水标准检验方法GB5750—85规定水样中细菌总数测定是1ml水样在普通营养琼脂培养基中37℃经24小时培养所生长的细菌菌落的总数。所测定的细菌总数增多说明水被生活废弃物污染,但不能说明污染的来源。因此必须结合总大肠菌群数来判断水污染的来源和安全程度。 本实验应用平板计数技术测定水中细菌总数。由于水中细菌种类繁多,它们对营养和其他生长条件的要求差别很大,不可能找到一种培养基在一种条件下,使水中所有的细菌均能生长繁殖,因此,以一定的培养基平板上生长出来的菌落,计算出来的水中细菌总数仅是一种近似值。目前一般是采用普通牛肉膏蛋白胨琼脂培养基。 平板菌落计数法的优点: 能测出样品中的活菌数。此法常用于某些成品和生物制品检定以及食品、水源的污染程度的检定等。 缺点:手续较繁,而且测定值常受各种因素的影响。 生活饮用水细菌卫生标准 我国饮用水卫生标准: ≤3个大肠菌群/1L饮水,≤100个细菌总数/1ml饮水
三、实验仪器和材料 1、高压蒸汽灭菌锅、恒温箱、冰箱、无菌接种间。 2、消毒酒精、消毒水。 3、试管、三角瓶、平皿、刻度吸管、涂布器等(实验前包扎灭菌处理好备用) 4、培养基 蛋白胨10g 牛肉膏3g 氯化钠5g 琼脂10~20g 蒸馏水1000ml 制备方法: 按照实际的需要量,按上述配方称取各成分混合后,加热溶解,调整pH 为7.4~7.6,,分装于玻璃容器中,用高压蒸汽灭菌锅121℃灭菌20min,倒制成平板后储存于冷处备用。 5、水样:自来水、中水。 四、实验内容: (一)、培养基的制备: 实验前事先准备好培养基平板(方法见上),每小组2-4个平板。(二)、取水样: 1、自来水的取样:先将自来水龙头用酒精棉擦拭,再用酒精灯火焰灭菌, 打开龙头放水1-2分钟,用无菌空三角瓶接取水样200毫升。 2、纯净水取样:用消毒酒精棉擦拭纯水机出口后,先放走部分水,再用
普通手术室常用细菌学监测方法
空气培养是通过空气菌落测定实现的,空气菌落测定可作为一种环境清洁的指标。 1人员着装要求: 检测者需要洗手戴口罩和帽子 2空气培养目的 检测手术部空气在静态下是否达到空气卫生学标准。 3采样时间 每月监测一次,在消毒处理后关好门窗,在无人走动的情况下,静止10min 进行采样。 4采样方法 检测者需要洗手带口罩和帽子,根据采样原理采用平板暴露法:在消毒处理后,操作前进行,室内面积≤30m2对角线内、中、外处设3点,内外点布位距墙壁1m处,室内面积>30m2设4角及中央5点,4角的布点部位距墙壁1m处。空气中细菌等微生物可随尘粒一起下降,在室内各采样点处放好营养琼脂平板,采样高度距地面0.8~1.5m,采样时,将平板盖打开搭在平皿边缘上,暴露5min,盖好平皿盖。 5注意事项 (1)布点位置要正确,严格按照房间面积、布点要求及采样方法进行操作。(2)采样后及时送检,48小时出结果。(可请护理服务中心送检,内线电话:542) (3)培养采样者应及时将结果取回,结果取回后如无异常应将检验报告单依次粘贴在A4纸上,并注明培养房间和培养日期做好完整记录,如有超标应及时通知护士长,并查找原因,复检。 6检测结果判断 空气培养标准值小于或等于200cfu/m3
1人员着装要求:检测者需要洗手戴口罩和帽子 2检测内容 (1)手术间的物体表面及可能有可能与患者接触的物体表面: 每月培养一次。包括治疗车、治疗台、无菌灯、输液架、手术间门把手、无菌器械台、麻醉机、吸引器瓶、麻醉床、手术间墙壁等。 (2)手卫生培养: 每月培养检测一次以同一台手术至少五人为一组,包括器械护士、手术医师,若一台手术人员不足五人,可两台手术合并5-6人做手培养。 (3)腔镜器械: 每月培养检测一次,培养项目3-5个,镜头、腔镜管道为每月必做项目,其余手术器械随机抽查 (4)无菌物品: 每月培养检测一次。包括一次性无菌物品及高压灭菌后的无菌物品。一次性无菌物品及高压灭菌后的无菌物品每月随机抽取至少3例,不得检出任何微生物。(5)植入性器械: 每月抽查一次骨科外来植入性器械包括钉子和钢板及专用器械。 2采样方法: (1)物体表面主要采用棉式子涂抹法。采用浸有含相应中和剂的无菌洗脱液的棉拭子,取出棉拭子,先在酒精灯外焰进行烧灼后,直接在物体表面按一定顺序滚动式涂抹,后将棉拭子入装有含相应中和剂的无菌洗脱液试管内,立即送检。(2)手部培养方法,被检测者须五指并拢,取出棉拭纸先在酒精灯外焰进行烧灼后以手掌到手指尖为平面S型滚动式涂抹,涂抹后将棉拭子入装有含相应中和剂的无菌洗脱液试管内,立即送检。 3注意事项: (1)培养不得检测出任何微生物。 (2)采样后及时送检,48小时出结果。 (3)结果出来后将检验报告单依次粘贴在A4纸上,并注明培养房间和培养日期做好完整记录。
食品中菌落总数的测定方法(参照材料)
食品中菌落总数的测定 一、实验目的 (1)学习和掌握测定食品中菌落总数的基本方法 (2)学会菌落总数的报告方式 二、实验材料 1、仪器与设备:恒温培养箱、托盘天平、电炉、吸管、三角瓶、平皿、试管、试管架、酒精灯、灭菌刀或剪刀、75%酒精棉球、玻璃蜡笔。 2、培养基和试剂:75%乙醇、0.85%生理盐水、琼脂培养基:胰蛋白胨5.0g、酵母浸膏2.5g、葡萄糖1.0g、 琼脂15.0g、蒸馏水1000mL、pH 7.0±0.2 3、检样:利乐包装鲜牛奶250ml 三、实验方法与步骤 1、检验程序 菌落总数检验程序: 检样→做成几个适当倍数的稀释液→选择2-3个适宜稀释度各以1ml之量分别入灭菌平皿内→每皿内加入46℃15-20ml营养琼脂→置36±1℃恒温箱内培养(48±2)h取出→菌落数→报告 2、检样稀释及培养 (1)以无菌操作,将检样包装打开,用吸管取25ml鲜牛奶,放于含有225ml灭菌生理盐水的500ml灭菌玻璃三角瓶内(瓶内预先置适当数量的玻璃珠),经充分振摇做成1:10的均匀稀释液。 (2)用1ml灭菌吸管吸取1:10稀释液1ml,沿管壁徐徐注入含有9ml灭菌生理盐水的试管内(注意吸管尖端不要触及管内稀释液,下同),振摇试管混合均匀,做成1:100的稀释液。 (3)另取1ml的灭菌吸管,按上项操作顺序作10倍递增稀释液,如此每递增稀释一次,即换用1支1ml灭菌吸管。 (4)根据食品卫生检验标准要求和检样的菌落数量,选择3个连续适宜稀释度即10、10-1、10-2,分别在作10倍递增稀释的同时,即以吸取该稀释度的吸管移1ml稀释液于灭菌平皿内,每个稀释度作两个平皿。(5)稀释液移入平皿后,应及时将凉至46℃营养琼脂培养基注入平皿15ml~20mL,并转动平皿使与稀释检样混合均匀,同时将营养琼脂培养基倾入加有1ml稀释液(不含样品)的灭菌平皿内作空白对照。 (6)等琼脂凝固后,翻转平板,置36±1℃恒温箱内培养(48±2)h取出,计算平板内菌落数目乘以倍数,即得1mL样品所含菌落总数。 四、检样中细菌菌落总数的计算与报告 1、菌落计算方法 (1)菌落计数方法 做平板菌落计数时,可用肉眼观查,必要时用放大镜检查,以防遗漏。在记下各平板的菌落数后,求出同稀释度的各平板平均菌落总数。 (2)菌落计数的报告 ①平板菌落数的选择 选取菌落数在30~300 CFU之间的平板作为菌落总数测定标准。一个稀释度使用两个平板,应采用两个平板平均数,
食品微生物检验中菌落总数测定的注意事项
食品微生物检验中菌落总数测定的注意事项 1菌落总数及测定 菌落是指细菌在固体培养基上生长繁殖而形成的能被肉眼识别 的生长物,它是由数以万计相同的细菌集合而成。当样品被稀释到一定程度,与培养基混合,在一定培养条件下,每个能够生长繁殖的细菌细胞都可以在平板上形成一个可见的菌落。 菌落总数就是指食品检样经过处理,在一定条件下(如需氧性质、培养基成分、pH、培养温度和时间等) 1 mL ( g)检样中所含菌落的总数。菌落总数测定是用来判定食品被细菌污染的程度、食品的新鲜度及卫生质量,它反映食品在生产、加工、销售过程中是否符合卫生要求, 以便对被检样品做出适当的卫生学评价。也可以应用这一方法观察食品中细菌的性质以及细菌在食品中繁殖的动态,菌落总数的多少在一定程度上标志着食品卫生质量的优劣[ 1 ] 。 2菌落总数测定中的注意事项 2. 1 所用器皿及稀释液 2. 1. 1 检验中所用玻璃器皿,如培养皿,吸管、试管、移液器的吸头等必须是完全灭菌的,并在灭菌前彻底洗涤干净,不得残留有抑菌 物质。 2. 1. 2 用作样品稀释的液体,每批都要有空白对照。如果在琼脂对照平板上出现几个菌落时,要查找原因,如可通过追加对照平板,以判定是空白稀释液,用于倾注平皿的培养基,还是平皿、吸管或空气可能存在的污染。
2. 1. 3 检样的稀释液一般用灭菌盐水,如果对含盐量较高的食品(如酱品等)进行稀释,则宜用蒸 馏水。做醋时用20% ~ 30%碳酸钠调pH 至中性。 2. 2 检样的稀释 2. 2. 1 检样稀释时,应以无菌操作称取(或量取)有代表性的样品25 g (或mL ) , 剪碎放于含有225 mL灭菌稀释液的玻璃瓶内(瓶内预置适当数量的玻璃珠) ,经充分振摇作成1: 10 的稀释液。如系肉、鱼等固体样品,先用自来水把表面冲洗干净,取可食部分(即鱼肉)剪细 加入稀释液后,置均质器中以8 000 ~ 10 000 r /min 速度处理1 min,使做成均匀的1: 10稀释液。 2. 2. 2 根据食品卫生标准要求或对标本污染情况的估计,将上述1: 10的检样稀释液再做成几个适当的10 倍递增稀释液,每递增稀释一次,必须另换1 支1 mL 灭菌吸管或吸头,这样所得检样的稀释倍数方为准确。 2. 2. 3 从吸管筒内取出灭菌吸管时,不要将吸管尖端触及其他仍留在容器内的吸管的外露部分;而且吸管在进出装有稀释液的玻璃瓶和试管时,也不要触及瓶口及试管口的外侧部分;因为这些部分都可能 接触过手或其他沾污物。当用吸管将检样稀释液加至另一装有9 mL 稀释液的试管内时,应小心沿管壁加入,不要触及管内稀释液,以防吸管尖端外侧部分黏附的检液也混入其中。 2. 2. 4 对吸管体积的要求是取1 mL的样品匀液使用的吸管的最小刻度应该不低于
水中细菌总数的检测
水中细菌总数的检测 1. 实验目的 1、学习并掌握水的细菌学检测方法 2、了解水质状况与细菌数量在饮用水检测中的重要性。 2. 菌落总数standard plate-count bacteria 水样在营养琼脂上、有氧条件下37°C培养48 h后,所得1 mL水样所含菌落的总数。细菌总数是评价水质污染程度的主要卫生指标,所测定的细菌总数增多说明水被生活废弃物污染。由于结果不能说明污染的来源,因此必须结合总大肠菌群数来判断污染源和安全程度。 3. 培养基与试剂 2.1 营养琼脂成分 2.2 制法:根据实际需要量,按照上述配方称取各成分混合后,加热溶解,调整pH为7.4~7.6,分装于玻璃容器中(如用含有较多杂质的琼脂,应先过滤。),经10 3.43 kPa(121°C,15 lb)湿热灭菌20 min,储存于冷暗处备用。 4. 仪器和材料 仪器:高压蒸汽灭菌器、干热灭菌箱、水热恒温培养箱、电炉、天平、冰箱。材料:灭菌平皿(直径9 cm)、灭菌试管、刻度吸管、三角烧瓶、采样瓶、酒精灯、消毒水、镊子、试管架等。放大镜或菌落计数器、pH计或精密pH试纸、火柴或打火机。 5. 样品采集 自来水的取样:先将自来水龙头用酒精棉擦拭,再用酒精灯火焰灭菌,打开龙头放水3-5 min,用无菌空三角瓶接取水样200 ml。 纯净水取样:用消毒酒精棉擦拭纯水机出口后,先放走部分水,再用无菌空三角瓶接取水样200毫升。 地表水的取样:应取距水面10—15 cm的深层水样,先将灭菌的带玻璃塞瓶,瓶口向下浸入水中,然后翻转过来,除去玻璃塞,水即流入瓶中,盛满后,将瓶塞盖好,再从水中取出,最好立即检查,否则需放入冰箱中保存。 6. 检验步骤 生活饮用水(自来水、纯净水):以无菌操作方法用灭菌吸管吸取1 mL充分混匀的水样,注入灭菌培养皿中,倾注约15 ml已融化并冷却到45°C左右的营养琼脂培养基,并立即旋摇平皿,使水样与培养基充分混匀。每次检验时应做一平行接种,同时另用一个平皿只倾注培养基作为空白对照。 待冷却凝固后,翻转平皿,使底面向上,置于36°C±1°C条件下连续培养48 h,进行菌落计数,即为1 ml水样中的菌落总数。 水源水:以无菌操作方法吸取1 ml充分混匀的水样,注入盛有9 ml灭菌生理盐水的试管中,混匀呈1:10稀释液。 吸取1:10稀释液1 ml,注入盛有9 ml灭菌生理盐水的试管中,混匀呈1:100稀释液。按同法依次稀释成1:1000、1:10000稀释液备用。如此递增稀释一次,必须更换一支刻度吸管。用灭菌吸管吸取1 ml未稀释的水样和2~3个适宜稀释度的水样,分别注入灭菌培养皿内,
细菌耐药性检测方法
细菌耐药性检测方法 1、细菌耐药表型检测:判断细菌对抗菌药物的耐药性可根据NCCLS标准,通过测量纸片扩散法、肉汤稀释法和E试验的抑菌圈直径、MIC值和IC值获得。也可通过以下方法进行检测: (1)耐药筛选试验:以单一药物的单一浓度检测细菌的耐药性被称为耐药筛选试验,临床上常用于筛选耐甲氧西林葡萄球菌、万古霉素中介的葡萄球菌、耐万古霉素肠球菌及氨基糖苷类高水平耐药的肠球菌等。 (2)折点敏感试验:仅用特定的抗菌药物浓度(敏感、中介或耐药折点MIC),而不使用测定MIC时所用的系列对倍稀释抗生素浓度测试细菌对抗菌药物的敏感性,称为折点敏感试验。 (3)双纸片协同试验:双纸片协同试验是主要用于筛选产超广谱β-内酰胺酶(ESBLs)革兰阴性杆菌的纸片琼脂扩散试验。若指示药敏纸片在朝向阿莫西林/克拉维酸方向有抑菌圈扩大现象(协同),说明测试菌产生超广谱β-内酰胺酶 (4)药敏试验的仪器化和自动化:全自动细菌鉴定及药敏分析仪如:Vitek-2、BD-Pheonix、Microscan等运用折点敏感试验的原理可半定量测定抗菌药物的MIC值。 2.β-内酰胺酶检测:主要有碘淀粉测定法(iodometric test)和头孢硝噻吩纸片法(nitrocefin test)。临床常用头孢硝噻吩纸片法,β-内酰胺酶试验可快速检测流感嗜血杆菌、淋病奈瑟菌、卡他莫拉菌和肠球菌对青霉素的耐药性。如β-内酰胺酶阳性,表示上述细菌对青霉素、氨苄西林、阿莫西林耐药;表示葡萄球菌和肠球菌对青霉素(包括氨基、羧基和脲基青霉素)耐药。 3.耐药基因检测:临床可检测的耐药基因主要有:葡萄球菌与甲氧西林耐药有关的MecA 基因,大肠埃希菌与β-内酰胺类耐药有关的blaTEM、blaSHV、blaOXA基因,肠球菌与万古霉素耐药有关的vanA、vanB、vanC、vanD基因。检测抗菌药物耐药基因的方法主要有:PCR扩增、PCR-RFLP分析、PCR-SSCP 分析、PCR-线性探针分析、生物芯片技术、自动DNA 测序 4.特殊耐药菌检测 (1)耐甲氧西林葡萄球菌检测:对 1цg苯唑西林纸片的抑菌圈直径≤10㎜,或其MIC≥4цg/ml的金黄色葡萄球菌和对1цg苯唑西林纸片的抑菌圈直径≤17㎜,或MIC≥0.5цg/ml 的凝固酶阴性葡萄球菌被称为耐甲氧西林葡萄球菌(MRS)。对MRS不论其体外药敏试验结果,所有的β-内酰胺类药物和β-内酰胺/β-内酰胺酶抑制剂均显示临床无效;绝大多数的MRS 常为多重耐药,耐药范围包括氨基糖甙类、大环内酯类、四环素类等。 (2)耐青霉素肺炎链球菌检测:当对1цg苯唑西林纸片抑菌圈直径〈20㎜或MIC〉0.06цg/ml均应视为耐青霉素肺炎链球菌(PRSP)。临床治疗显示 PRSP对氨卞西林、氨卞西林/舒巴坦、头胞克肟、头胞唑肟,临床治疗疗效很差,但应检测对头胞曲松、头胞噻肟和美洛培南等的MIC以判断是否对这些抗生素敏感。 (3)耐万古霉素肠球菌检测:肠球菌对30цg万古霉素纸片抑菌圈直径≤14㎜或MIC≥32цg/ml被称为耐万古霉素肠球菌(VRE)。针对多重万古霉素药物目前尚无有效治疗方法,但对青霉素敏感的VRE可用青霉素和庆大霉素联合治疗,若对青霉素耐药而不是高水平耐氨基糖甙类可用壁霉素+庆大霉素。 (4)产超广谱β-内酰胺酶的肠杆菌科细菌检测:超广谱β-内酰胺酶是一种能水解青霉素、
