大肠菌群检验原始记录(平板计数法)
精品文档
.
XX公司
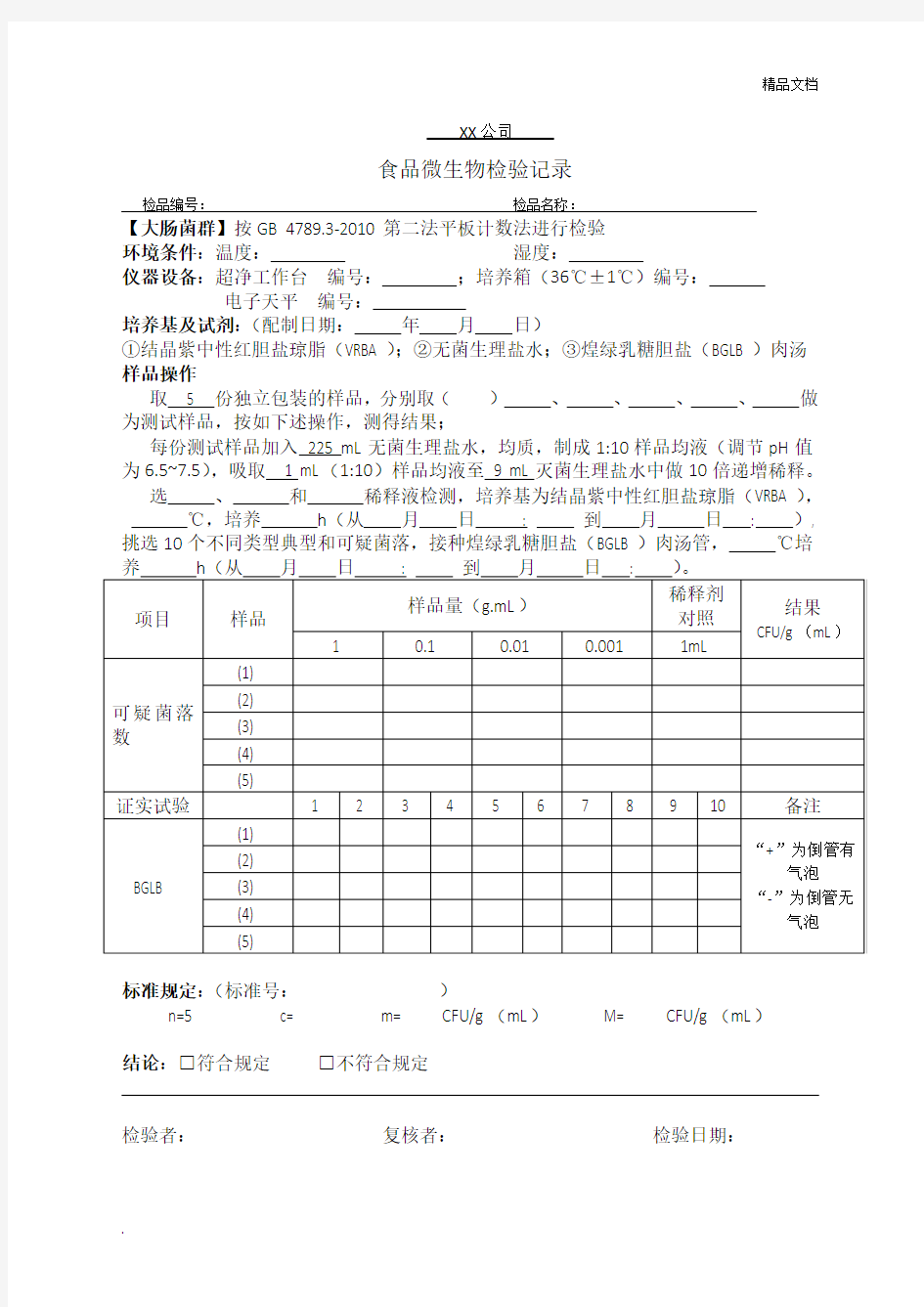
食品微生物检验记录检品编号:检品名称:
【大肠菌群】按GB 4789.3-2010第二法平板计数法进行检验
环境条件:温度:湿度:
仪器设备:超净工作台编号:;培养箱(36℃±1℃)编号:
电子天平编号:
培养基及试剂:(配制日期:年月日)
①结晶紫中性红胆盐琼脂(VRBA);②无菌生理盐水;③煌绿乳糖胆盐(BGLB)肉汤样品操作
取 5 份独立包装的样品,分别取()、、、、做为测试样品,按如下述操作,测得结果;
每份测试样品加入225 mL无菌生理盐水,均质,制成1:10样品均液(调节pH值为6.5~7.5),吸取 1 mL(1:10)样品均液至9 mL灭菌生理盐水中做10倍递增稀释。
选、和稀释液检测,培养基为结晶紫中性红胆盐琼脂(VRBA),℃,培养h(从月日: 到月日: ), 挑选10个不同类型典型和可疑菌落,接种煌绿乳糖胆盐(BGLB)肉汤管,℃培
标准规定:(标准号:)
n=5 c= m= CFU/g(mL)M= CFU/g(mL)
结论:□符合规定□不符合规定
检验者:复核者:检验日期:
菌落总数、大肠菌群测定方法
菌落总数和大肠菌群测定(固体样品) 药品: 1、平板计数琼脂 2、月桂基硫酸盐胰蛋白胨肉汤(LST) 3、煌绿乳糖胆盐肉汤(BGLB) 4、氯化钠 设备材料: 烧杯、三角瓶、广口瓶、培养皿、刻度吸管、倒气管、玻璃 棒、试管、硅胶塞、洗耳球、棉花、布或报纸等。 一、准备工作 (指导书是按一个样品所需物品准备的,实验室可按样品量增加) 1、平板计数琼脂培养基准备----用于菌落总数测定 将三角瓶放在电子称上,去皮,按平板计数琼脂使用说明称量,加 200ml蒸馏水搅拌,放电炉上煮沸加热煮沸,充分溶解,盖上硅胶塞,用报纸或布包好,再用橡皮筋扎紧。 2、月桂基硫酸盐胰蛋白胨(LST)肉汤----用于大肠菌群测定 (a)将烧杯放在电子称上,去皮,按使用说明称量,加100ml蒸馏水搅拌,放电炉上煮沸,充分溶解。 (b)用10ml(毫升)的吸管分装到9支(18*180规格)试管中,每支试管加10ml的月桂基溶液LST (合计90毫升)。 (c)9支试管分别放入倒气管(开口向下),排气,盖上硅胶塞。
3、0.85%的生理盐水----用于样品稀释 将广口瓶去皮,称取氯化钠1.91g加225ml蒸馏水,摇匀,用报纸 或布包好,再用橡皮筋扎紧;同样配制第二瓶。 4、准备2个空试管,盖上硅胶塞----用于样品稀释。 5、准备8个培养皿,用布包扎好。 6、准备至少3支5ml和1支10ml带有刻度的吸管,用布包扎好(顶部可用棉球塞住,防止吸液时,液体不慎吸入洗耳球)。 7、准备操作的工具:剪刀1把、镊子1个、勺子等打开产品包装所需工具,用布包扎好。 二、使用灭菌锅灭菌 1、检查灭菌锅底部加热管水位是否正常,水位要高过加热丝。 2、将上面准备好的7步骤物品逐一放入锅内,注意:滴定管吸口向下,有棉球的向上。 3、盖上火菌锅盖子时,将排气管插到排气口内,注意从对角线开始拧紧螺丝,将排气阀打开(安全阀始终关闭),通电后,待排气阀放气3分钟后(锅内冷空气已经排完),关闭排气阀。 4、查看灭菌锅的压力表,当温度升到121°,压力升到0.1MP(兆帕)时,灭菌维持15分钟后(温度和压力不能过高或者过低),断电自然冷却到接近“ 0”度后,慢慢打开排气阀,再对角拧开灭菌锅。 三、无菌操作 进无菌室前的准备:放好工具(酒精灯,记号笔,消毒用75%酒精棉球,洗耳球,电子称),打开紫外线杀菌灯,杀菌30分钟后关闭,再等
大肠菌群平板计数法的注意事项
大肠菌群是经常用来衡量食品卫生情况的重要指标,绝大部分食品都会要 求检测的项目。在食品微生物实验室里,大肠菌群和菌落总数的检测频次应该是最高的,但检测过程中总会有一些小问题困扰着大家,以下来讲解一下大肠 菌群平板计数法的注意事项。 方法选择 相比于MPN计数法,平板计数法更适用于大肠菌群含量较高的食品。但大肠菌群多少算是含量较高呢国标里没有明确规定,但通常认为,产品大肠菌群以100CFU/g(mL)为界,超过这个含量一般认为是含量较高。但具体什么时候选用平板计数法进行大肠菌群的检测,大部分情况还是要看你的产品执行的标准。假如产品标准要求大肠菌群含量的单位为CFU/g(mL),那必须选用平板计数法。若是/g(mL)或者MPN/100g(mL),就应选择MPN计数法,MPN法具体选用哪版国标 此处不再赘述。因此,根据自己产品的情况选择适当的检测方法。 培养基的要求 平板计数法使用的培养基为结晶紫中性胆盐琼脂培养基,简称VRBA。无论是国标,还是培养基的使用说明中都明确表示,VRBA是不需要进行灭菌的,煮沸2min即可使用。特地点出这一点是因为很多朋友都在问VRBA的灭菌条件,对不灭菌的培养基不信任,害怕出现检测异常,那是因为这些小伙伴们对其中的原理不清楚。大肠菌群的定义是在一定培养条件下能够在发酵乳糖、产酸产气的需氧和兼性厌氧的革兰氏阴性无芽孢杆菌,因此大肠菌群是不能形成芽孢的,在VRBA培养基煮沸的过程中,即使有大肠菌群存在也会被杀灭,所以从培养基带入污染的可能性是没有的。当然盛装培养基的容器是需要进行灭菌的,以免容器引入污染。另外,VRBA是一种选择性的培养基,含有的结晶紫对革兰氏阳性菌有比较强的抑制作用而对革兰氏阴性菌几乎没有作用,而且平板培养产生的菌落还需要进行复发酵的验证,因此VRBA培养基就不需要进行灭菌了。但值得注意 的是,VRBA需要现配现用,配制出的培养基应当在3h之内使用完毕。 稀释度的确定 国标中要求选择2-3个适宜的连续稀释度。什么样的稀释度是合适的呢这要根据计数来决定。计数环节要求选择菌落数在15CFU-150CFU的平板进行计数,
环境监测原始记录表
环境监测原始记录表 环境保护监测中心站 2012年
目录 1. 地表水采样原始记录表19.离子选择电极原始记录表 2. 大气采样原始记录表20.分光光度法分析原始记录表 3. 降水采样原始记录表21.原子吸收分光光度法分析原始记录表 4. 降尘采样原始记录表22.气相色谱分析原始记录表 5. 土壤采样原始记录表23.离子色谱分析原始记录表 6. 底质(底泥、沉积物)采样原始记录表24.细菌总数测定原始记录表 7. 污染源废水采样原始记录表25.粪大肠菌群测定原始记录表 8. 固定污染源排气中气态污染物采样原始记录表26.区域环境噪声监测原始记录表 9. 固定污染源排气中颗粒物采样原始记录表27.城市交通噪声监测原始记录表 10.烟气烟色监测现场记录表28.污染源噪声监测原始记录表 11.pH值分析原始记录表29.机动车排气路检原始记录表 12.电导率分析原始记录表30.一般试剂配制原始记录表 13.色度分析原始记录表(铂钴比色法)31.校准曲线配制原始记录表 14.色度分析原始记录表(稀释倍数法)32.标准溶液配制与标定原始记录表 15.重量分析原始记录表33.样品交接记录表 16.容量法分析原始记录表34.样品分析任务表 17.五日生化需氧量分析原始记录表35.样品前处理原始记录表 18.一氧化碳分析原始记录表36.大气采样器流量校准原始记录表
xx 省环境监测原始记录表( 1 ) 地表水采样原始记录表 采样目的: 方法依据:GB12998-91 采样日期: 年 月 日 枯 丰 平 pH 计型号及编号: DO 仪型号及编号: 电导仪型号及编号: 采样: 送样: 接样: .第 页 共 页
SN出口食品中大肠菌群粪大肠菌群和大肠杆菌检验方法
SN0169-92代替ZBX09002一88 Methodforexaminationofcoliform,fecalcoliformandescherichiacoliinfoodforexport 1、主题内容与适用范围 本标准规定了出口食品中大肠菌群、粪大肠菌群和大肠杆菌的检验方法。 本标准适用于出口食品的检验。 2、设备和材料 2.1 吸管:1mL,具0.1mL刻度;5mL和10mL,具1mL刻度。 2.2 水浴箱:44.5±0.5℃。 2.3 培养箱:36±1℃,44.5±0.5℃。 2.4 冰箱:0~5℃和-15~-20℃。 2.5 均质器。 2.6 乳钵和研棒。 2.7 平皿:直径90mm。 2.8 天平:感量0.1g。 2.9 显微镜。 2.10稀释瓶:100mL、200mL和500mL三角烧瓶及广口瓶。 2.11玻璃珠:直径约5mm。 2.12菌落计数器。 3、培养基及试剂 3.1 月桂基硫酸盐胰蛋白(胨)(LST)肉汤。 3.2 煌绿乳糖胆盐(BGLB)肉汤。 3.3EC肉汤。 3.4 伊红美蓝琼脂(EMB)。 3.5 营养琼脂斜面。
3.6 色氨酸肉汤。 3.7MR-VP培养基。 3.8Korser氏枸椽酸盐肉汤。 3.9 结晶紫中性红胆盐琼脂(VRBA)。 3.10 Butterfield氏磷酸盐缓冲稀释液。 3.11生理盐水。 3.12革兰氏染色液。 3.13Kovacs氏靛基质试剂。 3.14甲基红指示剂。 3.15Voges-proskauer(V-P)试剂。 4、样品制备 4.1 以无菌操作取有代表性的样品。如有包装则用75%乙醇在开口处擦拭后取样。若不能及时检验,应将冷冻样品置于-15℃保存;非冷冻而易腐的食品,应置于4℃冰箱保存。检验前冷冻样品可于2~5℃18h内解冻,或在45℃以下15min内解冻。 4.2 不同食品样品匀液的制备 4.2.1 液体食品以灭菌吸管取样25mL放入装有225mL稀释剂的灭菌玻璃瓶(瓶内预置适当数量的玻璃珠),以30cm幅度、于7s内振摇25次(或以机械振荡器振摇),制成1:10的样品匀液。 4.2.2 固体和半固体食品 以无菌操作取25g样品,放入装有225mL稀释剂的灭菌均质杯内,于8000r/min均质1~2min,制成1:10样品匀液(也可用灭菌乳钵研磨的方法代替)。 4.3 稀释样品匀液根据对样品污染情况的估计,用稀释剂将样品匀液制成一系列十倍递增的样品稀释液,如10-2、10-3、10-4……。从制备样品匀液至稀释完毕,全过程不得超过15min。 5、大肠菌群的测定 5.1 大肠菌群MPN值的测定 5.1.1 对每个样品,选择适宜的三个连续稀释度的样品稀释液。每个稀释度接种三管月桂基硫酸盐胰蛋白(月示)(LST)肉汤,每管接种1mL。 5.1.2 将接种管置于36±1℃培养48±2h。
全面大肠菌群平板计数法的注意事项..docx
大肠菌群平板计数法的注意事项 大肠菌群是经常用来衡量食品卫生情况的重要指标,绝大部分食品都会要求检 测的项目。在食品微生物实验室里,大肠菌群和菌落总数的检测频次应该是最高的,但检测过程中总会有一些小问题困扰着大家,以下来讲解一下大肠菌群 平板计数法的注意事项。 方法选择 相比于MPN计数法,平板计数法更适用于大肠菌群含量较高的食品。但大肠菌群多少算是含量较高呢?国标里没有明确规定,但通常认为,产品大肠菌群以 100CFU/g(mL)为界,超过这个含量一般认为是含量较高。但具体什么时候选用平板计数法进行大肠菌群的检测,大部分情况还是要看你的产品执行的标准。假如产品标准要求大肠菌群含量的单位为CFU/g(mL),那必须选用平板计数法。若是/g(mL)或者MPN/100g(mL),就应选择MPN计数法,MPN法具体选用哪版国标 此处不再赘述。因此,根据自己产品的情况选择适当的检测方法。 培养基的要求 平板计数法使用的培养基为结晶紫中性胆盐琼脂培养基,简称VRBA。无论是国标,还是培养基的使用说明中都明确表示,VRBA是不需要进行灭菌的,煮沸2min 即可使用。特地点出这一点是因为很多朋友都在问VRBA的灭菌条件,对不灭菌的培养基不信任,害怕出现检测异常,那是因为这些小伙伴们对其中的原理不清楚。大肠菌群的定义是在一定培养条件下能够在发酵乳糖、产酸产气的需氧和兼性厌氧的革兰氏阴性无芽孢杆菌,因此大肠菌群是不能形成芽孢的,在VRBA培养基煮沸的过程中,即使有大肠菌群存在也会被杀灭,所以从培养基带入污染的可能性是没有的。当然盛装培养基的容器是需要进行灭菌的,以免容器引入污染。另外,VRBA是一种选择性的培养基,含有的结晶紫对革兰氏阳性菌有比较强的抑制作用而对革兰氏阴性菌几乎没有作用,而且平板培养产生的菌落还需要进行复发酵的验证,因此VRBA培养基就不需要进行灭菌了。但值得注意的是,VRBA 需要现配现用,配制出的培养基应当在3h之内使用完毕。 稀释度的确定 国标中要求选择2-3个适宜的连续稀释度。什么样的稀释度是合适的呢?这要根据计数来决定。计数环节要求选择菌落数在15CFU-150CFU的平板进行计数,因此培养后菌落数在这个范围内的稀释度就是适宜的稀释度。实验室经常检测的产品的大肠菌群的水平检测人员可以预计的,但是对盲样,我们能做的只有根据实
实验四 大肠菌群和粪大肠菌的检验
实验四大肠菌群和粪大肠菌的检验 一、实验目的要求 1、了解大肠菌群在食品卫生检验中的意义。 2、学习并掌握大肠菌群检验的原理和方法。 二、原理 大肠菌群系指一群能发酵乳糖,产酸产气,需氧和兼性厌氧的革兰氏阴性无芽孢杆菌。一般认为该菌群细菌可包括:大肠埃希氏菌、柠檬酸杆菌、产气克雷白氏菌和阴沟肠杆菌等。该菌主要来源于人畜粪便,故以此作为粪便污染指标来评价食品的卫生质量,具有广泛的卫生学意义。它反映了食品是否被粪便污染,同时间接地指出食品是否有肠道致病菌污染的可能性。 食品中大肠菌群数系以每100g(或ml)检样内大肠菌群最近似数(the most probable number-简称MPN)表示。 三、试剂和仪器 (一)最先准备的器材 规格名称数量用途 1、500ml广口瓶 1个稀释样品 2、500ml三角瓶 2个制生理盐水 3、250ml三角瓶 1个制EMB琼脂 4、18×180mm试管 8支稀释及制双料乳糖胆盐发酵管 5、18×150mm试管20~25支单料乳糖胆盐发酵管、乳糖发酵管 6、13×130mm试管20支制蛋白胨水、EC肉汤 7、1ml移液管 5 支 8、10ml移液管 3 支 9、直径为90mm平皿12套制EMB平板 10、250ml量筒1支 (二)应灭菌消毒的器材 剪刀1把开瓶器不锈钢药匙1把滴管胶头4只称量纸适量 (三)应制备的培养基 培养基总量所用容器 1、0.85%NaCl生理盐水300ml 500ml三角瓶 2、乳糖胆盐发酵管 双料:10ml/支 5支 60ml 18×180mm试管(装有导管) 单料:10ml/ 8支 90ml 18×150mm试管(装有导管) 3、EMB琼脂: 1瓶 120ml 250ml三角瓶 4、乳糖发酵管: 3ml/支 5支20ml 13×130mm试管(装有导管) 5、EC肉汤: 3ml/支 6支20ml 13×130mm试管(装有导管)
微生物实验报告:水中细菌总数和大肠菌群的检测
实验六水中细菌总数和大肠菌群的检测 摘要:本实验以测定公园河流水的细菌总数和大肠菌群的数量,来测定特定地点的水质情况。初步介绍了一种通用的方法来检测水源的健康指标,判定水体的质量。对该实验点的水源作出了定性的评价,以及关于试验中如何提高梯度重复的精度的分析。 关键字:河流水;细菌总数测定;大肠菌群;EMB培养 前言 各种天然水中常含有一定数量的微生物。水中细菌总数往往同水体受有机污染程度呈正相关,因而是评价水质污染程度的重要指标之一。细菌总数是指1mL水样中所含细菌菌落的总数[cfu/g(mL)],可用稀释平板计数法检测。水中大肠菌群的数量可用来判断水源是否被粪便污染,并可间接推测水源受肠道病原菌污染的可能。 特征:G-无芽孢杆菌,兼性厌氧、在37℃24h内能发酵乳糖产酸、产气。 多管发酵法 初发酵:适当稀释样品,乳糖发酵培养,产酸产气; 分离培养:伊红美蓝(EMB)平板上划线分离,出现紫色、粉红色特征性菌落; 复发酵验证:挑取特征性菌落进行乳酸复发酵验证。 材料和方法 牛肉膏蛋白胨琼脂培养基:用于水中细菌总数测定 牛肉膏5g,蛋白胨10g,NaCl 5.0 g,琼脂8g,蒸馏水1000ml;pH 7.0 乳糖胆盐蛋白胨培养基:用于初发酵 1×:蛋白胨20g、牛胆盐5g、乳糖10g、0.04%溴甲酚紫水溶液25mL(调pH值后加)、水1000mL、pH 7.2-7.4 三倍浓缩液(3×):除水以外,其余成分取三倍用量 分装:1×的培养基分装9ml/管,3×的培养基分装5ml/管或50ml/瓶,均装上德汉氏小管。灭菌条件:115℃,15min。 EMB培养基:用于大肠菌群菌落鉴定 脱水培养基,按说明书操作,水用量为90%。 水源:紫竹院河水 仪器:高压灭菌锅、无菌培养皿、试管、吸管、接种环、德汉氏小管、温箱、载玻片、酒精灯、显微镜等。 试剂:牛肉膏,蛋白胨,NaCl,琼脂粉,伊红美兰琼脂培养基、水、乳糖、0.04%溴甲酚紫水溶液、胆盐、革蓝氏染色试剂 具体实验步骤: 1),相关器械的灭菌操作,以及前往紫竹院取少量的样品水。 2),按照上述的配料,无菌操作配置培养基。 3),细菌总数的测定:取上述样品水,一次稀释10-1,10-2,10-3,3个浓度。对于每个浓度,取1ml稀释液加入冷却好的牛肉膏蛋白胨培养基中,立即混匀,每个浓度重复一次。将平皿倒置培养在37℃的温箱24h,计算平皿的细菌总数。
水中大肠杆菌的检测方法
附件 水中大肠杆菌群检测方法-多管发酵法 NIEA E201.54B 一、方法概要 本方法系用以检测水中革兰氏染色阴性,不产生内生孢子之杆状好氧或兼性厌氧菌,且能在35 ± 1 ℃、 48 ± 3小时发酵乳糖并产生酸及气体之大肠杆菌群(Coliform group);在不同体积或不同稀释度之水样所 产生之结果,以「100 mL水中最大可能数(MPN/100 mL)」表示100 mL水中存在之大肠杆菌群数目。二、适用范围 本方法适用地面水体、地下水体、废水、污水及水源水质水样中大肠杆菌群之检验。 三、干扰 (一) 水样中含有抑制或促进大肠杆菌群细菌生长之物质。 (二) 检测使用的玻璃器皿及设备含有抑制或促进大肠杆菌群细菌生长的物质。 四、设备 (一) 量筒:100至1000 mL之量筒。 (二) 吸管:有0.1刻度之10 mL灭菌玻璃吸管或市售无菌塑料吸管,或无菌微量吸管(micropipet)。 (三) 试管:大小约150 × 15 mm之试管或有盖螺旋试管。 (四) 发酵管(fermentation tube):大小约22 × 9 mm之玻璃管。 (五) 稀释瓶:容量约100 mL可灭菌之硼硅玻璃制品。 (六) 锥形瓶:200至2000 mL之可灭菌硼硅玻璃制品。 (七) 采样容器:容量120 mL以上无菌之硼硅玻璃瓶或无菌塑料有盖容器,或市售无菌袋。 (八) 冰箱:温度能保持在4 ± 2℃者。 (九) 天平:待测物重量大于2 g时,须能精秤至0.01 g;待测物重量不大于2 g时,须能精秤至0.001 g。 (十) 培养箱:温度能保持在35 ± 1℃者。 (十一) 高压灭菌釜:温度能维持在121℃(压力约15 lb/in2或 1.1 Kg/cm2)灭菌15分钟以上者。
大肠杆菌和大肠菌群计数方法
大肠杆菌和大肠菌群计数方法 Enumeration of Escherichia coli and the coliform 章节内容: ?传统检测大肠菌群和大肠杆菌的方法 ?LST-MUG法检测冷藏和冷冻食品中的大肠杆菌 (除双壳类软体动物制品外) ?瓶装水检测方法 ?贝类和贝类肉制品检测方法 ?柑桔类水果汁中大肠杆菌检测方法 ?大肠菌群和大肠杆菌计数的其他方法 ?参考文件 大肠埃希氏菌,以前常称大肠杆菌,于1885年由德国儿科医生Theodor Escherich 发现,广泛存在于人类和温血动物的肠道中,是人类和动物肠道中需氧性共生菌的优势菌群,维持宿主健康部分生理功能必需的肠道菌。 大肠埃希氏菌属肠杆菌科,肠杆菌科包括许多种细菌,致病菌有沙门氏菌、志贺氏菌、和耶尔森氏菌。虽然大多数的大肠埃希氏菌为非致病菌,但是当宿主免疫力降低或细菌侵入肠道的外组织或器官时,可引起肠外感染。某些血清型可产生毒素,为致病性大肠埃希氏菌,可引起人类腹泻。 1892年,Shardinger建议把大肠杆菌作为粪便污染的指标。由于大肠杆菌广泛存在于人类和动物中,而在其他地方少见。再者,大肠杆菌能发酵葡萄糖(以后改为为乳糖)产生气体。与已知的非产气致病菌容易区别开来。 因此,大肠杆菌的检测已成为水和食品的近期粪便污染指标,表明可能含有致病菌。肠道中柠檬酸盐菌,克雷伯氏菌和肠杆菌能发酵乳糖,与大肠杆菌的生物型非常相似,使得把大肠杆菌作为健康威胁的指标,在实际应用中很复杂。于是,大肠菌群这个术语用来描述这类肠道菌,大肠菌群不是一个分类学上的定义,而是一个工作定义,指的是一群在35℃培养48h,产酸产气的,革兰氏阴性的芽孢杆菌。1914年,每国公共健康协会把大肠菌群作为一个重要的卫生标准。 虽然大肠菌群很容易检测到,但不一定与粪便污染有关系,因为在自然环境样品中也常存在。于是,粪大肠菌群就作为粪便污染的指标。首先由Eijkman提出,指的是在高温下发酵乳糖,是总大肠菌群的亚群,同时也称为耐热大肠菌群。粪大肠菌群的检测,除水、贝类、贝类养殖水在44.5℃进行,其他所有食品都在45.5℃进行。粪大肠菌群包含绝大部执蟪Ω司? 克雷伯氏菌也作为粪大肠菌群,但克雷伯氏菌的检出被认为与粪便污染并无关系。因此,大肠杆菌又被作为一个重要指标。快速鉴定大肠杆菌的新方法采用,使检测大肠杆菌相对容易了。
大肠杆菌检测实验报告
国标法测定大肠杆菌样本的细菌总数 实验目的 实验原理:国标法操作的原理 实验器材: 培养箱,10只移液管,1只250ml锥形瓶,5只大试管,试管架,4个平皿,500ml 大烧杯1个,电子天平,纱布,脱脂棉,灭菌锅,PH计或PH试纸,100ml量筒,橡皮手套,超净台 实验药品: 磷酸盐缓冲液,蒸馏水,LB培养基,琼脂,5%NaOH,5%HCl 实验步骤: 一: 10只移液管,1只250ml锥形瓶,5只大试管,4个平皿,500ml大烧杯1个,100ml量筒进行洗涤,然后一起放入高压蒸汽灭菌锅中在121摄氏度条件下灭菌20min。灭完菌后烘干,完成后放入超净台中。 用酒精擦拭超净台,紫外消毒30min 二: 1:用电子天平称取成品LB 3.1241g和琼脂1.8756g放入250ml的洁净锥形瓶中。 2:用量筒量取125ml的蒸馏水加入该锥形瓶中,制成培养基。 3:用棉花堵住该锥形瓶的瓶口,用牛皮纸包住瓶口,用橡皮筋扎牢,再将培养基放入灭菌锅中在121摄氏度之下灭菌20min。 4:灭完菌后放入超净台中备用。 三: 1:取1只无菌250ml锥形瓶,用量筒向其中加入49ml PBS 2:将1ml样品加入到该锥形瓶中,摇匀制成1:50的细菌溶液。 3:取4只试管,编号1—4 4:用无菌移液管分别向4只试管中加入9ml的PBS 5:用1ml无菌移液管从样品中移取1ml菌液加入到1中.震荡试管使菌液均匀。 6:用1ml无菌移液管从1号试管中移取1ml的细菌溶液加入2号试管中,摇匀 7:用另一只1ml无菌移液管从2号试管中移取1ml细菌溶液,加入3中,摇匀......以此类推直至4只试管中均加入了细菌溶液。 9:取4只平皿,编号1—4 10:分别用4只无菌移液管从这4只试管中移取1ml的菌液置于4只平皿中,加入45—50摄氏度温度下的培养基,约15mm厚度。缓慢旋转平皿使菌液与培养基混合均匀;待培养基冷凝后倒置。 11:将培养基在36摄氏度条件下培养12小时。 12:取出培养皿,选择细菌个数在30至300个之间的平皿数细菌的个数。 四:实验结果(记得在操作过程和得到结果时拍照) 1号,2号菌落个数多不可计,舍弃 4号平皿中菌落数目小于10 cfu ,舍弃 3号平皿中菌落分布较均匀,数3号中的菌落数,一共有210个cfu 。 计算样品中细菌浓度为:1.05× 105 Cfu/ml
第一法大肠菌群mpn计数
第一法大肠菌群MPN 计数 操作步骤 、样品的稀释 6.1.1、固体和半固体样品:称取25g 样品,放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质杯内,8 00or/min-10 000r/min 均质1 min-2 min ,或放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1 min-2 min ,制成1:10 的样品匀液。 、液体样品:以无菌吸管吸取25ml样品,置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分棍匀,制成1:10 的样品匀液。 、样品匀液的pH 值应在之间,必要时分别用1mol/L 氢氧化钠(NaOH )或1 mol/L 盐酸(HCI )调节。、用1ml无菌吸管或微量移液器吸取1:10 样品匀液1ml,沿管壁缓缓注人9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1 支1ml无菌吸管反复吹打,使其混合均匀,制成1:100 的样品匀液。 、根据对样品污染状况的估计,按上述操作,依次制成10 倍递增系列稀释样品匀液。每递增稀释1 次,换用1 支1ml无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15 min 。 、初发酵试验 每个样品,选择3 个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3 管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1ml(如接种量超过1ml,则用双料LST肉汤), 36℃±1℃ 培养24h±Zh ,观察倒管内是否有气泡产生,如未产气则继续培养至48h±2h 。记录在24h 和48h 内产气的LST 肉汤管数。未产气者为大肠菌群阴性,产气者则进行复发酵试验。 、复发酵试验
大肠菌群计数检验步骤
大肠菌群计数检验步骤 第一法大肠菌群MPN 计数 操作步骤 6.1、样品的稀释 6.1.1、固体和半固体样品:称取25g 样品,放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质杯内,8 00or/min-10 000r/min 均质1 min-2 min ,或放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1 min-2 min ,制成1:10 的样品匀液。 6.1.2、液体样品:以无菌吸管吸取25ml样品,置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分棍匀,制成1:10 的样品匀液。 6.1.3、样品匀液的pH 值应在6.5- 7.5 之间,必要时分别用1mol/L 氢氧化钠(NaOH )或1 mol/L 盐酸(HCI )调节。 6.1.4、用1ml无菌吸管或微量移液器吸取1:10 样品匀液1ml,沿管壁缓缓注人9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1 支1ml无菌吸管反复吹打,使其混合均匀,制成1:100 的样品匀液。 6.1.5、根据对样品污染状况的估计,按上述操作,依次制成10 倍递增系列稀释样品匀液。每递增稀释1 次,换用1 支1ml无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15 min 。 6.2、初发酵试验 每个样品,选择3 个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3 管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1ml(如接种量超过1ml,则用双料LST肉汤), 36℃±1℃培养24h±Zh ,观察倒管内是否有气泡产生,如未产气则继续培养至48h±2h 。记录在24h 和48h 内产气的LST 肉汤管数。未产气者为大肠菌群阴性,产气者则进行复发酵试验。 6.3、复发酵试验 用接种环从所有48h±2h 内发酵产气的LST 肉汤管中分别取培养物l环,移种于煌绿乳糖胆盐( BGLB)肉汤管中,36℃±1℃培养48h±2h ,观察产气情况。产气者,计为大肠菌群阳性管。 6.4、大肠菌群最可能数(MPN )的报告
粪大肠菌群检验记录
粪大肠菌群检查实验记录 品名 批号 物料编码 规格 来源 取样日期 代表量 检验日期 报告日期 检验编号 检验依据 1、粪大肠菌群检验记录 仪器设备名称:电热恒温培养箱仪器设备型号:DHP-500
生理盐水的配制:8.5g氯化钠加1000ml蒸馏水溶解待用(121℃灭菌30min)。 (1)恒温培养箱:36℃±1℃。 (2)冰箱:2℃~5℃。 (3)恒温水浴箱:46℃±1℃。 (4)天平:感量0.1g。 (5)无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。(6)无菌锥形瓶:容量500mL。 (7)无菌培养皿:直径90mm。 (8)pH 计或pH 比色管或精密pH 试纸。 1、操作步骤 (1)初发酵 选择适宜的三个连续稀释度的样品匀液。每个稀释度接种三管月桂基磺酸盐胰蛋白胨(LST)肉汤,每管接种1mL(如接种量需要超过1mL,则用双料LST肉汤)。36℃±1℃培养24h±2h,检查倒管内是否有气泡产生或轻摇试管时是否有密集连续的细小气泡从管底逸出,如未产气则继续培养至48h±2h。记录在24h和48h内产气的LST肉汤管数。未产气者为粪大肠菌群阴性;对产气者,则进行复发酵试验。 (2)复发酵 用接种环从所有48h±2h内发酵产气的LST肉汤管中分别取培养物1环,移种于已提前预温至45℃的EC肉汤管中。将所有接种的EC肉汤管放入于带盖的44.5℃±0.2℃恒温水浴箱内,水浴的水面应高于肉汤培养基液面,培养24h±2h,记录EC肉汤管的产气情况。产气管为粪大肠菌群阳性,不产气为粪大肠菌群阴性。 (1)取225ml生理盐水于标签为1:10的300ml锥形瓶中, 取9ml生理盐水于标签为1:100的50ml锥形瓶中。 (2)LST溶液的配制:取LST7.1g加水100ml(双料),溶解至透明, 倒入10ml于3只标有1g的并放有聚气管的试管中; 剩余溶液加一倍水配成单料倒入标有0.01g,0.001ml的6只试管中,每只10ml,并放有聚气管(试管要求180×18mm)。 (3)以上1和2;同时一起灭菌,灭菌起始时间(喷气开始计时): 压力表指针回零后打开放气阀,开盖取出,冷至常温。 (4)样品稀释:于225ml灭菌的生理盐水中加入样品25g,混匀,配成1:10的稀释样; 从1:10的稀释样中取1ml到入标有1:100的9ml灭菌的生理盐水中混匀,配成1:100稀释样; 从1:100的稀释样中取1ml到入标有1:1000的9ml灭菌的生理盐水中混匀,配成1:1000稀释样; (5)初发酵试验:每个稀释度接种3管月桂基硫酸盐蛋白胨(LST)肉汤。 取1:10的稀释样1ml于标有0.1g的3只试管中, 取1:100的稀释样1ml于标有0.01g的3只试管中, 取1:1000的稀释样1ml于标有0.001g的3只试管中, (6)BGLB溶液复发酵试验:配制BGLB溶液,称取BGLB 4g溶液100ml水中,均分倒入对应产气标号的标有标示并放有聚气管的试管中,放入灭菌锅灭菌15min。用接种针粘一环产气管液于标有对应的以灭菌的BGLB溶液的试管中,于36℃的培养箱中培养48h
水中细菌总数的测定和大肠菌群的检测
水中细菌总数的测定和大肠菌群的检测(1) 录入时间:2010-9-25 11:17:29 来源:生物信息网 (一)实验目的 (1)了解和学习水中细菌总数和大肠菌群的测定原理和测定意义。 (2)学习和掌握用稀释平板计数法测定水中细菌总数的方法。 (3)学习和掌握水中大肠菌群的检测方法。 (二)实验原理 水是微生物广泛分布的天然环境。各种天然水中常含有一定数量的微生物。水中微生物的主要来源有:水中的水生性微生物(如光合藻类)、来自土壤径流、降雨的外来菌群和来自下水道的污染物和人畜的排泄物等。水中的病原菌主要来源于人和动物的传染性排泄物。 水的微生物学的检验,特别是肠道细菌的检验,在保证饮水安全和控制传染病上有着重要意义,同时也是评价水质状况的重要指标。国家饮用水标准规定,饮用水中大肠菌群数每升中不超过3个,细菌总数每mL不超过100个。 所谓细菌总数是指1mL或1g检样中所含细菌菌落的总数,所用的方法是稀释平板计数法,由于计算的是平板上形成的菌落(colony-forming unit,cfu)数,故其单位应是cfu/g(mL)。它反映的是检样中活菌的数量。 所谓大肠菌群,是指在37℃24h内能发酵乳糖产酸、产气的兼性厌氧的革兰氏阴性无芽胞杆菌的总称,主要由肠杆菌科中四个属内的细菌组成,即埃希氏杆菌属、柠檬酸杆菌属、克雷伯氏菌属和肠杆菌属。 水的大肠菌群数是指100mL水检样内含有的大肠菌群实际数值,以大肠菌群最近似数(MPN)表示。在正常情况下,肠道中主要有大肠菌群、粪链球菌和厌氧芽胞杆菌等多种细菌。这些细菌都可随人畜排泄物进入水源,由于大肠菌群在肠道内数量最多,所以,水源中大肠菌群的数量,是直接反映水源被人畜排泄物污染的一项重要指标。目前,国际上已公认大肠菌群的存在是粪便污染的指标。因而对饮用水必须进行大肠菌群的检查。 水中大肠菌群的检验方法,常用多管发酵法和滤膜法。多管发酵法可运用于各种水样的检验,但操作繁琐,需要时间长。滤膜法仅适用于自来水和深井水,操作简单、快速,但不适用于杂质较多、易于阻塞滤孔的水样。
微生物检验原始记录(大肠菌群)
微生物检验原始记录(大肠菌群)
检验原始记录 编号:报告类别:微生物共页项目:大肠菌群coliforms 检验地点: 样品名称:样品编号: 样品状态:符合检验要求;其他境条件: 实验依据及步骤GB4789.3-2016 样品稀释 固体和半固体样品:称取25g样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌均质容器内均质,或放入盛有225ml稀释液的无菌均质袋中拍击式均质器拍打,制成为1:10样品匀液。依次进行10倍递增稀释。 液体样品:以无菌吸管吸取25ml样品置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中混匀,为1:10样品匀液。 样品匀液的ph应在6.5-7.5之间,必要时分别用1mol/lNaOH或1mol/lHcL调节。 取1mL1∶10稀释匀液沿管壁缓缓注入9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支无菌吸管反复吹打,使其混合均匀,制成1:100样品匀液。 按上述操作顺序做10倍递增稀释液,每稀释一次,换用一支1mL灭菌吸量管。从样品匀液制备到样品接种完毕,全过程不得超过15min。 初发酵试验(9管法)每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤(大肠菌群测定:如果超过1ml,则用双料LST肉汤) 36℃±1℃培养24h±2h,观察倒管内是否有气泡产生。 产气者进行复发酵试验,未产气则继续培养至48±2h,产期进行复发酵试验。未产气者为大肠菌群阴性。 复发酵试验(证实试验)用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,,观察产气情况。 数据分析与结果一、菌落计数
大肠菌群和大肠杆菌检测方法
出口食品中大肠菌群、粪大肠菌群和大肠杆菌检验方法 Method for examination of coliform,fecal coliform and escherichia coli in food for export SN 0169—92 代替ZB X09 002—86 1 主题内容与适用范围 本标准规定了出口食品中大肠菌群、粪大肠菌群和大肠杆菌的检验方法。 本标准适用于出口食品的检验。 2 设备和材料 2.1 吸管:1mL,具0.1mL刻度;5mL和10mL,具1mL刻度。 2 2 水浴箱:44.5±0.5℃。 2.3 培养箱:36±1℃,44.5±0.5℃。 2.4 冰箱:0~5℃和-15~-20℃。 2.5 均质器。 2.6乳钵和研棒。 2.7 平皿:直径90mm。 2.8天平:感量0.1g。 2.9 显微镜。 2.10 稀释瓶:100mL、200mL和500mL三角烧瓶及广口瓶。 2.11 玻璃珠:直径约5mm。 2.12菌落计数器。 3 培养基及试剂 3.1 月桂基硫酸盐胰蛋白(LST)肉汤。 3.2 煌绿乳糖胆盐(BGLB)肉汤。 3.3 EC肉汤。 3.4 伊红美蓝琼脂(EMB)。 3.5营养琼脂斜面。 3.6 色氨酸肉汤。 3.7 MR-VP培养基。 3.8 Korser氏枸椽酸盐肉汤。 3.9 结晶紫中性红胆盐琼脂(VRBA)。 3.10 Butterfield氏磷酸盐缓冲稀释液。 3.11 生理盐水。 3.12 革兰氏染色液。 3.13 Kovacs氏靛基质试剂。 3.14 甲基红指示剂。 3.15 V oges—pros kauer(V—P)试剂。 4 样品制备 4.1 以无菌操作取有代表性的样品。如有包装则用75%乙醇在开口处擦拭后取样。若不能及时检验,应将冷冻样品置于-15℃保存;非冷冻而易腐的食品,应置于4℃冰箱保存。检验前冷冻样品可于2—5℃18h内解冻,或在45℃以下15min内解冻。 4.2 不同食品样品匀液的制备 4.2.1 液体食品 以灭菌吸管取样25mL放入装有225mL稀释剂的灭菌玻璃瓶(瓶内预置适当数量的玻璃珠),以30cm幅度、于7s 内振摇25次(或以机械振荡器振摇),制成1:10的样品匀液。
大肠菌群计数含MPN表
大肠菌群计数 是一种估计悬浮在水溶液中活菌数的方法。 一般分几组进行,每一组各有数重复,分别以渐次的方式加入不同量的待测水溶液于培养液中进行培养,随后观察每一组中的试管是否有菌生长,然后再利用统计表估计菌数。 例如水中coliform数的测定,将待测水溶液以10ml,1ml及的量分别加入各组,每组三重复,经培养后观察coliform是否有生长,统计有菌生长的管数,以统计表统计菌数。 活菌的浓度可利用MPN的方式来估计,方式简单,可分为下列两步骤:在培养基中作数个重复稀释; 记录有菌生长的试管。若试管中无生长,则可能代表连一支菌都没有生长。 从统计观点,MPN这个方法是一种非常没效率的方式,因为每一试管与培养皿表面生长的菌数只有很小部分符合。然而MPN的好处有以下: 若菌无法长在固态培养基时,便可使用; 若菌的生长的动力学具有很大变化,便可使用:假设某些菌会会立即且迅速 的生长,且会在固态培养基产生很大的菌落,且与我们要的菌落接触到或盖过时;因为较少且具高度游动性或快速生长的菌,可能形成小菌落,因而其数量是很多而导致无法计数; 假如非我们所要菌存在,或无筛选的方法存在时,便可使用。虽然有污染的细菌可以大量生长,但仍可藉由我们所要看的菌产生特定的产物来估计; 假如琼脂或其他固化材料有某些因素会干扰我们计数时,便可使用 大肠菌群MPN表
正反应试管数MPN/ml (g )95% 信赖界线 下限上限000< 3 0013< 59 0103< 513 020--- 1004< 520 1017121 1107123 11111336 12011336 2009136 20114337 21015344 21120789 22021447 2212810150 230--- 300234120 301397130 3026415380 310437210 3117514230 31212030380 3209315380 3211530440 32221035470 330240361,300 331460712,400 3321,1001504,800 333> 1,100> 150> 4,800 说明: 若稀释倍数为10,100,1000倍(即每ml LST中,,ml(g)
大肠菌群_菌落总数检验报告原始记录
创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 微生物实验原始记录 粤珍小厨餐饮管理有限公司 样品名称样品编号放入时培养 箱温度 ℃ 设备名称电热恒温培养箱(±1℃) 设备编号DHP-9082取出时培养 箱温度 ℃ 检验依据GB/T4789.2-2010 GB/T4789.3-2010 样品状态 一、菌落总数(cfu/g) 以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。 每个稀释度吸取1ml于灭菌培养皿内,注入凉至46℃的营养琼脂15ml,混匀。待营养琼脂凝固后,翻转平板于36℃培养48h。同时做空白对照。 样品匀液 (10-i) 10-110-2 10-3 观察结果(C) 计算结果N 报告结果 CFU/g 二、大肠菌群(MPN/100g) 以无菌操作将检样25g于225ml灭菌生理盐水中,均质后充分振摇做成1:10的均匀稀释液。取1ml灭菌吸管吸取上述稀释液1ml,加入9ml灭菌生理盐水中,混合均匀,做成1:100的稀释液,按上述方法操作,做10倍递增稀释。 每个稀释梯度取1ml注入9mlLST接种试管,36℃培养48h。 样品匀液 (10-i) 10-110-210-3
主检:审核:检验日期:年月日 邹平县产品质量监督检验所检验原始记 录 共页
主检:校核:检验日期:年月日 邹平县产品质量监督检验所检验原始记录 共页
主检:校核:检验日期:年月日 创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王*
大肠菌群MPN 计数
第一法 操作步骤 6.1、样品的稀释 6.1.1、固体和半固体样品:称取25g样品,放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质杯内,8 00or/min-10 000r/min均质1min-2 min ,或放人盛有225ml磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1 min-2 min,制成1:10的样品匀液。 6.1.2、液体样品:以无菌吸管吸取25ml样品,置盛有225ml磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分棍匀,制成1:10的样品匀液。 6.1.3、样品匀液的pH 值应在6.5- 7.5之间, 必要时分别用1mol/L氢氧化钠(NaOH )或1 mol/L盐酸(HCI )调节。 6.1.4、用1ml无菌吸管或微量移液器吸取1:10样品匀液1ml,沿管壁缓缓注人9ml磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1ml无菌吸管反复吹打,使其混合均匀,制成1:100的样品匀液。 6.1.5、根据对样品污染状况的估计,按上述操作,依次制成10倍递增系列稀释样品匀液。每递增稀释1次,换用1支1ml无菌吸管或吸头。 从制备样品匀液至样品接种完毕,全过程不得超过15 min。 6.2、初发酵试验 每个样品,选择3个适宜的连续稀释度的样品 匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1ml(如接种量超过1ml,则用双料LST肉汤), 36℃±1℃培养24h±Zh,观察倒管内是否有气泡产生,如未产气则继续培养至
48h±2h。记录在24h和48h内产气的LST 肉汤管数。未产气者为大肠菌群阴性,产气者则进行复发酵试验。 6.3、复发酵试验 用接种环从所有48h±2h内发酵产气的LST 肉汤管中分别取培养物l环,移种于煌绿乳糖胆盐( BGLB)肉汤管中,36℃±1℃培养48h±2h,观察产气情况。产气者,计为大肠菌群阳性管。 6.4、大肠菌群最可能数(MPN )的报告根据大肠菌群阳性管数,检索MPN 表(见附录 B ),报告每克(或毫升)样品中大肠菌群的MPN 值。 第二法大肠菌群平板计数 8、操作步骤 8.1、样品的稀释 按6.1进行。 8.2、平板计数 8.2.1、选取2个~3个适宜的连续稀释度,每个稀释度接种两个无菌平皿,每皿1ml。同时分别取1ml生理盐水加人两个无菌平皿作空白对照。 8.2.2、及时将15 mL-20ml冷至46℃的结晶紫中性红胆盐琼脂(VRBA )约倾注于每个平皿中。小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3 mL-4mlVRBA覆盖平板表层。翻转平板,置于36℃±l℃培养18h- 24h。 8.3、平板菌落数的选择 选取菌落数在30-150之间的平板,分别计数平板上出现的典型和可疑大肠菌群菌落。典型菌落为紫红色,菌落周围有红色的胆盐沉淀环,菌落直径为0.5 mm或更大。
