利那洛肽Linaclotide杂质整理列表
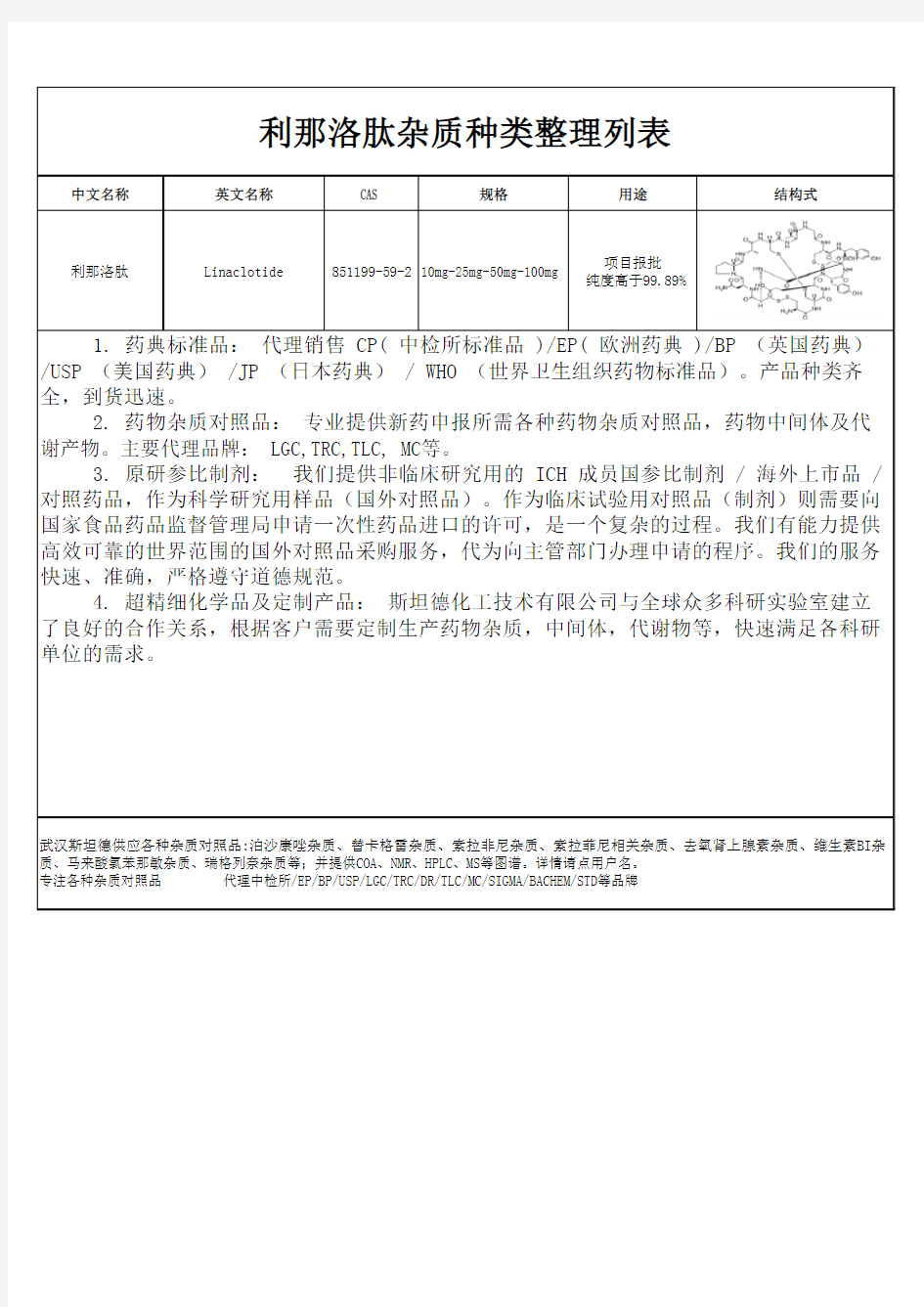
中文名称英文名称CAS 规格用途结构式
利那洛肽Linaclotide 851199-59-210mg-25mg-50mg-100mg 项目报批
纯度高于99.89%
武汉斯坦德供应各种杂质对照品:泊沙康唑杂质、替卡格雷杂质、索拉非尼杂质、索拉菲尼相关杂质、去氧肾上腺素杂质、维生素BI杂质、马来酸氯苯那敏杂质、瑞格列奈杂质等;并提供COA、NMR、HPLC、MS等图谱。详情请点用户名。
专注各种杂质对照品 代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD等品牌利那洛肽杂质种类整理列表
1. 药典标准品: 代理销售 CP( 中检所标准品 )/EP( 欧洲药典 )/BP (英国药典)/USP (美国药典) /JP (日本药典) / WHO (世界卫生组织药物标准品)。产品种类齐全,到货迅速。
2. 药物杂质对照品: 专业提供新药申报所需各种药物杂质对照品,药物中间体及代谢产物。主要代理品牌: LGC,TRC,TLC, MC等。
3. 原研参比制剂: 我们提供非临床研究用的 ICH 成员国参比制剂 / 海外上市品 /对照药品,作为科学研究用样品(国外对照品)。作为临床试验用对照品(制剂)则需要向国家食品药品监督管理局申请一次性药品进口的许可,是一个复杂的过程。我们有能力提供高效可靠的世界范围的国外对照品采购服务,代为向主管部门办理申请的程序。我们的服务快速、准确,严格遵守道德规范。
4. 超精细化学品及定制产品: 斯坦德化工技术有限公司与全球众多科研实验室建立了良好的合作关系,根据客户需要定制生产药物杂质,中间体,代谢物等,快速满足各科研单位的需求。
瑞戈非尼杂质标准品对照品产品详情对照表
产品信息: 中文名:瑞戈非尼杂质A 英文名:Regorafenib impurity A 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质B 英文名:Regorafenib impurity B 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质C 英文名:Regorafenib impurity C 规格:25mg和50mg 纯度大于99% 随货提供COA H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质D 英文名:Regorafenib impurity D 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 中文名:瑞戈非尼杂质E 英文名:Regorafenib impurity E 规格:25mg和50mg 纯度大于99% 随货提供COA,H-NMR,MS,H-NMR 基本信息: 产品ID117412 产品中文名称瑞戈非尼 产品英文名称Regorafenib 产品中文异名瑞格非尼; 产品英文异名Stivarga; CAS号755037-03-7 分子式C21H15ClF4N4O3
用于经标准治疗依然发生转移的结直肠癌患者。获批时间:9月(美国) 相关信息: 拜耳(Bayer)于2014年7月30日宣布,抗癌药Stivarga(regorafenib,瑞戈非尼)获欧盟委员会(EC)批准,用于既往经2种酪氨酸激酶抑制剂【格列卫(Gleevec,通用名:imatinib,伊马替尼),索坦(Sutent,通用名:sunitinib,舒尼替尼)】治疗后病情恶化或不耐受的不可切除性或转移性胃肠道间质瘤(GIST)患者的治疗。此前,Stivarga已于2013年8月获欧盟批准用于转移性结直肠癌(mCRC)的治疗。 Stivarga GIST新适应症的获批,是基于关键III期GRID研究的数据。数据显示,与安慰剂+最佳支持疗法(BSC)相比,Stivarga+BSC组合疗法使无进展生存期(PFS)取得了统计学意义的显著改善(4.8个月vs0.9个月,p<0.0001)。 目前,Stivarga已获美国、欧盟、日本批准,用于转移性结直肠癌(mCRC)的治疗。同时,该药已获美国和日本批准用于治疗胃肠道间质瘤(GIST)。Stivarga是FDA批准的第三个治疗胃肠道间质瘤(GIST)的药物,另2个药物为诺华的格列卫(Gleevec)、辉瑞的索坦(Sutent)。 胃肠道间质瘤(GIST)是癌细胞发生在胃肠道的一种肿瘤,患者多为老年人。GIST,由于其极具侵略性的特点,目前依然是尚未满足的医疗需求,同时治疗的选择也很有限,相关临床研究数据表明,Stivarga有望为那些经标准治疗后复发的患者提供一种重要的治疗方案。 Stivarga是一种口服多激酶抑制剂,在临床前研究中,regorafenib能够抑制数个促血管生成VEGF受体酪氨酸激酶,这些激酶在肿瘤的血管生成中发挥着重要作用。该药还可以抑制癌和肿瘤微环境中的多种激酶,包括VEGFR1-3,KIT,RET,PDGFR及FGFR。Stivarga由拜耳开发,由拜耳和Onyx制药联合推广。
奥拉西坦注射液-说明书
奥拉西坦注射液 药品名称: 通用名称:奥拉西坦注射液 英文名称:Oxiracetam Injection 商品名称:欧兰同 成份: 奥拉西坦 适应症: 用于脑损伤及引起的神经功能缺失、记忆与智能障碍等症的治疗。 规格: 5ml:1g 静脉滴注。每日一次,每次4-6g,用前加入到5%葡萄糖注射液或0.9%氯化钠注射液100-250ml中,摇匀后静脉滴注。可酌情增减用量,用药疗程为2-3周。 国外上市奥拉西坦注射液的用量范围是2-8g,但国内尚无低于4g、高于6g的用药经验。 不良反应: 1.据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒、恶心、精神兴奋、睡眠紊乱,但症状较轻, 停药后可自行恢复。 2.应用本品进行了临床试验,结果显示奥拉西坦注射液组与吡拉西坦注射液的不良事件发生率无统计学差 异,未发现严重不良事件。 禁忌: 对本品过敏者、严重肾功能损害者禁用。 注意事项: 1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。 2.患者出现精神兴奋和睡眠紊乱时,应减量。 孕妇及哺乳期妇女用药: 本品在孕妇及哺乳期妇女使用的安全性尚不明确,因此,不应使用。
尚不明确。 老年用药: Lecaillon JB等对老年病人的奥拉西坦药物代谢情况进行了研究,老年人由于生理性肾功能减退,消除半衰期(t1/2β)较健康青年人延长,曲线下面积(AUC)及血药峰浓度(C max)均略有升高,老年人在使用本品后消除速度稍慢,但与青年人相比无显著性差异。 药物相互作用: 尚不明确。 药物过量: 在超剂量使用本品的情况下偶有病人出现兴奋、失眠等不良反应,停药或减少剂量后症状可逐渐消失。 毒理研究: 动物研究显示,奥拉西坦小鼠灌胃给药10g/kg、静注给药2g/kg和大鼠灌胃给药10g/kg均未见动物死 亡;未见致突变性、致癌作用及生殖毒性。 药理作用: 奥拉西坦为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。机理研究结果提示,奥拉西坦可促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中ATP/ADP的比值,使大脑中蛋白质和 核酸的合成增加。 药代动力学: 应用本品进行了人体药代动力学研究,结果:单次静脉滴注(2.0g)血药峰浓度(Cmax)为96.15±3.58μg·ml-1,半衰期(t1/2)为3.84±0.64h,曲线下面积(AUC0-12)为256.26±16.84μg·ml-1·h-1,曲线下面积(AUC0-∞)为 276.74±18.11μg·ml-1·h-1,肾排泄速率常数(k e)为0.18±0.03h<>sup-1,平均滞留时间(MRT)为4.39±0.39h。 多次静脉滴注(2.0g)血药峰浓度C max为97.92±3.26ug·ml-1,半衰期(T1/2) 为4.14±0.82h,曲线下面积 (AUC0-12)为259.36±25.43μg. ml-1·h-1,曲线下面积(AUC0-∞)为285.59±27.38μg·ml-1·h-1,肾排泄速率常数(k e)为0.17±0.04h-1,平均滞留时间(MRT)为4.87±0.69h。奥拉西坦多次静脉给药体内无蓄积;静脉给药后,血药浓度水平以及主要的药代动力学参数在个体间差异较小; 文献资料显示: 奥拉西坦在肝、肾中分布浓度较高,除脑脊液中的半衰期为300分钟(口服2.0g)、140分钟(静脉注射2.0g)外,在其余组织的半衰期与血浆中相似。奥拉西坦主要通过肾脏代谢,48小时内90%以上的药物以原型从尿中排出,个体间差异很小;老年人与健康年轻人的肾脏消除速度无显著性差异。 性状: 本品为无色或几乎无色的澄明液体。
氨磷汀相关杂质
相关杂质整理列表 中文名英文名CAS 号规格纯度结构式 氨磷汀杂质1(氨 磷汀二硫化物)Amifostine Impurity 1(Amifostine Disulfide)10027-65-310mg-25mg-50mg-100mg ≥99% 氨磷汀杂质2(氨 磷汀硫醇)Amifostine Impurity 2(Amifostine Thiol)14653-77-110mg-25mg-50mg-100mg ≥99% 氨磷汀杂质3Amifostine Impurity 3N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质4Amifostine Impurity 4N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质5Amifostine Impurity 5N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质6Amifostine Impurity 6N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质7Amifostine Impurity 7N/A 10mg-25mg-50mg-100mg ≥99%
湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD 、LGC 、TLC 、EP 、USP 、TRC 等多个品牌产品,提供上万种标准品 对照品,真诚为您服务。 氨磷汀杂质8Amifostine Impurity 8N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质9Amifostine Impurity 9N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质10Amifostine Impurity 10N/A 10mg-25mg-50mg-100mg ≥99% 氨磷汀杂质11Amifostine Impurity 1123545-42-810mg-25mg-50mg-100mg ≥99%
奥拉西坦说明书
奥拉西坦注射液 百科名片 奥拉西坦注射液 一种可改善老年性痴呆和记忆障碍症患者的记忆和学习功能的药物。药品名称 通用名称:奥拉西坦注射液 英文名称:Oxiracetam Injection 成份 本品主要成分为奥拉西坦。 化学名称为:4-羟基-2-氧代-1-吡咯烷乙酰胺。 奥拉西坦注射液的化学分子结构式
化学结构式:见右图 分子式:C6H10N2O3 分子量:158.16 性状 本品为无色或几乎无色的澄明液体。 药理毒理 奥拉西坦为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。机理研究结果提示,奥拉西坦促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中ATP(三磷酸腺酐)/ADP (二磷酸腺酐)的比值,使大脑中蛋白质和核酸的合成增加。 毒理:动物研究显示,奥拉西坦小鼠灌胃给药10g/kg、静注给药2g/kg和大鼠灌胃给药10g/kg均未见动物死亡;未见致突变性、致癌作用及生殖毒性。 药代动力学 应用本品进行人体药代动力学研究,结果:单次静脉滴注(2.0克)血药峰值浓度(Cmax)为96.15±3.58μg·ml-1,半衰期(t1/2)为3.84±0.64h,曲线下面积(AUC0~12)为256.26±16.84μg·ml-1·h-1,曲线下面积(AUC0~∞)为276.74±18.11μg·ml-1,肾排泄速率常数(ke)为
0.18±0.03h-1,平均滞留时间(MRT)为4.39±0.39h。多次静脉滴注(2.0g)血药峰值浓度(Cmax)为 97.92±3.26μg·ml-1,半衰期(T1/2)为4.14±0.82h,曲线下面积(AUC0~12)为259.36±25.43μg·ml-1·h-1,曲线下面积(AUC0~∞)为285.59±27.38μg·ml-1·h-1,肾排泄速率常数(ke)为0.17±0.04h-1,平均滞留时间(MRT)为4.87±0.69h。奥拉西坦多次静脉给药体内无积蓄;静脉给药后,血药浓度水平以及主要的药代动力学参数在个体间差异较小。 文献资料显示:奥拉西坦在肝、肾分布浓度较高,除脑脊液中的半衰期为300分钟(口服2.0克)、140分钟(静脉注射2.0克)外,在其余组织的半衰期与血浆中相似。奥拉西坦主要通过肾脏代谢,48小时内90%以上的药物以原型从尿中排出,个体间差异很小;老年人与健康年轻人的肾脏消除速度无显著性差异。适应症 用于脑损伤及引起的神经功能缺失、记忆与智能障碍的治疗。 奥拉西坦注射液说明书
原料药杂质管理规程精讲
1. 目的:为了加强原料药杂质管理,确保上市药品质量。 2. 适用范围:本公司生产的原料药产品。 3. 责任者:QC、QC负责人、QA负责人、质量受权人。 4. 内容: 4.1杂质的定义及分类 4.1.1定义:任何影响药品纯度的物质均称为杂质。。 4.1.2分类: ●按化学特性分类:有机杂质、无机杂质、有机挥发性物质。(1)有机物质 ①有关物质 -起始原料 -中间体、副产物 -降解产物 -聚合物 -异构体 ②多晶型杂质 (2)无机杂质 -无机盐 阴离子 阳离子
-重金属催化剂 -过滤介质、活性炭 (3)有机挥发性物质 残留溶剂 ●按来源分类:有关物质(反应前体、中间体、副产物、降解产物等)、其它杂质、外来物质。 ●按结构分类:其他甾体、其他生物碱、几何异构体、光学异构体和聚合物。 4.2杂质的检测方法 ●原子吸收分光光度法:检查金属杂质 ●毛细管电泳法:抑肽酶中检查去丙氨酸-去甘氨酸-抑肽酶和去丙氨酸-抑肽酶两个特定杂质 ●色谱法:液相色谱法,检查有机杂质的主要方法 薄层色谱法,作为液相色谱法的补充 气相色谱法:检查挥发性杂质 ●热分析法:检查不同晶型的杂质(影响生物利用度和稳定性) ●拉曼光谱法、红外光谱法、X-射线粉末衍射 ●生物检定法、酶联免疫试剂盒(抗生素残留量) 4.3杂质的控制 4.3.1残留溶剂控制 ●标准起草过程中,应针对所用到的有机溶剂进行检查; ●建议采用了顶空进样方式和程序升温梯度洗脱的方法; ●应注意供试品溶液的配制,要求供试品在溶剂中溶解; ●方法学试验应进行回收试验,确认是否有基质干扰; ●采用标准加入法,该方法可减少基质干扰,提高方法的准确度。 4.3.1.1残留溶剂检测的常见问题 ①共出峰干扰 ②热降解干扰 ③基质效应的影响 ④药品溶解性的影响
20种氨基酸记忆口诀(张恒博整理)
老师让把20种氨基酸记住,带上英文缩写,还说是最低的要求,别的专业连结构式都得记熟,这些东西我看上一眼都会头痛,更别说背诵了,没办法,谁让自己学的这个呢,在网上查了点资料,竟然有好的口诀,希望会对自己有用 然后由于后面内容太多,广告打在前面吧 滨州医学院校友交流站https://www.360docs.net/doc/dc13470423.html,,里面也经常有很多好东西哦 六伴穷光蛋,酸谷天出门,死猪肝色脸,只携一两钱。一本落色书,拣来精读之。芳香老本色,不抢甘肃来。 六伴穷光蛋:硫、半、光、蛋→半胱、光、蛋(甲硫)氨酸→含硫氨基酸 酸谷天出门:酸、谷、天→谷氨酸、天门冬氨酸→酸性氨基酸 死猪肝色脸:丝、组、甘、色→丝、组、甘、色氨酸→一碳单位来源的氨基酸 只携一两钱:支、缬、异亮、亮→缬、异亮、亮氨酸→支链氨基酸 一本落色书:异、苯、酪、色、苏→异亮、苯丙、酪、色、苏氨酸→生糖兼生酮拣来精读之:碱、赖、精、组→赖氨酸、精氨酸、组氨酸→碱性氨基酸 芳香老本色:芳香、酪、苯、色→酪、苯丙、色氨酸→芳香族氨基酸 不抢甘肃来:脯、羟、甘、苏、赖→脯、羟脯、甘、苏、赖氨酸→不参与转氨基的氨基酸
甘氨酸-----Gly-----G 干gan了le的叶ye子 丙氨酸-----Ala-----A 一个夹心饼干(把A想成一片饼干,两面都是A,中间加点东西) 缬氨酸-----Val-----V 缬读xie,和腹泻的泻同音!四川人管上厕所叫窝(Val)屎 亮氨酸-----Leu-----L 亮的英语单词是light 异亮氨酸---Ile----I 把I想成一 苯丙氨酸---Phe----F 他(he)人又苯,又爱放屁(P),我真的服(F)了他了 脯氨酸-----Pro----P 胸脯(p)肉(ro) 色氨酸-----Trp----W 我w喜欢看三three个人renXXXXp,我太色了 丝氨酸-----Ser----S S的读音 酪氨酸-----Tyr----Y 踢T你的your鸭儿r,让你变成懦夫 半胱氨酸---Cys----C 这个来自一个单词Cyst,是膀胱的意思。读音和妹妹差不多。妹妹的膀胱 蛋氨酸-----Met----M 小的时候,妈妈M老是叫我吃eat鸡蛋 天冬氨酸---Asp----D 把As想成天冬。医生D说AS的尿是酸性的 天冬酰胺---Asn----N 不能在冬天制造血案 谷氨酰胺----Gln---Q 谷物没多少了,最大的问题在于可能发生血案 谷氨酸------Glu---E 谷物的益处E在于可以变成葡萄糖 苏氨酸------Thr---T 他TA喝he了瓶苏打水,终于不热re了 赖氨酸------Lys---K 美国的国务卿耐丝LYS说她可以让台湾占山为王KING,老胡说,你简(碱性氨基酸)直 是在放屁 精氨酸------Arg---R 大家都看过周星驰的电影,有一次,他喝了杯精液,观众就在争论argue他 喝的是不是热RE的精液 组氨酸------His---H H想成医院,医院切掉了他的his病变组织
奥拉西坦研究及临床应用
奥拉西坦研究及临床应用 郭瑞臣山东大学齐鲁医院临床药理研究所济南250012 奥拉西坦(Oxiracetam)化学名为:2-(4-羟基吡咯烷-2-酮-1-基)乙酰胺,是一种新的环状GABOB衍生物。1974年由意大利首先合成,为意大利ISF S.P.A 公司开发,1987年12月在意大利首次上市,商品名为Neupan,有口服剂型和注射剂型。国内于1997年2月批准石家庄制药集团欧意药业的胶囊剂上市(商品名欧来宁),随后该公司又开发出其注射剂。 一药理作用 1■作用机制 奥拉西坦是作用于中枢网状结构的拟胆碱能益智药,可透过血脑屏障,刺激特异性中枢神经通路;可改善思维、记忆力和学习成绩,减少休克所致的记忆力 损伤;拮抗原发性高血压脑血管损伤大鼠学习能力的降低,提高大鼠皮质和海马 部分乙酰胆碱的运转,增加对胆碱摄取的亲和力;可促进磷酰胆碱和磷酰乙醇胺合成,选择性地激活大脑皮层功能,改善大脑新陈代谢;可促进缺氧后EEG恢复,激活腺苷酸激活酶,增加ATP合成和能量储存,提高ATP转化和RNA合成,并有抗血小板凝聚作用。 2.药理学研究 100、300或1000mg/kg灌胃给药几乎不影响大鼠的一般行动、自发运动、运动协调性、电击刺激导致的痉挛,对兔子活体回肠运动、大鼠胆汁分泌及胃肠 粘膜无明显影响。100、300或1000mg/kg,静脉注射给药不影响乌拉坦麻醉兔的呼吸、血压、心率及心电图。 奥拉西坦毒性较低。急性毒性试验表明,灌胃给药LD50大于10g/kg,静脉给药LD50大于2g/kg。 亚急性毒性试验表明,大鼠和狗灌胃给药连续4周每日50、500、3000mg/kg 无死亡,13周每日3000mg/kg组大鼠兴奋性增加和有腹泻发生;狗连续静脉注射13周每日25、300、1000mg/kg对体重和饮食无影响,大鼠连续腹腔注射13 周,每日1000mg/kg组轻微增加肌氨酸酐、胆红素和Y球蛋白,可增加类脂类和高密度胆固醇。 长期毒性试验显示,大鼠灌胃给药连续1年每日120、600和3000mg/kg,
氟哌啶醇相关杂质
相关杂质整理列表 中文名英文名CAS号规格纯度结构式 氟哌啶醇杂质1(氟哌啶醇EP杂 质A) Haloperidol Impurity 1 (Haloperidol EP Impurity A) 3109-12-4 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质2(氟哌啶醇EP杂 质B) Haloperidol Impurity 2 (Haloperidol EP Impurity B) 1391052-5 3-1 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂3(氟哌啶醇EP杂质C) Haloperidol Impurity 3 (Haloperidol EP Impurity C) 1391052-8 7-1 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质4(氟哌啶醇EP杂 质D) Haloperidol Impurity 4 (Haloperidol EP Impurity D) 67987-08-0 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质5(氟哌啶醇EP杂 质E) Haloperidol Impurity 5 (Haloperidol EP Impurity E) 1391054-6 9-5 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质6(氟哌啶醇EP杂 质F) Haloperidol Impurity 6 (Haloperidol EP Impurity F) 1391052-6 7-7 10mg-25mg-50mg-100mg ≥99% 氟哌啶醇杂质7 Haloperidol Impurity 7 34104-67-1 10mg-25mg-50mg-100mg ≥99%
利伐沙班工艺杂质合成方法
利伐沙班原料药杂质合成工艺
目录 一、基本信息 (3) 1.1药品名称 (3) 1.2结构 (3) 二、利伐沙班杂质列表 (4) 2.1杂质合成工艺 (6) 2.2杂质A合成 (6) 2.3杂质B合成 (6) 2.4杂质C合成 (6) 2.5杂质D合成 (7) 2.6杂质E合成 (7) 2.7杂质F合成 (8) 2.8杂质G合成 (8)
利伐沙班原料药杂质合成工艺 一、基本信息 1.1药品名称 中文通用名:利伐沙班 英文通用名:Rivaroxaban 汉语拼音:LIFASHABAN 中文化学名::5-氯-N-(((5S)-2-氧代-3-(4-(3-氧代吗啉-4-基)苯基)-1,3-恶唑啉-5-基)甲基)噻吩-2-甲酰胺 英文化学名:5-Chloro-N-(((5S)-2-oxo-3-(4-(3-oxomorpholin-4-yl)phenyl)-1,3- oxazolidin-5-yl)methyl)thiophene-2-carboxamide 化学文摘登记(CAS)号:366789-02-8 外观与性状:白色至灰白色固体 1.2结构 分子式:C19H18ClN3O5S 分子量:435.88 立体结构:含一个手性中心 作用机理:利伐沙班是一种口服,具有生物利用度的Xa因子抑制剂,其选择性地阻断Xa因子的活性位点,且不需要辅因子(例如抗凝血酶Ⅲ)以发挥活性。通过内源性及外源性途径活化X因子为Xa因子(FXa),在凝血级联反应中发挥重要作用。利伐沙班在人体剂量依赖性抑制Xa因子活性,应用Neoplastin?试剂测定的凝血酶原时间(PT)、活化部分凝血活酶时间(aPTT)及HepTest?肝素定量检测可见剂量依赖性延长。抗Xa因子活性同样受利伐沙班影响。
新--奥拉西坦合成工艺研究资料
申明 本资料所有权归我公司内部绝密文件,任何人、部门不得随意外传,如有违反者,罚款叁万元人民币,并开出本公司! 情节严重者交公安部门处理! 往有关人员自觉遵守! 2012年12月1日 研发部 目录
一、奥拉西坦基本性状资料 二、合成工艺路线的选择 三、工艺流程图 四、详细操作 4.1中间体3-羟基-2-吡咯烷酮合成 4.2中间体2-(4-羟基吡咯烷-2-酮-1-基)乙酸乙酯合成 4.3 奥拉西坦的合成 4.4产品质量控制过程 4.5多批次小试试验结果 4.6工艺验证 五、奥拉西坦中间体质量标准及控制方法 六、三废处理原则及具体处理方案 6.1 处理原则 6.2 处理原则图 6.3 具体处理方案 七、试剂和中间体来源 奥拉西坦生产工艺的研究资料及文献资料
一、奥拉西坦基本资料 【中文名称】奥拉西坦 【英文名称】Oxiracetam 【中文化学名称】2-(4-羟基吡咯烷-2-酮-1-基)乙酰胺 【英文化学名称】4-Hydroxy-2-oxo-pyrrolidineacetamide 【结构式】 【化学式】C 6H 10【分子量】【CAS 号】酮-1-基)乙酸乙酯经1坦[1][2]。 2、4-氯-3-羟基丁酸酯与甘氨酰胺反应得到奥拉西坦[3][4],收率70%。 NH(CH 2CO 2C 2H 52225 N OH O CH 2CO 2C 2H 5 H 5O 2C H 2O CH 3CN N O O CH 2CO 2C 2H 5 NaBH 4 (CH 3OCH 2)2 N OH O CH 2CO 2C 2H 5 N O OH CH 2CONH 2
奥拉西坦注射液说明书.docx
奥拉西坦注射液 药品名称 : 通用名称:奥拉西坦注射液 英文名称:Oxiracetam Injection 商品名称:欧兰同 成份 : 奥拉西坦 适应症 : 用于脑损伤及引起的神经功能缺失、记忆与智能障碍等症的治疗。 规格 : 5ml : 1g 用法用量 : 静脉滴注。每日一次,每次4-6g ,用前加入到5%葡萄糖注射液或%氯化钠注射液100-250ml中,摇匀后静脉滴注。可酌情增减用量,用药疗程为2-3 周。 国外上市奥拉西坦注射液的用量范围是2-8g ,但国内尚无低于4g、高于6g 的用药经验。 不良反应 : 1.据国外文献报道,奥拉西坦的不良反应少见,偶见皮肤瘙痒、恶心、精神兴奋、睡眠紊乱,但症状较轻, 停药后可自行恢复。 2.应用本品进行了临床试验,结果显示奥拉西坦注射液组与吡拉西坦注射液的不良事件发生率无统计学差 异,未发现严重不良事件。 禁忌 : 对本品过敏者、严重肾功能损害者禁用。 注意事项 : 1.轻、中度肾功能不全者应慎用,必需使用本品时,须减量。 2.患者出现精神兴奋和睡眠紊乱时,应减量。 孕妇及哺乳期妇女用药: 本品在孕妇及哺乳期妇女使用的安全性尚不明确,因此,不应使用。 儿童用药 :
尚不明确。 老年用药 : Lecaillon JB 等对老年病人的奥拉西坦药物代谢情况进行了研究,老年人由于生理性肾功能减退,消除 半衰期 (t 1/2 β) 较健康青年人延长,曲线下面积 (AUC) 及血药峰浓度 (C max ) 均略有升高,老年人在使用本品 后消除速度稍慢,但与青年人相比无显著性差异。 药物相互作用 : 尚不明确。 药物过量 : 在超剂量使用本品的情况下偶有病人出现兴奋、失眠等不良反应,停药或减少剂量后症状可逐渐消失。 毒理研究 : 动物研究显示,奥拉西坦小鼠灌胃给药 10g/kg 、静注给药 2g/kg 和大鼠灌胃给药 10g/kg 均未见动物死 亡;未见致突变性、致癌作用及生殖毒性。 药理作用 : 奥拉西坦为吡拉西坦的类似物,可改善老年性痴呆和记忆障碍症患者的记忆和学习功能。机理研究结果 提示,奥拉西坦可促进磷酰胆碱和磷酰乙醇胺合成,提高大脑中 ATP/ADP 的比值,使大脑中蛋白质和核 酸的合成增加。 药代动力学 : 应用本品进行了人体药代动力学研究, 结果:单次静脉滴注血药峰浓度 (Cmax) 为±μ g ·ml -1 ,半衰期 (t 1/2 ) 为±,曲线下面积 0-12 ) 为±μ g ·ml -1-1 0- ∞ ) 为±μ g ·ml -1 -1 (AUC ·h ,曲线下面积 (AUC ·h ,肾排泄速率常数 (k ) 为± <>sup -1 ,平均滞留时间 (MRT)为±。多次静脉滴注血药峰浓度 C 为±· ml -1,半衰期 (T 1/2) 为±, e max 0-12 ) 为±μ g. ml -1 -1 0- ∞ ) 为±μ g ·ml -1 -1 e ) 为 曲线下面积 (AUC ·h ,曲线下面积 (AUC ·h ,肾排泄速率常数 (k ±,平均滞留时间 (MRT)为±。奥拉西坦多次静脉给药体内无蓄积;静脉给药后,血药浓度水平以及主要 的药代动力学参数在个体间差异较小; 文献资料显示: 奥拉西坦在肝、肾中分布浓度较高,除脑脊液中的半衰期为 300 分钟 ( 口服、 140 分钟 ( 静脉注射外,在 其余组织的半衰期与血浆中相似。奥拉西坦主要通过肾脏代谢, 48 小时内 90%以上的药物以原型从尿中 排出,个体间差异很小;老年人与健康年轻人的肾脏消除速度无显著性差异。 性状 : 本品为无色或几乎无色的澄明液体。 贮藏 :
奥拉西坦
奥拉西坦 【中文品名】奥拉西坦 【药效类别】脑代谢改善药>吡拉西坦类 【通用药名】OXIRACETAM 【别名】脑复智,奥拉酰胺,4-羟基脑复康, Hydroxypiracetam,Neuromet,Neuracitym,ISF-2522,CT-848 【化学名称】l-Pyrrolidineacetamide, 4-hydroxy-2-oxo- 【CA登记号】[62613-82-5] 【结构式】 【分子式】C6H10N2O3 【分子量】158.16 【收录药典】 【开发单位】ISF(意大利) 【首次上市】1984,意大利 【性状】白色结晶性粉末。mp165~168℃。 【用途】 智能促进药。可促进磷酰胆碱、磷酰乙醇胺合成和脑代谢,老龄者长期使用,可明显改善组织机能,还可提高有脑血管损伤的老年人的学习效率。用于治疗老年性脑机能不全性精神综合征及精神行为紊乱和老年性痴呆症。 【推荐合成路线】[1]
一、2-(3-乙氧甲酰-4-羟基吡咯烷-2-酮-1-基)乙酸乙酯(3)的制备 在反应瓶中,加入亚氨二乙酸乙酯648g(3.43mol),无水二氯甲烷3600ml和三乙胺572ml,于0℃滴加2-乙氧羰基乙酰氯619g(4.11mol)和二氯甲烷1.lL的溶液(内温不超过10~15℃),滴毕,于室温搅拌2h。反应毕,放置过夜,分出有机层,无水硫酸镁干燥。过滤,滤液减压回收溶剂,得油状物(2)。 在反应瓶中,加入金属钠75.6g(0.243mol)和无水乙醇2.7L的溶液,于室温下加入上步反应(2)和无水苯1.5L,加热搅拌6h。反应毕,冷却至室温,用水提取数次,合并水层。用浓酸调至pH1,过滤,干燥,得粗品(3)。乙醇重结晶,得(3)。mp175~179℃。 二、2-(2-吡咯烷-2,4-二酮-1-基)乙酸乙酯(4)的制备 在反应瓶中,加入(3)20g(0.077mol),乙腈200ml和水1.8ml,加热搅拌回流20min。反应毕,分出有机层,水层用乙腈提取数次,合并有机层,无水硫酸钠干燥。过滤,滤液减压回收溶剂,冷却,析出固体,干燥,得(4),mp87~91℃。 三、2-(4-羟基吡咯烷-2-酮-1-基)乙酸乙酯(5)的制备 在反应瓶中,加入(4)22.25g(0.12mol),无水二甲氧基乙烷445ml,冷却至0℃后,加人硼氢化钠 1.52g(0.04mol),于0~5℃中搅拌10min,室温搅拌0.5h。用20%盐酸酸化,过滤。滤液减压回收溶剂,将剩余物溶于适量二氯甲烷中,无水硫酸镁干燥。过滤,滤液回收溶剂,剩余物经色谱柱纯化,得(5),mp180℃(dec)。 四、奥拉西坦(1)的合成 在反应瓶中,加入(5)8.9g(0.048mol),甲醇300ml,于0℃下通氨至饱和,放置过夜。反应毕,减压回收溶剂。将剩余物溶于适量二氯甲烷中,加入活性炭脱色后,过滤,冷却,将其缓慢加入异丙醚200ml中,析出固体,过滤,干燥,得(l),mp161~163℃。 【其它合成路线】 详见参考文献[2~16] 【参考文献】 [1] US 1978, 4118396(DE, l977, 2635853, CA, 1977, 86:171253q)
依度沙班杂质整理总结列表
依度沙班是日本第一三共株式会社研制的小分子口服抗凝药,为凝血因子X (FXa)阻滞剂。凝血过程中,活化的凝血因子X(FXa)将凝血酶原(FII)激活成为凝血酶(FIIa),促使纤维蛋白形成,由此形成血栓,因而FXa 已成为开发新一代抗凝药物的主要靶点。依度沙班通过选择性、可逆性且直接抑制FXa 达到抑制血栓形成的口服抗凝药物,其对FXa 的选择性比FIIa 高104倍。日本国内外临床试验均证实本品可有效抑制接受下肢整形外科手术患者并发VTE,且安全可靠。我国未见依度沙班的项目申报。欧美等国家地区未上市。 以下为依度沙班杂质整理列表: 依度沙班相关杂质整理列表 中文名英文名CAS 号规格纯度结构式 依度沙班杂质1Edoxaban Impurity 11229194-11-910mg-25mg-50mg-100mg ≥99% 依度沙班杂质2Edoxaban Impurity 2480452-36-610mg-25mg-50mg-100mg ≥99% 依度沙班杂质3Edoxaban Impurity 3480452-37-7(free base)10mg-25mg-50mg-100mg ≥99%
:
依度沙班杂质9Edoxaban Impurity 9N/A 10mg-25mg-50mg-100mg ≥99% 依度沙班杂质10Edoxaban Impurity 10834919-19-610mg-25mg-50mg-100mg ≥99% 依度沙班杂质11Edoxaban Impurity 11N/A 10mg-25mg-50mg-100mg ≥99% 依度沙班杂质12Edoxaban Impurity 12767625-11-610mg-25mg-50mg-100mg ≥99% 依度沙班杂质18Edoxaban Impurity 181072-98-610mg-25mg-50mg-100mg ≥99% 依度沙班杂质19Edoxaban Impurity 191255529-23-710mg-25mg-50mg-100mg ≥99% 依度沙班杂质20Edoxaban Impurity 201255529-28-210mg-25mg-50mg-100mg ≥99%
土霉素杂质整理
土霉素相关杂质整理列表 中文名英文名 CAS 号规格纯度结构式 土霉素杂质1(土 霉素EP 杂质A)Oxytetracycline Impurity 1(Oxytetracyclin e EP Impurity A ) 14206-58-710mg-25mg-50mg-100mg ≥99%土霉素杂质2(土 霉素EP 杂质B)Oxytetracycline Impurity 2(Oxytetracyclin e EP Impurity B )60-54-810mg-25mg-50mg-100mg ≥99%土霉素杂质3(土 霉素EP 杂质C)Oxytetracycline Impurity 3(Oxytetracyclin e EP Impurity C )6542-44-510mg-25mg-50mg-100mg ≥99% 湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD 、LGC 、TLC 、EP 、USP 、TRC 等多个品牌产品,提供上万种标准品对照品,真诚为您服务。 土霉素杂质4(土 霉素EP 杂质D)Oxytetracycline Impurity 4(Oxytetracyclin e EP Impurity D )18695-01-710mg-25mg-50mg-100mg ≥99% 土霉素杂质5(土 霉素EP 杂质E)Oxytetracycline Impurity 5(Oxytetracyclin e EP Impurity E )18751-99-010mg-25mg-50mg-100mg ≥99% 土霉素杂质6(土 霉素EP 杂质F)Oxytetracycline Impurity 6(Oxytetracyclin e EP Impurity F )N/A 10mg-25mg-50mg-100mg ≥99%
奥拉西坦定义作用机制优点适应症叙述
奥拉西坦 1、奥拉西坦(oxiracetam,ORC)化学名: 2-(4-羟基吡咯烷-2-酮-1-基)-乙酰胺,其药效为吡拉西坦的3-5倍。结构式如下: 2、作用机制: 奥拉西坦(ORC)可以通过血脑屏障,主要分布在中隔区,其次海马,皮层和纹状体。 1)中线结构富含胆碱能神经元,其神经末梢与海马和皮层处的神经元广泛联系。通过对中枢网状结构的拟胆碱作用,提高Ach 的释放,并且通过突触后胆碱能受体阻断时出现的反馈机制,进而激活该系统而其作用,并通过抑制脯氨酸内肽酶作用于与记忆有关的神经肽而起作用。 2)药物本身没有直接的血管活性,也没有中枢兴奋作用,对学习
记忆能力的影响是一种持久的促进作用。ORC透过血脑屏障对 特异性中枢神经通路有刺激作用,能提高大脑对氧的利用能 力,并提高大脑对葡萄糖的利用,通过激活腺苷酸激酶提高大 脑中ATP/ADP的比值,使大脑中蛋白质和核酸的合成增加,为 大脑 正常工作提供充足的能量保障。 3)ORC可调节谷氨酸促离子α-AMPA,能选择性地和不可逆地延长离子通道开放时间,并且防止它的脱敏。ORC可增加L-谷氨酸盐激活的单通道反应的爆发长度,对AMPA受体具有正性作用。ORC对谷氨酸受体的促离子、促代谢作用,促进大脑长时程增强(LTP)的产生,增加突触后电位的时限和波幅,甚至引起长期强化后仍出现突触后电位的延长,即使受体已被致敏,ORC仍能增强突触反应,进而增强学习和记忆能力。 ORC还可以促进大脑皮质联络纤维突触的可塑性,调动未受损脑组织及功能重建,恢复神经功能,提高患者生活质量。4)蛋白激酶C(PKC)是存在于海马中的影响学习功能的蛋白,ORC 可以通过改变γ-PKC的活化反应过程,增加PKC的活性,提高学习记忆能力。 5)ORC作用后大鼠下丘脑神经元Na+电流及K+电流均增大。Na+电流的增加会提升神经元动作电位的幅值,使神经元动作电位在细胞间传导增加,而K+电流的增加会使神经元静息电位的绝对值增大,细胞膜电位负值变得更大,从而使神经元动作电位的传导更加容易;因此在细胞水平ORC可能是通过增加神经元动作电位的幅值及传导速度
硼替佐米杂质列表-杂质对照品
硼替佐米杂质列表-杂质对照品 序号杂质名称或编号英文名CAS 结构式及CAS 1硼替佐米杂质A Bortezomib Impurity A 2硼替佐米杂质B Bortezomib Impurity B 114457-94-2 3硼替佐米杂质C Bortezomib Impurity C 4硼替佐米杂质E Bortezomib Related Impurity E 5硼替佐米杂质F Bortezomib Related Impurity F 6硼替佐米杂质G Bortezomib Impurity G 7硼替佐米杂质H Bortezomib Impurity H
8硼替佐米杂质M Bortezomib Impurity M 9硼替佐米杂质N Bortezomib Impurity N 10硼替佐米RR异构 体Bortezomib Impurity (R,R- Isomer) 1132709-15-9 11硼替佐米RS异构 体Bortezomib Impurity (R,S- Isomer) 1132709-16-0 12硼替佐米SS异构 体Bortezomib Impurity (S,S-Isomer) 相关杂质1、阿考替胺杂质2、维格列汀杂质3、厄洛替尼杂质4、利伐沙班杂质5、索拉非尼杂质 6、阿伐那非杂质 7、替卡格雷杂质 8、阿哌沙班杂质 9、米格列奈杂质10、普拉克索杂质11、氨氯地平杂质12、非不司他杂质13、托法替尼杂质14、达比加群酯杂质15、埃索美拉唑钠杂质16、盐酸氨溴索杂质 17、卡格列净杂质 18 索菲布韦杂质 19、依托考昔杂质 及代理其他品牌杂质标准品(EP、USP、LGC、TRC、TLC、MC、SINCO)等。 联系电话:0 7 5 5 - 8 9 4 8 3 6 5 6 手机: 1 8 9 2 5 2 0 3 5 8 2 深圳菲斯—专注标准品
奥拉西坦研究及临床应用_0
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 奥拉西坦研究及临床应用 奥拉西坦研究及临床应用郭瑞臣山东大学齐鲁医院临床药理研究所济南 250012 奥拉西坦(Oxiracetam)化学名为: 2-(4-羟基吡咯烷-2-酮-1-基)乙酰胺,是一种新的环状 GABOB 衍生物。 1974 年由意大利首先合成,为意大利 ISF S.P.A公司开发,1987 年 12 月在意大利首次上市,商品名为 Neupan,有口服剂型和注射剂型。 国内于 1997 年 2 月批准石家庄制药集团欧意药业的胶囊剂上市(商品名欧来宁),随后该公司又开发出其注射剂。 一药理作用 1. 作用机制奥拉西坦是作用于中枢网状结构的拟胆碱能益智药,可透过血脑屏障,刺激特异性中枢神经通路;可改善思维、记忆力和学习成绩,减少休克所致的记忆力损伤;拮抗原发性高血压脑血管损伤大鼠学习能力的降低,提高大鼠皮质和海马部分乙酰胆碱的运转,增加对胆碱摄取的亲和力;可促进磷酰胆碱和磷酰乙醇胺合成,选择性地激活大脑皮层功能,改善大脑新陈代谢;可促进缺氧后 EEG 恢复,激活腺苷酸激活酶,增加 ATP 合成和能量储存,提高 ATP 转化和 RNA 合成,并有抗血小板凝聚作用。 2. 药理学研究 100、 300 或 1000mg/kg 灌胃给药几乎不影响大鼠的一般行动、自发运动、运动协调性、电击刺激导致的痉挛, 1/ 9
对兔子活体回肠运动、大鼠胆汁分泌及胃肠粘膜无明显影响。 100、 300 或 1000mg/kg,静脉注射给药不影响乌拉坦麻醉兔的呼吸、血压、心率及心电图。 奥拉西坦毒性较低。 急性毒性试验表明,灌胃给药 LD50大于 10g/kg,静脉给药LD50大于 2g/kg。 亚急性毒性试验表明,大鼠和狗灌胃给药连续 4 周每日 50、500、 3000mg/kg无死亡, 13 周每日 3000mg/kg 组大鼠兴奋性增加和有腹泻发生;狗连续静脉注射 13 周每日 25、 300、 1000mg/kg 对体重和饮食无影响,大鼠连续腹腔注射 13周,每日 1000mg/kg 组轻微增加肌氨酸酐、胆红素和 -球蛋白,可增加类脂类和高密度胆固醇。 长期毒性试验显示,大鼠灌胃给药连续 1 年每日 120、 600 和 3000mg/kg,出现软便和饮水量增加。 中高剂量组在给药开始时出现一过性饮食减少,高剂量组出现尿 pH 值降低、尿量增加、盲肠、肝、肾重量增加等,上述变化停药后即恢复正常。 奥拉西坦无致突变作用。 Ames 试验显示,奥拉西坦不增加沙门氏菌自发回复突变,即不引起基因突变; rec 试验显示,奥拉西坦不引起枯草杆菌重组缺陷性突变反应,即不破坏 DNA。 二药动学研究奥拉西坦口服吸收迅速,并分布于全身体液,
尼达尼布杂质全套结构整理
Nintedanib尼达尼布杂质结构图整理 英文名称:Nintedanib 英文同义名称:BIBF 1120,ntedanib,Vargatef 中文名称:尼达尼布 中文其他名称:尼达尼布乙烷磺酸盐 尼达尼布是由德国勃林格殷格翰公司研发的一种口服给药的三重酪氨酸激酶抑制剂,靶点包括血小板源生长因子(PDGF)、血管内皮生长因子(VEGF) 和碱性纤维母细胞生长因子(bFGF),也可抑制MAPK和Akt激活。目前主要用于肿瘤治疗,如结肠直肠癌、卵巢癌、多发性骨髓瘤等。针对呼吸系统疾病的研究主要围绕晚期非小细胞肺癌(NSCLC)和特发性肺间质纤维化(IPF) 的临床治疗开展。 2014年6月勃林格殷格翰公司宣布,尼达尼布治疗特发性肺纤维化(IPF)的上市许可申请获得欧洲药品管理局(EMA)的确认、并被EMA纳入加速审批名单。2014年10月15日,美国食品与药品管理局FDA批准尼达尼布(nintedanib,商品名:Ofev)和吡非尼酮(pirfenidone,商品名:Esbriet)两种新的口服药物用于特发性肺纤维化(IPF)治疗。IPF是一种对人类危害严重的致命性肺部疾病,患者在诊断之后的中位生存期仅为2至3年。在今天之前,尚无一种IPF治疗药物获得FDA批准。尼达尼布此前已被FDA授予突破性治疗药物的地位,此次批准也使尼达尼布成为首个、也是唯一一个获准用于治疗IPF的酪氨酸激酶抑制剂(TKI)。尼达尼布针对已被证实在肺纤维化病理机制中具有潜在影响的生长因子受体发挥作用,其中最为重要的就是血小板源性生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)和血管内皮生长因子受体(VEGFR)。通过阻断这些参与纤维化进程的信号转导通路,尼达尼布被认为有望能够通过减少肺功能下降速度、从而减缓IPF疾病进展。公司目前还在针对尼达尼布作为癌症治疗选择开展临床研发工作,包括非小细胞肺癌、卵巢癌、结直肠癌和肝细胞肝癌。 尼达尼布五种杂质为诚创合成,中杂质C和杂质D为原研杂质,既必 检杂质,五种杂质结构整理如下:
