氢、氘光谱实验报告

实验一(A ) 氢、氘光谱实验
【目的要求】
1.测定氢原子与氘原子的巴耳末系发射光谱的波长和氢原子与氘原子的里德伯常数;
2.了解WGD -8A 型组合式多功能光栅光谱仪的原理和使用方法。 【仪器用具】
氢氘灯、WGD -8A 型组合式多功能光栅光谱仪 【原 理】
光谱是研究物质微观结构的重要手段,它广泛地应用于化学分析、医药、生物、地质、冶金、考古等部门。常用的光谱有吸收光谱、发射光谱、和散射光谱,波段从X 射线、紫外线、可见光、红外光到微波和射频波段。本实验通过用光栅光谱仪测量氢原子与氘原子在可见波段的发射光谱,了解光谱与微观结构(能级)间的联系和掌握光谱测量的基本方法。 1.氢原子光谱
图1是氢原子的能级图,根据玻尔理论,氢原子的能级公式为:
22
2011
8)(n h
e n E ?-=-εμ (n = 1,2,3 … ) (1) 式中)/1/(M m m e e +=μ称为约化质量,e m 为电子质量,M 为原子核质量,氢原子的m M :等于1836.15。
电子从高能级跃迁到低能级时,发射的光子能量νh 为两能级间的能量差,
图1氢原子的能级图
)()(n E m E hv -= ( m > n ) (2)
如以波数λν
/1~=表示,则上式为 )1
1()()()()(~22m
n R m T n T hc n E m E H -=-=-=ν
(3)
式中H R 为氢原子的里德伯常数,单位是1-m ,)(n T 称为光谱项,它与能级)(n E 是对应的。从H R 可得氢原子各能级的能量
21
)(n
hc
R n E H -= (4) 式中h = 4.13567×10-15
eV ·s ,c = 2.99792×108
m·s -1
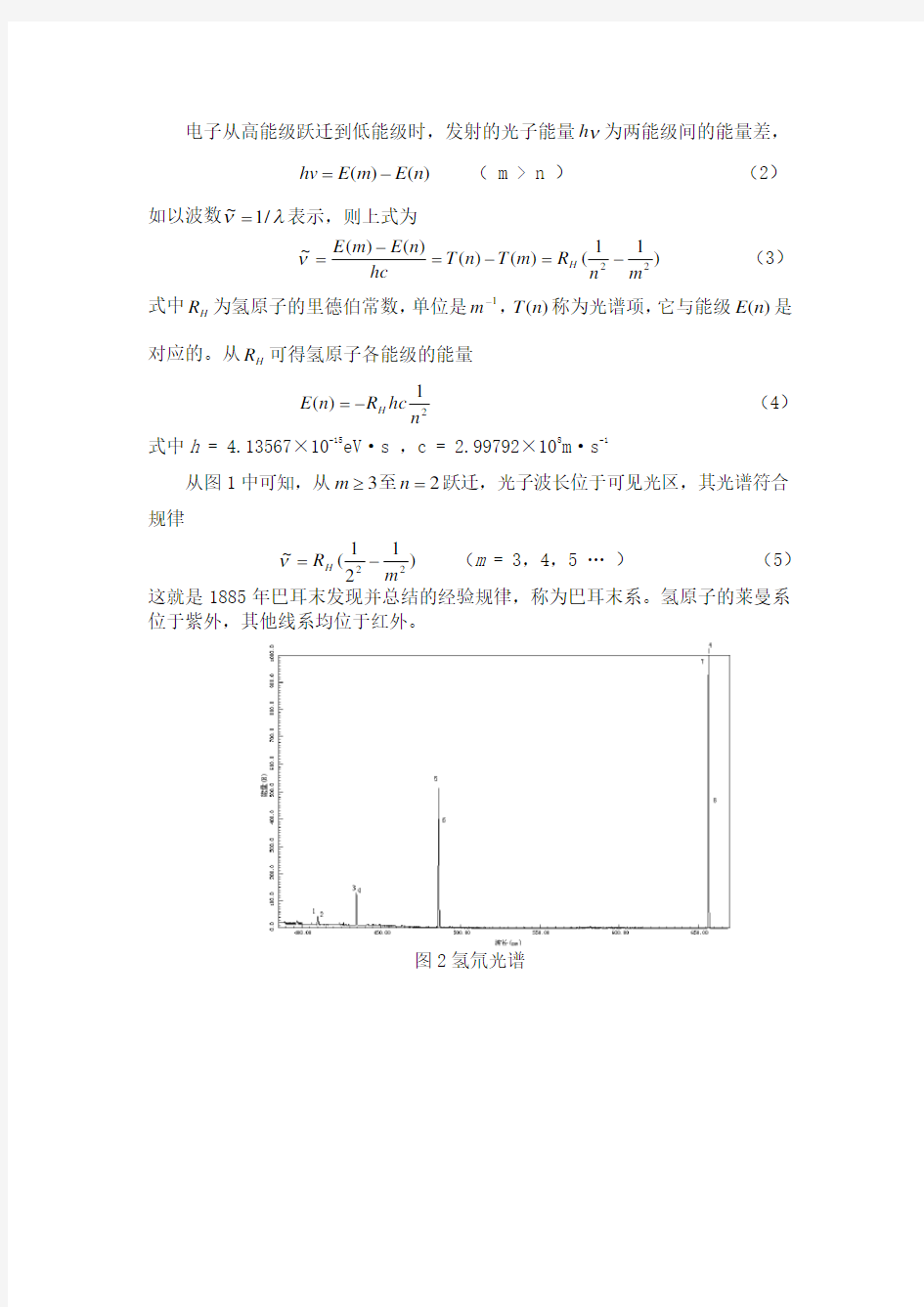
从图1中可知,从3≥m 至2=n 跃迁,光子波长位于可见光区,其光谱符合规律
)121(~22m
R H
-=ν (m = 3,4,5 … ) (5) 这就是1885年巴耳末发现并总结的经验规律,称为巴耳末系。氢原子的莱曼系位于紫外,其他线系均位于红外。
图2氢氘光谱
图3氢氘光谱巴耳尔末线系的β线
具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。氢原子核只有1个质子没有中子,氘D(又叫重氢)是氢的同位素,它的原子核由一个质子和一个中子组成。氘与氢具有相同的能级结构,因而光谱结构也相同,氢原子光谱的每一组谱线都是两条波长非常接近的谱线,一条是氢原子的谱线,一条是氘原子的谱线。
氢原子和氘原子的巴耳末线系的头几条谱线的波长为:
α线β线γ线δ线
波长 H:656.2 486.13 434.047 410.174
D:656.1 486.01 433.928 410.062
2.仪器组成:
WGD-8A型组合式多功能光栅光谱仪,由光栅单色仪,接收单元,扫描系统,电子放大器,A/D采集单元,计算机组成。该设备集光学、精密机械、电子学、计算机技术于一体,由计算机对光谱仪进行扫描控制、信号处理和光谱显示。其工作原理如图4所示。
图4光谱仪的工作原理
光谱仪的探测器为光电倍增管或CCD,用光电倍增管时,出射光通过狭缝S
2到达光电倍增管。用CCD做探测器时,转动小平面反射镜M
,使出射光通过狭缝
1
到达CCD,CCD可以同时探测某一个光谱范围内的光谱信号。
S
3
光信号经过倍增管(或CCD)变为电信号后,首先经过前置放大器放大,再经过A/D变换,将模拟量转变成数字量,最终由计算机处理显示。前置放大器的增益、光电倍增管的负高压和CCD的积分时间可以由控制软件根据需要设置。前置放大器的增益现为1,2,…,7七个档次,数越大放大器的增益越高。光电倍增管的负高压也分为1,2,…,7七个档次,数越大所加的负高压越高,每档之间负高压相差约200V。CCD的积分时间可以在10ms-40s之间任意改变。
扫描控制是利用步进电机控制正弦机构(根据光栅方程,波长和光栅的转角
成正弦关系,因此采用正弦机构。)中丝杠的转动,进而使光栅转动实现的。步
进电机在输入一组电脉冲后,就可以转动一个角度,相应地丝杠上螺母就移动一个固定的距离。每输入一组脉冲,光栅的转动便使出射狭缝出射的光波长改变0.1nm。
【实验步骤】
1.连接光栅光谱仪电源与计算机USB接口连线;
2.打开光栅光谱仪电源开关,打开氢氘灯电源开关,氢氘灯对准WGD-8A型光栅光谱仪的物镜狭缝(狭缝宽度取50),光栅光谱仪上光电倍增管狭缝取10;3.运行WGD-8A倍增管系统软件,系统进行检索;
4.设置系统参数:
工作方式:模式――能量
间隔――0.1nm
工作范围:起始波长:400nm
终止波长:660nm
最大值:1000
最小值:0
工作状态:负高压:800V(手动调节光栅光谱仪电源上负高压调节旋钮至800V,
此时软件调节不起作用,负高压越高,倍增管越灵敏)增益:3
采集次数:20
5.数据扫描:
单击“单程”选项,仪器开始扫描,计算机显示出氢原子和氘原子的可见光区域的巴尔末线系谱线,打印该光谱线图;
6.分别定量测量氢原子和氘原子的巴耳末线系谱线(系统参数的选择参考表1):将
测量结果填入表1,并打印氢原子和氘原子的巴耳末线系β谱线图。
表1:氢原子和氘原子的巴耳末线系谱线波长
原子谱
线
标准值
(nm)
选择参数
测量结
果
(nm)工作方式工作范围工作状态采
集
次
数
模
式
间
隔
(nm)
波长
(nm)
最大
值
最小
值
负高
压
增
益
氢α656.2 能
量0.01 655-657 1000 0 620V 3 50
氘656.1
氢
β486.13 能
量
0.01 485-487 1000 0 750V 3 50
氘486.01
氢
γ434.047 能
量
0.01 432-435 1000 0 800V 3 50
氘433.928
氢
δ410.174 能
量
0.01 408-412 1000 0 900V 3 50
氘410.062
7.根据测量得到的氢原子和氘原子的巴耳末线系谱线的波长,用线性拟合方法求出氢原子和氘原子的里德伯常数。
附:根据)141(~2
m R H -=ν,(6,5,4,3=m )用线性拟合求出H R 和D
R 的方法: 已测知:
nm H 2.656=αλ,nm H 13.486=βλ,nm H 047.434=γλ,nm H 174.410=δλ
根据:λ
ν
1~=,则: 11.15233~-=cm H α
ν,19.20564~-=cm H β
ν
,141.23032~-=cm H γν,11.24373~-=cm H δ
ν 令:)141(2m
x -=
3=m 时,3651=x ;4=m 时,1632=x ;5=m 时,21.03=x ;6=m 时,36
8
4=x ;
设拟合方程为:Bx A y +=,其中 ν
~=y ,)141(2
m x -=,(6,5,4,3=m )。 依据最小二乘法得:x B y A -=, 2
2
()
x y x y B x x ?-?=
-,
625.20800)1.243734.230329.205641.15232(41
141=+++==∑=i i y n y ,
18965.0)36
8
21.0163365(41141=+++==∑=i i x n x ,
4111538(15232.120564.923032.40.2124373.1)4361636i i i x y x y n =?=?=?+?+?+?=
∑
4056.134
222
42
22111538(0.21)0.036984361636
i i x x n ===+++=∑
2()0.035967x = 3944.83853x y ?=
代入解得: 6888.35-=A ,)(1965.1098671-=cm B , 根据)141(~2
m R H
-=ν、λ
ν
1~=、 ν
~=y 、)141(2
m x -=和Bx A y +=可推得: x R x B A y H
=+==ν
~
所以:x
x
B A R H +=
,代入数据得: 氢的里德伯常数)(100973731.117-?=m R H 。 氘的里德伯常数:
氢和氘的相应波长差为:
)1()~~1()~1~11()1(D
H H D H H H D
H H D H D H R R -=-=-=-=-=?λννλννλλλλλλλ
因为:)141(~2m R H H -=ν,)141(~2
m R D
D -=ν 所以,D
H D
H R
R
=νν~~
得:
)
1(H
H
D R R λ?-=
根据图3氢氘光谱巴耳尔末线系的β线波长及氢的里德伯常数为:
)(13.486nm H =λ
)(01.486nm D =λ,)(12.001.48613.486nm =-=?λ,)(01.1096791-=cm R H ,代
入上式
得:)(09.1097061-=cm R D 。
实验一 (B) 氢原子光谱的研究 -用光学多道分析器研究氢原子光谱
【目的要求】
1.测定氢原子的巴耳末系发射光谱的波长和氢原子的里德伯常数。 2.了解光学多道分析器的原理和使用方法。 【仪器用具】
汞灯,氢氘灯,WGD -6型光学多道分析器。 【原 理】
光谱是研究物质微观结构的重要手段,它广泛地应用于化学分析、医药、生物、地质、冶金、考古等部门。常用的光谱有吸收光谱、发射光谱和散射光谱,波段从X 射线、紫外线、可见光、红外光到微波和射频波段。本实验通过用光学多道分析器测量氢原子在可见波段的发射光谱,了解光谱与微观结构(能级)间的联系和掌握光谱测量的基本方法。 1.氢原子光谱
图1是氢原子的能级图,根据玻尔理论,氢原子的能级公式为:
22
2011
8)(n
h e n E ?-=-εμ (n = 1,2,3 … ) (1)
式中)/1/(M m m e e +=μ称为约化质量,e m 为电子质量,M 为原子核质量,氢原子的m M :等于1836.15。
电子从高能级跃迁到低能级时,发射的光子能量νh 为两能级间的能量差:
)()(n E m E hv -= ( m > n ) (2)
如以波数λν
/1~=表示,则上式为: )1
1()()()()(~22m
n R m T n T hc n E m E H -=-=-=ν
(3)
式中H R 为氢原子的里德伯常数,单位是1-m ,)(n T 称为光谱项,它与能级)(n E 是
对应的。从H R 可得氢原子各能级的能量
2
1
)(n hc
R n E H -= (4) 式中h = 4.13567×10-15eV ·s ,c = 2.99792×108m·s -1
从图1中可知,从3≥m 至2=n 跃迁,光子波长位于可见光区,其光谱符合规律
)121(~22m
R H
-=ν (m = 3,4,5 … ) (5) 这就是1885年巴耳末发现并总结的经验规律,称为巴耳末系。氢原子的莱曼系位于紫外,其他线系均位于红外。
图1氢原子的能级图
图2氢原子的巴耳末系光谱
氢原子的巴耳末线系的头几条谱线的波长为:
α线β线γ线δ线
波长(nm) 656.2 486.13 434.047 410.174
2.仪器组成:
光学多道分析器是一台多功能光栅光谱仪,由光栅单色仪,CCD接收单元,扫描系统,电子放大器,A/D采集单元,计算机组成。该设备集光学、精密机械、电子学、计算机技术于一体,由计算机对光谱仪进行扫描控制、信号处理和光谱显示。
光学多道检测系统的基本框图如图3所示。
图3 光学多道分析器框图
入射光经多色仪色散后在其出射窗口形成λ
1-λ
2
的谱带。位于出射窗口的
多通道光电探测器将谱带的强度分布转变为电荷强弱的分布,由信号处理系统扫描、读出、经A/D变换后存储并显示在计算机上。
光学多道分析器的优点是所有的像元(N个)同时曝光,整个光谱可同时取得,比一般的单通道光谱系统检测同一波段的总时间快N倍。在摄取一段光谱的过程中不需要谱仪进行机械扫描,不存在由于机械系统引起的波长不重复的误差,减少了光源强度不稳定引起的谱线相对强度误差,可测量光谱变化的动态过程。
多色仪及光源部分的光路见图4。光源S经透镜L成像于多色仪的入射狭缝
S 1,入射光经平面反射镜M
1
转向90°,再经球面反射镜M
2
反射后成为平行光射
向平面衍射光栅G。衍射后的平行光束经球面反射镜M
3和平面镜M
4
成像于观察屏
P。由于各波长光的衍射角不同,P处形成以一波长λ
为中心的一条光谱带,观察者可在P上直观地观察到光谱。转动光栅G可改变中心波长,整条谱带也随之
移动。多色仪上有显示中心波长的波长计。转开平面镜M
4,可使M
3
直接成像于
光电探测器CCD上,它测量的谱段与观察屏P上看到的完全一致。
图4 多色仪光学原理图
CCD是电荷耦合器件(Charge-Coupled Device)的简称,是一种以电荷量表示光强大小,用耦合方式传输电荷量的器件,它具有自扫描、光谱范围宽、动态范围大、体积小、功耗低、寿命长、可靠性高等优点。将CCD一维线阵放在光谱面上,一次曝光就可获得整个光谱。目前,二维面阵CCD已大量用于摄像机和数字照相机。
图5 CCD示意图
衬底是P型Si,硅表面是一层二氧化硅薄膜,膜上是一层金属作电极,这样硅和金属之间形成一个小电容。如果金属电极置于高电位,在金属面积累了一层正电荷,P型半导体中带正电荷的空穴被排斥,只剩下不能移动的带负电荷的受主杂质离子,形成一耗尽层,受主杂质离子因不能自由移动对导电作用没有任何贡献。在耗尽区内或附近,由于电子的作用产生电子-空穴对,电子被吸引到半导体与SiO
2
绝缘体的界面形成电荷包,这些电子是可以传导的。电荷包中电子的数目与入射光强和曝光时间成正比,很多排列整齐的CCD像元组成一维或二维CCD陈列,曝光后一帧光强分布图将成为一帧电荷分布图。
仪器采用的是有2048个像元的CCD一维线阵,其光谱响应范围为200-1000nm,响应峰值在550nm,动态范围大于210。每个像元的尺寸为14μm×
14μm,像元中心距为14μm,像敏区总长为28.672mm。多色仪中M
2,M
3
的焦距
为302mm ,光栅常数为1/600mm ,在可见光区的线色散Δλ/Δl (光谱面上单位宽度对应的波长范围)约为5.55nm/mm ,由此可知CCD 一次测量的光谱范围为5.55×28.67约为159nm 。光谱分辨率即两个像元之间波长相差约0.077nm 。在OMA 中每个像元称为一“道”,本实验的系统是2048道光学多道分析器。
每次采样(曝光)后,每个像元内的电荷在时钟脉冲的控制下顺序输出,经放大、模数(A/D )转换,将电荷量即光强顺序存入采集系统(微机)的存储器,经微机处理后,在显示器上就可以看到光谱图。移动光谱图上的光标,屏上即显示出光标所处的道数和相对光强值。 【实验步骤】
由于αH 线的波长为656.28nm ,H δ线为410.17nm ,波长间隔达246nm 。超过CCD 一次测量的光谱范围159nm 的范围,所以要分两次测量。测量H α线(波长为656.28nm )时的波长时,采用汞灯的(546.07nm ,576.96 nm ,579.07 nm )三条谱线作为标准谱线来定标;测量H β,H γ,H δ线(波长分别为486.13nm ,434.047nm ,410.174nm )的波长时,采用汞灯的(404.66nm , 407.78nm ,435.84nm )三条谱线作为标准谱线来定标。
图6 汞光谱线
序号 波长nm 相对强度 序号
波长nm 相对强度 序号
波长nm 相对强度
1 365.0
2 458.9
4 404.66 893.8 7 546.07 893.
5 2 365.4
6 160.2
5 407.78 86.9 8 576.9
6 113.3 3 366.30 109.9
6 435.84 996.3 9
579.07 101.3
1. 启动计算机,打开WGD-6型光栅光谱仪电源,运行Wgd-6型光学多道分析器
控制处理程序。 2. 设置工作参数:
暴光时间(采集谱线的积分时间):选择暴光时间为10。
(方法:用鼠标左键选中暴光时间调节窗口上,通过方向键“→”或“←”增加或减少暴光时间)
平均次数(对谱线数据进行平均的次数):选择平均次数为1。
累加次数(对谱线进行多次采集进行累加的次数):选择累加次数为1。 (增加曝光时间、平均次数和累加次数可增加信噪比和提高弱峰的计数。)
最大值(坐标显示的谱线相对光强的最大值):选择最大值为5000。最小值(坐标显示的谱线相对光强的最小值):选择最小值为1。
3.测量H
β,H
γ
,H
δ
的波长。
(1)定标:
①将光学多道分析器中心波长调到450 nm:单击任务栏中“检索”,在出现的
对话框中的当前位置波长处,键入450,单击“确定”。
②调节光源与多色仪共轴:将低压汞灯与汞(钠)灯电源连接,打开电源电亮
汞灯,将汞灯光源对准多色仪的入射狭缝,调节汞灯与多色仪,将多色仪观察转换扳手放在“观察缝”档,在观察屏P上观察谱线,直到看到清晰、明亮的紫色(435.84nm)水银谱线,使汞灯光源与多色仪共轴。
③将多色仪观察转换扳手放在“CCD”档,即转动M
4
使光谱照到CCD上,单击任务栏中“时实”,屏幕上会出现汞的谱线,由于谱线强度不同,对不同的谱线可选用不同的狭缝宽度。调节入射狭缝宽度,可获得清晰、尖锐的三条谱线(404.66nm, 407.78nm,435.84nm)。
④用汞的404.66nm, 407.78nm,435.84nm三条标准谱线定标,使横坐标表示
波长(nm)。在出现汞的清晰、尖锐的三条谱线后,单击任务栏中“数据处理”,在下拉菜单中选择“手动定标”,此时光标变成十字形状,将光标移到第一条光谱线上,此时光标变成红色的“?“形状,利用键盘上的方向键将光标移到该谱线的最高处,单击“回车”键,在出现的对话框中波长处输入404.66。点击对话框中“添加下一点“选项,光标又变成十字形状,再将光标移到第二条光谱线上的最高处,单击“回车”键,在出现的对话框中波长处输入407.78,再点击对话框中“添加下一点”选项,将光标移到第三条光谱线上的最高处,单击“回车”键,在对话框中波长处输入435.84,点击对话框中“添加定标”选项,在出现的最小二乘法定标对话框中,选“线性定标”选项,关闭对话框,此时横坐标表示波长(nm)。关闭汞灯,完成定标工作。
(2)测量H
β,H
γ
,H
δ
的波长。
将氢氘灯电源与氢氘灯连接,打开氢氘灯电源,点亮氢灯,单击任务栏中“时
实”,屏幕上会出现氢的H
β,H
γ
,H
δ
三条谱线,调节氢灯的位置,使谱线强度
为最强。单击任务栏中“数据处理”,在下拉菜单中选择“读取谱线数据”选项,光标变成十字形状,将光标移到所测的光谱线上的最高处,读出该谱线的波长并记录到表格中。
4.测量H
α
线的波长。将多色仪的中心波长调至600nm,用汞灯的(546.07nm,
576.96 nm,579.07 nm)三条谱线定标后,再测出H
α
线的波长并记录到表
格中。
5.列表
6.根据式5求出R H。
7.根据式4画出n = 1,2,3…6及n及∞的能级图,单位用eV,小数后2位,
并标出H
α,Hβ,Hγ,Hδ,各线是对应哪两个能级的跃迁。
氢原子光谱_实验报告
氢原子光谱 摘 要:本实验用光栅光谱仪对氢原子光谱进行测量,测得了氢原子光谱巴尔末线系的波长,求出了里德伯常数。最后对本实验进行了讨论。 关键词:氢原子光谱,里德伯常数,巴尔末线系,光栅光谱仪 1. 引言 光谱线系的规律与原子结构有内在的联系,因此,原子光谱是研究原子结构的一种重要方法。1885年巴尔末总结了人们对氢光谱测量的结果,发现了氢光谱的规律,提出了著名的巴尔末公式,氢光谱规律的发现为玻尔理论的建立提供了坚实的实验基础,对原子物理学和量子力学的发展起过重要作用。1932年尤里根据里德伯常数随原子核质量不同而变化的规律,对重氢赖曼线系进行摄谱分析,发现氢的同位素氘的存在。通过巴尔末公式求得的里德伯常数是物理学中少数几个最精确的常数之一,成为检验原子理论可靠性的标准和测量其他基本物理常数的依据。 2. 氢原子光谱 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 (1) 式中λH 为氢原子谱线在真空中的波长。 λ0=364.57nm是一经验常数。 n取3,4,5等整数。 若用波数表示,则上式变为 (2) 式中RH 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 (3) 式中M为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,ε0为真空 42 2 0-=n n H λλ??? ??-==22 1211~n R v H H H λ)/1()4(23202 42M m ch z me R z += πεπ
红外光谱(FTIR)实验报告
红外光谱仪调查及实验报告 第一部分红外光谱仪调查 1.1 简介 傅里叶红外光谱仪: 全名为傅里叶变换红外光谱仪(Fourier Transform Infrared Spectrometer,FTIR Spectrometer),是基于对干涉后的红外光进行傅里叶变换的原理而开发的红外光谱仪,主要由红外光源、光阑、干涉仪(分束器、动镜、定镜)、样品室、检测器以及各种红外反射镜、激光器、控制电路板和电源组成。傅里叶红外光谱仪不同于色散型红外分光的原理,可以对样品进行定性和定量分析,广泛应用于医药化工、地矿、石油、煤炭、环保、海关、宝石鉴定、刑侦鉴定等领域。 滤光片型近红外光谱仪器: 滤光片型近红外光谱仪器以滤光片作为分光系统,即采用滤光片作为单色光器件。滤光片型近红外光谱仪器可分为固定式滤光片和可调式滤光片两种形式,其中固定滤光片型的仪器时近红外光谱仪最早的设计形式。仪器工作时,由光源发出的光通过滤光片后得到一宽带的单色光,与样品作用后到达检测器。 色散型近红外光谱仪器: 色散型近红外光谱仪器的分光元件可以是棱镜或光栅。为获得较高分辨率,现代色散型仪器中多采用全息光栅作为分光元件,扫描型仪器通过光栅的转动,使单色光按照波长的高低依次通过样品,进入检测器检测。根据样品的物态特性,可以选择不同的测样器件进行投射或反射分析。 傅里叶变换型近红外光谱仪器: 傅里叶变换近红外分光光度计简称为傅里叶变换光谱仪,它利用干涉图与光谱图之间的对应关系,通过测量干涉图并对干涉图进行傅里叶积分变换的方法来测定和研究近红外光谱。其基本组成包括五部分:①分析光发生系统,由光源、分束器、样品等组成,用以产生负载了样品信息的分析光;②以传统的麦克尔逊干涉仪为代表的干涉仪,以及以后的各类改进型干涉仪,其作用是使光源发出的光分为两束后,造成一定的光程差,用以产生空间(时间)域中表达的分析光,即干涉光;③检测器,用以检测干涉光;④采
光谱分析实验报告
. 1 实验报告 课程名称: 材料科学基础实验 指导老师: 乔旭升 成绩: 实验名称: 光谱分析 实验类型: 同组学生: 一、实验目的和要求(必填) 三、主要仪器设备(必填) 五、实验数据记录和处理 七、讨论、心得 二、实验容和原理(必填) 四、操作方法和实验步骤 六、实验结果与分析(必填)一、实验目的 通过本实验了解紫光/可见光光度计、傅里叶变换红外光谱仪(FTIR )和荧光光谱仪的基本原理、主要用途和实际操作过程。掌握玻璃透光率、薄膜吸收光谱、固体粉末红外光谱和固 体发光材料荧光光谱的测试方法。学习分析影响测试结果的主要因素。 二、实验原理 电磁波可与多种物质相互作用。如果这种作用导致能量从电磁波转移至物质,就称为吸收。当光波与某一受体作用时,光子和接受体之间就存在碰撞。光子的能量可被传递给接受体而被吸收,由此产生吸收光谱。通常紫外和可见光的能量接近于某两个电子能级地能量差,故紫外与可见光吸收光谱起源于价电子在电子能级之间的跃迁,又称为电子光谱。 当一束平行单色光照射到非散射的均匀介质时,光的一部分将被介质所反射,一部分被介质吸收,一部分透过介质。如果入射光强度为I0.反射光强度为Ir ,吸收光强度为Ia ,透过光强度为It ,则有I0=Ir+Ia+It 投射光强度与入射光强度之比称为透光率 T=It/I0 当一束具有连续波长的红外光照射某化合物时,其分子要吸收一部分光能转变为分子的震专业: 材料0902 姓名: 王应恺 学号: 3090100481 日期: 11.29 地点: 曹楼230 装 订 线
动能量或转动能量。此时若将其透过的光用单色器进行色散,就可得到一带暗条的谱带。以红外光的波长或波数为横坐标,以吸收率或者透过率百分数为纵坐标,把该谱带记录下来,就可得到该化合物的红外吸收光谱图。不同的化合物均有标准特征谱,将实验所得的光谱与标准谱对照,就可进行分子结构的基础研究和化合组成的分析。可由吸收峰的位置和形状来推知被测物的结构,按照特征峰的强度来测定混合物中各组分的含量。 当分子吸收来自光辐射的能量后,其本身就由处于稳定的基态跃迁至不稳定的激发态:M+hν→。激发态是不稳定的,寿命极短,激发态分子会迅速以向周围散热或再发射电磁波(荧光或磷光)的方式回到基态:→M+荧光(或磷光)。任何能产生荧光(或磷光) 的物质都具有两个特征光谱:激发光谱和发射光谱。 激发光谱:荧光(或磷光)为光致发光,因此必须选择合适的激发光波长,这可通过激发光谱曲线来确定。选择荧光(或磷光)的最大发射波长为测量波长(监控波长),改变激发光的波长,测量荧光强度变化。以激发光波长为横坐标,荧光强度为纵坐标作图,即可获得激发光谱。激发光谱形状与吸收光谱形状极为相似,经校正后的激发光谱与吸收光谱不仅形状相同,而且波长位置一致。这是因为物质吸收能量的过程就是激发过程。 发射光谱:将激发波长固定在最大激发波长处,然后扫描发射波长,测定不同波长处的荧光(或磷光)强度,即可得到荧光(或磷光)发射光谱。 三、仪器简介 1.紫外/可见光分光光度计 PE公司的Lambda20双光束紫外/可见光分光光度计,测量光谱围190-1100nm;杂散光0.01%T;波长精度0.1nm;最高扫描速度2880nm/min。该仪器的整个操作过程可完全由计算机控制,随机提供的UV-Winlab窗口式操作软件,使样品测试、结果处理、图形变换
无水乙醇红外光谱分析实验报告
竭诚为您提供优质文档/双击可除无水乙醇红外光谱分析实验报告 篇一:红外光谱分析实验报告 一、【实验题目】 红外光谱分析实验 二、【实验目的】 1.了解傅立叶变换红外光谱仪的基本构造及工作原理 2.掌握红外光谱分析的基础实验技术 3.学会用傅立叶变换红外光谱仪进行样品测试 4.掌握几种常用的红外光谱解析方法 三、【实验要求】 利用所学过的红外光谱知识对碳酸钙、聚乙烯醇、丙三醇、乙醇的定性分析制定出合理的样品制备方法;并对其谱图给出基本的解析。 四、【实验原理】 红外光是一种波长介于可见光区和微波区之间的电磁波谱。波长在0.78~300μm。通常又把这个波段分成三个区域,即近红外区:波长在0.78~2.5μm(波数在12820~
4000cm-1),又称泛频区;中红外区:波长在2.5~25μm(波数在4000~400cm-1),又称基频区;远红外区:波长在25~300μm(波数在400~33cm-1),又称转动区。其中中红外区是研究、应用最多的区域。 红外区的光谱除用波长λ表征外,更常用波数(wavenumber)σ表征。波数是波长的倒数,表示单位厘米波长内所含波的数目。其关系式为: 作为红外光谱的特点,首先是应用面广,提供信息多且具有特征性,故把红外光谱通称为"分子指纹"。它最广泛的应用还在于对物质的化学组成进行分析。用红外光谱法可以根据光谱中吸收峰的位置和形状来推断未知物的结构,依照特征吸收峰的强度来测定混合物中各组分的含量。其次,它不受样品相态的限制,无论是固态、液态以及气态都能直接测定,甚至对一些表面涂层和不溶、不熔融的弹性体(如橡胶)也可直接获得其光谱。它也不受熔点、沸点和蒸气压的限制,样品用量少且可回收,是属于非破坏分析。而作为红外光谱的测定工具-红外光谱仪,与其他近代分析仪器(如核磁共振波谱仪、质谱仪 等)比较,构造简单,操作方便,价格便宜。因此,它已成为现代结构化学、分析化学最常用和不可缺少的工具。根据红外光谱与分子结构的关系,谱图中每一个特征吸收谱带都对应于某化合物的质点或基团振动的形式。因此,特征吸收
光谱分析 实验报告
实验报告 课程名称: 材料科学基础实验 指导老师: 乔旭升 成绩: 实验名称: 光谱分析 实验类型: 同组学生姓名: 一、实验目的和要求(必填) 三、主要仪器设备(必填) 五、实验数据记录和处理 七、讨论、心得 二、实验内容和原理(必填) 四、操作方法和实验步骤 六、实验结果与分析(必填)一、实验目的 通过本实验了解紫光/可见光光度计、傅里叶变换红外光谱仪(FTIR )和荧光光谱仪的基本原理、主要用途和实际操作过程。掌握玻璃透光率、薄膜吸收光谱、固体粉末红外光谱和固体发光材料荧光光谱的测试方法。学习分析影响测试结果的主要因素。 二、实验原理 电磁波可与多种物质相互作用。如果这种作用导致能量从电磁波转移至物质,就称为吸收。当光波与某一受体作用时,光子和接受体之间就存在碰撞。光子的能量可被传递给接受体而被吸收,由此产生吸收光谱。通常紫外和可见光的能量接近于某两个电子能级地能量差,故紫外与可见光吸收光谱起源于价电子在电子能级之间的跃迁,又称为电子光谱。 当一束平行单色光照射到非散射的均匀介质时,光的一部分将被介质所反射,一部分被介质吸收,一部分透过介质。如果入射光强度为I0.反射光强度为Ir ,吸收光强度为Ia ,透过光强度为It ,则有I0=Ir+Ia+It 投射光强度与入射光强度之比称为透光率 T=It/I0 当一束具有连续波长的红外光照射某化合物时,其分子要吸收一部分光能转变为分子的震动能量或转动能量。此时若将其透过的光用单色器进行色散,就可得到一带暗条的谱带。以红外光的波长或波数为横坐标,以吸收率或者透过率百分数为纵坐标,把该谱带记录下来,就可得到该化合物的红外吸收光谱图。不同的化合物均有标准特征谱,将实验所得的光谱与标准谱对照,就可进行分子结构的基础研究和化合组成的分析。可由吸收峰的位置和形状来推知被测物的结构,按照特征峰的强度来测定混合物中各组分的含量。 当分子吸收来自光辐射的能量后,其本身就由处于稳定的基态跃迁至不稳定的激发态: M+h ν→。激发态是不稳定的,寿命极短,激发态分子会迅速以向周围散热或再发射电磁波(荧光或磷光)的方式回到基态: →M+荧光(或磷光)。任何能产生荧光(或磷光)的物质都具有两个特征光谱:激发光谱和发射光谱。 激发光谱:荧光(或磷光)为光致发光,因此必须选择合适的激发光波长,这可通过激发
红外光谱分析实验报告
仪器分析实验 实验名称:红外光谱分析实验 学院:化学工程学院专业:化学工程与工艺班级: 姓名:学号: 指导教师: 日期:
一、 实验目的 1、掌握溴化钾压片法制备固体样品的方法; 2、学习并掌握美国尼高立IR-6700型红外光谱仪的使用方法; 3、初步学会对红外吸收光谱图的解析。 二、实验原理 红外光是一种波长介于可见光区和微波区之间的电磁波谱。波长在0.75~1000μm 。通常又把这个波段分成三个区域,即近红外区:波长在0.75~2.5μm (波数在13300~4000cm -1),又称泛频区;中红外区:波长在 2.5~50μm (波数在4000~200cm -1),又称振动区;远红外区:波长在50~1000μm (波数在200~10cm -1),又称转动区。其中中红外区是研究、应用最多的区域。 红外区的光谱除用波长λ表征外,更常用波数σ表征。波数是波长的倒数,表示单位厘米波长内所含波的数目。其关系式为: )(10)(4 1 cm cm λσ=- 三、仪器和试剂 1、仪器: 美国尼高立IR-6700 2、试剂: 溴化钾,聚乙烯,苯甲酸 3、傅立叶红外光谱仪(FTIR)的构造及工作原理 计算机检测器样品室干涉仪光源?→??→??→??→? 四、实验步骤 1、打开红外光谱仪并稳定大概5分钟,同时进入对应的计算机工作站。 2、波数检验:将聚乙烯薄膜插入红外光谱仪的样品池处,从4000-650cm -1进行 波数扫描,得到吸收光谱。然后将所得的谱图与计算机上的标准谱图进行匹配,分析得到最吻合的图谱,即可判断物质结构。 3、测绘苯甲酸的红外吸收光谱——溴化钾压片法 取1-2mg 苯甲酸,加入在红外灯下烘干的100-200mg 溴化钾粉末,在玛瑙研钵中充分磨细(颗粒约2μm ),使之混合均匀。取出约80mg 混合物均匀铺洒在干净的压模内,于压片机上制成直径透明薄片。将此片装于固体样品架上,样品架插入红外光谱仪的样品池处,从4000-400cm -1进行波数扫描,得到吸收光谱。然后将所得的谱图与计算机上的标准谱图进行匹配。 4、结束实验,关闭工作站和红外光谱仪。
实验1紫外-可见吸收光谱实验报告
实验一:紫外-可见吸收光谱 一、实验目的 1.熟悉和掌握紫外-可见吸收光谱的使用方法 2.用紫外-可见吸收光谱测定某一位置样品浓度 3.定性判断和分析溶液中所含物质种类 二、实验原理 紫外吸收光谱的波长范围在200~400,可见光吸收光谱的波长在400~800,两者都属于电子能谱,两者都可以用朗伯比尔(Lamber-Beer’s Law)定律来描述 A=ε bc 其中A为吸光度;ε为光被吸收的比例系数;c为吸光物质的浓度,单位mol/L; b为吸收层厚度,单位cm 有机化合物的紫外-可 见吸收光谱,是其分子中外 层价电子跃迁的结果,其中 包括有形成单键的σ电子、 有形成双键的π电子、有未 成键的孤对n电子。外层 电子吸收紫外或者可见辐 射后,就从基态向激发态(反键轨道)跃迁。主要有四种跃迁,所需能量ΔE 大小顺序为σ→σ*>n→σ*>π→π>n→π*
三、实验步骤 1、开机 打开紫外-可见分光光度计开关→开电脑→软件→联接→M(光谱方法)进行调节实验需要的参数:波长范围700-365nm 扫描速度高速;采样间隔:0.5nm 2、甲基紫的测定 (1)校准基线 将空白样品(水)放到比色槽中,点击“基线”键,进行基线校准 (2)标准曲线的测定 分别将5ug/ml、10ug/ml 、15ug/ml 、20ug/ml甲基紫溶液移入比色皿(大约2/3处),放到比色槽中,点击“开始”键,进行扫描,保存 (3)测定试样 将试样甲基紫溶液移入比色皿(大约2/3处),放到比色槽中,点击“开始” 键,进行扫描,保存 3、甲基红的测定 (1)校准基线
将空白样品(乙醇)放到比色槽中,点击“基线”键,进行基线校准 (2)测定试样 将试样甲基紫溶液移入比色皿(大约2/3处),放到比色槽中,点击“开始” 键,进行扫描,保存 四、实验结果 1.未知浓度的测定 分别测定了5μg/ml,10μg/ml,15μg/ml,20μg/ml和未知浓度的甲基紫溶液的紫外吸收光谱,紫外吸收谱图如下: 甲基紫在580nm是达到最大吸收见下表: 浓度/μg*ml-1吸光度 50.665 10 1.274 15 2.048 20 2.659
原子吸收光谱实验报告
原子吸收光谱定量分析实验报告 班级:环科10-1 姓名:王强学号:27 一、实验目的: 1.了解石墨炉原子吸收分光光度计的使用方法。 2.了解石墨炉原子吸收分光光度计进样方法及技术关键。 3.学会以石墨炉原子吸收分光光度法进行元素定量分析的方法。 二、实验原理: 在原子吸收分光光度分析中,火焰原子吸收和石墨炉原子吸收是目前使用最多、应用范围最广的两种方法。相对而言,前者虽然具有振作简单、重现性好等优点而得到广泛应用,但该法由于雾化效率低、火焰的稀释作用降低了基态原子浓度、基态原子在火焰的原子化区停留时间短等因素限制了测定灵敏度的提高以及样品使用量大等方面的原因,对于来源困难、鹭或数量很少的试样及固态样品的直接分析,受到很大的限制。石墨炉原子化法由于很好地克服了上述不足,近年来得到迅速的发展。 石墨炉原子吸收方法是利用电能使石墨炉中的石墨管温度上升至2000 ~ 3000 ℃的高温,从而使待测试样完全蒸发、充分的原子化,并且基态原子在原子化区停留时间长,所以灵敏度要比火焰原子吸收方法高几个数量级。样品用量也少,仅5 ~ 100 uL。还能直接分析固体样品。该方法的缺点是干扰较多、精密度不如火焰法好、仪器较昂贵、操作较复杂等。 本实验采用标准曲线法,待测水样品用微量分液器注入,经过干燥、灰化、原子化等过程对样品中的痕量镉进行分析。 三、仪器和试剂: 1.仪器 由北京瑞利分析仪器公司生产的WFX-120型原子吸收分光光度计。 镉元素空心阴极灯 容量瓶 50 mL(5只)微量分液器 ~ mL及5 ~ 50 uL
2.试剂 100 ng/mL镉标准溶液(1%硝酸介质) 2 mol/L硝酸溶液 四、实验步骤: 1.测定条件 分析线波长: nm 灯电流:3 mA 狭缝宽度: nm 干燥温度、时间:100℃、15 s 灰化温度、时间:400℃、10 s 原子化温度、时间:2200℃、3 s 净化温度、时间:2200℃、2 s 保护气流量:100 mL/min 2.溶液的配制 取4只50 mL容量瓶,分别加入0 mL、 mL、 mL、 mL浓度为100 ng/mL的镉标准溶液,再各添加 mL硝酸溶液(2 mol/L),然后以Milli-Q去离子水稀释至刻度,摇匀,供原子吸收测定用。 取水样500 mL于烧杯中,加入5 mL浓硝酸溶液,加热浓缩后转移至50 mL 容量瓶,以Milli-Q去离子水稀释至刻度,摇匀,此待测水样供原子吸收测定用。3.吸光度的测定 设置好测定条件参数,待仪器稳定后,升温空烧石墨管,用微量分液器由稀到浓向石墨管中依次注入40 uL标准溶液及待测水样,测得各份溶液的吸光度。 五、数据记录:
南京大学-氢原子光谱实验报告
氢原子光谱 一.实验目的 1.熟悉光栅光谱仪的性能和用法 2.用光栅光谱仪测量氢原子光谱巴尔末系数的波长,求里德伯常数 二.实验原理 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 2 024 H n n λλ=- (1) 式中H λ为氢原子谱线在真空中的波长。0364.57nm λ=是一经验常数。n 取3,4,5等整数。 若用波数表示,则上式变为 221 112H H R n νλ?? = =- ??? (2) 式中H R 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 () () 242 2 3 0241/Z me Z R ch m M ππε= + (3) 式中M 为原子核质量,m 为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,0ε为真空介电常数,Z 为原子序数。 当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)
() 242 2 3 024me Z R ch ππε∞= (4) 所以 () 1/Z R R m M ∞ = + (5) 对于氢,有 () 1/H H R R m M ∞ =+ (6) 这里H M 是氢原子核的质量。 由此可知,通过实验测得氢的巴尔末线系的前几条谱线j 的波长,借助(6)式可求得氢的里德伯常数。 里德伯常数R ∞是重要的基本物理常数之一,对它的精密测量在科学上有重要意义,目前它的推荐值为()=10973731.56854983/R m ∞ 表1为氢的巴尔末线系的前四条波长表 表1 氢的巴尔末线系波长 值得注意的是,计算H R 和R ∞时,应该用氢谱线在真空中的波长,而实验是在空气中进行的,所以应将空气中的波长转换成真空中的波长。即1λλλ?真空空气=+,氢巴尔末线系前6条谱线的修正值如表2所示。 表2 真空—空气波长修正值
固体红外光谱实验报告
KBr压片法测定固体样品的红外光谱 一、实验目的 1、掌握红外光谱分析法的基本原理。 2、掌握Nicolet5700智能傅立叶红外光谱仪的操作方法。 3、掌握用KBr压片法制备固体样品进行红外光谱测定的技术和方法。 4、了解基本且常用的KBr压片制样技术在红外光谱测定中的应用。 5、通过谱图解析及标准谱图的检索,了解由红外光谱鉴定未知物的一般过程。 二、仪器及试剂 1 仪器:美国热电公司Nicolet5700智能傅立叶红外光谱仪;HY-12型手动液压式红外压片机及配套压片模具;磁性样品架;红外灯干燥器;玛瑙研钵。 2 试剂:苯甲酸样品(AR);KBr(光谱纯);无水丙酮;无水乙醇。 三、实验原理 红外吸收光谱法是通过研究物质结构与红外吸收光谱间的关系,来对物质进行分析的,红外光谱可以用吸收峰谱带的位置和峰的强度加以表征。测定未知物结构是红外光谱定性分析的一个重要用途。根据实验所测绘的红外光谱图的吸收峰位置、强度和形状,利用基团振动频率与分子结构的关系,来确定吸收带的归属,确认分子中所含的基团或键,并推断分子的结构,鉴定的步骤如下: (1)对样品做初步了解,如样品的纯度、外观、来源及元素分析结果,及物理性质(分子量、沸点、熔点)。 (2)确定未知物不饱和度,以推测化合物可能的结构; (3)图谱解析 ①首先在官能团区(4000~1300cm-1)搜寻官能团的特征伸缩振动; ②再根据“指纹区”(1300~400cm-1)的吸收情况,进一步确认该基团的存在以及与其它基团的结合方式。
图1 仪器的基本结构 四、实验步骤 1. 红外光谱仪的准备 (1)打开红外光谱仪电源开关,待仪器稳定30 分钟以上,方可测定; (2)打开电脑,选择win98系统,打开OMNIC E.S.P软件;在Collect菜单下的Experiment Set-up 中设置实验参数; (3)实验参数设置:分辨率 4 cm-1,扫描次数32,扫描范围4000-400 cm-1;纵坐标为Transmittance 2.固体样品的制备 (1)取干燥的苯甲酸试样约1mg于干净的玛瑙研钵中,在红外灯下研磨成细粉,再加入约150mg干燥且已研磨成细粉的KBr一起研磨至二者完全混合均匀,混合物粒度约为2μm以下(样品与KBr的比例为1:100~1:200)。 (2)取适量的混合样品于干净的压片模具中,堆积均匀,用手压式压片机用力加压约30s,制成透明试样薄片。 3.样品的红外光谱测定 (3)小心取出试样薄片,装在磁性样品架上,放入Nicolet5700智能傅立叶红外光谱仪的样品室中,在选择的仪器程序下进行测定,通常先测KBr的空白
红外光谱实验报告
红外光谱实验报告 一、实验原理: 1、红外光谱法特点: 由于许多化合物在红外区域产生特征光谱,因此红外光谱法广 泛应用于这些物质的定性和定量分析,特别是对聚合物的定性 分析,用其他化学和物理方法较为困难,而红外光谱法简便易 行,特别适用于聚合物分析。 2、红外光谱的产生和表示 红外光谱定义:分子吸收红外光引起的振动能级跃迁和转动能级跃 迁而产生的吸收信号。 分子发生振动能级跃迁需要的能量对应光波的红外区域分类为: i.近红外区:10000-4000cm-1 ⅱ.中红外区:4000-400cm-1——最为常用,大多数化合物的化键振 动能级的跃迁发生在这一区域。 ⅲ.远红外区:400-10cm-1 产生红外吸收光谱的必要条件: 1)分子振动:只有在振动过程中产生偶极矩变化时才能吸收红外辐射。 ⅰ.双原子分子的振动:(一种振动方式)理想状态模型——把两个 原子看做由弹簧连接的两个质点,用此来 描述即伸缩振动;
图1 双原子分子的振动模型 ⅱ.多原子分子的振动:(简正振动,依据键长和键角变化分两大类) 伸缩振动:对称伸缩振动 反对称伸缩振动 弯曲振动:面内弯曲:剪切式振动 (变形振动)平面摇摆振动 面外弯曲振动:扭曲振动 非平面摇摆振动 ※同一种键型,不对称伸缩振动频率大于对称伸缩振动频率,伸缩振动频率大于弯曲振动频率。 ※当振动频率和入射光的频率一致时,入射光就被吸收,因而同一基团基本上总是相对稳定地在某一特定范围内出现吸收峰。ⅲ.分子振动频率: 基频吸收(强吸收峰):基态到第一激发态所产生分子振动 的振动频率。 倍频吸收(弱吸收峰):基态到第二激发态,比基频高一倍 处弱吸收,振动频率约为基频两倍。 组频吸收(复合频吸收):多分子振动间相互作用,2个或2
高中物理氢原子跃迁与氢原子光谱
氢原子跃迁与氢原子光谱 玻尔原子理论第三条假设的“跃迁’指出:原子从一个定态(设能量为En )跃迁到 )时.它輻射和吸收一定频率的光于.光子能量由这两个定态另一种定态(没能量为E K 能量差决定,即hυ=En-Ek 若原于原来处于能级较大的定态——激发态.这时原子处于不稳定的能量状态,一有机会让会释放能量.回到能量较小的激发态或基态(能级最小的定态).这一过程放出的能量以放出光于的形式实现的,这就是原于发光原因。可见原子发光与能级跃迁有必然联系。对于氢原子它们对应关系如上图所示,从图可知当电子从n=3、4、5、6这四个激发态跃迁到n=2的激发态时,可得到可见光区域的氢原子光增,其波长"入"用下列公式计算 hc/入=E (1/n2-1/n2) 1 其中n=3,4,5,6.相应波长依次为: h α=656.3nm,hβ=486.1nm,hδ=434.1nm,hγ=410.1nm. 它们属于可见光,颜色分别为红、蓝、紫、紫。组成谱线叫巴耳末线系;若从n>1的激发态 跃迁到基态,放出一系列光子组成谱线在紫外区,肉眼无法观测,叫赖曼线系.....。 当原子处于基态或能级较低的激发态向高能级跃迁,必须吸收能量。这能量来源有
两种途径。 其一、吸收光子能量、光子实质上是一种不连续的能量状态。光的发射与吸收都是一份一份的,每一份能量E=hυ叫光子能量.光子能量不能被分割的。因此原子所吸收的光子只有满足hυ=En-Ek时,才能被原子吸收,从En定态跃迁到Ek定态。若不满足hυ=En-Ek的光子均不被吸收,原子也就无法跃迁。 例如用能量为123eV的光子去照射一群处于基态的氢原子.下列关于氢原子跃迁的说法中正确的是() 1)原子能跃迁到n=2的轨道上;2)原子能跃迁到n=3的轨道; 4)原子能跃迁到n=4的轨道上;3)原子不能跃迁。 通过计算可知E 1-E 2 =10.2eV<I2.3ev;E 3 -E 1 =12.09ev<12.3eV,E 4 一E 1 =12.75eV >12.3eV,即任意两定态能级差均不等于12.3eV.此光子原子无法吸收。答案D)正确。 其二、吸收电子碰撞能量。夫兰克——赫兹实验指出:当电子速度达到一定数值时,与原子碰撞是非弹性的,电子把一份份能量传给原子,使原子从一个较低能级跃迁到较高能级,原子从电子处获得能量只能等于两定态能量差。电子与光子不同.其能量不是一份一份的只要人射电子能量大于或等于两定态能量差. 均可使原子发生能级跃迁。 例如,已知汞原子可能能级如下图所示,一个自由电子总能量为9.0电子伏与处 于基态的汞原子发生碰撞,已知碰撞过程中不计汞原子动能变化,则电子剩余能量为()(A)0.2eV;(B)1.4eV(C)2.3eV(D)5.5eV. 因为E 2-E 1 =4.9ev<9.0eV,E 3 -E 1 =7.7eV<9.0ev,E 4 -E 1 =8.8ev<9.0ev. 满足人射电子能量大于两定态能量差 .处于基态汞原子分别吸收电子部分能量跃迁到n= 2、3.4能级,而电子剩余能量分别为4.1ev,1.3ev,0.2ev,只选项(A)正确。 摘自《物理园地》
红外光谱实验报告
一、实验目的 1、掌握溴化钾压片法制备固体样品的方法; 2、学习并掌握美国尼高立IR-6700型红外光谱仪的使用方法; 3、初步学会对红外吸收光谱图的解析。 二、实验原理 红外光是一种波长介于可见光区和微波区之间的电磁波谱。波长在~1000μm。通常又把这个波段分成三个区域,即近红外区:波长在~μm(波数在13300~4000cm-1),又称泛频区;中红外区:波长在~50μm(波数在4000~200cm-1),又称振动区;远红外区:波长在50~1000μm(波数在200~10cm-1),又称转动区。其中中红外区是研究、应用最多的区域。 红外区的光谱除用波长λ表征外,更常用波数σ表征。波数是波长的倒数,表示单位厘米波长内所含波的数目。其关系式为: 三、仪器和试剂 1、仪器:美国尼高立IR-6700 2、试剂:溴化钾,聚乙烯,苯甲酸 3、傅立叶红外光谱仪(FTIR)的构造及工作原理 四、实验步骤
1、波数检验:将聚苯乙烯薄膜插入红外光谱仪的样品池处,从4000-650cm-1进行波数扫描,得到吸收光谱。 2、测绘苯甲酸的红外吸收光谱——溴化钾压片法 取1-2mg苯甲酸,加入在红外灯下烘干的100-200mg溴化钾粉末,在玛瑙研钵中充分磨细(颗粒约2μm),使之混合均匀。取出约80mg混合物均匀铺洒在干净的压模内,于压片机上制成直径透明薄片。将此片装于固体样品架上,样品架插入红外光谱仪的样品池处,从4000-400cm-1进行波数扫描,得到吸收光谱。 五、注意事项 1、实验室环境应该保持干燥; 2、确保样品与药品的纯度与干燥度; 3、在制备样品的时候要迅速以防止其吸收过多的水分,影响实验结果; 4、试样放入仪器的时候动作要迅速,避免当中的空气流动,影响实验的准确性。 5、溴化钾压片的过程中,粉末要在研钵中充分磨细,且于压片机上制得的透明薄片厚度要适当。 六、数据处理 该图中在波数700~800、1500~1600、2800~2975左右有峰形,证明了该物质中可能有烯烃的C-H变形振动,C-C间的伸缩振动,同时也拥有烷烃的C-H伸缩振动,推测为聚乙烯的红外谱图。 谱带位置/cm-1吸收基团的振动形式 )n—C— n≥4) (—C—(CH 2
物理实验报告_光学多道与氢氘光谱
光学多道与氢氘同位素光谱 摘 要:本实验利用光学多道分析仪研究氢氘光谱。首先使用已知波长的氦光谱进行定标测量了氢光谱,并在此基础上测量氢氘同位素光谱,修正获得了氢氘光谱的波长值;利用这些测得值计算出了氢氘的里德伯常量分别为H R =109717.82cm -1,=109747.00 cm -1。得到了 氢氘光谱的各光谱项及巴耳末系跃迁能级图;通过计算得出了电子与质子质量之比为 =1881.40,与理论值1836.15的相对误差为2.46%。 关键词:光学多道分析仪,氢、氘同位素光谱,CCD ,光电倍增管 1. 引言 光谱是不同强度的电磁辐射按照波长的有序排列。光谱学是研究各种物质的光谱特征,并根据这些特征研究物质结构、物质成分和物质与电磁辐射的相互作用,以及光谱产生和测量方法的科学。光谱学在物理学各分支学科中都占有重要地位,而且在生物学、考古学等诸多方面有着广泛的应用。在光谱学史上,氢光谱的实验和理论研究都占有特别重要的地位。1885年,巴耳末(J.J.Balmer )发现了可见光区氢光谱线波长的规律。1892年,尤雷(H.C.Urey )等发现氢(H)的同位素氘(D)的光谱,氢氘原子对应的谱线波长存在“同位素位移”。 本实验利用光学多道分析仪,从巴尔末公式出发研究氢氘光谱,了解其谱线特点, 并学习光学多道仪的使用方法及基本的光谱学技术。 2. 实验原理 2.1物理原理 在原子体系中,原子的能量状态是量子化的。用1E 和2E 表示不同能级的能量,ε表示跃迁发出光子的能量,h 表示波尔兹曼常量,ν表示光子的频率,对于原子从低能级到高能级的跃迁我们有: 21h E E εν==-,其中21 E E h ν-= (1) 由于原子能级的分立,频率ν也为分立值,在分光仪上表现为一条条分立的“线性光谱”,这些频率由巴耳末公式确定: H 原子: 22 1 2 1 11H H R n n λ?? =- ??? ……………………………………………………(2) 其中1n 和2n 为轨道量子数,H R 为氢原子的里德伯常数。当1n =2,2n =3,4,5……时,公式(2)对应氢原子巴耳末系。 同理,D 原子:221 2111D D R n n λ?? =- ??? (3)
实验2 氢原子光谱的观察与测定
实验2 氢原子光谱的观察与测定 每一种原子都有其特定的线状光谱线。氢原子的光谱线最为简单,且具有明显的规律。测定氢原子可见光谱线的波长对认识原子的分离能级、以及由于能级间的跃迁而产生的光辐射的规律起着重要作用。本实验用读谱仪测量氢原子可见谱线的波长,并通过巴耳末公式推算出氢原子的里德伯常数。 【实验目的】 (1)观察氢原子的可见光谱。 (2)了解读谱仪的结构,掌握读谱仪的调节与使用方法。 (3)通过测量氢原子可见光谱线的波长,验证巴耳末公式的正确性。 (4)准确测定氢原子的里德伯常数。 (5)理解曲线拟合法的意义。 【仪器用具】 WPL —2型读谱仪,氢谱光源,氦氖谱光源,会聚透镜。 【仪器介绍】 整个实验的装置简图如图1所示。 读谱仪是由棱镜摄谱仪改进设计而成。它是利用棱镜分光在物镜上观察光谱的光学仪器。其结构大致可以分为三部分:平行光管系统、色散系统、接收系统。 (1)平行光管系统 平行光管系统包括入射狭缝和入射物镜。入射物镜的作用是使入射狭缝发出的光线变成平行光,所以入射狭缝应放在入射物镜的焦平面上。 (2)色散系统 色散系统实际上就是一个恒偏向棱镜,如图2所示。 它的作用是将光束分解,使不同波长的单色光束沿不同 的方向射出。符合最小偏向角条件的单色光,其入射光束和出射光束的夹角为900。 (3)接收系统 接收系统由出射物镜及放在该物镜焦平面上的目镜组成。不同方向的单色光束经出射物镜聚焦,在其焦平面上得到连续或不连续的依照波长次序排列的入射狭缝的单色像,即光谱。调节光谱的位置时,可以使用水平方向左右移动的手轮、丝杠、滑块、导轨和支架,还包括读出目镜位置用的标尺和100分度的手轮刻度。 手轮转一圈平移mm 1,每分度mm 01.0,要求估读到 1.0分度。目境内的叉丝用来对准被测谱线的中心。 【实验原理】 图 1 图2
光谱测定实验报告
地物光谱测定实验 实验报告
学院:地质工程与测绘学院 专业:遥感科学与技术 班级:2017******班 姓名:王不二 学号:2017****** 序号:15 2019年11月 一、实习时间 2019年11月5日下午 二、实习设备 AvaField-1型地物光谱仪、USB数据线、标准探头、探头控制线、野外用白板、笔记本电脑 三、实习目的 1.练习地物光谱仪的使用。 2.通过对地表典型地物类型光谱特性的测量,进一步加深对遥感理论基础 的理解。
四、实习内容及光谱分析 1.地物光谱仪的使用 1)安装并打开电脑上的AvaField-EDU软件,用USB数据线连接光谱 仪,然后再将数据线连接电脑。旋开光谱仪探头处的螺丝。 2)将光谱仪探头对准参考白板,使用鼠标点击“单帧”按钮,开始采集一 次光谱。 3)然后使用鼠标点击“参考”按钮,将当前光谱作为参考值。 4)使用光闸挡住探头,再次使用鼠标点击“单帧”按钮。 5)然后使用鼠标点击“背景”按钮,将当前光谱作为背景值。 6)打开光闸,将探头对准标准白板,再次使用鼠标点击“单帧”按钮,这 时软件会自动切换到反射比(亮度比)模式。 7)将探头对准被测物,使用鼠标点击“单帧”按钮,采集反射光谱。 8)使用鼠标点击“保存”按钮,保存数据。 2.实习数据采集、处理及光谱分析 本次实习共采集3种典型地物,其分别为:草地、瓷砖地面、水泥地面。 每种地物分别采集3次数据,并求均值得平均光谱曲线。 1)草地
光谱分析:根据草地的反射光谱特性曲线可以看出,在可见光波段550nm (绿光)附近有反射率为0.18的一个波峰,草地对500nm之前的电磁波段反射率较小,在近红外波段690nm~740nm之间有一个反射率增长的陡坡并在760nm~920nm间有一个反射率为0.96的峰值。在680nm(红光)附近为其光谱曲线的一个谷值。 2)瓷砖地面 光谱分析:由瓷砖地面的反射光谱特性曲线可知,瓷砖地面的电磁波谱反射率在电磁波长为690nm(红光)之前一直随着电磁波长的增大而增大,并在690nm时达到峰值0.86,而后其反射率随波长的增大而逐渐减小,并在波长为750nm~930nm之间其反射率一直保持在0.68附近小幅波动。在波长大于
氢氘光谱实验报告
氢氘光谱实验报告 实验报告索引:实验原理 实验内容 数据处理 思考题 实验原理 1、根据玻尔的原子能级理论以及适当的近似可以得到类氢原子的里德伯常数为: ) 1(Z e Z m m R R += ∞ 所以氢和氘的混合气体的谱线相近,较难区分。 2、由公式 )1()1()1(D H H D H H H D H D H R R -=-=- =-=?λσσλλλλλλλ 可以通过实验测得氢和氘的巴耳末线系的前几条谱线的谱长及其波长差,可求得氢与氘的里德伯常数R H 、R D 。 3、由公式 D e H e H D m m m m R R /1/1++= 得到: ??? ? ??--???? ??= 11H D e H H D H D R R m m R R m m 将实验测得的 H D R R 代入上式,可求得氘与氢原子核的质量比H D m m /。 返回首页 实验内容 说明:实验的条件参数详见原始数据,其中 表1是测Hg 光谱所得的数据 表2是测HD 光谱所得的数据
返回首页 数据处理 根据氢和类氢原子的巴耳末线系对应光谱线波数 )121( )1()4(22 2320242n m m c h Z e m Z e e -+ = πεπσ 可知Z m ∝σ ,故而双线之中波长较短的是D 的谱线,较长的是H 谱线。又由公式 ?? ? ??-=22121n R H H σ 及 ??? ??-=2212 1n R D D σ 可得: n=3时,H λ=655.67nm ,H R = ) 3121(122-H λ=7 100981.1? D λ=655.47nm ,D R = ) 3121(122-D λ=7 100984.1? n=4时,H λ=485.97nm ,H R =) 4121(122-H λ=7 100975.1? D λ=485.83nm ,D R =) 4 121(122-D λ=7 100978.1?
钠原子氢原子光谱
实验二十 钠原子光谱 引言 研究元素的原子光谱,可以了解原子的内部结构,认识原子内部电子的运动,并导致电子自旋的发现。钠原子是一个多电子原子,原子序数为11,既有稳定的满内壳层,又有自由电子,既存在着原子核和电子的相互作用,又存在着电子之间的相互作用,还有电子自旋运动与轨道运动的相互作用,其光谱结构比较简单,即可用吸收光谱,也可用发射光谱进行研究,在激光光谱日益发展的今天,钠光谱仍是深入研究的对象之一。 一、实验目的 1、WGD-8型组合光栅光谱仪拍摄钠原子光谱的实验方法; 2、测定钠光谱线的波长,通过里德伯关系计算钠原子能级和量子亏损,并绘出能级图。 二、实验原理 在原子物理中,氢原子光谱的规律告诉我们:当原子在主量子数为2n 与1n 的上下两能级间跃迁时,它们的谱线波数可以用两光谱项之差表示: 22 21~n R n R ?=ν, (1) 式中R 为里德伯常量(109 677.581?cm ).当21=n ,2n =3,4,5,…,则为巴尔末线系。 对于只有一个价电子的碱金属原子(Li ,Na ,K ,…),其价电子是在核和内层电子所组成的原子实的库仑场中运动,和氢原子有点类似。但是,由于原子实的存在,价电子处在不同量子态时,或者按轨道模型的描述,处于不同的轨道时,它和原子实的相互作用是不同的。因为价电子处于不同轨道时,它们的轨道在原子实中贯穿的程度不同,所受到的作用不同。还有,价电子处于不同轨道时,引起原子实极化的程度也不同。这二者都要影响原子的能量。即使电子所处轨道的主量子数n 相同而轨道量子数l 不同,原子的能量也是不同的,因此原子的能量与价电子所处轨道的量子数n 、l 都有关,轨道贯穿和原子实极化都使原子的能量减少,量子数l 越小,轨道进入原子实部分越多,原子实的极化也越显著,因而原子的能量减少得越多。与主量子数n
实验1紫外-可见吸收光谱实验报告
实验一:紫外-可见吸收光谱 实验目的 1. 熟悉和掌握紫外-可见吸收光谱的使用方法 2. 用紫外-可见吸收光谱测定某一位置样品浓度 3. 定性判断和分析溶液中所含物质种类实验原理 紫外吸收光谱的波长范围在200~400,可见光吸收光谱的波长在 400~800,两者都属于电子能谱,两者都可以用朗伯比尔(Lamber-Beer'Law) 定律来描述 A=£ bc 其中A为吸光度;£为光被吸收的比例系数;c为吸光物质的浓度,单位mol/L; b为吸收层厚度,单位cm 有机化合物的紫外-可见吸收光谱,是其分子中外层价电子跃迁的结果,其中包括有形成单键的 c电子、有形成双键的n电子、有 未成键的孤对n电子。外层电子吸 收紫外或者可见辐射后,就从基态 向激发态 (反键轨道)跃迁。主要有 四种跃迁,所需能量圧大小顺序 为nf >n^n* 吸收带特征典型基团 cfc *主要发生在远紫外区C-C、C-H (在紫外光区观测不到) n fc *跃迁一般发生在150~250nm,因此在紫 外区不易观察到 -OH、-NH 2、-X、-S nfn *跃迁吸收带波长较长,孤立跃迁一般发 生在200nm左右 芳香环 n fn *跃迁一般发生在近紫外区(200~400nm ) C=O、C=s、一N=O、一N=N ―、C=N ; 三、实验步骤 1、开机 打开紫外-可见分光光度计开关f开电脑f软件f联接f M (光谱方法)进行调节实验需要的参数:波长范围700-365nm 扫描速度高速;采样间隔:0.5 nm 2、甲基紫的测定 (1)校准基线 将空白样品(水)放到比色槽中,点击“基线”键,进行基线校准 (2)标准曲线的测定 分别将5ug/ml、10ug/ml、15ug/ml、20ug/ml甲基紫溶液移入比色皿(大 约23处),放到比色槽中,点击“开始”键,进行扫描,保存
分析实验报告-红外光谱测定苯甲酸---最终版
华南师范大学实验报告 学生姓名:杨秀琼学号:20082401129 专业:化学年级班级:08化二 实验类型:综合实验时间:2010/3/25 实验指导老师郭长娟老师实验评分: 红外光谱法测定苯甲酸 一、[ 实验目的] 1.了解苯甲酸的红外光谱特征,通过实践掌握有机化合物的红外光谱鉴定方法。 2.练习用KBr压片法制备样品的方法。 3.了解红外光谱仪的结构,熟悉红外光谱仪的使用方法。 二、[实验原理] 红外吸收光谱分析方法主要是依据分子内部原子间的相对振动和分子转动等信息进行测定。不同的化学键或官能团,其振动能级从基态跃迁到激发态所需的能量不同,因此要吸收不同的红外光,将在不同波长出现吸收峰,从而形成红外光谱。 三、[仪器与试剂] 仪器:傅里叶红外光谱仪 软件:IRSolution; 压片机、膜具和干燥器;玛瑙研钵、药匙、镜纸及红外灯。 试剂:苯甲酸粉末、光谱纯KBr粉末。 四、[实验步骤]
1.将所有的膜具用酒精擦拭干净,用电吹风先烘干,再在红外灯下烘烤; 2.用电子天平称量一定量的KBr粉末(每份约200mg),在红外灯下研钵中加入KBr进行研磨,直至KBr粉末颗粒足够小(注意KBr粉末的干燥); 3.将KBr装入膜具,在压片机上压片,压力上升至14Mpa左右,稳定30S; 4.打开傅里叶红外光谱仪,将压好的薄片装机,设置背景的各项参数之后,进行测试,得到背景的扫描谱图。 5. 取一定量的样品(样品:大约1.2-1.3g)放入研钵中研细,然后重复上述步骤得到试样的薄片; 6.将样品的薄片固定好,装入红外光谱仪,设置样品测试的各项参数后进行测试,得到苯甲酸的红外谱图; 7.然后删掉背景谱图,对样品谱图进行简单的编辑和修饰,并标注出吸收峰值,保存试样的红外谱图; 8.谱图分析:在测定的谱图中根据出现吸收带的位置、强度和形状,利用各种基团特征吸收的知识,确定吸收带的归属。若出现了某基团的吸收,应该查看该基团的相关峰是否也存在。应用谱图分析,结合其他分析数据,可以确定化合物的结构单元,在按照化学知识和解谱经验,提出可能的结构式。然后查找该化合物标准谱图来验证推定的化合物的结构式。 五、[结果与分析]
