同位素表
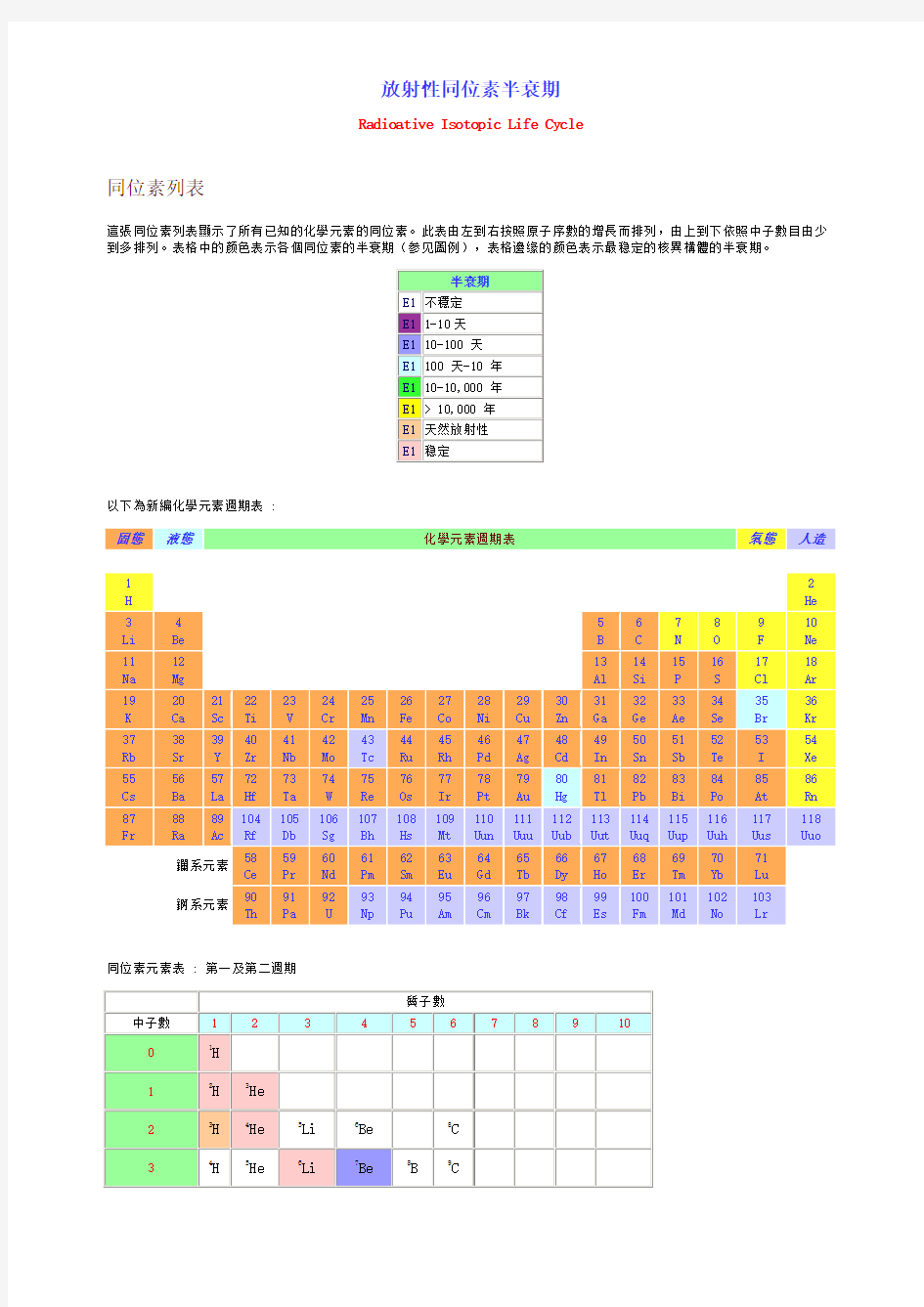

放射性同位素半衰期
Radioative Isotopic Life Cycle
同位素列表
這張同位素列表顯示了所有已知的化學元素的同位素。此表由左到右按照原子序數的增長而排列,由上到下依照中子數目由少到多排列。表格中的颜色表示各個同位素的半衰期(参见圖例),表格邊缘的颜色表示最稳定的核異構體的半衰期。
以下為新編化學元素週期表 :
同位素元素表 : 第一及第二週期
同位素元素表 : 第三週期
同位素元素表 : 第四週期
同位素元素表 : 第五及第六週期
同位素元素表 : 鑭系元素週期
化学《元素及元素周期表》优质教案、教学设计
【教学设计】第二单元第四节 元素及元素周期表(第二课时) 一、学习目标: 1. 知道元素的简单分类;元素符号所表示的意义;会正确书写元素符号并记住常见的元素符号。 2. 知道元素周期表的结构;能根据原子序数在元素周期表中找到指定元素和有关该元素的一些其它的信息。 二、学习过程: (一)、知识链接: 1、构成物质的基本粒子有、、。 如水是构成的,汞是由构成的,氯化钠是由构成的。 2、决定元素种类的是原子的数,钠原子和钠离子是否属于同种元素?。为什么?。元素:具有相同(即)的一类原子总称。 (二)、温故知新: 1、下列说法有没有错误?将错误的说法加以改正 ⑴水是由一个氧元素和两个氢元素组成的。 ⑵二氧化硫中有硫和氧两个元素。 ⑶水是由氢原子和氧原子构成的. ⑷水分子是由氢元素和氧元素组成的 ⑸一个水分子是由2 个氢原子和1 个氧原子构成的 2、填上合适的元素:
⑴地壳中含量最多的元素是: ⑵地壳中含量最多的非金属元素 ⑶地壳中含量最多的金属元素 ⑷生物细胞中含量最多的元素 3、联系生活:小华用凉开水养鱼,不久鱼全死了,下列哪个是合理的解释 A、凉开水中几乎不含氧元素 B、凉开水中几乎不含氧原子 C、凉开水中几乎不含水分子 D、凉开水中几乎不含氧气 4、5 题见课件。 (三)、自主学习与探究: 阅读课本46-47 页,完成自主学习知识点一、二。 知识点一:元素的种类 1. 稀有气体: 2. 金属元素: 3. 非金属元素:. 知识点二:元素的表示---国际通用(元素符号) 1. 为什么要使用元素符号? 2. 元素符号的读法: 3 .元素符号的书写: (1)由一个字母表示的元素: (2)由两个字母表示的元素: 4.元素符号的意义
元素的精确质量数及同位素丰度报告
元素的精确质量数及同位素丰度 Aluminum Al(27) 26.981541 100.00 Antimony Sb(121) 120.903824 57.30 Sb(123) 122.904222 42.70 Argon Ar(36) 35.967546 0.34 Ar(38) 37.962732 0.063 Ar(40) 39.962383 99.60 Arsenic As(75) 74.921596 100.00 Barium Ba(130) 129.906277 0.11 Ba(132) 131.905042 0.10 Ba(134) 133.904490 2.42 Ba(135) 134.905668 6.59 Ba(136) 135.904556 7.85 Ba(137) 136.905816 11.23 Ba(138) 137.905236 71.70 Beryllium Be(9) 9.012183 100.00 Bismuth Bi(209) 208.980388 100.00 Boron B(10) 10.012938 19.80 B(11) 11.009305 80.20 Bromine Br(79) 78.918336 50.69 Br(81) 80.916290 49.31
Cadmium Cd(106) 105.906461 1.25 Cd(110) 109.903007 12.49 Cd(111) 110.904182 12.80 Cd(112) 111.902761 24.13 Cd(113) 112.904401 12.22 Cd(114) 113.903361 28.73 Cd(116) 115.904758 7.49 Calcium Ca(40) 39.962591 96.95 Ca(42) 41.958622 0.65 Ca(43) 42.958770 0.14 Ca(44) 43.955485 2.086 Ca(46) 45.953689 0.004 Ca(48) 47.952532 0.19 Carbon C(12) 12.000000 98.90 C(13) 13.003355 1.10 Cerium Ce(136) 135.907140 0.19 Ce(138) 137.905996 0.25 Ce(140) 139.905442 88.48 Ce(142) 141.909249 11.08 Cesium Cs(133) 132.905433 100.00 Chlorine Cl(35) 34.968853 75.77 Cl(37) 36.965903 24.23 Chromium Cr(50) 49.946046 4.35 Cr(52) 51.940510 83.79 Cr(53) 52.940651 9.50 Cr(54) 53.938882 2.36 Cobalt Co(59) 58.933198 100.00 Copper Cu(63) 62.929599 69.17 Cu(65) 64.927792 30.83
中考化学考点全解考点九元素符及元素周期表
中考化学考点全解考点九元素符及元素周期表 文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
元素符号及元素周期表元素符号的写法: ①由一个字母表示的元素符号要大写,如 :H、C、 S、P,K。 ②由两个字母表示的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”)。如:Na、Mg、 Ca、Zn、Si。 元素周期表的结构: ①每一横行(周期):元素周期表每一横行叫做一个周期.共有7个横行,即7个周期。每个周期开头是金属元素(第一周期除外),靠近尾部是非金属元素,结尾的是稀有气体元素。同一周期元素的原子具有相同的电子层数。 ②每一纵行(族):元素周期表共有18个纵行,每一个纵行叫做一个族(第8,9,10三个纵行共同组成一个族),共有16个族。 ③每一格:在元素周期表中,每一种元素均占据一格。对于每一格,均包含元素的原子序数、元素符号、元素名称、相对原了质量等内容,如下图所示: 元素符号和化学式的关系: 化学用语元素符号化学式 易错考点
例题解析 例题1:近阶段多家媒体报道:云南铬污染和问题胶囊铬超标影响甚广.有关铬元素在元素周期表中的位置如图所示.从图中获取的信息正确的是()A.该元素为非金属元素 B.该元素在地壳中的含量为52.00% C.该元素的原子序数为52
D.该元素的原子核外有24个电子 答案:D 解析:A、根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁;因此该元素属于金属元素,故A正确; B、根据元素周期表中的信息,52.00是该元素的相对原子质量,而不是该元素在地壳中含量.故B错误; C、根据元素周期表中的信息可知,该元素原子的原子序数为24,故C错误; D、根据元素周期表中的信息可知,铬元素的原子序数=质子数=核外电子数,铬元素的原子核外有24个电子,故D正确. 例题2:下列符号中,既能表示一种元素,又能表示该元素的一个原子,还能表示由该元素组成的单质的是() A、H 2 B.N C.Fe D.CO 2 答案:C 解析:由原子构成的物质,元素既能表示一种元素,又能表示该元素的一个原子,还能表示由该元素组成的单质 课后练习 1、如图为元素周期表的一部分.下列说法不正确的是() A.钠、镁、铝三种原子的电子层都有3个层 B.氢、锂、钠三种原子的最外层都有1个电子
元素及元素周期表练习题
元素及元素周期表 一.选择题: 1.地壳中含量最多的金属元素是 ( ) A .氧 B .硅 C .铝 D .铁 2.决定元素种类的是 ( ) A .质子数 B .电子数 C .中子数 D .核外电子数 3.下列化学符号中数字表示的意义正确的是 ( ) A .CO 2:“2”表示一个二氧化碳分子含有两个氧原子 ] B .2Na :“2”表示两个钠元素 C . :“+2”表示镁离子带有两个单位正电荷 D .S 2- :“2–”表示硫元素的化合价为负二价 4.某粒子的结构示意图如图所示,对该粒子的说法错误的是( ) A .[ B . 核电荷数为12 B .核外有3个电子层 C .带12个单位正电荷 D .在化学反应中,易失去最外层上的2个电子 5.根据右图提供的信息,下列说法正确的是( ) A .钠原子最外层有11个电子 B .钠的相对原子质量是 C .钠属于非金属元素 D .钠的原子序数为11 6.生活中常接触到“加碘食盐”、“高钙牛奶”,其中的“碘”和“”应理解为( ) A.单质 B.分子 C.元素 D.原子 7.最近,“镉大米”成为公众关注的热点问题之一。据了解,含镉的大米对人的肝肾损害比较大。镉(Cd)的原子序数为48,中子数为64,下列说法错误的是( ) 【 A 、镉原子的质子数为48 B 、镉原子的相对原子质量为112g C 、镉是金属元素 D 、镉原子的核外电子数为48 8.正确读写化学符号是学好化学的基础。铝元素符号书写正确的是( ) 9.硒被誉为“抗癌大王”。根据右图提供的硒的有关信息,下列说法中,正确的是 ( ) Mg +2
A.硒属于金属元素 B.硒的原子序数是34 C.硒的原子结构示意图中x=4 D.硒的相对原子质量是 g . 10.近来中国部分地区出现镉污染的大米,食用后对人体有害。下列有关镉 的说法中错误 ..的是() A.镉的原子序数是48 B.镉属于非金属元素 C.镉的元素符号是Cd D.镉的相对原子质量是 11.氦是太阳中含量较多的元素,其元素符号为() A.H B. He C. N 12.我市盛产茶叶,“雪青”“清润茗芽”等绿茶享誉省内外。绿茶中的单宁酸具有抑制血 压上升、清热解毒、抗癌等功效,其化学式为C 76H 52 O 46 ,下列说法不正确的是() A.单宁酸由碳、氢、氧三种元素组成 | B.一个单宁酸分子由76个碳原子、52个氢原子和46个氧原子构成 C.单宁酸分子中碳、氢、氧原子个数比为38︰26︰23 D.一个单宁酸分子中含26个氢分子 13.钇(Y)是一种稀土元素,该元素在元素周期表中的信息如图所示。下列有关说法错误的是() A.钇属于金属元素 B.钇原子中的质子数为39 C.钇元素的相对原子质量为 D.钇原子中的中子数为39 14.根据右表提供的信息,下列判断错误的是() } 的原子序数是12 原子核外有三个电子层 C.表中所列元素均为金属元素 D.元素所在周期的序数等于其原子的电子层数
元素周期表中各元素名称及性质
— / [ *
、
…
氢(H) [ 主要性质和用途 熔点为℃,沸点为℃,密度为0. 089 88 g/L(10 ℃)。无色无臭气体,不溶于水,能在空气中燃烧,与空气形成爆炸混合物。工业上用于制造氨、环已烷、甲醇等。 发现 1766年由卡文迪许()在英国判明。 氦(He) ; 主要性质和用途 熔点为℃(加压),沸点为-℃,密度为 5 g/L(0 ℃)。无色无臭气体。化学性质不活泼。用于深海潜水、气象气球和低温研究仪器。 发现 1895年由拉姆塞(Sir )在英国、克利夫等(和在瑞典各自独立分离出。 锂(Li)
。 主要性质和用途 熔点为℃,沸点为1 347 ℃,密度为g/cm3(20 ℃)。软的银白色金属,跟氧气和水缓慢反应。用于合金、润滑油、电池、玻璃、医药和核弹。发现 1817年由阿尔费德森(. Arfvedson)在瑞典发现。 铍(Be) 主要性质和用途 ~ 熔点为1 278±5 ℃,沸点为2 970 ℃(加压下),密度为g/cm3(20 ℃)。较软的银白色金属,在空气和水中稳定,即使在红热时也不反应。用于与铜和镍制合金,其导电性和导热性极好。 发现 1798年由沃克兰()发现 硼(B) 主要性质和用途 * 熔点为2 300 ℃,沸点为3 658 ℃,密度为g/cm3(β-菱形)(20 ℃)。具有几种同素异形体,无定形的硼为暗色粉末,跟氧气、水、酸和碱都不起反应,跟大多数金属形成金属硼化物。用于制硼硅酸盐玻璃、漂白和防火。 发现 1808年由戴维(Sir Humphrey Davy)在英国、盖-吕萨克()和泰纳)在法国发现。 碳(C)
同位素丰度
Table I. Isotopic Data Z El A Abundance(%)σγ(total) b g(293?K)N γ E γ(σγ) for most intense capture gamma rays 1H 199.9885(70)0.3326(7) 0.99912223.24835(0.3326) H 20.0115(70)0.000519(7) 1.00012He 30.000137(3)0.000031(9) 1.000 120520.46(4.2×10-11) σp (3He)=5333(7) b He 499.999863(3)0.0 1.00003Li 67.59(4)0.039(4) 1.000 3σα(6Li)=940(4) b Li 792.41(4)0.045(3) 1.00032032.30(0.0381), 980.53(0.00415), 1051.90(0.00414) 4Be 91000.0088(4) 1.000136809.61(0.0058), 3367.448(0.00285), 853.630(0.00208) 5 B 1019.9(7)0.5(1) 1.000 10477.595(716) σα(10B)=3837(9) b B 1180.1(7)0.005(3) 1.00006 C 1298.93(8)0.00353(5) 1.00064945.301(0.00261), 1261.765(0.00124), 3683.920(0.00122) C 13 1.07(8)0.00137(4) 0.99877N 1499.632(7)0.0798(14) 1.000 605269.159(0.0236), 5297.821(0.01680), 5533.395(0.0155) σp (14N)=1.83(3) b N 150.368(7)0.000024(8) 1.003128O 1699.757(16)0.000190(19) 1.0004870.68(1.77×10-4), 2184.42(1.64×10-4), 1087.75(1.58×10-4) O 170.038(1)0.00054(7) 0.99920 O 180.205(14)0.00016(1) 1.000139 F 191000.0096(5) 1.0001681633.53(0.0096)d, 583.561(0.00356), 656.006(0.00197) 10Ne 2090.48(3)0.037(4) 1.000272035.67(0.0245), 350.72(0.0198), 4374.13(0.01910) Ne 210.27(1)0.67(11) 1.00011 Ne 229.25(3)0.045(6) 1.000151979.89(0.00306), 1017.00(0.0030) 11Na 231000.530(5) 1.0002401368.66(0.530)d, 2754.13(0.530)d, 472.202(0.478)d 12Mg 2478.99(4)0.0536(15) 1.001353916.84(0.0320), 585.00(0.0314), 2828.172(0.0240) Mg 2510.00(1)0.200(5) 1.0012061808.668(0.0180), 1129.575(0.00891), 3831.480(0.00418) Mg 2611.01(3)0.0386(6) 1.0014413Al 271000.231(3) 1.0002161778.92(0.232)d, 30.6380(0.0798), 7724.027(0.0493) 14Si 2892.2297(7)0.177(5) 1.001463538.966(0.1190), 4933.889(0.1120), 2092.902(0.0331) Si 29 4.6832(5)0.119(3) 1.00399 Si 30 3.0872(5)0.107(2) 1.0073915P 311000.172(6) 1.001158512.646(0.079), 78.083(0.059), 636.663(0.0311) 16S 3294.93(31)0.548(10) 1.000101840.993(0.347), 5420.574(0.308), 2379.661(0.208) S 330.76(2)0.454(25) 1.001249 S 34 4.29(28)0.235(5) 1.00155 S 360.02(1)0.23(2) 1.0142217Cl 3575.78(4)43.5(4) 1.0003841164.8650(8.91), 517.0730(7.58), 6110.842(6.59) Cl 3724.22(4)0.430(6) 1.0007118Ar 360.3365(30) 5.2(5) 1.01610 Ar 380.0632(5)0.8(2) 1.0400 Ar 4099.6003(30)0.66(1) 1.00240167.30(0.53), 4745.3(0.36), 1186.8(0.34) 19K 3993.2581(44) 2.1(2) 1.00130829.8300(1.380), 770.3050(0.903), 1158.887(0.1600) K 400.0117(1)30(4) 1.000490 K 41 6.7302(44) 1.45(3) 1.00163820Ca 4096.94(16)0.41(2) 1.001491942.67(0.352), 6419.59(0.176), 4418.52(0.0708) Ca 420.647(23)0.68(7) 1.00144 Ca 430.135(10) 6.2(6) 1.001129 Ca 44 2.09(11)0.88(5) 1.00141 Ca 460.004(3)0.72(3) 1.00010 Ca 480.187(21) 1.09(14) 1.0011521Sc 4510027.2(2) 1.002440227.773(7.13), 147.011(6.08), 142.528(4.88)d 22Ti 468.25(3)0.59(18) 1.00123 Ti 477.44(2) 1.52(11) 1.001175 Ti 4873.72(3)7.88(25) 1.002921381.745(5.18), 6760.084(2.97), 6418.426(1.96) Ti 49 5.41(2) 1.79(12) 1.00188 Ti 50 5.18(2)0.179(3) 1.0011923V 500.250(4)21(4) 0.999328 V 5199.750(4) 4.92(4) 1.0013091434.10(4.81)d, 125.082(1.61), 6517.282(0.78) 24Cr 50 4.345(13)15.9(2) 1.00064749.09(0.569), 8510.77(0.233), 8482.80(0.169) Cr 5283.789(18)0.76(6) 1.000167938.46(0.424) Cr 539.501(17)18.2(15) 1.00090834.849(1.38), 8884.36(0.78), 9719.06(0.260) Cr 54 2.365(7)0.36(4) 1.0003825Mn 5510013.36(5) 1.000126846.754(13.10)d, 1810.72(3.62)d, 26.560(3.42) 26Fe 54 5.845(35) 2.25(18) 1.001339297.68(0.0747) Fe 5691.754(36) 2.59(14) 1.0001937631.136(0.653), 7645.5450(0.549), 352.347(0.273) Fe 57 2.119(10) 2.5(3) 1.00135 Fe 580.282(4) 1.30(3) 1.0026727Co 5910037.18(6) 1.000340229.879(7.18), 277.161(6.77), 555.972(5.76) 28Ni 5868.0769(89) 4.5(2) 1.0002368998.414(1.49), 464.978(0.843), 8533.509(0.721) Ni 6026.2231(77) 2.9(2) 1.0001377819.517(0.336), 282.917(0.211), 7536.637(0.190) Ni 61 1.1399(6) 2.5(8) 1.00064 Ni 62 3.6345(17)14.5(3) 1.000536837.50(0.458) Ni 640.9256(9) 1.63(7) 1.000 35 * Decay gamma: 20F(11.163 s), 24Na(20.20 ms), 28Al(2.2414 m), 46Sc(18.75 s), 52V(3.75 m), 56Mn(2.5789 h)
物质结构及元素周期表
物质结构及元素周期表 为您服务的教育网络 主题一材料结构和元素周期表 一、审查考试地点 1.考试网站网络建设 (1)元素“位-结构-单位”之间的关系 (2)。推断元素的名称或位置是本节中常见的问题之一。其方法可以大致概括如下: 2.检查现场解释: 测试地点1:同一时期、同一主体群体性质变化的逻辑衍生关系1。相同周期和相同主族元素性质变化规律性质原子半径电子层结构电子损失能力获得电子能力金属非金属主价最高价氧化物酸相应水合物碱性非金属气态氢化物形成困难稳定性相同周期(从左到右)具有相同数量电子层的最外层电子的数量逐渐减少,最外层电子的数量逐渐减少,最外层电子的数量逐渐增加,最外层电子的数量逐渐减少,最外层电子的数量逐渐减少,最外层电子的数量逐渐增加,最外层电子的数量逐渐增加,最大正价(+1→+7)非金属负价=-(8族序数)酸度逐渐增加,最外层电子的数量XK碱度 随着主族(自上而下)电子层数的逐渐增加,最外层电子的数量也在逐渐增加,逐渐减少,逐渐增加,逐渐减少,逐渐减少,逐渐减少,最高正价=族序数(除O,F外)非金属负价=-(8-族序数)酸度逐渐减少,碱度逐渐增加,形成从难到易的稳定性逐渐增加,形成从易到难的稳
定性逐渐减少2。元素周期表中的“三角形”变化规律 如果元素a、b和c位于元素周期表中图5-1所示的位置,所有相关的性质都可以顺利释放。 1 为您服务的教育网络 订单(但D不能参与安排)。(1)原子半径:碳>氮>硼;(2)金属度:碳>碳>硼;(3)非金属:硼>碳>碳3。元素周期表(1)中的相似性规则与主族元素的性质相似(因为最外面的电子是相同的);⑵元素周期表中对角线位置(如2中的A、D位置)的元素具有相似的性质,如锂和镁、铍和铝、硼和硅等。 (3)相邻元素的性质差别不大。 测试点2元素周期定律的普通次定律 1.最外层电子数大于或等于3且小于8的元素必须是主族元素;最外层电子数为1或2的元素可以是主族、次族或0族(he)元素;最外层电子数为8的元素是稀有气体元素(氦除外)。 2.在元素周期表中,IIA族和IIA族元素的原子数有三种不同:①1-3周期(短周期)1元素的原子数不同;(2)第4和第5周期之间的差异为11;③第6和第7周期的差异为25。 3.在每个周期中排列的元素类型满足以下规则:如果n是周期序数,那么在奇数周期中它是(n?1)222(n?2)物种,物种处于偶数周期。2 4.在元素周期表中,除了第八族元素外,具有奇数(或偶数)原子序数的元素,元素所在的族的序数和主价也是奇数(或偶数)。
高中化学元素周期表和元素题型归纳
元素周期律和元素周期表习题 知识网络 中子N 原子核 质子Z 原子结构 : 电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化 ①、原子最外层电子的周期性变化(元素周期律的本质) 元素周期律 ②、原子半径的周期性变化 ③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 如:Na>Mg>Al>Si>P>S>Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如:Li
元素周期表及各元素英文
元素周期表及各元素英文 第01 号元素: 氢[化学符号]H, 读“轻”, [英文名称]Hydrogen 第02 号元素: 氦[化学符号]He, 读“亥”, [英文名称]Helium 第03 号元素: 锂[化学符号]Li, 读“里”, [英文名称]Lithium 第04 号元素: 铍[化学符号]Be, 读“皮”, [英文名称]Beryllium 第05 号元素: 硼[化学符号]B, 读“朋”, [英文名称]Boron 第06 号元素: 碳[化学符号]C, 读“炭”, [英文名称]Carbon 第07 号元素: 氮[化学符号]N, 读“淡”, [英文名称]Nitrogen 第08 号元素: 氧[化学符号]O, 读“养”, [英文名称]Oxygen 第09 号元素: 氟[化学符号]F, 读“弗”, [英文名称]Fluorine 第10 号元素: 氖[化学符号]Ne, 读“乃”, [英文名称]Neon 第11 号元素: 钠[化学符号]Na, 读“纳”, [英文名称]Sodium 第12 号元素: 镁[化学符号]Mg, 读“美”, [英文名称]Magnesium
第13 号元素: 铝[化学符号]Al, 读“吕”, [英文名称]Aluminum 第14 号元素: 硅[化学符号]Si, 读“归”, [英文名称]Silicon 第15 号元素: 磷[化学符号]P, 读“邻”, [英文名称]Phosphorus 第16 号元素: 硫[化学符号]S, 读“流”, [英文名称]Sulfur 第17 号元素: 氯[化学符号]Cl, 读“绿”, [英文名称]Chlorine 第18 号元素: 氩[化学符号]Ar,A, 读“亚”, [英文名称]Argon 第19 号元素: 钾[化学符号]K, 读“甲”, [英文名称]Potassium 第20 号元素: 钙[化学符号]Ca, 读“丐”, [英文名称]Calcium 第21 号元素: 钪[化学符号]Sc, 读“亢”, [英文名称]Scandium 第22 号元素: 钛[化学符号]Ti, 读“太”, [英文名称]Titanium 第23 号元素: 钒[化学符号]V, 读“凡”, [英文名称]Vanadium 第24 号元素: 铬[化学符号]Cr, 读“各”, [英文名称]Chromium 第25 号元素: 锰[化学符号]Mn, 读“猛”, [英文名称]Manganese
同位素
1000 /)()(000?=标准标准样品-R R R δ8.3 矿区地下水环境同位素分析 在水中天然存在很多种环境同位素,比如2H 、18O 、34S 、13C 、14C 等。地下水和地表水在其演化运动过程中,除了形成其一般的物理、化学踪迹外,还形成了大量微观的同位素踪迹。用同位素方法研究地下水的优越性在于它的化学性质比较稳定,不易被岩土吸附,不易生成沉淀的化合物;它的检测灵敏度非常高,很小的剂量就可获得满意的效果。用环境同位素的示踪方法来研究地下水的运动规律,能快速和有效的取得其它方法难以得到或者根本无法得到的重要水文地质信息,由于环境同位素作为天然示踪剂“标记”着天然水和地下水的形成过程,因此研究它们在各水体中的分布规律就有可能直接获得地下水形成和运动过程的信息。其途径就是通过环境同位素的分析,比较地下水体和地表水体中环境同位素的差异和变化规律来揭示地下水的起源、形成条件、补给机制以及各水体之间的水动力关系。该方法还是解决地下水各种补给来源水的混合比例、各类水体间水力联系等实际问题的有效工具。 8.3.1同位素标准及应用方法原理 在稳定同位素研究中,把某一元素两种同位素的丰度比用R 值来表示, 如D/H 、18O/16O ,在分析时只测定它的丰度比值而不测量单项同位素的绝对含量,通常用δ值表示,δ值定义如下: 其意义是样品中一元素的两种同位素丰度相对于某一对应标准丰度的千分偏差。使用国际标准SMOW(为平均大洋水)为标准。SMOW 定义δ2H 和δ18O 值均为零作为其标准。 氢氧元素共有5个稳定同位素(1H 、2H 、16O 、 17O 、18O ),但通常用于稳定同位素研究的是2H 和18O 。一般在水分子中氢氧的不同稳定同位素以不同方式组合,可形成9种不同形式的水分子,如H 216O 、HD 16O 、D 216O 、H 218O 、HD 18O 、D 218O 、H 217O 、HD 17O 、D 217O ,这些同位素水分子,由于质量不同,因而具有
高中化学 元素周期表及其应用
元素周期表及其应用 知识与技术 1、知道元素周期表是元素周期律的具体表现形式,能描述元素周期表的结构,初步学会 运用元素周期表。 2、知道同周期、同主族元素性质的递变规律。 3、理解元素在周期表中的位置与它的原子结构、元素化学性质三者之间关系。 过程与方法 1、运用直接观察法学习元素周期表的结构。 2、运用逻辑推理方法研究学习同主族元素性质的递变规律。 3、采用研究性学习学方式学习有关周期表的史料。 情感、态度与价值观 1、了解周期表的编制过程,了解科学发现和发展的历程。 2、认识周期表的理论对实践的指导作用。 教学重点 元素周期表的结构及其应用 教学难点 元素在周期表中的位置与原子结构、元素化学性质三者之间的关系。 教具准备 多媒体, 元素周期表及其应用(第一课时) 导入新课: 我们已经学习过了元素周期律的有关内容,现在请大家来完成一个任务:将1—18号元素排列在一张表格中,这张表格必须体现出周期律内容。 学生活动,交流: 评价: 展示:元素周期表 投影: [问题与探究] 1、元素周期表有几行几列? 2、什么叫周期?什么叫族? 3、有几种不同的族?族是如何排列的? 4、如何确定周期和主族序数? 学生交流、讨论: 板书:一、元素周期表结构 1周期 短周期:第1、2、3行分别有2、8、8种元素 长周期:第4、5、6行分别有18、18、32种元素 不完全周期:第7行有26种元素 2族 主族:(A)有7个 副族:(B)有7个 Ⅷ族:1个有3纵横 0族:1个 提问:请写出氮、铝、氖元素周期中的位置?
学生活动: 提问:通过以上练习你能看出这些元素原子的核外电子数,最外层电子数,主要化合价与周期数及族的序数是什么关系? 学生思考、交流: 板书:周期序数=电子层数 主族序数=最外层电子数 投影:指出下列主族元素在周期表中的位置,并推测其主要化合价 学生回答: 投影:锂、钠、钾、铷、铯的性质具有哪些相似性? 学生活动 演示实验:钾与水反应 学生观察: 视频:锂、钠、钾、铷、铯与水反应 结论:性质相似,但金属性逐渐增强。 投影:氟、氯、溴、碘元素 讲述:(性质的递变) [练习] 依据碳、氮元素在周期表中的位置,在下列空格中填上必要的内容。 [板书] (1)、核电荷数:碳氮 (2)、原子半径:碳氮 (3)、非金属性:碳氮 (4)、氧化性:碳氮气 (5)、热稳定性:甲烷氨气 (6)、酸性:碳酸硝酸 [结论] 同周期元素由左向右,随着核电荷递增,最外层电子逐渐增多,原子半径逐渐减小,原子得电子能力逐渐增强,失电子能力逐渐减弱;金属性逐渐减弱,非金属性逐渐增强。[思考与探究] 根据氟、氯、溴、碘在周期表中的位置及原子结构,对下列事实给出合理解释 (1)、它们的单质与氢气反应越来越难。 (2)、它们的单质与水反应越来越难。 (3)、氯、溴、碘的置换顺序为:氯>溴>碘。 (4)、它们气态氢化物的热稳定性顺序为:氟>氯>溴>碘。 (5)、它们最高价氧化物的水化物的酸性强弱顺序为:氯>溴>碘。 [结论]
元素周期表及各元素英文
元素周期表及各元素英文 精品
第 01 号元素: 氢 [化学符号]H, 读“轻”, [英文名称]Hydrogen 第 02 号元素: 氦 [化学符号]He, 读“亥”, [英文名称]Helium 第 03 号元素: 锂 [化学符号]Li, 读“里”, [英文名称]Lithium 第 04 号元素: 铍 [化学符号]Be, 读“皮”, [英文名称]Beryllium 第 05 号元素: 硼 [化学符号]B, 读“朋”, [英文名称]Boron 第 06 号元素: 碳 [化学符号]C, 读“炭”, [英文名称]Carbon 第 07 号元素: 氮 [化学符号]N, 读“淡”, [英文名称]Nitrogen 第 08 号元素: 氧 [化学符号]O, 读“养”, [英文名称]Oxygen 第 09 号元素: 氟 [化学符号]F, 读“弗”, [英文名称]Fluorine 第 10 号元素: 氖 [化学符号]Ne, 读“乃”, [英文名称]Neon 第 11 号元素: 钠 [化学符号]Na, 读“纳”, [英文名称]Sodium 第 12 号元素: 镁 [化学符号]Mg, 读“美”, [英文名称]Magnesium 第 13 号元素: 铝 [化学符号]Al, 读“吕”, [英文名称]Aluminum 精品
第 14 号元素: 硅 [化学符号]Si, 读“归”, [英文名称]Silicon 第 15 号元素: 磷 [化学符号]P, 读“邻”, [英文名称]Phosphorus 第 16 号元素: 硫 [化学符号]S, 读“流”, [英文名称]Sulfur 第 17 号元素: 氯 [化学符号]Cl, 读“绿”, [英文名称]Chlorine 第 18 号元素: 氩 [化学符号]Ar,A, 读“亚”, [英文名称]Argon 第 19 号元素: 钾 [化学符号]K, 读“甲”, [英文名称]Potassium 第 20 号元素: 钙 [化学符号]Ca, 读“丐”, [英文名称]Calcium 第 21 号元素: 钪 [化学符号]Sc, 读“亢”, [英文名称]Scandium 第 22 号元素: 钛 [化学符号]Ti, 读“太”, [英文名称]Titanium 第 23 号元素: 钒 [化学符号]V, 读“凡”, [英文名称]Vanadium 第 24 号元素: 铬 [化学符号]Cr, 读“各”, [英文名称]Chromium 第 25 号元素: 锰 [化学符号]Mn, 读“猛”, [英文名称]Manganese 第 26 号元素: 铁 [化学符号]Fe, 读“铁”, [英文名称]Iron 精品
同位素的命名
第9章同位素丰度改变化合物(Isotopically modified compounds) 有机化合物中所含元素的同位素组成与自然界中不同时,对他们的命名就需要在原命名的基础上加以专门的标识,根据IUPAC对各种不同类型同位素丰度改变而建议的规则体系,以下为中文命名时的相应建议。美国化学文摘社(Chemical Abstract Serivice)索引命名体系中采用了Boughton建议[9-1]基础上发展出的另一同位素丰度改变化合物的命名体系,对此中文命名建议中未予采用。 9.1. 符号和定义 9.1.1. 核素符号 同位素丰度改变的化合物分子式或命名中所涉及核素的符号由元素的原子符号和元素符号左上标表示核素质量数的阿拉伯数字两部分组成。 9.1.2. 原子符号 核素符号中的元素符号即IUPAC无机化学命名里面的原子符号。在核素符号中,原子符号为罗马字体,斜体的原子符号则按有机化学命名习惯仍保留为位次标识时用。 注:氢的同位素氕、氘和氚分别用核素符号1H, 2H和3H表示,也可以用符号D和T分别表示2H和3H,但是如果同时有其他丰度改变的核素存在时,则不能使用,因为这将使同位素标识时,按字母排序核素变得困难。尽管按照Boughton体系(见上)命名时仍用d和t 代替2H和3H,但在其他场合都不采用小写字母来作为原子符号。因此,Boughton体系范围外,均不再推荐d和t用于化学命名。 按IUPAC的建议[9-2]各种氢原子和其离子名称如下表: 原子(atom)正离子(cation)负离子(anion) H H+H- 1H 氕(pie)(protium)氕核,质子(proton)氕化物(protide) 2H 氘(dao) 氘核(deuteron)氘化物(deuteride)(deuterium) 3H 氚(chuan) 氚核(triton)氚化物(tritide)(tritium) H(天然)氢(hydrogen)氢核,氢正离子(hydron)氢化物(hydride) 9.1.3. 天然同位素丰度化合物 同位素丰度未变的化合物的组成是宏观的,它核素成分的比例和自然界中一样。它的分子式和命名按常规写法。
铷同位素丰度的测定
铷同位素丰度的测量 学院:物理学院 专业:光信息科学与技术 学号:32080708 学生姓名:陈楠 指导教师:吴金辉
摘要 :根据光抽运、光磁双共振原理和光探测方法,利用拍得的共振谱线可以通过计算共振峰面积比进而较准确的得到铷同位素的丰度值。 关键字:光抽运、光磁共振、铷同位素、丰度比 1 实验原理 1.1 Rb 原子的超精细结构及其塞曼分裂 铷原子是一价碱金属原子,其基态及最低激发态的电子组态分别为 1s 22s 22p 63s 23p 63d 104s 24p 65s 1 , 1s 22s 22p 63s 23p 63d 104s 24p 65p 1原子序数是37,基态原子符号是52S 1/2,在天然的Rb 中含有两种同位素:85Rb (72.15%)和87Rb (27.85%),85Rb 的核自旋量子数I=5/2,87Rb 的核自旋量子数I=3/2。 考虑到电子自旋与轨道相互作用(L-S 耦合),Rb 原子的基态S 态是单重的,最低激发态P 态在精细结构中是双重的,基态52S 1/2的量子数为S=1/2,L=0,J=1/2; 第一激发态52P 1/2,3/2的量子数为L=1,S=1/2,J=1/2,3/2. 从52P 1/2→52S 1/2谱线D 1=794.8nm 。 考虑到铷原子具有核自旋,核自旋量子数为I. 87Rb 具有核自旋量子数I=3/2, 85Rb 具有核自旋量子数I=5/2。 相应的核自旋角动量P I ,磁矩μI ,在弱磁场中核自旋角动量的耦合,即P I 和P J 耦合成总角动量P F ,F 为总量子数,F=I+J ,…,|I-J|. 原子总角动量P F 与总磁矩μF 之间的关系为 2F F F e g P m c μ=- 其中 (1)(1)(1)(1)2(1)(1)(1)(1)1(2)()2(1)F J J F F J J I I g g F F J J L L S S g L S J J +++-+=++-+++=+-+ 耦合 对铷原子??Rb 基态52S 1/2,量子数:S=1/2,L=0,J=1/2,I=3/2,F=1,2. ??Rb 基态52S 1/2,量子数:S=1/2,L=0,J=1/2,I=5/2,F=2,3. 由量子数F 标定的能级称为精细结构能级。
同位素比例质谱
同位素比例质谱 1 同位素有关概念 同位素:两个原子质子数目相同,但中子数目不同,则他们仍有相同的原子序,在周期表是同一位置的元素。同位素可分为两大类:放射性同位素(radioactive isotope)和稳定同位素(stable isotope)。 放射性同位素指某些同位素的原子核很不稳定,会不间断地、自发地放射出射线,直至变成另一种稳定同位素。 稳定同位素指某元素中不发生或极不易发生放射性衰变的同位素,常用的有34种,已实现规模生产的稳定同位素及化合物有235U、重水、6Li、10B,而常用于质谱分析的主要是12C和13C、18O和16O、34S和32S、D/H等。 2 同位素丰度 绝对丰度:指某一同位素在所有各种稳定同位素总量中的相对份额,常以该同位素与1H(取1H=1012)或28Si(28Si=106)的比值表示。 相对丰度:指同一元素各同位素的相对含量。例如12C=98.892%,13C=1.108%。大多数元素由两种或两种以上同位素组成,少数元素为单同位素元素,例如19F=100%。 3 R值和δ值 同位素比值R为某一元素的重同位素原子丰度与轻同位素原子丰度之比. 例如D/H、13C/12C、34S/32S等,由于轻元素在自然界中轻同位素的相对丰度很高,而重同位素的相对丰度都很低,R值就很低且冗长繁琐不便于比较,故在实际工作中通常采用样品的δ值来表示样品的同位素成分。 样品(se)的同位素比值Rse与一标准物质(st)的同位素比值(Rst)比较,比较结果称为样品的δ值。其定义为:δ(‰)=(Rse/Rst -1)×1000(即样品的同位素比值相对于标准物质同位素比值的千分差)。 氢同位素标准物质:分析结果均以标准平均大洋水(Standard Mean Ocean Water,即SMOW)为标准报导,这是一个假象的标准,以它作为世界范围比较的基点,其D/H SMOW =(155.76±0.10)×10-6。碳同位素标准物质为美国南卡罗来纳州白垩纪皮狄组层位中的拟箭石化石(Peedee Belemnite,即PDB),其13C/12C =(11237.2±90)×10-6,定义其δ13C =0‰。硫同位素标准物质为Canyon Diablo铁陨石中的陨硫铁(Troilite),简称CDT。34S/32S CDT=0.0450045±93,定义CDT的δ34S=0‰。氮同位素标准物质为:选空气中氮气为标准,15N/14N=(3.676.5±8.1)×10-6,定义其δ15N=0‰。氧同位素标准物质:大部分氧同位素分析结果均以SMOW标准报导,它是根据水样NBS-1定义的,18O/16O SMOW=(2005.2±0.43)×10-6,17O/16O SMOW=(373±15)×10-6;而在碳酸盐样品氧同位素分析中则经常采用PDB标准,其18O/16O=2067.1×10-6,它与SMOW标准之间存在转换关系。 4 稳定同位素质谱的原理 稳定同位素质谱仪测定样品中的C、H、O、S等同位素之前,需要将样品转化成相应的气体。如H 同位素分析转化成氢气,C、O同位素分析分析采用二氧化碳气体,S同位素分析采用二氧化硫和SF6 。 下面以元素分析仪-同位素比例质谱(EA-IRMS)为例介绍下原理:以测定葡萄酒中乙醇的δ13C为例。Integra-CN稳定碳同位素比质谱仪( 英国Sercon 质谱有限公司,软件为
