届高中化学竞赛专题辅导晶体结构及答案
2010届高中化学竞赛专题辅导(三)
晶体结构
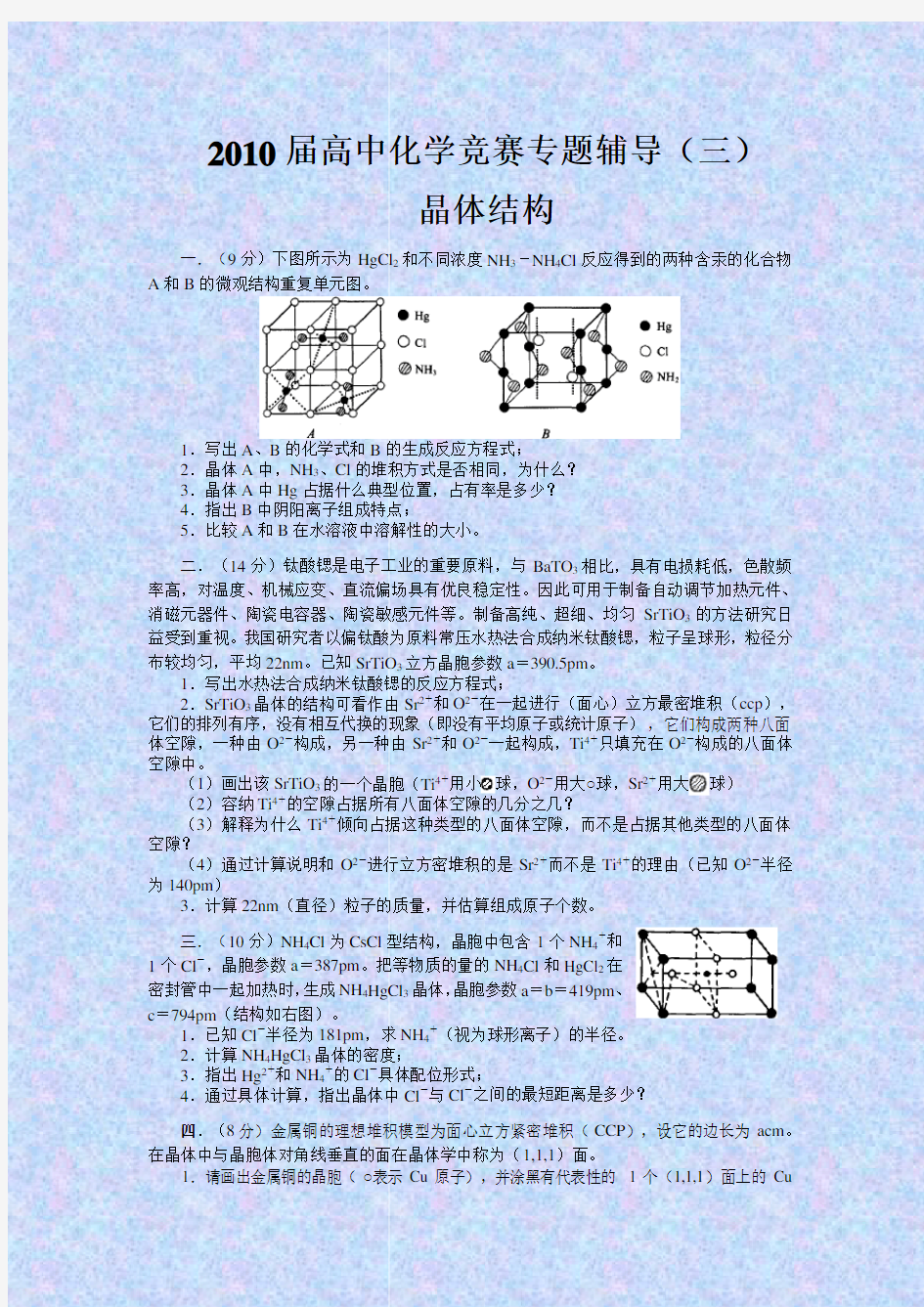
一.(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A和B的微观结构重复单元图。
1.写出A、B的化学式和B的生成反应方程式;
2.晶体A中,NH3、Cl的堆积方式是否相同,为什么?
3.晶体A中Hg占据什么典型位置,占有率是多少?
4.指出B中阴阳离子组成特点;
5.比较A和B在水溶液中溶解性的大小。
二.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;
2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)
(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?
(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?
(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)
3.计算22nm(直径)粒子的质量,并估算组成原子个数。
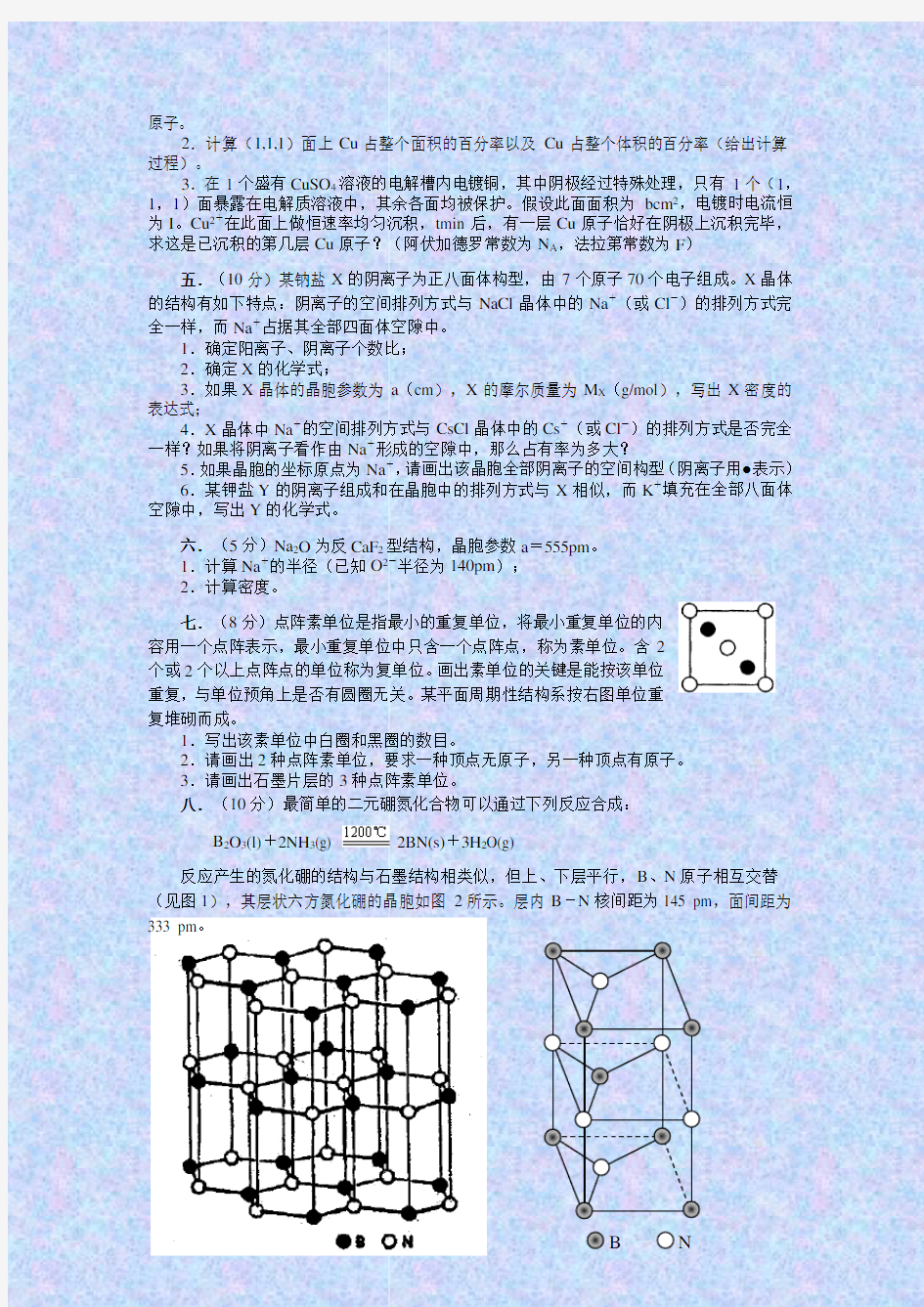
三.(10分)NH4Cl为CsCl型结构,晶胞中包含1个NH4+和
1个Cl-,晶胞参数a=387pm。把等物质的量的NH4Cl和HgCl2在
密封管中一起加热时,生成NH4HgCl3晶体,晶胞参数a=b=419pm、
c=794pm(结构如右图)。
1.已知Cl-半径为181pm,求NH4+(视为球形离子)的半径。
2.计算NH4HgCl3晶体的密度;
3.指出Hg2+和NH4+的Cl-具体配位形式;
4.通过具体计算,指出晶体中Cl-与Cl-之间的最短距离是多少?
四.(8分)金属铜的理想堆积模型为面心立方紧密堆积(CCP),设它的边长为acm。在晶体中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)面。
1.请画出金属铜的晶胞(○表示Cu原子),并涂黑有代表性的1个(1,1,1)面上的Cu
原子。
2.计算(1,1,1)面上Cu占整个面积的百分率以及Cu占整个体积的百分率(给出计算过程)。
3.在1个盛有CuSO4溶液的电解槽内电镀铜,其中阴极经过特殊处理,只有1个(1,1,1)面暴露在电解质溶液中,其余各面均被保护。假设此面面积为bcm2,电镀时电流恒为I。Cu2+在此面上做恒速率均匀沉积,tmin后,有一层Cu原子恰好在阴极上沉积完毕,求这是已沉积的第几层Cu原子?(阿伏加德罗常数为N A,法拉第常数为F)五.(10分)某钠盐X的阴离子为正八面体构型,由7个原子70个电子组成。X晶体的结构有如下特点:阴离子的空间排列方式与NaCl晶体中的Na+(或Cl-)的排列方式完全一样,而Na+占据其全部四面体空隙中。
1.确定阳离子、阴离子个数比;
2.确定X的化学式;
3.如果X晶体的晶胞参数为a(cm),X的摩尔质量为M X(g/mol),写出X密度的表达式;
4.X晶体中Na+的空间排列方式与CsCl晶体中的Cs+(或Cl-)的排列方式是否完全一样?如果将阴离子看作由Na+形成的空隙中,那么占有率为多大?
5.如果晶胞的坐标原点为Na+,请画出该晶胞全部阴离子的空间构型(阴离子用●表示)6.某钾盐Y的阴离子组成和在晶胞中的排列方式与X相似,而K+填充在全部八面体空隙中,写出Y的化学式。
六.(5分)Na2O为反CaF2型结构,晶胞参数a=555pm。
1.计算Na+的半径(已知O2-半径为140pm);
2.计算密度。
七.(8分)点阵素单位是指最小的重复单位,将最小重复单位的内
容用一个点阵表示,最小重复单位中只含一个点阵点,称为素单位。含2
个或2个以上点阵点的单位称为复单位。画出素单位的关键是能按该单位
重复,与单位预角上是否有圆圈无关。某平面周期性结构系按右图单位重
复堆砌而成。
1.写出该素单位中白圈和黑圈的数目。
2.请画出2种点阵素单位,要求一种顶点无原子,另一种顶点有原子。
3.请画出石墨片层的3种点阵素单位。
八.(10分)最简单的二元硼氮化合物可以通过下列反应合成:
B2O3(l)+2NH3(g) 2BN(s)+3H2O(g)
反应产生的氮化硼的结构与石墨结构相类似,但上、下层平行,B、N原子相互交替(见图1),其层状六方氮化硼的晶胞如图2所示。层内B-N核间距为145 pm,面间距为333 pm。
B N
H 3BO 3的层状结构
请回答下列问题:
⑴写出晶胞中B 、N 原子的原子坐标。
B 原子: ,N 原子 。 ⑵试列出求算层状六方氮化硼晶体的密度的计算式:(阿伏加德罗常数用N A 表示) 。
⑶在高压(60 kpa )、高温(2000℃)下,层状六方氮化硼晶体可转化为立方氮化硼, 它与金刚石有类似结构。若立方氮化硼晶胞的边长为a pm ,试列出求算立方氮化硼晶体 中B -N 键键长的计算式: 。
九.(8分)正硼酸(H 3BO 3)是一种片层状结构白色晶体,层内的H 3BO 3分子通过氢键相连(如右图)。
1.正硼酸晶体属于 晶体;
2.片层内微粒间的作用力是上面?片层间微粒间的
作用力又是上面?
3.含1mol H 3BO 3的晶体中有 mol 氢键;
4.以1个片层为研究对象,画出其二维晶胞,并指
出其所包含的内容。
十.(11分)Ar 、Xe 、CH 4、Cl 2等分子能和水形成气体水合物晶体。在这种晶体中,水分子形成三维氢键
骨架体系。在骨架中有空穴,它可以容纳这些气体小分子形成笼型结构。
(1)甲烷的气体水合物晶体成为可燃冰。已知每1m 3这种晶体能释放出164m 3的甲烷气体。试估算晶体中水与甲烷的分子比。(不足的数据由自己假定,只要假设合理均按正确论)
(2)X -射线衍射分析表明,该晶体属于立方晶系,a =1200pm (即晶胞为立方体,边长为1200pm )。晶胞中46个水分子围成两个五角十二面体和六个稍大的十四面体(2个六角形面,12个五角形面),八个CH 4分子可以进入这些多面体笼中。计算甲烷和水的分子数之比和该晶体的密度。
(3)已知Cl 2的气体水合物晶体中,Cl 2和H 2O 的分子数之体为1︰8,在其晶体中水分子所围成的笼型结构与可燃冰相同。推测它的结构。
十一.近年来对于三价铜的研究日益深入,特别随着是钇钡铜氧化物的研究的深入,三价铜化合物越来越受到化学家的重视。起初发现的三价铜化合物为离子化合物,三价铜存在
于阴离子[Cu 2O 6]6-中,目前所发现的三价铜配合物都是四配位的。
1.画出[Cu 2O 6]6-的结构;
2.一种三价铜的稀土化合物LaCuO 3的晶格属立方晶系,氧离子位于棱心,阳离子各占据氧离子所构成的空隙中,其中三价铜离子的配位数是La(Ⅲ)的一半,试画出LaCuO 3的晶胞。
十二.(12分)Q 为多核电中性对称配合物,化学式可写成M 3A 3Cl 3,其中M 为中心原子,A 为一有机配体(由常见元素组成)。A 为中性配体,不带电荷,M 的质量分数为30.70%。空气中灼烧有白烟和刺激性气体生成,A 中也有一C 3轴。将Q 溶解在液氨中得R ,分离溶液后蒸馏结晶再灼烧,得红褐色固体氧化物。R 可由一常见白色难溶物(氯化物)溶解在液氨中制得。
1.M 为何种元素,指出其配位数;
2.推出A 的化学式;
3.画出Q的结构。
十三.(8分)发光材料Y2O2S的晶体属三方晶系,它的六方晶胞参数为:a=378.8pm,c=659.1pm。在晶体中,每个Y原子由3个S原子和4个O原子和它配位,Y原子坐标为±(1/3,2/3,0.71),O原子坐标为±(1/3,2/3,0.36),试画出Y2O2S的晶胞。
十四.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;
2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)
(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?
(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?
(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)
3.计算22nm(直径)粒子的质量,并估算组成原子个数。
十五.(11分)硫化锰MnS是赭色物质,用碱金属硫化物沉淀制得。
1.计算纯水中MnS的溶解度?
已知MnS的K sp为3×10-14,H2S的K1和K2分别为1.0×10-7和1.2×10-13
2.α-MnS晶体属于立方晶系,用X射线粉末法测得该晶体晶胞参数a=522.4pm;
(1)26℃测得该晶体的密度为4.05g/m3,请计算一个晶胞中的离子数;
(2)若某α-MnS纳米颗粒形状为立方体,边长为α-MnS晶胞边长的10倍,请估算其表面原子占总原子数的百分比。(已知S2-的半径0.184nm)
十六.(6分)金属M的晶格是面心立方,密度为8.90g/cm3,计算:
1.Ni晶体中最邻近的原子之间的距离。
2.能放入Ni晶体空隙中的最大原子半径是多少?
2010届高中化学竞赛专题辅导(三)晶体结构答案
一.(9分)下图所示为HgCl2和不同浓度NH3-NH4Cl反应得到的两种含汞的化合物A 和B的微观结构重复单元图。
1.写出A、B的化学式和B的生成反应方程式;
2.晶体A中,NH3、Cl的堆积方式是否相同,为什么?
3.晶体A中Hg占据什么典型位置,占有率是多少?
4.指出B中阴阳离子组成特点;
5.比较A和B在水溶液中溶解性的大小。
答案:1.A:Hg(NH3)2Cl2;B:Hg2(NH2)2Cl2(HgNH2Cl);HgCl2+2NH3=HgNH2Cl+NH4Cl(各1分)
2.都为简单立方堆积(1.5分)
3.占据Cl-形成简单立方的面心,占有率1/6(各1分)
4.B中存在着-Hg-NH2-Hg-锯齿型链和链间的Cl-(1.5分)
5.A比B易溶于水(1分)
二.(14分)钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;
2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)
(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?
(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?
(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)
3.计算22nm(直径)粒子的质量,并估算组成原子个数。
答案:1.H2TiO3+SrCl2+2KOH=SrTiO3+2H2O+2KCl(2分)
2.(1)(2分)
(2)1/4(1分)
(3)容纳Ti4+的八面体空隙处于晶胞的中心,是由6个最邻近的O2-氧负离子所构成。
其他的八面体中心均位于晶胞边棱的中心,虽然最邻近的微粒数也是6,但其中只
有4个是O2-,另外两个是Sr2+。两个正离子Sr2+和Ti4+彼此靠近,从静电学角度
分析是不利的。(2分)
(4)Sr2+半径为(390.5×2-140×2)/2=136pm;
Ti4+半径为(390.5-140×2)/2=55pm(各1分)
Sr2+半径与O2-半径相近,而Ti4+半径小得多,适合填充在八面体空隙中(1.5分)4.ρ=M/N A a3=5.12g/cm3(1分)V=πd3/6=5.57×10-18cm3(0.5分)
m=ρV=2.85×10-17g(1分)N=5×V/a3=4.68×105个(1分)
三。(10分)NH4Cl为CsCl型结构,晶胞中包含1个NH4+和1
个Cl-,晶胞参数a=387pm。把等物质的量的NH4Cl和HgCl2在密封
管中一起加热时,生成NH4HgCl3晶体,晶胞参数a=b=419pm、c=
794pm(结构如右图)。
1.已知Cl-半径为181pm,求NH4+(视为球形离子)的半径。
2.计算NH4HgCl3晶体的密度;
3.指出Hg2+和NH4+的Cl-具体配位形式;
4.通过具体计算,指出晶体中Cl-与Cl-之间的最短距离是多少?
答案:1.154pm (1.5分)
2.ρ=1×325.0/[6.022×1023×(4.19×10-8)2×(7.94×10-8)]=3.87g/cm 3。(1.5分)
3.Hg 2+:压扁的正八面体 NH 4+:压扁的正四棱柱(各1.5分,无压扁各1分)
4.Cl -的空间环境不同,可分为两类:体内的两个Cl -①为一类;棱边中点的4个Cl -②为
另一类。前者距NH 4+较近(335pm ),距Hg 2+也较近(241pm );后者距离NH 4+ 397pm ,距
Hg 2+ 296cm 。Cl -①与邻近晶胞的Cl -的距离最短为3.13pm ,Cl -①与Cl -②的距离为382pm ;Cl -②与Cl -②的距离为419pm 。(4分)
四.(8分)金属铜的理想堆积模型为面心立方紧密堆积(CCP ),设它的边长为acm 。在晶体中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)面。
1.请画出金属铜的晶胞(○表示Cu 原子),并涂黑有代表性的1个(1,1,1)面上的Cu 原子。
2.计算(1,1,1)面上Cu 占整个面积的百分率以及Cu 占整个体积的百分率(给出计算过程)。
3.在1个盛有CuSO 4溶液的电解槽内电镀铜,其中阴极经过特殊处理,只有1个(1,1,
1)面暴露在电解质溶液中,其余各面均被保护。假设此面面积为bcm 2,电镀时电流恒为I 。Cu 2+在此面上做恒速率均匀沉积,tmin 后,有一层Cu 原子恰好在阴极上沉积完毕,求这是已沉积的第几层Cu 原子?(阿伏加德罗常数为N A ,法拉第常数为F )
答案:1.(2分)
2.设Cu 原子半径为r ,r =2a/4,一个(1,1,1)面上有1/2×3+1/6×3=2个Cu 原子。S Cu =2πr 2=πa 2/4,S 总=3a 2/2,S Cu /S 总=3π/6=90.69%。(1.5分)
一个晶胞上有1/2×6+1/8×8=4个Cu 原子。S Cu =16/3πr 3=2πa 3/6,S 总=a 3,S Cu /S 总=2π/6=74.05%。(1分)
2.阴极面上一层Cu 的物质的量为:2/32a b
×2×A N 1=A
N a b 2334;沉积的Cu 原子的物质的量是:F It 260,层数:A N a b F It 23/34/30=Fb
It N a A 23152(3.5分) 五.(10分)某钠盐X 的阴离子为正八面体构型,由7个原子70个电子组成。X 晶体的结构有如下特点:阴离子的空间排列方式与NaCl 晶体中的Na +(或Cl -
)的排列方式完全一样,而Na +占据其全部四面体空隙中。
1.确定阳离子、阴离子个数比;
2.确定X 的化学式;
3.如果X 晶体的晶胞参数为a (cm ),X 的摩尔质量为M X (g/mol ),写出X 密度的表达式;
4.X 晶体中Na +的空间排列方式与CsCl 晶体中的Cs +(或Cl -)的排列方式是否完全一样?
如果将阴离子看作由Na +形成的空隙中,那么占有率为多大?
5.如果晶胞的坐标原点为Na +,请画出该晶胞全部阴离子的空间构型(阴离子用●表示) 6.某钾盐Y 的阴离子组成和在晶胞中的排列方式与X 相似,而K +填充在全部八面体空隙中,写出Y 的化学式。
答案:1.2︰1(1分)
2.Na 2SiF 6(2分)
3.ρ=4M X /N A a 3(1.5分)
4.一样(0.5分) 50%(1分)
5.(正四面体)(2.5分) 6.KPF 6(1.5分)
H 3BO 3的层状结构
六.(5分)Na 2O 为反CaF 2型结构,晶胞参数a =555pm 。
1.计算Na +的半径(已知O 2-半径为140pm );
2.计算密度。
答案:1.100.32pm (2分)
2.2.41g/cm 3(3分)
七.(8分)点阵素单位是指最小的重复单位,将最小重复单位的内容
用一个点阵表示,最小重复单位中只含一个点阵点,称为素单位。含2个或2
个以上点阵点的单位称为复单位。画出素单位的关键是能按该单位重复,与
单位预角上是否有圆圈无关。某平面周期性结构系按右图单位重复堆砌而成。
1.写出该素单位中白圈和黑圈的数目。
2.请画出2种点阵素单位,要求一种顶点无原子,另一种顶点有原子。
3.请画出石墨片层的3种点阵素单位。
答案:1.●○(1分)
2. (各2分)
3.(各1分)
八.(8分)正硼酸(H 3BO 3)是一种片层状结构白色晶体,层内的H 3BO 3分子通过氢键相连(如右图)。
1.正硼酸晶体属于 晶体;
2.片层内微粒间的作用力是上面?片层间微粒间的作
用力又是上面?
3.含1mol H 3BO 3的晶体中有 mol 氢键;
4.以1个片层为研究对象,画出其二维晶胞,并指出
其所包含的内容。
答案:1.分子(1.5分)
2.共价键、氢键(1分) 分子间作用力(1分)
3.3(1.5分) 4.(2分) 2H 3BO 3(1分)(B 的排列类似石墨)
九.(10分)最简单的二元硼氮化合物可以通过下列反应合成:
B N
B 2O 3(l)+2NH 3(g) 2BN(s)+3H 2O(g)
反应产生的氮化硼的结构与石墨结构相类似,但上、下层平行,B 、N 原子相互交替 (见图1),其层状六方氮化硼的晶胞如图2所示。层内B -N 核间距为145 pm ,面间距为333 pm 。
请回答下列问题:
⑴写出晶胞中B 、N 原子的原子坐标。 B 原子: ,N 原子 。 ⑵试列出求算层状六方氮化硼晶体的密度的计算式:(阿伏加德罗常数用N A 表示) 。
⑶在高压(60 kpa )、高温(2000℃)下,层状六方氮化硼晶体可转化为立方氮化硼, 它与金刚石有类似结构。若立方氮化硼晶胞的边长为a pm ,试列出求算立方氮化硼晶体 中B -N 键键长的计算式: 。 答案:(10分,每空2分)
⑴(4分)
B 原子 (0,0,0) (31,32,21)或(32,31,2
1)(2分) N 原子 (0,0,21) (31,32,0)或(32,3
1,0) (2分) ⑵3
3021A 1cm 1033322
2145)3(mol -mol 14.01)g (10.812-??????-?+?=N ρ (3分) ⑶d (B -N)=a 4
3 (3分) 十.(11分)Ar 、Xe 、CH 4、Cl 2等分子能和水形成气体水合物晶体。在这种晶体中,水分子形成三维氢键骨架体系。在骨架中有空穴,它可以容纳这些气体小分子形成笼型结构。
(1)甲烷的气体水合物晶体成为可燃冰。已知每1m 3这种晶体能释放出164m 3的甲烷气体。试估算晶体中水与甲烷的分子比。(不足的数据由自己假定,只要假设合理均按正确论)
(2)X -射线衍射分析表明,该晶体属于立方晶系,a =1200pm (即晶胞为立方体,边
长为1200pm)。晶胞中46个水分子围成两个五角十二面体和六个稍大的十四面体(2个六角形面,12个五角形面),八个CH4分子可以进入这些多面体笼中。计算甲烷和水的分子数之比和该晶体的密度。
(3)已知Cl2的气体水合物晶体中,Cl2和H2O的分子数之体为1︰8,在其晶体中水分子所围成的笼型结构与可燃冰相同。推测它的结构。
25. (1)假设甲烷气体体积果折合成标准状况下的数据,为7.32kmol。设甲烷水合物晶体的密度与冰密度是相同的,为1g/cm3,则其中的水有:55.56kmol,因此:CH4︰H2O=1︰7.6。说明:甲烷水合物的组成可能是6CH4·46H2O。以上是最简单的参考答案,只要答案为CH·7~9H2O,均可按满分计。(4分)
(2)n(CH4)︰n(H2O)=8︰46=4︰23(1分);ρ=0.92g/cm3。(3分)
(3)由于n(Cl2):n(H2O)=1︰8=6︰48。因此,十四面体笼填入6个Cl2,2H2O 进入十二面体笼。(3分)
十一.近年来对于三价铜的研究日益深入,特别随着是钇钡铜氧化物的研究的深入,三价铜化合物越来越受到化学家的重视。起初发现的三价铜化合物为离子化合物,三价铜存在于阴离子[Cu2O6]6-中,目前所发现的三价铜配合物都是四配位的。
1.画出[Cu2O6]6-的结构;
2.一种三价铜的稀土化合物LaCuO3的晶格属立方晶系,氧离子位于棱心,阳离子各占据氧离子所构成的空隙中,其中三价铜离子的配位数是La(Ⅲ)的一半,试画出LaCuO3的晶胞。
答案:1.O
Cu3-
O
O
O
Cu3-
O
O
2.
十二。(12分)Q为多核电中性对称配合物,化学式可写成M3A3Cl3,其中M为中心原子,A为一有机配体(由常见元素组成)。A为中性配体,不带电荷,M的质量分数为30.70%。空气中灼烧有白烟和刺激性气体生成,A中也有一C3轴。将Q溶解在液氨中得R,分离溶液后蒸馏结晶再灼烧,得红褐色固体氧化物。R可由一常见白色难溶物(氯化物)溶解在液氨中制得。
1.M为何种元素,指出其配位数;
2.推出A的化学式;
3.画出Q的结构。
十三。(8分)发光材料Y2O2S的晶体属三方晶系,它的六方晶胞参数为:a=378.8pm,c =659.1pm。在晶体中,每个Y原子由3个S原子和4个O原子和它配位,Y原子坐标为±(1/3,2/3,0.71),O原子坐标为±(1/3,2/3,0.36),试画出Y2O2S的晶胞。
十四。(14分)
钛酸锶是电子工业的重要原料,与BaTO3相比,具有电损耗低,色散频率高,对温度、机械应变、直流偏场具有优良稳定性。因此可用于制备自动调节加热元件、消磁元器件、陶瓷电容器、陶瓷敏感元件等。制备高纯、超细、均匀SrTiO3的方法研究日益受到重视。我国研究者以偏钛酸为原料常压水热法合成纳米钛酸锶,粒子呈球形,粒径分布较均匀,平均22nm。已知SrTiO3立方晶胞参数a=390.5pm。
1.写出水热法合成纳米钛酸锶的反应方程式;
2.SrTiO3晶体的结构可看作由Sr2+和O2-在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由O2-构成,另一种由Sr2+和O2-一起构成,Ti4+只填充在O2-构成的八面体空隙中。
(1)画出该SrTiO3的一个晶胞(Ti4+用小球,O2-用大○球,Sr2+用大球)
(2)容纳Ti4+的空隙占据所有八面体空隙的几分之几?
(3)解释为什么Ti4+倾向占据这种类型的八面体空隙,而不是占据其他类型的八面体空隙?
(4)通过计算说明和O2-进行立方密堆积的是Sr2+而不是Ti4+的理由(已知O2-半径为140pm)
3.计算22nm(直径)粒子的质量,并估算组成原子个数。
答案:1.H2TiO3+SrCl2+2KOH=SrTiO3+2H2O+2KCl(2分)
2.(1)(2分)
(2)1/4(1分)
(3)容纳Ti4+的八面体空隙处于晶胞的中心,是由6个最邻近的O2-氧负离子所构成。
其他的八面体中心均位于晶胞边棱的中心,虽然最邻近的微粒数也是6,但其中只
有4个是O2-,另外两个是Sr2+。两个正离子Sr2+和Ti4+彼此靠近,从静电学角度
分析是不利的。(2分)
(4)Sr2+半径为(390.5×2-140×2)/2=136pm;
Ti4+半径为(390.5-140×2)/2=55pm(各1分)
Sr2+半径与O2-半径相近,而Ti4+半径小得多,适合填充在八面体空隙中(1.5分)4.ρ=M/N A a3=5.12g/cm3(1分)V=πd3/6=5.57×10-18cm3(0.5分)
m=ρV=2.85×10-17g(1分)N=5×V/a3=4.68×105个(1分)
十五。(11分)硫化锰MnS是赭色物质,用碱金属硫化物沉淀制得。
1.计算纯水中MnS的溶解度?
已知MnS的K sp为3×10-14,H2S的K1和K2分别为1.0×10-7和1.2×10-13
2.α-MnS晶体属于立方晶系,用X射线粉末法测得该晶体晶胞参数a=522.4pm;
(1)26℃测得该晶体的密度为4.05g/m3,请计算一个晶胞中的离子数;
(2)若某α-MnS纳米颗粒形状为立方体,边长为α-MnS晶胞边长的10倍,请估算其表面原子占总原子数的百分比。(已知S2-的半径0.184nm)
答案:1.S2-+H2O HS-+OH-K b=K w/K2=0.083
MnS的溶解度为x mol/L,x=[Mn2+]=[HS-]=[OH-]。
[S2-]=[HS-][OH-]/K b=x2/0.083
[Mn2+][S2-]=x(x)2/0.083=K sp=3×10-14x=1.4×10-5(4分)
2.(1)Z=N A VD/M=4 即晶胞中含有4个[MnS],8个离子。(3分)
(2)该纳米颗粒(立方体)边长为10×522.4pm=5.224nm。
设表面层厚度为S2-的直径,即2×0.184nm=0.368nm
表面原子占总原子数的百分比为:
1-(5.224-0.368)3nm3/(5.224nm)3×100%=20%(3分)
十六。(6分)金属M的晶格是面心立方,密度为8.90g/cm3,计算:
1.Ni晶体中最邻近的原子之间的距离。
2.能放入Ni晶体空隙中的最大原子半径是多少?
答案:1.一个晶胞中有Ni:8×1/8+6×1/2=4(个)
设晶胞边长为acm
4×58.69/(6.02×1023×a3)=8.90 得a=352.5(pm)
最邻近的Ni原子是顶角与面心的两个N i原子d min=2a/2=249.3(pm)(3分)
2.八面体空隙显然要大于四面体空隙
2r Ni=d min,2r x+2r Ni=a,所以rx=51.6(pm)
故最大填隙原子半径为51.6pm。(3分)
高中化学竞赛专题辅导:有机反应历程(四)
有机反应历程(四) 【例1】芳香族化合物氯苯(Ⅰ)、硝基苯(Ⅱ)、N,N‐二甲苯胺(Ⅲ)、苯甲醚(Ⅳ)等进行硝化时,其反应速度的快慢顺序如何? A.Ⅰ>Ⅱ>Ⅲ>Ⅳ B.Ⅲ>Ⅳ>Ⅰ>Ⅱ C.Ⅳ>Ⅲ>Ⅱ>Ⅰ D.Ⅱ>Ⅰ>Ⅳ>Ⅲ 解:B。 【例2】某溴苯与Br2+FeBr3反应只得到一种三溴苯产物,该溴苯应为: 解:C。因‐Br是邻对位定位基,所以,A.和B.都有两种三溴苯产物,而D.有3种三溴苯产物。 (2)亲核取代反应 在特殊结构或特殊条件下产生。 ①加成—消除历程 芳环上有吸电子基使之活化,以‐NO2最强, 如OH‐、CN‐、‐OR、胺等。生成碳负离子络合物中间体叫Meisenheimer络合物。例如, 已被核磁和X射线所证实。 【例3】2,4‐二硝基氯苯和氨发生反应生成2,4‐二硝基苯胺的反应历程是什么? A.亲电取代反应 B.双分子消除—加成反应 C.双分子加成—消除反应 D.单分子亲核取代反应 答:C. ②苯炔历程(消除—加成历程)发生于试剂碱性很强时。 特征为亲核试剂不一定进入离去基团所在位置上,可以在它的邻位。 【例4】氯苯与氨基钠在液氨中作用生成苯胺时,其反应可能的中间体是什么? A.碳正离子 B.卡宾Carbene C.碳负离子 D.苯炔 解: 故为D.
5.饱和碳原子上的亲核取代反应 通式是:Nu‐+R-L→NuR+L‐ 其中Nu‐表示亲核试剂,可以是负离子或带未共享电子对的中性分子;R—L表示作用物、为中性分子或正离子;L表示离去基团。 反应进行有两种类型,一种是单分子亲核取代反应SN1,速率=k1[RL];另一种为双分子亲核取代反应S N2,速率=k2[RL][Nu‐:]。S N2为一步反应,亲核试剂进攻与离去基团离去同时发生。例如: SN1为二步反应,先离解成碳正离子,随即快速的受试剂进攻。例如, 其势能图如图4-1所示。 判断反应按S N2或S N1进行,可从作用物结构、亲核试剂亲核性强弱、离去基团离去的难易及溶剂极性等方面分析,从产物的立体化学及改变反应条件对反应速度的影响来判别。 作用物结构: 【例1】在加热条件下,下列化合物分别与氢氧化钠水溶液作用,反应最快的是哪一个? A.氯乙烷B.氯乙烯 C.3‐氯丙烯 D.氯甲烷 答:C.,S N1与S N2均最快。 凡使碳正离子稳定的因素,有利于S N1;空间障碍小,有利于S N2;α和β位有大的取代基,不利于S N2。 亲核试剂亲核性强,有利于S N2,亲核原子相同时,碱性与亲核性有平行关系,如O原
高中化学竞赛-晶体结构-10年真题加完整答案
(2000)4.理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚 MgO单晶如附图1所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面 是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶 的八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。(6分) 【答案】 ; 所有原子都是Mg(3分)所有原子都是O(3分) 注:画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。 (2000)5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角 和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。 【答案】Ti14C13(2分)说明:凡按晶胞计算原子者得零分。 (2001)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。 5-1 由图5-1可确定硼化镁的化学式为:。 5-2 在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。 图5-1硼化镁的晶体结构示意图 第5题(5分)5-1 MgB2(2分)(注:给出最简式才得分)
或 a = b ≠ c,c轴向上(3分) 5-2 (注:任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。) (2001)第10题(5分)最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。回答如下问题: 10-1 以上反应看起来很陌生,但反应类型上却可以跟中学化学课本中的一个化学反应相比拟,后者是:。 10-2 上述阴离子[CB11H6Cl6]-的结构可以跟图10-1的硼二十面体相比拟,也是一个闭合的纳米笼,而且,[CB11H6Cl6]-离子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过。请在图10-1右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。 图10-1 第10题(5分)NH3+HCl = NH4Cl (2分) (注:答其他非质子转移的任何“化合反应”得1分)。(3分)(注:硼上氢氯互换如参考图形仍按正确论,但上下的C、B分别连接H和Cl,不允许互换。) (2001)第11题(10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则: 11-1 第二层离子有个,离中心离子的距离为 d,它们是离子。 11-2 已知在晶体中Na+离子的半径为116pm,Cl-离子的半径为167pm,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。 11-3 纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
历年高中化学竞赛有机题
历年有机试题 一. 有机结构 (1999)第六题(10分)曾有人用金属钠处理化合物A (分子式C 5H 6Br 2,含五元环),欲得产物B ,而事实上却得到芳香化合物C (分子式C 15H 18)。 6-1请画出A 、B 、C 的结构简式。 6-2为什么该反应得不到B 却得到C ? 6-3预期用过量酸性高锰酸钾溶液处理C ,得到的产物是D ,写出D 的结构式。 [解题思路] 1.对比产物C 的分子式(C 15H 18)和起始物A 的分子式(C 5H 6Br 2)可见一个C 分子是3个A 分子脱去溴原子连接而成的,而且A 转化为C 的反应是用金属钠消除A 分子中的溴。可见此题并没有要求应试者必须学过武兹反应,此思路的知识基础没有超过中学化学。 2.试题用A 是溴代环戊烯和C 是芳香化合物2个信息同时限定了A 和C 的结构。溴代环戊烯因溴原子连在不同碳原子上而有多种位置异构体,它们与金属钠反应失去溴连接的方式更多,但是,为满足C 是分子式为C 15H 18的芳香化合物(至少要有一个含共轭双键的苯环)的条件,A 必须是1,2-二溴环戊烯,C 必定有答案给出的结构式。应试者得出这个结论的过程和花费的时间自然很不相同,有的学生可能在草稿纸画满各种各样的二溴环戊烯,并令其脱溴相连,甚至得出很大的环状化合物,有的学生则只需在脑子里想清楚,其差别不是知识水平高低而是智力水平高低。在思考过程中,下述联想是有助于应试者得出结论: 3.为什么A 与金属钠反应会得到C 呢?如果应试者联想起中学化学里学过乙炔合成苯的反应,就会想到,A 脱去溴首先得到的应是含C C 键的环戊炔(B ),既然乙炔经催化可三聚成苯,对比乙炔和环戊炔的结构,理应联想到中学化学学到:乙炔的碳氢处在一条直线上(《化学读本》的sp 杂化当然有帮助,属竞赛大纲要求,但并非必需),环戊炔的炔碳在五元环上,其不稳定性就不至犹豫,不需催化剂也会聚合就在意料之中。 4.命题人考虑到环戊烯不稳定,有的学生可能将B 写成它的双聚物,以求得到较稳定的化合物,因而答双聚体也算对,而且对两种B 的不稳定给了注释性说明(注:不要求学生达到这种注释水平)。 5.C 的氧化可看成是苯环的侧链碳原子的氧化。中学化学里讲过甲苯氧化得苯(甲)酸,去年初赛题分析里讨论过芳香烃侧链氧化的规律,应试者一般研究过去年初赛题,所以由C 得出D 应不是困难的事。但是,这里仍有很强的智力因素,应试者若被C 的复杂结构迷惑住,不注意分子的核心部位是一个苯环,对题目给出的C 是芳香化合物的信息视而不见,D 是什么就很难答上来,到事后才恍然大悟。 [答案] 6-1 各2分 若答B 的结构式为: 亦给2分 6-2 要点:B 不稳定 (2分) 注:前者的炔碳原子通常为sp 杂化轨道,线性,环炔的张力太大;后者为反芳香性。 6-3 A B C
(完整word版)高中化学选修3第三章晶体结构与性质讲义及习题
高中化学选修三第三章晶体结构与性质 一、晶体常识 1、晶体与非晶体比较 2、获得晶体的三条途径 ①熔融态物质凝固。 ②气态物质冷却不经液态直接凝固(凝华)。 ③溶质从溶液中析出。 3、晶胞 晶胞是描述晶体结构的基本单元。晶胞在晶体中的排列呈“无隙并置”。 4、晶胞中微粒数的计算方法——均摊法 某粒子为n个晶胞所共有,则该粒子有1/n属于这个晶胞。中学常见的晶胞为立方晶胞。 立方晶胞中微粒数的计算方法如下: ①晶胞顶角粒子为8个晶胞共用,每个晶胞占1/8 ②晶胞棱上粒子为4个晶胞共用,每个晶胞占1/4 ③晶胞面上粒子为2个晶胞共用,每个晶胞占1/2 ④晶胞内部粒子为1个晶胞独自占有,即为1 注意:在使用“均摊法”计算晶胞中粒子个数时要注意晶胞的形状。 二、构成物质的四种晶体 1、四种晶体的比较
晶体类型分子晶体原子晶体金属晶体离子晶体熔沸点很低很高一般较高,少部分低较高 溶解性相似相溶难溶于任何溶剂难溶于常见溶剂(Na等 与水反应) 大多易溶于水等 极性溶剂 导电传热性一般不导电,溶于水 后有的导电 一般不具有导电 性(除硅) 电和热的良导体 晶体不导电,水溶 液或熔融态导电 延展性无无良好无 物质类别及实例气态氢化物、酸(如 HCl、H2SO4)、大多数 非金属单质(如P4、 Cl2)、非金属氧化物 (如SO2、CO2,SiO2 除外)、绝大多数有机 物(有机盐除外) 一部分非金属单 质(如金刚石、硅、 晶体硼),一部分 非金属化合物(如 SiC、SiO2) 金属单质与合金(Na、 Mg、Al、青铜等) 金属氧化物(如 Na2O),强碱(如 NaOH),绝大部分 盐(如NaCl、CaCO3 等) (1)不同类型晶体的熔、沸点高低一般规律:原子晶体>离子晶体>分子晶体。 金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点很高,汞、铯等熔、沸点很低。 (2)原子晶体 由共价键形成的原子晶体中,原子半径小的键长短,键能大,晶体的熔、沸点高。如熔点:金刚石>碳化硅>硅 (3)离子晶体 一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,相应的晶格能大,其晶体的熔、沸点就越高。 (4)分子晶体 ①分子间作用力越大,物质熔、沸点越高;具有氢键的分子晶体熔、沸点反常的高。 ②组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高。 ③组成和结构不相似的物质(相对分子质量接近),分子的极性越大,熔、沸点越高。 ④同分异构体,支链越多,熔、沸点越低。 (5)金属晶体 金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点就越高。 三、几种典型的晶体模型 晶体晶体结构示意图晶体中粒子分布详解 CsCl 晶体每8个Cs+、8个Cl-各自构成立方体,在每个立方体的中心有一个异种粒子(Cs+或Cl-)。在每个Cs+周围最近的等距离(设为a/2)的Cl-有8个,在每个Cs+周围最近的等距离(必为a)的Cs+有6个(上下左右前后),在每个Cl-周围最近的等距离的Cl-也有6个
2007年全国高中学生化学竞赛试题及详解
2007年全国高中学生化学竞赛(省级赛区)试题 (时间:3小时满分:100分) 第1题(12分) 通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)4。 1-1已知反应分两步进行,试用化学方程式表示上述溶解过程。 早在上世纪50年代就发现了CH5+的存在,人们曾提出该离子结构的多种假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H键的键长相等。 1-2该离子的结构能否用经典的共价键理论说明?简述理由。 1-3该离子是()。 A.质子酸 B.路易斯酸 C.自由基 D.亲核试剂 2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下: 1-4该分子的分子式为; 1-5该分子有无对称中心? 1-6该分子有几种不同级的碳原子? 1-7该分子有无手性碳原子? 1-8该分子有无手性? 第2题(5分) 羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下: NH2OH+HN﹡O2→ A+H2O NH2OH+HN﹡O2→ B+H2O A、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。 请分别写出A和B的路易斯结构式。 第3题(8分)
3-1 以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。 3-2计算一个六方晶胞中“MgCl2”的单元数。 3-3 假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型? 第4题(7分) 化合物A是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表: 利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程。 第5题(10分) 甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g样品,与25 mL 4mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50 mL20%硝酸后,用25.00mL 0.1000mol·L-1硝酸银水溶液处理,再用0.1000mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL。 5-1 写出分析过程的反应方程式。 5-2 计算样品中氯化苄的质量分数(%)。 5-3 通常,上述测定结果高于样品中氯化苄的实际含量,指出原因。 5-4 上述分析方法是否适用于氯苯的纯度分析?请说明理由。
高中化学竞赛辅导参考资料(全)
绪论 1.化学:在分子、离子和原子层次上,研究物质的组成和结构以及物质的化学 性质和化学变化及其内在联系的科学。 应注意的问题: (1)化学变化的特点:原子核组成不变,发生分子组成或原子、离子等结合方式的改变; (2)认为物理变化不产生质变,不生成新物质是不准确的,如: 12H+3 1 H==42He+10n是质变,产生了新元素,但属于物理变化的范畴; (3)化学变化也有基本粒子参加,如:2AgCl==2Ag+Cl2就有光子参加; (4)物质 2.无机化学:除去碳氢化合物及其大多数衍生物外,对所有元素和他们的化合 物的性质和反应进行研究和理论解释的科学。(莫勒提法) 3.怎样学习无机化学? (1)你所积累的好的学习方法都适于学习无机化学。 (2)课前预习,带着问题听课。提倡写预习笔记。 (3)课上精力集中,边听边看边想边记,眼、耳、手、脑并用。 (4)课后趁热复习,按时完成作业,及时消化,不欠账。 (5)提高自学能力,讨论课积极发言。 (6)随时总结,使知识系统化。达到书越读越薄之目的。 (7)理论联系实际,做好化学实验。
第一章原子结构和原子周期系 教学目标:1.学会一个规则:斯莱特规则; 2.掌握两个效应:屏蔽效应、钻穿效应; 3.掌握三个原理:能量最低、保里不相容、洪特规则; 4.掌握四个量子数:n、l、l、m s 5.掌握五个分区:s、p、d、ds、f 6.掌握六对概念; 7.掌握七个周期; 8.掌握八个主族八个副族。 重点:1.原子核外电子排布三个原理,核外电子的四个量子数; 2.元素周期表的结构其及元素性质变化规律。 难点:屏蔽效应、钻穿效应概念及应用; 教学方法:讲授与讨论相结合,做适量练习题和作业题。 教学内容: §1-1经典物理学对原子结构的认识 1-1原子的核形结构 1708年卢瑟福通过α粒子散射实验确认:原子是由中央带正电的原子核和周围若干绕核旋转的电子组成。遇到的问题:电子绕核运动,将不断辐射电磁波,不断损失能量,最终将落到核上,原子因此而消亡实际与此相反,原子是稳定存在的,急需找到理论解释。 1-2 原子光谱的规律性 1光谱一束光通过分光棱镜折射后再屏幕上得到一条彩带或线形亮条前者称连续光谱后者称线形光谱太阳光电灯光为连续光谱原子光谱为线形光谱图1-1 2氢原子光谱里德堡方程 R H=1.097×10 M n1 元素化学专题练习 1.I2和S2O32-间发生的是一个速率快、定量进行的反应。由于强酸能促进S2O32-的分解, 而强碱液中I2将发生歧化反应,所以该反应需在近中性条件下进行。 ⑴写出I2和S2O32-间发生的反应方程式; ⑵若把I2液滴入S2O32-液中,即使在碱性条件下(pH~11)也能发生定量反应,为什 么? ⑶若把S2O32-液滴入I2液中,即使在酸性条件下(pH~1)仍能发生定量反应,为什 么? 2.氧和硫是同族元素,性质相似。试用化学方程式表示下列实验事实: ⑴CS2和Na2S (aq)一起振荡,水溶液由无色变成有色; ⑵SnS2溶于Na2S (aq); ⑶SnS溶于Na2S2 (aq)。 3.试用一种试剂将可溶性硫化物、多硫化物、亚硫酸盐、硫代硫酸盐和硫酸盐彼此区分开 来。写出反应方程式和反应现象。 4.给出SOCl2分子的空间构型和成键情况,为什么SOCl2既可以作为路易斯酸,又可作为 路易斯碱? 5.某液体物质A具有与CO2相似的结构,A与Na2S反应生成化合物B,B遇酸能产生恶 臭的有毒气体C及物质A,C可使湿润的醋酸铅试纸变黑。A与Cl2在MnCl2催化下作用可生成一种不能燃烧的液体物质D;A与Cl2O作用则生成极毒气体E和透明液体F。 试推断从A到F各代表什么物质? 6.欲测定大气中H2S的含量,试用Cd (NO3)2溶液、I2溶液及Na2S2O3溶液为试剂,设计 一种测定方法,写出有关反应式,导出大气中H2S含量的计算公式(以质量分数表示)(设Cd (NO3)2溶液浓度为M1 mol·L-1;I2溶液浓度为M2 mol·L-1;Na2S2O3溶液浓度为M3 mol·L-1;H2S的摩尔质量为34 g·mol-1。 7.SO2分子中,S原子已满足八隅体规则,为什么还可以作为路易斯酸接受电子对形成配 合物?试给出SO2F-和(CH3)3NSO2可能的结构并预测它们与OH-的反应。 8.现有五瓶无色溶液分别是Na2S,Na2SO3,Na2S2O3,Na2SO4,Na2S2O8,如何通过试验 加以确认,写出有关反应方程式。 第17讲有机化合物的合成 学号姓名得分1、由指定原料及其他必要的无机及有机试剂合成下列化合物:(1)由丙烯合成甘油。 (2 )由丙酮合成叔丁醇。 (3)由1 -戊醇合成2-戊炔。 (4)由乙炔合成CH3CH2CH2CH2CH2CH2CH 3。 (5)由CH3CH2CH2CHO合成 2、试用化学方程式表示以乙烯、为主要原料制备肉桂醛()的过程。 3、用一步或几步反应完成下列甾体化合物的转化。 4、已知苯磺酸在稀硫酸中可以水解而除去磺酸基: 又知苯酚与浓硫酸易发生磺化反应: 请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。 5、由甲苯为原料,加入必要的有机、无机试剂合成 6、以C2H5OH为原料,加入必要的无机试剂合成CH3CH2CH2CH2OH。 7、以BrCH2CH(CH3)2为原料制取2-甲基-1,2-丙二醇。 8、环氧树脂(一种黏合剂)的重要原料是环氧氯丙烷(),试以丙烯为原料加必要的试剂合成之。 9、用你掌握的苯及其衍生物性质的有关知识,写出以最短的流程制备苯甲酸乙酯以及o–、m–、p–氨基苯甲酸反应的化学方程式。 10、请用苯及任选无机试剂合成3,5-二溴硝基苯。 11、以丙二酸二乙酯制备2-苄基丁二酸。 12、请使用不超过4个碳原子的开链有机化合物及任选无机试剂合成2,4-甲基戊酸。 13、(1)写出(CH3)2CHOCH2CH3的两种合成方法,并解释哪种合成法较好; (2)今需合成甲基叔丁基醚[CH3OC(CH3)3],有人用甲醇钠[CH3ONa] 加到叔丁基氯[(CH3)3CCl] 中来制备,未能得到所需产物。指出在此反应中得到了什么产物?应该怎样合成甲基叔丁基醚? 14、动物之间的信息传递除了声音、光电信号外,在低等动物中,如昆虫,还能分泌化学物质作为种群个体之间的通讯工具,这就是所谓“化学通讯”。棉铃象(一种象鼻虫)的性引诱剂就是这类化学物质。它是混合物,含有单环萜烯醇E和萜烯醛F和H。人工合成棉铃象性引诱剂是杀灭这种棉花害虫的绿色农药。其合成路线如下: O +CH3MgI CuCl2H 3O+ A (1) BrZnCH2CO2C2H5 (2)3+ CO2Et HO (1) KOH 23+ B (1) (CH3CO)2O 23 + CO2C2H5 + CO2C2H5 +C+D (i) (ii) C LiAlH4 E MnO2 CHO (F) (iii) E LiAlH4 G MnO2 H 问题:分别写出上面以A、B、C、D、E、G、H为代号的各化合物的结构简式。 15、丙炔醇(A)在精细有机合成中是一个重要的化合物,可由乙炔与一分子甲醛反应制得。在氨基锂等强碱存在下,丙炔醇与卤代烃反应可得到各种取代的丙炔醇,这是制备一元伯醇的方法:HC≡CCH2OH + RBr RC≡CCH2OH 化合物B,C,D和E均可以经由上述反应合成 高二化学竞赛辅导培训计划 一、辅导思想 1、举全备课组之力参与竞赛辅导。 2、辅导教师认真备课、上课,精心辅导。 3、辅导教师严格学生课堂管理。 4、强调竞赛辅导纪律,关注参赛学生进出教室。 二、辅导要求 教师方面:1.多研讨,多做题。 2.加强资料的搜集和分类管理。 3.做好学生的出勤和考试管理。 学生方面:1.加强出勤,保证出满勤; 2.创造条件,使学生能在足够时间完成相关内容。 3.加强指导,努力提高学生的兴趣和信心。 三、辅导计划 1.把选拔出的选手组成竞赛班,以讲座的形式复习基础知识,这个阶段是较大规模的复习训练。 2.进入专题训练。以小专题的形式加强训练。 3. 模拟考试。这个阶段主要任务是设计模拟竞赛试卷,改卷,评卷。取材范围广,如历届赛题,培训题等等。这一阶段要求老师与学生充分发挥主观能动性,认真严肃对待每一次测试,限时保质保量完成。 四、做好竞赛学生工作 1. 抓好竞赛学生的思想工作 2. 引导竞赛学生掌握正确的学习方法 3. 抓好课堂教学中基础知识的掌握与竞赛能力的培养 4. 抓好知识的拓宽、加深,培养竞赛拔尖人才 五、辅导时间 利用晚上化学自习进行,其它时间待定 六、负责老师: 每位教师按要求精心组织竞赛内容,力求习题精选,知识点覆盖全面,涉及常见易错点。当堂讲解知识点及习题,有针对性和突破性的专题辅导。 七、辅导措施: 1、注重基础知识训练。 由于竞赛命题大多以课本为依据,因此在辅导时要紧扣课本,严格按照由浅入深、由易到难、由简到繁、循序渐进的原则,适时联系课本内容。 2、不拘泥于课本,适当扩展深度。 由于竞赛题目往往比平时考试试题难,教师必须在课本的基础上加以延伸、拓 2020届高中化学竞赛辅导(一)原子结构元素周期 律 原子结构元素周期系 一.〔4分〕某元素的离子R2+有5个电子层,最外层有2个电子,R(NO3)2是它的一种常见盐。R的元素符号是,R元素在周期表中的位置是,配制澄清R(NO3)2溶液的方法是。 二.〔2分〕235 92U原子吸取一个慢中子后,分裂成136 54 Xe和90 38 Sr,写出核反应方程式。 三.〔7分〕有人建议依照〝最高价阳离子〞电子排布的相似性和差异性来分主副族。例如:S、Cr规定为ⅥA族;Se规定为ⅥB族。 1.写出S、Cr、Se最高价阳离子的电子构型; 2.周期数和每周期元素个数是否发生变化; 3.新旧周期表中哪些族的元素是统一的〔即完全相同〕 4.不同的新的主、副族元素在原周期表的基础上做如何样的变动? 四.美国和俄罗斯科学家组成的一个研究小组10月16日宣布,他们成功制造出了门捷列夫元素周期表中的118号元素。他们通过设在俄罗斯杜布纳的U400回旋加速器实验设备,两次将许多钙-48离子加速,用来轰击人造元素锎〔Cf〕-249,从而制造出3颗新原子:每颗新原子的原子核包含118个质子和179个中子。118号元素原子存在时刻仅为0.9毫秒。研究人员观看到了118号元素原子的〝衰变链〞过程,证实了新元素的存在。其衰变过程中依次开释出一种相同的粒子后得到116、114、112号元素,112号元素最终裂变为两颗大小差不多的其他原子。 1.指出118号元素在周期表中的位置; 2.写出合成118号元素的核反应方程式; 3.指出衰变过程中112号元素模样的质量数。 五.〔4分〕2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X和Y。 X是用高能48Ca撞击243 93Am靶得到的。通过100微秒,X发生α-衰变,得到Y。然后Y连 续发生4次α-衰变,转变为质量数为268的第105号元素Db的同位素。以X和Y的原子序数为新元素的代号〔左上角标注该核素的质量数〕,写出上述合成新元素X和Y的核反应方程式。 高中化学竞赛用书推荐 常规/高考类: 化学岛 用户名: 密码:woaihuaxuedao 以下是另一个公邮 icholand. 密码:huaxuedaogongyou 提供公共邮箱的目的还是方便大家交流,如果遇到超出流量限制的问题,可以直接把邮件转发出去。 尽管以前有XX的Gbaopan。。但是貌似很多人并不清楚密码。。 附上: 部分优秀资料帖索引 《高中化学重难点手册》(华中师范大学出版社,王后雄老师主编);历年高考试题汇编(任何一种,最好有详细解析的,比如三年高考两年模拟);《高中化学读本》(很老的人民教育出版社甲种本化学教材,最近有更新版本);《高中化学研究性学习》(龙门书局,施华、盛焕华主编)南师大化科院创办的《化学教与学》每年的十套高考模拟题题型新颖质量比较高,可作为江苏预赛的模拟卷,不少5月份预赛原题就出自本套模拟题。 初赛类: 比较经典的有《化学高考到竞赛》(陕西师范大学出版社,李安主编,比较老);《高中化学奥林匹克初级本》(江苏教育出版社,段康宁主编);《高中化学竞赛初赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《高中化学竞赛热点专题》(湖南师范大学出版社,肖鹏飞、苏建祥、周泽宇主编,版本比较老,但编排体系不错);最新奥林匹克竞赛试题评析·高中化学》(南京师范大学出版社,马宏佳主编,以历年真题详细解析为主,可作为课外指导);《最新竞赛试题选编及解析高中化学卷》(首都师范大学出版社);《化学竞赛教程》(华东师范大学出版社,三本,王祖浩、邓立新、施华等人编写,适合同步复习),还有一套西南师范大学出版社的《奥林匹克竞赛同步教材·高中化学》(分高一、高二和综合卷,综合卷由严先生、吴先生、曹先生等参加编写,绝对经典),还有浙江大学出版社《高中化学培优教程》AB教程、《金牌教程·高一/二化学》(邓立新主编,南京大学出版社)。江苏省化学夏令营使用的讲义是马宏佳主编的《全国高中化学竞赛标准教程》(东南大学出版社),简明扼要,但由于不同教授编写不同章节,参差不齐;春雨出版的《冲刺金牌·高中化学奥赛辅导》(任学宝主编,吉林教育出版社)、《冲刺金牌·高中化学奥赛解题指导》(孙夕礼主编,吉林教育出版社)。《赛前集训·高中化学竞赛专题辅导》(施华编著,体现他的竞赛培训思维,华东师范大学出版社) 比较新颖的包括浙江大学出版社的林肃浩主编的竞赛系列《高中化学竞赛实战演练》(高一、高二)、《高中化学竞赛解题方法》、《冲刺高中化学竞赛(省级预赛)》、《冲刺高中化学竞赛(省级赛区)》、《高中化学竞赛解题方法》、《决战四月:浙江省高中化学竞赛教程(通向金牌之路)》《金版奥赛化学教程》(高一、高二、·综合)都是近年来体系、选题新颖的竞赛资料,足见浙江省对化学竞赛的重视,端木非常推荐。南京教研室刘江田老师2010年5月份主编的《高中化学竞赛全解题库》(南京大学出版社)选择了近年来省级赛区真题和各地新颖的预赛题,解析详细,适合缺少老师指导的同学参考。 决赛类: 比较经典的有《高中化学奥林匹克高级本》(江苏教育出版社,段康宁主编,完全按照大学的思路);《金牌之路高中化学竞赛辅导》以及配套解题指导书(陕西师范大学出版社,李安主编);《高中化学竞赛决赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《历届国际化学奥林匹克竞赛试题分析》(学苑出版社);《最新国际国内化学奥林匹克竞赛优化解题题典》(吉林教育出版社),还有浙江大学出版社的浙江大学出版社《高中化学培优教程》“专题讲座”,《高中化学奥赛一 智浪教育-普惠英才文库 高中化学竞赛辅导练习参考答案与解析 第一章元素与化合物 第一节卤素 一.1.IO3-十5I-+6CH3COOH===3I2+6CH3COO-+3H2O 2.KI在潮湿空气里,在阳光的作用下会被空气氧化而产生紫黑色固体(或紫色蒸气),而KIO3不被空气氧化。4I-+O2+2H2O===2I2+4OH-二.l.(1)主要反应:I2+2KClO3==2KIO3+C12↑ (2)可能的副反应:C12+H2O(冷)==HClO+HCl C12+H2O==2HCl+1/2O2 3C12+3H2O(热)==HClO3+5HCl I2+5Cl2+6H2O==2HIO3+10HCl 一步:I2+5H2O2? ?催化剂2HIO3+4H2O ?→ 二步:2HIO3+K2CO3==2KIO3+CO2↑+H2O 2.使氧化生成的I2再还原为碘化物 I2+2S2O32-==S4O62-+2I- 三.3I2+6OH-===IO3-+5I-+3H2O S2O32-+4I2+10OH-===2SO42-十8I-+5H2O S2O32-+2H+===SO2↑十S↓+H2O 4I-+O2+4H+===2I2+2H2O 四.加入过量KI生成I3-离子以减少I2挥发 1.在强酸性溶液中S2O32-遇酸分解,且I-易被空气氧化:(反应略);在碱性溶液中: S2O32-+4I2+10OH-===SO42-+8I-+5H2O 3I2+6OH-===IO3-+5I-+3H2O 上述到反应的发生,使定量反应难以准确. 2.前者,I2与S2O32-的反应速度大于I2与OH-的反应速度;后者,S2O32-与I2的反应速度大于S2O32-与H+的反应速度。 五.I2(反应略) 七.A CaF2 B H2SO4 C HF D NaF E NaHF2 九.紫2I-+CI2===I2+2CI- 棕紫2Br-+Cl2===Br2+2Cl- 棕红色I2+5Cl2+6H2O===2IO3-+5Cl-+12H+ 十.A AgNO3 B AgCl C [Ag(NH3)2]Cl D AgBr E Na3[Ag(S2O3)2] F Agl G Na[Ag(CN)2] H Ag2S (反应略) 十三.1.该固体一定含钠和碘,使煤气灯火焰显黄色表明钠的存在;不溶于NH3,而溶于强络合剂CN-或S2O32-的黄色银盐一定是碘化银。 晶体结构综合例题 一.有一立方晶系的离子晶体,其结构如右图所示,试回答: 1.晶体所属的点阵形式及结构基元; 2.已知r Cs+=169pm,r Cl-=181pm,试问此两种离于联合组 成了何种型式的密堆积; 3.Cu2+处在何种空隙里? 4.指出各离子的配位情况? 解:1. 立方P,CaCsCl3 ; 2. A1型(立方面心)堆积, Cs+,Cl-离子半径大致相近; 3. 八面体空隙中; 4. Cu2+周围Cl-配位数6,Cs+配位数8;Cl-周围Cu2+配位数2,Cs+配位数4;Cs+周围Cl-配位数12,Cu2+配位数8。 二.黄铜矿是最重要的铜矿,全世界的2/3的铜是由它提炼 的。 1.右图为黄铜矿的晶胞。计算晶胞中各种原子的数目,写出 黄铜矿的化学式; 2.在高温下,黄铜矿晶体中的金属离子可以发生迁移。若铁 原子与铜原子发生完全无序的置换,可将它们视作等同的金属离 子,请说出它的晶胞。 3.在无序的高温型结构中,硫原子作什么类型的堆积? 金属原子占据什么类型的空隙?该空隙被金属原子占据的分数是 多少? 4.计算黄铜矿晶体的密度; (晶胞参数:a=52.4pm, c=103.0pm;相对原子量:Cu 63.5 Fe 55.84 S 32.06)。 解:1. 各种原子的数目Cu, Fe, S: 4, 4, 8; 黄铜矿的化 学式CuFeS2 ; 2.它的晶胞与ZnS晶胞相同;但金属离子随机性为50%; (如图); 3.硫原子作A1型(立方F)堆积; 金属原子占据四面体空 隙; 该空隙被金属原子占据的分数1/2; 4.容易计算黄铜矿晶体的密度4.31g/cm3 . 竞赛时间3小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。 ●试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填 写。草稿纸在最后一页。不得持有任何其他纸张。 ●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废 卷论处。 ●允许使用非编程计算器以及直尺等文具。 第一题 (17分) Cr及其化合物在现今工业上十分常用,Cr占地壳蹭的丰度为0.0083%,主要来源是铬铁矿、铬铅矿。最初Cr的提炼是用铬铁矿与焦炭共热生产的。 1.写出铬铁矿、铬铅矿的化学式,写出铬铁矿与焦炭共热的反应方程式。 。其水溶液可有三2.Cr常见的价态为+3和+6,常见的Cr(Ⅲ)化合物为CrCl 3 种不同的颜色,分别为紫色、蓝绿色和绿色,请分别画出这三种不同颜色的Cr (Ⅲ)化合物阳离子的立体结构。指出Cr的杂化方式 3.常见的Cr(Ⅵ)化合物是重铬酸钾,是由铬铁矿与碳酸钠混合在空气中煅烧后用水浸取过滤,然后加适量硫酸后加入氯化钾即可制得,写出涉及的反应方程式。 4.在钢铁分析中为排除Cr的干扰可加入NaCl和HClO 加热至冒烟来实现,写出 4 (CN)2被称为拟卤素,其性质与卤素单质既有相似点,也有一些不同。它可以由含有同一种元素的两种化合物一同制取得到。 1. 写出制取(CN)2的反应方程式。 2. (CN)2不稳定,它在水溶液中有2种水解方式,其中一种是生成HCN与HOCN。 请分别写出(CN)2的两种水解反应的方程式。 3. HCN在加热时与O2反应,反应比为8:3,写出该反应方程式。 4.液态的HCN不稳定,易聚合。其中,三聚体中包含有2种不同环境的C, 2 种不同环境的H与2种不同环境的N;而四聚体中H只有1种环境,C,N则各有2种不同环境。试画出两种聚合体的结构,并分别标明它们中所具有的 SmCo5是一种典型的AB5型金属化合物,可作为磁性材料,其结构如下 其中大球为Sm,小球为Co。而另一种永磁体材料X跟SmCo5的结构密切相关,他是将如图(a)层的1/3Sm原子用一对Co原子代替,并且这对Co原子不在(a)平面上而是出于该平面的上方和下方,其连线被(a)平面垂直平分。且相邻两(ABAB……型排列,三方晶胞则为ABCABC……型排列。 For personal use only in study and research; not for commercial use 高中化学竞赛用书推荐 常规/高考类: 《高中化学重难点手册》(华中师范大学出版社,王后雄老师主编);历年高考试题汇编(任何一种,最好有详细解析的,比如三年高考两年模拟);《高中化学读本》(很老的人民教育出版社甲种本化学教材,最近有更新版本);《高中化学研究性学习》(龙门书局,施华、盛焕华主编) 初赛类: 比较经典的有《化学高考到竞赛》(陕西师范大学出版社,李安主编,比较老);《高编的《高中化学竞赛全解题库》(南京大学出版社)解析详细,适合缺少老师指导的同学参考。 决赛类: 比较经典的有《高中化学奥林匹克高级本》(江苏教育出版社,段康宁主编,完全按照大学的思路);《金牌之路高中化学竞赛辅导》以及配套解题指导书(陕西师范大学出版社,李安主编);《高中化学竞赛决赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《历届国际化学奥林匹克竞赛试题分析》(学苑出版社);《最新国际国内化学奥林匹克竞赛优化解题题典》(吉林教育出版社),还有浙江大学出版社的浙江大学出版社《高中化学培优教程》“专题讲座”,《高中化学奥赛一本通》和《高中化学奥赛实用题典》(南京大学丁漪主编,南京大学多位教授参加编写) 我比较推荐的有《华罗庚学校化学读本,高1~高3》(春雨组织编写的,南京大学化学院多名教授编写,吉林教育出版社)《金牌教程?高三化学》(施华主编,南京大学出版社)《高中化学奥赛培训教程》(袁永明主编,中国石化出版社,四川大学教授负责编写)《高中化学竞赛高级教程》(胡列扬主编,浙江大学出版社),都是最近几年比较新颖、体系完备的参考书籍 综合科普类: 《化学实验的启示与科学思维的训练》(严宣申主编,北京大学出版社)、《奥林匹克化学》(吴国庆、李克安、严宣申、段连运、程铁明编写,北京大学出版社)、《中学化学竞赛导引——从高考到奥林匹克竞赛》(钮泽富、因尧、因红编著,上海教育出版社)(以上三本主编都是国家化学奥赛命题组负责人、著名大学教授,书中对竞赛训练的科学思维讲述很好,体现他们命题思想),《物质结构和性质的关系——中学化学疑难浅析》(周志华著,科学普及出版社,周老师是我大老板,以前在南师大主讲结构化学,研究功能材料,同时也是课程与教学论博士生导师,他的这本书结合化学键、分子间作用力、氢键和物质聚集状态对宏观性质的影响,深入浅出阐明结构和性质的关系,非常适合竞赛辅导)、《和中学生谈化学》(金松寿编著,陕西科学技术出版社,这本小册子的亮点也在于结构这条主线在化学学习中的应用) 期刊杂志类: 南师大化科院创办的《化学教与学》一般每年的高考模拟题可作为江苏预赛的模拟卷,也会收集前一年的江苏省预赛、夏令营选拔、全国初赛和当年的决赛题作为资料出版;《化学教育》、《化学教学》、《中学化学教学参考》、《中学化学》一般每期都有专门栏目刊 专题三 化学热力学基础 学号 姓名 得分 1、25℃,KNO 3在水中的溶解度是6mol ·dm -3,若将1 mol 固体KNO 3置于水中,则KNO 3变成盐溶液过程的ΔG 的符号为_____________,ΔS 的符号为_____________。 2、已知下列反应 : H 2(g )= 2H (g ) △H = +Q 1 ;1/2O 2(g )= O (g ) △H = +Q 2 2H (g )+ O (g )= H 2O (g ) △H = -Q 3 ;H 2O (g )= H 2O (l ) △H = -Q 4 H 2(g )+ 1/2O 2(g )= H 2O (l ) △H = -Q 5 试指出Q 1、Q 2、Q 3、Q 4、Q 5的关系 。 3、假设反应H 2 (g)?→? 2 H (g) 的内能变化ΔU 与键能ΔH H-H 相等,已知ΔH H-H 为433.2 kJ ·mol -1 ,则键焓ΔH 是 kJ ·mol -1 。 4、298 K 时,生成气态水的Δf G 0m = -228.6 kJ ·mol -1,Δr S 0m = -44.4 J ·mol -1·K -1 , 则 其Δf H 0m 为_________________________。 5、27℃时,将100g Zn 溶于过量稀硫酸中,反应若分别在开口烧杯和密封容器中进行,哪种情况放热较多?多出多少? 6、已知下列反应的焓变为: H 2 (g) +2 1I 2 (s) = HI (g) Δr H 0 m = 25.9 kJ ·mol -1 21 H 2 (g) = H (g) Δr H 0 m = 218 kJ ·mol -1 21 I 2 (g) = I (g) Δr H 0 m = 75.7 kJ ·mol -1 I 2 (s) = I 2 (g) Δr H 0 m = 62.3 kJ ·mol -1 计算反应 H (g) + I (g) = HI (g) 的焓变Δr H 0 m 。 7、100 g 铁粉在25℃溶于盐酸生成氯化亚铁(FeCl 2), (1) 这个反应在烧杯中发生; (2) 这个反应在密闭贮瓶中发生;两种情况相比, 哪个放热较多? 简述理由。 8、已知: BaO (s )+ H 2O (l )= Ba(OH)2(s ) △H = -103 kJ·mol -1 Ba(OH)2(s) + aq = Ba 2+ (aq )+ 2OH - (aq ) △H = -52 kJ·mol -1 Ba(OH)2·8H 2O (s )+ aq = Ba 2+ (aq )+ 2OH - (aq )+ 8H 2O △H = + 64 kJ·mol -1 第三章晶体结构与性质第一节晶体的常识知识归纳 一、晶体与非晶体 1.晶体与非晶体的本质差异: 2.获得晶体的三条途径 (1)______物质凝固; (2)______物质冷却不经液态直接凝固(______); (3)______从溶液中析出。 3.晶体的特点 (1)自范性 ①定义:在适宜的条件下,晶体能够自发地呈现规则的______,这称为晶体的______。非晶体物质没有这个特性。 ②形成条件:晶体______适当。 ③本质原因:晶体中粒子在______里呈现______的______排列。 (2)晶体在不同的方向上表现出不同的物理特质即______。 (3)晶体的______较固定。 (4)区分晶体和非晶体的最可靠的科学方法是对固体进行______实验。 二、晶胞 1.概念 晶胞是晶体中最小的______。 2.结构 晶胞一般都是______,晶体是由无数晶胞“______”而成。 (1)无隙:相邻晶胞之间无任何______。 (2)并置:所有晶胞都是______排列的,取向______。 (3)所有晶胞的______及内部的原子______及几何排列是完全相同的。 【答案】一、1.有周期性没有相对无序 2.(1)熔融态(2)气态凝华(3)溶质 3.(1)多面体外形性质自范性生长的速率三维空间周期性有序 (2)各向异性(3)熔点(4)X-射线衍射 二、1.结构重复单元 2.平行六面体无隙并置(1)间隙(2)平行相同(3)形状种类 知识重点 与晶体有关的计算 晶体结构的计算常常涉及如下数据:晶体密度、N A、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解答这类题时,一要掌握晶体“均摊法”的原理,二要有扎实的立体几何知识,三要熟悉常见晶体的结构特征,并能融会贯通,举一反三。 1.“均摊法”原理 晶胞中任意位置上的一个原子如果被n个晶胞所共有,则每个晶胞对这个原子分得的份额就是1 n 。 非平行六面体形晶胞中粒子数目的计算同样可用“均摊法”,其关键仍然是确定一个粒子为几个晶胞所共 有。例如,石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为1 3 ,那么一个六 边形实际有6×1 3 =2个碳原子。又如,在六棱柱晶胞(如下图所示的MgB2晶胞)中,顶点上的原子为6个 晶胞(同层3个,上层或下层3个)共有,面上的原子为2个晶胞共有,因此镁原子个数为12×1 6 +2×高中化学竞赛培训专题作业
高中化学奥林匹克竞赛专题练习:有机化合物的合成
高二化学竞赛辅导培训计划
2020届高中化学竞赛辅导(一)原子结构元素周期律
高中化学竞赛用书推荐
高中化学竞赛辅导练习参考答案与解析
最新化学竞赛晶体结构综合例题
高中化学竞赛模拟试题(附答案)
高中化学竞赛用书
高中化学奥林匹克竞赛专题练习:专题三 化学热力学基础
高中化学晶体结构与性质范文晶体的常识
