蛋白酶的分类及酶切位点
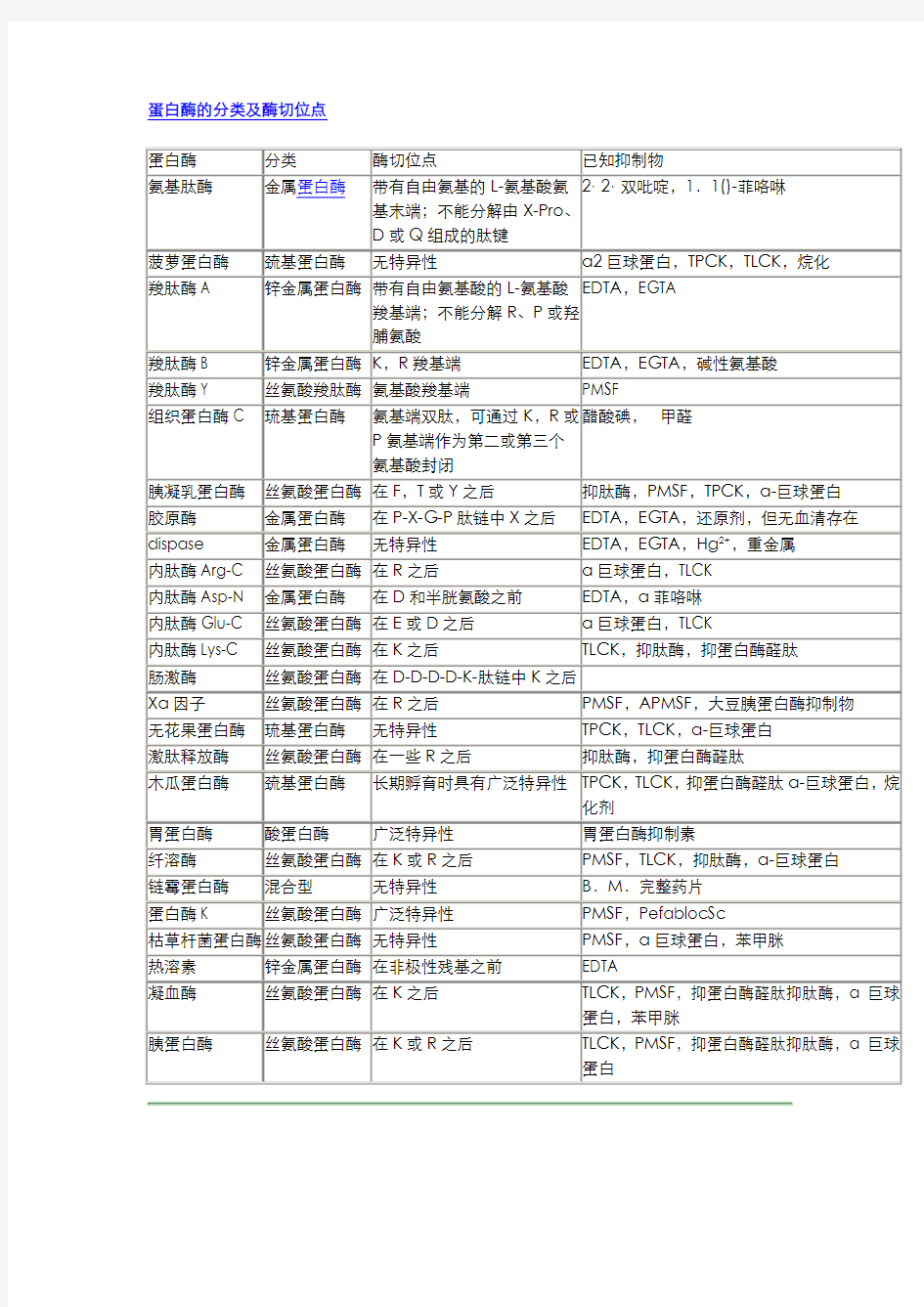

蛋白酶的分类及酶切位点
氨基酸0.ppt
氨基酸的名称与符号
alanine 丙氨酸Ala A
arginine 精氨酸Arg R
asparagine 天冬酰氨Asn Asx N
aspartic acid 天冬氨酸Asp Asx D
cysteine 半胱氨酸Cys C
glutamine 谷氨酰胺Gln Glx Q
glutamic acid 谷氨酸Glu Glx E
glycine 甘氨酸Gly G
histidine 组氨酸His H
isoleucine 异亮氨酸Ile I
leucine 亮氨酸Leu L
lysine 赖氨酸Lys K
methionine 甲硫氨酸Met M
phenylalanine 苯丙氨酸Phe F
proline 脯氨酸Pro P
serine 丝氨酸Ser S
threonine 苏氨酸Thr T
tryptophan 色氨酸Trp W
tyrosine 酪氨酸Tyr Y
valine 缬氨酸Val V
血清终止胰酶消化的原理
血清终止的原理其实是竞争抑制。就是用过量的牛血清中含有的蛋白来和胰酶结合。不给胰酶消化细胞蛋白的机会。
细胞传代时,血清为什么能终止胰酶消化?
胰蛋白酶的酶切位点是肽链的Lys和Arg两个残疾的羧基端肽键,血清的加入可使酶饱和,严格上说不是竞争性抑制,因为血清蛋白不是抑制剂,还是底物!
什么样的细胞不能用胰酶-EDTA消化
植物细胞不能用胰酶-EDTA消化,要用纤维素酶消化。
应该是肿瘤细胞吧。正常的细胞,貌似都需要用胰酶或者胶原酶消化。
EDTA-胰酶,只不过是在胰酶里加入了EDTA而已。
EDTA是乙二胺四乙酸,一种金属螯合剂。一般和胰蛋白酶配合使用。原因在于,钙,镁等金属离子会降低胰酶活力,故在使用胰酶消化液时要配合加入EDTA。它可以螯合这些离子,消除对胰酶的抑制。
干细胞饲养层制作中,胰酶—EDTA消化成纤维细胞(MEF)时,EDTA的作用是什么?
应该是胰酶分散细胞,EDTA鳌合金属离子使金属酶失活
《军医进修学院学报》1992年02期
加入收藏投稿
正常人血浆蛋白酶解产物对胃癌细胞肺转移抑制作用的研究
焦顺昌赵东海黄昌霞王洪海
【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合消化方法得到正常人血浆(NHP)有限蛋白酶解产物(NHP-EP)。体外研究发现,NHP的细胞粘附性可达90%;而NHP-EP的细胞粘附抑制性亦可达90%以上,具有可逆性、竞争性、非细胞毒性等特点。动物实验发现,NHP-EP可抑制小鼠胃癌细胞实验性肺转移的形式,抑制率达83.3%;并可延长带瘤小鼠的中位生存期,实验组生存期35天,而对照组为19天。我们认为,NHP-EP对胃癌血行转移防治可能有较大实用价值。
【作者单位】:
【关键词】:正常人血浆蛋白酶解产物胃肿瘤肺肿瘤癌症肿瘤转移细胞粘连
【正文快照】:
肿瘤转移的各个环节均有赖于癌细胞活跃的游走、与基质的粘附和去粘附等生物学功能田。体内有多种介导细胞—基质粘附的蛋白质,常见的有纤维连接素(fi bronectin,FN)、层粘素(laminin,LN)、胶原、Vitro-neetin等,它们与肿瘤转移有关(2,’〕。其中FN与细胞结合位点的氨基酸序
《癌症》1993年02期
加入收藏投稿
纤维连接素酶解产物的生物学特性及其对胃癌细胞血行转移抑制作用的初步研究
焦顺昌赵东海黄昌霞王洪海
【摘要】:本文采用胰凝乳蛋白酶和胃蛋白酶联合降解方法得到正常人血浆纤维连接素有限蛋白酶解产物(FN—EP)。体外研究发现,纤维连接素的细胞粘附率可达60%以上;而FN—EP 的细胞粘附抑制率可达90%,具有可逆性、竞争性、非细胞毒性等特征。动物实验初步显示, FN—EP可抑制小鼠胃癌细胞实验性肺转移的形成,抑制率达78.6%。本研究提示,FN—EP在恶性肿瘤血行转移防治中具有应用价值。
【作者单位】:解放军总医院解放军总医院解放军总医院解放军总医院
【关键词】:血浆纤维连接素酶解产物细胞粘附肿瘤转移
【正文快照】:
纤维连接素(Fibroneetin,FN)通过介导癌细月包一胞外基质粘附,在肿瘤转移中发挥重要作用〔’,”〕。FN与细胞结合位点的氨基酸序列为RGD(即精氨酸一甘氨酸一天门冬氨酸)。Hum分hr ies〔3,‘〕等用人工合成的含RGD序列的GRGDS多肚成功地抑制了黑色素瘤细胞实验性小鼠肺转移,抑
台研究发现Pif1解旋酶蛋白质杀死癌细胞有转机
2013年09月13日15:32 来源:中国新闻网参与互动(0)中新网9月13日电据台湾东森电视台网站报道,修复受损癌细胞的谜题逐渐解开。台湾大学生化所发现细胞内一种“Pif1解旋酶”蛋白质,能在癌细胞基因受损时,促进DNA 间的重组,进而修复细胞。医师指出,无论是正常细胞或是癌细胞都拥有Pif1,未来有机会借由抑制癌细胞中的Pif1,开发抗癌新药物。
台大生化所助理教授冀宏源带领的研究团队3年前开始与美国贝勒医学院、耶鲁大学等知名学校合作,成功从酵母菌中找到细胞里的Pif1解旋酶。冀宏源表示,DNA受损的形
态中,最严重的就是双股DNA断裂,团队利用酵母菌、蛋白质纯化技术,发现Pif1可解开双股DNA结构,帮助它的重组,完成细胞修复。
这项发现成为治疗癌症的重大突破,也登上国际知名期刊《自然》(Nature)。2年前海外实验更证实,若在乳癌细胞株上注射Pif1抑制剂,降低癌细胞存活率的效果高达10倍。台大校长杨泮池表示,下一阶段研究重点是透过临床试验,尽快找到对Pif1活性敏感的癌症种类。
标签:癌细胞酵母菌冀宏源解旋酶细胞
阻断细胞内“通讯线路” 抑制肾癌细胞增殖
2013年08月19日08:26 来源:扬子晚报参与互动(0)肾癌又称肾细胞癌,肾腺癌,多起源于肾小管上皮细胞。早期症状不明显,等到出现“无痛性的血尿、腰部肿块、腰痛”三联症时,肿瘤多已进展到中晚期。江苏省肿瘤医院冯继锋教授告诉记者,靶向药物是治疗肾癌的最重要手段之一,但实际上肿瘤细胞非常“聪明”,会自我“进化”,用药一段时间后就有耐药的可能,所以不断寻找新的有效的治疗方法,就成了临床及科研人员的研究热点。
冯继锋教授表示,和其他癌症有所不同的是,肾癌对放疗、化疗、免疫或是激素治疗相对不敏感。而对晚期患者来讲,靶向药物一直是主要的治疗手段。现代的医学研究表明,基因的变异会左右肿瘤的发展,而这一因果关系的发生需要依靠肿瘤细胞内的信号的传导,有了信号的传递,肿瘤相关的生长因子才会被“激活”。
“哪些基因变异起主要作用?哪些通路是肿瘤的发生、发展、转移的关键因素?科学的研究还有很长的一段路要走,但目前也寻找到了若干可以作用的靶点,由此也诞生了一些靶向药物。”冯继锋教授告诉记者,用特殊的药物将这个关键的靶点“封掉”,肿瘤细胞内的“通讯线路”就被阻断了,细胞核接收不到信息无法分裂增殖,自然达到了抑制肿瘤的目的。
“不过,肿瘤细胞比我们想的要‘聪明’得多。”冯继锋教授说,肿瘤内传递信号的通路非常复杂,像网络一样。而且肿瘤细胞会随着给药时间的延长,肿瘤发生发展的机制也有所改变,比如信号在一条“通讯线路”上走不通,渐渐地就走上了别的“岔道”,继续将信号传递下去。表现在病人身上就是出现了耐药性,原先有效的药物不再起作用了,病情会进一步进展。“但是肾癌患者也不必过分灰心。”即使是产生了耐药性的患者,也可以陆续受益于新的治疗方法。比如以往接受过舒尼替尼或索拉非尼治疗失败的晚期肾细胞癌的患者,现在就可以使用靶向药物mTOR抑制剂依维莫司片进行治疗。肿瘤基础研究和治疗新技术、新药物研发应用的进步,让很多以往失去治疗机会的患者多了选择。杨彦整理
标签:通讯线路肾癌细胞内肾细胞癌mTOR
蛋白酶酶切位点
蛋白酶酶切位点 木瓜蛋白酶巯基蛋白酶具有广泛特异性TPCK,TLCK,抑蛋白酶醛肽α-巨球蛋白,烷化剂胃蛋白酶酸蛋白酶广泛特异性胃蛋白酶抑制素 胰蛋白酶丝氨酸蛋白酶在K或R之后TLCK,PMSF,抑蛋白酶醛肽抑肽酶,α巨球蛋白人体20种氨基酸及其英文缩写
名称三字符号单字符号 丙氨酸Ala A 精氨酸Arg R 天冬氨酸Asp D 半胱氨酸Cys C 谷氨酰胺Gln Q 谷氨酸Glu/Gln E 组氨酸His H 异亮氨酸Ile I 甘氨酸Gly G 天冬酰胺Asn N 亮氨酸Leu L 赖氨酸Lys K 甲硫氨酸Met M 苯丙氨酸Phe F 脯氨酸Pro P 丝氨酸Ser S 苏氨酸Thr T 色氨酸Trp W 酪氨酸Tyr Y 缬氨酸Val V 【生化】特异性蛋白酶的酶切位点 胰蛋白酶arg、lys,得到以arg、lys为C末端残基的肽段。胰凝乳蛋白酶phe、trp、tyr 等疏水aa。胃蛋白酶phe、trp、tyr等疏水aa。木瓜蛋白酶arg、lys。葡萄球菌蛋白酶,磷酸缓冲液ph7.8时断裂glu、asp。碳酸氢铵缓冲液ph7.8或醋酸铵缓冲液ph4.0时断裂glu。梭菌蛋白酶arg,用于不溶性蛋白的长时间裂解。CNBr断裂Met。羟胺断裂asn—gly间的肽键。二硫键可以用巯基化合物还原法或者过甲酸氧化法断裂.。 木瓜蛋白酶(Papain),又称木瓜酶,是一种蛋白水解酶。木瓜蛋白酶是番木瓜(Carieapapaya)中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,因此在食品、医药、饲料、日化、皮革及纺织等行业得到广泛应用。 木瓜蛋白酶是一种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。纯木瓜蛋白酶制品可含有:(1)木瓜蛋白酶,分子量21000,约占可溶性蛋白质的10%;(2)木瓜凝乳蛋白酶,分子量26000,约占可溶性蛋白质的45%;(3)溶菌酶,分子量25000,约占可溶性蛋白质的20%;及纤维素酶等不同的酶。 番木瓜未成熟果实中含有木瓜蛋白酶(Papain)、木瓜凝乳蛋白酶A(Chymopapain A )、木瓜凝乳蛋白酶B(Chym opapain B )、木瓜肽酶B (PapayaPeptidase B ) 等多种蛋白水解酶。且已知四种半胱氨酸蛋白酶的一级结构具有高度的同源性。其中,木瓜蛋白酶属巯基蛋白酶,可水解蛋白质和多肽中精氨酸和赖氨酸的羧基端,并能优先水解那些在肽键的N-端具有二个羧基的氨基酸或芳香L-氨基酸的肽键。
常用限制性内切酶酶切位点汇总
Acc65I识别位点AccI识别位点AciI识别位点AclI识别位点AcuI识别位点 AfeI识别位点AflII识别位点AflIII识别位点AgeI识别位点AhdI识别位点AleI识别位点AluI识别位点AlwI识别位点AlwNI识别位点ApaI识别位点ApaLI识别位点ApeKI识别位点ApoI识别位点AscI识别位点AseI识别位点AsiSI识别位点AvaI识别位点AvaII识别位点AvrII识别位点BaeI识别位点BamHI识别位点BanI识别位点BanII识别位点
BbvCI识别位点BbvI识别位点 BccI识别位点BceAI识别位点BcgI识别位点 BciVI识别位点 BclI识别位点 BfaI识别位点 BfuAI识别位点 BglI识别位点 BglII识别位点 BlpI识别位点 Bme1580I识别位点BmgBI识别位点BmrI识别位点BmtI识别位点BpmI识别位点Bpu10I识别位点BpuEI识别位点BsaAI识别位点BsaBI识别位点BsaHI识别位点BsaI识别位点BsaJI识别位点BsaWI识别位点BsaXI识别位点BseRI识别位点BseYI识别位点
BsiEI 识别位点BsiHKAI 识别位点BsiWI识别位点BslI 识别位点BsmAI识别位点 BsmBI识别位点BsmFI识别位点BsmI识别位点BsoBI识别位点Bsp1286I识别位点BspCNI识别位点BspDI识别位点BspEI识别位点BspHI识别位点BspMI识别位点BspQI识别位点BsrBI识别位点BsrDI识别位点BsrFI识别位点BsrGI识别位点BsrI识别位点BssHII识别位点BssKI识别位点BssSI识别位点BstAPI识别位点BstBI识别位点BstEII识别位点BstNI识别位点
蛋白酶的工厂设计
年产1500m3蛋白酶的工厂设计 摘要 蛋白酶是催化肽键水解的一类酶,它可迅速水解蛋白质为胨、肽类,广泛存在于动物内脏、植物茎叶、果实和微生物中。同时大多数微生物蛋白酶都是胞外酶。微生物蛋白酶按其作用的最适pH可分为酸性蛋白酶、中性蛋白酶、碱性蛋白酶三类。酸性蛋白酶是一种羧基蛋白酶,它的分子质量为30-40kD,等电点(pH3.0-5.0) 酸性蛋白酶现已广泛应用于食品、饲料、酿造、毛皮与皮革、医药、胶原纤维等各个行业之中。本设计采用豆饼粉、玉米粉、淀粉为主要的培养基原料,并选用黑曲霉(Aspergillus niger )3.350菌种发酵。其中豆饼粉3.75%,玉米粉0.625%,鱼粉0.625%,氯化铵1%,氯化钙0.5%,磷酸氢二钠0.2%。 本设计利用通风搅拌式发酵罐进行发酵,同时利用离子交换树脂对母液进行提取,提高了酸性蛋白酶的生产效率,减少了生产成本。设计还包括发酵罐,全厂平面图,车间平面布置图,工艺流程图。 关键词:酸性蛋白酶发酵工厂设计
The Process Design of the Protease used for Section with the Capacity of 1500m3 Annually Abstract protease is a kind of Peptone and peptide. It has been discover across in animal giblets ,the stem of plant,fruit , microbial and so on.Most of the Microbial protease are ectoenzyme .According to its best Optimum pH function ,Microbial protease Can be divided into Acid protease ,Neutral protease and alkaline protease .Acid protease is a kind of Carboxyl protease , Its molecular weight is 30-40 kd, lower isoelectric point (pH3.0-5.0) Acid protease in food, medicine, textile, leather, feed, cosmetics, washing industries have applications, natural health, avirulent and harmless, quite safe. So in this paper the basic content of more acid protease, production process and application development were introduced. This design USES the bean cake powder, corn flour, starch as the main medium of raw materials, and selects the Aspergillus Niger, Aspergillus Niger) 3.350 bacterial fermentation. With bean cake powder 3.75%, corn flour 3.75%, 0.625% fish meal, 1% ammonium chloride, calcium chloride 0.5%, disodium hydrogen phosphate 0.2%. This design using the ventilation agitator in fermentor, using ion exchange resin in mother liquid was extracted at the same time, improve the efficiency of the acid protease production, reduce the production cost. The design also includes Fermentor, The factory plan, Shop floor plan, Flow Chart. Key Words: Acid protease ; fermentation; plant-design;
动物蛋白酶解研究
动物蛋白酶解研究(I) 北京工商大学宋焕禄 天调食品配料有限公司廖国洪 摘要 本文主要目的是以美拉德(Maillard)反应产物(MRPs)的风味为判断依据,以水解度(DH)为动物蛋白酶解液——Maillard反应底物之一的特征性指标,根据MRPs 的风味确定动物蛋白水解液的最佳DH或DH范围。实验的主要内容包括: 1.以牛肉为酶解底物,对所用的几种蛋白酶进行酶活测定 2.确定各酶的适宜加量和反应时间 3.确定最佳酶组合及其最佳反应条件 4.用最佳反应条件下制得的动物蛋白水解液进行Maillard反应,感官评定产物风味。 关键词动物蛋白水解液水解度(DH)酶解Maillard反应 1.概述 1.1肉味香精研究进展 肉味香精研究及生产中有关肉味形成机理的报道很多。随着肉味香精的需求量日益增加,有关肉味香精的研究也不断深入和扩展。肉味香精中各种香味物质的形成主要是通过Maillard反应产生。参与反应的底物中氨基酸或多肽对风味物质的形成有重要影响。根据已有的研究结果,通常认为,Maillard反应产物中含硫化合物、杂环化合物和羰基化合物对肉味形成有重要影响[1]。这些风味物质的形成机理极其复杂。杂环化合物中以吡咯类、吡嗪类、噻吩类等化合物贡献较大[2]。 对Maillard反应产物的一系列研究表明,它还具有抗氧化、抗诱变等多种性能[3]。 此外,人们还从蛋白质结构及肽键顺序等方面对Maillard反应产物进行分析,以期找到它们与产物风味之间的某种关系[4]。 酶解法是一种新兴的动物蛋白水解液的生产方法。与已有的生产方法相比,酶解法有很多优点,因此对酶法生产动物蛋白水解液的研究很受重视。人们从酶解机理、酶解原料、酶及酶解液等多方面进行了大量深入研究。G.M.O′Meara和P.A.Munro以米氏方程和兰格缪尔等温吸附模型为基础,研究了瘦肉的酶解动力 [5],并对酶解反应的影响因素如pH值、温度、时间、酶/底物比及底物浓度分别 进行研究[6]。研究者还试图从不同途径寻找更有效的酶,研究酶的性质、结构、作用特点、反应条件以及单、多酶水解效果的比较、不同底物水解效果的比较,等等[7]。 人们还注意到,由于水解条件的变化,得到的水解液有时会含有苦味,并影响到后面的Maillard反应产物的风味。研究认为,其原因是某种蛋白质含有疏水性氨基酸,它们常隐藏在蛋白质内部中,一旦水解暴露出来就会显出苦味[8,9]。生产动物蛋白水解液的原料由于价格问题,生产成本一直降不下来。近年来人们一
常用限制性内切酶酶切位点保护残基
酶切位点保护碱基-PCR引物设计用于限制性内切酶 发布: 2010-05-24 20:19| 来源:生物吧| 编辑:刘浩| 查看: 161 次 本文给出了分子克隆中常用限制性内切酶的保护碱基序列,如AccI,AflIII,AscI,AvaI,BamHI,BglII,BssHII,BstEII,BstXI,ClaI,EcoRI,HaeIII,HindIII,KpnI,MluI,NcoI,NdeI,NheI,NotI,NsiI,PacI,PmeI,PstI,PvuI,SacI,SacII,SalI,ScaI,SmaI,SpeI,SphI,StuI,XbaI,XhoI,XmaI, 为什么要添加保护碱基? 在分子克隆实验中,有时我们会在待扩增的目的基因片段两端加上特定的酶切位点,用于后续的酶切和连接反应。由于直接暴露在末端的酶切位点不容易直接被限制性核酸内切酶切开,因此在设计PCR引物时,人为的在酶切位点序列的5‘端外侧添加额外的碱基序列,即保护碱基,用来提高将来酶切时的活性。 其次,在分子克隆实验中选择载体的酶切位点时,相临的两个酶切位点往往不能同时使用,因为一个位点切割后留下的碱基过少以至于影响旁边的酶切位点切割。 该如何添加保护碱基? 添加保护碱基时,最关心的应该是保护碱基的数目,而不是种类。什么样的酶切位点,添加几个保护碱基,是有数据可以参考的。 添加什么保护碱基,如果严格点,是根据两条引物的Tm值和各引物的碱基分布及GC含量。如果某条引物Tm值偏小,GC%较低,添加时多加G或C,反之亦反。 为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。 实验方法:用γ-[32P]ATP在T4多聚核苷酸激酶的作用下标记0.1A260单位的寡核苷酸。取1μg已标记了的寡核苷酸与20单位的内切酶,在20°C条件下分别反应2小时和20小时。反应缓冲液含70mM Tris-HCl (pH 7.6), 10 mM MgCl2, 5 mMDTT及适量的NaCl或KCl(视酶的具体要求而定)。20%的PAGE(7M尿素)凝胶电泳分析,经放射自显影确定酶切百分率。 本实验采用自连接的寡核苷酸作为对照。若底物有较长的回文结构,切割效率则可能因为出现发夹结构而降低。
蛋白酶
8.蛋白酶(酸性、中性、碱性)的特征与相应的发酵微生物菌。 答:中性蛋白酶生产菌枯草杆菌1.398,S114,172,放线菌166,栖土曲霉3.942; 碱性蛋白酶生产菌地衣芽孢杆菌2709,短小芽孢杆菌289,209; 酸性蛋白酶生产菌黑曲霉3.350,宇佐美曲霉537,肉桂色曲霉No.81,浆油工业用的米曲霉3042。 按酶的最适pH分类: ①酸性蛋白酶,最适pH2.0-5.0。 ②中性蛋白酶,pH7-8。 ③碱性蛋白酶,pH9.5-10.5。 为方便起见,微生物蛋白酶常用此分类法。 酸性蛋白酶主要来源于哺乳动物的消化道, 如胃蛋白酶; 部分微生物是酸性蛋白酶的主要来源, 如:目前的商品酸性蛋白酶制剂主要是由黑曲霉发酵生产 分子特性: 酸性蛋白酶的最适pH在2-5范围, 酶蛋白的等电点在pI3-5, 分子量MW30,000-35,000。 ②催化特性: 酸性蛋白酶的最适温度因来源不同而有差异, 一般霉菌的蛋白酶的最适温度较高, 大部分在50-60℃范围, 而来源于动物胃粘膜的蛋白酶的最适温度较低, 一般在40℃左右, 但酸性蛋白酶的热稳定性都较差, 一般在50℃都很快失活, 此外, 酶的热稳定性还受到基质的pH的影响; 有些酸性蛋白酶不耐低温, 在低温条件下,很快失活。许多酸性蛋白酶分子中含5-10%多糖,对酶的稳定有益。 中性蛋白酶是最早用于酶制剂工业化生产的蛋白酶, 目前的微生物生产的商品酶制剂的菌种主要有: 枯草杆菌、耐热解蛋白芽孢杆菌、灰色链霉菌、寄生曲霉、米曲霉、栖土曲霉。 除上述微生物生产中性蛋白酶外, 来源于植物的木瓜蛋白酶、无花果蛋白酶、菠萝蛋白酶等都属于中性蛋白酶。 ①分子特性: 大部分微生物产生的中性蛋白酶属于金属蛋白酶, 一分子酶蛋白含有一个锌原子, 酶蛋白的分子量在35,000-40,000范围, 等电点pI 8-9, 微生物蛋白酶中, 中性蛋白酶的稳定性最差, 分子之间最容易发生自溶, 即使在低温条件下, 也会发生明显的自溶, 造成分子量明显降低。 ②催化特性: 中性蛋白酶的热稳定性较差, 如枯草杆菌的中性蛋白酶在pH7, 60℃处理15min, 失活90%; 栖土曲霉的中性蛋白酶在pH7, 55℃处理10min, 失活80%以上; 以酪蛋白为底物时, 枯草杆菌蛋白酶的最适pH7-8、热解蛋白芽孢杆菌的中性蛋白酶的最适pH7-9、栖土曲霉的中性蛋白酶pH6.5-7.5; 最适温度受测定时的反应时间有直接关系, 因为酶蛋白的稳定性较差, 所以反应时间的长短影响着反应结果, 一般在10-30min 最适温度为45-50℃。钙离子可以增加酶蛋白的稳定性,并减少自溶。 碱性蛋白酶主要是由微生物产生, 微生物中主要是细菌的部分菌种产生碱性蛋白酶, 目前碱性蛋白酶主要是用于洗涤剂、皮革工业、丝绸脱胶。 几乎所有的细菌碱性蛋白酶都是胞外蛋白酶, 主要包括两类: 其一是在中性条件下生产的碱性蛋白酶, 如枯草杆菌、地衣芽孢杆菌、短小芽孢杆菌等; 其二是嗜碱微生物, 其必须在碱性条件下[pH8-10]才能生产的碱性蛋白酶。 ①酶蛋白特性: 碱性蛋白酶的分子量比中性蛋白酶的分子量小, 一般在20,000-34,000Da, 而且等电点较高, 一般在pH8-9。 ②催化特性: 大部分碱性蛋白酶的最适pH在7-11范围, 当以酪蛋白为底物时, 最适pH为9.5-10.5, 碱性蛋白酶除能够水解肽键外, 还具有水解酯键的能力和转肽能力, 最适温度因菌种不同而有差异, 一般在50 ℃左右, 酶蛋白的热稳定性不高, 50-60℃处理15分钟, 几乎有50%的酶活力丧失, 我国目前生产的几种碱性蛋白酶的热稳定性一般都在60℃以下。 中性蛋白酶——枯草芽胞杆菌、栖土曲霉、灰色链霉菌、放线菌等 碱性蛋白酶——地衣芽孢杆菌、短小芽孢杆菌等 酸性蛋白酶——大都采用曲霉 中性蛋白酶作为一种内切蛋白酶,具有纯天然、安全无毒、水解能力强、作用范围广等。2、中性蛋白酶应用于焙烤,可降低面团湿筋度、改良面团可塑性及理化性质,同时使蛋白质大分子水解成短肽和氨基酸,从而有利于糖类和氨基
高产蛋白酶菌株的选育.总结
课堂报告名称:高产蛋白酶菌株的选育方法 武汉轻工大学食品学院王宏勋 一、课堂报告依据的知识背景 1、遗传变异的物质基础 遗传变异有无物质基础以及何种物质可承担遗传变异功能的问题,是生物学中的一个重大理论问题。利用微生物这一实验对象进行了三个著名的实验,才以确凿的事实证实了核酸尤其是 DNA 才是遗传变异的真正物质基础。三个经典实验是: 一是1928年进行的转化实验。二是美国人1952年开展的噬菌体感染实验。三是1956年创立的植物病毒的重建实验。 朊病毒的发现和思考。无论是 DNA 还是 RNA 作为遗传物质的基础已是无可辨驳的事实。但朊病毒的发现对“蛋白质不是遗传物质的定论也带来一些疑云。 PrP 是具有传染性的蛋白质致病因子,迄今未发现蛋白内有核酸,但已知的传染性疾病的传播必须有核酸组成的遗传物质,才能感染宿主并在宿主体内自然繁殖。那么这是生命界的又一特例呢?还是因为目前人们的认识和技术所限而尚未揭示的生命之谜呢?还有待于生命科学家去认识和探索。 2、遗传物质在细胞内的存在形式 除部分病毒的遗传物质是 RNA 外,其余病毒及全部具有典型细胞结构的生物体的遗传物质都是 DNA 。按其在细胞中存在形式可分成染色体 DNA 和染色体外 DNA 。原核细胞和真核细胞中的 DNA 存在形式不完全相同。
1)DNA 在原核细胞中的存在方式 原核细胞最大的细胞学特点就是无核膜与核仁的分化,只有一个核区称拟核。其染色体 DNA 处于拟核区,无组蛋白,近年来发现与非组蛋白结合。结构上为双链环状 DNA 。几种微生物染色体的物理特性见表。原核细胞的染色体外DNA 主要指质粒(如 F 因子、 R 因子、 Col 因子)。 2)DNA 在真核细胞中的存在方式 真核细胞 DNA分为核 DNA和核外 DNA。核 DNA即染色体 DNA ,它与组蛋白结合构成具有复杂结构的染色体。核外DNA是指线粒体和叶绿体等DNA ,其结构与原核细胞的 DNA相似,亦能编码结构蛋白。 3、基因和性状 1)基因的概念 基因是由丹麦生物学家 W . Johansen 于 1909 年提出来的,他用“基因”这个述语来代替孟德尔的“遗传因子”。直到本纪世 50 年代以后,“基因”才有一个较明确的概念。概括地说:“基因”是一个具有遗传因子效应的 DNA 片段,它是遗传物质的最小功能单位。2)性状的决定——基因表达 性状是构成一个生物个体的有关结构、形态、物质和功能等各方面特征的总称。基因表达是遗传信息表现为生物性状的过程,这一过程是通过基因产物的生物学功能来完成的。基因决定性状,而性状则是基因表达的最终结果。基因依其功能的差别可分成调节基因、操纵基因和结构基因 3 大类。
蛋白酶催化蛋白质水解
蛋白酶催化蛋白质水解 1、酶的重要性 生命的最主要、最基本的特征在于生物体的新陈代谢,具体表现为活体经常由外部摄取所需要的物质,以生物能为动力,经过体内同化、更新、异构化,并排出一些物质,发散热能至外界。机体或单个细胞的所有这些化学反应,基本上是在催化剂作用下完成的。酶是人体内新陈代谢的催化剂,只有酶存在,人体内才能进行各项生化反应。人体内酶越多,越完整,其生命就越健康。当人体内没有了活性酶,生命也就结束。人类的疾病,大多数均与酶缺乏或合成障碍有关。 2、酶的生物学功能 在生物体内,酶发挥着非常广泛的功能,具体功能如下: (1)信号转导和细胞活动的调控都离不开酶。特别是激酶和磷酸酶的参与。 (2)酶也能产生运动。通过催化肌球蛋白上ATP的水解产生肌肉收缩,并且能够作为细胞骨架的一部分参与运送胞内物质。 (3)参与在动物消化系统的工作。以淀粉酶和蛋白酶为代表的一些酶可以将进入消化道的大分子(淀粉和蛋白质)降解为小分子,以便于肠道吸收。淀粉不能被肠道直接吸收,而酶可以将淀粉水解为麦芽糖或更进一步水解为葡萄糖等肠道可以吸收的小分子。不同的酶分解不同的食物底物。
(4)在代谢途径中,多个酶以特定的顺序发挥功能:前一个酶的产物是后一个酶的底物;每个酶催化反应后,产物被传递到另一个酶。有些情况下,不同的酶可以平行地催化同一个反应,从而允许进行更为复杂的调控:比如一个酶可以以较低的活性持续地催化该反应,而另一个酶在被诱导后可以较高的活性进行催化。酶的存在确定了整个代谢按正确的途径进行;而一旦没有酶的存在,代谢既不能按所需步骤进行,也无法以足够的速度完成合成以满足细胞的需要。实际上如果没有酶,代谢途径,如糖酵解,无法独立进行。例如,葡萄糖可以直接与ATP反应使得其一个或多个碳原子被磷酸化;在没有酶的催化时,这个反应进行得非常缓慢以致可以忽略;而一旦加入己糖激酶,在6位上的碳原子的磷酸化反应获得极大加速,虽然其他碳原子的磷酸化反应也在缓慢进行,但在一段时间后检测可以发现,绝大多数产物为葡萄糖-6-磷酸。于是每个细胞就可以通过这样一套功能性酶来完成代谢途径的整个反应网络。3、酶的分类 酶可分为二类,第一类是所谓的单纯酶,其催化活性仅由酶蛋白提供;第二类称为结合酶,除了蛋白质外,还需含有其他成分才呈现催化活性。这些成分包括无机离子,Fe卄、Zn卄.Mn卄等或有机化合物,如硫胺素焦磷酸、黄素腺嘌呤二核苷酸等。这些化学组分称为辅助因子,这类化合物称为辅酶。这类酶也称为全酶。 按国际生化会的规定,将现已分离得到的2000多种酶按所催化的反应类型分类,可分为以下六种。
不同的酶切位点
ApaI (类型:Type II restriction enzyme )识别序列:5'GGGCC^C 3' BamHI(类型:Type II restriction enzyme )识别序列:5' G^GATCC 3' BglII (类型:Type II restriction enzyme )识别序列:5' A^GATCT 3' EcoRI (类型:Type II restriction enzyme )识别序列:5' G^AATTC 3' HindIII (类型:Type II restriction enzyme )识别序列:5' A^AGCTT 3' KpnI (类型:Type II restriction enzyme )识别序列:5' GGTAC^C 3' NcoI (类型:Type II restriction enzyme )识别序列:5' C^CATGG 3' NdeI (类型:Type II restriction enzyme )识别序列:5' CA^TATG 3' NheI (类型:Type II restriction enzyme )识别序列:5' G^CTAGC 3' NotI (类型:Type II restriction enzyme )识别序列:5' GC^GGCCGC 3' SacI (类型:Type II restriction enzyme )识别序列:5' GAGCT^C 3' SalI (类型:Type II restriction enzyme )识别序列:5' G^TCGAC 3' SphI (类型:Type II restriction enzyme )识别序列:5' GCATG^C 3' XbaI (类型:Type II restriction enzyme )识别序列:5' T^CTAGA 3' XhoI (类型:Type II restriction enzyme )识别序列:5' C^TCGAG 3'
常用限制性内切酶酶切位点
AatII 识别位点 Acc65I 识别位点 AccI 识别位点 AciI 识别位点 AclI 识别位点 AcuI 识别位点 AfeI 识别位点 AflII 识别位点 AflIII 识别位点 AgeI 识别位点 AhdI 识别位点 AleI 识别位点 AluI 识别位点 AlwI 识别位点 AlwNI 识别位点 ApaI 识别位点 ApaLI 识别位点 ApeKI 识别位点 ApoI 识别位点 AscI 识别位点 AseI 识别位点 AsiSI 识别位点
AvaI识别位点 AvaII识别位点 AvrII识别位点 BaeI识别位点 BamHI 识别位点 BanI识别位点 BanII识别位点 BbsI识别位点 BbvCI识别位点 BbvI识别位点 BccI识别位点 BceAI识别位点BcgI识别位点BciVI识别位点BclI识别位点 BfaI识别位点BfuAI识别位点BglI识别位点BglII识别位点BlpI识别位点Bme1580I识别位点BmgBI识别位点BmrI识别位点
BmtI 识别位点 BpmI 识别位点 Bpu10I 识别位点 BpuEI 识别位点 BsaAI 识别位点 BsaBI 识别位点 BsaHI 识别位点 BsaI 识别位点 BsaJI 识别位点 BsaWI 识别位点 BsaXI 识别位点 BseRI 识别位点 BseYI 识别位点 BsgI 识别位点 BsiEI 识别位点 BsiHKAI 识别位点 BsiWI 识别位点 BslI 识别位点 BsmAI 识别位点 BsmBI 识别位点 BsmFI 识别位点 BsmI 识别位点
蛋白酶专一性酶切位点地影响因素分析报告
蛋白酶专一性酶切位点的影响因素分析 摘要:生物活性肽(bioactive peptides)是具有特殊生理功能的肽。酶法水解蛋白质广泛用于制备生物活性肽,但酶解法存在目标肽得率低、副产物过多的缺点。蛋白酶和蛋白质的选择是关键步骤,局部构象、三维结构、实验条件以及其它偶然因素也会影响蛋白水解酶的酶切效果。本文综述了温度、pH值、温度和pH值共同作用、金属离子对酶切位点的影响,旨在为研究酶切规律、制备高得率活性肽提供理论基础。 关键词:生物活性肽;蛋白酶;水解条件;酶切位点 Influencing Factors Analysis of Protease Specific Cleavage Sites Abstract:Bioactive peptides are fragments with specific amino acid sequences that exert a positive physiological influence on the body. Many reported Bioactive peptides are produced by enzymatic hydrolysis,but there are disadvantages of by-product and low yield.The choice of protease and protein source is a key step,and many factors such as local conformation,tertiary structure, experimental conditions and causal interference can influence the protease hydyolysis.This article presents the influencing fators,temperature,pH values,temperature combined pH values and metal ions included,to provide theoretical basis for enzymatic law analysis and higher yield bioactive peptides production. Key words:bioactive peptides;protease;hydrolysis conditions;protease cleavage sites 1.前言 生物活性肽(bioactive peptides)是具有特殊生理功能的肽,是氨基酸以不同组成和排列方式构成的不同肽类的总称(氨基酸数目一般小于100)。生物活性肽有的是天然存在的,如谷胱甘肽、催产素、加压素、舒缓激肽、部分抗菌肽等,有的生物活性肽是以非活性的状态存在于某些蛋白质中,当用特定的蛋白酶水解后被释放出来,才成为有特定生理活性的肽。同种蛋白质经不同的蛋白酶酶解后,可以产生具有不同氨基酸序列、不同生理功能的生物活性肽,如大豆蛋白、
高产胞外蛋白酶正文
高产胞外蛋白酶菌株的选育生命科学学院生物科学0901班王亚云 2009044020119 摘要:采用养牛场中的土壤,设置培养基来筛选出具有产胞外蛋白酶的菌株。以酪素培养基平板产生的透明圈的大小作为选择标记,经初筛选择出透明圈的直径/菌落直径大的菌株为出发菌株。经紫外线诱变处理,培养获得两种未知高产胞外蛋白酶菌株。通过形态观察、生理生化试验进行鉴定:突变菌株w1的形态、生理生化特性符合芽孢杆菌属的特征,而突变菌株w2为革兰氏阴性杆菌。 关键字:细菌;胞外蛋白酶;筛选;诱变;鉴定 蛋白酶是催化蛋白质水解的一类酶,是酶学研究中较早也是最深入的一种酶。作为一种生物催化剂,该酶催化反应速度较快,无工业污染,且反应条件适宜性宽,被广泛应用于食品、制药、化妆品、洗涤剂、丝纺、毛皮软化等行业。目前微生物菌种选育所采用的诱变手段主要有激光诱变、DES诱变结合热处理、空间诱变、紫外线照射和亚硝基胍复合诱变等。常见的能产生蛋白酶的蛋白微生物有细菌中的酸性蛋白酶生产菌如黑曲霉、根霉;碱性蛋白酶生产菌如地衣芽孢杆菌;中性蛋白酶生产菌如枯草芽孢杆菌。本实验是研究从养牛场土壤中筛选得到的蛋白酶产生菌株为出发菌株,采用紫外线照射育种,以得到高产胞外蛋白酶菌株。 1 材料与方法 1.1 材料 1.1.1 土样:河北农业大学西校区养牛场中的土壤 1.1.2 培养基: 1.1. 2.1 筛选培养基: 酪素培养基 1.1. 2.2营养培养基: 肉汤培养基 1.1. 2.3鉴别性培养基 (1)淀粉培养基 (2)明胶培养基
(3)葡萄糖发酵培养基 (4)葡萄糖蛋白胨培养基 乳糖发酵培养基、柠檬酸盐培养基、半固体培养基、三糖铁培养基均为商品试剂,直接按比例加蒸馏水即可。 1.2 方法 1.2.1 菌种的筛选 1.2.1.1 培养基的配置及灭菌 按上述配置方法分别配置肉汤培养基和酵素培养基,配置完成后放入高压灭菌锅于120℃下灭菌20min。取6只试管,分别加入9mL蒸馏水,向试管中加入10个玻璃珠,盖好胶塞,进行灭菌。 1.2.1.2 涂布分离 称取9g土样,放入盛有90mL无菌水的锥形瓶中,充分震荡5~8min,静置10min。 取1mL上清液进行逐步稀释,分别稀释到浓度为10-1,10-2,10-3,10-4,10-5,10-6,10-7。在酒精灯附近进行无菌操作,分别取10-5,10-6,10-7三个浓度梯度的稀释液各100μL于无菌的酪素培养基平板上,用涂布器进行涂布,每个浓度梯度下设置两个平板。待培养基凝固后贴好标签,在30℃的培养箱中倒置培养6d。 1.2.1.3 菌种的纯化 观察平板上菌落的形态特征,挑选出具有透明圈的菌落,用直尺测量其菌落直径C和透明圈直径H,从中选出两个H/C较大的菌落进行接种。采用分区划线法在酪素平板上进行分离纯化,每次都从上一次划线的末端开始划起,保证菌落被逐步稀释,最后得到单个菌株。 将纯化的菌株接种盛有肉汤培养基中的锥形瓶中,在37℃条件下振荡培养。 1.2.2 紫外线诱变育种 1.2.2.1 悬浮液的制备 在摇瓶培养营养肉汤中取出1mL放入离心管12000r离心2min,去上清,加入无菌水1mL,再离心,在重复3-4次至可得到以后步骤可用的足够的菌,在加入无菌水1mL,将12个Ep 管中的悬浮液加入平皿中混匀。 1.2.2.2 紫外诱变
(完整版)常用限制性内切酶酶切位点汇总,推荐文档
Acc65I识别位点 AccI识别位点 AciI识别位点 AclI识别位点 AcuI识别位点 AfeI识别位点 AflII识别位点 AflIII识别位点 AgeI识别位点 AhdI识别位点 AleI识别位点 AluI识别位点 AlwI识别位点 AlwNI识别位点 ApaI识别位点 ApaLI识别位点 ApeKI识别位点 ApoI识别位点 AscI识别位点 AseI识别位点 AsiSI识别位点 AvaI识别位点 AvaII识别位点 AvrII识别位点 BaeI识别位点 BamHI识别位点 BanI识别位点 BanII识别位点
BbvCI识别位点 BbvI识别位点 BccI识别位点 BceAI识别位点 BcgI识别位点 BciVI识别位点 BclI识别位点 BfaI识别位点 BfuAI识别位点 BglI识别位点 BglII识别位点 BlpI识别位点 Bme1580I识别位点 BmgBI识别位点 BmrI识别位点 BmtI识别位点 BpmI识别位点 Bpu10I识别位点 BpuEI识别位点 BsaAI识别位点 BsaBI识别位点 BsaHI识别位点 BsaI识别位点 BsaJI识别位点 BsaWI识别位点 BsaXI识别位点 BseRI识别位点 BseYI识别位点
BsiEI识别位点 BsiHKAI识别位点 BsiWI识别位点 BslI识别位点 BsmAI识别位点 BsmBI识别位点 BsmFI识别位点 BsmI识别位点 BsoBI识别位点 Bsp1286I识别位点 BspCNI识别位点BspDI识别位点 BspEI识别位点 BspHI识别位点 BspMI识别位点 BspQI识别位点 BsrBI识别位点 BsrDI识别位点 BsrFI识别位点 BsrGI识别位点 BsrI识别位点 BssHII识别位点 BssKI识别位点 BssSI识别位点 BstAPI识别位点 BstBI识别位点 BstEII识别位点 BstNI识别位点
高产蛋白酶的芽孢杆菌菌株选育
高产蛋白酶的芽孢杆菌菌株选育 学校河北农业大学 专业生命科学学院 姓名xxx 学号x 指导老师x 同组人员x 二〇一三年十二月二十五日 (河北农业大学生命科学学院,河北保定,071000) 摘要:目的:通过筛选诱变选育高产蛋白酶,为食品、制药、化妆品、洗涤剂、丝纺、毛皮软化等行业提供材料基础。方法: 通过在富含蛋白质的场所的针对性采集土样,菌落平板筛选结合紫外线诱变育种,选育高产蛋白酶的芽孢杆菌,通过一系列鉴别性培养基鉴
定其生理生化特性,查找其种属。结果:通过筛选得到一诱变菌种,通过伯杰氏手册鉴定其为枯草芽孢杆菌属。诱变90s后,其蛋白酶活性提高最大。 关键词:高产蛋白酶芽孢杆菌诱变鉴定 引言:蛋白酶(Protease)是催化蛋白质水解的一类酶,微生物蛋白酶主要由霉菌、细菌生产。蛋白酶对所作用的反应底物有严格的选择性,一种蛋白酶仅能作用于蛋白质分子中一定的肽键。该酶催化反应速度较快,无工业污染,且反应条件适应性宽,被广泛应用在皮革、毛皮、丝绸、医药、食品、酿造等方面。目前微生物菌种选育所采用的诱变手段主要有激光诱变、DES诱变结合热处理、空间诱变、紫外线照射和亚硝基胍复合诱变等。蛋白酶分布广,主要存在于人和动物消化道中,在植物和微生物中含量丰富。由于动植物资源有限,工业上生产蛋白酶制剂主要利用枯草杆菌、栖土曲霉等微生物发酵制备。常见的能产生蛋白酶的蛋白微生物有细菌中的酸性蛋白酶生产菌(如黑曲霉、根霉);碱性蛋白酶生产菌(如地衣芽孢杆菌);中性蛋白酶生产菌(如枯草芽孢杆菌)。本实验以树林土壤中筛选得到的蛋白酶生产菌株为出发菌株,采用紫外线照射诱变方法育种,筛选得到高产蛋白酶菌株。 High protease of Bacillus Strain Breeding Abstract:Objective: by screening the mutation breeding of high yield protease, food, pharmaceutical, cosmetics, detergent, spinning, fur softening provides basic material industry. Methods: the protein rich places for collecting soil samples, colony plate screening combined with ultraviolet mutagenesis breeding, breeding of high yield protease of Bacillus, cultivate their physiological and biochemical characteristics based identification through a series of differential, find the species. Results: by screening a mutagenic strain, through Berger's manual was identified as Bacillus subtilis. Mutation in 90s, the protease activity increased. Keywords: high yield protease from Bacillus mutagenesis and identification 目录
蛋白酶
一、蛋白酶将蛋白质变成了氨基酸还是多肽还是都有? 1、都有,主要是多肽,有少量氨基酸。 不同的蛋白酶所催化的肽键不同,即是不同的蛋白酶能使不同的肽键(不同的氨基酸形成的)断裂。有可能某蛋白酶(或多种蛋白酶)水解蛋白质时正好有单个的氨基酸生成。因此,蛋白质在蛋白酶的催化下水解的产物不能理解为只有多肽,而应该表述为主要产物是多肽,同时也有少量游离氨基酸生成。 2、如果是外切酶就是从两端切的酶就会产生氨基酸,如果是内切酶如常见的胃蛋白酶、胰蛋白酶就会从中间切,产生多肽。那个多取决于是内切酶还是外切酶 3、如果是蛋白酶的话,水解蛋白质的结果一定是多肽啦~~ 水解成多肽后,经肽酶进一步水解成氨基酸~ 4、从事实出发,我认为都有,这不仅与酶有关,和蛋白质本身也有关,一些蛋白质本来结构就相对简单。从高中考察的范围而言,我建议最好认为是多肽链,尤其在考试时,若不是“彻底水解”的提法,说变成氨基酸一般会错,因为命题指向通常是多肽链。 二、蛋白质在胃蛋白酶和胰蛋白酶的作用下变成氨基酸的反应属 于什么类型? 属于蛋白质的酶促降解,蛋白质先在蛋白酶的作用下分解成肽链,再在肽酶的作用下分解成氨基酸 三、胃蛋白酶、胰糜蛋白酶水解蛋白质获得的都是芳香族氨基 酸? 糜蛋白酶水解苯丙氨酸、酪氨酸、色氨酸等疏水残基的羧基形成的肽键。 糜蛋白酶水解疏水残基之间的肽键。 如果只用一种酶消化,得到的是各种长度不等的肽段,以及少量游离氨基酸。这些游离氨基酸中,有芳香族的,也有其它氨基酸。可能芳香族的稍多一些。 糜蛋白酶水解芳香族氨基酸的羧基形成的肽键,并不是直接将芳香族氨基酸切下来。 四、碱性蛋白酶可以催化蛋白质及其多肽的水解吗? 碱性蛋白酶(胰蛋白酶)可以催化蛋白质及其多肽的水解,胃蛋白酶(酸性条件下有催化作用)将蛋白质分解为多肽。 五、胰蛋白酶在催化蛋白质水解的时候为什么要先将肽链羰基极
大豆蛋白酶解的研究
收稿日期:2005-11-17 修回日期:2005-12-22 作者简介:李大明,男,1982年出生,在读硕士,从事植物蛋白酶解及天然级热反应肉味香精的研究。 大豆蛋白酶解的研究 李大明,宋焕禄,祖道海 北京工商大学化学与环境工程学院 (北京 100037) 摘 要:用几种常用蛋白酶对大豆蛋白进行酶解,利用均匀设计安排试验,确定各种酶的最佳 酶解条件,并以水解度(DH )为考察标准,选出水解度最大的酶,确定其最佳加酶量和酶解时间。 关键词:大豆蛋白;水解植物蛋白(HVP );水解度(DH );酶解;均匀设计中图分类号:TS201.1 文献标识码:B 文章编号:1672-5026(2006)02-0020-04 Study on enzymatic hydrolysis of soybean protein Li Daming ,Song Huanlu ,Zu Daohai College of Chem ical and Envi ronmental Engi neeri ng ,Beiji ng Technology and B usi ness U niversity (Beiji ng 100037) Abstract :The enzymatic hydrolysis of soybean protein by several normal enzymes is studied.The best condition for enzymatic hydrolysis by experiments uniform designed is confirmed.Making hydrol 2ysis degree (DH )as the standard ,the best adding amounts and hydrolysis time of enzymes whose DH are largest are got. K ey w ords :soybean protein ;hydrolyzed vegetable protein (HVP );hydrolysis degree (DH );en 2zymatic hydrolysis ;uniform designs 大豆蛋白的营养价值很高,含有丰富的优质蛋白质,可以提供充足的人体所需的八种必需的氨基酸以及多种维生素和矿物质等[1]。水解植物蛋白(HVP )是一种营养型食品添加剂,以其柔和丰满的鲜美口感广泛用于肉产品加工、方便面、膨化食品以及调味品中[2]。特别是在Maillard 反应制备肉味香精的研究中,HVP 作为一种前体物质和丰富的氨基酸源得到广泛的应用。Cadwallader 等人以酶解大豆蛋白为前体物质通过Maillard 反应制备肉味香精,并通过GC -MS 和GCO 检测分析出大量特征香味物质[3]。因此HVP 在绿色食品添加剂的生产中将得到广泛的应用。 目前工业上主要采用酸水解法生产HVP 。但酸水解反应条件激烈,会破坏氨基酸,此外,酸水解 法会产生1,3-二氯-2-丙醇(1,3-DCP )和3-氯-1,2-丙二醇(3-MCPD )具有致癌性[4]。酶法水解具有条件温和、副反应少、水解程度容易控制,特别是在营养成分的保留上,具有不可比拟的优点。随着酶工业的发展,酶解方法将替代酸法,成为水解大豆蛋白最有效的方法之一。 1 材料与方法 111 材料 11111 试验原料与主要试剂。豆粕,购于北京和田 宽酿造厂;甲醛溶液,优级纯,北京市旭东化工厂;L -酪氨酸,BR ,上海政翔化学试剂研究所;福林酚试剂,Sigma F -9252,北京欣经科生物技术有限公司;干酪素,BR ,北京双旋微生物培养基制品厂;复合风味酶(Flavozyme )、复合内切酶(Protamex )和碱性内切酶(Alcalase ),Novo Nodisk 公司;其他化学试剂均为分析纯;试验用水为蒸馏水。 2Vol.13,2006,No.2 粮食与食品工业 Cereal and Food Indust ry 食品科技
