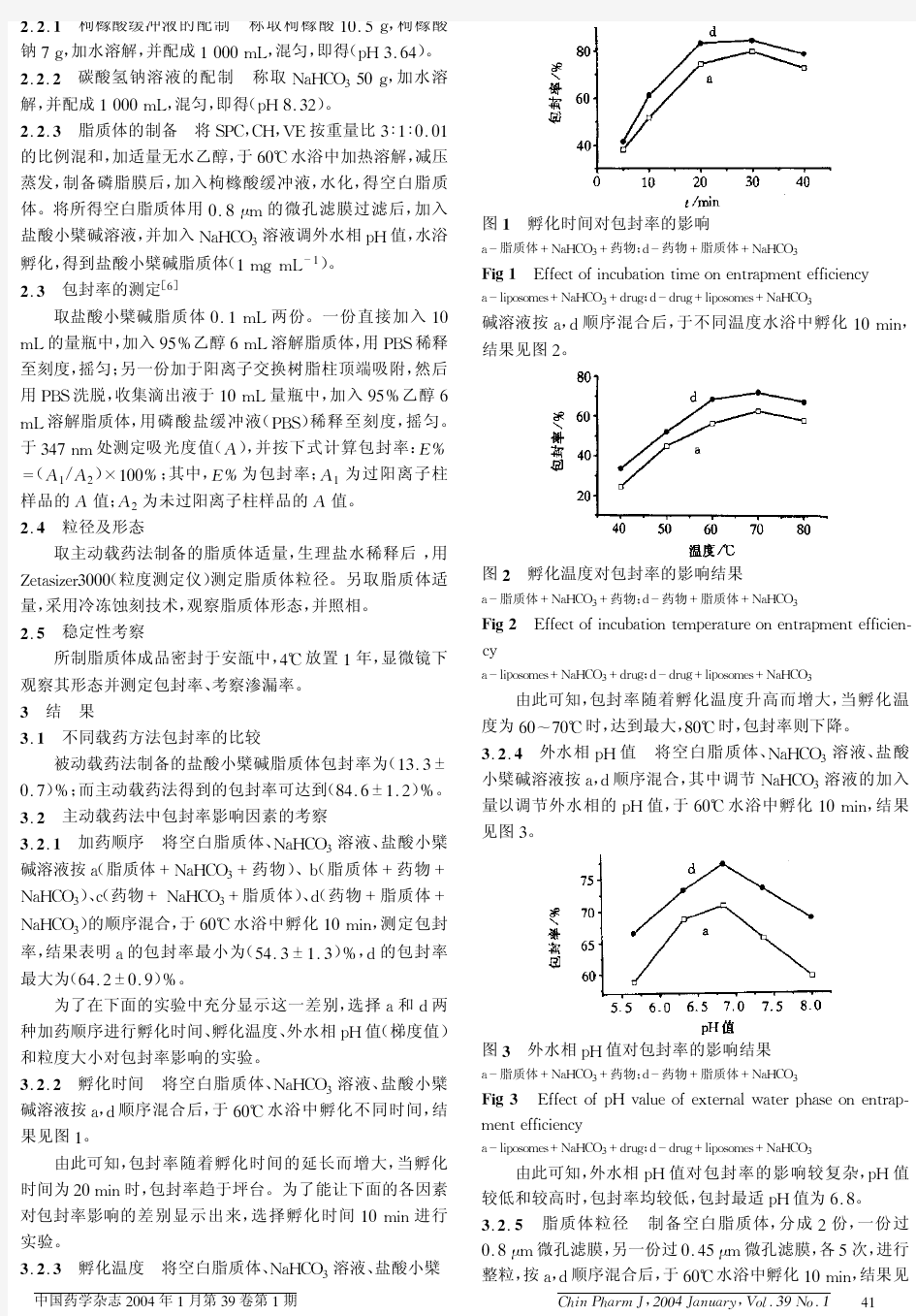
主动载药法制备盐酸小檗碱脂质体

脂质体透皮给药研究
脂质体透皮给药研究 摘要:经皮给药制剂是通过皮肤使药物吸收入体内发挥全身作用的新剂型,是药剂学研究的重点和难点领域,众多学者致力于这方面的研究,以达到治疗水平上的经皮和黏膜透过量。本文查阅国内外文献,笔者综述脂质体的制备方法,脂质体经皮给药的渗透促进作用机制、透皮影响因素、最近脂质 体用于经皮给药的研究进展 关键词:脂质体;透皮给药系统;透皮吸收 引言:经皮给药系统指在皮肤或粘膜表面给药,使药物以恒定速度(或接近恒定速度)通过皮肤各层或粘膜,进入体循环,产生全身或局部治疗作用的新制剂1.经皮给药系统有以下优势:保持血药浓度稳定在治疗窗范围;避免药物口服经胃肠道及肝的首过效应,经皮传递比口服给药更稳定地直接进入血液;改善患者顺应性,不必频繁给药;提高安全性,如发现不良反应,可立即移去,减少口服或注射给药的危险性。脂质体是由磷脂和其他两亲性物质分散于水中,由一层或多层同心的脂质双分子膜包封而成的球状体。脂质体以其低毒性、相对易制备,可避免药物的降解和可实现靶向性给药等优点,而被广泛作为药物载体使用。脂质体作为经皮给药的载体,应用于动物实验和临床观察,结果显示具有显著的促渗透效果。脂质体药物经皮传递中具有更好的性能2,如:①可使用的赋形剂广泛,无需使用高浓度表面活性剂;②较高载药量;③提高药物稳定性,避免药物降解或泄漏,并减少药物对皮肤的刺激性;④可使药物突释或缓释,药物突释可提高药物对皮肤的通透性;由于药物存在于固体基质中,也可缓释,使皮肤表面及皮肤组织中长时间保持较高药物浓度;⑤纳米粒尺寸较小,能够与角质层紧密接触,而且其较高的表面积,大大地增加药物与角质层的接触时间和面积,有利于药物经皮吸收;⑥能够在皮肤表面成膜,起到包封作用,减少表皮水分流失,有利于药物对皮肤经皮通透。固体脂质纳米粒应用于经皮给药具有较大潜力,其具有良好的粘附性,在皮肤表面形成闭塞效应膜,增加角质层水合作用,增加皮肤角质层流动性,提高经皮给药效率3。 1.脂质体的制备方法 脂质体常用的制备方法有乙醇注入法、逆向蒸发法、乙醚注入法、pH 梯度法、散法、冻融法、超声分散法、冷冻干燥法4等。近几年又产生几种新的方法。 1.1 超临界二氧化碳法超临界二氧化碳是一种无毒、惰性且对环境无害的介质,较传统制备方法安全,且包封率较高。文震5等利用超临界CO2 技术先将膜材和药物制成脂质体混悬液,再真空干燥制备脂质体,影响脂质体包封率和粒径的因素有压力(脂质体的包封率、载药量均随着压力的升高而增大)、温度[当温度低于323 K(磷脂相变温度)Tm 时,包封效果较差;当温度高于323 K,包封率、载药量随温度增加而增大;再继续增高就会下降]、共溶剂。测得脂质体平均包封率为87.2%,平均载药量为5.9%,平均粒径448nm。 1.2 微乳法用微乳法制备脂质体包封率比较高,粒径较大。用有机溶剂溶解磷脂和胆固醇后加入待包封的药物溶液,乳化得W/O 乳液;再加入大量的水中 1 2 3 4
脂质体制备方法
微脂体(又称脂质体)及其制备方法一二 微脂体(又称脂质体) 微脂体起源于1960 年代中期,Bangham博士等人首先提出,在磷酸脂薄膜上加入含盐分的水溶液后,再加以摇晃,会使脂质形成具有通透性的小球;196 8年,Sessa 和Weissmann 等人正式将此小球状的物体命名为微脂体(liposo me)并做出明确的定义: 指出微脂体是由一到数层脂质双层膜(lipid bilayer) 所组成的微小的囊泡,有自行密合(self-closing)的特性。微脂体由脂双层膜包裹水溶液形成,由于构造的特性,可同时作为厌水性(hydrophobic)及亲水性(hydrophilic)药品的载体,厌水性药品可以嵌入脂双层中,而亲水性药品则可包覆在微脂体内的水溶液层中。如同细胞膜,微脂体的脂质膜为脂双层构造,由同时具有亲水性端及厌水性端的脂质所构成,脂双层由厌水性端相对向内而亲水性端面向水溶液构成,组成中的两性物质以磷酸脂质最为常见。微脂体的形成是两性物质在水溶液中,依照热力学原理,趋向最稳定的排列方式而自动形成。微脂体的性质深受组成脂质影响,脂质在水溶液的电性,决定微脂体是中性或带有负电荷、正电荷。此外,磷酸脂碳链部分的长短,不饱和键数目,会决定微脂体的临界温度(transition temperature, Tc),影响膜的紧密度。一般来说,碳链长度越长临界温度越高,双键数越多则临界温度越低,常见的DPPC(dipalmitoylp hosphatidylcholine)与DSPC(distearoylphosphatidylcholine)的临界温度分别是42℃与56℃,而Egg PC(egg phosphatidylcholine)与POPC(palmitoyl oleoyl phosphatidylcholine)的Tc 则低于0℃。临界温度影响微脂体包裹及结合药物的紧密度,当外界温度高于Tc时,对膜有通透性的药物,较容易通过膜;此外,当外界温度处于临界温度时,微脂体脂质双层膜中的脂质,会因为流动性不一致而使微脂体表面产生裂缝,造成内部药物的释出。在磷脂质内加入胆固醇,会对微脂体性质产生下列影响:增加微脂体在血液中的安定性,较不易发生破裂;减少水溶性分子对微脂体脂膜的通透性;增加微脂体的安定性,使其在血液循环中存在的时间较长。 微脂体可依脂双层的层数或是粒子大小,加以命名或分类: (1) Multilamellar vesicle(MLV)是具有多层脂双层之微脂体,粒子大小介于100-1000 nm,特色是粒子内具多层脂质膜,一般而言,干燥后的脂质薄膜,
简述亲水性药物脂质体的制备
一,前言 脂质体作为一种新型的载药系统,今年来得到广泛的应用和研究。评价脂质体质量的指标有外观、粒径分布和包封率等。其中包封率是衡量脂质体内在质量的一个重要指标。对于亲脂性药物,由于其对磷脂膜的亲和性,可以在制备过程中得到很高的包封率,且不易渗漏。而亲水性药物在制备时则必须包封在脂质体囊内部或多层脂质体层间的水性介质中,除一些特殊药物外包封率普遍不高,且易泄露。制备中为了得到更大的包封率,不得不增加囊内的容积,而这与控制脂质体在有效的粒径范围内又相互矛盾。以下将介绍一些用于提高亲水性药物在脂质体中的包封率的方法。 二,制备方法 1,常规方法 对于一些亲水性药物,使用常规的制备方法也可以得到满意的包封率。胡静等(1)用简单的薄膜水化-机械分散法研究了硫唑嘌呤(Aza)脂质体包封率的影响因素。这些因素包括卵磷脂与胆醇摩尔比、缓冲液(PBS)pH值、水相用量及药脂重量比。通过正交设计得到最佳处方所制得的3批硫唑嘌呤脂质体形态圆整,大小均匀,粒度范围0.01~0.42μm,包封率均达30%以上。但在实验中发现药脂重量比增加时,包封率反而下降,这说明Aza的利用率在减少。 吴骏等(2)使用逆相蒸发法制备阿昔洛韦ACV脂质体,经过正交优化后,得到阿昔洛韦脂质体的平均粒径为219.8nm,多分散系数为0.158,包封率为65%,且具有良好的稳定性。作者将卵磷脂、胆固醇、油酸和去氧胆酸钠溶于乙醚,于室温搅拌下滴入ACV水溶液,使形成稳定的W/O型乳剂。25℃减压蒸去乙醚,得乳白色混悬液,通过微孔滤膜后,即得ACV脂质体。产品经离心加速实验表现出良好的稳定性。此实验通过选择适当的油水体积比可使内相体积增加,提高包封率;同时加入了乳化剂可以防止脂质体的粒径增大。 翟光喜等(3)也将表面活性剂胆酸钠引入脂质体的处方中制备了低分子肝素的柔性纳米脂质体,此类脂质体具有高度的形变性,可由于经皮给药系统。制备方法就是简单的将处方混合后至冰水浴中超声处理,再通过微孔滤膜即得。经正交优化后包封率可达到33.1%。但该制剂的稳定性和储存中的渗漏作者并没有做进一步研究。陈鹰等(4)也研究了双氯芬酸钠的柔性脂质体,试验将磷脂等脂溶性成分和胆酸盐溶于乙醚中,药物则溶解在磷酸缓缓冲液中,混合后减压旋转挥干后再超声过滤。得到的脂质体包封率为73.12%。 侯新朴等对低包封率的水溶性药物(如甲硝唑)进行疏水衍生化,其疏水链将药物分子插入脂质体膜,包封率和稳定性都提高十多倍(5)。 在这些常规的制备方法中,首先应该对药物的性质有充分的了解。同时工艺参数的选择,尤其是合适的油水相比及乳化剂的用量对于水溶性药物的包封率有很大的影响。在制备过程中采用超声,加乳化剂的方法都可以有效地控制脂质体的粒径。
国外脂质体载药系统制备技术
国外脂质体载药系统制备技术浅述[摘要]脂质体作为一种载药系统,具有靶向性和淋巴定向性、细胞亲和性和组织相容性、长效作用、降低药物毒性、提高药物稳定性等有优点,在国内外得到广泛的应用。 [关键词]脂质体;载药系统;制备; [abstract]liposomes as a drug carrier system has many merits,such as targeting and lymphatic orientation, cell compatibility and tissue compatibility, long-lasting effect, reduce drug toxicity, improve drug stability etc. so it is widely used at domestic and abroad. [key word]liposomes ;drug carrier system; manufacture; banghman在20世纪60年代中期发现了脂质体,这在药物载体方面是一个里程碑式的发明。[1]脂质体大多是由磷脂构成,因此他们具有高度的生物利用度和生物可降解性,脂质体作为载体的最大优势是能够承载酶、蛋白质和遗传物质等生物大分子。近年来,国外对脂质体制备研究进展较快,简要综述如下。 从形态上脂质体可以分为单室囊泡载药系统和多室囊泡载药系统,按照平均粒径可以分成小囊泡(粒径<100nm)、中囊泡(粒径100-500nm)、大囊泡(粒径>100um)。 1.脂质体的组成配方 脂质体最主要的成分为卵磷脂(lecithins)和胆固醇(cholesterol),其他组成成分还包括类固醇分子、负电荷磷脂、
脂质体的研究与应用
脂质体的研究与应用 摘要:脂质体是某些细胞质中的天然脂质小体有关脂质体的研究进展进行了检索、分析、整理和归纳,综述了脂质体的分类、制备方法及研究进展。 关键字:主动载药;被动载药;药物载体;前体脂质体;靶向给药脂质体(Liposomes)是由磷脂胆固醇等为膜材包合而成。磷脂分散在水中时能形成多层微囊,且每层均为脂质双分子层,各层之间被水相隔开,这种微囊就是脂质体。脂质体可分为单室脂质体、多室脂质体,含有表面活性剂的脂质体。按性能脂质体可分为一般质体(包括上述单室脂质体、多室脂质体和多相脂质体等)特殊性能脂质体、热敏脂质体、PH敏感脂质体、超声波敏感脂质体、光敏脂质体和磁性脂质体等。按电荷性,脂质体可分为中性脂质体、负电性脂质体、正电性脂质体。 脂质体作为药物载体在恶性肿瘤的靶向给药治疗方面极具潜力。为克服脂质体作为载体的靶向分布不理想、稳定性较差的缺点,近年来开发了一些新型脂质体,如温度敏感型、PL敏感型、免疫、聚合膜脂质体。前体脂质体概念的提出和研究,提供了克服脂质体不稳定的较好思路。 目前,制备脂质体的方法较多,常用的有薄膜法、反相蒸发法、溶剂注入法和复乳法等,这些方法一般称为被动载药法,而pH梯度法,硫酸铵梯度法一般被称为主动载药法。 1被动载药法 脂质体常用制备方法主要有薄膜分散法、反相蒸发法、注入法、超声波分散等。陈建明等[1]在制备含药脂质体时,首先将药物溶于水相或有机相中,然后按适宜的方法制备含药脂质体,该法适于脂溶性强的药物,所得脂质体具有较高包封率。 1 )薄膜分散法 此法是最原始但又是迄今为止最基本和应用最广泛的脂质体的制备方法。将磷脂和胆固醇等类脂及脂溶性药物溶于有机溶剂,然后将此溶液置于一大的圆底烧瓶中,再旋转减压蒸干,磷脂在烧瓶内壁上会形成一层很薄的膜,然后加入一定量的缓冲溶液,充分振荡烧瓶使脂质膜水化脱落,即可得到脂质体。 2)超声分散法 将磷脂、胆固醇和待包封药物一起溶解于有机溶剂中,混合均匀后旋转蒸发去除有机溶剂,将剩下的溶液再经超声波处理,分离即得脂质体。超声波法可分为两种“水浴超声波法和探针超声波法”,本法是制备小脂质体的常用方法,但是超声波易引起药物的降解问题。 3)冷冻干燥法 脂质体混悬液在贮存期间易发生聚集、融合及药物渗漏,且磷脂易氧化、水解,难以满足药物制剂稳定性的要求。目前,该法已成为较有前途的改善脂质体制剂长期稳定性的方法之一。 4 )冻融法 此法首先制备包封有药物的脂质体,然后冷冻。在快速冷冻过程中,由于冰晶的形成,使形成的脂质体膜破裂,冰晶的片层与破碎的膜同时存在,此状态不稳定,在缓慢融化过程中,暴露出的脂膜互相融合重新形成脂质体。分别用反相蒸发法、乳化法和冻融法制备了甲氧沙林脂质体。 5)复乳法
脂质体
脂质体(Liposomes)是由卵磷脂和神经酰胺等制得的脂质体(空心),具有的双分子层结构与皮肤细胞膜结构相同,对皮肤有优良的保湿作用,尤其是包敷了保湿物质如透明质酸、聚葡糖苷等的脂质体是更优秀的保湿性物质。 脂质体(liposome)是一种人工膜。在水中磷脂分子亲水头部插入水中,脂质体疏水尾部伸向空气,搅动后形成双层脂分子的球形脂质体,直径25~1000nm不等。脂质体可用于转基因,或制备的药物,利用脂质体可以和细胞膜融合的特点,将药物送入细胞内部生物学定义:当两性分子如磷脂和鞘脂分散于水相时,分子的疏水尾部倾向于聚集在一起,避开水相,而亲水头部暴露在水相,形成具有双分子层结构的的封闭囊泡,称为脂质体。药剂学定义脂质体(liposome): 系指将药物包封于类脂质双分子层内而形成的微型泡囊体。 脂质体的分类 1.脂质体按照所包含类脂质双分子层的层数不同,分为单室脂质体和多室脂质体。 小单室脂质体(SUV):粒径约0.02~0.08μm;大单室脂质体(LUV)为单层大泡囊,粒径在0.1~lμm。 多层双分子层的泡囊称为多室脂质体(MIV),粒径在1~5μm之间。 2.按照结构分:单室脂质体,多室脂质体,多囊脂质体 3.按照电荷分:中性脂质体,负电荷脂质体,正电荷脂质体 4.按照性能分:一般脂质体,特殊功效脂质体 组成和结构 脂质体的组成:类脂质(磷脂)及附加剂。 脂质体
脂质体 如注射给药脂质体的粒径应小于200nm,且分布均匀,呈正态性,跨距宜小。 2、包封率和载药量 包封率:包封率=(脂质体中包封的药物/脂质体中药物总量)×100% 一般采用葡聚糖凝胶、超速离心法、透析法等分离方法将溶液中游离药物和脂质体分离,分别测定,计算包封率。通常要求脂质体的药物包封率达80%以上。 载药量:载药量=[脂质体中药物量/(脂质体中药物+载体总量)]×100% 载药量的大小直接影响到药物的临床应用剂量,故载药量愈大,愈易满足临床需要。载药量与药物的性质有关,通常亲脂性药物或亲水性药物较易制成脂质体。 3、脂质体的稳定性 1)、物理稳定性:主要用渗漏率表示。 渗漏率=(放置前介质中药物量-放置后介质中的药量)/制剂中药量x100% 胆固醇可以加固脂质双分子层膜,降低膜流动,可减小渗漏率。 2)、化学稳定性: (1)磷脂氧化指数:氧化指数=A233nm/A215nm;一般规定磷脂氧化指数应小于0.2。 (2)磷脂量的测定:基于每个磷脂分子中仅含1个磷原子,采用化学法将样品中磷脂转变为无机磷后测定磷摩尔量(或重量),即可推出磷脂量。 4、防止氧化的措施: 防止氧化的一般措施有充入氮气,添加抗氧剂-生育酚、金属络合剂等;也可直接采用氢化饱和磷脂。 5、脂质体的灭菌: 灭菌的一般方法有过滤除菌、无菌操作、-射线照射(60钴15~20kGy)、121℃热压灭菌等。 特点 1、靶向性和淋巴定向性:肝、脾网状内皮系统的被动靶向性。用于肝寄生虫病、利什曼病等单核-巨噬细胞系统疾病的防治。如肝利什曼原虫药锑酸葡胺脂质体,其肝中浓度比普通制剂提高了200~700倍。 2、缓释作用:缓慢释放,延缓肾排泄和代谢,从而延长作用时间。
转基因技术与动物育种
转基因技术与动物育种 高彩霞,张永升,周天野 甘肃农业大学动物科学技术学院甘肃兰州(730070) E-mail:gcx.815@https://www.360docs.net/doc/e45407706.html, 摘要:随着转基因技术的不断发展,其在动物育种中取得了很大成果。因此,转基因技术具有诱人的前景和发展前途。本文简要综述了转基因技术的原理、方法、研究前沿领域以及应用于动物育种中的进展情况。 关键词:转基因技术转基因动物动物育种 远缘生物之间的杂交是极其困难的,有些甚至是不可能的,这就是众所周知的种间生殖隔离。那么能否打破这种隔离,使一种生物同时具有一种或几种生物的优良性状,进而培育符合人们意愿的生物新品种,更好地服务于人类呢?科学家们经过多年艰苦的努力和探素,终于使这一愿望变为现实,这就是在基因工程发展的基础上融基因工程和胚胎工程为一体的转基因技术。由于这一技术能够实现基因的种间转移,用于动物育种将大大提高育种的目的性,加快育种进程。自Palrniter等1982年将大白鼠生长激素基因显微注射到小白鼠受精卵,获得比正常小鼠大1倍的“超级巨鼠”以来,世界各国科学家竞相开展转基因技术研究,通过多种转基因方法在猪、牛、鸡、兔、羊等动物上获得成功。如今,转基因技术正在对动物育种产生一场新的革命[1]。 1转基因技术的概述 1.1转基因技术的概念 转基因技术起始于20世纪70年代的高新技术,是按照科研或生产需要在分子水平上用人工方法提取或合成不同生物的遗传物质(DNA片段),然后在体外切割,并连接形成重组DNA,重组DNA再与载体的遗传物质重新组合,将其引入到没有DNA的受体细胞中,进行复制和表达,生产出符合人类需要的产品或创造出生物的新性状,并使之能稳定地遗传给下一代[2]。简要地说是指将体重组DNA外通过显微注射或载体系统导入胚胎细胞中,并整合到基因组中,得到稳定地表达的技术[3]。 1.2 转基因动物技术的概念 转基因动物技术是在20世纪80年代初发展起来的。从这项技术诞生的那天起,它就在改良畜禽生产性状、提高畜禽抗病力以及利用转基因畜禽生产非常规畜牧产品(如人药用蛋白和工业用酶)等方面显示了广阔的应用前景[4]。它是将外源基因或体外重组的基因转移到动物的受精卵内,使其在随后发育的动物体内得到整合和表达,以产生具有新的遗传特征或性状的动物个体的过程,或者是将外源基因在特定调控元件作用下在某些宿主组织中进行独立的复制,并在一定的时间内表达外源蛋白的过程[1]。 1.3 转入基因的选择 目前在转入基因的选择上主要有四类:1)编码蛋白基因,这类基因参与机体组织生长发育的调节,如生长激素基因等;2)抗性基因;3)经济性状的主效基因,如猪和绵羊的高繁殖力基因和肉牛的“双肌”基因等,这些基因与动物的生产力密切相关;4)治疗人类疾病所需的蛋白质基因[5]。
脂质体及其制备方法的选择
脂质体及其制备方法的选择 1.脂质体概述 1965年,英国学者Bangham和Standish将磷脂分散在水中进行电镜观察时发现了脂质体。磷脂分散在水中自然形成多层囊泡,每层均为脂质的双分子层;囊泡中央和各层之间被水相隔开,双分子层厚度约为4纳米。后来,将这种具有类似生物膜结构的双分子小囊称为脂质体。此两位学者曾获得过诺贝尔奖提名。 某些磷脂分散在过量的水中形成了脂质体,该脂分子本身排成双分子层,在磷脂的主要相变温度(Tm)以上,瞬间形成泡囊,且泡囊包围水液,根据磷脂种类及制备时所用温度,双分子层可以是凝胶或液晶状态。在凝胶态时磷脂烃链是一种有规律的结构,在液态时烃链是无规律的,每一种用来制备脂质体的纯磷脂由凝胶状态过渡到液晶状态时均具有特征的相变温度。这种相变温度(Tin)是根据磷脂性质而变(见下表),它可在-20~+90℃之间变化,双分子层的不同成分混合物可引起相变温度的变化或相变完全消失,当双分子层通过相变温度时,被封闭的水溶性标示物的漏出量增加。 脂质体的相变行为决定了脂质体的通透性、融合、聚集及蛋白结合能力,所有这些都明显影响脂质体的稳定性和它们在生物体系中的行为。
脂质体根据其脂质膜的层数和腔室的数量,可以分为单层脂质体,多层脂质体和多囊脂质体,单层脂质体。不同类型的脂质体其结构特点各不相同,见下图表。 1971年,英国Rymen等人开始将脂质体用作药物载体。所谓载体,可以是一组分子,包蔽于药物外,通过渗透或被巨嗜细胞吞噬后载体被酶类分解而释放药物,从而发挥作用。它具有类细胞结构,进入动物体内主要被网状内皮系统吞噬而激活机体的自身免疫功能,并改变被包封药物的体内分布,使药物主要在肝、脾、肺和骨髓等组织器官中积蓄,从而提高药物的治疗指数,减少药物的治疗剂量和降低药物的毒性。脂质体技术是被喻为“生物导弹”的第四代靶向给药技术,也是目前国际上最热门的制药技术。至于药物在脂质体中的负载定位,其取决于所载药物的性质,见下图。
脂质体在载药及造影中的双重应用
脂质体在癌症诊疗中的载药和造影双重应用 马冬121635 东南大学生物医学与工程学院,江苏省生物材料与器件重点实验室, 江苏南京210009摘要:脂质体是由磷脂双层构成的具有水相内核的脂质微囊,在其水相和脂质双分子层组成的膜内可以包裹多种物质,且具有被动靶向和主动靶向的潜力,因此常被用来作为药物或各种造影剂的载体。脂质体可以以包封、膜标记、表面螯合、远端装载等方式与药物和造影剂结合,并在温度、pH、超声等的作用下进行可控的药物释放,因此脂质体在诊疗一体化方面有很多运用,可以根据实际情况的要求进行某种药物和单个成像模式的一体化,也可以对多种成像模式进行一体化。本问对脂质体作为药物和造影剂载体在癌症的诊断和治疗方面的最新应用作一综述。 关键词:脂质体;靶向载药;造影;诊疗一体化 引言 脂质体是一层或多层磷脂双层膜分散在水中形成的一个类球状、包封一部分水相的封闭囊泡。早在1947年Bernard就提出了这种存在于水性体系中的两亲分子囊泡性结构的假设,但直到1962年剑桥大学动物生理学研究所装备了电子显微镜后,Alec D. Bangham才和他的同事于1965年正式提出脂质体的概念【1】。由于磷脂双分子层具有和细胞膜类似的结构,所以其具有良好的生物相容性。脂质体进入人体内会被网状内皮系统吞噬,主要在肝、脾和骨髓等组织器官中积蓄,从而具有天然的被动靶向性;如果再对其修饰上特定的配体,又可主动的靶向某些部位。这些性质使其可作为良好的药物和其他试剂的载体。 人体的内部结构和功能一般是看不见的,但人们借助各种科学技术将人体内部结构和功能形成图像,从而检视人体,进行诊断和治疗,这就是医学成像的目的。1895年伦琴发现X射线后不久医生就将其应用于医学。从20世纪50年代开始,医学成像的发展突飞猛进,新的成像系统相继出现。X射线包括CT主要用于观察人体形态学上的特征。采用放射性核素的核素成像可以了解脏器的生理功能。单光子发射CT(SPECT)和正电子发射CT(PET)利用失踪动力学模型,显示了活体对注入药物的体内代谢过程,使许多疾病的研究和诊断大为深入。磁共振成像(MRI)从另一角度些事了人体内部状况,它的图像与体内生化过程有关;它既是功能性的又比核素成像更清晰,而且对人体损伤很小。超声成像与这些方法相比价格低廉,使用方便,对人体基本无损,因此得到广泛应用,成为常规的首选成像手段之一[2].在成像技术中为了得到信号或增强信号需要用到显影剂或造影剂,脂质体具有作为这些试剂载体的潜力。 随着科技的发展,成像技术在许多疾病特别是癌症的诊断和治疗中的重要性急剧增加。在纳米医学领域,成像和治疗结合的趋势明显。经过改造的脂质体可以选择性的靶向肿瘤组织,并能同时携带药物和造影剂,这使得脂质体在诊疗一体化方面有很大的潜力。本文将重点对脂质体作为抗肿瘤药物和各类成像技术中(CT、核素成像、MRI、超声成像)的应用情况作一综述。
实验十五 脂质体的制备.
实验十五脂质体的制备 一、实验目的 1. 掌握注入法制备脂质体的工艺。 2. 掌握脂质体包封率的测定方法。 二、实验原理 60年代初 Banghan 等发现磷脂分散在水中可形成多层囊,并证明每层囊均为双分子脂质膜组成且被水相隔开,称这种具有生物膜结构的囊为脂质体。197l 年Ryman 等人提出将脂质体作为药物载体, 即将酶或药物包囊在脂质体中。近年来脂质体作为药物载体在传递给药系统中的研究有了迅速的发展。 脂质体系一种人工细胞膜, 它具有封闭的球形结构, 可使药物被保护在它的结构中, 发挥定向作用。特别适于作为抗癌药物载体,以改善药物的治疗作用,降低毒副作用等。脂质体系由磷脂为骨架膜材及附加剂组成。用于制备脂质体的磷脂有天然磷脂, 如豆磷脂,卵磷脂等;合成磷脂,如二棕榈酰磷脂酰胆碱,二硬脂酰磷脂酰胆碱等。磷脂在水中能形成脂质体是由其结构决定的。磷脂具有两条较长的疏水烃链和一个亲水基团。当较多的磷脂加至水或水性溶液中, 磷脂分子定向排列, 其亲水基团面向两侧的水相, 疏水的烃链彼此对向缔合形成双分子层, 并进一步形成椭圆形或球状结构——脂质体。常用的附加剂为胆固醇,它也是两亲性物质,与磷脂混合使用,可制备稳定的脂质体,其作用是调节双分子层流动性,减低脂质体膜的通透性。其它附加剂有十八胺,磷脂酸等,这两种附加剂可改变脂质体表面电荷的性质。 脂质体可分为三类:小单室(层脂质体,粒径在 20~50nm,凡经超声波处理的脂质体混悬液, 绝大部分为小单室脂质体; 多室(层脂质休, 粒径约在 400~1000nm; 大单室脂质, 粒径约为 200~1000nm,用乙醚注入法制备的脂质体多属这—类。 脂质体包封率的测定包封率的定义可用下式表示: 包封率% =(W总 - W游离 / W总 x 100
细胞的脂质体转染法和电穿孔法
细胞的脂质体转染法和电穿孔转染法 (一)脂质体转染 一、实验试剂及器材 Lipofectamine? 3000 Transfection Reagent,质粒DNA(0.5-5 μg/μL储液),Opti-MEM?减血清培养基,培养板,酒精灯,离心机,微量移液器,离心管等。 二、实验步骤 1. 接种细胞至70-90%汇合度时转染; 2. 使用Opti-MEM?减血清培养基稀释Lipofectamine? 3000试剂(2管),充分混匀(6孔板Opti-MEM?培养基为125 μL× 2,Lipofectamine? 3000为 3.75和7.5 μL); 3. 在每管已稀释的Lipofectamine? 3000试剂中加入稀释的DNA(用P3000TM试剂稀释)(1:1比例); 4. 室温孵育5分钟; 5. 加入DNA-脂质体复合物至细胞中; 6. 37°C(PK-15在39°C下培养)孵育细胞2–4天,然后分析转染细胞。 三、注意事项 1. 在无血清培养基(如Opti-MEM?减血清培养基)中制备DNA-Lipofectamine? 3000脂质体复合物,直接将其加入含细胞培养基的细胞中(在血清/抗生素存在或不存在时均可); 2. 转染后无需去除转染复合物或者更换/添加培养基;
3. Lipofectamine? 3000试剂用量各有不同,测试推荐的两种浓度的Lipofectamine? 3000试剂,以确定最佳用量,开始新的转染; 4. Lipofectamine? 3000试剂应放在4℃储存(切勿冷冻)。 附上Lipofectamine 3000 REagent Protocol:
盐酸多柔比星脂质体注射液说明书--楷莱
盐酸多柔比星脂质体注射液说明书 【药品名称】 通用名:盐酸多柔比星脂质体注射液 商品名:楷莱 英文名:Doxorubicin Hydrochloride Liposome Injection 汉语拼音:Yan Suan Duo Ruo Bi Xing Zhi Zhi Ti Zhu She Ye 【成份】 本品主要成分及其化学名称为:盐酸多柔比星,(1S,3S)-3-乙醇酰-1,2,3,4,6,11-六氧-3,5,12-三羟基-10-甲氧基-6,13-二氧并四苯-1-基-3-氨基-2,3,6-三去氧-α-L-来苏吡喃糖苷。 其结构式为: 分子式:C27H29NO11.HCl 分子量:579.99 CAS No.:25316-40-9 【性状】 本品是一种脂质体制剂,系将盐酸多柔比星通过与甲氧基聚乙二醇的表面结合包封于脂质体中。这种工艺被称作为空间稳定或隐匿,可以保护脂质体免受单核巨噬细胞系统(MPS)识别,从而延长其在血液循环中的时间。 本品为无菌、半透明的红色混悬液,每瓶10 mL,含盐酸多柔比星2 mg/mL,是用于单剂量静脉滴注给药的浓缩液。本品的活性成分为盐酸多柔比星,是从一种波塞链霉菌表灰变种(strep tomyces peucetius var. caesius)培养液中提取得到的蒽环类细胞毒性抗生素。 【适应症】 本品可用于低CD4(<200 CD4淋巴细胞/mm3)及有广泛皮肤粘膜内脏疾病的与艾滋病相关的卡波氏肉瘤(AIDS-KS)病人。 本品可用作一线全身化疗药物,或者用作治疗病情有进展的AIDS-KS病人的二线化疗药物,也可用于不能耐受下述两种以上药物联合化疗的病人:长春新碱、博莱霉素和多柔比星(或其他蒽环类抗生素)。 【规格】20mg/ml/支 【用法用量】 本品应为每2-3周静脉内给药20 mg/m2,给药间隔不宜少于10天,因为不能排除药物蓄积和毒性增强的可能。病人应持续治疗2-3个月以产生疗效。为保持一定的疗效,在需要时继续给药。本品用250毫升5%葡萄糖注射液稀释,静脉滴注30分钟以上。禁止大剂量注射或给用未经稀释的药液。建议本品滴注管与5%葡萄糖滴注管相连接以进一步稀释并最大限度地减少血栓形成和外渗危险。 本品禁用于肌肉和皮下注射。
国外脂质体载药系统制备技术浅述
国外脂质体载药系统制备技术浅述 []Liposomes as a drug carrier system has many merits,such as targeting and lymphatic orientation, cell compatibility and tissue compatibility, long-lasting effect, reduce drug toxicity, improve drug stability etc. So it is widely used at domestic and abroad. []liposomes ;drug carrier system; manufacture; Banghman在20世纪60年代中期发现了脂质体,这在药物载体方面是一个里程碑式的发明。[1] 脂质体大多是由磷脂构成,因此他们具有高度的生物利用度和生物可降解性,脂质体作为载体的最大优势是能够承载酶、蛋白质和遗传物质等生物大分子。近年来,国外对脂质体制备研究进展较快,简要综述如下。 从形态上脂质体可以分为单室囊泡载药系统和多室囊泡载药系统,按照平均粒径可以分成小囊泡(粒径v 100nm)、中囊 泡(粒径100-500nm)、大囊泡(粒径>100um)。 1. 脂质体的组成配方 脂质体最主要的成分为卵磷脂(Lecithins )和胆固醇(cholesterol ),其他组成成分还包括类固醇分子、负电荷磷脂、神经节苷脂和为使脂质体具有治疗功能调节性的高分子材料。[2] 实际上,这些成分可以调节脂质体在体内的分布、表面电荷、 释放、清除率。该表了脂质体负载表面情况可以改变脂质体在体内的
脂质体的制备概要
实验十五 脂质体的制备
一实验目的 1.了解脂质体(liposome)在细胞 工程技术中的应用及其制备方法。 2.掌握采用超声波法、冰冻干燥法 和冻融法三种不同的方法制备脂 质体的方法并了解该技术在细胞 工程中的应用。
二实验原理 脂质体(liposome)的制备技术,一般采用超声波法、振荡法、乙醚蒸发法、去污剂透析法、冰 冻干燥法和冻融法等。制备方法 不同,所得脂质体结构、大小不 同,性质和用途也就不同(表15-1)。
种类制备方法大小(m) 特性 多层大脂质体(MLV) 乙醚蒸发法、醇醚水 法、振荡法、液相快 速混合振荡法 0.1~50 易制备,包被物释放 速度慢 单层小脂质体(SUV) 直接超声波法、溶剂 超声波法、乙醚注射 法 0.02~0.05 体积小,适合包被离 子、小分子药物等 单层大脂质体(LUV) 递相蒸发法、去污剂 (胆酸纳等)透析法、 冰冻干燥法 0.05~0.5 适合包被蛋白质、 RNA、DNA片段、 大分子药物及细胞融 合 单层巨大脂质体(GUV) 冻融法5~30 适合包被蛋白质、 RNA、DNA片段, 除菌处理较难
本实验采用超声波法、冻融法、冰冻干燥 法三种不同类型的方法,超声波法的原理是:在超声波作用下,磷脂类双亲媒性分子被打碎为分子或分子团,并自动重新排布成类似生物膜的双分子层囊泡。冻融法是在超声波法形成的小脂质体基础上,通过冷冻和融解过程使其破裂,重组为大体积脂质体,在通过透析时膜内外渗透压的变化而膨胀为更大体积的脂质体。冰冻干燥法语原理与冻融法基本一致,只在处理条件上有所不同。
三实验用品 1.器材 超声波清洗机、光学显微镜、荧光显微镜、荧光 分光光度计、漩涡混合器、核酸蛋白检测仪、柱层析装置、冰冻干燥机。 2.试剂 1)磷脂液:100mg经丙酮-乙醚法纯化的卵磷 脂,57.2mg胆固醇,溶于1ml氯仿。 2)荧光液:钙黄绿素(calcein)47mg溶于 100ml Tris缓冲液。 3)Tris 缓冲液:称取Tris 0.12g,EDTA 0.288mg,溶于80ml去离子水中,用0.1 mol/L 盐酸调Ph7.2,再加水至100ml。
盐酸小檗碱前体脂质体的制备及理化性质研究
盐酸小檗碱前体脂质体的制备及理化性质研究目的制备盐酸小檗碱前体脂质体,并对其理化性质进行考察。方法采用 薄膜载体沉积法制备盐酸小檗碱前体脂质体,正交实验优选处方;透射电镜观察形态;马尔文激光粒度仪测定粒径;高效液相色谱法测定包封率。结果电镜下观察脂质体形态多为圆形或椭圆形,平均粒径为741 nm,包封率为(29.93±1.32)%。结论该方法制备工艺简单,易于工业化生产。 [Abstract] Objective To prepare berberine hydrochloride proliposomes and investigate its physicochemical properties. Methods Proliposomes were prepared by film-deposition oncarriers. Orthogonal design was used to select the optimum formulation. The shape and particle size of proliposomes were investigated by transmission electron microscope and laser scatter. The encapsulation efficiency was determined by HPLC. Results The berberine hydrochloride liposome vesicles were globular or elliptic under the electronic microscopy. The average size of the liposomes was 741nm. The encapsulation efficiency was(29.93±1.32)%. Conclusion The preparation method is simple and easily industrialized preparation . [Key words] Berberine hydrochloride;Proliposomes;Liposomes 小檗碱(berberine)又称黄连素,常用于治疗肠道炎症。现代研究发现它对于心律失常、高血压、高脂血症、糖尿病和肿瘤等也具有较好的治疗作用[1]。但由于盐酸小檗碱口服血药浓度低,维持时间短,难以达到有效的治疗浓度,若长期大剂量给药,又会产生诸多不良反应。1986年,英国学者Payne等[2]首次提出了前体脂质体(proliposomes)这一概念,是指将脂质材料吸附于水溶性载体上,制备成的干燥颗粒或粉末。当口服给药时,与体液接触,脂质溶胀而载体迅速溶解,在水相中形成脂质体,能促进药物的吸收[3]。为解决盐酸小檗碱吸收差及生物利用度低和普通脂质体不稳定等问题,本实验首次探讨了盐酸小檗碱前体脂质体的制备工艺并对其理化性质进行研究。 1仪器与试药 日本岛津高效液相色谱仪(LC-20AT四元泵、CTO-10ASVP柱温箱、SPD-20A 紫外检测器);752紫外可见分光光度计(上海现科分光仪器有限公司);RE-2000A型旋转蒸发器(上海亚荣生化仪器厂);SHZ-D(III)循环水式真空泵(巩义市英峪予华仪器厂);pHS-3C精密酸度计(上海伟业仪器厂);BSl10S 型1/万电子分析天平(北京赛多利斯仪器系统有限公司);JEM-1230透射电子显微镜(日本电子公司);Zetasize Nano ZS纳米粒度仪(英国马尔文);Olympus CX21 型显微镜(日本)。 盐酸小檗碱对照品(中国药品生物制品检定所,批号 110713-200911);盐酸小檗碱提取物(四川什邡鸿鸣药物原料有限公司);
脂质体转染的实验原理与操作步骤
脂质体转染的实验原理与操作步骤大全 日期:2012-06-25 来源:互联网作者:青岚点击:4751次 摘要: 细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀 法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。 找产品,上生物帮 >> >> 细胞转染的方法主要包括:电穿孔法、显微注射、基因枪、磷酸钙共沉淀法、脂质体转染法、多种阳离子物质介导、病毒介导的转染等,理想的细胞转染方法是具有高转染效率、对细胞的毒性作用小等,本文主要介绍细胞转染常用的方法-脂质体转染的原理和操作步骤等。 脂质体(lipofectin regeant,LR)试剂是阳离子脂质体N-[1-2,3-Dioleyoxy,Propyl]-n, n,n-Trimethylammonium Chloride(DOTMA)和Dioleoyl photidye-thanolamine(DOPE)的混合物[1:1(w/w)]。它适用于把DNA转染入悬浮或贴壁培养细胞中,是目前条件下最方便的转染方法之一。转染率高,优于磷酸钙法,比它高5~100倍,能把DNA和RNA转染到各种细胞。 用LR进行转染时,首先需优化转染条件,应找出该批LR对转染某一特定细胞适合的用量、作用时间等,对每批LR都要做:第一,先要固定一个DNA的量和DNA/LR 混合物与细胞相互作用的时间,DNA可从1~5μg和孵育时间6小时开始,按这两个参数绘出相应LR需用量的曲线,再选用LR和DNA两者最佳的剂量,确定出转染时间(2~24小时)。因LR对细胞有一定的毒性,转染时间以不超过24小时为宜。 细胞种类:COS-7、BHK、NIH3T3、Hela和Jurkat等任何一种细胞均可作为受体细胞。 一、脂质体(liposome)转染方法原理 脂质体(liposome)转染方法原理:脂质体((Iiposome)作为体内和体外输送载体的工具,已经研究的十分广泛,用合成的阳离子脂类包裹DNA,同样可以通过融合而进人细胞。使用脂质体将DNA带人不同类型的真核细胞,与其它方法相比,有较高的效率和较好的重复性。 中性脂质体是利用脂质膜包裹DNA,借助脂质膜将DNA导入细胞膜内。带正电的阳离子脂质体,DNA并没有预先包埋在脂质体中,而是带负电的DNA自动结合到带正电的脂质体上,形成DNA-阳离子脂质体复合物,从而吸附到带负电的细胞膜表面,经过内吞被导入细胞。 二、脂质体转染操作步骤
盐酸多柔比星脂质体注射液说明书楷莱样本
盐酸多柔比星脂质体注射液说明书楷 莱
盐酸多柔比星脂质体注射液说明书 【药品名称】 通用名:盐酸多柔比星脂质体注射液 商品名:楷莱 英文名:Doxorubicin Hydrochloride Liposome Injection 汉语拼音:Yan Suan Duo Ruo Bi Xing Zhi Zhi Ti Zhu She Ye 【成份】 本品主要成分及其化学名称为:盐酸多柔比星,(1S,3S)-3-乙醇酰-1,2,3,4,6,11-六氧-3,5,12-三羟基-10-甲氧基-6,13-二氧并四苯-1-基-3-氨基 -2,3,6-三去氧-α-L-来苏吡喃糖苷。 其结构式为: 分子式:C27H29NO11.HCl 分子量:579.99 CAS No.:25316-40-9 【性状】 本品是一种脂质体制剂,系将盐酸多柔比星经过与甲氧基聚乙二醇的表面结合包封于脂质体中。这种工艺被称作为空间稳定
或隐匿,能够保护脂质体免受单核巨噬细胞系统(MPS)识别,从而延长其在血液循环中的时间。 本品为无菌、半透明的红色混悬液,每瓶10 mL,含盐酸多柔比星 2 mg/mL,是用于单剂量静脉滴注给药的浓缩液。本品的活性成分为盐酸多柔比星,是从一种波塞链霉菌表灰变种(strep tomyces peucetius var. caesius)培养液中提取得到的蒽环类细胞毒性抗生素。 【适应症】 本品可用于低CD4(<200 CD4淋巴细胞/mm3)及有广泛皮肤粘膜内脏疾病的与艾滋病相关的卡波氏肉瘤(AIDS-KS)病人。 本品可用作一线全身化疗药物,或者用作治疗病情有进展的AIDS-KS病人的二线化疗药物,也可用于不能耐受下述两种以上药物联合化疗的病人:长春新碱、博莱霉素和多柔比星(或其它蒽环类抗生素)。 【规格】20mg/ml/支 【用法用量】 本品应为每2-3周静脉内给药20 mg/m2,给药间隔不宜少于10天,因为不能排除药物蓄积和毒性增强的可能。病人应持续治疗2-3个月以产生疗效。为保持一定的疗效,在需要时继续给药。本品用250毫升5%葡萄糖注射液稀释,静脉滴注30分钟以上。禁止大剂量注射或给用未经稀释的药液。建议本品滴注管与5%葡萄糖滴注管相连接以进一步稀释并最大限度地减少血栓形成
脂质体在载药和造影中的双重应用(1)
研究生课程考试成绩单 (试卷封面) 任课教师签名: 日期: 注:1. 以论文或大作业为考核方式的课程必须填此表,综合考试可不填。“简要评语”栏缺填无效。 2. 任课教师填写后与试卷一起送院系研究生秘书处。 3. 学位课总评成绩以百分制计分。
脂质体在癌症诊疗中的载药和造影双重应用 马冬121635 东南大学生物医学与工程学院,江苏省生物材料与器件重点实验室, 江苏南京210009摘要:脂质体是由磷脂双层构成的具有水相内核的脂质微囊,在其水相和脂质双分子层组成的膜内可以包裹多种物质,且具有被动靶向和主动靶向的潜力,因此常被用来作为药物或各种造影剂的载体。脂质体可以以包封、膜标记、表面螯合、远端装载等方式与药物和造影剂结合,并在温度、pH、超声等的作用下进行可控的药物释放,因此脂质体在诊疗一体化方面有很多运用,可以根据实际情况的要求进行某种药物和单个成像模式的一体化,也可以对多种成像模式进行一体化。本问对脂质体作为药物和造影剂载体在癌症的诊断和治疗方面的最新应用作一综述。 关键词:脂质体;靶向载药;造影;诊疗一体化 引言 脂质体是一层或多层磷脂双层膜分散在水中形成的一个类球状、包封一部分水相的封闭囊泡。早在1947年Bernard就提出了这种存在于水性体系中的两亲分子囊泡性结构的假设,但直到1962年剑桥大学动物生理学研究所装备了电子显微镜后,Alec D. Bangham才和他的同事于1965年正式提出脂质体的概念【1】。由于磷脂双分子层具有和细胞膜类似的结构,所以其具有良好的生物相容性。脂质体进入人体内会被网状内皮系统吞噬,主要在肝、脾和骨髓等组织器官中积蓄,从而具有天然的被动靶向性;如果再对其修饰上特定的配体,又可主动的靶向某些部位。这些性质使其可作为良好的药物和其他试剂的载体。 人体的内部结构和功能一般是看不见的,但人们借助各种科学技术将人体内部结构和功能形成图像,从而检视人体,进行诊断和治疗,这就是医学成像的目的。1895年伦琴发现X射线后不久医生就将其应用于医学。从20世纪50年代开始,医学成像的发展突飞猛进,新的成像系统相继出现。X射线包括CT主要用于观察人体形态学上的特征。采用放射性核素的核素成像可以了解脏器的生理功能。单光子发射CT(SPECT)和正电子发射CT(PET)利用失踪动力学模型,显示了活体对注入药物的体内代谢过程,使许多疾病的研究和诊断大为深入。磁共振成像(MRI)从另一角度些事了人体内部状况,它的图像与体内生化过程有关;它既是功能性的又比核素成像更清晰,而且对人体损伤很小。超声成像与这些方法相比价格低廉,使用方便,对人体基本无损,因此得到广泛应用,成为常规的首选成像手段之一[2].在成像技术中为了得到信号或增强信号需要用到显影剂或造影剂,脂质体具有作为这些试剂载体的潜力。 随着科技的发展,成像技术在许多疾病特别是癌症的诊断和治疗中的重要性急剧增加。在纳米医学领域,成像和治疗结合的趋势明显。经过改造的脂质体可以选择性的靶向肿瘤组织,并能同时携带药物和造影剂,这使得脂质体在诊疗一体化方面有很大的潜力。本文将重点对脂质体作为抗肿瘤药物和各类成像技术中(CT、核素成像、MRI、超声成像)的应用情况作一综述。
