BZ振荡反应实验报告

B-Z 振荡反应
华天瑞2013030020/生34 同组:于泽铭 实验日期2014/10/18 ,提交报告日期2014/10/24
指导教师:袁斌
1 引言
实验目的
? 了解Belousov-Zhabotinski 反应的机理
? 通过测定电位-时间曲线球的振荡反应的表观活化能 实验原理
? 化学震荡:反映系统中某些物理量(如组分浓度)随时间做周期性变化
? B-Z 反应机理:在硫酸介质中以金属铈离子做催化剂的条件下,丙二酸被溴酸氧化——FKN 机理(共
十步)系统中[Br -]、[HBrO 2],[Ce 4+]/[Ce 3+]都随时间做周期性的变化。
? 测量及数据:我们用溴离子选择电极和铂丝电极分别测定[Br -]和[Ce 4+]/[Ce 3+]随时间变化的曲线,处理
数据得到诱导期时间及震荡周期。由1/t 诱,1/t 振分别衡量诱导期和振荡周期反应速率的快慢,综合不同温度下的t 诱和t 振,估算表观活化能E 诱,E 振。
2 实验操作
2.1 实验药品、仪器型号及测试装置示意图
计算机及接口一套,HS-4型精密恒温浴槽,电磁搅拌器,反应器*1,铂电极*1,饱和甘汞电极*1,滴瓶*3,量筒*3,2mL 移液管*1,洗瓶*1,镊子*1
0.02mol ?L -1硝酸铈铵,0.5mol ?L -1丙二酸,0.2mol ?L -1溴酸钾,0.8mol ?L -1硫酸 测试装置示意如右图。
2.2 实验条件(实验温度、湿度、压力等)
恒温浴槽分别取20℃,24℃,28℃,32℃,35℃
2.3 实验操作步骤及方法要点
1. 检查仪器药品(注意是否需要补加饱和甘汞电极及盐桥中的溶液)
2. 按装置图接好线路,接通相应设备电源,准备数据采集
3. 调节恒温槽温度为20℃,分别取7mL 丙二酸,15mL 溴酸钾,18mL 硫酸溶液于干净的反应器中,开动搅拌(注意磁子位置,水波位置,不可打到电极)。打开数据记录设备,开始数据采集,待基线走平稳后用移液管加入2mL 硝酸铈铵溶液
4. 观察溶液颜色变化,观察反映曲线,出现振荡后待振荡周期完整重复8次后停止数据记录,保存数据文件,记录恒温槽温度,读出相应诱导期t 诱,振荡周期t 振。
5. 升高温度(24℃,28℃,32℃,35℃),重复3、4步
3 结果与讨论
3.1 原始实验数据
3.1.1原始数据
加入硝酸铈铵溶液后,反应器中溶液马上呈浅黄色,约600s 后出现第一组振动曲线,每组完成时间随温度升高逐渐缩短。实验记录原始数据如下
图1
表1:原始数据
T/℃t诱/s t振/s
20.00 716.125 115.010
24.00 540.625 82.125
28.00 397.063 56.766
32.00 322.063 42.250
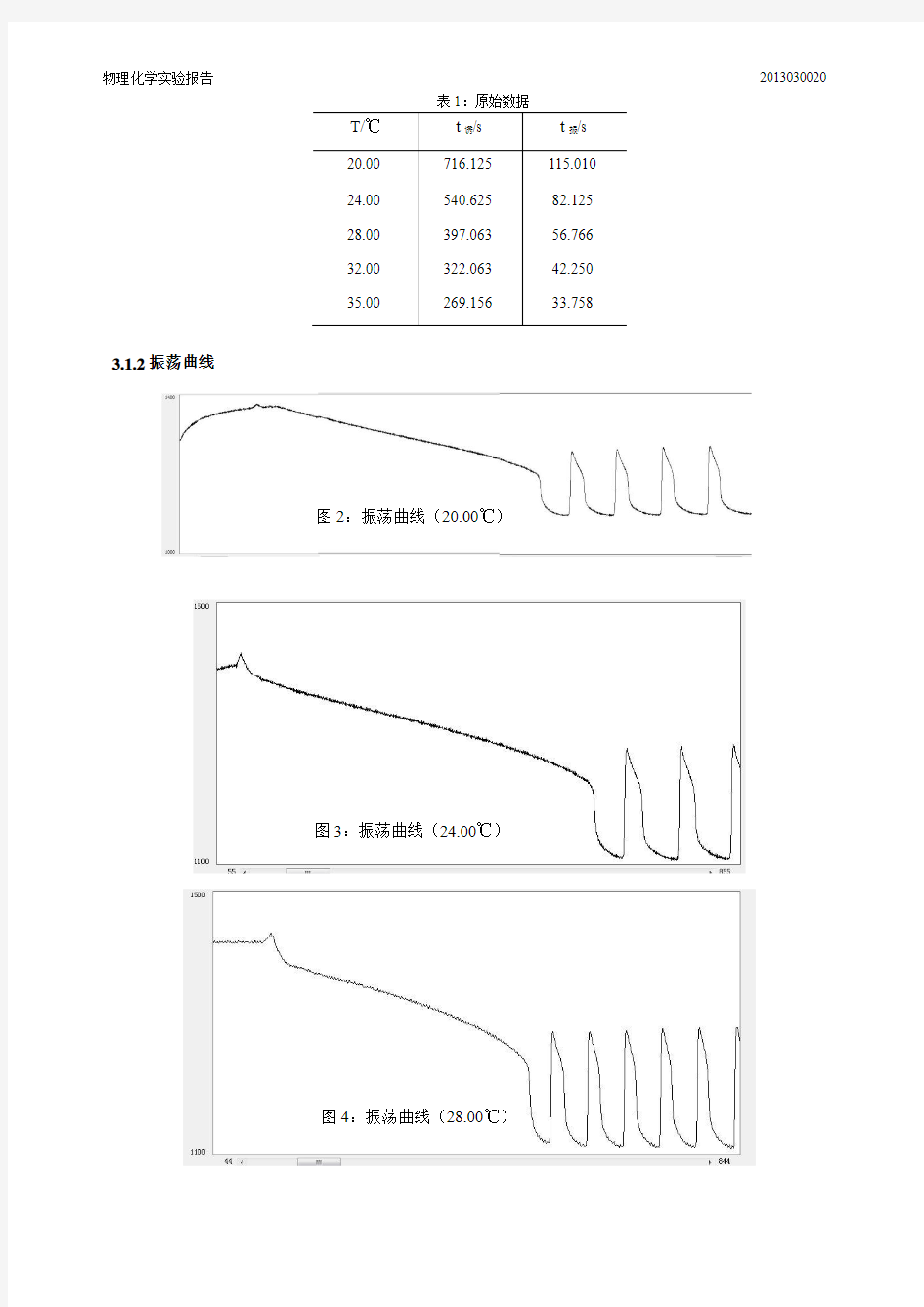
35.00 269.156 33.758 3.1.2振荡曲线
图2:振荡曲线(20.00℃)
图3:振荡曲线(24.00℃)
图4:振荡曲线(28.00℃)
如图2-图6,曲线左侧波动显示加入硝酸铈铵的时间,之后长而平缓的曲线为诱导期,至第一次明显下降开始诱导期结束,振动周期开始。
3.1.3 实验室软件拟合结果
诱导期
振荡期
E (kJ/mol) R^2 E (kJ/mol) R^2 49.06
0.997
61.72
0.999
3.2计算的数据、结果
在BZ 振荡数据处理软件中分别取诱导期起点、终点,以及8次振荡周期最高点作为周期点,计算得出诱导期t 诱,振荡周期t 振。
由:
t 诱 r 诱 =常数
又由:
lnk=lnA-RT
E a
从而:
图5:振荡曲线(32.00℃)
图6:振荡曲线(35.00℃)
E a
ln1/t诱=lnA-
RT
分别作ln(1/t诱)-1/T,ln(1/t振)-1/T图,由直线斜率可求出表观活化能。
首先计算ln(1/t诱),ln(1/t振),1/T数据如下表:
表2:计算过程
1/T ln(1/t诱) ln(1/t振)
0.05000 -6.57385 -4.74502
0.04167 -6.29273 -4.40824
0.03571 -5.98409 -4.03893
0.03125 -5.77474 -3.74360
0.02857 -5.59529 -3.51921
用Origin8.0描点,多项式拟合作曲线,如下图3、4所示:
图3:ln(1/t诱)-1/T拟合
图4:ln(1/t振)-1/T拟合
由“BZ振荡反应”软件,Origin 8.0分别计算得到诱导期表观活化能,振荡期表观活化能,数据如下表:
表3:表观活化能计算结果
诱导期
振荡期
E 诱(kJ/mol)
R^2 E 振(kJ/mol)
R^2 实验室软件 49.06 0.997 61.72 0.999 Origin
48.42
0.984
61.33
0.978
二者差别不大,因原始数据相同。但经过查阅文献,知E 诱 =35.45 kJ/mol ,E 振 =63.79 kJ/mol 。可知,
振荡期表观活化能测定较为准确,而诱导期存在较大失误差。分析原因,本实验由曲线选取诱导期终点时并无精确的标准,而是人工从光滑曲线上选取。我在选取时,五组数据统一选取光滑转弯曲率最大的时间点。同意选取可消除组间误差,但无法消除与理论值以及平行实验者之间的误差。同时,实验室软件所得数据拟合R^2数值显示线性程度较高,故实验过程中温度、试剂量均较稳定准确。
对于Origin 8.0 处理获得的数据,R^2为0.98左右,考虑可能因为ln(1/t 诱),ln(1/t 振),1/T 的数值为手动计算器分别计算后用于描点,有效位数等与实验室软件处理不同,故结果有差异。
3.3讨论分析
3.3.1原始数据的采集
实验原始数据由“BZ 振荡反应”软件计算得出,需手动选取点,此操作存在误差,相同操作两次得出结果可能存在差异。例如下表4为第一次选点所得结果,与上表1(第二次选点)对比有差异。考虑第一次使用数据处理软件,操作存在偏差。且诱导期起点、终点选择不确定性太大。我认为应对此进行更明确的规定,可大幅消除实验者不同而产生的数据差异。
表4
T/℃ t 诱/s t 振/s 20.00 668.69 124.68 24.00 491.56 85.21 28.00 348.39 55.52 32.00 338.33 51.00 35.00
237.66 33.19
表1
T/℃ t 诱/s t 振/s 20.00 716.125 115.010 24.00 540.625 82.125 28.00 397.063 56.766 32.00 322.063 42.250 35.00
269.156
33.758
3.3.2 溴离子选择电极和铂丝电极对[Br -]、[Ce 4+]/[Ce 3+]的测定原理
对离子交换电极,有:
x x 0x c lgf nF
2.303RT
E E +
= 其中E x 为欲测电势,E 0为标准电势,R 为气体常量,T 为绝对温度,F 为法拉第常数。F x 为活度系数,c x 为浓度。可见它的电位对溶液中给定的离子的活度的对数呈线性关系。
3.3.3 振荡现象的分析
在本实验中,我们观察到,当刚加入硝酸铈铵时,溶液显黄色,电压值出现一个小突起;随后电压平缓下降,溶液颜色变浅;当进入振荡期时,电压值升高,溶液重新出现黄色,当屏幕上的电压值达到极大值点时,溶液颜色最深,为淡黄色;当电压值达到极小值点时,溶液颜色最浅,几乎无色,如此反复。
在电压的上升时,[Br -]量比较少,[HBrO 2]通过自催化反应增加,[Br -
]被更加快速地消耗,同时也产生
了[Ce 4+ ],使溶液颜色变黄;在电压的下降沿,[Ce 4+ ]通过过程 C 消耗,生成[Br -
],体系中 HBrO 2的自催化生成受到抑制,系统又从 B 转换到 A ,可观察到溶液颜色变浅。
4 结论
经过 5 个温度点的测定,我们得到了 B-Z 振荡反应的表观活化能,分别为:E 诱
=49.6Jk/mol ,E
振
=61.72kJ/mol 。
5 参考文献
1. 《物理化学实验》,清华大学化学系物理化学实验编写组,清华大学出版社,1991.
2. 《基础物理化学实验》,贺德华,麻英,张连庆,高等教育出版社,2008.5.
3. 《物理化学》,朱文涛,清华大学出版社,1995.8.
6 附录-思考题
6.1 已知卤素离子(Cl - ,Br -
,I -
)都很易和 HBrO 2反应,如果在振荡反应的开始或是中间加入这些离子,将会出现什么现象?试用 FKN 机理加以分析。
答:若在振荡反应的开始加入,则因卤素离子与 HBrO 2 反应,会减缓 HBrO 2的积累速率,如果卤素粒子过多,会导致 HBrO2 无法达到触发振荡反应的临界浓度,无法发生振荡。若在振荡中间加入,因临界溴
离子浓度较小,会使得[Br -] >]~[ r B ,体系转化至步骤 A ,如果量大的话,可能会使得振荡反应终止。
6.2 为什么 B-Z 反应有诱导期?反应何时进入振荡期?
答:因为振荡涉及的关键物质 HBrO 2 在一开始并不存在,需要由一系列的反应来进行积累,而且还存在着自身的分解反应,故需要一个较长的积累期,当它的生成速率与分解速率相等时,反应便进入振荡期。
6.3 影响诱导期的主要因素有哪些?
答:反应温度、反应物浓度、卤素离子等杂质浓度、搅拌均匀程度。
6.4 体系中什么样的反应步骤对振荡行为最为关键?
答:步骤 A 、B 形成竞争关系,通过 HBrO 2 这个关键物质的生成、分解反应的相互竞争,来调配振荡过程的进行,通过催化剂铈离子来体现周期性的电位变化、颜色转化,而这个振荡所需的能量则由反应物丙二酸和溴酸根离子来提供,二者发生氧化还原反应来维持振荡,当这两者消耗完或者低于某一临界浓度时,振荡终止。
有限元分析实验报告
武汉理工大学 学生实验报告书 实验课程名称机械中的有限单元分析 开课学院机电工程学院 指导老师姓名 学生姓名 学生专业班级机电研 1502班 2015—2016 学年第2学期
实验一方形截面悬臂梁的弯曲的应力与变形分析 钢制方形悬臂梁左端固联在墙壁,另一端悬空。工作时对梁右端施加垂直向下的30KN的载荷与60kN的载荷,分析两种集中力作用下该悬臂梁的应力与应变,其中梁的尺寸为10mmX10mmX100mm的方形梁。 1.1方形截面悬臂梁模型建立 建模环境:DesignModeler 15.0。 定义计算类型:选择为结构分析。 定义材料属性:弹性模量为2.1Gpa,泊松比为0.3。 建立悬臂式连接环模型。 (1)绘制方形截面草图:在DesignModeler中定义XY平面为视图平面,并正视改平面,点击sketching下的矩形图标,在视图中绘制10mmX10mm的矩形。(2)拉伸:沿着Z方向将上一步得到的矩阵拉伸100mm,即可得到梁的三维模型,建模完毕,模型如下图1.1所示。 图1.1 方形截面梁模型 1.2 定义单元类型: 选用6面体20节点186号结构单元。 网格划分:通过选定边界和整体结构,在边界单元划分数量不变的情况下,通过分别改变节点数和载荷大小,对同一结构进行分析,划分网格如下图1.2所示:
图1.2 网格划分 1.21 定义边界条件并求解 本次实验中,讲梁的左端固定,将载荷施加在右端,施以垂直向下的集中力,集中力的大小为30kN观察变形情况,再将力改为50kN,观察变形情况,给出应力应变云图,并分析。 (1)给左端施加固定约束; (2)给悬臂梁右端施加垂直向下的集中力; 1.22定义边界条件如图1.3所示: 图1.3 定义边界条件 1.23 应力分布如下图1.4所示: 定义完边界条件之后进行求解。
BZ振荡反应
BZ振荡反应 刘恺 1120123036 一、实验目的 (1)了解BZ(Belousov-Zhabotinski)反应的基本原理。 (2)观察化学振荡现象。 (3)练习用微机处理实验数据和作图。 二、实验原理 化学振荡:反应系统中,某些物理量(如某组分浓度)随时间做周期性变化。 BZ体系:溴酸盐、有机物在酸性条件以及在有(或无)金属离子催化剂作用下构成的体系。 BZ振荡反应机理(FKN机理): 总反应:(A)2H++2Br0 3-+2CH 2 (COOH) 2 →2BrCH(COOH) 2 +3CO 2 +4H 2 O 过程(1):(B)BrO 3-+Br-+H+→HBrO 2 +HOBr (C)HBrO 2 +Br-+H+→2HOBr 过程(2):(D)BrO 3-+HBrO 2 +H+→2BrO 2 +H 2 O (E)BrO 2+Ce3++H+→HBrO 2 +Ce4+ (F)2HBrO 2→BrO 3 -+HOBr+H+ Br-再生过程(G)4Ce4++BrCH(COOH) 2+H 2 O+HOBr→2Br-+4Ce3++3CO 2 +6H+ 体系中存在着两个受溴负离子浓度控制的过程(1)与(2)。当溴负离子含量足够高时,主要发生过程(1),其中步骤B是速率控制步骤。当溴负离子含量低时,主要发生过程(2),其中D是速率控制步骤。如此,体系在过程(1)与(2)之间往复振荡。 反应进行时,系统中Br-、HBrO 2 、Ce3+、Ce4+的浓度均随时间做周期性变化。实验中,可选用溴离子选择电极测定Br-,用铂丝电极测定Ce4+、Ce3+随时间变化。 从加入硫酸铈铵到体系开始振荡的时间为t 诱 ,诱导期与反应速率成反比, 即1/t 诱正比于k=Aexp(-E 表 /RT),并且有, Ln(1/t 诱)=LnA-E 表 /RT. 作图Ln(1/t 诱)-1/T,根据斜率可求出表观活化能E 表。 三、仪器与试剂 BZ反应数据采集接口系统、微型计算机、恒温槽、反应器、磁力搅拌器、丙二酸(0.45mol/L)、溴酸钾(0.25mol/L)、硫酸(3.00mol/L)、硫酸铈铵(4×10-3mol/L). 四、实验步骤 (1)恒温槽水浴接通电源,设置温度为30℃。用去离子水清洗反应器、铂电极、参比电极。检查仪器连线(铂电极-BZ反应数据采集接口正极,参比电极-BZ反应数据采集接口负极,温度传感器探头-恒温水浴)。 (2)启动微机,接通BZ反应数据采集接口系统电源,进入BZ振荡软件主菜单。(3)文件-新建;实验-设置参数(使用默认值);实验-反应记录。(4)取8ml 硫酸铈铵溶液于锥形瓶中,放于恒温槽中恒温。(待恒温槽温度稳定在设置温度
有限元分析实验报告
学生学号1049721501301实验课成绩 武汉理工大学 学生实验报告书 实验课程名称机械中的有限单元分析机电工程学院开课学院 指导老师姓名
学生姓名 学生专业班级机电研1502班 学年第学期2016—20152 实验一方形截面悬臂梁的弯曲的应力与变形分析 钢制方形悬臂梁左端固联在墙壁,另一端悬空。工作时对梁右端施加垂直 向下的30KN的载荷与60kN的载荷,分析两种集中力作用下该悬臂梁的应力与应变,其中梁的尺寸为10mmX10mmX100mm的方形梁。 方形截面悬臂梁模型建立1.1 建模环境:DesignModeler15.0。 定义计算类型:选择为结构分析。 定义材料属性:弹性模量为 2.1Gpa,泊松比为0.3。 建立悬臂式连接环模型。 (1)绘制方形截面草图:在DesignModeler中定义XY平面为视图平面,并正 视改平面,点击sketching下的矩形图标,在视图中绘制10mmX10mm的矩形。 (2)拉伸:沿着Z方向将上一步得到的矩阵拉伸100mm,即可得到梁的三维模型,建模完毕,模型如下图 1.1所示。
图1.1方形截面梁模型 :定义单元类型1.2 选用6面体20节点186号结构单元。 网格划分:通过选定边界和整体结构,在边界单元划分数量不变的情况下,通过分别改变节点数和载荷大小,对同一结构进行分析,划分网格如下图 1.2
所示: 图1.2网格划分 1.21定义边界条件并求解 本次实验中,讲梁的左端固定,将载荷施加在右端,施以垂直向下的集中 力,集中力的大小为30kN观察变形情况,再将力改为50kN,观察变形情况,给出应力应变云图,并分析。 (1)给左端施加固定约束; (2)给悬臂梁右端施加垂直向下的集中力; 1.22定义边界条件如图1.3所示:
BZ振荡实验
BZ振荡实验 一、实验目的及要求 1.了解BZ(Belousov-Zhobotinski)振荡反应的基本原理,观察BZ化学振荡 实验。 2.了解化学振荡反应中的电势测定方法,通过测定电位-时间曲线求得化学振荡反应的表观活化能。 二、实验原理 振荡反应 化学振荡是指反应系统中的某些量(如某组分的浓度)随时间做周期性的变化。BZ振荡实验是由贝诺索夫(Belousov)和柴波廷斯基(Zhobotinski)发现和发展 起来的,是指在酸性介质中,有机物在有金属离子催化的条件下被溴酸盐氧化,某些组分的浓度发生周期性的变化。 大量实验研究表明,化学振荡反应的发生必须满足三个条件:(1)必须是远离平衡态体系;(2)反应历程中含有自催化步骤;(3)体系必须具有双稳态性,即可在稳态间来回振荡。 机理 菲尔德(Field)、科罗什(Koros)、诺伊斯(Noyes)三位科学家对BZ振荡反应 实验进行了解释,称为FKN机理。下面以BrO 3~Ce4+~CH 2 (COOH) 2 ~H 2 SO 4 体系为例说 明。在该体系中发生的总反应为: 该反应的的核心内容是系统中存在受Br-浓度控制的A和B两个过程。具体的说, 当Br-的浓度高于某个浓度(这个浓度被称为临界浓度C 临)时,BrO 3 -被还原成Br 2 , 即发生A过程。 过程A: (注:HOBr产生后立即被丙二酸消耗,反应过程如下: 当Br-的浓度低于临界浓度时,或者说Br-的浓度较低时,Ce3+被氧化为Ce4+,发生B过程。 过程B:
(自由基反应瞬间完成) Br-再生过程: 过程A是消耗Br-并产生能进一步发生反应的HBrO 2 ,HOBr是中间产物,产 生之后立即被丙二酸消耗。 过程B是一个自催化的过程(HBrO 2 充当催化剂),在Br-消耗到一定程度后, HBrO 2 才按③和④进行,并使反应不断加速,与此同时,Ce3+被氧化为Ce4+。 HBrO 2 的累积还受⑤的制约。 ⑥反应为丙二酸被溴化为BrCH(COOH) 2 ,与Ce4+反应生成Br-使Ce4+转化为Ce3+。这个反应使得Br-和Ce3+再生,形成周期振荡,并且控制A过程和B过程发生的离子是Br-。 -的临界浓度 过程A中,慢反应②控制整个A过程的速度,当过程A达到准定态,即υ ①=υ ② ,这时: k 1[BrO 3 -][Br-][H+]2=k 2 [HBrO 2 ][Br-][H+],得:[HBrO 2 ] A =k 1 /k 2 [BrO 3 -][H+]。 过程B中,慢反应③产生的自由基BrO 2 ·立即反应,当反应达到准定态, 即υ ③=υ ⑤ ,这时 k 3[BrO 3 -][HBrO 2 ][H+]=k 5 [HBrO 2 ]2,得:[HBrO 2 ] B =k 3 /k 5 [BrO 3 -][H+]。 观察②反应和③反应,Br-和BrO 3 -均要与HBrO 2 反应,形成竞争反应。当 k 2[HBrO 2 ][Br-][H+]>k 3 [BrO 3 -][HBrO 2 ][H+]时,即k 2 [Br-]>k 5 [BrO 3 -]时,反应②进 行,反应③不能进行。而k 2[Br-] 有限元上机实验报告结构数值分析与程序设计 上机实验 院系: 土木工程与力学学院专业: 土木工程 班级: 姓名: 学号: 指导教师: 1、调试教材P26-30程序FEM1。 1.1、输入数据文件为: 6,4,12,6,1.0E0,0.0,1.0,0.0,1 3,1,2 5,2,4 3,2,5 6,3,5 0.0,2.0 0.0,1.0 1.0,1.0 0.0,0.0 1.0,0.0 2.0,0.0 1,3,7,8,10,12 1.2、输出数据文件为: NN NE ND NFIX E ANU T GM NTYPE 6 4 12 60.1000E+01 0.000 1.0000.0000E+00 1 NODE X-LOAD Y-LOAD 1 0.000000E+00 -0.100000E+01 2 0.000000E+00 0.000000E+00 3 0.000000E+00 0.000000E+00 4 0.000000E+00 0.000000E+00 5 0.000000E+00 0.000000E+00 6 0.000000E+00 0.000000E+00 NODE X-DISP Y-DISP 1 -0.879121E-15 -0.325275E+01 2 0.879121E-16 -0.125275E+01 3 -0.879121E-01 -0.373626E+00 4 0.117216E-1 5 -0.835165E-15 5 0.175824E+00 -0.293040E-15 6 0.175824E+00 0.263736E-15 ELEMENT X-STR Y-STR XY-STR 1 -0.879121E-01 -0.200000E+01 0.439560E+00 2 0.175824E+00 -0.125275E+01 0.256410E-15 3 -0.879121E-01 -0.373626E+00 0.307692E+00 4 0.000000E+00 -0.373626E+00 -0.131868E+00 2、修改FEM1,计算P31例2-2。 B-Z 振荡反应 实验日期:2016/11/24 完成报告日期:2016/11/25 1 引言 1.1 实验目的 1. 了解Belousov-Zhabotinski 反应(简称B-Z 反应)的机理。 2. 通过测定电位——时间曲线求得振荡反应的表观活化能。 1.2 实验原理 对于以B-Z 反应为代表的化学振荡现象,目前被普遍认同的是Field ,kooros 和Noyes 在1972年提出的FKN 机理,,他们提出了该反应由萨那个主过程组成: 过程A ① ② 式中 为中间体,过程特点是大量消耗。反应中产生的能进一步反应,使 有机物MA 如丙二酸按下式被溴化为BrMA, (A1) (A2) 过程B ③ ④ 这是一个自催化过程,在消耗到一定程度后, 才转化到按以上③、④两式 进行反应,并使反应不断加速,与此同时,催化剂氧化为。在过程B 的③和④中,③的正反应是速率控制步骤。此外, 的累积还受到下面歧化反应的制约。 ⑤ 过程C MA 和使离子还原为,并产生(由)和其他产物。 这一过程目前了解得还不够,反应可大致表达为: ⑥2++f +2+其他产物 式中f 为系数,它是每两个离子反应所产生的数,随着与MA 参加反应 的不同比例而异。过程C 对化学振荡非常重要。如果只有A 和B ,那就是一般的自催化反应或时钟反应,进行一次就完成。正是由于过程C ,以有机物MA 的消耗为代价,重新得到和,反应得以重新启动,形成周期性的振荡。 322BrO Br H HBrO HOBr --+++→+22HBrO Br H HOBr -+++→2 HBrO Br - HOBr 22HOBr Br H Br H O -+++→+2Br MA BrMA Br H -+ +→++32222BrO HBrO H BrO H O -++++342222222BrO Ce H HBrO Ce ++ ++→+Br - 2 HBrO 3Ce + 4Ce + 2 HBrO 232HBrO BrO HOBr H -+ →++BrMA 4Ce + 3Ce + Br - BrMA 4Ce + MA BrMA →Br - 3Ce + 4Ce + Br - BrMA Br - 3Ce + 中南林业科技大学机械零件有限元分析 实验报告 专业:机械设计制造及其自动化 年级: 2013级 班级:机械一班 姓名:杨政 学号:20131461 I 一、实验目的 通过实验了解和掌握机械零件有限元分析的基本步骤;掌握在ANSYS 系统环境下,有限元模型的几何建模、单元属性的设置、有限元网格的划分、约束与载荷的施加、问题的求解、后处理及各种察看分析结果的方法。体会有限元分析方法的强大功能及其在机械设计领域中的作用。 二、实验内容 实验内容分为两个部分:一个是受内压作用的球体的有限元建模与分析,可从中学习如何处理轴对称问题的有限元求解;第二个是轴承座的实体建模、网格划分、加载、求解及后处理的综合练习,可以较全面地锻炼利用有限元分析软件对机械零件进行分析的能力。 实验一、受内压作用的球体的有限元建模与分析 对一承受均匀内压的空心球体进行线性静力学分析,球体承受的内压为 1.0×108Pa ,空 心球体的内径为 0.3m ,外径为 0.5m ,空心球体材料的属性:弹性模量 2.1×1011,泊松比 0.3。 承受内压:1.0×108 Pa 受均匀内压的球体计算分析模型(截面图) 1、进入 ANSYS →change the working directory into yours →input jobname: Sphere 2、选择单元类型 ANSYS Main Menu : Preprocessor →Element Type →Add/Edit/Delete →Add →select Solid Quad 4node 42 →OK (back to Element Types window)→ Options… →select K3: Axisymmetric →OK →Close (the Element Type window) 3、定义材料参数 ANSYS Main Menu : Preprocessor →Material Props →Material Models →Structural →Linear →Elastic →Isotropic →input EX:2.1e11, PRXY:0.3→ OK 4、生成几何模型生成特征点 ANSYS Main Menu: Preprocessor →Modeling →Create →Keypoints →In Active CS →依次输入四个点的坐标:input :1(0.3,0),2(0.5,0),3(0,0.5),4(0,0.3)→OK 生成球体截面 ANSYS 命令菜单栏: Work Plane>Change Active CS to>Global Spherical ANSYS Main Menu: Preprocessor →Modeling →Create →Lines →In ActiveCoord → 依次连接 1,2,3,4 点生成 4 条线→OK Preprocessor →Modeling →Create →Areas →Arbitrary →By Lines →依次拾取四条线→OK ANSYS 命令菜单栏: Work Plane>Change Active CS to>Global Cartesian 5、网格划分 ANSYS Main Menu : Preprocessor →Meshing →Mesh Tool →(Size Controls) lines: Set B-Z振荡反应 2011011743 分1 黄浩 同组人姓名:李奕 实验日期:2013-11-2 提交报告日期:2013-11-8 指导教师:王振华 1 引言 1.1. 实验目的 (1)了解Belousov-Zhabotinski反应(简称B-Z反应)的机理。 (2)通过测定电位——时间曲线求得振荡反应的表观活化能。 1.2 实验原理 所谓化学振荡就是反应系统中某些物理量如组分的浓度随时间作周期性的变化。1958年,Belousov首次报道在以金属铈离子作催化剂的条件下,柠檬酸被溴酸氧化的均相系统可呈现这种化学振荡现象。随后,Zhabotinsky继续了该反应的研究。到目前为止,人们发现了一大批可呈现化学振荡现象的含溴酸盐的反应系统。例如,除了柠檬酸外,还有许多有机酸(如丙二酸、苹果酸、丁酮二酸等)的溴酸氧化反应系统能出现振荡现象,而且所用的催化剂也不限于金属铈离子,铁和锰等金属离子可起同样的作用。后来,人们笼统地称这类反应为B- Z反应。目前,B-Z反应是最引人注目的实验研究和理论分析的对象之一。该系统相对来说比较简单,其振荡现象易从实验中观察到。由实验测得的B-Z体系典型铈离子和溴离子浓度的振荡曲线如图2-11-1所示。 图1. B-Z体系典型铈离子和溴离子浓度的振荡曲线 关于B-Z反应的机理,目前为人们普遍接受的是关于在硫酸介质中以金属铈离子作催化剂的条件下,丙二酸被溴酸氧化的机理,简称为FKN机理。其主要的反应步骤及各步骤的速率或速率系数归纳如下表: i 222按照FKN 机理,可对化学振荡现象解释如下: 当[Br -]较大时,反应主要按表中的(1)、(2)、(3)进行,总反应为: O H Br H Br BrO 2233365+→+++-- (11) 生成的Br 2按步骤(7)消耗掉。步骤(1)、(2)、(3)、(7)组成了一条反应链,称为过程A ,其总反应为: O H COOH BrCH H COOH CH Br BrO 222233)(33)(32+→++++-- (12) 当[Br -]较小时,反应按步骤(5)和(6)进行,总反应为: O H HBrO Ce H HBrO BrO Ce 2242332232++→+++++- + (13) 步骤(5)为该反应的速度控制步骤((5)的逆反应速率可忽略),这样有 ]][][[] [2352+-=H HBrO BrO k dt HBrO d (14) 上式表明HBrO 2的生成具有自催化的特点,但HBrO 2的增长要受到步骤(4)的限制。(4)、(5)、(6)组成了另一个反应链,称为过程B 。其总反应为: O H Ce HOBr H Ce BrO 24332454++→+++++- (15) 最后Br - 可通过步骤(9)和(10)而获得再生,这一过程叫做C 。总反应为: ++-++++→+++H CO Ce Br O H COOH BrCH Ce HOBr 6342)(423224 (16) 过程A 、B 、C 合起来组成了反应系统中的一个振荡周期。 当[Br -]足够大时,HBrO 2按A 中的步骤(2)消耗。随着[Br -]的降低,B 中的步骤(5) 有限元实验报告 T1013-5 20100130508 蔡孟迪 ANSYS有限元上机报告(一) 班级:T1013-5 学号:20100130508 姓名:蔡孟迪 上机题目: 图示折板上端固定,右侧受力F=1000N,该力均匀分布在边缘各节点上;板厚t=2mm 材料选用低碳钢,弹性模量E=210Gpa,μ=0.33. 一、有限元分析的目的: 1.利用ANSYS构造实体模型; 2.根据结构的特点及所受载荷的情况,确定所用单元类型;正确剖分网格并施加外界条件;3.绘制结构的应力和变形图,给出最大应力和变形的位置及大小;并确定折板角点A处的应力和位移; 4.研究网格密度对A处角点应力的影响; 5.若在A处可用过渡圆角,研究A处圆角半径对A处角点应力的影响。 二、有限元模型的特点: 1.结构类型 本结构属于平面应力类型 2.单位制选择 本作业选择N(牛),mm(毫米),MPa(兆帕)。 3.建模方法 采用自左向右的实体建模方法。 4.定义单元属性及类型 1)材料属性:弹性模量:EX=2.10E5MPa, 泊松比:PRXY=0.33 2)单元类型:在Preferences选Structural,Preprocessor>ElemmentType>Add/Edit/Delete中定义单元类型为:Quad4 node 182,K3设置为:平面薄板问题(Plane strs w/thk) 3)实常数:薄板的厚度THK=2mm 5.划分网格 在MeshTool下选set,然后设置SIZE Element edge length的值,再用Mesh进行网格划分。6.加载和约束过程:在薄板的最上端施加X、Y方向的固定铰链,在薄板的最右端施加1000N 的均匀布置的载荷。 北京理工大学 物理化学实验报告 BZ震荡反应 班级:09111101 实验日期:2013-4-9 一、 实验目的 1) 了解BZ 反应的基本原理。 2) 观察化学振荡现象。 3) 练习用微机处理实验数据和作图。 二、 实验原理 化学振荡:反应系统中某些物理量随时间作周期性的变化。 BZ 体系是指由溴酸盐,有机物在酸性介质中,在有(或无)金属离子催化剂作用下构成的体系。 本实验以BrO - 3 ~ Ce + 4 ~ CH 2(COOH)2 ~ H 2SO 4作为反映体系。该体系的总 反应为: ()()O 4H 3CO COOH 2BrCH COOH 2CH 2BrO 2H 222223++?→?++- + 体系中存在着下面的反应过程。 过程A : HOBr HBrO 2H Br BrO 2K 32+?→?+++-- 2HOBr H Br HBrO 3K 2?→?+++- 过程B : O H 2BrO H HBrO BrO 22K 234+?→?+++- 42K 32Ce HBrO H Ce BrO 5++++?→?++ +++?→?H HOBr BrO 2HBrO -3K 26 Br - 的再生过程: ()+ +- ++++?→?+++6H 3CO 4Ce 2Br HOBr O H COOH BrCH 4Ce 23 K 2247 当[Br -]足够高时,主要发生过程A ,研究表明,当达到准定态时,有 [][][]+- =H BrO K K HBrO 3 3 22。 当[Br -]低时,发生过程B ,Ce +3被氧化。,达到准定态时,有 [][][] +- ≈ H BrO 2K K HBrO 36 42。 可以看出:Br - 和BrO -3是竞争HbrO 2的。当K 3 [Br - ]>K 4[BrO - 3]时,自催 化过程不可能发生。自催化是BZ 振荡反应中必不可少的步骤。否则该振荡不能发生。研究表明,Br -的临界浓度为: [] [][] - --?== 3 633 4crit - BrO 105BrO K K Br 若已知实验的初始浓度[BrO - 3],可由上式估算[Br - ]crit 。 体系中存在着两个受溴离子浓度控制的过程A 和过程B ,当[Br - ]高于临界浓度[Br - ]crit 时发生过程A ,当[Br - ]低于[Br -]crit 时发生过程B 。这样体系就在过程A 、过程B 间往复振荡。 在反应进行时,系统中[Br - ]、[HbrO 2]、[Ce +3]、[Ce +4]都随时间作周期性的变化,实验中,可以用溴离子选择电极测定[Br - ],用铂丝电极测定[Ce +4]、[Ce +3]随时间变化的曲线。溶液的颜色在黄色和无色之间振荡,若再加入适量的FeSO 4邻菲咯啉溶液,溶液的颜色将在蓝色和红色之间振荡。 从加入硫酸铈铵到开始振荡的时间为t 诱 ,诱导期与反应速率成反比,即 ??? ? ??-=∝RT E A k t 表诱exp 1 ,并得到 BZ 振荡 1.影响诱导期的主要因素有哪些? 答:影响诱导期的主要因素有反应温度、酸度和反应物的浓度。温度、酸度、催化剂、离子活性、各离子的浓度 2.本实验记录的电势主要代表什么意思?与Nernst 方程求得的电位有何不同? 答:本实验记录的电势是Pt 丝电极与参比电极(本实验是甘汞电极)间的电势,而Nernst 方程求得的电位是电极相对于标准电极的电势,它反映了非标准电极电势和标准电极电势的关系。 表面张力 1、用最大气泡法测定表面张力时为什么要读最大压力差? 答:分析毛细管口气泡的形成与破裂的过程中,气泡的半径与气泡膜表面张力的关系有: 当R r →时,气泡的σ达到最大,此时等于()max 0max p p p -=?。 当R r >时,σ减小;而继续抽气,使压力差增大而导致气泡破裂。故读取最大压差,使满足222r p r p r πππσ=?=最大,从而计算表面张 力。 2、哪些因素影响表面张力测定结果?如何减小以致消除这些因素对实验的影响? 答:影响测定结果的因素有:仪器系统的气密性是否良好;测定用的毛细管是否干净,实验中气泡是否平稳流过;毛细管端口是否直切入 液面;毛细管口气泡脱出速度;试验温度。 故试验中要保证仪器系统的气密性,测定用的毛细管洁净,实验中气泡平稳流过;毛细管端口一定要刚好垂直切入液面,不能离开液面,但亦不可深插;从毛细管口脱出气泡每次应为一个,即间断脱出;表面张力和温度有关,要等溶液恒温后再测量。 3、滴液漏斗放水速度过快对实验结果有没有影响?为什么? 答:若放水速度太快,会使抽气速度太快,气泡的形成与逸出速度快而不稳定,致使读数不稳定,不易观察出其最高点而起到较大的误差。 磁化率的测定 1.不同励磁电流下测得的样品摩尔磁化率是否相同? 答:相同,摩尔磁化率是物质特征的物理性质,不会因为励磁电流的不同而变。但是在不同励磁电流下测得的cM稍有不同,。主要原因在于天平测定臂很长(约50cm),引起Dw的变化造成的,当然温度的变化也有一定影响。 2.用古埃磁天平测定磁化率的精密度与哪些因素有关? 答:(1)样品管的悬挂位置:正处于两磁极之间,底部与磁极中心线齐平,悬挂样品管的悬线勿与任何物体相接触; (2)摩尔探头是否正常:钢管是否松动,若松动,需坚固; (3)温度光照:温度不宜高于60℃,不宜强光照射,不宜在腐蚀性气体场合下使用; (4)摩尔探头平面与磁场方向要垂直; 一、实验目的 通过上机对有限元法的基本原理和方法有一个更加直观、深入的理解;通过对本实验所用软件平台Ansys 的初步涉及,为将来在设计和研究中利用该类大型通用CAD/CAE 软件进行工程分析奠定初步基础。 二、实验设备 机械工程软件工具包Ansys 三、实验内容及要求 1) 简支梁如图3.1.1所示,截面为矩形,高度h=200mm ,长度L=1000mm ,厚 度t=10mm 。上边承受均布载荷,集度q=1N/mm2,材料的E=206GPa ,μ=0.29。平面应力模型。 X 方向正应力的弹性力学理论解如下: 图3.1.1 ①在Ansys 软件中用有限元法探索整个梁上x σ,y σ的分布规律。 ②计算下边中点正应力x σ的最大值;对单元网格逐步加密,把x σ的计算值与理论解对比,考察有限元解的收敛性。 ③针对上述力学模型,对比三节点三角形平面单元和4节点四边形平面等参元的求解精度。 2) 一个正方形板,边长L = 1000mm ,中心有一小孔,半径R = 100mm ,左右边 受均布拉伸载荷,面力集度q = 25MPa ,如图 3.2.1所示。材料是 206E GPa =,0.3μ=,为平面应力模型。当边长L 为无限大时,x = 0截面上理论解为: ) 534()4 (6222 23-+-=h y h y q y x L h q x σ )32(2|44 220r R r R q x x ++==σ 其中R 为圆孔半径,r 为截面上一点距圆心的距离。x = 0截面上孔边(R r =)应力q x 3=σ。所以理论应力集中系数为3.0。 图3.2.1 用四边形单元分析x = 0截面上应力的分布规律和最大值,计算孔边应力集中系数,并与理论解对比。利用对称性条件,取板的四分之一进行有限元建模。 3) 如图3.3.1所示,一个外径为0.5m ,内径为0.2m ,高度为0.4m 的圆筒,圆 筒的外壁施加100MPa 的压强,圆筒的内部约束全部的自由度,材料参数是密度。 使用平面单元,依照轴对称的原理建模分析。 q B-Z振荡反应 姓名:李上学号:2012011849 班级:分2 同组人姓名:刘昊雨 实验日期:2014年12月4日 提交报告日期:2014年12月10日 指导教师:王振华 1.引言 1.1.实验目的 (1)了解Belousov-Zhabotinski反应(简称B-Z反应)的机理。 (2)通过测定电位——时间曲线求得振荡反应的表观活化能。 1.2.实验原理 所谓化学振荡就是反应系统中某些物理量如组分的浓度随时间作周期性的变化。1958年,Belousov首次报道在以金属铈离子作催化剂的条件下,柠檬酸被溴酸氧化的均相系统可呈现这种化学振荡现象。随后,Zhabotinsky继续了该反应的研究。到目前为止,人们发现了一大批可呈现化学振荡现象的含溴酸盐的反应系统。例如,除了柠檬酸外,还有许多有机酸(如丙二酸、苹果酸、丁酮二酸等)的溴酸氧化反应系统能出现振荡现象,而且所用的催化剂也不限于金属铈离子,铁和锰等金属离子可起同样的作用。后来,人们笼统地称这类反应为B-Z反应。目前,B-Z反应是最引人注目的实验研究和理论分析的对象之一。该系统相对来说比较简单,其振荡现象易从实验中观察到。由实验测得的B-Z体系典型铈离子和溴离子浓度的振荡曲线如图2-11-1所示。 图1. B-Z体系典型铈离子和溴离子浓度的振荡曲线 关于B-Z反应的机理,目前为人们普遍接受的是关于在硫酸介质中以金属铈离子作催化剂的条件下,丙二酸被溴酸氧化的机理,简称为FKN机理。其主要的反应步骤及各步骤的速率或速率系数归纳如下表: -+Br BrMA i 222 按照FKN 机理,可对化学振荡现象解释如下: 当[Br - ]较大时,反应主要按表中的(1)、(2)、(3)进行,总反应为: O H Br H Br BrO 2233365+→+++-- (11) 生成的Br 2按步骤(7)消耗掉。步骤(1)、(2)、(3)、(7)组成了一条反应链,称为过程A ,其总反应为: O H COOH BrCH H COOH CH Br BrO 222233)(33)(32+→++++-- (12) 当[Br - ]较小时,反应按步骤(5)和(6)进行,总反应为: O H HBrO Ce H HBrO BrO Ce 2242332232++→+++++-+ (13) 步骤(5)为该反应的速度控制步骤((5)的逆反应速率可忽略),这样有 ]][][[] [2352+-=H HBrO BrO k dt HBrO d (14) 上式表明HBrO 2的生成具有自催化的特点,但HBrO 2的增长要受到步骤(4)的限制。(4)、 (5)、(6)组成了另一个反应链,称为过程B 。其总反应为: O H Ce HOBr H Ce BrO 24332454++→+++++- (15) 最后Br - 可通过步骤(9)和(10)而获得再生,这一过程叫做C 。总反应为: ++-++++→+++H CO Ce Br O H COOH BrCH Ce HOBr 6342)(423224 (16) 过程A 、B 、C 合起来组成了反应系统中的一个振荡周期。 当[Br -]足够大时,HBrO 2按A 中的步骤(2)消耗。随着[Br - ]的降低,B 中的步骤(5)对HBrO 2的竞争愈来愈重要。当[Br - ]达到某个临界值[- r B ~ ]时,自催化步骤(5)引起的HBrO 2的生成速率正好等于过程A 中由步骤(2)引起的HBrO 2的消耗速率,即 0]][][r B ~ []][][[][222352=-=++-H HBrO k H HBrO BrO k dt HBrO d - (17) 由(17)式易得:] []r B ~ [32 5-=BrO k k - 若已知实验的初始浓度][3-BrO ,由(18)式可估算[-r B ~]。 当 ]r B ~[][Br -- <时,[HBrO 2]通过自催化反应(13)很快增加,导致[Br -]通过反应步骤(2)而迅速下降。于是系统的主要过程从A 转换到B 。B 中产生的Ce 4+通过C 使Br - 再生, [Br - ]慢慢回升;当 ]r B ~[][Br -- >时,体系中HBrO 2的自催化生成受到抑制,系统又从B 有限元上机实验报告 姓名柏小娜 学号0901510401 实验一 一 已知条件 简支梁如图所示,截面为矩形,高度h=200mm ,长度L=1000mm ,厚度t=10mm 。上边承受均布载荷,集度q=1N/mm 2,材料的E=206GPa ,μ=0.29。平面应力模型。 X 方向正应力的弹性力学理论解如下: )534()4 (6222 23-+-=h y h y q y x L h q x σ 二 实验目的和要求 (1)在Ansys 软件中用有限元法探索整个梁上x σ,y σ的分布规律。 (2)计算下边中点正应力x σ的最大值;对单元网格逐步加密,把x σ的计算值与理论解对比,考察有限元解的收敛性。 (3)针对上述力学模型,对比三节点三角形平面单元和4节点四边形平面等参元的求解精度。 三 实验过程概述 (1) 定义文件名 (2) 根据要求建立模型:建立长度为1m ,外径为0.2m ,平行四边行区域 (3) 设置单元类型、属性及厚度,选择材料属性: (4) 离散几何模型,进行网格划分 (5) 施加位移约束 (6) 施加载荷 (7) 提交计算求解及后处理 (8) 分析结果 四 实验内容分析 (1)根据计算得到应力云图,分析本简支梁模型应力分布情况和规律。主要考察x σ和y σ,并分析有限元解与理论解的差异。 由图1看出沿X 方向的应力呈带状分布,大小由中间向上下底面递增,上下底面应力方向相反。由图2看出应力大小是由两侧向中间递增的,得到X 方向 上最大应力就在下部中点,为0.1868 MPa 。根据理论公式求的的最大应力值为0.1895MPa 。由结果可知,有限元解与理论值非常接近。由图3看出Y 的方向应力基本相等,应力主要分布在两侧节点处。 图 1 以矩形单元为有限元模型时计算得出的X 方向应力云图 图 2 以矩形单元为有限元模型时计算得出的底线上各点x 方向应力图 (2)对照理论解,对最大应力点的x σ应力收敛过程进行分析。列出各次计算 应力及其误差的表格,绘制误差-计算次数曲线,并进行分析说明。 答:在下边中点位置最大应力理论值为: MPa h y h y q y x L h q x 1895.0)5 34()4(622223=-+-=σ 设计性实验报告 实验名称酸对B-Z振荡反应的影响 实验报告人学号班级 同组人 实验日期2013 年月日 室温 9.9℃大气压 102.78KPa 指导老师 评分 1、前言 1.1背景材料 在化学反应中,反应产物本身可作为反应催化剂的化学反应称为催化反应。一般的化学反应最终都能达到平衡状态(组分浓度不随时间而改变),而在自催化反应中,有一类是发生在远离平衡态的体系中,在反应过程中的一些参数(如压力、温度、热效应等)或某些组分的浓度会随时间或空间位置作周期的变化,人们称之为“化学振荡”。由于化学振荡反应的特点,如体系中某组分浓度的规律变化在适当条件下能显示出来时,可形成色彩丰富的时空有序现象(如空间结构、振荡、化学波……等)。这种在开放体系中出现的有序耗散结构也证明负熵流的存在,因为在开放体系中,只有足够的负熵流才能使体系维持有序的结构。化学振荡属于时间上的有序耗散结构。 别洛索夫(Belousov )在1958年首先报道以金属锌离子作催化剂在柠檬酸介质中被溴酸盐氧化时某中间产物浓度随时间周期性变化的化学振荡现象,扎勃丁斯基(Zhabotinski )进一步深入研究在1964年证明化学振荡体系还能呈现空间有序周期性变化现象。为纪念他们最早期的研究成果,,将后来发现大量的可呈现化学振荡的含溴酸盐的反应体系称为B-Z 振荡反应[1]。 1.2实验原理 随着研究的深入,发现所有的振荡反应都含有自催化反馈步骤,同时也发现了许多能发生振荡反应的体系(振荡器Dscillator )尽管如此,但化学振荡的动力学机理,特别是产生时一些有序现象的机理仍不完全清楚。对于B-Z 振荡反应,人们比较认可的FKN 机理,是由Field 、Koros 、Noyes 等完成的[2]对含溴酸盐体系的B -Z 振荡反应进行设计性的探讨。 将溴酸钾、硫酸、丙二酸与硝酸铈溶液混合,由于4+Ce 呈黄色而3+Ce 无色,反应中可以观察到体系在黄色和无色之间作周期性的振荡。 丙二酸在硫酸介质中及金属铈离子的催化作用下被溴酸氧化。在过量丙二酸存在时,净反应过程为: -+3222222BrO + 3CH (COOH)+2H = 2BrCH(COOH) + 3CO + 4H O 根据FKN 机理,B-Z 振荡不少于11个元反应,若抓住其中三个关键物质,2HBrO 、-Br 、4+3+Ce /Ce ,则可以简化为用6个元反应来描述: 本科生实验报告书 四节点等参单元有限元分析的FORTRAN程序 目录 1.问题概述 (1) 2.四节点四边形等参单元介绍 (1) 3.单元应力磨平方法介绍 (4) 4.程序流程设计 (6) 程序设计概述 流程图 5.程序结构及程序说明 (8) 6.程序应用及算例分析 (9) 算例概述 算例ANSYS求解 算例程序数值解 算例分析 7. 总结 (15) 1. 问题概述 等参单元是有限元方法中使用最广泛的单元类型。等参单元的位移模式和坐标变换均采用相同的形函数,这种坐标变换叫做等参变换。通过等参变换可以将自然(局部)坐标中几何形状规则的单元转换成总体(笛卡尔)坐标中形状扭曲的单元,因而使得单元有较好的适应性。 本问题首先对平面四节点四边形等参单元的形函数、应力矩阵和等效节点力矩阵、应力磨平公式等的推导和计算求解。并通过设计FORTRAN 求解程序进行编程求解,最后给出算例(受集中荷载的悬臂梁)并进行求解,将解与ANSYS 的解进行比较。在这个过程中,采用了高斯三点积分和高斯两点积分,这种积分方法的求解效率较高而且精度也较好。在问题的最后,尝试去分析引起数值解误差的原因,并分析四节点等参单元的若干特性。 2. 四节点四边形等参单元介绍 边长为2的正方形单元(如下图所示),在其形心处安置一个局部坐标。单元角 结点i 的坐标(,)分别为 ,因此单元四条边界的方程可用简单公式 和 逐一给出。 图2-1 母单元 1 2 3 4 0 图2-2 四边形单元 形函数的表达式: 位移函数: ∑==41 i N u i i u ∑==4 1 i N v i i v 坐标变换式: ∑==41 i x N x i i ,∑==4 1 i y N y i i 单元应变矩阵 {}[]{}[]{}e e B B B B B x v y u y v x u δδε4321==??? ? ??? ?????????????+??????= 式中{ }[]T T T T T 4 321e δδδδδ=——单元节点的位移列阵; B-Z 振荡反应 姓名:刘若晴 学号:2007011980 班级:材72 同组实验者:穆浩远、曾燕群 带实验的老师:王老师 1 引言(简明的实验目的/原理) 实验目的: 1.了解Belousov-Zhabotinski 反应(简称B-Z 反应)的机理。 2.通过测定电位——时间曲线求得振荡反应的表观活化能。 实验原理: 所谓化学振荡就是反应系统中某些物理量如组分的浓度随时间作周期性的变化。1958年,Belousov 首次报道在以金属铈离子作催化剂的条件下,柠檬酸被溴酸氧化的均相系统可呈现这种化学振荡现象。随后,Zhabotinsky 继续了该反应的研究。到目前为止,人们发现了一大批可呈现化学振荡现象的含溴酸盐的反应系统。例如,除了柠檬酸外,还有许多有机酸(如丙二酸、苹果酸、丁酮二酸等)的溴酸氧化反应系统能出现振荡现象,而且所用的催化剂也不限于金属铈离子,铁和锰等金属离子可起同样的作用。后来,人们笼统地称这类反应为B-Z 反应。目前,B-Z 反应是最引人注目的实验研究和理论分析的对象之一。该系统相对来说比较简单,其振荡现象易从实验中观察到。由实验测得的B-Z 体系典型铈离子和溴离子浓度的振荡曲线如图1所示。 图1:B-Z 体系典型铈离子和溴离子浓度的振荡曲线 关于B -Z 反应的机理,目前为人们普遍接受的是关于在硫酸介质中以金属铈离子作催化剂的条件下,丙二酸被溴酸氧化的机理,简称为FKN 机理。其主要的反应步骤及各步骤的速率或速率系数归纳如下: 序号 机理步骤 速率或速率常数 (1) 22HOBr Br H Br H O -+ +++ 1 116291110108----=???=s k s dm mol k (2) HOBr H Br HBrO k 22 2?→?+++- 16292102--???=s dm mol k有限元上机实验报告
BZ振荡反应-实验报告
机械零件有限元分析——实验报告
物化实验报告-BZ振荡实验
有限元实验报告模板
BZ振荡反应
BZ振荡
有限元实验报告
BZ振荡反应
ansys实验报告
BZ振荡反应设计实验报告
有限元编程大作业报告
BZ振荡反应实验报告
