植物病原菌拮抗放线菌的分离筛选与鉴定

植物内生菌的分离
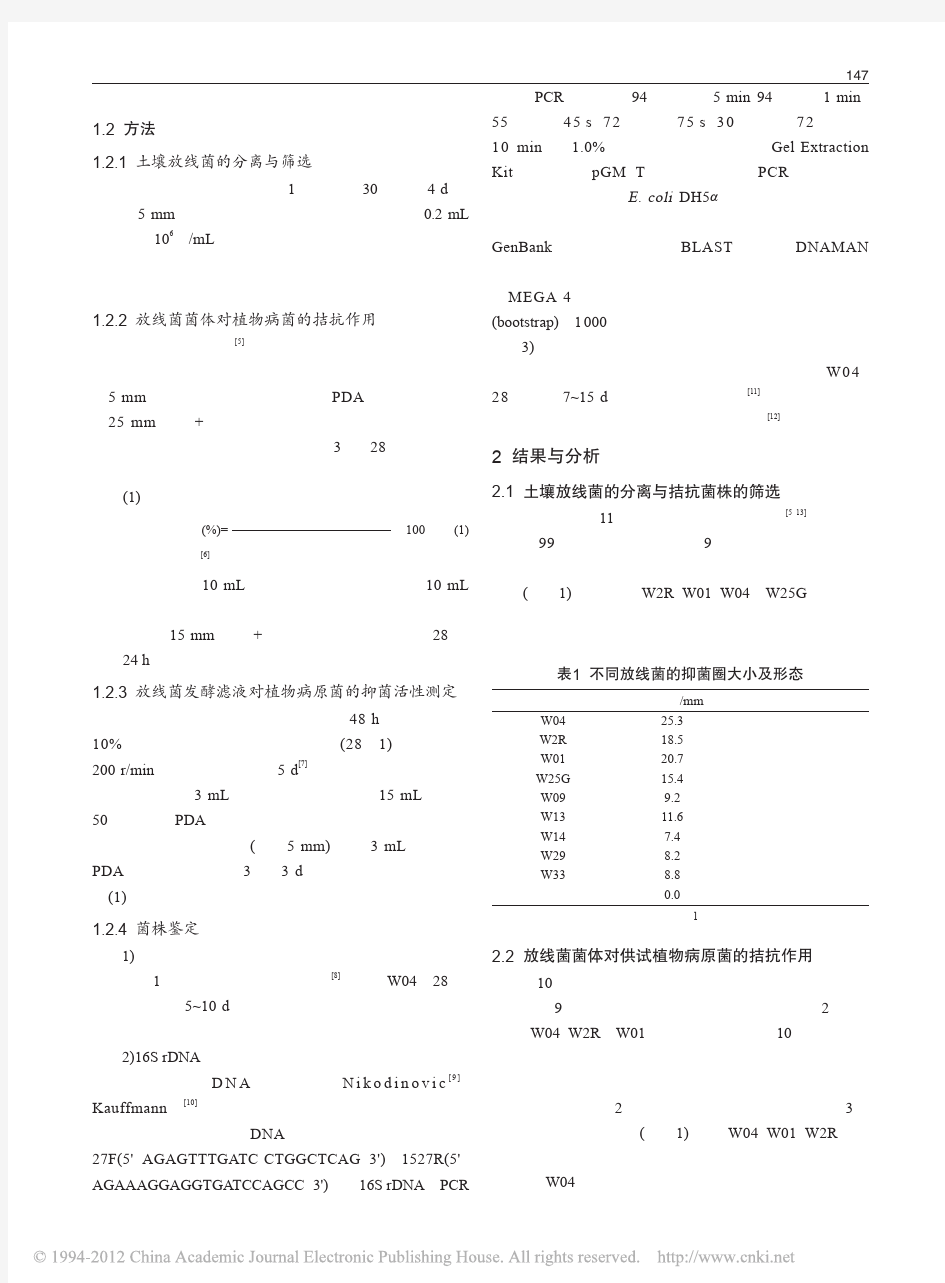
植物内生菌的分离 钱昆121140041 一、实验目的 1、掌握对植物内生菌的分离处理方法。 2、熟练掌握对细菌、真菌的染色观察技术。 3、了解微生物分子实验的基本操作流程。 二、实验原理 在植物的生态环境中,存在着各种各样的微生物,它们有的附着于植物的表面,有的则生活于植物体内。对于附着于植物表面和根际的微生物已有很多研究,而对于植物体内微生物的研究却刚刚起步。但有资料显示, 一些植物内生微生物与宿主发生关系时,可明显增强宿主的抗病性,提高植物的生产力。因此,合理利用植物的内生微生物具有重要的理论意义和实用价值。植物内生菌作为微生物研究领域之一,近年来一直备受关注。 内生菌概念在1866年首先由Bary提出的,指那些在其生活史的一定阶段或全部阶段生活于健康植物的组织或器官内部的微生物(主要为真菌和细菌)。其后的很长时间内,内生菌研究进展缓慢。直到1993 年,美国蒙大拿州立大学Strobel等从短叶红豆杉的韧皮部位分离到一株产新型抗癌物质紫杉醇的内生真菌,从而启发人们可从植物内生菌寻找与植物产生的相同或相似的化合物,由此促进了植物内生菌的研究。植物内生菌为植物组织内的正常菌群,包括植物内生真菌、内生细菌和内生放线菌,广泛分布于各种陆生及水生的低等植物和高等植物中。 内生真菌是在宿主植物的茎和叶内生存并完成生活周期的真菌。这类真菌中,有许多种类很少形成孢子,或者在宿生植物上形成孢子(或者孢子果),不容易识别。真菌感染植物组织,菌丝存在于细胞内和细胞间。与病原菌不同,这些真菌对宿主植物几乎没有害处,它们和植物之间或者是相互依存的共生关系,或者是不太密切的共生关系。 对于现已分离得到的植物内生细菌,一般可分为专性内生细菌与兼性内生细菌,前者指至今只能在植物体内分离得到的细菌;后者指能在植物根际与土壤中分离得到,也能在植物体内分离得到的细菌,而且种类居多。根据内生细菌对宿主植物生长发育的影响可以将其分成三类:第一类对植物的作用是中性的,即尚未发现它们的内生定殖对宿主植物生长与繁殖有影响;第二类对植物生长发育有促进作用,如能提高宿主植物抗病、抗逆能力,或能通过固氮与分泌激素促进植物生长发育等;第三类对植物生长具有负面影响,在特别条件下接种到原宿主植物或另外的宿主植物会诱发植物病害。但需要注意的是,同种细菌定殖于不同宿主植物可能对宿主植物产生不同的影响。 除根瘤菌外,还有放线菌侵入多种被子植物宿主,形成根瘤的共生固氮体系。早在十九世纪后期,人们就发现了这类非豆科的根瘤,并发现根瘤内有生微生物,1881年布隆科斯特将它称为Frankia,但当时并不知道它是什么微生物。确定内
(推荐)植物病原菌的接种
实验五植物病原物的接种 一、实验目的 人工使病原物与寄主植物感病部位接触,创造条件使病原物侵入并诱致寄主发病叫接种,接种是证病过程的重要步骤,在研究寄生现象发病规律,测定品种抗病性,药剂防病效果时都需要接种。因此,接种是植病工作者必须掌握的基本技术环节。 植物病害人工接种方法,是根据病害的传染方式和侵染途径设计的,植物病害的种类很多、其传染方式和侵染途径各异。因此接种方法也不相同。本次实验以玉米大斑病,小麦根腐病,小麦秆锈病,梨褐腐病等为内容学习常用的接种方法。 二、内容、材料和方法 (一)拌土法(小麦根腐病) 拌土法适于土壤传染的病害,方法是将消毒的土壤分别装入两个小花盆中,其中一盆表层覆以一厘米厚的菌土,菌土是用玉米砂培养菌1份加消毒土5份混合而成,另一盆不接种(不覆菌土)作为对照。将经0.1%升汞表面消毒3分钟并用无菌水洗3次的小麦种子,分别播种在两个花盆内,插上标牌,注明接种日期,方法病害名称及接种人姓名,花盆放在室温下,浇水保湿,遮阴管理,待幼苗出土展开叶子后(大约一周),观察并记载根腐病发生情况。 (二)喷雾法(玉米大斑病) 气流及雨水传播的病害常用此法接种,将培养好的玉米大斑病的斜面
菌种一支,用移植钩刮于装有100毫升无菌水的三角瓶中,用力振荡,待孢子洗下后,以纱布过滤,并于滤液中加入
0.1克中性肥皂,即成孢子菌丝悬液,用卫生喷雾器均匀喷布在麦苗上。同时设一不喷菌液而喷无菌水的作对照,用塑料罩保湿48小时,揭布后正常管理,7天后作发病调查。 (三)涂抹法(小麦秆锈病) 这也是气流传播的病害常用的接种方法,用于禾本科锈病接种。方法是用姆指沾锈菌夏孢子悬液自下向上轻轻涂欲接种的小麦叶片,也可先用手指沾水摩擦叶片,使叶表有一层水膜,然后将夏孢子粉抹在上面,以不涂抹孢子悬液或孢子粉的作为对照。塑料罩保湿48小时后揭布,正常管理,7天后作发病调查。 (四)创伤接种法(白菜软腐病及梨褐腐病) 创伤接种法是伤口侵入的弱寄生菌常用的接种方法。 1.白菜软腐病:取切成适当大小的白菜帮两块、经水洗,待水稍干后,以10%漂白粉溶液作表面消毒,分放在两个灭过菌的上下铺有吸水纸的培养皿中,用酒精擦过的玻璃棒顺着白菜帮打三排不穿透的孔穴。将培养好的白菜软腐病菌斜面菌种的菌苔以无菌水洗下作成菌悬液。然后,先以灭过菌的兽用注射器吸取无菌水滴于菜帮的第一排内孔作为对照,再用该注射器吸菌液滴于第二、三排孔内。注意无论无菌水、还是菌液都不要滴的过多。以免流出孔穴,另一培养皿的菜帮以同法处理作为重复。盖好皿盖,置于26—28℃的温箱中,24小时后检查发病情况。 2.梨褐腐病:取白梨以酒精火焰表面消毒后,用炽热的解剖刀,在其上切成小手指粗的孔穴3
植物内生菌DNA提取方法
在提取植物内生菌之前,植物需要表面灭菌,其具体操作为将植物浸泡在添加了0.02%的Tween-20的质量分数为1%的次氯酸钠溶液中1 min,再将植物浸泡在70%酒精中1 min,然后用硫代硫酸盐/Ringer’s(林格氏液)清洗3次,每.次1 min。根和茎(土表面以上1 cm处)都要灭菌处理,将根茎切成片状。为了更好地分析细菌的位置,灭菌后茎表皮撕下,茎内部按照之前的方法灭菌。表皮组织和根最后一次淋洗液中的细胞都用来提取DNA。 植物不同组织的内生菌群落DNA提取通过直接研磨植物组织,步骤为溶解、提取和纯化步骤(方案一),或者在DNA提取前从片状植物组织中淋洗出细胞(方案二)。 东南景天表面灭菌方法:整株植物用自来水冲洗30 min,用蒸馏水洗3次,每次3 min。用吸水纸吸去植物表面水分,用无菌剪刀在根基部将根系剪下,与植物地上部分开。将根系用70 %酒精浸泡2 min,无菌水洗3次,3 % NaClO浸泡2次,每次1 min,然后用无菌水冲洗3次,每次2 min,最后一次清洗液涂LB平板。 1. 将2 g左右消毒后植物组织于无菌研钵中,加5 mL磷酸钠缓冲液(19.9 g Na2HPO4·H2O,1.27 g NaH2PO4·2H2O,H2O 定容到1 L)研磨至匀浆。 2. 将植物匀浆转移至50 mL无菌离心管中,摇床200 rpm振荡1-2 h,使细菌细胞尽可能的从植物组织中释放出来。 3. 取4 mL悬液于新的无菌离心管中,12 000×g离心10 min收集菌体细胞。 4. 弃上清,将收集的菌体细胞重新溶于550μL 1×TE buffer(Tris-EDTA;pH8)中加入10 mg mL-1溶菌酶10μL,37℃水浴1-4h。 5. 加入50μL 20% SDS和8μL 20 mg mL-1蛋白酶K,混匀,65℃水浴3h,期间轻轻上下颠倒混匀数次。 6. 加入200μL 5M NaCl,涡旋振荡15 s,12000×g离心10 min。 7.取上清液,并向上清液中加入等体积的氯仿-异戊醇(24:1),彻底混匀,12000×g离心10 min。 8. 上清液转移至新的无菌离心管中,重复步骤7一次。 9. 上清液转移至新的无菌离心管中,加入0.6倍体积(0.6 vol)的冰冷的异丙醇,4℃放置1 h。 10. 4℃,12000×g离心10 min,弃上清。 11. 沉淀用70%冰乙醇清洗,离心,弃上清。 12. DNA沉淀室温风干后,用无菌超纯水溶解。 13. DNA纯化采用TIANquick Midi Purification Kit。
_大豆根瘤菌剂载体的选择及最佳施用浓度筛选
第33卷第2期2014年 4月 大豆科学SOYBEAN SCIENCE Vol.33No.2Apr. 2014 大豆根瘤菌剂载体的选择及最佳施用浓度筛选 刘庆莉1,王金生1,刘丽君1,林蔚刚1,王红蕾2,张俐俐3,吴俊江 1 (1.黑龙江省农业科学院大豆研究所,黑龙江哈尔滨150086;2.黑龙江省农业科学院信息中心,黑龙江哈尔滨150086;3.黑龙江省农业科学院,黑龙江哈尔滨150086) 摘要:为筛选出适宜根瘤菌吸附且能促进大豆生长、提高产量的优质载体,并且在优质载体的条件下,筛选出大豆 根瘤菌液的最佳使用浓度,通过3种载体吸附不同浓度根瘤菌液拌种大豆盆栽播种后,对大豆的生物量、结瘤及产量的对比发现:不同载体介入、大豆接入根瘤菌后均对大豆的生物量及结瘤产生一定的促进作用。根瘤菌以草炭和蛭石为载体,更有利于促使大豆植株生长,积累更多的干物质;草炭的促进结瘤作用持续效果时间较长,液体的持续效果时间最短,而蛭石的持续效果时间相对比较居中;以草炭和蛭石作为根瘤菌载体,低浓度的根瘤菌液接入更能发挥其提高产量的作用,以液体作为根瘤菌载体,根瘤菌接入浓度较高才能发挥其提高产量的作用。结合生产成本来看, 草炭土更适宜作为自主研发根瘤菌剂的载体,同时推荐根瘤菌使用浓度为1.4?108 菌细胞 ·mL -1。关键词:大豆根瘤菌;结瘤;载体 中图分类号:S565.1文献标识码:A 文章编号:1000- 9841(2014)02-0207-04收稿日期:2013-10-11基金项目:国家“十二五”科技支撑计划(2012BAD14B06);现代农业产业技术体系(CARS-004);黑龙江省自然科学基金(C201104);哈尔滨市科技创新人才研究专项资金(2013RFXYJ043)。 第一作者简介:刘庆莉(1971-),女,技师,主要从事大豆耕作与栽培研究。E-mail :liuqingli1971@126.com 。通讯作者:吴俊江(1970-),男,博士, 研究员,主要从事大豆耕作与栽培研究。E-mail :nkywujj@163.com 。Chosen of Soybean Rhizobia Carrier and Screening of the Best Concentration LIU Qing-li 1,WANG Jin-sheng 1,LIU Li-jun 1,LIN Wei-gang 1,WANG Hong-lei 2,ZHANG Li-li 3,WU Jun-jiang 1 (1.Soybean Research Institute ,Heilongjiang Academy of Agricultural Sciences ,Harbin 150086,China ;2.Information Center of Heilongjiang Academy of Agricultural Sciences ,Harbin 150086,China ;3.Heilongjiang Academy of Agricultural Sciences ,Harbin 150086,China ) Abstract :In order to screen the carrier that was more appropriate for the absorption of rhizobia ,improving yield and quality of inoculated soybean ,and screen the best soybean rhizobia bacterial concentration at levels of quality carrier ,three carriers ab-sorbed different soybean rhizobia bacterial concentration with seed dressing were performed according to the biomass ,nodular rate and yields of soybean plant by soil pot experiments.The results showed that different carriers and inoculating soybean rhi-zobia could improve the biomass and nodular rate of soybean plant.Peat and vermiculite were used as carriers of rhizobia could remarkably promote the growth of soybean plant and enhance dry matter accumulation ;thus the lasting effect of nodular was the longest ,followed by vermiculite and liquid.Low level bacterial concentration could remarkably increased soybean yield and quality with peat and vermiculite as carriers ,however the opposite when used liquid as carriers.In conclusion ,in view of the cost ,peat was more appropriate for soybean rhizobia ,and the best bacterial concentration was 1.4?108 cells ·mL -1.Key words :Soybean rhizobia ;Nodulation ;Carrier 施用根瘤菌菌剂能促进大豆结瘤, 有效提高豆科植物的产量,减少生产中的化肥使用量,降低生产成本,而且可以提高土壤肥力,同时,由于根瘤菌剂耐污染能力强[1] ,还可以减少因长期使用化肥对 环境的破坏 [2-3] ,对无公害大豆生产以及降低农民 投人, 保护环境等具有十分重要的作用[4-5] 。因此 引起了人们的极大兴趣和广泛关注,已成为豆科植 物增产的主要研究方向。 近年来随着新技术特别是分子生物学技术的发展,各种高效菌种不断被选育或改造,制备菌剂的工艺、保藏菌剂的方法也不断完善和发展,配制成的菌剂的效果越来越好,在农业生产中得到了广泛利用。与此同时,诸如发酵水平低、保质期短和 技术不成熟、质量不过关等问题限制了根瘤菌剂的产业化和大面积推广应用。其中,菌种质量的高低一直是影响其应用效果的一个突出问题;载体也是大豆根瘤菌肥料质量控制的一个关键因素 [6] 。作 为根瘤菌的载体很多, 如草炭、蛭石、珍珠岩、煤炭、草炭、膨润土和高岭土等。草炭、蛭石由于其营养与pH 适中,表面积比较大和吸附性好,有利于根瘤菌的存活及菌剂保存,是理想的载体 [7-9] 。另外,草 炭和蛭石等资源丰富,价格低廉,适合于在根瘤菌剂生产中应用推广,已成为当代根瘤菌类肥料的主要类型。 本文的研究目的是筛选出适宜根瘤菌吸附且接种大豆能促进大豆生长、提高产量的优质载体,
植物病原菌分离方法
病原菌分离方法 一、实验原理: 植物患病组织内的真丝菌丝体,如果给予适宜的环境条件,除了个别种类外,一般都能恢复生长和繁殖。植物病原菌的分离就是指通过人工培养,重染病植物组织中将病原真菌与其他杂菌相分开并从寄主植物中分离出来,再将分离得到的病原菌于适宜环境内纯化,这个过程总称植物病原的分离培养。 二、实验用具: 酒精灯、手术剪、镊子、75%酒精、3%~5%次氯酸钠、灭菌水、培养皿、封口膜、乳酸等 三、实验前的准备工作: 1、煮培养基(PDA):马铃薯200g,葡萄糖20g,琼脂粉(AGAR)20g(10:1:1)水1000ml (1)将去皮称量好的马铃薯切片后加水煮沸15~20min(水可以适量多加200ml 左右,因为在煮的过程中会蒸发一些),待土豆煮软即可。 (2)三层纱布滤去马铃薯后将过滤的水倒入洗净的锅中,加琼脂粉搅拌充分后再加热煮沸,小火使其充分融化。 (3)加入葡萄糖并不断搅拌,待其完全融化后双层纱布过滤,定容到1000ml,分装到500ml的玻璃瓶内,每个玻璃瓶最多装300ml,121℃湿热灭菌 30min。 2、培养皿干热灭菌170℃1h;蒸馏水、枪头等湿热灭菌121℃30min。 四、实验步骤: 1、用75%酒精擦拭超净工作台,所有器具用紫外灯灭菌30min,分离室要保持清洁。 2、取样,病斑大小约20个(含病缘线) 3、分装培养基:(1)融PDA,松盖在微波炉中加热约3min(看量多少而定) (2)待冷却至50℃后在超净工作台指示灯显绿灯时分装 (3) 分装时滴入一管乳酸约20滴(每10ml培养基中加3滴乳酸) (4)左手拿培养皿并将皿盖在火焰附近打开一缝,迅速倒入培养基 约15m1(300ml一瓶的培养基倒20多个平板),加盖后轻轻摇动培 养皿,使培养基均匀分布在培养皿底部,然后平置于桌面上,待凝
植物病原菌分离方法
第四章植物病原菌分 离与纯化 植物病原菌 一、植物病原菌分离流程 二、分离的准备 ?分离的准备工作 无菌室操作前保持清洁无菌 接种工作准备 培养基的准备 ?分离材料选择 以收获的材料从病健交界处采样 果实腐烂从开始腐烂处分离 根腐和枯萎层可能从离土较远处分离
有些枯萎如野火病被固定在局部,从病斑边缘分不到等 有些材料污染严重时可先接种再分离:即将病组织接种到健康材料等 发病后分离 ?组织表面消毒 ⑴升汞:1‰ ◆升汞1g HCl(浓)25ml 水1000ml ◆升汞先溶于盐酸中,加水后稀释,也 可用NaCl 5g/L 代替盐酸,但易沉淀 ◆作用:盐酸,NaCl增加溶解度,HCl 能增强杀菌能力。 ◆处理时间:30’S-30min不等,常3 -5min;所需时间因材料不同而异, 消毒后灭菌水3-5次 附在组织表皮的气泡,含使消毒剂不能与寄生表面直接通气影响消毒 效果,除气泡抽气、70%酒精浸2 -3秒
⑵漂白粉 ◆常用表面消毒剂适用于病组织表面消 毒,也可处理种子 ◆成分:漂白粉10g,水140ml,过滤后使 用。 ◆最好现配现用,放久失效,有效成分 CaClO次氯酸钙 ◆好的消毒液易使有色纸褪色,且产生氯 气有强烈臭味。 ◆一般3-5min,时间长短因材料不同而 不同。处理种子5-10min,长的可达20 -30min。 优点:杀菌能力强,具有挥发性,不会遗留在组织上影响分离结果,其杀菌能力小于升汞。 (3)酒精:70%,浸很短时间(几秒到1min)灭菌水洗。 ◆较大的材料在酒精中浸或棉花 擦,然后在火焰烧去。 ◆幼嫩的病组织,表面用药剂消毒 时可能会同时杀死其中的病原真
植物内生菌
植物内生菌是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和 器官内部的微生物,被感染的宿主植物不表现出外在病症,可通过组织学方法或从严格表面消毒的植物组织中分离或从植物组织内直接扩增出微生物DNA的方法来证明其内生。它不仅包括互惠共利的和中性的内共生微生物,也包括那些潜伏在宿主体内的病原微生物,这些微生物有细菌、真菌、放线菌等。自1898年Vogl从黑麦草种子内分离出第一株内生真菌以来,植物内生菌作为一种新的微生物资源受到了广泛的关注,从内生菌中寻找和发现新的活性化合物已成为国内外研究的又一热点。近年来,该领域的研究已取得一定进展,发现了一些有医用、农用价值的菌株和化合物。 1. 内生真菌 从牧草中分离得到的内生真菌香柱菌,所产生的波胺碱和黑麦草碱类物质对昆虫具有杀伤作用,对牲畜等脊椎动物无毒。Strobel等从雷公藤的茎中分离得到一株内生真菌,能产生一种肽类抗生素Cryptocandin,它能抑制灰葡萄孢)等一些植物病原真菌,分离自同一内生真菌的一种新酰胺生物碱cryptocin对稻瘟病菌(及其他多种植物病原真菌有强的抑杀作用。纪丽莲等人从黄海海岸低盐药用植物芦竹中分离得到一株木霉属的内生真菌,它对黄瓜灰霉病菌有较强的抑菌活性。 2. 内生细菌 从辣椒中分离出的一株内生枯草芽孢杆菌,该菌株分泌的抗菌多肽对热稳定,在中性PH范围较稳定,并抗紫外线照射,对植物炭疽病菌和番茄青枯病菌等多种植物病原真菌和细菌有强的抑制作用。 3. 内生放线菌 链霉菌属于放线菌,它占具有生物活性的植物内生放线菌的绝大部分。澳大利亚Coombs研究小组从小麦根部分离的60多株放线菌中筛选到防治小麦全蚀病的菌株,在温室试验中可使小麦全蚀病的危害降低70%。Strobel等在蛇藤中分离到一株新的链霉菌,它能产生4种新的广谱抗生素Munumbicins A、B、C和D,这些抗生素对多种人体和植物致病霉菌、细菌及疟原虫具有广泛的抑杀活性。最近,Strobel等又从一种有叶蕨类植物中分离到一株新内生链霉菌,它能产生一种被称为kakadumycins的新型抗菌素,对炭疽芽孢杆菌和疟原虫均具有抑杀活性,其生物活性比棘霉素强。从卫矛科植物分离的内生链霉菌产生的新chloropyrrol抗生素对多种耐药性细菌和分枝杆菌有抑制活性。从杜鹃花植物中分离的链霉菌产生新的抗真菌物质fistupyrone,对植物病原真菌甘蓝黑斑交链格孢有抑制作用。李萌等从油菜和芹菜的茎和叶中分离得到215株内生菌,18株对蔬菜立枯丝核菌、直啄镰刀菌、苹果黑腐皮壳有很好的拮抗作用,其中有8株为放线菌;从油菜茎中分离出的内生放线菌CHSH19A经鉴定为一株链霉菌Streptomyces sp.,活性筛选结果证明其具有极强的抗立枯丝核菌活性。 植物内生菌是一类次生代谢产物丰富、应用前景广阔的资源微生物。近年来,植物内生菌由于能够产生丰富多样的具有农药活性的次生代谢产物,在自然界中具有重要的生态学作用,引起了人们广泛的关注并取得很大进展。从微生物中寻找发现新型先导化合物,是新农药研制的重要途径。内生菌作为微生物中的重要类群,其物种丰富,数量庞大,这为新农药的研究和开发提供了巨大的资源库。最近一个全面的研究显示,51%的从植物内生菌分离的生物活性物质是以前没有发现的化合物,而从土壤微生物发现的新物质仅为38%。由此
根瘤菌及其应用
根瘤菌与豆科植物及其应用 摘要:自贝叶林克1888年首次从豆科植物根瘤中分离获得根瘤菌以来,国内外的许多学者都为揭开这一大自然的奥秘进行着孜孜不倦的研究,成为生命科学最为活跃的领域之一。人们从生物学,生态学,生理生化,分类和遗传等方面对根瘤菌进行了广泛研究,在根瘤菌和根瘤的形态结构,固氮酶的结构和功能,固氮机理和作用调件,根瘤菌在细菌分类学中的地位直到固氮基因,结瘤基因,固氮生态等应用方面都有着较快发展,20世纪90年代共生固氮体系已进入分子水平,研究转入根瘤菌与宿主豆目植物植物的相互识别和信息传递以及根瘤菌群体感应等方面。 关键词:根瘤菌生物固氮根瘤菌应用 一.根瘤菌的生物学特征 根瘤菌:根瘤菌主要指与豆类作物根部共生形成根瘤并能固氮的细菌,一般指根瘤菌属和慢生根瘤菌属;两属都属于根瘤菌目。根瘤菌侵入寄主根内,刺激根部皮层和中柱鞘的某些细胞,引起这些细胞的强烈和生长,使根的局部膨大形成根瘤;根瘤菌在根内定居,植物供给根瘤菌以矿物养料和能源,根瘤菌固定大气中游离氮气,为植物提供氮素养料,两者在拮抗寄生关系中处于均衡状态而表现共生现象。 根瘤菌的形态特征:根瘤菌是短杆状细菌,因生活环境和发育阶段的不同,在形态上有显著变化.根瘤菌在固体培养基上和土壤中呈杆状,端生或周生鞭毛能运动,革兰氏染色阴性,无芽孢,培养较久
菌体粗大,染色不均。 生存习性:根瘤菌与植物的共生体系具有很强的固氮能力。已知全世界豆科植物近两万种。根瘤菌是通过豆科植物根毛、侧根杈口(如花生)或其他部位侵入,形成侵入线,进到根的皮层,刺激宿主皮层细胞分裂,形成根瘤,根瘤菌从侵入线进到根瘤细胞,继续繁殖,根瘤中含有根瘤菌的细胞群构成含菌组织。 根瘤菌进入这些宿主细胞后被一层膜套包围,有些菌在膜套内能继续繁殖,大量增加根瘤内的根瘤菌数,以后停止增殖,成为成熟的类菌体;宿主细胞与根瘤菌共同合成豆血红蛋白,分布在膜套内外,作为氧的载体,调节膜套内外的氧量。 类菌体执行固氮功能,将分子氮还原成NH3,分泌至根瘤细胞内,并合成酰胺类或酰尿类化合物,输出根瘤,由根的传导组织运输至宿主地上部分供利用。与宿主的共生关系是宿主为根瘤菌提供良好的居住环境、碳源和能源以及其他必需营养,而根瘤菌则为宿主提供氮素营养。 二.根瘤菌与豆科植物 根瘤菌(root nodule bacteria)是与豆科植物共生,形成根瘤并固定空气中的氮气供植物营养的一类杆状细菌。这种共生体系具有很强的固氮能力。已知全世界豆科植物近两万种。根瘤菌是通过豆科植物根毛、侧根杈口(如花生)或其他部位侵入,形成侵入线,进到根的皮层,刺激宿主皮层细胞分裂,形成根瘤,根瘤菌从侵入线进到根
分离植物内生真菌操作流程
分离植物内生真菌操作流程 1.材料准备:植物样本、剪刀、镊子、70%乙醇、3%次氯酸钠(本实验用4%84)、 酒精灯、计时器、平板、锥形瓶,无菌水,离心管(带盖,灭菌)、打开无菌操作台灭菌30min。 (1)植物样本的采集:选取生长状态良好,不要有病斑或者枯枝烂叶,每种植物采取三株标本,要带有叶子、叶柄和枝条及其他部位,将样本名字写在 小纸条上放在装标本的袋子里,采下来的标本与写有名字的纸条一同拍照,样本上有脏东西时,请用纸轻轻擦掉,若不清楚植物名字,请将整棵植物 拍照留用于鉴定,并做好相关记录。 (2)制作PDA固体培养基,在无菌操作台中倒平板,每瓶250ml的培养基大概倒15个板,待其凝固后用于接种。 2.清洗:认真用清水将标本洗净,洗去标本表面的灰尘,去除枯叶,备用。 3.取样: (1)在叶片的左上、右上、左下,右下和正中五个部位进行取样,剪取5mm*5mm的叶片,如果是叶柄或枝干,则剪取5~10mm,若是比较 粗的枝干或圆圆的果实之类的,总之比较大的,则将它切开,再剪取 样本,样本不要剪的太大或太小。 (2)每种植物的叶子,叶柄,枝干等其他部位,每种部位接种两块板,大板每个要接种五个样本即左上、右上、左下,右下和正中,小板每个 接种四个样本即左上、右上、左下,右下,计算好所要剪的样本数, 尽量多剪几个,以免后面的表面灭菌中冲洗时被冲掉。 (3)若植物标本有剩余,且是没有洗过的,重新装好,放到冰箱里,备用,洗过的扔掉。 (4)每种植物标本所剪的样本放在一个50ml的离心管中,放在试管架上,并且每个离心管上要标好所对应的植物标本。 4.表面灭菌:在无菌操作台中进行 (1)先向各离心管内倒入适量(10~20ml)70%乙醇,拧紧盖子,用计时器开始计时1min,每10秒钟晃动离心管几次,使其充分灭菌。 (2)1min后,拧松盖子,将乙醇倒入事先准备的锥形瓶中,注意不要将管
植物内生真菌的分离
植物内生真菌的分离 一、实验目的 1.理解内生真菌存在的普遍性和多样性 2.掌握常规的微生物分离纯化方法 3.掌握分菌过程中的一些基本操作技能 二、实验原理 植物内生真菌( Endophyte) 是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部的真菌或细菌,而宿主植物一般不表现出外在的症状。所有植物中几乎都存在内生菌. 由于植物内生真菌与宿主在长期的进化过程中形成了特殊的生态关系,因而内生真菌能产生与宿主相同或相似的具有生理活性的次生代谢产物,从内生菌中寻找和发现新的活性化合物越来越成为微生物次生代谢产物的研究热点之一。 采用微生物学常规的组织分离法从植物中分离内生真菌 三、实验材料 板蓝根新鲜健康的叶片 试剂:次氯酸钠、无水乙醇、葡萄糖、琼脂、青霉素、链霉素 培养基:PDA培养基、分离培养基 四、实验步骤 (一)、配制PDA培养基 10月27号晚上:
(1)配置PDA培养基,用电子称称取去皮的土豆100g,煮沸30min,4层纱布过滤,滤液加热,加入琼脂7.5克,琼脂完全融化后加入葡萄糖10g,待稍冷却后加水至500毫升。 (2)准备10瓶无菌水,每瓶150ml左右。 (3)包好烧杯,培养皿,涂布棒等实验仪器,等待消毒。 (二)、配制分离培养基 28号中午: (1)配置分离培养基,将PDA培养液均分成两份,一份备用,另一份待高温灭菌后,加入青霉素100mg/L、链霉素200mg/L的混合液20ml,即得到分离培养基。 (2)用消毒后的培养皿在通风橱中倒平板,注意在整个过程中保证无菌操作。 (三)、采集新鲜板蓝根叶片 28号晚上到实验室外采集新鲜健康叶片完整的板蓝根叶片。(四)、植物组织表面消毒 28号晚上将新鲜、健康的板蓝根叶片于自来水下冲洗干净,用吸水纸吸干表面水分后剪成小段(片)做如下表面消毒处理:75%酒精漂洗3min,无菌水冲洗4~5次,5%次氯酸钠溶液漂洗叶3min,无菌水冲洗4~5次,无菌滤纸吸干水分。 (五)、接种并培养 28号晚上: (1)将上述表面消毒后的材料剪切成0.5cm 2 小块,放入含
植物与病原菌互作和抗病性的分子机制
中国农业科学 1999,32(增刊):94~102 Scientia A gricultrua Sinica 植物与病原菌互作和抗病性的分子机制3 刘胜毅1 许泽永1 何礼远2 (1中国农业科学院油料作物研究所,武汉 430062;2中国农业科学院植物保护研究所) 提要 概述了近几年在寄主植物抗病基因与防卫反应基因、病原菌毒性基因、寄主抗病性机制和抗病基因工程策略等方面取得的主要进展,重点分析了抗病反应的一般过程、毒性基因 产物胞外水解酶和毒素的作用与关系、作物抗毒素基因工程策略。 关键词 植物;抗病基因;防卫基因;毒性基因;基因工程策略 早在40年代末50年代初,F lo r(1947;1955)在对亚麻和亚麻锈菌互作的遗传规律研究中,提出了基因对基因假说(gene2fo r2gene hypo thesis)〔4,5〕,这标志着对植物与病原菌互作的认识深入到了基因水平,从而为应用分子生物学手段研究植物抗病性奠定了基础。本文概要地综述近几年在寄主植物抗病基因、病原菌致病基因、寄主抗病机制等方面取得的主要进展,并试图侧重分析概括抗病反应的一般过程及毒素的作用与基因工程策略。 1 抗病相关基因 根据基因的作用性质,可把抗病反应过程中起作用的基因分为两类:抗病基因和防卫反应基因。抗病基因是决定寄主植物对病原菌的专化性识别,并激发抗病反应的基因。即按F lo r的基因对基因理论,它与病原菌的无毒基因互补;按Keen(1990)提出的用来解释基因对基因理论分子机制的配体2受体模型〔6〕,它的产物是抗病反应信号传导链的起始组分,即信息链的前端,当它与病原菌的无毒基因直接或间接编码产物互补结合后,启动信号传导激发植物的抗病反应。防卫反应基因是一类在抗病机制中最终起作用的基因,它们的编码产物直接或间接地作用于病原。除此之外,抗病基因和防卫反应基因的区别还有:(1)抗病基因编码产物具有特异性,而防卫反应基因编码产物具有普遍性,即不同的寄主植物中有一套类似的防卫反应基因,如植保素合成链中的酶基因、病程相关(PR)蛋白基因、植物细胞壁成分合成酶基因等。(2)抗病基因产物是植物防卫反应基因表达的直接或间接调节因子。防卫反应基因一般是受病原菌诱导表达的,编码产物比较容易分离的一类基因,而抗病基因是组成型表达的,编码产物不容易分离的一类基因。因此在基因克隆、基因编码产物的结构和功能分析等方面的研究工作中,防卫反应基因均早于抗病基因。所以植物防卫基因既有普遍性,又有特殊性。除有一部分是相似的外,还有一部分是不同的,如对真菌、细菌毒素的解毒基因,因毒素不同而不同。而人工赋予植物的解毒基因则可能更加不同,有动物源的,也有微生物源的。 1.1 抗病基因 接收病原菌信号,启动植物抗病反应信号转导的是植物抗病基因的编码产物,这是分子植物病理学研究寄主植物的重点和难点。自1992年应用转座子标签法分离出第一个抗病基 收稿日期 1999207215
植物病原真菌的分离培养精选文档
植物病原真菌的分离培 养精选文档 TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
实验十三植物病原真菌的分离培养 一、实验原理 植物患病组织内的真菌菌丝体,如果给予适宜的环境条件,除个别种类外,一般都能恢复生长和繁殖。植物病原菌的分离就是指通过人工培养,从染病植物组织中将病原真菌与其它杂菌相分开,并从寄主植物中分离出来,再将分离到的病原菌于适宜环境内纯化,这个过程总称植物病菌的分离培养。植物病原真菌的分离一般都是采用组织分离法,就是切取小块病组织,经表面消毒和灭菌水洗过后,移到人工培养基上培养。 二、实验目的: 植物病原菌的分离培养是植物病理学实验最基本的操作技术之一,它对原害鉴定,病原形态观察、植物病害接种体的培养等方面都是经常使用的研究手段。通过本实验,要求植物病原菌分离培养的一般原则和方法。 三、实验材料及准备: 1.分离材料:梨黑斑病(Alternaria kikuchiana),柿树圆斑病(Pestnlotia sp)及杉木炭疽病(Glomerella cingolata)新发病的病叶;杨树烂皮病(Cytospora chrysosperma)国槐腐烂病(Dothiorella sp.)的带有新病斑的枝条;油松种子。 2.分离用具(每小组为单位)
酒精灯4个,手术剪4把,眼科镊4把,PDA培养基3瓶,培养皿 (Φ9cm)24套,小烧杯(5ml)4个,大烧杯1个,斜面培养基12管,灭菌水4瓶,75%酒精瓶1个(内放脱脂棉球)%升汞瓶1个,5%乳酸瓶(60ml)1个,火柴1盒,湿、干纱布各4张。 四、实验方法及步骤: (一)、分离前的准备工作: 1.工作环境的清洁和消毒 分离培养一般在无菌室、无菌箱或无菌工作台(超净工作台)上进行,无菌室和无菌箱要经过喷雾除尘,并用药物或紫外线照射消毒(常用消毒药物为70%酒精,2%煤酚皂液,5%石炭酸液等喷雾。若用紫外线灯照射则需20-30分钟)。在没有上述设备条件时,在清洁房间里关闭门窗,避免空气流动,经过喷雾除去空气及地面灰尘后进行操作,也可获得较好的结果。工作前擦净桌面,最好铺上湿纱布。将所需用的物品按次序放在工作台上,避免工作时走动,工作人员最好穿上灭菌后的工作服,带上口罩,并用肥皂洗手,用70%酒精或%新洁尔灭擦手。 2.分离用具的消毒 凡是和分离材料接触的器皿(刀、剪、镊、针等)都要随时(至少在使用时)保持无菌,将这些用具浸于70%酒精中,使用时在灯焰上灭菌烧去酒精,如此2-3次(刀、剪、镊等不宜在灯焰上烧时过长,以防退火)。再次使
植物对病原菌的防御
昆虫取食诱导的植物防御反应 (中国农业大学昆虫系,北京100094) 摘要:植物被昆虫取食后可产生直接防御或间接防御。直接防御通过增加有毒的次生代谢产物或防御蛋白对昆虫生理代谢产生不利的影响,但对植物的消耗较大。间接防御通过释放挥发性化合物吸引天敌昆虫,并以此控制植食性昆虫。特异性的昆虫激发子(insect specific elicitors)能够诱导挥发性化合物的释放。多种信号途径参与昆虫取食诱导的植物防御反应,它们之间的相互作用协同或拮抗。了解昆虫取食诱导的植物防御反应,对于害虫综合治理策略的完善具有重要的意义。 植物在进化过程中对昆虫和病原菌危害形成了多种防御机制,一般分为组成型防御机制(constitutive defenses)和诱导型防御机制(induced defenses)。前者指植物中原本就存在的、阻碍昆虫取食或病原菌侵染的物理和化学因子;后者是由昆虫和病原菌诱导产生的(Mauricio et al.,1997)。诱导防御机制在植物自我保护中发挥着重要作用(Maleck and Dietrid,1999)。包括:增加有毒物质含量;产生局部过敏反应或系统获得抗性(systematic acquired resistance);产生有毒化合物和防御蛋白,延缓昆虫发育速度;以及释放挥发性化合物来吸引捕食性和寄生性天敌等作用。关于植物对病原菌防御反应在细胞水平的研究已取得了许多进展(Baker et al.,1997),而对植物是如何识别昆虫取食机制的了解还非常有限, 第1个昆虫特异性的激发子——昆虫口腔分泌物volicitin直到1997年才得到详细描述。将甜菜夜蛾Spodoptera exigua幼虫口腔分泌物中的活性成分N 17 羟基亚麻酰基 L 谷氨酰氨涂抹于玉米伤口部位,能够增加挥发性有机化合物的释放(Alborn et al.,1997),这些释放的物质具有吸引天敌的作用。表明植物能够招引三级营养关系中的天敌来消灭害虫,达到自我保护的目的,这一点与抵抗病原菌不同。 近年来,植物诱导抗性的研究报道较多,尤其是昆虫取食诱导的植物间接防御,已经成为新的研究热点。昆虫与植物相互关系的研究在生态学、害虫综合治理研究中的地位越来越受到人们的重视。关于植物诱导抗虫性的基本特征、理化机制和对昆虫及其天敌的影响,松树诱导抗虫性机制,外源茉莉酸类物质诱导的植物抗虫性及作用机理,昆虫诱导的植物蛋白酶抑制剂和挥发性化合物国内已有一些研究综述(娄永根和程家安, 1997, 2001; 宗娜等, 2003; 刘兴平等, 2003; 桂友连等, 2004)。本文主要从植物生物化学角度,对昆虫取食诱导的植物次生代谢及其相关信号途径进行综述。 1植物直接防御反应 直接防御反应分为3类:(1)产生有毒的次生化合物(如烟碱、呋喃香豆素等)直接杀伤昆虫或病原菌;(2)产生防御蛋白(如蛋白酶抑制剂、多酚氧化酶等)降低昆虫对食物的消化能力;(3)改变自身的营养状况使昆虫不能获得足够的营养。虫害诱导的植物直接防御反应最典型的例子就是番茄、马铃薯、大豆等植物受虫害诱导后,能够系统性累积蛋白酶抑制剂来抑制昆虫消化道中的丝氨酸蛋白酶活性,从而减少昆虫的进一步取食(Farmer and Ryan, 1992),烟草等植物叶片受机械伤害或昆虫取食后诱导叶片和根部烟碱的合成(Baldwin et al.,1997)。根部的烟碱运输到叶片和繁殖器官,可阻止昆虫的进一步取食。 1 1产生防御蛋白或防御酶活性升高 植物产生的防御蛋白包括蛋白酶抑制剂、氧化酶系、苯丙烷类代谢途径酶、糖结合蛋白和病程相关蛋白(pathogenesis related protein)等。在番茄中,昆虫取食会导致原
高效大豆根瘤菌的筛选
高效大豆根瘤菌的筛选 作者:张欣,李玉文转贴自:本站原创 (1.东北林业大学林学院;2.黑龙江省科学院生物肥料研究中心,黑龙江哈尔滨150086) 摘要:将选取的10株大豆根瘤菌菌株(HLJN1001,HLJN1002,HLJN1003,HLJN1004,HLJN10 05,HLJN1006,HLJN1007,HLJN1008,HLJN1009,HLJN10010)与在黑龙江省大面积栽培的5 个大豆品种(垦农18号,垦鉴豆25号,合丰25号,疆丰21-1381号,绥农4号)进行最佳共生匹配双瓶筛选试验,测定了大豆植株株高、叶片颜色、结瘤数、瘤干重和植株地上部分干重等生物学指标并进行统计分析,从中筛选出共生固氮结瘤能力强的优良菌株HLJN1001和HLJN 1003。 关键词:大豆根瘤菌;大豆品种;共生匹配;筛选 中图分类号:S565.1 文献标识码:A 文章编号:1007—6921(2011)10—0125—03 根瘤菌(Rhizobium)是一类广泛分布于土壤中的革兰氏阴性细菌,它可以侵染豆科植物根部,形成根瘤,固定空气中的分子态氮形成氨,为植物提供氮素营养。但根瘤菌与豆科植物独立存在时,不能利用大气中的N2,而当根瘤菌侵入豆科植物的根细胞并在其中迅速增殖后,可产生类菌体,并在根瘤内出现豆血红蛋白,同时具备类菌体和豆血红蛋白的根瘤便具有固氮能力。研究表明,不同的根瘤菌与大豆品种间的共生固氮能力存在着较大的差异[1,2] 。因此,筛选与豆科作物品种匹配、固氮能力好、竞争结瘤能力强的优良菌株,是提高根瘤菌应用效果的重要途径[3]。现选取10株大豆根瘤菌菌株,与5个在黑龙江省大面积栽培的大豆品种进行共生匹配性研究,从中筛选出优良菌株,为大豆育种材料的选择和共生固氮作用的发挥提供依据。 1 材料与方法 1.1 试验材料 1.1.1 供试菌株 HLJN1001,HLJN1002,HLJN1003,HLJN1004,HLJN1005,HLJN1006,HLJN1007,HLJN1008,HLJN1009,
植物病原真菌的分离培养
实验十三植物病原真菌的分离培养 一、实验原理 植物患病组织内的真菌菌丝体,如果给予适宜的环境条件,除个别种类外,一般都能恢复生长和繁殖。植物病原菌的分离就是指通过人工培养,从染病植物组织中将病原真菌与其它杂菌相分开,并从寄主植物中分离出来,再将分离到的病原菌于适宜环境内纯化,这个过程总称植物病菌的分离培养。植物病原真菌的分离一般都是采用组织分离法,就是切取小块病组织,经表面消毒和灭菌水洗过后,移到人工培养基上培养。 二、实验目的: 植物病原菌的分离培养是植物病理学实验最基本的操作技术之一,它对原害鉴定,病原形态观察、植物病害接种体的培养等方面都是经常使用的研究手段。通过本实验,要求植物病原菌分离培养的一般原则和方法。 三、实验材料及准备: 1.分离材料:梨黑斑病(Alternaria kikuchiana),柿树圆斑病(Pestnlotia sp)及杉木炭疽病(Glomerella cingolata)新发病的病叶;杨树烂皮病(Cytospora chrysosperma)国槐腐烂病(Dothiorella sp.)的带有新病斑的枝条;油松种子。 2.分离用具(每小组为单位) 酒精灯4个,手术剪4把,眼科镊4把,PDA培养基3瓶,培养皿(Φ9cm)24套,小烧杯(5ml)4个,大烧杯1个,斜面培养基12管,灭菌水4瓶,75%酒精瓶1个(内放脱脂棉球)0.1%升汞瓶1个,5%乳酸瓶(60ml)1个,火柴1盒,湿、干纱布各4张。 四、实验方法及步骤: (一)、分离前的准备工作: 1.工作环境的清洁和消毒 分离培养一般在无菌室、无菌箱或无菌工作台(超净工作台)上进行,无菌室和无菌箱要经过喷雾除尘,并用药物或紫外线照射消毒(常用消毒药物为70%酒精,2%煤酚皂液,5%石炭酸液等喷雾。若用紫外线灯照射则需20-30分钟)。在没有上述设备条件时,在清洁房间里关闭门窗,避免空气流动,经过喷雾除去空气及地面灰尘后进行操作,也可获得较好的结果。工作前擦净桌面,最好铺上湿纱布。将所需用的物品按次序放在工作台上,避免工作时走动,工作人员最好穿上灭菌后的工作服,带上口罩,并用肥皂洗手,用70%酒精或0.1%新洁尔灭擦手。 2.分离用具的消毒 凡是和分离材料接触的器皿(刀、剪、镊、针等)都要随时(至少在使用时)保持无菌,将这些用具浸于70%酒精中,使用时在灯焰上灭菌烧去酒精,如此2-3次(刀、剪、镊等不宜在灯焰上烧时过长,以防退火)。再次使用时必须重复灭菌。培养皿、试验等要
病原菌的分离培养和纯化
普通植物病理学 实验十七、病原菌的分离培养和纯化 一、目的要求 (1)了解分离与纯化微生物的基本原理及方法。 (2)掌握倒平板的方法和组织分离、稀释分离、平板划线分离的基本操作技术。 (3)掌握在平板、斜面及液体培养基上培养病原菌及观察其培养性状的方法。 二、基本原理植物病原菌的分离培养,是植物病理实验室工作中的基本技能。为了获得某微生物的纯培养,一般是根据该微生物对营养、酸碱度、氧气等条件要求不同,而供给它们适宜的生活条件,即让病原菌生活在适宜的培养基上,或加入某种抑制剂造成只利于此菌生长,而抑制其他菌生长的环境,从而得到纯菌株。植物病原真菌的分离方法主要有组织分离法和稀释分离法两种。最常用的方法是组织分离法,而稀释分离法主要用于病组织上产生大量孢子的病原真菌的分离。病原细菌的分离方法以划线分离法为最常用,在有些情况下也采用稀释分离法。为了获得分离菌的纯培养,必须要进行分离菌的纯化,纯化的方法类似于分离工作中采用的稀释分离法或划线分离法。 三、材料、仪器与用具 1.材料(依当地情况进行选择,下列材料供参考) (1)稻瘟病叶、病节、病穗颈(pyricularia orycae)。 (2)玉米大斑病叶(exserohilum turcicum)。 (3)玉米弯孢菌叶斑病叶(curvularia lunata)。 (4)玉米小斑病叶(bipolaris maydis)。 (5)番茄灰霉病果(botrytis cinefca)。
(6)黄瓜菌核病果(sclerotinia sclerotiorum)。 (7)黄瓜细菌性角斑病叶(pseudomonas syringaepv.1achrymans)。 (8)水稻白叶枯病叶(xanthomonas campestms pv.oryeue)。 (9)大豆细菌性斑点病叶(pseudomonas syringaepv.glycinea)。 (10)白菜软腐病叶(erudnia carotovora subsp.carotovora)。 2.培养基pda培养基;肉膏蛋白胨培养基;加寄主组织煎汁的培养基等。 3.仪器与用品超镜工作台、培养箱、培养皿、吸管、吸水纸、三角玻璃棒、剪刀、解剖刀、镊子、接种铲(针)、接种环(铒)、70%酒精、0.1%升汞、酒精灯、火柴、记号笔、橡皮筋套、可调式电炉、铝锅等。0.1%升汞溶液配制:升汞1e 浓盐酸2.5ml 蒸馏水1000ml。先将升汞溶于盐酸中,待充分溶解后,再加水稀释。升汞是剧毒药物,在操作时应特别小心。 四、实验操作 (一)病原真菌的分离 1.组织分离法按照以下步骤进行: (1)取灭菌培养皿一个,置于湿纱布上,在皿盖上用玻璃铅笔注明分离日期、材料和分离人的姓名。提示:为了保证无菌操作,应注意下面几点:工作前最好将所需的物品都放在超净工作台内,工作中临时去取容易带来杂菌;保证工作人员自身的洁净,工作前用肥皂洗手;无菌操作前还要用70%酒精擦拭双手;工作中,特别在使用无菌操作间时,呼吸要轻,不要说话。 (2)用无菌操作法向培养皿中加入25%乳酸1--2滴(可减少细菌污染),然后将融化而冷至60c 左右的pda培养基倒人培养皿中,每皿倒10--15ml,轻轻摇动使之成平面。凝固后即成平板培养基。提示:加入25%乳酸1~2滴,可基本保证平板上不出现污染细菌苗落。除乳酸外,在培养基中加入适当的抗菌素抑制细菌的生长,也是常用的方法。加青霉素(20μg/ml)可以抑制g+细菌生长;加多黏霉素b(5.0μg/ml)可以抑制g—细菌生长;加链霉素(40μg /ml)或氯霉素(50μg/ml)可以抑制大部分细菌的生长。除了氯霉素可在灭菌前加入外,其他抗菌素都应在灭菌后并冷却到45c左右(以手背触三角瓶感到烫,但尚可以忍耐为宜)’时
