植物内生菌分离处理方法汇总
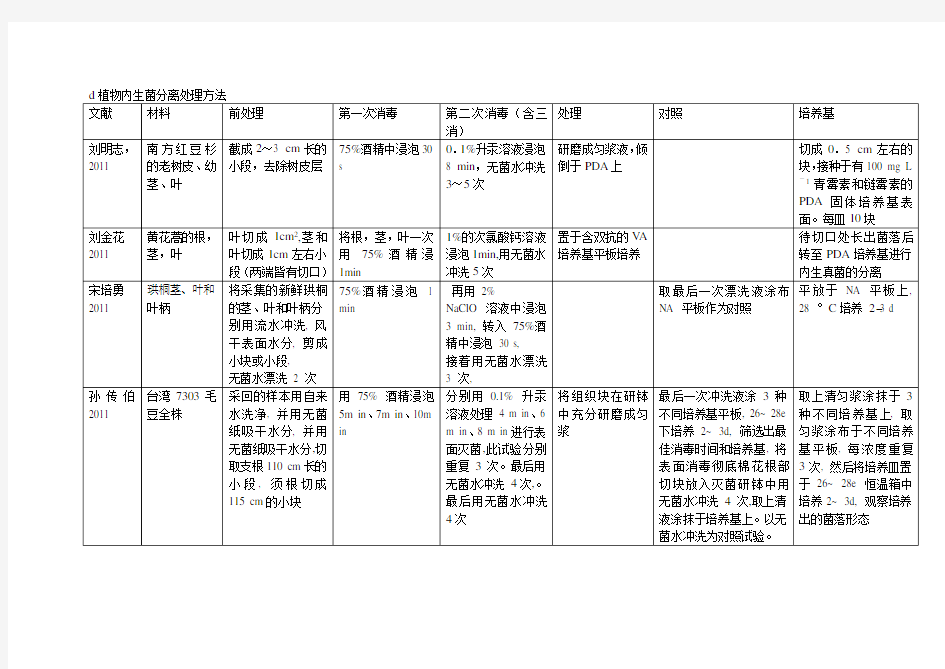

d植物内生菌分离处理方法
文献材料前处理第一次消毒第二次消毒(含三
消)
处理对照培养基
刘明志,2011 南方红豆杉
的老树皮、幼
茎、叶
截成2~3 cm长的
小段,去除树皮层
75%酒精中浸泡30
s
0.1%升汞溶液浸泡
8 min,无菌水冲洗
3~5次
研磨成匀浆液,倾
倒于PDA上
切成0.5 cm左右的
块,接种于有100 mg L
-1青霉素和链霉素的
PDA固体培养基表
面。每皿10块
刘金花2011 黄花蒿的根,
茎,叶
叶切成1cm2,茎和
叶切成1cm左右小
段(两端皆有切口)
将根,茎,叶一次
用75%酒精浸
1min
1%的次氯酸钙溶液
浸泡1min,用无菌水
冲洗5次
置于含双抗的V A
培养基平板培养
待切口处长出菌落后
转至PDA培养基进行
内生真菌的分离
宋培勇2011 珙桐茎、叶和
叶柄
将采集的新鲜珙桐
的茎、叶和叶柄分
别用流水冲洗, 风
干表面水分, 剪成
小块或小段,
无菌水漂洗2 次
75%酒精浸泡 1
min
再用2%
NaClO 溶液中浸泡
3 min, 转入75%酒
精中浸泡30 s,
接着用无菌水漂洗
3 次,
取最后一次漂洗液涂布
NA 平板作为对照
平放于NA 平板上,
28 °C培养2?3 d
孙传伯2011 台湾7303毛
豆全株
采回的样本用自来
水洗净, 并用无菌
纸吸干水分, 并用
无菌纸吸干水分,切
取支根110 cm长的
小段, 须根切成
115 cm的小块
用75% 酒精浸泡
5m in、7m in、10m
in
分别用0.1% 升汞
溶液处理4 m in、6
m in、8 m in进行表
面灭菌,此试验分别
重复3次。最后用
无菌水冲洗4次,。
最后用无菌水冲洗
4次
将组织块在研钵
中充分研磨成匀
浆
最后一次冲洗液涂3种
不同培养基平板, 26~ 28e
下培养2~ 3d, 筛选出最
佳消毒时间和培养基, 将
表面消毒彻底棉花根部
切块放入灭菌研钵中用
无菌水冲洗4次,取上清
液涂抹于培养基上。以无
菌水冲洗为对照试验。
取上清匀浆涂抹于3
种不同培养基上, 取
匀浆涂布于不同培养
基平板, 每浓度重复
3次, 然后将培养皿置
于26~ 28e 恒温箱中
培养2~ 3d, 观察培养
出的菌落形态
张鑫2011 植物圣罗勒
的健康
叶子
将叶子用流水冲洗
10 min
1% 的次氯酸
钠中浸泡10
min
0.02 mol / L、pH
7.0 的无菌磷酸
钾缓冲液( PB) 漂
洗
4 次
加无菌水将材料
研磨
涂布培养
李铭, 2011 石耳目地衣为了诱导产孢,黑化菌
株在光照/黑暗( 12 h∶
12h) 条件下,于2%的
PDA
培养基上,18℃下培
养 3 个月
刘杰凤2011 健康的小白
菜,染病的小
白菜根,茎,
叶
流水冲洗干净,剪
成小段
75%酒精中浸泡3
min
10%次氯酸钠浸泡
茎为8 min,根和叶
由于气孔较茎大,
浸泡5 min即可,然
后用无菌水浸泡多
次,每次3 min
无菌条件下用适
量的
PBS
缓冲液捣碎
以最后一次的漂洗液作
对照
,30 ℃
下培养
一个星期
搅拌后静置3 min,取
上清液0.5 mL分别
涂布于分离培养基平
板上,每种材料做3
次平行
朱士茂2011 新采集的银
杏枝条,叶子
和根
在自来水中冲洗干
净,然后将枝条和
根截成 3 -4cm
长,将叶子和叶柄
分开,分别将根,
枝,叶放在不同的
灭菌后的广口瓶中
(一),根的表面
灭菌: 0. 1%的土温
20 消毒1min,无
菌蒸馏水冲洗 2
次。
(二)枝,叶和叶
柄:75% 的乙醇
消毒30s,无菌蒸
馏冲洗3 次
(一),根:75%的乙
醇消毒30s,无菌蒸
馏水冲洗 2 次,0.
1% 升汞消毒
5min,无菌蒸馏水
冲洗 5 次。
(二)枝,叶和叶柄:
0. 1% 升汞消毒
7min,无菌蒸馏水
冲洗 5 次
茎,将其表皮剥
离,用无菌小刀纵
切表皮取其中间
的部分,然后将其
切成0. 5cm ×0.
5cm 大小
叶和叶柄,用研钵
将叶磨碎( 内放
石英砂和生理盐
水) 然后用无菌
移液管吸取0.
2ml 放入培养皿
中
①将以上接入的每种平
皿按相同的方法接入
5min 后用无菌镊子取
出;②用无菌蒸馏水冲洗
已表面灭菌后的材料,然
后将此液体移入培养基
中,培养观察。
KB 培养基:
PL 培养基:
PDA 培养基:
肖淑贤2011. 长势好、无病
害的植株
在自来水中冲洗干
净
采用升汞、乙醇、
H2O2、次氯酸钠等
表面消毒剂进行消
毒,无菌水冲洗
直接切取植物组
织或榨取植物组
织汁液稀释
王剑峰2011 取生长15
天马铃薯
无表面灭菌方法马铃薯内生菌单菌落
的分离取生长15 天
马铃薯LK99 组培苗,
剪成长度约 1.0 cm
的带腋芽茎段接种于
PSA 培养基上,分别于
光下(28℃、2200Lx、
16hr 光/8hr 黑暗)或
28℃暗培养,3 天后光
下和黑暗条件下组培
苗周围的培养基上出
现黄色菌块,挑取黄色
菌块,用稀释涂布法
[66]分离单菌落。
李晓红不同表面消毒
方法对核桃叶
内生菌分离效
果的比较
内容残缺)
熊亚南2011 刺五加植株
流水冲洗去
土,根,茎,
根茎等部
流水冲洗去土按根,茎,根茎等
部进行分割,每段
长10cm左右,按
下列程序表面消
毒:无菌水冲洗→
95%酒精漂洗
1min→6%的Naclo
浸3min
75%的乙醇漂洗
0.5min→无菌水漂
洗3次
进行分割,每段长
10cm左右
同样处理的材料不做切
割直接滚印于对照平板,
并去最后一次漂洗的无
菌水平板涂布,置相同条
件下培养,无菌长出即为
表面消毒彻底。
NA培养基。将上述处
理过的材料韧皮部与
木质部无菌分离,韧皮
部切成约
0.5cm×0.4cm的薄片,
然后将薄片直插入和
水平贴附两种方式置
于分离平板上,
25-28℃暗箱培养,带
材料边缘有菌苔长出
后转接与纯化平板划
线法分离纯化,镜检验
纯后转接到斜面。
邓正山2012 健康的大蒜
鳞茎
用纯净水冲洗干净依次用体积分数7
5%的乙醇浸泡3
min
0.1%的氯化汞
表面消毒15s,
再用无菌水漂洗5
次
杨明琰2012 新鲜的杜仲将新鲜植物材料
用自来水冲洗外表
面直至干净,晾干。
用无菌刀将样品切
割成3cm左右的
小段
75%的酒精溶液
中浸泡6min,
用无菌水冲洗样品
表面3~5次
再在4%的次氯酸
钠溶液中浸泡3m
in,用无菌水冲
洗样品表面3~5
次
用镊子及解剖取
其韧皮部,切除两
端后切成大约1
cm×0.5cm
的小段
①漂洗液检验法:把最后
一次漂洗材料的无菌水
涂布于PDA平板上,2
8℃恒温培养。②组织印
迹法:将上述表面灭菌处
理的完整枝段压入PD
A平板内,使表面灭菌材
料与培养基接触30m
in后,移去植物材料,
28℃恒温培养。③组织
压入法:将灭菌材料不经
切割直接贴于PDA培
养基表面,28℃恒温培
养
将小段,贴于PDA培
养基的表面,每皿放3
块材料,于28℃恒温
培养箱内培养5~1
0d。待菌丝从植物组
织长出后,从边缘挑取
菌丝移至另一PDA
平板上进行纯化
胡秀荣2011 采集健康的
柑橘植株
放线菌
:先在自来水下冲
洗掉样品表面的泥
土,再用超声波清
放线菌:
然后用99%乙醇处
理1min,3%次氯
酸钠处理5min
放线菌:
最后用99%乙醇再
处理30s
放线菌:
灭菌好的材料用
无菌刀切成
1cm×1cm小块,
放线菌:
将最后一次处理植物样
品的清洗液涂在ISP2培
养基上,用以检测表面灭
洗置于分离培养基
表面
菌的效果
熊党生2012 取新鲜健康
的葛根的根、
茎、叶
分别用水冲洗干
净,用滤纸吸干水
分
无菌水冲洗2 遍,
先用体积分数75%
酒精浸泡 3 ~ 5
min( 叶子3 min,
茎 4 min,根
5min) ,无菌水冲
洗 3 ~ 4 遍
用0.1% 升汞浸
泡 2 ~4min( 叶
子 2 min,茎 3
min,根4 min) ,
无菌水冲洗 4 ~5
次
在无菌的条件下,
用灭过菌的手术
剪刀将植物根、
茎、叶剪成小段,
从中间剪开后,分
别置于含有葛根
浸出夜的PDA
琼脂培养基上,置
于生化培养箱中
培养一段时间
将上述经过表面消毒后
未作任何处理的材料直
接置于平板中,27℃培
养,结果材料周围未见任
何菌长出,证明所分离的
菌株为葛根的内生菌。
挑取内生细菌到牛肉
膏蛋白胨培养基中,挑
取内生真菌的菌丝到
PDA 培养基中纯化数
次,将纯化好的菌种接
种到斜面培养基上保
存备用
张彦涛2012 白蜡、茅草、
射干、罗布
麻、蓼草、胡
杨、怪柳。
取采集的新鲜样
品,用蒸馏水将植
物表面洗净
干后分别取其根、
茎、叶,在75% 乙
醇消毒液中浸泡
3~5min
3% 次氯酸钠浸泡
5min,75% 乙醇浸
泡5min。最后用无
菌水冲洗3~4 次
将样品在灭菌的
研钵中研磨,加适
量无菌生理盐水
研磨至匀浆状
最后一次冲洗的无菌水
涂布平板做空白对照
(分离培养基)取
1mL 液体分别按照
10-1、10-2、10-3、10-4、
10-5、10-6、10-7依次
梯度稀释,并分别涂布
平板,37℃恒温培养
2d。
红树林
内生放
线菌
文件不完整
李雁津2012 完整交城骏
枣,
用自来水清洗表面
后再用无菌水冲洗,
晾干称重后浸入
30%的乙醇中3 min
浸入 2.6%的次氯
酸钠溶液中5 min
浸入30%的乙醇中
30s进行表面消毒,
最后用无菌水冲洗
5次,晾干
用无菌剪刀将枣
果去皮,果肉剪碎,
加入无菌生理盐
水研磨
取最后一次淋洗水150微
升涂于LB平板上,28°C
培养72小时,检测表面灭
菌效果。
将碾磨液分别涂布于
胰酶大豆琼脂培养基
(TSA)、任氏培养基
(R2A)、金氏培养基
(KMB)、肉汁胨培养基
(BPA)、LB培养基、
酵母膏蛋白胨琼脂培
养基(YPM)、无氮培养
基,28°C培养箱中倒
置培养3-7天。
张慧茹2012 挑选新鲜、生
长旺盛的葎
草,用保鲜袋
包装
用自来水冲洗干
净,置无菌操作台
中紫外灯照射 5
min 后晾干。
用75%酒精进行
全草消毒1 min
升汞消毒时间分别
为:根65 s、茎50 s、
叶35 s。再用无菌
水冲洗干净
将上述组织块剪
成0.5 cm×0.5
cm大小
分别取各种组织最后一
次冲洗的无菌水,涂布于
营养琼脂平板上;将表面
消毒处理过的完整的根、
茎、叶各组织贴压在PDA
培养基平板内;在超净工
作台内放置一敞开的
PDA 平板。将上述3 种
对照平板置于28 ℃恒
温培养箱内培养7 d,用
于检查表面灭菌效果。
置于马铃薯葡萄糖琼
脂(PDA)培养基中,
28 ℃恒温培养箱中培
养约5~7 d,待内生菌
长出后,挑取单个菌落
进行纯化,PDA 培养
基斜面保菌。
李勇2011 健康人参自来水将人参根表
面粘连的土壤清
洗,再用无菌水冲
洗 1 次
依次用70% 乙醇
浸泡3 min
2. 6% 次氯酸钠浸
泡 5 min,再用
70%乙醇浸泡30 s。
最后用无菌水淋洗
5 次
将无菌人参根剪
成碎块,放入无菌
研钵中,加入适量
无菌石英砂和生
理盐水( 0.
取最后一次淋洗液150
μL 涂平板,28 ℃培养
3 d,观察平板上是否有菌
长出
。取200 μL 稀释液
至细菌分离培养基,涂
布均匀。25 ℃恒温培
养7 d,记录每个平板
上的菌落形态及菌落
85%) ,充分研
磨,梯度稀释 1
万倍
数,纯化培养。
林娜2012 随机挑选
100g 左右
根、茎、叶、
果实
洗净风干75% 乙醇分别浸
泡2、3、1、1 min,
无菌水冲洗6 次,
无菌滤纸吸干
0.1%HgCl2分别浸
泡50、60、40、40 s,
无菌水冲洗6 次
加无菌石英砂研
磨,梯度稀释至
10-3,每一稀释
梯度涂布10 个
分离平板
每个样品都取最后一次
无菌水洗液涂于相应平
板上,以检测表面消毒是
否彻底
定期观察分离平板,挑
取单菌落划线纯化于
牛肉膏蛋白胨斜面上。
张鑫2012 无纹背苔藓取苔藓叶片用无菌
水洗净
紫外先线(功率
18QW)照射6min
(苔藓叶正反面个
照射30min)灭菌
然后用75%的酒精
漂洗15min ,用无
菌水冲洗3次,再
利用酒精灯火焰进
行表面灭菌
将验证表面无菌
的叶子于无菌碾
钵中碾磨,用无菌
水梯度稀释
将表面灭菌的叶子直接
贴于固体PDA和LB培养
基表面,28℃培养3-4h,
观察叶子周围是否长菌,
以检验鲜苔表面灭菌是
否彻底。
各取200微升稀释液
涂布于固体PDA和
LB培养基进行内生菌
的分离。根据菌落形
态,颜色等特征初步判
断处分理出菌落的中
类,并按常规的方法挑
取菌落保存。
蓝江林2012 香蕉,处于成
果期的健株
和病株各 1
株
将样品用自来水冲
洗干净,吸干水分,
称重
先用75%酒精浸泡
40 s 左右,用无菌
水充分淋洗
再用10% KClO3溶
液浸8 min,无菌水
反复淋洗,无菌滤
纸吸干
根部选取根尖和
根基部分;假茎部
从茎基部到茎顶
端等分为 5 段,
每段随机取样;
叶片根据生长的
位置分为上部、中
部和下部叶片,每
部分取叶基部中
部和叶尖部分
以组织消毒后无菌水淋
洗的最后淋洗液作为对
照, 涂NA 平板培养,如
长菌落, 则判定研磨液所
培养的菌落为非内生菌,
丢弃; 若对照中无菌落,
则基本可判定研磨液中
长出的菌落可能是内生
菌,纯化后保存待用。
在无菌研钵中充分研
磨匀浆,无菌水梯度稀
释至102、103和
104,取200 μL 稀释
液涂布于NA平板上,
每梯度 3 个重复,静
置20 min 后,30℃倒
置暗培养24 ~ 48 h。
史应武2012 新疆醉马草将醉马草的根、茎、
叶( 包括叶鞘) 、种
子分别用自来水冲
洗干净,
再用无菌水冲洗一
次; 在75% 的0
乙醇浸泡30s 将
醉马草的根、茎、
叶( 包括叶鞘) 、
种子分别用自来水
冲洗干净
然后在0. 1% 的升
汞中浸泡 1 min;
无0菌水淋洗 5
次,在无菌条件下
晾干
取最后一次淋洗水涂于
LB 平板上,28℃培养
72 h,检测表面灭菌效果
马赟2012 阿尔泰虫草取阿尔泰虫草用水
粗洗
再用乙醇擦洗
2min
然后在0. 1% 氯化
汞溶液中消毒 3
min,无菌水冲洗
4 ~6次
将虫草切成0.
1 ~0. 5 cm 长的
小段
将小段接到马铃薯培
养基( PDA) 、LB 培
养基培养
刘明志。南方红豆杉产紫杉醇内生真菌的分离。热带亚热带植物学报,2011,19(4):360~364
剥取红豆杉的老树皮,截成2~3 cm长的小段,去除树皮层,先用75%酒精中浸泡30 s,无菌水冲洗3次,再用0.1%升汞溶液浸泡8 min,无菌水冲洗3~5次。用无菌滤纸吸干表面水分,用无菌解剖刀将小段切成0.5 cm左右长的小块,接种于加有100 mg L-1青霉素和链霉素的PDA固体培养基表面。每皿放置10块,依次编号,置于25℃恒温培养箱中培养。幼茎内生菌的分离方法同上,将幼茎切成1 cm长的小段,以伤口断面垂直接种于PDA 固体培养基上培养。红豆杉叶片内生菌的分离采用两种方法,第一种方法与树皮内生菌的分离方法类似,分离时将叶片切成2至3段,接种于PDA固体培养基上;第二种方法是将叶片消毒后用无菌研钵研磨成匀浆液,然后将研磨液倾倒于PDA固体培养基上,置于25℃恒温培养箱中培养。
1刘金花。黄花蒿内生菌的分离与初步鉴定。2011,33(4):27~30
黄花蒿的根,茎,叶,叶切成1cm2,茎和叶切成1cm左右小段(两端皆有切口),将根,茎,叶一次用75%酒精浸1min,再用1%的次氯酸钙溶液浸,置于含双抗的V A培养基平板培养泡1min,用无菌水冲洗5次。待切口处长出菌落后转至PDA培养基进行内生真菌的分离。
2宋培勇,珙桐内生细菌的分离鉴定及系统发育分析,2011, 38(1): 8?13
将采集的新鲜珙桐的茎、叶和叶柄分别用流水冲洗, 风干表面水分, 剪成小块或小段,无菌水漂洗2 次, 75%酒精浸泡 1 min, 再用2%NaClO 溶液中浸泡 3 min, 转入75%酒精中浸泡30 s,接着用无菌水漂洗3 次, 平放于NA 平板上, 28 °C培养2?3 d。取最后一次漂洗液涂布NA 平板作为对照。
内生菌分离和纯化。将NA 平板上组织块下或周缘长出的菌落或菌苔划线稀释分离1-2 次直到获得纯培养
3孙传伯。毛豆内生菌的分离及生物学特征观察。(2011)10- 0026- 02
(1)从供试材料上取植物组织1. 0 g, 用70% (体积分数)酒精浸泡30 s, 用无菌水漂洗后, 置于1% (体积分数)次氯酸钠水溶液中表面消毒3- 5m in(其中叶片和花消毒3 m in, 茎和果消毒5m in), 再取出植物组织用无菌水冲洗3次. 样品晾干后分别置于无菌研钵中加5 mL 无菌水研磨成浆状, 静置10- 15 m in后, 每一样品各取上层澄清液50 LL 分别涂布在培养基( NA、KB和TSA ) 平板上, 每种培养基涂布3皿, 28 e 黑暗培养48- 72 h, 计算每一平板的菌落数. 表面消毒后, 在研磨前取50 LL 无菌水冲洗液涂布平板;或是通过组织印迹试验, 将最后一次清洗的植物组织在培养基平板上印一下, 按上述条件培养48 h, 观察有无菌落产生, 以验证采用该消毒方法是否能杀死供试材料表生微生物. 根据菌落形态、颜色等挑取单菌落, 划线分离、纯化后保存、备用.在融化并冷却至45 e 的NA 培养基中加入待测病原菌的悬浮液, 其中每100 mL 培养基加 1 mL 细菌悬浮液, 倒入平板. 采用点接法将内生菌接种于NA平板上, 每个平板上等距离点接5株不同的内生细菌菌株, 每组进行2次平行试验, 在恒温箱中28 e 下培养, 2 d后观察有无抑菌圈生成. (2)采用组织切块法, 进行表面消毒,再用灭菌的蒸馏水清洗, 检验灭菌效果。内生细菌的分离前,将采回的样本用自来水洗净, 并用无菌纸吸干水分,切取支根110 cm 长的小段, 须根切成115 cm的小块, 进行组织表面清毒, 棉花根部切段后经无菌水冲洗3次,用75% 酒精浸泡5m in、7m in、10m in后, 然后分别用011% 升汞溶液处理4 m in、6 m in、8 m in进行表面灭菌,此试验分别重复3次。最后用无菌水冲洗4次, 最后一次冲洗液涂3种不同培养基平板, 26~ 28e 下培养2~ 3d, 筛选出最佳消毒时间和培养基, 将表面消毒彻底棉花根部切块放入灭菌研钵中用无菌水冲洗4次,取上清液涂抹于培养基上。以无菌水冲洗为对照试验。培养2d后观察灭菌效果, 直到彻底表面灭菌, 再进行最后的内生菌分离。将组织块在研钵中充分研磨成匀浆,取上清匀浆涂抹于3种不同培养基上, 取匀浆涂布于不同培养基平板, 每浓度重复3次, 然后将培养皿置于26~ 28e 恒温箱中培养2~ 3d, 观察培养出的菌落形态。
(3)再将材料放进经过紫外线消毒的超净工作台内, 切割成小段, 按常规无菌操作进行表面消费处理: 75% 乙醇浸泡3 min y无菌水冲洗 3 遍y011% 升汞浸泡8 m in y 无菌水冲洗3 遍。将上述处理过的材料经滤纸吸干水分后, 在无菌条件下切成015 cm@015 cm 的小块, 放置于新鲜的PDA 平板培养基上, 每个平板放置4 块, 28 e 恒温培养3~ 7 d。待切口边缘长出真菌菌丝, 及时转接至新鲜PDA 培养基上培养, 采用菌丝顶端纯化法逐步纯化。同时, 以消毒后不做切割的材料作为空白对照, 同样条件下观察是否有菌长出, 结果对照材料周围无任何菌长出, 证明表面消费彻底。212 内生真菌的鉴定: 采用真菌学插片培养方法,对分离获得的见血封喉内生真菌进行显微形态特征( 菌丝、孢子形态等) 的观察、分类鉴定。分类检索参照文献报道[ 8]。213 内生真菌的发酵上清液制备: 将分离得到的菌株, 切取黄豆粒大小的菌丝块, 接种于PDB 培养基中。1 L 三角瓶装400 mL 培养液, 室温, 164 r/ min 振荡培养7 d, 同时以纯培养基作空白对照。无菌条件下取发酵液15 mL 于离心管中, 12 000 r/ min 离心30 min 后取上清液, 用012Lm 微孔滤膜滤过除菌, - 20 e 保存备用。214 抑菌活性测定: 采用杯碟法测定样品抑菌活性。金黄色葡萄球菌和MRSA 采用NA 培养基, 白色念珠菌采用YPD 培养基。将金黄色葡萄球菌、M RSA 和白色念珠菌分别制成一定浓度的菌悬液( 1@105~ 1@107cfu/ m L) , 用棉签将其均匀涂布在供试无菌培养皿中, 制成含菌平板, 然后在每个平板放入3 个牛津杯, 分别取样品200 微升加入其内, 同时以发酵纯培养基作阴性对照。金黄色葡萄球菌和M RSA 在37 e 下恒温培养, 白色念珠菌在28 e 下恒温培养。24 h 后观察结果, 测量并记录抑菌圈直径。每个样品做3 个重复, 以抑菌圈直径的平均值为试验结果
4张鑫,生菌的分离方法及其次级代谢产物研究,(2011)02-0023-04
内从药用植物圣罗勒的健康叶子上分离出4 种内生细菌OS -9、OS -10、OS -11和OS -12。他们首先将叶子用流水冲洗10 min,随后于1% 的次氯酸钠中浸泡10 min,再用0.02 mol / L、pH 7.0 的无菌磷酸钾缓冲液( PB) 漂洗4 次,每次洗后取100 μL 漂洗液转移到装有5 mL 肉汤培养基的离心管中,经过48 h 震荡培养( 条件是200 rpm,28 ℃) ,检测样品表面消毒是否彻底。分离过程为选用紫外线和75%酒精作为表面消毒剂,经过多次消毒,加无菌水将材料研磨后,再将研磨液涂布。
5李铭, 石耳目地衣(2011) 02-0014-07
无
6刘杰凤, 小白菜内生菌的分离及菌核菌拮抗菌的筛选(2011)13-2676-04
健康的小白菜,染病的小白菜。采回的植株用流水冲洗干净,剪成小段,75%酒精中浸泡3 min,再用10%次氯酸钠浸泡一定时间:茎为8 min,根和叶由于气孔较茎大,浸泡5 min即可,然后用无菌水浸泡多次,每次3 min,表面消毒检测至漂洗液无菌落长出为止,一般为3~4次。在无菌条件下用适
量的PBS缓冲液捣碎,充分搅拌后静置3 min,取上清液0.5 mL分别涂布于分离培养基平板上,每种材料做3次平行,以最后一次的漂洗液作对照,30 ℃下培养一个星期。挑取不同形态的菌落,平板划线进行3~4次的传代纯化、镜检、斜面低温保存。
选取具有明显菌核菌病症的小白菜,采用常规组织分离方法从长菌丝及菌核处取样,接种于PDA培养基中(添加10%的1 /3 000孟加拉红溶液),30 ℃培养至长出白色菌丝后,取白色菌丝进行多次划线纯化至纯种,斜面低温保存。
7将朱士茂,银杏内生菌的分离与鉴定2011
新采集的银杏枝条,叶子和根放在自来水中冲洗干净,然后将枝条和根截成3 -4cm 长,将叶子和叶柄分开,分别将根,枝,叶放在不同的灭菌后的广口瓶中.之后在超净工作台进行消毒。
根的表面灭菌: 0. 1%的土温20 消毒1min,无菌蒸馏水冲洗2 次,75%的乙醇消毒30s,无菌蒸馏水冲洗2 次,0. 1% 升汞消毒5min,无菌蒸馏水冲洗5 次。枝的表面灭菌: 75% 的乙醇消毒30s,无菌蒸馏冲洗3 次,0. 1% 升汞消毒7min,无菌蒸馏水冲洗5 次,叶子和叶柄的灭菌: 75% 的乙醇消毒10s,无菌蒸馏冲洗3 次,0. 1% 升汞消毒5min,无菌蒸馏水冲洗5 次,对照实验: ①将以上接入的每种平皿按相同的方法接入5min 后用无菌镊子取出;②用无菌蒸馏水冲洗已表面灭菌后的材料,然后将此液体移入培养基中,培养观察。2. 3 内生菌的分离在超净工作台中用无菌镊子挑取根放在无菌培养皿中,将其表皮剥离,用无菌小刀纵切表皮取其中间的部分,然后将其切成0. 5cm ×0. 5cm 大小,插入到培养基中。茎皮内生菌的获取同上,其次茎的木质部切成半径1cm 长2cm 的部分接入培养基中。
叶,叶柄中内生菌的获取一是将叶切成0. 5 ×0. 5 大小接入培养基中,二是用研钵将叶磨碎( 内放石英砂和生理盐水) 然后用无菌移液管吸取0. 2ml 放入培养皿中,最后用玻璃涂棒涂布均匀( 以上材料均接入五种培养基中,且每种均接三次) 。对照实验: 将表面消毒过的材料用无菌镊子夹取后在培养基中滚动2min 后弃掉,而且最后一次永无菌蒸馏水冲洗的冲洗液转入到五种培养基中培养( 将上述培养皿放入温箱终于27℃培养) 。
8肖淑贤, 植物内生菌的研究概况及应用进展2011.01.013
分离时可选取长势好、无病害的植株。分离方法通常是直接切取植物组织或榨取植物组织汁液稀释。目前内生菌的分离过程一般采用表面消毒技术,采用升汞、乙醇、H2O2、次氯酸钠等表面消毒剂进行消毒,无菌水冲洗。常用平板划线和稀释涂布的方法纯化所分离出的内生菌,纯化后接种于试管斜面培养基上,在5℃温度下保存,供作进一步的筛选。
9王剑峰,马铃薯内生菌的分离纯化及马铃薯生长发育的影响2011,12:60-62
组培苗的培养方法有两种,第一种方法:取生长15 天马铃薯LK99 组培苗,剪成长度约 1.0 cm 的带腋芽茎段,接种于MS 培养基[64]上,于光下(2200Lx、16hr光/8hr 黑暗、28℃)或28℃暗培养。第二种方法:取生长15 天马铃薯LK99 组培苗,剪成长度约1.0 cm 的带腋芽茎段,接种于马铃薯蔗糖琼脂培养基(PSA)[65]上,于光下(2200Lx、16hr 光/8hr 黑暗、28℃)或28℃暗培养。
马铃薯内生菌单菌落的分离取生长15 天马铃薯LK99 组培苗,剪成长度约1.0 cm 的带腋芽茎段接种于PSA 培养基上,分别于光下(28℃、2200Lx、16hr 光/8hr 黑暗)或28℃暗培养,3 天后光下和黑暗条件下组培苗周围的培养基上出现黄色菌块,挑取黄色菌块,用稀释涂布法[66]分离单菌落。
10李晓红,不同表面消毒方法对核桃叶内生菌分离效果的比较2012,28(28):163-168 (内容残缺不完整)
11熊亚南,刺五加内生菌的分离2011
刺五加植株流水冲洗去土,按根,茎,根茎等部进行分割,每段长10cm左右,按下列程序表面消毒:无菌水冲洗→95%酒精漂洗1min→6%的Naclo浸3min→ 75%的乙醇漂洗0.5min→无菌水漂洗3次→无菌滤纸吸干。将上述处理过的材料韧皮部与木质部无菌分离,韧皮部切成约0.5cm×0.4cm 的薄片,然后将薄片直插入和水平贴附两种方式置于分离平板上,25-28℃暗箱培养,带材料边缘有菌苔长出后转接与纯化平板划线法分离纯化,镜检验纯后转接到斜面。
将上述同样处理的材料不做切割直接滚印于对照平板,并去最后一次漂洗的无菌水平板涂布,置相同条件下培养,无菌长出即为表面消毒彻底。12邓正山,大蒜鳞茎中抗番茄灰霉病内生菌的筛选及其防治效果,(2012)05-0050-07
选取健康的大蒜鳞茎,用纯净水冲洗干净,,依次用体积分数75%的乙醇浸泡3min和0.1%的氯化汞表面消毒15s,再用无菌水漂洗5次,将最后一次洗涤液作对照,以检测表面消毒是否彻底。取表面消毒彻底的大蒜鳞茎,在无菌条件下充分研磨,梯度稀释,用接种环蘸取大蒜鳞茎液,在牛肉膏蛋白胨固体培养基上划线分离,28℃培养48h,选择形态、大小和颜色等特征不同的菌落进行划线分离纯化,得到纯化菌株后,接斜面置于4℃冰箱保存备用[10]。
13钟林芳,杜鹃花科植物菌根研究进展,2012,14( 3) : 145 -150
无
14杨明琰,杜仲内生真菌的分离鉴定及抗菌活性研究,2012,32(1):0193-0198
将新鲜植物材料用自来水冲洗外表面直至干净,晾干。用无菌刀将样品切割成3cm左右的小段,于75%的酒精溶液中浸泡6min,用无菌水冲洗样品表面3~5次,无菌滤纸吸干;再在4%的次氯酸钠溶液中浸泡3min,用无菌水冲洗样品表面3~5次,无菌滤纸吸干。用镊子及解剖取其韧皮部,切除两端后切成大约1cm×0.5cm的小段,贴于PDA培养基的表面,每皿放3块材料,于28℃恒温培养箱内培养5~10d。待菌丝从植物组织长出后,从边缘挑取菌丝移至另一PDA平板上进行纯化。对照设置:①漂洗液检验法:把最后一次漂洗材料的无菌水涂布于PDA平板上,28℃恒温培养。②组织印迹法:将上述表面灭菌处理的完整枝段压入PDA平板内,使表面灭菌材料与培养基接触30min后,移去植物材料,28℃恒温培养。③组织压入法:将灭菌材料不经切割直接贴于PDA培养基表面,28℃恒温培养。
15胡秀荣,柑橘内生菌的研究进展,2011
由于内生菌广泛存在于植物的根、茎、叶、花、果实等器官的组织中,所以分离时可以采集健康的植株,然后对样品进行一系列的表面消毒,其中包括酒精、次氯酸钠、高锰酸钾、升汞等消毒剂进行表面消毒,最后用无菌水冲洗干净,将消毒好样品进行无菌研磨,加入少量无菌水,吸取汁液涂平板,待长出细菌后,进行转接纯化,最后一次冲洗水涂板检测表面消毒是否彻底。
16熊党生,葛根内生菌的分离及其发酵产物抗氧化活性的初步研究,2012.01.009
取新鲜健康的葛根的根、茎、叶,分别用水冲洗干净,用滤纸吸干水分,采用本实验前期建立的方法进行表面消毒处理: 无菌水冲洗2 遍,先用体积分数75% 酒精浸泡3 ~ 5 min( 叶子3 min,茎 4 min,根5min) ,无菌水冲洗 3 ~4 遍,再用0.1% 升汞浸泡2 ~4min( 叶子 2 min,茎3 min,根4 min) ,无菌水冲洗4 ~5 次,处理完毕。
在无菌的条件下,用灭过菌的手术剪刀将植物根、茎、叶剪成小段,从中间剪开后,分别置于含有葛根浸出夜的PDA 琼脂培养基上,置于生化培养箱中培养一段时间,观察外植体侧面或顶端有菌落形成,挑取内生细菌到牛肉膏蛋白胨培养基中,挑取内生真菌的菌丝到PDA 培养基中纯化数次,将纯化好的菌种接种到斜面培养基上保存备用,空白对照: 将上述经过表面消毒后未作任何处理的材料直接置于平板中,27℃培养,结果材料周围未见任
何菌长出,证明所分离的菌株为葛根的内生菌。
17张彦涛,旱生植物内生细菌的分离及耐旱菌株的筛选鉴定,(2012)05-0124-05
材料:白蜡、茅草、射干、罗布麻、蓼草、胡杨、怪柳。
采用组织研磨法对典型旱生植物内生细菌进行分离[ 9 ]。取采集的新鲜样品,用蒸馏水将植物表面洗净,稍干后分别取其根、茎、叶,在75% 乙醇消毒液中浸泡3~5min,3% 次氯酸钠浸泡5min,75% 乙醇浸泡5min。最后用无菌水冲洗3~4 次,最后一次冲洗的无菌水涂布平板做空白对照。将样品在灭菌的研钵中研磨,加适量无菌生理盐水研磨至匀浆状。取1mL 液体分别按照10-1、10-2、10-3、10-4、10-5、10-6、10-7依次梯度稀释,并分别涂布平板,37℃恒温培养2d。若对照处理的分离培养基平板上无菌落出现,表明植物材料表面消毒彻底,分离到的是内生细菌。挑取单菌落转移至新的培养基平板上,划线法纯化,纯化好的菌株于-80℃冰箱保藏。
18红树林内生放线菌(文件不完整)
19李雁津,骏枣内生细菌的分离、鉴定与拮抗菌的筛选2012
取完整交城骏枣,用自来水清洗表面后再用无菌水冲洗,晾干称重后浸入30%的乙醇中3 min,再浸入2.6%的次氯酸钠溶液中5 min,之后浸入30%的乙醇中30s进行表面消毒,最后用无菌水冲洗5次,晾干,取最后一次淋洗水150微升涂于LB平板上,28°C培养72小时,检测表面灭菌效果。用无菌剪刀将枣果去皮,果肉剪碎,加入无菌生理盐水研磨,梯度稀释(稀释为IQi-lO7倍)后分别涂布于胰酶大豆琼脂培养基(TSA)、任氏培养基(R2A)、金氏培养基(KMB)、肉汁胨培养基(BPA)、LB培养基、酵母膏蛋白胨琼脂培养基(YPM)、无氮培养基,28°C培养箱中倒置培养3-7天。同时以最后一次洗漆的水作为对照。根据平板上长出菌落的形态、颜色、大小等挑取不同单菌落,反复划线纯化后接斜面保藏待用。
国内外学者用分离培养方法研究内生细菌时,采用了不同的培养基,分离结果的差值较大,本实验对分离内生细菌的常用培养基[68]:胰酶大豆琼脂培养基(TSA)、任氏培养基(R2A)、金氏培养基B(KMB)、肉汁胨培养基(BPA)、LB培养基、酵母膏蛋白胨琼脂培养基(YPM)、无氮培养基进行了选择,以使其能最大限度的分离红枣中的内生细菌。
20张慧茹,葎草内生真菌SS3的分离与鉴定,(2012)01-0026-03
挑选新鲜、生长旺盛的葎草,用保鲜袋包装,送实验室备用。将采集的葎草全草用自来水冲洗干净,置无菌操作台中紫外灯照射5 min 后晾干。用75%酒精进行全草消毒1 min,将葎草剪成根、茎、叶各组织块,不同组织升汞消毒时间分别为:根65 s、茎50 s、叶35 s。再用无菌水冲洗干净,将上述组织块剪成0.5 cm×0.5 cm大小,置于马铃薯葡萄糖琼脂(PDA)培养基中,28 ℃恒温培养箱中培养约5~7 d,待内生菌长出后,挑取单个菌落
进行纯化,PDA 培养基斜面保菌。
分别取各种组织最后一次冲洗的无菌水,涂布于营养琼脂平板上;将表面消毒处理过的完整的根、茎、叶各组织贴压在PDA 培养基平板内;在超净工作台内放置一敞开的PDA 平板。将上述3 种对照平板置于28 ℃恒温培养箱内培养7 d,用于检查表面灭菌效果。若没有菌落出现,说明植物表面菌被葎草内生真菌的分离经表面消毒效果检测,冲洗的无菌水、组织印迹培养及环境培养基均无菌生长,证明表面消毒彻底,植物切口培养的菌落为内生菌。从新鲜的葎草中共获得21 株内生真菌,命名为SS1~SS21。2.2 抗致病菌的内生真菌的筛选彻底消毒,所生长的菌为植物内生菌。
21李勇,人参内生细菌的分离及拮抗菌株的筛选,(2011)1202010
先用自来水将人参根表面粘连的土壤清洗,再用无菌水冲洗1 次。依次用70% 乙醇浸泡3 min,2. 6% 次氯酸钠浸泡5 min,再用70%乙醇浸泡30 s。最后用无菌水淋洗5 次,无菌吸水纸吸干人参根部残留水分。取最后一次淋洗液150 μL 涂平板,28 ℃培养3 d,观察平板上是否有菌长出,以确定灭菌是否彻底。将无菌人参根剪成碎块,放入无菌研钵中,加入适量无菌石英砂和生理盐水( 0. 85%) ,充分研磨,梯度稀释1 万倍。取200 μL 稀释液至细菌分离培养基,涂布均匀。25 ℃恒温培养7 d,记录每个平板上的菌落形态及菌落数,纯化培养。
22林娜,山苍子内生细菌的分离及抑菌活性研究,2012) 06 -03382 -03
随机挑选根、茎、叶、果实100g 左右,洗净风干,75% 乙醇分别浸泡2、3、1、1 min,无菌水冲洗6 次,无菌滤纸吸干,0.1%HgCl2分别浸泡50、60、40、40 s,无菌水冲洗6 次,加无菌石英砂研磨,梯度稀释至10-3,每一稀释梯度涂布10 个分离平板。每个样品都取最后一次无菌水洗液涂于相应平板上,以检测表面消毒是否彻底。定期观察分离平板,挑取单菌落划线纯化于牛肉膏蛋白胨斜面上。
23张鑫,苔藓内生菌Bacillus megaterium z12的分离,鉴定和抗菌活性帅选,(2012)06-1401-05
取苔藓叶片用无菌水洗净,紫外线(功率18QW)照射6min(苔藓叶正反面个照射30min)灭菌,然后用75%的酒精漂洗15min ,用无菌水冲洗3次,再利用酒精灯火焰进行表面灭菌。将表面灭菌的叶子直接贴于固体PDA和LB培养基表面,28℃培养3-4h,观察叶子周围是否长菌,以检验鲜苔表面灭菌是否彻底。将验证表面无菌的叶子于无菌碾钵中碾磨,用无菌水梯度稀释,各取200微升稀释液涂布于固体PDA和LB培养基进行内生菌的分离。根据菌落形态,颜色等特征初步判断处分理出菌落的中类,并按常规的方法挑取菌落保存。
24王宇光,香蕉内生拮抗细菌KKWB-10的分离鉴定及其内生性证明(文件不完整)
25蓝江林,香蕉植株内生细菌群落多态性研究,,2012, 20(3): 285~291
将香蕉植株分为根、茎、叶3 部分。根部选取根尖和根基部分; 假茎部从茎基部到茎顶端等分为5 段,每段随机取样; 叶片根据生长的位置分为上部、中部和下部叶片,每部分取叶基部、中部和叶尖部分。将样品用自来水冲洗干净,吸干水分,称重,先用75%酒精浸泡40 s 左右,用无菌水充分淋洗,再用10% KClO3溶液浸8 min,无菌水反复淋洗,无菌滤纸吸干。在无菌研钵中充分研磨匀浆,无菌水梯度稀释至102、103和104,取200 μL 稀释液涂布于NA平板上,每梯度3 个重复,静置20 min 后,30℃倒置暗培养24 ~ 48 h。统计菌落种类和数量。分别计数后用-80℃甘油冷冻保存待用。
以组织消毒后无菌水淋洗的最后淋洗液作为对照, 涂NA 平板培养,如长菌落, 则判定研磨液所培养的菌落为非内生菌, 丢弃; 若对照中无菌落, 则基本可判定研磨液中长出的菌落可能是内生菌,纯化后保存待用。
26史应武,新疆醉马草内生菌群落结构、2012) 52( 10)
将醉马草的根、茎、叶( 包括叶鞘) 、种子分别用自来水冲洗干净,再用无菌水冲洗一次; 在75% 的0乙醇浸泡30 将醉马草的根、茎、叶( 包括叶鞘) 、种子分别用自来水冲洗干净,s,然后在0. 1% 的升汞中浸泡1 min; 无0菌水淋洗5 次,在无菌条件下晾干; 取最后一次淋洗水涂于LB 平板上,28℃培养72 h,检测表面灭菌效果[11]。
27马赟,一株阿尔泰虫草内生菌的分离及抑菌活性2012.02.045
阿尔泰虫草,取阿尔泰虫草用水粗洗,再用乙醇擦洗2min,然后在0. 1% 氯化汞溶液中消毒3 min,无菌水冲洗4 ~6次后将虫草切成0. 1 ~0. 5 cm 长的小段接种于培养基中。马铃薯培养基( PDA) 、LB 培养基等。
植物内生菌的分离
植物内生菌的分离 钱昆121140041 一、实验目的 1、掌握对植物内生菌的分离处理方法。 2、熟练掌握对细菌、真菌的染色观察技术。 3、了解微生物分子实验的基本操作流程。 二、实验原理 在植物的生态环境中,存在着各种各样的微生物,它们有的附着于植物的表面,有的则生活于植物体内。对于附着于植物表面和根际的微生物已有很多研究,而对于植物体内微生物的研究却刚刚起步。但有资料显示, 一些植物内生微生物与宿主发生关系时,可明显增强宿主的抗病性,提高植物的生产力。因此,合理利用植物的内生微生物具有重要的理论意义和实用价值。植物内生菌作为微生物研究领域之一,近年来一直备受关注。 内生菌概念在1866年首先由Bary提出的,指那些在其生活史的一定阶段或全部阶段生活于健康植物的组织或器官内部的微生物(主要为真菌和细菌)。其后的很长时间内,内生菌研究进展缓慢。直到1993 年,美国蒙大拿州立大学Strobel等从短叶红豆杉的韧皮部位分离到一株产新型抗癌物质紫杉醇的内生真菌,从而启发人们可从植物内生菌寻找与植物产生的相同或相似的化合物,由此促进了植物内生菌的研究。植物内生菌为植物组织内的正常菌群,包括植物内生真菌、内生细菌和内生放线菌,广泛分布于各种陆生及水生的低等植物和高等植物中。 内生真菌是在宿主植物的茎和叶内生存并完成生活周期的真菌。这类真菌中,有许多种类很少形成孢子,或者在宿生植物上形成孢子(或者孢子果),不容易识别。真菌感染植物组织,菌丝存在于细胞内和细胞间。与病原菌不同,这些真菌对宿主植物几乎没有害处,它们和植物之间或者是相互依存的共生关系,或者是不太密切的共生关系。 对于现已分离得到的植物内生细菌,一般可分为专性内生细菌与兼性内生细菌,前者指至今只能在植物体内分离得到的细菌;后者指能在植物根际与土壤中分离得到,也能在植物体内分离得到的细菌,而且种类居多。根据内生细菌对宿主植物生长发育的影响可以将其分成三类:第一类对植物的作用是中性的,即尚未发现它们的内生定殖对宿主植物生长与繁殖有影响;第二类对植物生长发育有促进作用,如能提高宿主植物抗病、抗逆能力,或能通过固氮与分泌激素促进植物生长发育等;第三类对植物生长具有负面影响,在特别条件下接种到原宿主植物或另外的宿主植物会诱发植物病害。但需要注意的是,同种细菌定殖于不同宿主植物可能对宿主植物产生不同的影响。 除根瘤菌外,还有放线菌侵入多种被子植物宿主,形成根瘤的共生固氮体系。早在十九世纪后期,人们就发现了这类非豆科的根瘤,并发现根瘤内有生微生物,1881年布隆科斯特将它称为Frankia,但当时并不知道它是什么微生物。确定内
(推荐)植物病原菌的接种
实验五植物病原物的接种 一、实验目的 人工使病原物与寄主植物感病部位接触,创造条件使病原物侵入并诱致寄主发病叫接种,接种是证病过程的重要步骤,在研究寄生现象发病规律,测定品种抗病性,药剂防病效果时都需要接种。因此,接种是植病工作者必须掌握的基本技术环节。 植物病害人工接种方法,是根据病害的传染方式和侵染途径设计的,植物病害的种类很多、其传染方式和侵染途径各异。因此接种方法也不相同。本次实验以玉米大斑病,小麦根腐病,小麦秆锈病,梨褐腐病等为内容学习常用的接种方法。 二、内容、材料和方法 (一)拌土法(小麦根腐病) 拌土法适于土壤传染的病害,方法是将消毒的土壤分别装入两个小花盆中,其中一盆表层覆以一厘米厚的菌土,菌土是用玉米砂培养菌1份加消毒土5份混合而成,另一盆不接种(不覆菌土)作为对照。将经0.1%升汞表面消毒3分钟并用无菌水洗3次的小麦种子,分别播种在两个花盆内,插上标牌,注明接种日期,方法病害名称及接种人姓名,花盆放在室温下,浇水保湿,遮阴管理,待幼苗出土展开叶子后(大约一周),观察并记载根腐病发生情况。 (二)喷雾法(玉米大斑病) 气流及雨水传播的病害常用此法接种,将培养好的玉米大斑病的斜面
菌种一支,用移植钩刮于装有100毫升无菌水的三角瓶中,用力振荡,待孢子洗下后,以纱布过滤,并于滤液中加入
0.1克中性肥皂,即成孢子菌丝悬液,用卫生喷雾器均匀喷布在麦苗上。同时设一不喷菌液而喷无菌水的作对照,用塑料罩保湿48小时,揭布后正常管理,7天后作发病调查。 (三)涂抹法(小麦秆锈病) 这也是气流传播的病害常用的接种方法,用于禾本科锈病接种。方法是用姆指沾锈菌夏孢子悬液自下向上轻轻涂欲接种的小麦叶片,也可先用手指沾水摩擦叶片,使叶表有一层水膜,然后将夏孢子粉抹在上面,以不涂抹孢子悬液或孢子粉的作为对照。塑料罩保湿48小时后揭布,正常管理,7天后作发病调查。 (四)创伤接种法(白菜软腐病及梨褐腐病) 创伤接种法是伤口侵入的弱寄生菌常用的接种方法。 1.白菜软腐病:取切成适当大小的白菜帮两块、经水洗,待水稍干后,以10%漂白粉溶液作表面消毒,分放在两个灭过菌的上下铺有吸水纸的培养皿中,用酒精擦过的玻璃棒顺着白菜帮打三排不穿透的孔穴。将培养好的白菜软腐病菌斜面菌种的菌苔以无菌水洗下作成菌悬液。然后,先以灭过菌的兽用注射器吸取无菌水滴于菜帮的第一排内孔作为对照,再用该注射器吸菌液滴于第二、三排孔内。注意无论无菌水、还是菌液都不要滴的过多。以免流出孔穴,另一培养皿的菜帮以同法处理作为重复。盖好皿盖,置于26—28℃的温箱中,24小时后检查发病情况。 2.梨褐腐病:取白梨以酒精火焰表面消毒后,用炽热的解剖刀,在其上切成小手指粗的孔穴3
植物内生菌
植物内生菌是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和 器官内部的微生物,被感染的宿主植物不表现出外在病症,可通过组织学方法或从严格表面消毒的植物组织中分离或从植物组织内直接扩增出微生物DNA的方法来证明其内生。它不仅包括互惠共利的和中性的内共生微生物,也包括那些潜伏在宿主体内的病原微生物,这些微生物有细菌、真菌、放线菌等。自1898年Vogl从黑麦草种子内分离出第一株内生真菌以来,植物内生菌作为一种新的微生物资源受到了广泛的关注,从内生菌中寻找和发现新的活性化合物已成为国内外研究的又一热点。近年来,该领域的研究已取得一定进展,发现了一些有医用、农用价值的菌株和化合物。 1. 内生真菌 从牧草中分离得到的内生真菌香柱菌,所产生的波胺碱和黑麦草碱类物质对昆虫具有杀伤作用,对牲畜等脊椎动物无毒。Strobel等从雷公藤的茎中分离得到一株内生真菌,能产生一种肽类抗生素Cryptocandin,它能抑制灰葡萄孢)等一些植物病原真菌,分离自同一内生真菌的一种新酰胺生物碱cryptocin对稻瘟病菌(及其他多种植物病原真菌有强的抑杀作用。纪丽莲等人从黄海海岸低盐药用植物芦竹中分离得到一株木霉属的内生真菌,它对黄瓜灰霉病菌有较强的抑菌活性。 2. 内生细菌 从辣椒中分离出的一株内生枯草芽孢杆菌,该菌株分泌的抗菌多肽对热稳定,在中性PH范围较稳定,并抗紫外线照射,对植物炭疽病菌和番茄青枯病菌等多种植物病原真菌和细菌有强的抑制作用。 3. 内生放线菌 链霉菌属于放线菌,它占具有生物活性的植物内生放线菌的绝大部分。澳大利亚Coombs研究小组从小麦根部分离的60多株放线菌中筛选到防治小麦全蚀病的菌株,在温室试验中可使小麦全蚀病的危害降低70%。Strobel等在蛇藤中分离到一株新的链霉菌,它能产生4种新的广谱抗生素Munumbicins A、B、C和D,这些抗生素对多种人体和植物致病霉菌、细菌及疟原虫具有广泛的抑杀活性。最近,Strobel等又从一种有叶蕨类植物中分离到一株新内生链霉菌,它能产生一种被称为kakadumycins的新型抗菌素,对炭疽芽孢杆菌和疟原虫均具有抑杀活性,其生物活性比棘霉素强。从卫矛科植物分离的内生链霉菌产生的新chloropyrrol抗生素对多种耐药性细菌和分枝杆菌有抑制活性。从杜鹃花植物中分离的链霉菌产生新的抗真菌物质fistupyrone,对植物病原真菌甘蓝黑斑交链格孢有抑制作用。李萌等从油菜和芹菜的茎和叶中分离得到215株内生菌,18株对蔬菜立枯丝核菌、直啄镰刀菌、苹果黑腐皮壳有很好的拮抗作用,其中有8株为放线菌;从油菜茎中分离出的内生放线菌CHSH19A经鉴定为一株链霉菌Streptomyces sp.,活性筛选结果证明其具有极强的抗立枯丝核菌活性。 植物内生菌是一类次生代谢产物丰富、应用前景广阔的资源微生物。近年来,植物内生菌由于能够产生丰富多样的具有农药活性的次生代谢产物,在自然界中具有重要的生态学作用,引起了人们广泛的关注并取得很大进展。从微生物中寻找发现新型先导化合物,是新农药研制的重要途径。内生菌作为微生物中的重要类群,其物种丰富,数量庞大,这为新农药的研究和开发提供了巨大的资源库。最近一个全面的研究显示,51%的从植物内生菌分离的生物活性物质是以前没有发现的化合物,而从土壤微生物发现的新物质仅为38%。由此
植物内生菌DNA提取方法
在提取植物内生菌之前,植物需要表面灭菌,其具体操作为将植物浸泡在添加了0.02%的Tween-20的质量分数为1%的次氯酸钠溶液中1 min,再将植物浸泡在70%酒精中1 min,然后用硫代硫酸盐/Ringer’s(林格氏液)清洗3次,每.次1 min。根和茎(土表面以上1 cm处)都要灭菌处理,将根茎切成片状。为了更好地分析细菌的位置,灭菌后茎表皮撕下,茎内部按照之前的方法灭菌。表皮组织和根最后一次淋洗液中的细胞都用来提取DNA。 植物不同组织的内生菌群落DNA提取通过直接研磨植物组织,步骤为溶解、提取和纯化步骤(方案一),或者在DNA提取前从片状植物组织中淋洗出细胞(方案二)。 东南景天表面灭菌方法:整株植物用自来水冲洗30 min,用蒸馏水洗3次,每次3 min。用吸水纸吸去植物表面水分,用无菌剪刀在根基部将根系剪下,与植物地上部分开。将根系用70 %酒精浸泡2 min,无菌水洗3次,3 % NaClO浸泡2次,每次1 min,然后用无菌水冲洗3次,每次2 min,最后一次清洗液涂LB平板。 1. 将2 g左右消毒后植物组织于无菌研钵中,加5 mL磷酸钠缓冲液(19.9 g Na2HPO4·H2O,1.27 g NaH2PO4·2H2O,H2O 定容到1 L)研磨至匀浆。 2. 将植物匀浆转移至50 mL无菌离心管中,摇床200 rpm振荡1-2 h,使细菌细胞尽可能的从植物组织中释放出来。 3. 取4 mL悬液于新的无菌离心管中,12 000×g离心10 min收集菌体细胞。 4. 弃上清,将收集的菌体细胞重新溶于550μL 1×TE buffer(Tris-EDTA;pH8)中加入10 mg mL-1溶菌酶10μL,37℃水浴1-4h。 5. 加入50μL 20% SDS和8μL 20 mg mL-1蛋白酶K,混匀,65℃水浴3h,期间轻轻上下颠倒混匀数次。 6. 加入200μL 5M NaCl,涡旋振荡15 s,12000×g离心10 min。 7.取上清液,并向上清液中加入等体积的氯仿-异戊醇(24:1),彻底混匀,12000×g离心10 min。 8. 上清液转移至新的无菌离心管中,重复步骤7一次。 9. 上清液转移至新的无菌离心管中,加入0.6倍体积(0.6 vol)的冰冷的异丙醇,4℃放置1 h。 10. 4℃,12000×g离心10 min,弃上清。 11. 沉淀用70%冰乙醇清洗,离心,弃上清。 12. DNA沉淀室温风干后,用无菌超纯水溶解。 13. DNA纯化采用TIANquick Midi Purification Kit。
植物病原菌分离方法
病原菌分离方法 一、实验原理: 植物患病组织内的真丝菌丝体,如果给予适宜的环境条件,除了个别种类外,一般都能恢复生长和繁殖。植物病原菌的分离就是指通过人工培养,重染病植物组织中将病原真菌与其他杂菌相分开并从寄主植物中分离出来,再将分离得到的病原菌于适宜环境内纯化,这个过程总称植物病原的分离培养。 二、实验用具: 酒精灯、手术剪、镊子、75%酒精、3%~5%次氯酸钠、灭菌水、培养皿、封口膜、乳酸等 三、实验前的准备工作: 1、煮培养基(PDA):马铃薯200g,葡萄糖20g,琼脂粉(AGAR)20g(10:1:1)水1000ml (1)将去皮称量好的马铃薯切片后加水煮沸15~20min(水可以适量多加200ml 左右,因为在煮的过程中会蒸发一些),待土豆煮软即可。 (2)三层纱布滤去马铃薯后将过滤的水倒入洗净的锅中,加琼脂粉搅拌充分后再加热煮沸,小火使其充分融化。 (3)加入葡萄糖并不断搅拌,待其完全融化后双层纱布过滤,定容到1000ml,分装到500ml的玻璃瓶内,每个玻璃瓶最多装300ml,121℃湿热灭菌 30min。 2、培养皿干热灭菌170℃1h;蒸馏水、枪头等湿热灭菌121℃30min。 四、实验步骤: 1、用75%酒精擦拭超净工作台,所有器具用紫外灯灭菌30min,分离室要保持清洁。 2、取样,病斑大小约20个(含病缘线) 3、分装培养基:(1)融PDA,松盖在微波炉中加热约3min(看量多少而定) (2)待冷却至50℃后在超净工作台指示灯显绿灯时分装 (3) 分装时滴入一管乳酸约20滴(每10ml培养基中加3滴乳酸) (4)左手拿培养皿并将皿盖在火焰附近打开一缝,迅速倒入培养基 约15m1(300ml一瓶的培养基倒20多个平板),加盖后轻轻摇动培 养皿,使培养基均匀分布在培养皿底部,然后平置于桌面上,待凝
植物内生菌的研究
植物内生菌的研究 摘要:植物内生菌是植物微生态系统的重要组成部分,在长期的协同进化过程中,与植物形成了互惠互利的关系。植物内生菌能够产生活性物质,可作为生物防治资源、外源基因的载体和新药的来源,在农业、医药卫生领域有着巨大的应用潜力。但是虽然经过几十年的研究,目前植物内生菌的研究仍处于起步阶段,对其开发和应用刚刚展开。 关键词:植物内生菌,发展,应用,问题 植物体内普遍存在着内生菌,由于其生活在没有外在感染症状的健康植物组织内部,因此植物内生菌的存在和作用长期以来未被发现。直到20世纪30年代,由于牲畜食了感染内生真菌的牧草,给畜牧业造成重大损失,才开始对植物内生菌有了初步认识。内生菌一词“endophyte”最早是由德国科学家yDeBerr于1886年提出。1986年,Carrol将植物内生菌定义为生活在地上部分、活的植物组织内不引起明显症状的微生物。1991年,Petrini提出植物内生菌是指生活史的一定阶段生活在活体植物组织内不引起植物明显病害的微生物。1992年,K1eopper等认为植物内生菌是指能够定殖在植物细胞间隙或细胞内,并与寄主植物建立和谐联合关系的一类微生物,并首次提出了“植物理内生细菌”的概念,他认为能在植物体内定殖的致病菌和菌根菌不属于内生菌。 目前,植物内生菌较被公认的定义是指那些在其生活史的一定阶段或者全部阶段生活于健康植物的各种组织和器官内部的真菌或者细菌,被感染的宿主植物(至少是暂时)不表现出外在症状,是一个生态学概念,而非分类学单位。 植物内生菌的研究现状 1. 植物内生菌的生物多样性 植物内生菌的生物多样性主要包括寄主植物种类多样性、内生菌在寄主植物不同部位分布多样性和内生菌自身种类多样性。研究发现植物内生菌广泛存在,地球上300000种植物中都有内生菌的存在。农业上对内生菌研究较多的植物有水稻、小麦、棉花、高粱、牧草、马铃薯、玉米、甘蔗、甜菜、黄瓜、柠檬等。研究发现植物内生菌几乎存在于植物的所有组织中,不仅存在于植物的根、茎、叶、花、果、胚、种子中,在植物的根瘤中也分离到了内生菌。 植物内生菌的种类也十分繁多,主要包括内生细菌、内生真菌和内生放线菌三大类。目前已报道在各种农作物及经济作物中发现的植物内生细菌已超过129种,分属于54个属,主要为假单胞菌属(Pseudomonas)、肠杆菌属(Enterobacter)、芽孢杆菌属(Bacillus)、土壤杆菌属(Agrobacterium)、克雷伯氏菌属(Klebsiella)、泛菌属(Pantoea)、甲基杆菌属(Methylobacterium)等。植物内生真菌主要在药用植物、羊茅属植物、热带树木中研究较多,现在发现的内生真菌主要为子囊菌类(As comycet)及其无性型,包括核菌纲(Pyrenomyetes)、盘菌纲(Discomyetes)和腔菌纲(Loculoascomyetes)等。植物内生放线菌主要在红树林、热带多年生树木及一些药用作物中研究较多,主要为链霉菌属(Streptomyces)、链轮丝菌属(Streptoverticillum)、游动放线菌属(Antinoplanes)、诺氏卡菌属(Nocardia)、小单胞菌属(Micromono sp.ora)。 2. 植物内生菌的动力学研究 植物内生菌的动力学主要指内生菌在植物体内的定殖、分布和运动。内生菌一旦进入植物体内就寻找适合自已生存的组织定殖下来,而不是在各组织间到处扩散。Posada和Vega 认为植物内生细菌主要定殖在细胞间隙。刘忠梅等采用链霉素和利福平抗性标记B946菌株发现B946向茎基部和叶内转移。植物内生菌可以定殖于植物的根毛、叶片、维管组织、木质部的表皮细胞、细胞间隙、细胞质中等。内生菌可以很容易地穿过植物皮层进入木质部导管中,随着植物的生长可以将内生菌运送到植物上部营养器官或繁殖器官中。而有些内生菌定殖在植物种子内,成为“种生内生菌”,成为下一代植物新植株内生菌的重要来源。
植物病原菌分离方法
第四章植物病原菌分 离与纯化 植物病原菌 一、植物病原菌分离流程 二、分离的准备 ?分离的准备工作 无菌室操作前保持清洁无菌 接种工作准备 培养基的准备 ?分离材料选择 以收获的材料从病健交界处采样 果实腐烂从开始腐烂处分离 根腐和枯萎层可能从离土较远处分离
有些枯萎如野火病被固定在局部,从病斑边缘分不到等 有些材料污染严重时可先接种再分离:即将病组织接种到健康材料等 发病后分离 ?组织表面消毒 ⑴升汞:1‰ ◆升汞1g HCl(浓)25ml 水1000ml ◆升汞先溶于盐酸中,加水后稀释,也 可用NaCl 5g/L 代替盐酸,但易沉淀 ◆作用:盐酸,NaCl增加溶解度,HCl 能增强杀菌能力。 ◆处理时间:30’S-30min不等,常3 -5min;所需时间因材料不同而异, 消毒后灭菌水3-5次 附在组织表皮的气泡,含使消毒剂不能与寄生表面直接通气影响消毒 效果,除气泡抽气、70%酒精浸2 -3秒
⑵漂白粉 ◆常用表面消毒剂适用于病组织表面消 毒,也可处理种子 ◆成分:漂白粉10g,水140ml,过滤后使 用。 ◆最好现配现用,放久失效,有效成分 CaClO次氯酸钙 ◆好的消毒液易使有色纸褪色,且产生氯 气有强烈臭味。 ◆一般3-5min,时间长短因材料不同而 不同。处理种子5-10min,长的可达20 -30min。 优点:杀菌能力强,具有挥发性,不会遗留在组织上影响分离结果,其杀菌能力小于升汞。 (3)酒精:70%,浸很短时间(几秒到1min)灭菌水洗。 ◆较大的材料在酒精中浸或棉花 擦,然后在火焰烧去。 ◆幼嫩的病组织,表面用药剂消毒 时可能会同时杀死其中的病原真
药用植物内生放线菌的分离和生物学特性
药用植物内生放线菌的分离和生物学 特性 摘要:【目的】探索药用植物内生环境可培养放线菌的分离、培养方法,总结药用植物内生放线菌的生物学特 性,探讨其物种多样性,挖掘新的微生物资源。【方法】采用10 种分离培养基对37 个新鲜的药用植物样品 进行内生放线菌的分离;通过比较,选择适合植物内生放线菌生长的培养条件;根据菌落形态和细胞特征观 察结果,选择其中174 株菌测定16S rRNA 基因序列,分析药用植物内生放线菌的多样性;应用Biolog GEN III 微孔培养、API 50CH 以及API ZYM 试剂条测试27 株代表菌株的生理生化特性。【结果】分离得到940 株植物内生菌,分属于47 个属,30 个科,其中放线菌600 余株,分属于34 个属,共发现潜在的新分类单元有 7 个;本研究中药用植物内生放线菌的培养条件是:PYG 培养基、pH7. 2、28℃-32℃;菌株间的生物学特性的 差异与菌株系统进化关系呈正相关关系;不同环境植物的内生菌菌株的生物学特性差异较大,相同环境的不 同植物内生菌的生物学特性差异较小。【结论】药用植物内生放线菌物种丰富多样;药用植物内生放线菌在 唯一碳源利用、发酵碳源产酸及酶学活性等生理生化特性方面没有表现出和宿主植物的直接相关性,而是呈 现出和宿主植物的地理分布有一定的相关性。 关键词:药用植物,内生放线菌,生物学特性,多样性 中图分类号:Q939 文献标识码:A 文章编号:0001-6209 (2013)01-0015-09 药用植物有着独特的药理活性,特别是在治疗一些疑难病症上有着不可替代的作用。如茵陈主治 黄疸型肝炎、肝硬化、肝腹水等肝病;狼毒主治结核、 气喘等,还具有抗肿瘤的作用。药用植物的有效成 分的提取和研究一直是国内的热门课题。1993 年, 美国蒙大拿州立大学的Stierle 研究小组首次从短叶 紫杉(Taxus breviforlia)中分离得到一株能合成抗癌 物质紫杉醇的内生真菌新种安德氏紫杉霉菌 (Taxomyces andreanae) [1] ,并证明内生菌具有合成 与宿主植物相同或相似的活性成分的功能。由此掀 起了对药用植物内生菌研究的热潮。《微生物学通 报》编辑部的郝荣乔于2009 年初对2008 年的年度 点评中报道“植物内生菌成为我国当前微生物研究 领域的热点” [2] 。的确,药用植物内生菌的研究和 有效开发对药用植物资源、特别是濒危植物资源的 保护具有重要的意义。 本研究选取采集自北京、贵州、云南和西藏等地 的药用植物样品37 份,经过表面消毒处理后,应用 放线菌分离培养技术从中分离放线菌菌株;根据菌 株的16S rRNA 基因序列信息以及系统进化关系, 探讨药用植物内生放线菌的物种多样性;通过生理 生化实验测定,揭示药用植物内生放线菌的生物学
植物内生真菌的分离
植物内生真菌的分离 一、实验目的 1.理解内生真菌存在的普遍性和多样性 2.掌握常规的微生物分离纯化方法 3.掌握分菌过程中的一些基本操作技能 二、实验原理 植物内生真菌( Endophyte) 是指那些在其生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部的真菌或细菌,而宿主植物一般不表现出外在的症状。所有植物中几乎都存在内生菌. 由于植物内生真菌与宿主在长期的进化过程中形成了特殊的生态关系,因而内生真菌能产生与宿主相同或相似的具有生理活性的次生代谢产物,从内生菌中寻找和发现新的活性化合物越来越成为微生物次生代谢产物的研究热点之一。 采用微生物学常规的组织分离法从植物中分离内生真菌 三、实验材料 板蓝根新鲜健康的叶片 试剂:次氯酸钠、无水乙醇、葡萄糖、琼脂、青霉素、链霉素 培养基:PDA培养基、分离培养基 四、实验步骤 (一)、配制PDA培养基 10月27号晚上:
(1)配置PDA培养基,用电子称称取去皮的土豆100g,煮沸30min,4层纱布过滤,滤液加热,加入琼脂7.5克,琼脂完全融化后加入葡萄糖10g,待稍冷却后加水至500毫升。 (2)准备10瓶无菌水,每瓶150ml左右。 (3)包好烧杯,培养皿,涂布棒等实验仪器,等待消毒。 (二)、配制分离培养基 28号中午: (1)配置分离培养基,将PDA培养液均分成两份,一份备用,另一份待高温灭菌后,加入青霉素100mg/L、链霉素200mg/L的混合液20ml,即得到分离培养基。 (2)用消毒后的培养皿在通风橱中倒平板,注意在整个过程中保证无菌操作。 (三)、采集新鲜板蓝根叶片 28号晚上到实验室外采集新鲜健康叶片完整的板蓝根叶片。(四)、植物组织表面消毒 28号晚上将新鲜、健康的板蓝根叶片于自来水下冲洗干净,用吸水纸吸干表面水分后剪成小段(片)做如下表面消毒处理:75%酒精漂洗3min,无菌水冲洗4~5次,5%次氯酸钠溶液漂洗叶3min,无菌水冲洗4~5次,无菌滤纸吸干水分。 (五)、接种并培养 28号晚上: (1)将上述表面消毒后的材料剪切成0.5cm 2 小块,放入含
分离植物内生真菌操作流程
分离植物内生真菌操作流程 1.材料准备:植物样本、剪刀、镊子、70%乙醇、3%次氯酸钠(本实验用4%84)、 酒精灯、计时器、平板、锥形瓶,无菌水,离心管(带盖,灭菌)、打开无菌操作台灭菌30min。 (1)植物样本的采集:选取生长状态良好,不要有病斑或者枯枝烂叶,每种植物采取三株标本,要带有叶子、叶柄和枝条及其他部位,将样本名字写在 小纸条上放在装标本的袋子里,采下来的标本与写有名字的纸条一同拍照,样本上有脏东西时,请用纸轻轻擦掉,若不清楚植物名字,请将整棵植物 拍照留用于鉴定,并做好相关记录。 (2)制作PDA固体培养基,在无菌操作台中倒平板,每瓶250ml的培养基大概倒15个板,待其凝固后用于接种。 2.清洗:认真用清水将标本洗净,洗去标本表面的灰尘,去除枯叶,备用。 3.取样: (1)在叶片的左上、右上、左下,右下和正中五个部位进行取样,剪取5mm*5mm的叶片,如果是叶柄或枝干,则剪取5~10mm,若是比较 粗的枝干或圆圆的果实之类的,总之比较大的,则将它切开,再剪取 样本,样本不要剪的太大或太小。 (2)每种植物的叶子,叶柄,枝干等其他部位,每种部位接种两块板,大板每个要接种五个样本即左上、右上、左下,右下和正中,小板每个 接种四个样本即左上、右上、左下,右下,计算好所要剪的样本数, 尽量多剪几个,以免后面的表面灭菌中冲洗时被冲掉。 (3)若植物标本有剩余,且是没有洗过的,重新装好,放到冰箱里,备用,洗过的扔掉。 (4)每种植物标本所剪的样本放在一个50ml的离心管中,放在试管架上,并且每个离心管上要标好所对应的植物标本。 4.表面灭菌:在无菌操作台中进行 (1)先向各离心管内倒入适量(10~20ml)70%乙醇,拧紧盖子,用计时器开始计时1min,每10秒钟晃动离心管几次,使其充分灭菌。 (2)1min后,拧松盖子,将乙醇倒入事先准备的锥形瓶中,注意不要将管
植物内生放线菌的分离方法_陈华红
放线菌研究专栏 植物内生放线菌的分离方法* 陈华红1,2 杨 颖1 姜 怡1 唐蜀昆1 徐丽华1** (云南大学省微生物研究所 昆明 650091)1 (楚雄师范学院化学与生命科学学院 楚雄 675000)2 摘要:植物内生放线菌是一类大有开发潜力的微生物资源。目前使用的分离条件和技术尚 不完善,容易被外源菌和内生真菌、细菌污染,因此内生放线菌尤其是稀有内生放线菌的 选择性分离技术至少是今后一段时间研究的重点。介绍了植物内生放线菌选择性分离方法 并提出值得研究的问题。 关键词:植物内生放线菌,分离方法 中图分类号:Q939 文献标识码:A 文章编号:0253 2654(2006)04 0182 04 1 植物内生放线菌的定义及其研究意义 对植物内生菌的定义一直争议较多,Bacon和W hite作出了一个较普遍接受的定义:植物内生菌(endophy tes)是指在其生活史的一定阶段或[1]全部阶段生活于健康植物组织内部或细胞间隙、不引起植物产生明显病症的微生物。植物与其内生菌构成了稳定的共生关系。 植物茎和叶的化石提供的证据表明,植物与其内生菌之间的内生关系早在高等植物出现在地球上的时候就已存在了。在植物与内生菌长期的协同进化中,建立了独特的遗传与代谢关系。由于植物与内生菌相互间基因交换的结果,使内生菌具有产生某些与植物相同或相似化合物的能力,因此,可作为天然活性物质的重要来源。地球上有数十万种植物,每一种都有一种或多种内生菌与之共生,但只有几百种植物的内生菌被较为全面的研究过。因此,从大量未研究过的植物中发现新内生菌种的机率较高。而新物种通常都会有新的功能基因,新基因又意味着新的天然产物。研究表明,近来发现的新的生物活性物质有51%分离自内生菌的新物种,而仅有38%来自土壤微生物[2]。最容易分离到的内生菌是真菌和细菌。由于放线菌的生长较慢,分离比较困难,必须用特殊的具有高度选择性的分离条件才能分离到。 放线菌属于细菌域放线菌门,是抗生素、酶和酶抑制剂等生理活性物质的主要产生菌。迄今为止,微生物产生的2万多种生物活性物质(如抗生素等),有近60%~ 80%是放线菌产生的[3]。初步的研究证实,从植物内生放线菌已经分离到多种新抗生 *国家973项目(N o 2004CB719601) 国家自然科学基金项目(No 30270004、30560001) **通讯作者 Te:l0871 *******,Fax:0871 *******,E m ai:l li hxu@ynu edu cn 收稿日期:2006 03 08,修回日期:2006 04 18
植物病原真菌的分离培养精选文档
植物病原真菌的分离培 养精选文档 TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
实验十三植物病原真菌的分离培养 一、实验原理 植物患病组织内的真菌菌丝体,如果给予适宜的环境条件,除个别种类外,一般都能恢复生长和繁殖。植物病原菌的分离就是指通过人工培养,从染病植物组织中将病原真菌与其它杂菌相分开,并从寄主植物中分离出来,再将分离到的病原菌于适宜环境内纯化,这个过程总称植物病菌的分离培养。植物病原真菌的分离一般都是采用组织分离法,就是切取小块病组织,经表面消毒和灭菌水洗过后,移到人工培养基上培养。 二、实验目的: 植物病原菌的分离培养是植物病理学实验最基本的操作技术之一,它对原害鉴定,病原形态观察、植物病害接种体的培养等方面都是经常使用的研究手段。通过本实验,要求植物病原菌分离培养的一般原则和方法。 三、实验材料及准备: 1.分离材料:梨黑斑病(Alternaria kikuchiana),柿树圆斑病(Pestnlotia sp)及杉木炭疽病(Glomerella cingolata)新发病的病叶;杨树烂皮病(Cytospora chrysosperma)国槐腐烂病(Dothiorella sp.)的带有新病斑的枝条;油松种子。 2.分离用具(每小组为单位)
酒精灯4个,手术剪4把,眼科镊4把,PDA培养基3瓶,培养皿 (Φ9cm)24套,小烧杯(5ml)4个,大烧杯1个,斜面培养基12管,灭菌水4瓶,75%酒精瓶1个(内放脱脂棉球)%升汞瓶1个,5%乳酸瓶(60ml)1个,火柴1盒,湿、干纱布各4张。 四、实验方法及步骤: (一)、分离前的准备工作: 1.工作环境的清洁和消毒 分离培养一般在无菌室、无菌箱或无菌工作台(超净工作台)上进行,无菌室和无菌箱要经过喷雾除尘,并用药物或紫外线照射消毒(常用消毒药物为70%酒精,2%煤酚皂液,5%石炭酸液等喷雾。若用紫外线灯照射则需20-30分钟)。在没有上述设备条件时,在清洁房间里关闭门窗,避免空气流动,经过喷雾除去空气及地面灰尘后进行操作,也可获得较好的结果。工作前擦净桌面,最好铺上湿纱布。将所需用的物品按次序放在工作台上,避免工作时走动,工作人员最好穿上灭菌后的工作服,带上口罩,并用肥皂洗手,用70%酒精或%新洁尔灭擦手。 2.分离用具的消毒 凡是和分离材料接触的器皿(刀、剪、镊、针等)都要随时(至少在使用时)保持无菌,将这些用具浸于70%酒精中,使用时在灯焰上灭菌烧去酒精,如此2-3次(刀、剪、镊等不宜在灯焰上烧时过长,以防退火)。再次使
植物内生细菌3
植物内生细菌3 冯永君① 宋 未② ①博士生,首都师范大学生物系,北京100037 ②研究员,博士生导师,首都师范大学生物系,北京100037 3国家自然科学基金资助项目(批准号:39770023) 关键词 植物内生细菌 植物微生态学 内共生固氮 植物内生细菌是指能定殖在健康植物组织内,并与植物建立了和谐联合关系的一类微生物,有生物防治、植物促生和内共生固氮作用.在农业生产过程中,由于农药和化肥的大量使用以及农田耕作的单一化,使植物和土壤中微生物的多样性大为减少.在人们日益重视人与自然和谐相处的今天,研究和利用植物内生细菌对于替代或减少农药和化肥的使用,改善农业生态系统,保持植物微生态系统的生物多样性以及维护农田生态平衡实现可持续发展都有重要意义. 一、引 言 植物内生细菌名称的由来是经历了几十年的发展才逐渐形成的.起初,人们对健康植物组织中存活的微生物并未引起重视,但后来越来越多的微生物(特别是细菌)从植物的根、茎、叶、穗中分离出来,人们才意识到这些从植物中分离的微生物可能与植物存在某种相互关系.随着对这类微生物研究的不断深入,1992年克洛珀[1]第一次提出了“植物内生细菌”(endophytic bacteria)的概念.植物内生细菌是指能定殖在健康植物组织内,并与植物建立了和谐联合关系的一类微生物.内生细菌在植物体内的定殖是一个主动过程,定殖细胞必须是活的和能增殖的;定殖后的内生细菌不会对植物造成实质性的危害症状[2]. 虽然植物内生细菌概念提出的时间尚短,然而这一概念一经提出就立刻引起了微生物学家、植物学家和微生态学家以及作物学家的广泛关注.首先,这是因为内生细菌概念的提出完全打破了人们对植物组织的传统认识:传统的观念一直认为健康的植物组织内是无菌的.虽然在1992年克洛珀提出内生细菌的概念之前的几十年的发展时间里,已从植物组织内越来越多地分离了许多微生物,但人们还是认为这是一些潜在的植物病原菌,因而始终未引起广泛关注和高度重视.克洛珀总结了前人的工作将这些“内生细菌”作为一个概念提出后,才使人们意识到不得不抛弃以前的所谓“潜在的植物致病菌”的片面性见解,重新面对这个新鲜事物.因而可以说植物内生细菌概念的提出是植物微生物学学科发展的一次革命.内生细菌的研究已成为植物微生态学和微生物学学科交叉的新的生长点. 其次,人们不禁要问,为什么植物体内要含有这些细菌呢?它们的行为是怎样的,有何应用价值?一些初步的研究已经证实,内生细菌在植物体内不仅积极地生存着,而且还能产生多种生物学作用,如固氮作用,促进植物生长作用和对病虫害的防治作用等[3].这些研究结果的公布立即让生态学家和作物学家兴奋起来.人们注意到植物-内生细菌这种和谐共生,互利共栖的生命形式,可能是未来生态型农业发展的一条重要思路.所以,开展植物内生细菌的研究不仅对植物微生物学科的基础研究有重要的理论价值,而且对农业可持续发展也有重要的实践意义. 二、植物内生细菌和植物之间的关系 目前关于植物内生细菌和植物之间的关系的认识上,主要有两种观点.一种是传统的观点,认为植物内生细菌是潜在的植物致病菌.研究者从植物病理学的角度着手,研究重心是单个微生物及其致病性,目的在于分离内生细菌,鉴定致病性,阻止其进入周围环境.通过这方面的研究发现,多数植物内生细菌有潜在的植物致病性,它们在侵染健康植物时,不表现实质性的致病症状,但当无病症的健康植物偶然受到来源于生物的或非生物的胁迫条件的威胁,以及受到突然恶劣的环境变化的冲击而造成植物自身的防御功能严重削弱时,一部分内
植物病原真菌的分离培养
实验十三植物病原真菌的分离培养 一、实验原理 植物患病组织内的真菌菌丝体,如果给予适宜的环境条件,除个别种类外,一般都能恢复生长和繁殖。植物病原菌的分离就是指通过人工培养,从染病植物组织中将病原真菌与其它杂菌相分开,并从寄主植物中分离出来,再将分离到的病原菌于适宜环境内纯化,这个过程总称植物病菌的分离培养。植物病原真菌的分离一般都是采用组织分离法,就是切取小块病组织,经表面消毒和灭菌水洗过后,移到人工培养基上培养。 二、实验目的: 植物病原菌的分离培养是植物病理学实验最基本的操作技术之一,它对原害鉴定,病原形态观察、植物病害接种体的培养等方面都是经常使用的研究手段。通过本实验,要求植物病原菌分离培养的一般原则和方法。 三、实验材料及准备: 1.分离材料:梨黑斑病(Alternaria kikuchiana),柿树圆斑病(Pestnlotia sp)及杉木炭疽病(Glomerella cingolata)新发病的病叶;杨树烂皮病(Cytospora chrysosperma)国槐腐烂病(Dothiorella sp.)的带有新病斑的枝条;油松种子。 2.分离用具(每小组为单位) 酒精灯4个,手术剪4把,眼科镊4把,PDA培养基3瓶,培养皿(Φ9cm)24套,小烧杯(5ml)4个,大烧杯1个,斜面培养基12管,灭菌水4瓶,75%酒精瓶1个(内放脱脂棉球)0.1%升汞瓶1个,5%乳酸瓶(60ml)1个,火柴1盒,湿、干纱布各4张。 四、实验方法及步骤: (一)、分离前的准备工作: 1.工作环境的清洁和消毒 分离培养一般在无菌室、无菌箱或无菌工作台(超净工作台)上进行,无菌室和无菌箱要经过喷雾除尘,并用药物或紫外线照射消毒(常用消毒药物为70%酒精,2%煤酚皂液,5%石炭酸液等喷雾。若用紫外线灯照射则需20-30分钟)。在没有上述设备条件时,在清洁房间里关闭门窗,避免空气流动,经过喷雾除去空气及地面灰尘后进行操作,也可获得较好的结果。工作前擦净桌面,最好铺上湿纱布。将所需用的物品按次序放在工作台上,避免工作时走动,工作人员最好穿上灭菌后的工作服,带上口罩,并用肥皂洗手,用70%酒精或0.1%新洁尔灭擦手。 2.分离用具的消毒 凡是和分离材料接触的器皿(刀、剪、镊、针等)都要随时(至少在使用时)保持无菌,将这些用具浸于70%酒精中,使用时在灯焰上灭菌烧去酒精,如此2-3次(刀、剪、镊等不宜在灯焰上烧时过长,以防退火)。再次使用时必须重复灭菌。培养皿、试验等要
(完整)植物氮的高效利用
植物氮的高效利用 氮是植物生长所必须的大量元素之一。土壤中氮素的丰缺和供给状况直接影响着植物的生长水平。高效利用氮素对植物生长有着重要意义。 一、氮素高效利用的生理生态机制 氮素的利用效率从两方面来衡量。一方面是指植株在同等的供氮水平下吸氮量的大小;一方面是指对已吸收的氮素利用率的高低,即单位吸收氮素所生成的干物质的多少。总的来说氮素的利用效率从氮的高效吸收生理机制和氮的高效利用生理机制两方面来衡量。 氮素的高效吸收主要在于根系对养分的吸收功能以及地上部物质的反馈作用。土壤中的氮素需经过植物根系才能进入植物体内。根系发达、生长量、分布密度、有效吸收面积较大、根系扎入土层较深的植物,能够利用深层土壤氮素,减少硝态氮淋洗损失; 另外高吸收效率的品种会产生形态的变化而提高吸收氮素的能力。根吸收功能的发挥还与根系活力有关。根系活力衡量指标主要有根对TTC 还原强度、根对α-萘胺的氧化强度、根系伤流量,以及活跃吸收面积等。反馈作用中,根部吸收的氮素绝大部分在叶片中同化。同化氮素的酶活性越强地上部光合产物积累的越多。这些光合产物通过韧皮部运输到根部为根系吸收氮素提供了能量来源,从而有利于根系对氮素的吸收。 植物中氮的高效利用与几个生理机制密切相关。1)氮代谢过程中的关键酶氮素同化的氨基酸是植物中重要的氮素运输载体;2)氮素转运能力促进茎叶氮素向籽粒的转运,减少氮素在非经济产物中的残留;遇氮素逆境时,可将衰老叶片的氮素再分配到生长点去,维持植株正常生长,并且避免生育后期的氨挥发损失;3)液泡中硝酸盐的再利用成熟植物细胞液泡中硝酸盐浓度较高,使之高程度再利用,不仅可以提高植物氮素利用效率,而且可以降低植物体内硝酸盐含量。 二、氮高效品种的培育 C4作物比C3作物氮利用率高主要是由氮营养基因控制的遗传差异引起的。同种作物内基因型的改善可提高氮利用率。因此,通过培育氮高效利用品种或选育新品种来适应低氮水平是氮高效利用的根本途径。分子生物学技术的发展为研究植物氮素效率遗传行为提供了新的手段。迄今,在分子水平上对不同形式的氮素转运蛋白及氮代谢相关酶类的研究有了很大的进展。进一步的发展应该从形态、生理、分子水平逐步深入系统地研究。目前,中国科学院遗传研究所已把带有固氮基因的质粒PRD1 从大肠杆菌K12jc5564 导入到无固氮能力的水稻根系菌4502Y 中,表现出较强的固氮能力。
植物内生菌研究进展
植物内生菌研究进展 李能章,彭远义 3 (西南农业大学动物科技学院,重庆400716) 摘要:就近年来在环境因子对内生菌的影响,代谢物质的多样性,基因工程在植物内生菌方面的应用,宿主-内生菌-内生菌间的关系等方面的研究作一简要综述。 关键词:植物内生菌;环境因子;代谢物质;基因工程;相互关系 中图分类号:Q935,Q945117 文献标识码:A 文章编号:1004-311X (2004)02-0069-03 收稿日期:2003-06-27;修回日期:2003-09-30 作者简介:李能章(1975-),男,硕士生,专业方向:分子微生物学;3联系人:彭远义(1965-),男,博士,硕士生导师。 植物内生菌的研究起始于19世纪中叶,De Bary (1886)首先提出植物内生菌一词“endophyte ”,在其后的几十年中,先后在几种牧草植物中发现了内生真菌,对植物内生菌并没有进行更深入的研究,直到1977年Bacon 等人发现高羊茅内生真菌与牛的中毒症状相关后,才引起广泛关注,在其后的十几年时间,侧重于草本植物内生菌研究,特别是对感染内生菌的牧草对草食动物的影响以及对食叶虫的影响方面研究。20世纪90年代以后,在植物内生菌方面的研究范围扩大了,不仅仅局限于牧草植物内生菌的研究,也从其他不同植物中分离内生菌,研究其生物多样性,生物学作用,侵染途径以及与宿主之间的关系等,特别是1993年S trobel 首次报道了从短叶紫杉(Taxus brevifo 2lia )的树皮中分离出一株内生真菌(Taxomyces andreanae )能产生紫杉醇(tax ol )[1],对植物内生菌又有了更深的了解,掀起了从植物内生菌中寻找新物质的热潮,一些新的抗肿瘤、抗菌、抗虫物质先后从内生菌中分离出来,在研究植物内生菌的过程中引入了现代分子生物技术,从而使对内生菌的研究进入了分子水平。植物内生菌来源于外界环境微生物,以不同方式进入植物组织中,通过水平和垂直方式进行传播,其遗传与代谢都由于与宿主在长期共同进化过程中相互作用而有别于外界环境微生物。几乎所有的植物中都有生活的内生菌,现仅仅对极少数植物内生菌进行了完全的研究,因此从植物内生菌中寻找到新物质几率是很大的,并且植物内生菌本身作为新的微生物资源也具有广泛的研究价值。 1 环境因子对植物内生菌的影响 植物内生菌生活在活体植物组织中,其生长代谢受多方面因素制约,不仅受到宿主植物的影响,外界环境因子也是其重要影响因素,外界环境变化影响植物生长代谢,间接影响到内生菌生物多样性与生长代谢。1.1 对其生物多样性的影响:自然环境因素如季节温度变化、光照、雨水、空气湿度等都会影响到植物内生菌的多样性,M o 2 cali S (2003)等[2] 人调查研究两株榆树不同季节内生菌的动态变化,以4、6、9、12月作为调查时间,通过植物器官和植物的纤维蛋白酶的变化参数,揭示了其内生菌的波动变化是受温度(冷热)的影响。环境污染物质同样会影响植物内生菌的生物多样性,Danti R (2002)[3]在研究植物Fagus sylvatia L 的枝梢暴露于S DBS 浮质中其内生真菌的多样性和数量的变化时,发现枝梢中内生真菌的多样性和数量随其暴露时间的延长而减少,S DBS 作为一种人工合成的阴离子去垢剂,可能是被S DBS 处理的植物其叶的蜡质层被降解,同化能力和叶片水分蒸腾作用的变化导致内生菌的减少,这是环境作用于植物而影响其内生菌的多样性,还有一些化学物质并不影响植物的生长代谢,但却直接影响内生菌的数量和多样性,如一些人工合成的杀虫剂、杀菌剂。现今工业污染物不仅对动物植物造成极大的伤害,同时也对植物内生菌资源造成极大的破坏,一种植物的灭绝就意味着大量的内生菌的消失。1.2 对内生菌生长代谢的影响:环境因子影响植物内生菌的多样性的同时影响着内生菌的生长代谢,Maccheroni Jr W (1998)等[4]研究了植物内生菌刺盘孢霉在营养缺陷时其磷酸酶的合成与分泌状况,研究表明,pH5.0酸性磷酸酶和Mg 2+-depen 2dent pH7.5磷酸二酯酶在任何生长状况下都恒量表达,在磷饥饿时,pH6.0酸性磷酸酶表达分泌胞外,而碱性磷酸酶的表达为另一独特模式,在磷丰富或氮饥饿时,表达pH 10.0胞内碱性磷 酸酶,但在又缺氧或硫源时,其表达就会被阻。T ejera NA (2003)[5]等调查了一些非生命因素如干燥、热、盐等对内生菌G luconacetobacter diazotrophicus 的生长和生物学活性影响,结果表明,这株菌可以忍耐热处理和耐盐,但其固氮酶活性和碳代谢酶类活性会受到高NaCl 浓度的影响。环境除对内生菌酶的产生极其活性的影响之外,还影响着内生菌的次生代谢,如降低对感染内生真菌的高酥油草和多年生黑麦草的收割次数和增加其牧草的高度会使内生真菌生物碱代谢增加(Salminen S O ,et al .2002,2003)[6] 。 2 代谢物质的多样性 植物内生菌的生物多样性决定其代谢物质的多样性。现有研究表明,从植物中分离出的内生菌能代谢多种活性物质,其中一些是新物质,具有特殊生物活性。2.1 抗癌类物质:从某些植物中分离出的某些内生菌能代谢具有抗肿瘤活性的物质,美国的S trobel (1993)等首次从短叶紫杉(Taxus brevifolia )的树皮中分离出能产生紫杉醇(tax ol )的内生真菌(Taxomyces andreanae ),其后,其他学者又从其它植物中分离到内生菌能产生不同作用机理的抗癌新物质。2.1.1 引起癌细胞凋亡类物质:从植物Pinus species 的针叶活组织中分离出的内生真菌Hormonema dematioides 产生一种新的真菌物质horm onmate (1),能诱导结肠癌细胞系C O LO -320程序化细胞死亡,同时对结肠癌细胞系D LD -1和HT -29和五种其它的人的癌细胞系H L -60、JURK AT 、HEP -G 2、MCF -7、HeLaS 2 都有毒作用(Filip P ,et al ,2003)[7] 。2.1.2 破坏癌细胞微丝物质:从植物Ficus Microcarpa L 的树皮中分离到的内生真菌产生一种新的生物碱nom ofungin ,能破坏哺乳动物细胞的微纤丝(Ratnayaka As ,et al ,2001)[8]。2.1.3 癌细胞分裂抑素:Wagenaar M M (2000)等[9]从来源于传统药用植物雷公藤的内生真菌Rhinocladiella sp.的培养液中分离出3种新的生物碱(cytochalasins ),是具有细胞毒作用的细胞分裂抑素,实验结果表明它们对多种人肿瘤细胞有很强的抑制作用。2.1.4 酶抑制剂:从内生菌中分离的物质具有抑制引起细胞产生癌变的病毒的酶的活性,从而起到防止癌症,G uo B (2000)等人[10]就从内生菌Cytonama sp.的固态发酵中分离出两种新的人细胞巨化病毒蛋白酶抑制剂cytonic acidA (1)和B (2)。 2.1.5其它类抗癌物质:S tierle DB (1999,2003)等[11] 从北美红杉中分离的内生真菌寄生曲霉(Aspergillus parasiticus )产生系列抗肿瘤活性物质sequoiatone A -F 和另一类新的C 架系列物质se 2 quoiam onascinsA -D 。Wagenaar M M (2001)等[12] 从濒临灭绝的薄荷Dicerandra frutescens 中分离出的内生菌Phomopsis longicolla 产生3种新的具有抗肿瘤活性的二聚物dicerandrolsA 、B 和C 。 Brady SF (2000)等[13] 从一种内生真菌中分离出二种新物质cy 2toskyrinsA 和B ,破坏DNA 和抑制DNA 合成,具有在抗癌方面应用的潜力。张玲琪等分别从植物长春花(Catharanthus roseus )、桃儿七(Sinopodophyllum hexandrum )等植物中分离到产抗癌药物长春新碱和鬼臼毒素类似物的内生菌,从美登木叶中分离到1株球毛壳菌,从该菌的发酵产物中提取出抗癌活性物质球毛壳甲素A 。 从以上可以看出,植物内生菌代谢多种抗肿瘤物质,它为寻找新的抗肿瘤物质提供了新的微生物资源,具有广阔应用前景。2.2 产生抗菌类物质:作为产生抗菌类物质的微生物,植物内生菌是一大类群,能产生多种具有不同抗菌活性的物质,对植物、人和动物病原菌有抑制活性。产生抗植物病原菌物质的内生菌由于产生的抗生素类物质存在于植物体内,所以更有利于 第14卷第2期:692004年4月 生 物 技 术BI OTECH NO LOGY V ol 114,N o 12:69 Apr 12004
