生物化学资料

吴老师,我整理的很认真的!麻烦您帮我看一下啊!谢谢!非常感谢!
22章糖酵解
1.试比较:EMP途径中,由葡萄糖分解为乳酸或乙醇,这两条代谢途径有何异同点?
人肌肉中,葡萄糖在被分解为丙酮酸的基础上,被进一步还原为乳酸;在酵母菌中,葡萄糖被分解为丙酮酸后,可脱羧生成乙醛,乙醛再还原为乙醇,称生醇发酵。
2.由葡萄糖经EMP途径到乳酸(或乙醇)的产能情况及获能效率?
①1摩尔G →2摩尔乳酸,已知:反应共放热196KJ(47千卡),而1摩尔A TP水解放能30.514KJ(7.3千卡),求获能效率?
解:η=(2×30.514)×100%/196=31%
②1摩尔G→2摩尔乙醇,已知:反应共放热56千卡,求获能效率?
解:η=(2×7.3)×100%/56=26%
23章TCA循环
1糖有氧氧化进行的场所?
糖有氧氧化中,丙酮酸以后的氧化在线粒体中进行。原核细胞则在细胞膜上进行。2.柠檬酸循环中,第一和第二次氧化脱羧分别是哪2个反应?
草酰琥珀酸仍在异柠檬酸脱氢酶作用下,脱羧生成α-酮戊二酸。
α-酮戊二酸的氧化脱羧能量贮存在琥珀酰辅酶A的高能硫酯键中,同时又产生NADH+H+和二氧化碳各一分子。
3.丙二酸抑制细胞呼吸的机理
丙二酸是琥珀酸的结构类似物,是琥珀酸脱氢酶的竞争性抑制剂。
4.柠檬酸循环回补反应的主要途径(只要写大标题就好了吗?)
1.丙酮酸的羧化:丙酮酸在丙酮酸羧化酶的催化下,羧化生成草酰乙酸.动物、植物和微生物中,还存在由苹果酸酶和苹果酸脱氢酶联合催化,以NAD+为辅酶,由丙酮酸生成草酰乙酸的反应
2.磷酸烯醇式丙酮酸的羧化:
3.天冬氨酸和谷氨酸等的转氨基作用:
24章生物氧化
1.生物氧化的特点:生物都需能量维持生存,能量一般来自体内糖类、脂肪、蛋白质等
有机物的氧化。有机物在生物体内氧化成CO2和H2O,并释放能量生成ATP的过程,称生物氧化。是生物生命活动中最重要、最基本的供能方式。
2.两条典型的呼吸链:
●NADH呼吸链:NAD+→FMN→COQ→Cytb→Cytc1→Cytc→Cytaa3→O2
●FADH2呼吸链:FAD→COQ→Cytb→Cytc1→Cytc→Cytaa3→O2
3.化学渗透假说的主要内容:(括号里的要要吗?)
●P.Mitchell认为,电子传递的结果是将H+从线粒体基质中“泵”出到内膜外,形成跨
内膜的H+梯度;此梯度中蕴含的势能可促使ATP的生成。(电子传递链是个H+泵,可将H+从线粒体基质中泵出内膜外,在内膜内、外形成H+梯度,积累起电化学势能。被泵出的H+ 被H+浓度梯度趋使,通过A TP合酶的H+离子通道又流回线粒体基质,此释放自由能的反应与ATP合成反应相偶联。)
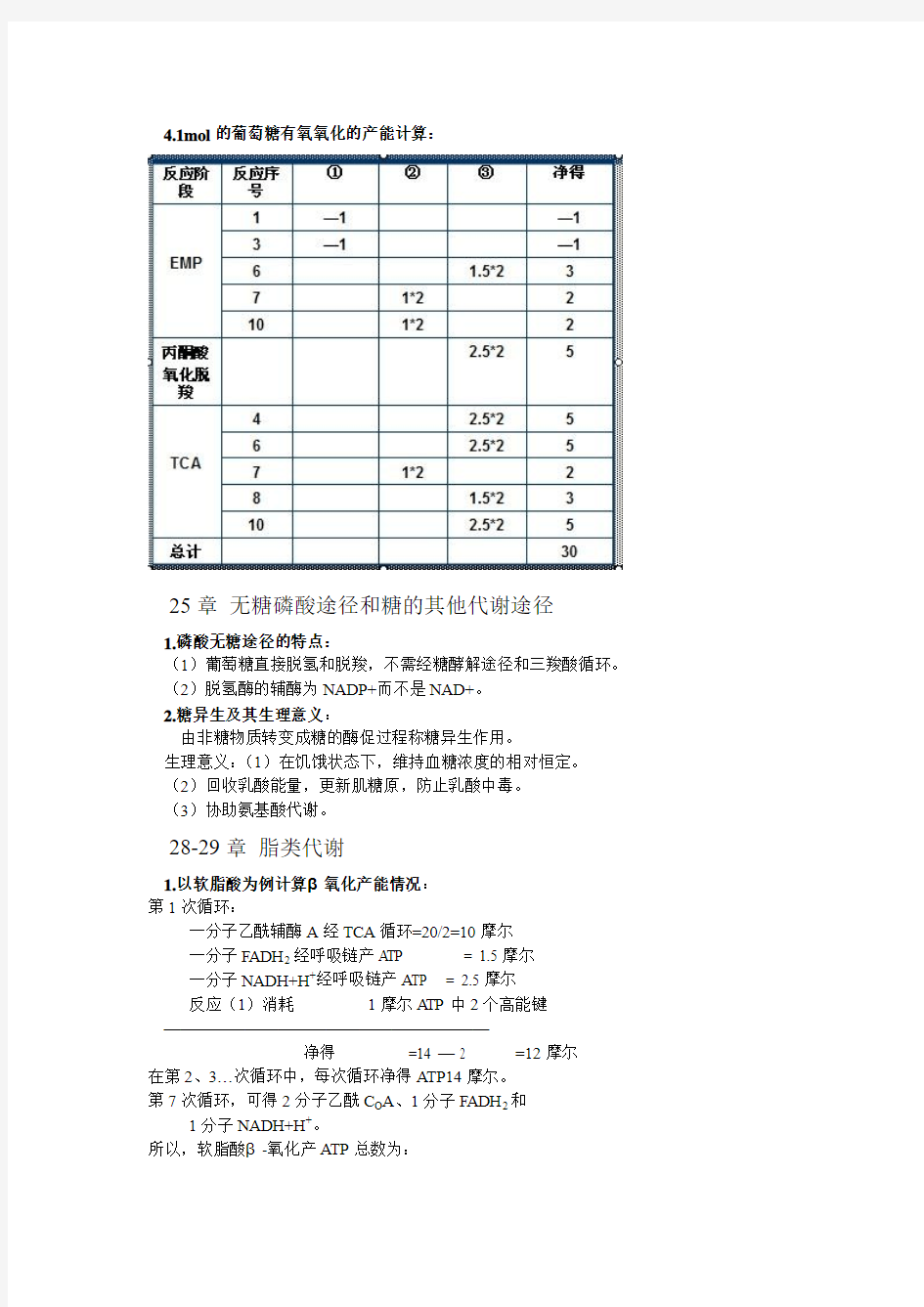
4.1mol的葡萄糖有氧氧化的产能计算:
25章无糖磷酸途径和糖的其他代谢途径
1.磷酸无糖途径的特点:
(1)葡萄糖直接脱氢和脱羧,不需经糖酵解途径和三羧酸循环。(2)脱氢酶的辅酶为NADP+而不是NAD+。
2.糖异生及其生理意义:
由非糖物质转变成糖的酶促过程称糖异生作用。
生理意义:(1)在饥饿状态下,维持血糖浓度的相对恒定。(2)回收乳酸能量,更新肌糖原,防止乳酸中毒。
(3)协助氨基酸代谢。
28-29章脂类代谢
1.以软脂酸为例计算β氧化产能情况:
第1次循环:
一分子乙酰辅酶A经TCA循环=20/2=10摩尔
一分子FADH2经呼吸链产ATP = 1.5摩尔
一分子NADH+H+经呼吸链产A TP = 2.5摩尔
反应(1)消耗1摩尔ATP中2个高能键————————————————————
净得=14 — 2 =12摩尔
在第2、3…次循环中,每次循环净得A TP14摩尔。
第7次循环,可得2分子乙酰C O A、1分子FADH2和
1分子NADH+H+。
所以,软脂酸β-氧化产A TP总数为:
12+14×5+(14+10)=106摩尔A TP
1摩尔软脂酸完全氧化为CO2+H2O时,可放能9790.56KJ(或2340千卡),产能效率η=(106×30.514)×100%/9790.56或(106×7.3)×100%/2340=33%
2.含有奇数及偶数个碳原子的脂肪酸分别如何经β-氧化作用被彻底分解(偶数的还要不要?我不知道该怎么写?老师请您帮我写一下!谢谢!)
奇数个碳原子的脂肪酸,经β-氧化会产生若干分子乙酰辅酶A及1分子丙酰辅酶A。
乙酰辅酶A进入TCA循环
丙酰辅酶A在动物体内代谢如下:丙酰辅酶A先经羧化生成D-型甲基丙二酰辅酶A,再经2次异构化而生成琥珀酰辅酶A。此物为柠檬酸循环反应6的产物,最终进入TCA循环被分解。
3.什么是酮体,其生成有何生理意义?
酮体是肝脏、肾脏中脂肪酸代谢所特有的、脂肪酸未被彻底氧化的中间产物。
意义:【1】. 肝外组织对酮体的利用:酮体为肝外组织提供了可利用的能源。
【2.】酮体是脂肪酸加工的“半成品”:酮体分子量小、水溶性较强、便于运输,有利于肝外组织对酮体的利用。
【3.】酮体代谢紊乱:酮血症、酮尿症、酸中毒。恶性循环。
4.脂肪酸合成中乙酰辅酶A为何须经转运?如何转运?
?乙酰COA的生成都是在线粒体内进行,而大部分脂肪酸的合成发生在线粒体外。生成的乙酰COA又不能直接透过线粒体膜到细胞质中去,因此需经转运。
如何转运:1动物机体中,可在ATP供能的情况下,以柠檬酸穿梭方式将乙酰COA转运到线粒体内。动物体内的乙酰COA,也可借酰基载体:肉碱的作用,将其上的乙酰基转运出线粒体外。
2植物体内,线粒体内产生的乙酰COA先脱去辅酶A基团,以乙酸的形式被运出线粒体;在线粒体外,再由脂酰COA合成酶催化,乙酸重新生成乙酰COA。
5.脂肪酸从头合成与β-氧化作用的主要不同点。
6.线粒体位与内质网中脂肪酸C链延长系统作用的异同点{这题不太确定,感觉不太完整,请老师指教!}
异处:在线粒体中:此合成酶系多作用于中等长度的脂肪酸加长,产物多为具18个碳的脂肪酸,如:硬脂酸。
此体系可用于延长饱和及不饱和脂肪酸的碳链,但只能用于催化延长,不能用于合成新链。
在内质网中:延长的主要产物是硬脂酸,也可继续延长至22-24个碳。可催化延长饱和及不饱和脂肪酸链,可用于催化延长及合成新链。
同处:线粒体和内质网内2种催化延长的酶系,脂肪酸碳链的延长都是以2个碳原
子为单位逐步增长的。
30-32章蛋白质的降解和氨基酸的分解代谢
1.脱氨基作用的主要分类:(要不要解释一下的?)
(1)转氨基作用
(2)氧化脱氨基作用
(3)其他脱氨基作用应
(4)联合脱氨基作用
2.氨基酸如何经脱羧基作用分解代谢?
氨基酸脱羧后生成的CO2,大部分直接排出细胞外,小部分被固定成为细胞内的组成成分。
氨基酸脱羧的另一产物:胺,一部分具有药物作用,但绝大多数胺类对动物有毒。
动物体内具有胺氧化酶,可继续氧化胺为醛及氨;醛被进一步氧化为脂肪酸,再沿脂类代谢途径分解。
3.为何患缺乏尿素循环酶类的病人无法食用蛋白质?如何治疗?为何这种病人的中枢神经系统及肝脏易受毒害?(这题我归纳的太罗嗦了,能不能帮我修改一下老师!)
(1)为什么不能食言蛋白质:其蛋白质代谢中产生的氨无法转化为尿素排出,只能以氨的形式积累在体内。高浓度游离氨对排尿素的脊椎动物机体,尤其是对其中枢神经系统有很大毒害。
(2)如何治疗:将病人膳食中的蛋白质换成必需氨基酸相应的α-酮酸,便可得到治疗。原因:α-酮酸与血液中积累的氨结合,生成α-氨基酸,从而缓解了氨的高浓度积累。(3)为何这种病人的中枢神经系统及肝脏易受毒害:
对中枢神经的毒害:氨浓度较高时,线粒体中发生:
NH3+α-酮戊二酸+NADH+H+
←→谷氨酸+NAD++H2O
α-酮戊二酸同时又是柠檬酸循环中反应(6)的底物。所以游离氨与柠檬酸循环争夺α-酮戊二酸并占优势,使柠檬酸循环因缺乏中间产物:α-酮戊二酸而被迫减慢速度甚至停顿下来,使与柠檬酸循环紧密联系的呼吸链也受影响,从而使对O2浓度最敏感的中枢神经系统表现出缺氧。
对肝脏的毒害:在病人肝脏中,因柠檬酸循环的停顿而使脂类代谢中产生的乙酰辅酶A 无法彻底氧化分解,只能转变为酮体。酮体中多为酸性物质,若在血液中过量积累,会使血液pH值下降,出现酸中毒现象
4.生糖氨基酸:在代谢中可以作为丙酮酸、葡萄糖和糖原前体的氨基酸。
生酮氨基酸:经过代谢能产生酮体的氨基酸。
生糖兼生酮氨基酸:指在体内既能转变成糖又能转变酮体的一类氨基酸。包括色氨酸、异亮氨酸、苏氨酸、苯丙氨酸、酪氨酸。
5.必需氨基酸:人体自身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸。
非必需氨基酸:人或动物机体能自身合成,不需通过食物补充的氨基酸
6.按合成起始物,氨基酸如何分类:
?谷氨酸族氨基酸:由柠檬酸循环中间产物α-酮戊二酸衍生而来的氨基酸。
?天冬氨酸族氨基酸:由草酰乙酸衍生而来的氨基酸。
?丙酮酸族氨基酸:由糖酵解产物:丙酮酸衍生而来的氨基酸。属于这族的氨基酸有丙氨酸、缬氨酸。
?丝氨酸族氨基酸:由糖酵解中间产物:3-磷酸-甘油酸衍生而来的氨基酸。
?芳香族氨基酸:由磷酸戊糖途径中间产物:4-磷酸-赤藓糖和糖酵解中间产物:磷酸烯醇式丙酮酸衍生而来的氨基酸。
?组氨酸:合成起始物是5-磷酸-核糖。
7.生成谷氨酸的重要途径:
.1.由α-酮戊二酸形成谷氨酸:
α-酮戊二酸与游离氨在L-谷氨酸脱氢酶催化下发生氨基化作用。
动物体内,L-谷氨酸脱氢酶可利用NAD+/NADH和NADP+/NADPH两类辅酶。
2.先由α-酮戊二酸氨基化生成L-谷氨酸,再由L-谷氨酸生成谷氨酰胺。接着由谷氨酸合酶催化,α-酮戊二酸接受来自L-谷氨酰胺的酰胺基,生成谷氨酸。
8.芳香族氨基酸合成的共同途径:
芳香族氨基酸:由磷酸戊糖途径中间产物:4-磷酸-赤藓糖和糖酵解中间产物:磷酸烯醇式丙酮酸衍生而来的氨基酸。
9.酰胺类如何合成:(老师我找不到!希望您提示一下)
10.氨基酸之间相互转化的实例。(不确定???)
丙酮酸分别与酮丁酸及活性乙醛缩合,缩合产物都经加氢还原、脱水及与谷氨酸的转氨基,最终生成异亮氨酸和缬氨酸。
谷氨酸+丙酮酸=丙氨酸+α-酮戊二酸(GTP)(可逆)
谷氨酸+草酰乙酸=天冬氨酸+α-酮戊二酸(GOP)(可逆)
33-36章核酸的降解和核苷酸的代谢
1.核酸降解过程:
核酸酶核苷酸酶核苷酶
核酸←→核苷酸←→磷酸+核苷←→碱基+戊糖
2.核酸内切酶及外切酶的比较:
?外切酶是作用于核酸链的一端,逐个水解下核苷酸的核酸酶为核酸外切酶。为非特异性核酸酶,对于RNA、DNA及低分子量寡核苷酸等底物都能分解。
?内切酶是能水解核酸分子内部磷酸二酯键的磷酸二酯酶称核酸内切酶
?限制性核酸内切酶:细菌体内存在着一类能识别并水解外源双链DNA的核酸内切酶,称“限制性内切酶”。
3.核苷酸合成的主要途径:
?(1)从氨基酸、Pi、核糖、CO2和NH3等简单化合物合成核苷酸,此途径经过从碱基到核苷的中间阶段,称“从头合成或从无到有途径”;
?(2)由核酸分解的中间产物:碱基和核苷再转变为核苷酸,称“补救途径”。
?细胞中,当从头合成途径不能满足生长需要时,一般都能经补救途径合成新核苷酸。
4.为什么氨基蝶呤和氨甲喋呤能抑制核苷酸合成
四氢叶酸在核苷酸生物合成中,起到重要作用。
某些叶酸的结构类似物,如:氨基蝶呤、氨甲蝶呤等,对二氢叶酸还原酶具有竞争性抑制作用,从而阻止四氢叶酸生成,最终抑制了亚甲基转移反应,使胸苷酸合成被阻断,干扰DNA 的合成。
5.嘌呤嘧啶从头合成的个分子来源:
其他核苷酸如何经RNP,UNP转化而来(不知道如何归纳!!)
胞嘧啶核苷酸的合成:
(1)UMP磷酸激酶、Mg2+
UMP + ATP ←→UDP + ADP
(2)UDP激酶、Mg2+
UDP + ATP ←→UTP + ADP
(3)CTP合成酶、Mg2+
UTP+NH3+ATP+H2O ←→CTP+ADP+Pi
第3步氨基化反应若在细菌中进行,可直接用NH3氨基化;动物组织中,则由谷氨酰胺提供酰胺基进行氨基化,并生成谷氨酸。
2.胸腺嘧啶核苷酸的合成:
合成过程:先由UMP还原,生成dUMP;再在嘧啶环C5上甲基化而成。
6.两条核苷酸合成的补救途径
A.由嘧啶碱和核苷合成核苷酸:
即嘧啶核苷酸合成的补救途径,也有2条:
(1)第一条补救途径:
这条途径,只有尿嘧啶和胸腺嘧啶能使用。因为在动物及微生物细胞中,只存在尿嘧啶和胸腺嘧啶磷酸核糖基转移酶。
反应式如下:
尿嘧啶+ PRPP ←→UMP + PPi
(2)第二条补救途径:
这条补救途径在嘧啶核苷酸合成补救途径中起重要作用。
第一步反应中,游离尿嘧啶、胞嘧啶很少被利用。而胸腺嘧啶的第一步反应,除真菌外,在其他所有生物体内均能进行。
(1)胸苷磷酸化酶
胸腺嘧啶+ 1-磷酸-脱氧核糖←→脱氧胸苷+ Pi
(2)核苷激酶
嘧啶核苷+ A TP →嘧啶核苷酸+ ADP
B.由嘌呤碱和核苷合成核苷酸:
将嘌呤碱基和嘌呤核苷再用于核苷酸生物合成,即补救途径。
嘌呤核苷酸合成的补救途径有2条:
(1)第一条补救途径:以腺苷酸的合成。
腺苷磷酸化酶
腺嘌呤+ 1-P-R←→腺苷+ Pi
腺苷磷酸激酶
腺苷+ ATP ←→AMP + ADP
此途径在生物体内不重要。
(2)第二条补救途径:
游离嘌呤碱基可在磷酸核糖转移酶催化下,直接和PRPP反应,生成5’-核苷酸。
腺嘌呤(A)+ PRPP ←→AMP + ppi
鸟嘌呤(G)+ PRPP ←→GMP + ppi
次黄嘌呤(I)+PRPP ←→IMP + ppi
磷酸核糖转移酶在人类嘌呤核苷酸代谢中地位重要。
人类的Lesch Nyhan综合症就是由于患者先天性缺乏次黄嘌呤-鸟嘌呤磷酸核糖转移酶而造成的。
7.核苷酸还原酶系的组成及其还原的过程
还原酶系的组成:(不清楚)
过程:以大肠杆菌为例,核糖核苷酸在NDP水平上被还原。
以AMP为例:AMP激酶
AMP + ATP ←→ADP + ADP
核苷二磷酸再在核糖核苷酸还原酶作用下,被还原型硫氧还蛋白所还原,脱下核糖C2-OH上的氧,生成脱氧核苷二磷酸。
还原型硫氧还蛋白转变为氧化型,并可在硫氧还蛋白还原酶催化下,由NADPH + H+ 供氢,再被还原为还原型,循环参加反应
8.解释,复制,转录,翻译
“复制”指以亲代DNA分子双链为模板,按照碱基配对原则,合成与亲代DNA分子相同的两个双链DNA分子的过程。
“转录”是以DNA分子中一条链为模板,按照碱基配对原则,合成一条与模板DNA互补的RNA分子的过程。
“翻译”又称“转译”,是指在mRNA指令下,按照三联体密码原则,把mRNA上遗传信息转换成蛋白质中特定氨基酸顺序的过程。
9.什么是Klenow片段?它有何功能?
用枯草杆菌蛋白酶处理DNA聚合酶Ⅰ,可得到相对分子量分别为68000和35000的两个片段。较大的片段称Klenow片段,它同时具有5’→3’聚合酶(用于DNA链催化延长)及3’→5’核酸外切酶的活性(如果碱基错配,以便于错配的碱基的矫正);
10.什么半保留复制,半不连续复制,及其原因(老师帮我简化一下,我感觉写太多了)
?在每个子代分子中,都有一条链来自亲代DNA,另一条链则是新合成的。这种复制方式称“半保留复制”。
形成原因:DNA复制过程中,亲代DNA的两条链先解螺旋并分离,每条链各自作为模板,按照碱基互补配对原则,各合成新的互补链。
?前导链连续复制、滞后链不连续复制的现象,称“DNA的半不连续复制”。
形成原因:复制延伸过程:复制叉由左至右移动。上方亲代模板链由左至右的方向为3’
→5’,子链便由左至右沿5’→3’方向连续合成,即合成方向与复制叉移动方向相同。此新链称“前导链”。下方模板链上,子链也按5’→3’方向合成,但它随复制叉右移而由左至右、不连续地合成若干个冈崎片段,再由DNA连接酶将这些片段连成一条完整的DNA 新链,此链称“滞后链”。(有冈崎片段形成)
11.大肠杆菌中的DNA聚合酶Ⅰ、Ⅱ和Ⅲ的主要异同点
?DNA聚合酶Ⅱ和Ⅲ与Ⅰ的主要相同点:(1)都需模板指导,以四种脱氧核苷三磷酸为底物,且需具有3’-羟基的引物存在,聚合反应沿5’→3’方向进行。(2)都兼有3’→5’核酸外切酶活力,在聚合中起校对作用。
?3种聚合酶Ⅰ的主要不同点:(1)酶Ⅰ具有5’→3’核酸外切酶活力,酶Ⅱ和Ⅲ没有这种活力。(2)酶Ⅱ和Ⅲ最适合作用于有小段缺口的双链DNA;酶Ⅰ最适合作用于具有大段单链区的双链
12.DNA复制的特点:
(1)复制方式为半保留复制。
(2)细菌或病毒的DNA复制起始于一个特定位点,真核细胞染色体DNA的复制有多处起始点。
(3)复制大多双向进行,少数单向。双向复制时,两个复制叉的前进速度不一定相同。
(4)复制时,每条链均沿5’→3’方向延长。
(5)复制需RNA引物,后被切除。
(6)复制过程为半不连续的。
13.DNA损伤修复的种类及定义(定义是否完整或累赘?)
(一)错配修复:
DNA复制中可能发生错配,若能及时校正,则新链上基因编码的信息可得到恢复,即进行错配修复。
(二)直接修复:
包括光修复系统和暗修复系统。
(三)切除修复:
切除修复指在酶的作用下,将DNA分子中受损部分切除,再以完整的那条链为模板,合成被切掉的部分,使DNA恢复正常结构。包括切开、切除受损部分、修补及封口4步。
(四)重组修复:
带缺口的子链与完整姐妹双链中的亲代链重组交换,用来自姐妹双链的正常DNA片段填补子链上缺口。姐妹双链中亲代链上的缺口,以完整子链为模板,由DNA聚合酶催化修复合成。最后由DNA连接酶将新合成的片段连接到缺口处。
(五)应急反应(SOS)和易错修复:
SOS反应是细胞在DNA受损或复制系统受抑制的紧急情况下,为求生存而表现出的应急效应。此修复系统包括避免出错的修复和倾向出错的修复2类。
14.为什么RNA转录为不对称转录?
染色体上各基因的负链并不一定在同一条DNA单链上,转录时仅以DNA一条链的某一区段作为模板,因此又称“不对称转录”
15.大肠杆菌RNA聚合酶的主要亚基及其功能?和RNA聚合酶的催化反应条件?
α亚基上有β亚基结合位点,功能是进行全酶装配及与DNA模板上的启动子区结合。
β亚基上有底物NTP结合部位,功能是结合NTP底物、引发RNA新链合成及催化延长。
β’亚基可与DNA模板结合,且与转录的终止有关。
σ亚基上有DNA启动子识别位点,可进行启动子识别,促进转录起始,又称“起始亚基”
条件:真核生物RNA聚合酶也按照DNA模板链的指令转录,不需引物,沿5’→3’方向合成,无核酸外切酶的校对功能,底物为NTP等。
16.大肠杆菌终止子的类型:
以原核生物大肠杆菌为例,其DNA上有2类终止子。
一类是不依赖于ρ因子的终止子,又称简单终止子。另一类为依赖于ρ因子的终止子。
17.大肠杆菌tRNA前体的转录后加工,真核生物mRNA前体的一般加工
tRNA前体的转录后加工包括:由核酸内切酶或外切酶切除前体链5’-和3’-末端的多余核苷酸序列;由核苷酰转移酶催化,在前体链的3’-末端添加CCA三核苷酸序列,作为翻译时氨基酸的结合部位;在一系列专一性酶促反应中对碱基、核糖等进行特征性修饰;
等等。
5'-端加帽:
真核生物mRNA前体的一般加工:真核生物mRNA前体的加工其实主要指hnRNA的加工。
加工过程包括:在5'-端形成特殊的帽子结构,在3'-端添加多聚腺苷酸(即polyA)尾巴,剪除内含子并将外显子拼接起来,对链内特定核苷酸进行甲基化修饰;等等。hnRNA 的5’-端原是三磷酸嘌呤核苷,转录开始后三个磷酸中被脱去一个,成为二磷酸。
此物质与脱去一分子焦磷酸的GTP作用,使鸟嘌呤戊糖的C5与原嘌呤核苷酸戊糖C5间以3个磷酸键相连。
此物质5'-端鸟嘌呤N7上被S-腺苷甲硫氨酸(SAM)甲基化,形成帽子结构。
加尾:
mRNA3’-端多聚腺苷酸尾巴的产生过程可能:由RNA酶Ⅲ催化,在hnRNA的3’-端切断。再在多聚腺苷酸聚合酶作用下,以带3'-端-OH的RNA为受体,以ATP为腺苷酸供体,以Mg2+或Mn2+为辅助因子,将3'-端进行多聚腺苷酸化。除酵母外的多数高等真核生物及病毒mRNA在近3'-端处,都有一段保守序列AAUAAA。推测,此保守序列是为3'-端的切断及继续发生多聚腺苷酸化提供了信号
37-38章遗传密码
1.遗传密码字典:
AUG除编码甲硫氨酸外,还是肽链合成的起始密码子。少数情况下,也有以GUG作为起始密码子的。一般由UAA、UAG和UGA这三组密码子作为多终止密码子,但它们不编码氨基酸。UUU是编码苯丙氨酸的密码子。CCC是脯氨酸的密码子,AAA是赖氨酸的密码子。
2.遗传密码的基本特征:(小标题下面的可以省略吗?)
(1)方向性:密码子的阅读方向和mRNA上从起始信号到终止信号的方向一样,均为从5’-端到3’-端。
(2)简并性:密码表的64组密码子中,除UAA、UAG和UGA三组为终止密码子外,其余61组密码子分别代表20种氨基酸。象这样编码同一种氨基酸的密码子称“同义密码子”。这种现象称“密码的简并性”。
(3)通用性:病毒、原核生物或真核生物都共同使用同一套密码字典。这种现象称“密码的通用性”。
(4)读码的连续性:在mRNA链上,从起始信号到终止信号,密码子的排列一般是连续的。即密码子间既没有重叠也不存在间隔,即无标点性。
(5)起始密码子和终止密码子:AUG除编码甲硫氨酸外,还是肽链合成的起始密码子。
少数情况下,也有以GUG作为起始密码子的。一般由UAA、UAG和UGA这三组密码子作为多终止密码子,但它们不编码氨基酸。
(6)变偶性:密码子的专一性主要取决于前2位碱基,而第三位碱基重要性相对较低,可以有一定程度的变动。称“变偶性”。
3.tRNA结构中的主要位点:
①tRNA上3'-端CCA序列上的氨基酸接受位点,②识别氨酰-tRNA合成酶位点,③核
糖体识别位点,④反密码子位点。
4.蛋白质生物合成的五大阶段:
(1)氨基酸的活化
(2)肽链合成的起始:
3)肽链的延伸:
(4)肽链合成的终止与释放:
(5)翻译后加工:
39章基因表达调控
1.基因表达的调节可在转录水平:
(包括转录前、转录中和转录后)或在翻译水平(包括翻译中和翻译后)上进行。
2.以乳糖操纵子为例,介绍什么叫操纵子,其上各基因的功能?
?在细菌基因组中,编码一组在功能上相关的蛋白质的几个结构基因,和共同的控制位点所组成的一个基因表达的协同单位,合称操纵子。
功能:大肠杆菌乳糖操纵子的基因组成
乳糖操纵子包括三个结构基因Z、Y和A,其控制位点包括调节基因R、启动基因P、操纵基因O及终止基因t。
①启动基因P提供转录起始信号,同时也是RNA聚合酶的结合位点。
②操纵基因O和其下游的结构基因紧密结合,也可和调节基因的表达产物:阻遏蛋白结合。
③调节基因R可经转录、翻译产生阻遏蛋白。阻遏蛋白控制着操纵基因的开或关。
④三个结构基因Z、Y、A可经转录、翻译,产生蛋白质产物,即三种酶:β-半乳糖苷酶、β-半乳糖苷透性酶和β-半乳糖苷转乙酰酶。
⑤终止基因t提供转录的终止信号。
3.介绍酶合成的诱导作用和阻遏作用的机理以及两者的异同。
酶合成的诱导作用:
如:大肠杆菌乳糖操纵子模型。
酶合成的诱导作用过程:乳糖操纵子中的三个结构基因Z、Y、A是作为一个单位,同时进行转录和翻译。转录时,由RNA聚合酶结合到启动基因上,然后右行经过操纵基因,同时开始转录三个结构基因,最后,转录过程终止于终止基因。
1).调节基因经转录、翻译,生成阻遏蛋白,有活性的阻遏蛋白会结合到操纵基因上,使RNA聚合酶不能再结合到启动基因上,从而阻止下游三个结构基因的转录。
2).当培养基中有乳糖存在时,乳糖作为诱导物,可与阻遏蛋白优先结合,生成二者复合物,使阻遏蛋白变构,失去活性,无法再与操纵基因结合,则阻遏作用消失。RNA聚合酶可以结合到启动基因上并右行,正常转录三个结构基因,并翻译产生三种酶蛋白分子。
酶合成的阻遏作用:
如:大肠杆菌色氨酸操纵子模型,色氨酸操纵子包括5个结构基因,
过程:单独存在的阻遏蛋白无活性,不能与操纵基因结合,即不能阻遏结构基因合成各种酶
蛋白。当有辅阻遏物存在时,阻遏蛋白可与辅阻遏物结合,使阻遏蛋白被活化而变构。该复合物反而可与操纵基因相结合,使之被封闭,RNA聚合酶无法右行,导致结构基因不能合成相应的酶蛋白。
两者的异同点:酶合成的诱导和阻遏作用是相似机制的两种不同表现形式。
不同点:①诱导作用是在各种分解酶中的通则,阻遏作用则是在合成酶中的通则。
②诱导物一般是代谢过程中的底物,辅阻遏物一般是代谢过程中的产物。二者都作为
阻遏蛋白的拮抗物,但拮抗作用的最终结果刚好相反。
相同点:①目的都是控制酶合成的速度。②作用都具高度特异性。
4.降解物阻遏的机理?
当有葡萄糖存在时,葡萄糖的降解物可抑制腺苷酸环化酶活性,激活磷酸二酯酶活性,这两个反应的综合结果都是使得cAMP浓度下降,从而抑制除葡萄糖外的其他糖类代谢酶的转录。反之,当培养基中葡萄糖含量极少时,cAMP浓度上升,则可使除葡萄糖外的其他糖类代谢酶的转录加强,cAMP可与降解物基因活化蛋白CAP相结合。CAP是一种基因表达调节蛋白,它在乳糖操纵子上结合的CAP位点是启动子的一部分,位于RNA聚合酶结合位点上游。
当CAP单独存在时,不能与CAP位点结合;当CAP与cAMP结合成复合物时,才能被活化,从而再与CAP位点结合。其结合到CAP位点上后,可引起启动子中RNA聚合酶结合位点处的DNA片段构象发生变化,从而促进RNA聚合酶与启动子结合,使转录起始更频繁。所以,cAMP浓度的升高可促进其他糖类代谢酶的转录活性。
受到降解物阻遏的包括代谢乳糖、半乳糖、阿拉伯糖、麦芽糖等糖类的酶类操纵子
5.衰减作用机理:图在P565
(A图)当培养基中无任何氨基酸时,前导肽不能形成,前导序列以A图样结构存在。
此结构中1和2、3和4互相配对而形成特殊茎环构象及mRNA链末端的PolyU区都提供了终止信号,促使转录停止。
(C图)当培养基中色氨酸丰富时,前导序列翻译产生前导肽。这时核糖体占据1和2位置,但3和4互补配对了,即形成终止信号,故转录也被终止。
(B图)当培养基中有其他种类氨基酸但色氨酸量不足时,核糖体被阻滞在区域1的Trp 密码子处,导致2和3配对,而3和4不能配对形成终止信号。这样转录可继续进行。
生物化学期末考试试题及答案范文
《生物化学》期末考试题 A 一、判断题(15个小题,每题1分,共15分)( ) 2、糖类化合物都具有还原性( ) 3、动物脂肪的熔点高在室温时为固体,是因为它含有的不饱和脂肪酸比植物油多。( ) 4、维持蛋白质二级结构的主要副键是二硫键。( ) 5、ATP含有3个高能磷酸键。( ) 6、非竞争性抑制作用时,抑制剂与酶结合则影响底物与酶的结合。( ) 7、儿童经常晒太阳可促进维生素D的吸收,预防佝偻病。( ) 8、氰化物对人体的毒害作用是由于它具有解偶联作用。( ) 9、血糖基本来源靠食物提供。( ) 10、脂肪酸氧化称β-氧化。( ) 11、肝细胞中合成尿素的部位是线粒体。( ) 12、构成RNA的碱基有A、U、G、T。( ) 13、胆红素经肝脏与葡萄糖醛酸结合后水溶性增强。( ) 14、胆汁酸过多可反馈抑制7α-羟化酶。( ) 15、脂溶性较强的一类激素是通过与胞液或胞核中受体的结合将激素信号传递发挥其生物() 二、单选题(每小题1分,共20分) 1、下列哪个化合物是糖单位间以α-1,4糖苷键相连:( ) A、麦芽糖 B、蔗糖 C、乳糖 D、纤维素 E、香菇多糖 2、下列何物是体内贮能的主要形式( ) A、硬酯酸 B、胆固醇 C、胆酸 D、醛固酮 E、脂酰甘油 3、蛋白质的基本结构单位是下列哪个:( ) A、多肽 B、二肽 C、L-α氨基酸 D、L-β-氨基酸 E、以上都不是 4、酶与一般催化剂相比所具有的特点是( ) A、能加速化学反应速度 B、能缩短反应达到平衡所需的时间 C、具有高度的专一性 D、反应前后质和量无改 E、对正、逆反应都有催化作用 5、通过翻译过程生成的产物是:( ) A、tRNA B、mRNA C、rRNA D、多肽链E、DNA 6、物质脱下的氢经NADH呼吸链氧化为水时,每消耗1/2分子氧可生产ATP分子数量( ) A、1B、2C、3 D、4.E、5 7、糖原分子中由一个葡萄糖经糖酵解氧化分解可净生成多少分子ATP?( ) A、1 B、2 C、3 D、4 E、5 8、下列哪个过程主要在线粒体进行( ) A、脂肪酸合成 B、胆固醇合成 C、磷脂合成 D、甘油分解 E、脂肪酸β-氧化 9、酮体生成的限速酶是( )
生物化学复习资料
第二章糖类化学 1.糖的概念:糖类物质是多羟基的醇类或醛累化合物及其他们的衍生物或聚合 物。 2.糖的种类可以分为:单糖寡糖多糖结合唐糖的衍生物。 3.根据旋光性分类,可以将自然界中的糖分为D型和L型。规定,已距醛基或 酮基最远的的不对称性碳原子为准,羟基在右的为D型,羟基在左的为L型. 4.还原性二糖:由一分子糖的的半缩醛羟基与另一分子的糖的醇羟基缩合而 成。 5.非还原性二糖:由二分子糖的半缩醛羟基脱水而成。 6.淀粉、糖原、和纤维素的基本结构单元是葡萄糖。 7.凡是能被费林试剂还原的糖都称为还原糖。 8.糖类的生物学功能:提供能量,细胞间的碳骨架,细胞间的的骨架,细胞间 识别和生物分子识别。 第三章蛋白质 1.蛋白质的基本结构单元是氨基酸。 2.大多数蛋白质的含氮量接近16% 3.蛋白质的一级结构是多肽链中氨基酸的排列顺序。 4.氨基酸:分子中含有氨基的羧酸称为氨基酸。 5.氨基酸为两性电解质,当PH等于PI时,氨基酸为兼性离子。 6.肽键是蛋白质中的主要共价键,也称为主键。 7.必需氨基酸:人体中不能合成的,必须从食物中摄取的氨基酸称为必须氨基 酸。 8.必需氨基酸包括:赖氨酸、蛋氨酸、亮氨酸、异亮氨酸、苏氨酸、缬氨酸、 色氨酸、苯丙氨酸。 9.极中性氨基酸包括:丝氨酸、酪氨酸、苏氨酸、谷氨酰胺、半胱氨酸、天冬 酰胺。 10.酸性氨基酸包括:天冬氨酸、谷氨酸 11.碱性氨基酸包括:组氨酸、赖氨酸、精氨酸 12.氨基酸的等电点(PI):在一定PH值得溶液中,氨基酸所带的正负电荷相等, 净电荷为零,此时溶液的PH值称为氨基酸的等电点。(当PH>PI,氨基酸带净负电荷,在电场中向正极移动;当PH<PI,氨基酸带净正电荷,在电场中
生物化学笔记(整理版)1
《生物化学》绪论 生物化学可以认为是生命的化学,是研究微生物、植物、动物及人体等的化学组成和生命过程中的化学变化的一门科学。 生命是发展的,生命起源,生物进化,人类起源等,说明生命是在发展,因而人类对生命化学的认识也在发展之中。 20世纪中叶直到80年代,生物化学领域中主要的事件: (一)生物化学研究方法的改进 a. 分配色谱法的创立——快捷、经济的分析技术由Martin.Synge创立。 b. Tisellius用电泳方法分离血清中化学构造相似的蛋白质成分。吸附层析法分离蛋白质及其他物质。 c. Svedberg第一台超离心机,测定了高度复杂的蛋白质。 d. 荧光分析法,同位素示踪,电子显微镜的应用,生物化学的分离、纯化、鉴定的方法向微量、快速、精确、简便、自动化的方向发展。 (二)物理学家、化学家、遗传学家参加到生命化学领域中来 1. Kendrew——物理学家,测定了肌红蛋白的结构。 2. Perutz——对血红蛋白结构进行了X-射线衍射分析。 3. Pauling——化学家,氢键在蛋白质结构中以及大分子间相互作用的重要性,认为某些protein具有类似的螺旋结构,镰刀形红细胞贫血症。 (1.2.3.都是诺贝尔获奖者) 4.Sanger―― 生物化学家 1955年确定了牛胰岛素的结构,获1958年Nobel prize化学奖。1980年设计出一种测定DNA内核苷酸排列顺序的方法,获1980年诺贝尔化学奖。 5.Berg―― 研究DNA重组技术,育成含有哺乳动物激素基因的菌株。 6.Mc clintock―― 遗传学家发现可移动的遗传成分,获1958年诺贝尔生理奖。 7.Krebs―― 生物化学家 1937年发现三羧酸循环,对细胞代谢及分生物的研究作出重要贡献,获1953年诺贝尔生理学或医学奖。 8.Lipmann―― 发现了辅酶A。 9. Ochoa——发现了细菌内的多核苷酸磷酸化酶 10.Korberg——生物化学家,发现DNA分子在细菌内及试管内的复制方式。(9.10.获1959年的诺贝尔生理医学奖) 11.Avery―― 加拿大细菌学家与美国生物学家Macleod,Carty1944年美国纽约洛克菲勒研究所著名实验。肺炎球菌会产生荚膜,其成分为多糖,若将具荚膜的肺炎球菌(光滑型)制成无细胞的物质,与活的无荚膜的肺炎球菌(粗糙型)细胞混合 ->粗糙型细胞也具有与之混合的光滑型的荚膜->表明,引起这种遗传的物质是DNA 1 / 29
生物化学复习资料
什么是蛋白质的变性作用?引起蛋白质变性的因素有哪些?有何临床意义?在某些理化因素作用下, 使蛋白质严格的空间结构破坏,引起蛋白质理化性质改变和生物学活性丧失的现象称为蛋白质变性。引起蛋白质变性的因素有:物理因素,如紫外线照射、加热煮沸等;化学因素,如强酸、强碱、重金属盐、有机溶剂等。临床上常常利用加热或某些化学士及使病原微生物的蛋白质变性,从而达到消毒的目的,在分离、纯化或保存活性蛋白质制剂时,应采取防止蛋白质变性的措施。 比较蛋白质的沉淀与变性 蛋白质的变性与沉淀的区别是:变性强调构象破坏,活性丧失,但不一定沉淀;沉淀强调胶体溶液稳定因素破坏,构象不一定改变,活性也不一定丧失,所以不一定变性。 试述维生素B1的缺乏可患脚气病的可能机理 在体内Vit B1 转化成TPP,TPP 是α-酮酸氧化脱羧酶系的辅酶之一,该酶系是糖代谢过程的关键酶。维生素B1 缺乏则TPP 减少,必然α-酮酸氧化脱羧酶系活性下降,有关代谢反应受抑制,导致ATP 产生减少,同时α-酮酸如丙酮酸堆积,使神经细胞、心肌细胞供能不足、功能障碍,出现手足麻木、肌肉萎缩、心力衰竭、下肢水肿、神经功能退化等症状,被通称为“脚气病”。 简述体内、外物质氧化的共性和区别 共性①耗氧量相同。②终产物相同。③释放的能量相同。
区别:体外燃烧是有机物的C 和H 在高温下直接与O2 化合生成CO2 和H2O,并以光和热的形式瞬间放能;而生物氧化过程中能量逐步释放并可用于生成高能化合物,供生命活动利用。 简述生物体内二氧化碳和水的生成方式 ⑴CO2 的生成:体内CO2 的生成,都是由有机酸在酶的作用下经脱羧反应而生成的。根据释放CO2 的羧基在有机酸分子中的位置不同,将脱羧反应分为: α-单纯脱羧、α-氧化脱羧、β-单纯脱羧、β-氧化脱羧四种方式。 ⑵水的生成:生物氧化中的H2O 极大部分是由代谢物脱下的成对氢原子(2H),经一系列中间传递体(酶和辅酶)逐步传递,最终与氧结合产生的。 试述体内两条重要呼吸链的排练顺序,并分别各举两种代谢物氧化脱氢 NADH 氧化呼吸链:顺序:NADH→FMN/(Fe-S)→CoQ→Cytb→c1→c→aa3 如异柠檬酸、苹果酸等物质氧化脱氢,生成的NADH+H+均分别进入NADH 氧化呼吸链进一步氧化,生成2.5 分子ATP。 琥珀酸氧化呼吸链:FAD·2H/(Fe-S)→CoQ→Cytb→c1→c→aa3 如琥珀酸、脂酰CoA 等物质氧化脱氢,生成的FAD·2H 均分别进入琥珀酸氧化呼吸链进一步氧化,生成1.5 分子ATP。 试述生物体内ATP的生成方式 生物体内生成ATP 的方式有两种:底物水平磷酸化和氧化磷酸化。
生物化学期末考试试卷与答案
安溪卫校药学专业生物化学期末考试卷选择题 班级 _____________姓名 _____________座号 _________ 一、单项选择题(每小题 1 分,共30 分) 1、蛋白质中氮的含量约占 A 、 6.25% B 、10.5%C、 16% D 、19%E、 25% 2、变性蛋白质分子结构未改变的是 A 、一级结构B、二级结构C、三级结构 D 、四级结构E、空间结构 3、中年男性病人,酗酒呕吐,急腹症,检查左上腹压痛,疑为急性胰腺炎,应测血中的酶是 A 、碱性磷酸酶 B 、乳酸脱氢酶C、谷丙转氨酶D、胆碱酯酶E、淀粉酶 4、酶与一般催化剂相比所具有的特点是 A 、能加速化学反应速度 C、具有高度的专一性 E、对正、逆反应都有催化作用B、能缩短反应达到平衡所需的时间D、反应前后质和量无改 5、酶原之所以没有活性是因为 A 、酶蛋白肽链合成不完全C、酶原是普通的蛋白质E、是已 经变性的蛋白质B、活性中心未形成或未暴露D、缺乏辅酶或辅基 6、影响酶促反应速度的因素 A 、酶浓度B、底物浓度C、温度D、溶液pH E、以上都是 7、肝糖原能直接分解葡萄糖,是因为肝中含有 A 、磷酸化酶 B 、葡萄糖 -6-磷酸酶C、糖原合成酶D、葡萄糖激酶E、己糖激酶 8、下列不是生命活动所需的能量形式是 A 、机械能B、热能C、 ATP D、电能E、化学能 9、防止动脉硬化的脂蛋白是 A、CM B 、VLDL C、 LDL D、 HDL E、 IDL 10、以下不是血脂的是 A 、必需脂肪酸 B 、磷脂C、脂肪D、游离脂肪酸E、胆固醇 11、一分子软脂酸在体内彻底氧化净生成多少分子ATP A、38 B、 131 C、 129 D、146 E、 36 12、没有真正脱掉氨基的脱氨基方式是 A 、氧化脱氨基B、转氨基C、联合脱氨基D、嘌呤核苷酸循环E、以上都是 13、构成 DNA 分子的戊糖是 A 、葡萄糖B、果糖C、乳糖 D 、脱氧核糖E、核糖 14、糖的有氧氧化的主要生理意义是: A 、机体在缺氧情况下获得能量以供急需的有效方式 B 、是糖在体内的贮存形式 C、糖氧化供能的主要途径 D 、为合成磷酸提供磷酸核糖 E、与药物、毒物和某些激素的生物转化有关 15、体内氨的主要运输、贮存形式是 A 、尿素B、谷氨酰胺C、谷氨酸 D 、胺E、嘌呤、嘧啶 16、DNA作为遗传物质基础,下列叙述正确的是 A 、 DNA 分子含有体现遗传特征的密码 B 、子代 DNA 不经遗传密码即可复制而成
生物化学复习资料(人卫7版)汇总讲解
生化复习资料 第一章 一、蛋白质的生理功能 蛋白质是生物体的基本组成成分之一,约占人体固体成分的45%左右。蛋白质在生物体内分布广泛,几乎存在于所有的组织器官中。蛋白质是一切生命活动的物质基础,是各种生命功能的直接执行者,在物质运输与代谢、机体防御、肌肉收缩、信号传递、个体发育、组织生长与修复等方面发挥着不可替代的作用。 二、蛋白质的分子组成特点 蛋白质的基本组成单位是氨基酸 ?编码氨基酸:自然界存在的氨基酸有300余种,构成人体蛋白质的氨基酸只有20种,且具有自己的遗传密码。各种蛋白质的含氮量很接近,平均为16%。 ?每100mg样品中蛋白质含量(mg%):每克样品含氮质量(mg)×6.25×100。 氨基酸的分类 ?所有的氨基酸均为L型氨基酸(甘氨酸)除外。 ?根据侧链基团的结构和理化性质,20种氨基酸分为四类。 1.非极性疏水性氨基酸:甘氨酸(Gly)、丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、异亮氨酸(Ile)、苯丙氨酸(Phe)、脯氨酸(Pro)。 2.极性中性氨基酸:色氨酸(Trp)、丝氨酸(Ser)、酪氨酸(Tyr)、半胱氨酸(Cys)、蛋氨酸(Met)、天冬酰胺(Asn)、谷胺酰胺(gln)、苏氨酸(Thr)。 3.酸性氨基酸:天冬氨酸(Asp)、谷氨酸(Glu)。 4.碱性氨基酸:赖氨酸(Lys)、精氨酸(Arg)、组氨酸(His)。 ?含有硫原子的氨基酸:蛋氨酸(又称为甲硫氨酸)、半胱氨酸(含有由硫原子构成的巯基-SH)、胱氨酸(由两个半胱氨酸通过二硫键连接而成)。 ?芳香族氨基酸:色氨酸、酪氨酸、苯丙氨酸。 ?唯一的亚氨基酸:脯氨酸,其存在影响α-螺旋的形成。 ?营养必需氨基酸:八种,即异亮氨酸、甲硫氨酸、缬氨酸、亮氨酸、色氨酸、苯丙氨酸、苏氨酸、赖氨酸。可用一句话概括为“一家写两三本书来”,与之谐音。 氨基酸的理化性质 ?氨基酸的两性解离性质:所有的氨基酸都含有能与质子结合成NH4+的氨基;含有能与羟基结合成为COO-的羧基,因此,在水溶液中,它具有两性解离的特性。在某一pH环境溶液中,氨基酸解离生成的阳郭子及阴离子的趋势相同,成为兼性离子。此时环境的pH值称为该氨基酸的等电点(pI), 氨基酸带有的净电荷为零,在电场中不泳动。pI值的计算如下:pI=1/2(pK 1 + pK 2 ),(pK 1 和pK 2 分 别为α-羧基和α-氨基的解离常数的负对数值)。 ?氨基酸的紫外吸收性质 ?吸收波长:280nm ?结构特点:分子中含有共轭双键 ?光谱吸收能力:色氨酸>酪氨酸>苯丙氨酸 ?呈色反应:氨基酸与茚三酮水合物共加热,生成的蓝紫色化合物在570nm波长处有最大吸收峰;蓝紫色化合物=(氨基酸加热分解的氨)+(茚三酮的还原产物)+(一分子茚三酮)。 肽的相关概念 ?寡肽:小于10分子氨基酸组成的肽链。 ?多肽:大于10分子氨基酸组成的肽链。 ?氨基酸残基:肽链中因脱水缩合而基团不全的氨基酸分子。 ?肽键:连接两个氨基酸分子的酰胺键。 ?肽单元:参与肽键的6个原子Cα1、C、O、N、H、Cα2位于同一平面,组成肽单元。
2014生物化学期末考试试题
《生物化学》期末考试题 A 1、蛋白质溶液稳定的主要因素是蛋白质分子表面形成水化膜,并在偏离等电点时带有相同电荷 2、糖类化合物都具有还原性 ( ) 3、动物脂肪的熔点高在室温时为固体,是因为它含有的不饱和脂肪酸比植物油多。( ) 4、维持蛋白质二级结构的主要副键是二硫键。 ( ) 5、ATP含有3个高能磷酸键。 ( ) 6、非竞争性抑制作用时,抑制剂与酶结合则影响底物与酶的结合。 ( ) 7、儿童经常晒太阳可促进维生素D的吸收,预防佝偻病。 ( ) 8、氰化物对人体的毒害作用是由于它具有解偶联作用。 ( ) 9、血糖基本来源靠食物提供。 ( ) 10、脂肪酸氧化称β-氧化。 ( ) 11、肝细胞中合成尿素的部位是线粒体。 ( ) 12、构成RNA的碱基有A、U、G、T。 ( ) 13、胆红素经肝脏与葡萄糖醛酸结合后水溶性增强。 ( ) 14、胆汁酸过多可反馈抑制7α-羟化酶。 ( ) 15、脂溶性较强的一类激素是通过与胞液或胞核中受体的结合将激素信号传递发挥其生物() 1、下列哪个化合物是糖单位间以α-1,4糖苷键相连: ( ) A、麦芽 B、蔗糖 C、乳糖 D、纤维素 E、香菇多糖 2、下列何物是体内贮能的主要形式 ( ) A、硬酯酸 B、胆固醇 C、胆酸 D、醛固酮 E、脂酰甘油
3、蛋白质的基本结构单位是下列哪个: ( ) A、多肽 B、二肽 C、L-α氨基酸 D、L-β-氨基酸 E、以上都不是 4、酶与一般催化剂相比所具有的特点是 ( ) A、能加速化学反应速度 B、能缩短反应达到平衡所需的时间 C、具有高度的专一性 D、反应前后质和量无改 E、对正、逆反应都有催化作用 5、通过翻译过程生成的产物是: ( ) A、tRNA B、mRNA C、rRNA D、多肽链E、DNA 6、物质脱下的氢经NADH呼吸链氧化为水时,每消耗1/2分子氧可生产ATP分子数量( ) A、1B、2 C、3 D、4. E、5 7、糖原分子中由一个葡萄糖经糖酵解氧化分解可净生成多少分子ATP? ( ) A、1 B、2 C、3 D、4 E、5 8、下列哪个过程主要在线粒体进行 ( ) A、脂肪酸合成 B、胆固醇合成 C、磷脂合成 D、甘油分解 E、脂肪酸β-氧化 9、酮体生成的限速酶是 ( ) A、HMG-CoA还原酶 B、HMG-CoA裂解酶 C、HMG-CoA合成酶 D、磷解酶 E、β-羟丁酸脱氢酶 10、有关G-蛋白的概念错误的是 ( ) A、能结合GDP和GTP B、由α、β、γ三亚基组成 C、亚基聚合时具有活性 D、可被激素受体复合物激活 E、有潜在的GTP活性 11、鸟氨酸循环中,合成尿素的第二个氮原子来自 ( ) A、氨基甲酰磷酸 B、NH3 C、天冬氨酸 D、天冬酰胺 E、谷氨酰胺 12、下列哪步反应障碍可致苯丙酮酸尿症 ( )
生物化学重点笔记(整理版)
教学目标: 1.掌握蛋白质的概念、重要性和分子组成。 2.掌握α-氨基酸的结构通式和20种氨基酸的名称、符号、结构、分类;掌握氨基酸的重要性质;熟悉肽和活性肽的概念。 3.掌握蛋白质的一、二、三、四级结构的特点及其重要化学键。 4.了解蛋白质结构与功能间的关系。 5.熟悉蛋白质的重要性质和分类 导入:100年前,恩格斯指出“蛋白体是生命的存在形式”;今天人们如何认识蛋白质的概念和重要性? 1839年荷兰化学家马尔德(G.J.Mulder)研究了乳和蛋中的清蛋白,并按瑞典化学家Berzelius的提议把提取的物质命名为蛋白质(Protein,源自希腊语,意指“第一重要的”)。德国化学家费希尔(E.Fischer)研究了蛋白质的组成和结构,在1907年奠立蛋白质化学。英国的鲍林(L.Pauling)在1951年推引出蛋白质的螺旋;桑格(F.Sanger)在1953年测出胰岛素的一级结构。佩鲁茨(M.F.Perutz)和肯德鲁(J.C.kendrew) 在1960年测定血红蛋白和肌红蛋白的晶体结构。1965年,我国生化学者首先合成了具有生物活性的蛋白质——胰岛素(insulin)。 蛋白质是由L-α-氨基酸通过肽键缩合而成的,具有较稳定的构象和一定生物功能的生物大分子(biomacromolecule)。蛋白质是生命活动所依赖的物质基础,是生物体中含量最丰富的大分子。 单细胞的大肠杆菌含有3000多种蛋白质,而人体有10万种以上结构和功能各异的蛋白质,人体干重的45%是蛋白质。生命是物质运动的高级形式,是通过蛋白质的多种功能来实现的。新陈代谢的所有的化学反应几乎都是在酶的催化下进行的,已发现的酶绝大多数是蛋白质。生命活动所需要的许多小分子物质和离子,它们的运输由蛋白质来完成。生物的运动、生物体的防御体系离不开蛋白质。蛋白质在遗传信息的控制、细胞膜的通透性,以及高等动物的记忆、识别机构等方面都起着重要的作用。随着蛋白质工程和蛋白质组学的兴起和发展,人们对蛋白质的结构与功能的认识越来越深刻。 第一节蛋白质的分子组成 一、蛋白质的元素组成 经元素分析,主要有C(50%~55%)、H(6%~7%)、O(19%~24%)、N(13%~19%)、S(0%~4%)。有些蛋白质还含微量的P、Fe、Cu、Zn、Mn、Co、Mo、I等。 各种蛋白质的含氮量很接近,平均为16%。因此,可以用定氮法来推算样品中蛋白质的大致含量。 每克样品含氮克数×6.25×100=100g样品中蛋白质含量(g%) 二、蛋白质的基本组成单位——氨基酸 蛋白质在酸、碱或蛋白酶的作用下,最终水解为游离氨基酸(amino acid),即蛋白质组成单体或构件分子。存在于自然界中的氨基酸有300余种,但合成蛋白质的氨基酸仅20种(称编码氨基酸),最先发现的是天门冬氨酸(1806年),最后鉴定的是苏氨酸(1938年)。 (一)氨基酸的结构通式 组成蛋白质的20种氨基酸有共同的结构特点: 1.氨基连接在α- C上,属于α-氨基酸(脯氨酸为α-亚氨基酸)。 2.R是側链,除甘氨酸外都含手性C,有D-型和L-型两种立体异构体。天然蛋白质中的氨基酸都是L-型。 注意:构型是指分子中各原子的特定空间排布,其变化要求共价键的断裂和重新形成。旋光性是异构体的光学活性,是使偏振光平面向左或向右旋转的性质,(-)表示左旋,(+)表示右旋。构型与旋光性没有直接对应关系。 (二)氨基酸的分类 1.按R基的化学结构分为脂肪族、芳香族、杂环、杂环亚氨基酸四类。 2.按R基的极性和在中性溶液的解离状态分为非极性氨基酸、极性不带电荷、极性带负电荷或带正电荷的四类。 带有非极性R(烃基、甲硫基、吲哚环等,共9种):甘(Gly)、丙(Ala)、缬(Val)、亮(Leu)、异亮(Ile)、苯丙(Phe)、甲硫(Met)、脯(Pro)、色(Trp) 带有不可解离的极性R(羟基、巯基、酰胺基等,共6种):丝(Ser)、苏(Thr)、天胺(Asn)、谷胺(Gln)、酪(Tyr)、半(Cys)带有可解离的极性R基(共5种):天(Asp)、谷(Glu)、赖(Lys)、精(Arg)、组(His),前两个为酸性氨基酸,后三个是碱性氨基酸。 蛋白质分子中的胱氨酸是两个半胱氨酸脱氢后以二硫键结合而成,胶原蛋白中的羟脯氨酸、羟赖氨酸,凝血酶原中的羧基谷氨酸是蛋白质加工修饰而成。 (三)氨基酸的重要理化性质 1.一般物理性质 α-氨基酸为无色晶体,熔点一般在200 oC以上。各种氨基酸在水中的溶解度差别很大(酪氨酸不溶于水)。一般溶解于稀酸或稀碱,
生物化学深刻复习资料(全)
生物化学复习资料 第一章蛋白质化学 第一节蛋白质的基本结构单位——氨基酸 凯氏定氮法:每克样品蛋白质含量(g)=每克样品中含氮量x 6.25 氨基酸结构通式: 蛋白质是由许多不同的α-氨基酸按一定的序列通过肽键缩合而成的具有生物学功能的生物大分子。 氨基酸分类:(1)脂肪族基团:丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甘氨酸、脯氨酸(2)芳香族基团:苯丙氨酸、色氨酸、酪氨酸(3)含硫基团:蛋氨酸(甲硫氨酸)、半胱氨酸(4)含醇基基团:丝氨酸、苏氨酸(5)碱性基团:赖氨酸、精氨酸、组氨酸(6)酸性基团:天冬氨酸、谷氨酸(7)含酰胺基团:天冬酰胺、谷氨酰胺 必需氨基酸(8种):人体必不可少,而机体内又不能合成,必需从食物中补充的氨基酸。蛋氨酸(甲硫氨酸)、缬氨酸、赖氨酸、异亮氨酸、苯丙氨酸、亮氨酸、色氨酸、苏氨酸 氨基酸的两性性质:氨基酸可接受质子而形成NH3+,具有碱性;羧基可释放质子而解离成COO-,具有酸性。这就是氨基酸的两性性质。 氨基酸等电点:指氨基酸的正离子浓度和负离子浓度相等时的pH值。 蛋白质中的色氨酸和酪氨酸两种氨基酸具有紫外吸收特性,在波长280nm处有最大吸收值。镰刀形细胞贫血:血红蛋白β链第六位上的Glu→Val替换。 第二节肽 肽键:一个氨基酸的α-羧基与另一个氨基酸的α-氨基脱水综合而形成的酰胺键叫肽键。肽键是蛋白质分子中氨基酸之间的主要连接方式,它是由一个氨基酸的α-羧基与另一个氨基酸的α-氨基缩合脱水而形成的酰胺键。 少于10个氨基酸的肽称为寡肽,由10个以上氨基酸形成的肽叫多肽。 谷胱甘肽(GSH)是一种存在于动植物和微生物细胞中的重要三肽,含有一个活泼的巯基。参与细胞内的氧化还原作用,是一种抗氧化剂,对许多酶具有保护作用。 化学性质:(1)茚三酮反应:生产蓝紫色物质(2)桑格反应 第三节蛋白质的分子结构 蛋白质的一级结构:是指氨基酸在肽链中的排列顺序。 蛋白质的二级结构:是指蛋白质分子中多肽链本身的折叠方式。二级结构有α-螺旋、β-折叠、β-转角和无规则卷曲。 蛋白质的三级结构:指蛋白质在二级结构的基础上借助各种次级键卷曲折叠成特定的球状分子结构的构象。 蛋白质的四级结构:指数条具有独立的三级结构的多肽链通过非共价键相互连接而成的聚合体结构。 维持蛋白质一级结构的化学键有肽键和二硫键,维持二级结构靠氢键,维持三级结构和四级结构靠次级键,其中包括氢键、疏水键、离子键和范德华力。 第四节蛋白质的重要性质书P16 蛋白质的等电点:当蛋白质解离的阴阳离子浓度相等即净电荷为零,此时介质的pH即为蛋白质的等电点。
生物化学期末考试试题及答案
《生物化学》期末考试题 A 一、判断题(15个小题,每题1分,共15分) ( ) 1、蛋白质溶液稳定的主要因素是蛋白质分子表面形成水化膜,并在偏离等电点时带有相同电荷 2、糖类化合物都具有还原性 ( ) 3、动物脂肪的熔点高在室温时为固体,是因为它含有的不饱和脂肪酸比植物油多。( ) 4、维持蛋白质二级结构的主要副键是二硫键。 ( ) 5、ATP含有3个高能磷酸键。 ( ) 6、非竞争性抑制作用时,抑制剂与酶结合则影响底物与酶的结合。( ) 7、儿童经常晒太阳可促进维生素D的吸收,预防佝偻病。 ( ) 8、氰化物对人体的毒害作用是由于它具有解偶联作用。 ( )
9、血糖基本来源靠食物提供。 ( ) 10、脂肪酸氧化称β-氧化。 ( ) 11、肝细胞中合成尿素的部位是线粒体。 ( ) 12、构成RNA的碱基有A、U、G、T。 ( ) 13、胆红素经肝脏与葡萄糖醛酸结合后水溶性增强。 ( ) 14、胆汁酸过多可反馈抑制7α-羟化酶。 ( ) 15、脂溶性较强的一类激素是通过与胞液或胞核中受体的结合将 二、单选题(每小题1分,共20分)
1、下列哪个化合物是糖单位间以α-1,4糖苷键相连:() A、麦芽糖 B、蔗糖 C、乳糖 D、纤维素 E、 香菇多糖 2、下列何物是体内贮能的主要形式 ( ) A、硬酯酸 B、胆固醇 C、胆酸 D、醛固酮 E、 脂酰甘油 3、蛋白质的基本结构单位是下列哪个: ( ) A、多肽 B、二肽 C、L-α氨基酸 D、L-β-氨基酸 E、以上都不是 4、酶与一般催化剂相比所具有的特点是 ( ) A、能加速化学反应速度 B、能缩短反应达到平衡所需的时间 C、具有高度的专一性 D、反应前后质和量无改 E、对正、逆反应都有催化作用 5、通过翻译过程生成的产物是: ( ) A、tRNA B、mRNA C、rRNA D、多肽链E、DNA
生物化学笔记(完整版)
第一章绪论 一、生物化学的的概念: 生物化学(biochemistry)是利用化学的原理与方法去探讨生命的一门科学,它是介于化学、生物学及物理学之间的一门边缘学科。 二、生物化学的发展: 1.叙述生物化学阶段:是生物化学发展的萌芽阶段,其主要的工作是分析和研究生物体的组成成分以及生物体的分泌物和排泄物。 2.动态生物化学阶段:是生物化学蓬勃发展的时期。就在这一时期,人们基本上弄清了生物体内各种主要化学物质的代谢途径。 3.分子生物学阶段:这一阶段的主要研究工作就是探讨各种生物大分子的结构与其功能之间的关系。 三、生物化学研究的主要方面: 1.生物体的物质组成:高等生物体主要由蛋白质、核酸、糖类、脂类以及水、无机盐等组成,此外还含有一些低分子物质。 2.物质代谢:物质代谢的基本过程主要包括三大步骤:消化、吸收→中间代谢→排泄。其中,中间代谢过程是在细胞内进行的,最为复杂的化学变化过程,它包括合成代谢,分解代谢,物质互变,代谢调控,能量代谢几方面的内容。 3.细胞信号转导:细胞内存在多条信号转导途径,而这些途径之间通过一定的方式方式相互交织在一起,从而构成了非常复杂的信号转导网络,调控细胞的代谢、生理活动及生长分化。 4.生物分子的结构与功能:通过对生物大分子结构的理解,揭示结构与功能之间的关系。 5.遗传与繁殖:对生物体遗传与繁殖的分子机制的研究,也是现代生物化学与分子生物学研究的一个重要内容。 第二章蛋白质的结构与功能 一、氨基酸: 1.结构特点:氨基酸(amino acid)是蛋白质分子的基本组成单位。构成天然蛋白质分子的氨基酸约有20种,除脯氨酸为α-亚氨基酸、甘氨酸不含手性碳原子外,其余氨基酸均为L-α-氨基酸。 2.分类:根据氨基酸的R基团的极性大小可将氨基酸分为四类:①非极性中性氨基酸(8种);②极性中性氨基酸(7种);③酸性氨基酸(Glu和Asp);④碱性氨基酸(Lys、Arg和His)。 二、肽键与肽链: 肽键(peptide bond)是指由一分子氨基酸的α-羧基与另一分子氨基酸的α-氨基经脱水而形成的共价键(-CO -NH-)。氨基酸分子在参与形成肽键之后,由于脱水而结构不完整,称为氨基酸残基。每条多肽链都有两端:即自由氨基端(N端)与自由羧基端(C端),肽链的方向是N端→C端。 三、肽键平面(肽单位): 肽键具有部分双键的性质,不能自由旋转;组成肽键的四个原子及其相邻的两个α碳原子处在同一个平面上,为刚性平面结构,称为肽键平面。 四、蛋白质的分子结构:
生物化学复习资料
第一章绪论 生物化学:简单来讲,研究生物体内物质组成(化学本质)和化学变化规律的学科。生物化学的研究内容:生物分子的结构与功能(静态生化); 物质代谢及其调节(动态生化); 生命物质的结构与功能的关系及环境对机体代谢的影响(功能生化)。 第二章糖类化学 一、糖的定义及分类 糖类是一类多羟基醛(或酮),或通过水解能产生这些多羟基醛或多羟基酮的物质。糖类分类:(大体分为简单糖和复合糖) 单糖:基本单位,自身不能被水解成更简单的糖类物质。最简单的多羟基醛或多羟基酮的化合物。Eg:半乳糖 寡糖:2~10个单糖分子缩合而成,水解后可得到几分子单糖。Eg:乳糖 多糖:由许多单糖分子缩合而成。如果单糖分子相同就称为同聚多糖或均一多糖;由不同种类单糖缩合而成的多糖为杂多糖或不均一多糖。 复合糖:是指糖和非糖物质共价结合而成的复合物,分布广泛,功能多样,具有代表性的有糖蛋白或蛋白聚糖,糖脂或脂多糖。 二单糖 1、单糖的构型:在糖的化学中,采用D/L法标记单糖的构型。单糖构型的确定以甘油醛为标准。距羰基最远的手性碳与D-(+)-甘油醛的手性碳构型相同时,为D型;与L-(-)-甘油醛构型相同时,为L型。 2、对映异构体:互为镜像的旋光异构体。如:D-Glu与L-Glu 3、旋光异构现象:不对称分子中原子或原子团在空间的不同排布对平面偏振光的偏正面发生不同影响所引起的异构现象。 4、差向异构体:具有两个以上不对称碳原子的的分子中仅一个不对称碳原子上的羟基排布方式不同。如:葡萄糖与甘露糖;葡萄糖与半乳糖。 5、环状结构异构体的规定:根据半缩醛羟基与决定直链DL构型的手性碳上羟基处于同侧为α,异侧为β。(只在羰基碳原子上构型不同的同分异构体) 6、还原糖:能还原Fehling试剂或Tollens试剂的糖叫还原糖。分子结构中含有还原性基团(如游离醛基半缩醛羟基或游离羰基)的糖,还原糖是指具有还原性的糖类,叫还原糖。 1)单糖和寡糖的游离羰基,有还原性。 2)以开链结构存在的单糖中除了二羟丙酮外均具有游离羰基。 3)环式结构可通过与开链结构之间的平衡转化为后者,有半缩醛羟基的为还原糖。 4)非还原性双糖相当于由两个单糖的半缩醛羟基失水而成的,两个单糖都成为苷, 这样的双糖没有变旋现象和还原性。如:蔗糖) 7、糖含量的测定:蒽酮测糖。 三寡糖 麦芽糖:两分子葡萄糖通过α-1,4-糖苷键连接而成 纤维二糖:两分子葡糖糖通过β-1,4-糖苷键连接 乳糖:一分子葡萄糖和一分子β半乳糖通过β-1,4-糖苷键连接而成 蔗糖:一分子葡糖糖和一分子果糖通过脱水缩合而成
生物化学试题及答案期末用
生物化学试题及答案 维生素 一、名词解释 1、维生素 二、填空题 1、维生素的重要性在于它可作为酶的组成成分,参与体内代谢过程。 2、维生素按溶解性可分为和。 3、水溶性维生素主要包括和VC。 4、脂脂性维生素包括为、、和。 三、简答题 1、简述B族维生素与辅助因子的关系。 【参考答案】 一、名词解释 1、维生素:维持生物正常生命过程所必需,但机体不能合成,或合成量很少,必须食物供给一类小分子 有机物。 二、填空题 1、辅因子; 2、水溶性维生素、脂性维生素; 3、B族维生素; 4、VA、VD、VE、VK; 三、简答题 1、
生物氧化 一、名词解释 1.生物氧化 2.呼吸链 3.氧化磷酸化 4. P/O比值 二、填空题 1.生物氧化是____ 在细胞中____,同时产生____ 的过程。 3.高能磷酸化合物通常是指水解时____的化合物,其中重要的是____,被称为能量代谢的____。 4.真核细胞生物氧化的主要场所是____ ,呼吸链和氧化磷酸化偶联因子都定位于____。 5.以NADH为辅酶的脱氢酶类主要是参与____ 作用,即参与从____到____的电子传递作用;以NADPH 为辅酶的脱氢酶类主要是将分解代谢中间产物上的____转移到____反应中需电子的中间物上。 6.由NADH→O2的电子传递中,释放的能量足以偶联ATP合成的3个部位是____、____ 和____ 。 9.琥珀酸呼吸链的组成成分有____、____、____、____、____。
10.在NADH 氧化呼吸链中,氧化磷酸化偶联部位分别是____、____、____,此三处释放的能量均超过____KJ。 12.ATP生成的主要方式有____和____。 14.胞液中α-磷酸甘油脱氢酶的辅酶是____,线粒体中α-磷酸甘油脱氢酶的辅基是____。 16.呼吸链中未参与形成复合体的两种游离成分是____和____。 26.NADH经电子传递和氧化磷酸化可产生____个ATP,琥珀酸可产生____个ATP。 三、问答题 1.试比较生物氧化与体外物质氧化的异同。 2.描述NADH氧化呼吸链和琥珀酸氧化呼吸链的组成、排列顺序及氧化磷酸化的偶联部位。 7.简述化学渗透学说。 【参考答案】 一、名词解释 1.物质在生物体内进行的氧化反应称生物氧化。 2.代谢物脱下的氢通过多种酶与辅酶所催化的连锁反应逐步传递,最终与氧结合为水,此过程与细胞呼吸有关故称呼吸链。 3.代谢物脱下的氢经呼吸链传递给氧生成水,同时伴有ADP磷酸化为ATP,此过程称氧化磷酸化。 4.物质氧化时每消耗1摩尔氧原子所消耗的无机磷的摩尔数,即生成ATP的摩尔数,此称P/O比值。 二、填空题 1.有机分子氧化分解可利用的能量 3.释放的自由能大于20.92kJ/mol ATP 通货 4.线粒体线粒体内膜 5.生物氧化底物氧H++e- 生物合成 6.NADH-CoQ Cytb-Cytc Cyta-a3-O2 9.复合体Ⅱ泛醌复合体Ⅲ细胞色素c 复合体Ⅳ 10.NADH→泛醌泛醌→细胞色素c 细胞色素aa3→O2 30.5 12.氧化磷酸化底物水平磷酸化 14.NAD+ FAD
鲁东大学生物化学期末复习资料试题大题答案
蛋白质结构与功能的关系解答一 (1)蛋白质一级结构与功能的关系 ①一级结构是空间构象的基础 蛋白质一级结构决定空间构象,即一级结构是高级结构形成的基础。只有具有高级结构的蛋白质才能表现生物学功能。实际上很多蛋白质的一级结构并不是决定蛋白质空间构象的惟一因素。除一级结构、溶液环境外,大多数蛋白质的正确折叠还需要其他分子的帮助。这些参与新生肽折叠的分子,一类是分子伴侣,另一类是折叠酶。 ②一级结构是功能的基础 一级结构相似的多肽或蛋白质,其空间构象和功能也相似。相似的一级结构具有相似的功能,不同的结构具有不同的功能,即一级结构决定生物学功能。 ③蛋白质一级结构的种属差异与分子进化 对于不同种属来源的同种蛋白质进行一级结构测定和比较,发现存在种属差异。蛋白质一定的结构执行一定的功能,功能不同的蛋白质总是有不同的序列。如果一级结构发生变化,其蛋白质的功能可能发生变化。 ④蛋白质的一级结构与分子病 蛋白质的氨基酸序列改变可以引起疾病,人类有很多种分子病已被查明是某种蛋白质缺乏或异常。这些缺损的蛋白质可能仅仅有一个氨基酸发生异常所造成的,即所为的分子病。如镰状红细胞贫血症(HbS)。 (2)蛋白质高级结构与功能的关系 ①高级结构是表现功能的形式蛋白质一级结构决定空间构象,只有具有高级结构的蛋白质才能表现出生物学功能。 ②血红蛋白的空间构象变化与结合氧
血红蛋白(Hb)是由α2β2组成的四聚体。每个亚基的三级结构与肌红蛋白(Mb)相似,中间有一个疏水“口袋”,亚铁血红素位于“口袋”中间,血红素上的Fe2+能够与氧进行可逆结合。当第一个O2与Hb结合成氧合血红蛋白(HbO2)后,发生构象改变犹如松开了整个Hb分子构象的“扳机”,导致第二、第三和第四个O2很快的结合。这种带O2的Hb亚基协助不带O2亚基结合氧的现象,称为协同效应。O2与Hb结合后引起Hb构象变化,进而引起蛋白质分子功能改变的现象,称为别构效应。小分子的O2称为别构剂或协同效应剂。Hb则称为别构蛋白。 ③构象病因蛋白质空间构象异常变化——相应蛋白质的有害折叠、折叠不能,或错误折叠导致错误定位引起的疾病,称为蛋白质构象病。其中朊病毒病就是蛋白质构象病中的一种。 蛋白质结构与功能的关系解答二 (一)蛋白质一级结构与功能的关系要明白三点: 1.一级结构是空间构象和功能的基础,空间构象遭破坏的多肽链只要其肽键未断,一级结构未被破坏,就能恢复到原来的三级结构,功能依然存在。 2.即使是不同物种之间的多肽和蛋白质,只要其一级结构相似,其空间构象及功能也越相似。 3.物种越接近,其同类蛋白质一级结构越相似,功能也相似。 但一级结构中有些氨基酸的作用却是非常重要的,若蛋白质分子中起关键作用的氨基酸残基缺失或被替代,都会严重影响其空间构象或生理功能,产生某种疾病,这种由蛋白质分
复旦大学生物化学笔记完整版
复旦大学生物化学笔记完整版 第一篇生物大分子的结构与功能 第一章氨基酸和蛋白质 一、组成蛋白质的20种氨基酸的分类 1、非极性氨基酸 包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸 2、极性氨基酸 极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸酸性氨基酸:天冬氨酸、谷氨酸 碱性氨基酸:赖氨酸、精氨酸、组氨酸 其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸 属于亚氨基酸的是:脯氨酸 含硫氨基酸包括:半胱氨酸、蛋氨酸 注意:在识记时可以只记第一个字,如碱性氨基酸包括:赖精组 二、氨基酸的理化性质 1、两性解离及等电点 氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐,故它是一种两性电解质。在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。 2、氨基酸的紫外吸收性质 芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过对280nm波长的紫外吸光度的测量可对蛋白质溶液进行定量分析。 3、茚三酮反应 氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸收峰在570nm波长处。由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。 三、肽 两分子氨基酸可借一分子所含的氨基与另一分子所带的羧基脱去1分子水缩合成最简单的二肽。二肽中游离的氨基和羧基继续借脱水作用缩合连成多肽。10个以内氨基酸连接而成多肽称为寡肽;39个氨基酸残基组成的促肾上腺皮质激素称为多肽;51个氨基酸残基组成的胰岛素归为蛋白质。 多肽连中的自由氨基末端称为N端,自由羧基末端称为C端,命名从N端指向C端。 人体内存在许多具有生物活性的肽,重要的有: 谷胱甘肽(GSH):是由谷、半胱和甘氨酸组成的三肽。半胱氨酸的巯基是该化合物的主要功能基团。GSH的巯基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免被氧化,使蛋白质或酶处于活性状态。 四、蛋白质的分子结构 1、蛋白质的一级结构:即蛋白质分子中氨基酸的排列顺序。 主要化学键:肽键,有些蛋白质还包含二硫键。 2、蛋白质的高级结构:包括二级、三级、四级结构。
大学生物化学复习资料
一、名词解释 1、血液:血液中的葡萄糖称为血糖。 2、糖原合成与分解:由单糖合成糖原的过程称为糖原合成。 糖原分解成葡萄糖的过程称为糖原的分解。 3、糖异生:由非糖物质合成葡萄糖的过程叫糖异生。 4、有氧氧化:指糖、脂肪、蛋白质在氧的参与下分解为二氧化碳和水,同时释放大量能量,供二磷酸腺苷(ADP)再合成三磷酸腺苷(ATP)。 5、三羧酸循环(TAC循环):由乙酰CoA和草酰乙酸缩合成有三个羧基的柠檬酸, 柠檬酸经一系列反应, 一再氧化脱羧, 经α酮戊二酸、琥珀酸, 再降解成草酰乙酸。而参与这一循环的丙酮酸的三个碳原子, 每循环一次, 仅用去一分子乙酰基中的二碳单位, 最后生成两 分子的CO2 , 并释放出大量的能量。反应部位在线粒体基质。 6、糖酵解:是指细胞在细胞质中分解葡萄糖生成丙酮酸的过程。(在供氧不足时,葡萄糖在胞液中分解成丙酮酸,丙酮酸再进一步还原乳酸。) 7、血脂:血中的脂类物质称为血脂。 8、血浆脂蛋白:指哺乳动物血浆(尤其是人)中的脂-蛋白质复合物。(脂类在血浆中的存在形式和转运形式) 9、脂肪动员:指在病理或饥饿条件下,储存在脂肪细胞中的脂肪,被脂肪酶逐步水解为游离脂酸(FFA)及甘油并释放入血以供其他组织氧化利用,该过程称为脂肪动员。 (补充知识:脂肪酶—催化甘油三酯水解的酶的统称。甘油三酯脂肪酶—脂肪分解的限速酶。)10、酮体:在肝脏中,脂肪酸的氧化很不完全,因而经常出现一些脂肪酸氧化分解的中间产物,这些中间产物是乙酰乙酸、β-羟基丁酸及丙酮,三者统称为酮体。(知识补充:酮体是脂肪分解的产物,而不是高血糖的产物。进食糖类物质也不会导致酮体增多。)
考研生物化学复习笔记
第一篇生物大分子的结构与功能 第一章氨基酸和蛋白质 一、组成蛋白质的20种氨基酸的分类 1、非极性氨基酸 包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸 2、极性氨基酸 极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸 酸性氨基酸:天冬氨酸、谷氨酸 碱性氨基酸:赖氨酸、精氨酸、组氨酸 其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸 属于亚氨基酸的是:脯氨酸含硫氨基酸包括:半胱氨酸、蛋氨酸 注意:在识记时可以只记第一个字,如碱性氨基酸包括:赖精组 二、氨基酸的理化性质 1、两性解离及等电点 氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐,故它是一种两性电解质。在某一PH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨基酸的等电点。 2、氨基酸的紫外吸收性质 芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过对280nm波 长的紫外吸光度的测量可对蛋白质溶液进行定量分析。 3、茚三酮反应 氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸收峰在570nm波长处。由于此吸收峰值的大小与氨基酸释放出的氨量成正比,因此可作为氨基酸定量分析方法。 三、肽 两分子氨基酸可借一分子所含的氨基与另一分子所带的羧基脱去1分子水缩合成最简单的二肽。二肽中游离的氨基和羧基继续借脱水作用缩合连成多肽。10个以内氨基酸连接而成多肽称为寡肽;39个氨基酸残基组成的促肾上腺皮质激素 称为多肽;51个氨基酸残基组成的胰岛素归为蛋白质。 多肽连中的自由氨基末端称为N端,自由羧基末端称为C端,命名从N端指向C端。 人体内存在许多具有生物活性的肽,重要的有: 谷胱甘肽(GSH ):是由谷、半胱和甘氨酸组成的三肽。半胱氨酸的巯基是该化合物的主要功能基团。GSH的巯基具有还原性,可作为体内重要的还原剂保护体内蛋白质或酶分子中巯基免被氧化,使蛋白质或酶处于活性状态。 四、蛋白质的分子结构 1、蛋白质的一级结构:即蛋白质分子中氨基酸的排列顺序。 主要化学键:肽键,有些蛋白质还包含二硫键。 2、蛋白质的高级结构:包括二级、三级、四级结构。 1)蛋白质的二级结构:指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链骨架
