化工热力学下册第二版夏清第章干燥答案

化工热力学下册第二版夏
清第章干燥答案
The latest revision on November 22, 2020
第5章 干燥的习题解答
1.已知湿空气的总压强为50Pa,温度为60℃,相对湿度为40%,试求:
(1)湿空气中水汽的分压; (2)湿度;
(3)湿空气的密度。
解:(1)湿空气的水汽分压,V S p P ?=
由附录查得60C 时水的饱和蒸汽压19.92S p KPa = (2) 湿度 (1) 密度
32.27m =湿空气/kg 绝干气 密度 3110.118
0.493/2.27
H H H kg m v ρ++=
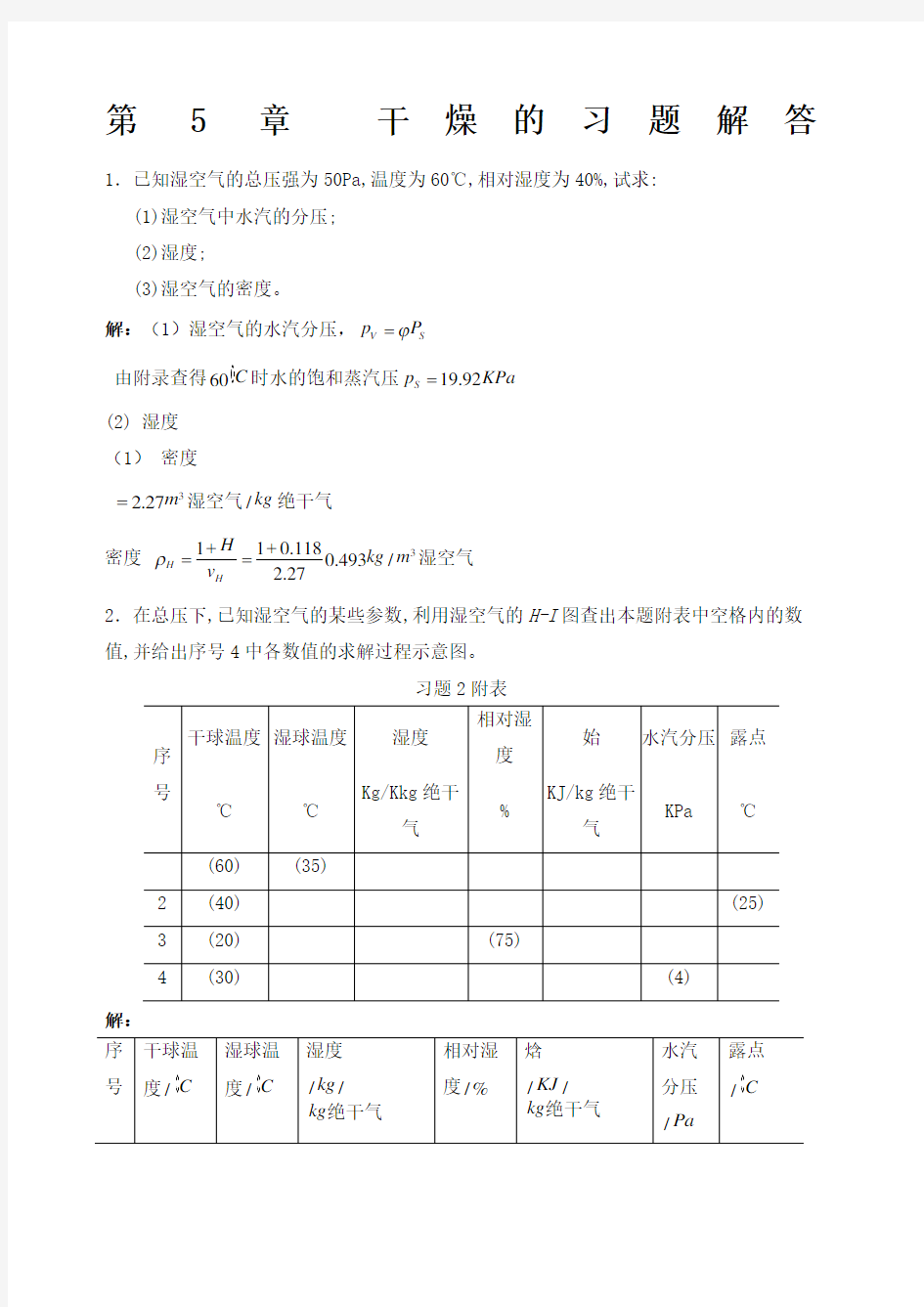
=湿空气 2.在总压下,已知湿空气的某些参数,利用湿空气的H-I 图查出本题附表中空格内的数值,并给出序号4中各数值的求解过程示意图。
习题2附表
解:
上表中括号内的数据为已知,其余值由图H I -查得。 分题4的求解示意图如附图所示,其中A 为状态点。
3.干球温度为20℃、湿度为水/kg 绝干气的温空气通过预热器加热到50℃后,再送至常压干燥器中,离开干燥器时空气的相对温度为80%,若空气在干燥器中经历等焓干燥过程,试求:
(1)1m 3原温空气在预热过程中始的变化; (2)1m 3原温空气在干燥器中获得的水分量。 解:(1)31m 原湿空气在预热器中焓的变化
当0020,0.009/t C H kg kg ==绝干气时,由H I -图查出043/I KJ kg =绝干气。 当01050,0.009/t C H H kg kg ===绝干气时,由H I -图查出
1kg 绝干空气在预热器中焓的变化为:
原湿空气的比容为
30.84m =湿空气/kg 绝干气
31m 原湿空气的焓变为 33136.9/0.84
H I KJ m v ?==湿空气 (2)31m 原湿空气在干燥器中获得的水分
当01050,0.009/t C H H kg kg ===绝干气时,在H I -图上确定空气的状态点,由该点沿等焓线向右下方移动与80%?=的线相交,交点即为离开干燥器时空气的状态点。由该点读出空气离开干燥器时的湿度20.018H =/kg kg 绝干气 故31m 原湿空气在干燥器中获得的水分
3210.0180.009
0.0107/0.84
H H H kg m v --==原湿空气 4..将t 0=25℃、0?=40%的常压新鲜空气,与由干燥器排出的t 2=50℃、2?=80%的常压废气混合,两者中绝干气的质量比为1:3。试求:
(1)混合气体的温度和焓;
(2)现需将此混合温空气的相对湿度降至10%后用于干燥湿物料,应将空气的温度升至多少度。
解:(1)对混合气列湿度和焓的衡算,得
0234m H H H += (1)
0234m I I I += (2)
由附录查得025t C =时,水的饱和蒸汽压,3168.4o S p Pa = 050t C =时,水的饱和蒸汽压2,12340S p Pa = 当025t C =,050%?=时,空气的湿度和焓分别为 当250t C =,280%?=时,空气的湿度和焓分别为 将以上数据代入式子(1)、(2),即 分别解得 0.0529m H =/kg kg 绝干气
由(1.01 1.88)2490m m m m I H t H =+?+并代如m H 及m I 的值解得44.15m t C = (2)加热到相对湿度为10%时,空气湿度不变 水汽分压不变,则
1
1
0.6220.0529101.3P P =
-,解得 17.94p KPa =
由 17.97
0.01S
P ?=
=, 解得 79.7S P KPa = 查水的饱和蒸汽压表,得对应的温度为093.1t C =
5.采用如图所示的废气循环系统干燥湿物料,已知数据标于本题附图中。假设系统热损失可忽略,干燥操作为等始干燥过程。试求:(1)新鲜空气的耗量;(2)进入干燥器的湿空
气的温度及焓;(3)预热器的加热量。
解:(1)新鲜空气消耗量
蒸发水量 12()800(0.250.05263)157.9W G X X kg =-=?-=水/h 绝干空气用量 20()L H H W -=
新鲜空气用量 0(1)2760.5 1.012788L H kg h +=?=新鲜空气/ (1) 由于干燥过程为等焓过程,故进出干燥器的空气的焓相等 即:1(1.01 1.88)2490224.1m m H t H +?+=
将0.0529m H =/kg kg 绝干气代入上式,解出 183.26t C = (m H 的值在第4题中已解出)
所以,进入干燥器的湿蒸汽的温度为83.26C ,焓为224.1/KJ Kg 绝干气 (2) 预热器的加热量
其中 442760.611042m L L kg ==?=绝干气/h
所以 511042(224.1180.7) 4.7910/133.1P Q KJ h KW =?-=?=
6. 干球温度t 0=26℃、湿球温度t w0=23℃的新鲜空气,预热到t l =95℃后送至连续逆流干燥器内,离开干燥器时温度t 2=85℃。湿物料初始状态为:温度1θ=25℃、含水量1w =15%;终了时状态为:温度2θ=25℃、含水量2w =%。每小时有9200kg 温物料加入干燥器内。绝干物料的比热容c s =(kg 绝干料·℃)。干燥器内无输送装置,热损失为580KJ/kg 汽化的水分。试求:
(1)单位时间内获得的产品质量;
(2)写出干燥过程的操作线方程,在H-I 图上画出操作线; (3)单位时间内消耗的新鲜空气质量;
(4)干燥器的热效率。
(1)单位时间内获得的产品质量 绝干物料流量 干燥产品流量
(2)干燥过程的操作线
由250,t C =23wo t C =查出066/I KJ kg =绝干气,求出00.0157/H kg kg =绝干气 由195,t C =100.0157/H H kg kg ==绝干气,求出1138.6/I KJ kg =绝干气 热损失速度 580119.969542/L Q KJ h =?= 由焓的定义可计算出干燥器的焓分别为
同理'
2
222 1.8434.50.02 4.18734.563.8/S W I C X C KJ kg θθ=+=?+??=绝干物料 对干燥器作水分衡算,得
或 2(0.0157)119.9L H -= (1) 再对干燥器做物料衡算,得
或 2(138.2)9602(63.847.6)69542L I -=?-+ (2) 联立(1)、(2)解得 4225.55100.0928H I -+?= (3)
上式为本题干燥操作的操作线方程。经过本题附图2的点B ,故任意设一H 值,如0.02H =,由式(3)求得131.5/I kJ kg =绝干气。
据此在附图2上标出点D ,过点D 及点B 的直线即为干燥过程的操作线。该线与
265t C =的线交于点C ,点C 为空气离开干燥器的状态点,由点C 读出
20.023/H kg kg =绝干气,2126/I kJ kg =绝干气
(3)单位时间内消耗新鲜空气的质量 由式(1)得 2119.9119.9
171280.01570.0230.0157
L kg H =
==--绝干气/h
新鲜空气消耗量 00(1)17100(10.0157)17403/L L H kg h =+=?+=新鲜空气
(3) 干燥器的热效率
其中 610()17128(138.666) 1.24310/P Q Q L I I kJ h ==-=?-=?
7.在一常压逆流转筒干燥器中,干燥某种晶状物料。温度t 0=25℃、相对湿度0?=55%的新鲜空气经过预热器使温度升至t 1=85℃后送入干燥器中,离开干燥器时温度t 2=30℃。湿物料初始温度1θ=24℃、湿基含水量1w =,干燥完毕后温度升到2θ=60℃、湿基含水量降为2w =。干燥产品流量G 2=1000kg/h 。绝干物料比热容c s =(kg 绝干料·℃)。转筒干燥器的直径D=,长度Z=7m 。干燥器外壁向空气的对流—辐射传热系数为35KJ/(m 2·h·℃)。试求绝干空气流量和预热器中加热蒸汽消耗量。加热蒸汽的绝对压强为180KPa 。 解:(1)绝干空气流量
绝干空气流量 22(1)1000(10.002)998G G w kg =-=?-=绝干物料/h 水分蒸发量 12()998(0.03840.002)36.33W G X X kg =-=?-=水/h 由附录查出25C 时水的饱和蒸汽压为Pa ,故湿度为 对干燥器作水分的物料衡算,取1h 为基准,得
2(0.0109)36.33L H -= (1)
对干燥器做物料衡算,得
其中1111(1.01 1.88)2490I H t H =+?+ 题给 1.507/()S C KJ kg C =绝干物料 题给235/()a KJ m h C α=
所以 120()()2L a a t t
Q S t DL t ααπ+=?=-
将以上各值代入热量衡算式,得
2114.799840(30.32546)99890.932520L H L +?=++?+ (2) 联立式(1)、(2),解得 (2)预热器中加热蒸气消耗量
加热蒸气压强为180KPa ,由附录查出相应的汽化热为/KJ kg ,
116.6T C =,预热器中消耗热量的速度为
其中 0(1.01 1.880.0109)2524900.010952.9/I KJ kg =+??+?=绝干气/h 所以 3102(114.752.9)191700/53.25P Q KJ h KW =?-== 加热蒸气消耗量191700
86.6/2214.3
kg h =
8.在恒定干燥条件下进行间歇干燥实验。已知物料的干燥面积为,绝干物料质量为15kg 。测得的实验数据列于本例附表中。试标绘干燥速率曲线,并求临界含水量X c 及平衡含水量X *。
习题8附表
解:以表中第1、2组数据为例计算如下:
开始时物料的干基湿含量 44.115
1.94/15X kg kg -=
=绝干物料, 终了时 3715
1.47/15
X kg kg -==绝干物料
蒸发的水份量 3744.17.1/W kg h ?=-=- 干燥时间的增量 0.200.2h τ?=-= 干燥速度 27.1
177.5/()0.20.2
W u kg m h S τ?-=
==-?? 与干燥速率对应的物料的平均湿含量为 由上法计算的数据列于下表
以X 为横坐标,u 为纵坐标绘图,从图中读出 临界含水量 1.24C X =/kg kg 绝干物料 平衡含水量 *0.13X =/kg kg 绝干物料
9.某湿物料经过进行恒定干燥操作。物料含水量由X 1=kg 绝干料降至X 2=kg 绝干料。若在相同条件下,要求将物料含水量由X 1=kg 绝干料降至X '2=g/kg 绝干料。试求新情况下的干燥时间。物料的临界含水量Xc=g/kg 绝干料、平衡含水量X*=kg 绝干料。假设在降速阶段中干燥速率与物料的自由含水量(X-X *)成正比. 解:恒速干燥的干燥时间为 11'
()C C
G X X Su τ=
- 降速干燥阶段,干燥速率与物料的自由含水量*()X X -成正比。 因此, *()C X C u k X X =-
降速干燥的干燥时间为 ***2**
22''
ln ln C C C C X X X X X X X G G S u X X Sk X X τ---==-- 总干燥时间为 *112**2'(ln )C
C X C X X X X G Sk X X X X τττ--=+=+--
将第一次干燥实验的数据代入,得 于是
'
2.27X
G Sk = 第二次干燥时间
由于第二次干燥实验的条件与第一次相同,即所有定性的参数均不变,所以
10.对lOkg 某温物料在恒定干燥条件下进行间歇干燥,物料平铺在×lm 的浅盘中,常压空气以2m/s 的速度垂直穿过物料层。空气t=75℃,H =kg 绝干气,物料的初始含水量为X 1=025Kukg 绝干料。此干燥条件下物料的X c =kg 绝干料,r=0。假设阵速段干燥速率与物料含水量呈线性关系。试求:(1)将物料干燥至含水量为kg 绝干料所需的总干燥时问:(2)空气的t 、H 不变,而流速加倍,此时将物料由含水量kg 绝干料干燥至kg 绝干料需,求此干燥条件下的X e 。
解:(1)恒速段干燥速率
由空气75,0.018/t C H kg kg ==绝干气,查H I -图得34w t C =相应水的汽化热
2416/tw r KJ kg =,空气对物料的对流传热系数
湿空气的质量速度 '3600H L μρ= 湿空气密度 1H H
H
v ρ+=
湿空气的比容 273101.3
(0.772 1.244)273H t v H P
+=+??
降速干燥阶段时间
降速段u X -为线性关系,故降速段干燥时间 因为 *0X =,所以
总干燥时间为 120.07850.840 1.625h τττ=+=+= (2)空气流速加倍后 '2u u = 恒速干燥时间为 '
11'
'()C C
G X X Su τ=
- 降速干燥时间为 ''
2'2
'ln C C C X G X Su X τ=
总干燥时间为 '
'
121'2
'()(ln )C C C C X G X X X Su X τττ=+=-+
即 '
''
3
101.43600()(0.25ln )0.688100.2C C C X X X -?=-+? 解得 '
0.121C
X =/kg kg 绝干物料 11.在常压间歇操作的厢式干燥器内干燥某种温物料。每批操作处理湿基含水量为159毛的湿物料500kg 物料提供的总干燥面积为40㎡。经历4h 后干燥产品中的含水量可达到要求。操作属于恒定干燥过程。由实验测得物料的临界含水量及平衡含水量分别为水/kg 绝干料及水/kg 绝干料。临界点的干燥速率为1kg 水/(㎡-h),降速阶段干燥速率线为直线。每批操作装卸物料时间为10min,求此干燥器的生产能力,以每昼夜(24h)获得的干燥产品质量计。
解:一批物料中的绝干空气流量
恒速干燥阶段时间为 11'
()C C
G X X Su τ=
- 降速阶段干燥速率线为直线,所以降速段干燥时间为
总干燥时间为 **
121*2'
()()ln C C C X
X X G X X X X Sk X X τττ??-=+=
-+-??-?
? 代入已知数据得 20.110.002410.625(0.1760.11)(0.110.002)ln 0.002X ??
-=?-+-??-??
解得 20.00809X kg =水/kg 绝干物料
干燥一批物料的干燥产品量 22'(1)425 1.00809428.4G G X kg +=?==
干燥一批物料所用时间 10
4 4.166760h +
= 因此,生产能力为 428.4
2424684.1667kg ?=干燥产品/昼夜
12.在常压并流操作的干燥器中,用热空气将每种物料由初含水量X 1=1kg/kg 绝干料干燥到最终含水量X 2=kg 绝干料。空气进干燥器的温度为135℃、湿度为kg 绝干气;离开干燥器的温度为60℃。空气在干燥器内经历等熔过程。根据实验得出的干燥速率表达式为:
干燥第一阶段)(30,H H d dX
w t s -=-
τ 干燥第二阶段X d dX
2.1=-τ
式中τd dX -——干燥速度,㎏/(㎏绝干料h)
试计算完成上述干燥任务所需要的干燥时间。
解:本题为变动干燥操作,但给出了本题特定条件下的干燥速率微分式。根据
11135,0.01/t C H kg kg ==绝干气,在H I -图上确定空气的状态点,由该点沿等焓线向
右下方移动与260t C =的线相交,读出交点处的20.039H =/kg kg 绝干气;与100%?=的饱和空气线相交,由交点读出初始状态空气的饱和湿度,0.048S tw H =/kg kg 绝干气。
对干燥器作水分衡算,得
在临界点处的干燥速率应既满足干燥第一阶段,也满足干燥第二阶段的速度,将题给的两个求干燥速率的式子均应用于临界点,得
,30
30() 1.2(0.048) 1.2251.2
C S tw C C C C C dX H H X X H H d τ-
=-=?=-=- (1)
在空气进入干燥器与临界点处列水分方程衡算式
111310.01
C
C C C X X X L G H H X --===-- (2) 联立(1)、(2)解得 0.018/C H kg kg =绝干气 20.743X kg =/kg 绝干物料 干燥第一阶段的时间为
11
110
,3030()C C X X X X S tw
dX dX d H H H τττ--===?-??
? (3) 在离开干燥器的微元长度内列水分的衡算式,有
将以上关系代入式(3),并将式中积分上下限换成相应的H ,即 干燥第二阶段的时间为
总干燥时间为 120.255 1.67 1.925h τττ=+=+=
化工热力学(下册)第二版夏清第2章吸收答案
第二章 吸收 1. 从手册中查得 KPa 、25 ℃时,若100 g 水中含氨1 g ,则此溶液上方的氨气平衡分压为 KPa 。已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·kPa))及相平衡常数m 。 解:(1) 求H 由33NH NH C P H * = .求算. 已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出: 以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为 31000/kg m .则: 3333 31/17 0.582/1001 1000 0.582 /0.590/() 0.987NH NH NH a C kmol m H C P kmol m kP *= =+∴===? (2). 求m .由333 333330.987 0.00974 101.33 1/17 0.0105 1/17100/18 0.00974 /0.928 0.0105 NH NH NH NH NH NH NH NH y m x P y P x m y x ** **== = ===+=== 2. kpa 、10 ℃时,氧气在水中的溶解度可用p O2=×106x 表示。式中:P O2为氧在气相中的分压,kPa 、x 为氧在液相中的摩尔分数。试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。 解: 氧在空气中的摩尔分数为0.21.故: 222 26 6 101.330.2121.2821.28 6.4310 3.31106 3.3110O O a O O P Py kP P x -==?====??? 因2O x 值甚小,故可以认为X x ≈ 即:2266.4310O O X x -≈=? 所以:溶解度6522232()6.431032 1.1410()/()11.4118()g O kg O kg H O m H O --????= =?=?????
化工热力学(第三版)答案陈新志等
第1章 绪言 一、是否题 1. 封闭体系中有两个相βα,。在尚未达到平衡时,βα,两个相都是均相敞开体系; 达到平衡时,则βα,两个相都等价于均相封闭体系。(对) 2. 理想气体的焓和热容仅是温度的函数。(对) 3. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积 相等,初态和终态的温度分别为T 1和T 2,则该过程的? =2 1 T T V dT C U ?;同样,对于初、 终态压力相等的过程有? =2 1 T T P dT C H ?。(对。状态函数的变化仅决定于初、终态与途径 无关。) 二、填空题 1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。 2. 封闭体系中,温度是T 的1mol 理想气体从(P i ,V i )等温可逆地膨胀到(P f ,V f ),则所做的 功为() f i rev V V RT W ln =(以V 表示)或() i f rev P P RT W ln = (以P 表示)。 3. 封闭体系中的1mol 理想气体(已知ig P C ),按下列途径由T 1、P 1和V 1可逆地变化至P 2,则 A 等容过程的 W = 0 ,Q =()1121T P P R C ig P ???? ??--,?U =() 1121T P P R C ig P ??? ? ??--,?H = 112 1T P P C ig P ??? ? ??-。 B 等温过程的 W =21ln P P RT -,Q =2 1ln P P RT ,?U = 0 ,?H = 0 。 C 绝热过程的 W =( ) ???? ????? ? -???? ??--112 11ig P C R ig P P P R V P R C ,Q = 0 ,?U =( ) ???? ????? ? -??? ? ??-112 11ig P C R ig P P P R V P R C ,?H =112 1T P P C ig P C R ig P ??????????-???? ??。 4. 1MPa=106Pa=10bar=9.8692atm=7500.62mmHg 。
化工热力学答案课后总习题答案详解
化工热力学答案_课后总习题答案详解 第二章习题解答 一、问答题: 2-1为什么要研究流体的pVT 关系? 【参考答案】:流体p-V-T 关系是化工热力学的基石,是化工过程开发和设计、安全操作和科学研究必不可少的基础数据。(1)流体的PVT 关系可以直接用于设计。(2)利用可测的热力学性质(T ,P ,V 等)计算不可测的热力学性质(H ,S ,G ,等)。只要有了p-V-T 关系加上理想气体的id p C ,可以解决化工热力学的大多数问题。 2-2在p -V 图上指出超临界萃取技术所处的区域,以及该区域的特征;同时指出其它重要的点、线、面以及它们的特征。 【参考答案】:1)超临界流体区的特征是:T >T c 、p >p c 。 2)临界点C 的数学特征: 3)饱和液相线是不同压力下产生第一个气泡的那个点的连线; 4)饱和汽相线是不同压力下产生第一个液滴点(或露点)那个点的连线。 5)过冷液体区的特征:给定压力下液体的温度低于该压力下的泡点温度。 6)过热蒸气区的特征:给定压力下蒸气的温度高于该压力下的露点温度。 7)汽液共存区:在此区域温度压力保持不变,只有体积在变化。 2-3 要满足什么条件,气体才能液化? 【参考答案】:气体只有在低于T c 条件下才能被液化。 2-4 不同气体在相同温度压力下,偏离理想气体的程度是否相同?你认为哪些是决定偏离理想气体程度的最本质因素? 【参考答案】:不同。真实气体偏离理想气体程度不仅与T 、p 有关,而且与每个气体的临界特性有 ()() () () 点在点在C V P C V P T T 00 2 2 ==?? ?
关,即最本质的因素是对比温度、对比压力以及偏心因子r T ,r P 和ω。 2-5 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗? 【参考答案】:偏心因子ω为两个分子间的相互作用力偏离分子中心之间的作用力的程度。其物理意义为:一般流体与球形非极性简单流体(氩,氪、氙)在形状和极性方面的偏心度。为了提高计算复杂分子压缩因子的准确度。 偏心因子不可以直接测量。偏心因子ω的定义为:000.1)p lg(7.0T s r r --==ω , ω由测定的对比温度为0.7时的对比饱和压力的数据计算而得,并不能直接测量。 2-6 什么是状态方程的普遍化方法?普遍化方法有哪些类型? 【参考答案】:所谓状态方程的普遍化方法是指方程中不含有物性常数a ,b ,而是以对比参数作为独立变量;普遍化状态方程可用于任何流体、任意条件下的PVT 性质的计算。普遍化方法有两种类型:(1)以压缩因子的多项式表示的普遍化关系式 (普遍化压缩因子图法);(2)以两项virial 方程表示的普遍化第二virial 系数关系式(普遍化virial 系数法) 2-7简述三参数对应状态原理与两参数对应状态原理的区别。 【参考答案】:三参数对应状态原理与两参数对应状态原理的区别在于为了提高对比态原理的精度,引入了第三参数如偏心因子ω。三参数对应态原理为:在相同的 r T 和r p 下,具有相同ω值的所有 流体具有相同的压缩因子Z ,因此它们偏离理想气体的程度相同,即),P ,T (f Z r r ω=。而两参数对应状态原理为:在相同对比温度r T 、对比压力 r p 下,不同气体的对比摩尔体积r V (或压缩因子z ) 是近似相等的,即(,) r r Z T P =。三参数对应状态原理比两参数对应状态原理精度高得多。 2-8总结纯气体和纯液体pVT 计算的异同。 【参考答案】: 由于范德华方程(vdW 方程)最 大突破在于能同时计算汽、液两相性质,因此,理论上讲,采用基于vdW 方程的立方型状态方程能同时将纯气体和纯液体的性质计算出来(最小值是饱和液体摩尔体积、最大值是饱和气体摩尔体积),但事实上计算的纯气体性质误差较小,而纯液体的误差较大。因此,液体的p-V-T 关系往往采用专门计算液体体积的公式计算,如修正Rackett 方程,它与立方型状态方程相比,既简单精度又高。 2-9如何理解混合规则?为什么要提出这个概念?有哪些类型的混合规则? 【参考答案】:对于混合气体,只要把混合物看成一个虚拟的纯物质,算出虚拟的特征参数,如Tr ,
化工热力学马沛生第二版
为什么要研究流体的pVT 关系? 答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。因此,流体的p –V –T 关系的研究是一项重要的基础工作。 理想气体的特征是什么? 答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。 理想气体状态方程是最简单的状态方程: RT pV = 偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗? 答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合: ??? ? ??-=r s r T p 11log α 其中,c s s r p p p = 对于不同的流体,α具有不同的值。但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气 压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=s r p 这一点。对于给定流体 对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的s r p log 值之差来表征。 Pitzer 把这一差值定义为偏心因子ω,即 )7.0(00.1log =--=r s r T p ω 任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。 纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而 减小吗? 答:正确。由纯物质的p –V 图上的饱和蒸气和饱和液体曲线可知。 同一温度下,纯物质的饱和液体与饱和蒸气的热力学性质均不同吗? 答:同一温度下,纯物质的饱和液体与饱和蒸气的Gibbs 自由能是相同的,这是纯物质气液平衡准则。气他的热力学性质均不同。 常用的三参数的对应状态原理有哪几种? 答:常用的三参数对比态原理有两种,一种是以临界压缩因子Zc 为第三参数;另外一种是
化工热力学(第三版)陈钟秀课后习题答案
第二章 2-1.使用下述方法计算1kmol 甲烷贮存在体积为0.1246m 3、温度为50℃的容器中产生的压力:(1)理想气体方程;(2)R-K 方程;(3)普遍化关系式。 解:甲烷的摩尔体积V =0.1246 m 3/1kmol=124.6 cm 3/mol 查附录二得甲烷的临界参数:T c =190.6K P c =4.600MPa V c =99 cm 3/mol ω=0.008 (1) 理想气体方程 P=RT/V=8.314×323.15/124.6×10-6=21.56MPa (2) R-K 方程 22.5 22.5 6 0.52 6 8.314190.60.427480.42748 3.2224.610 c c R T a Pa m K mol P - ?== =???? 531 68.314190.60.08664 0.08664 2.985104.610 c c RT b m mol P --?===??? ∴() 0.5RT a P V b T V V b = --+ ()()50.555 8.314323.15 3.222 12.46 2.98510323.1512.461012.46 2.98510---?= - -???+? =19.04MPa (3) 普遍化关系式 323.15190.6 1.695r c T T T === 124.699 1.259r c V V V ===<2 ∴利用普压法计算,01Z Z Z ω=+ ∵ c r ZRT P P P V = = ∴ c r PV Z P RT = 65 4.61012.46100.21338.314323.15 c r r r PV Z P P P RT -???===? 迭代:令Z 0=1→P r0=4.687 又Tr=1.695,查附录三得:Z 0=0.8938 Z 1=0.4623 01Z Z Z ω=+=0.8938+0.008×0.4623=0.8975 此时,P=P c P r =4.6×4.687=21.56MPa 同理,取Z 1=0.8975 依上述过程计算,直至计算出的相邻的两个Z 值相差很小,迭代结束,得Z 和P 的值。 ∴ P=19.22MPa 2-2.分别使用理想气体方程和Pitzer 普遍化关系式计算510K 、2.5MPa 正丁烷的摩尔体积。已知实验值为1480.7cm 3/mol 。 解:查附录二得正丁烷的临界参数:T c =425.2K P c =3.800MPa V c =99 cm 3/mol ω=0.193
化工热力学答案(3章)
3-1. 物质的体积膨胀系数β和等温压缩系数k 的定义分别为: 1P V V T β???= ????,1T V k V P ???=- ????。试导出服从Vander Waals 状态方程的β和k 的表达式。 解:Van der waals 方程2 RT a P V b V =-- 由Z=f(x,y)的性质1y x z z x y x y z ???????????=- ? ? ??????????得 1 T P V P V T V T P ????? ??????=- ? ? ?????????? 又 () 2 3 2T P a RT V V V b ???=- ????- V P R T V b ???= ? ?-?? 所以 ()2321P a RT V V b V T R V b ???-??-??=-?? ????-???? ()() 323 2P RV V b V T RTV a V b -???= ????-- 故 ()() 22 3 12P RV V b V V T RTV a V b β-???== ? ???-- ()() 2 223 12T V V b V k V P RTV a V b -???=-= ????-- 3-2. 某理想气体借活塞之助装于钢瓶中,压力为34.45MPa ,温度为93℃,反抗一恒定的外压力3.45 MPa 而等温膨胀,直到两倍于其初始容积为止,试计算此过程之U ?、H ?、S ?、A ?、G ?、 TdS ?、 pdV ?、Q 和W 。 解:理想气体等温过程,U ?=0、H ?=0 ∴ Q =-W = 21 1 1 2ln 2V V V V RT pdV pdV dV RT V ===??? =2109.2 J/mol ∴ W =-2109.2 J/mol 又 P P dT V dS C dP T T ??? =- ???? 理想气体等温膨胀过程dT =0、P V R T P ???= ???? ∴ R d S d P P =- ∴ 2 2 2 1 1 1 ln ln ln2S P P P S P S dS R d P R P R ?==-=-=??=5.763J/(mol· K) A U T S ?=?-?=-366×5.763=-2109.26 J/(mol·K) G H T S A ?=?-?=?=-2109.26 J/(mol·K) TdS T S A =?=??=-2109.26 J/(mol· K) 21 1 1 2ln 2V V V V RT pdV pdV dV RT V ===??? =2109.2 J/mol 3-3. 试求算1kmol 氮气在压力为10.13MPa 、温度为773K 下的内能、焓、熵、V C 、p C 和自由焓之值。
《化工热力学》第三版课后习题答案
化工热力学课后答案 第1章 绪言 一、是否题 1. 封闭体系的体积为一常数。(错) 2. 封闭体系中有两个相βα, 。在尚未达到平衡时,βα,两个相都是均相敞开体系; 达到平衡时,则βα,两个相都等价于均相封闭体系。(对) 3. 理想气体的焓和热容仅是温度的函数。(对) 4. 理想气体的熵和吉氏函数仅是温度的函数。(错。还与压力或摩尔体积有关。) 5. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相 等,初态和终态的温度分别为T 1和T 2,则该过程的? =2 1 T T V dT C U ?;同样,对于初、终态 压力相等的过程有? =2 1 T T P dT C H ?。(对。状态函数的变化仅决定于初、终态与途径无关。) 二、填空题 1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。 2. 封闭体系中,温度是T 的1mol 理想气体从(P i ,V i )等温可逆地膨胀到(P f ,V f ),则所做的 功为() f i rev V V RT W ln =(以V 表示)或() i f rev P P RT W ln = (以P 表示)。 3. 封闭体系中的1mol 理想气体(已知ig P C ),按下列途径由T 1、P 1和V 1可逆地变化至P 2,则 A 等容过程的 W = 0 ,Q =() 1121T P P R C ig P ??? ? ??--, U =( )11 2 1T P P R C ig P ??? ? ? ?--,H = 112 1T P P C ig P ??? ? ??-。 B 等温过程的 W =21ln P P RT -,Q =2 1ln P P RT ,U = 0 ,H = 0 。 C 绝热过程的 W =( ) ???? ????? ? -???? ??--112 11ig P C R ig P P P R V P R C ,Q = 0 ,U = ( ) ??????????-???? ??-11211ig P C R ig P P P R V P R C ,H =1121T P P C ig P C R ig P ??????????-???? ??。
(完整word版)化工热力学((下册))第二版夏清第5章干燥答案
第5章 干燥的习题解答 1.已知湿空气的总压强为50Pa,温度为60℃,相对湿度为40%,试求: (1)湿空气中水汽的分压; (2)湿度; (3)湿空气的密度。 解:(1)湿空气的水汽分压,V S p P ?= 由附录查得60C 时水的饱和蒸汽压19.92S p KPa = 0.419.927.97V p KPa =?= (2) 湿度 0.6220.6227.970.118/507.97V V P H kg kg p P ?= ==--绝干气 (1) 密度 55 3 273 1.0131027360 1.01310(0.772 1.244)(0.772 1.2440.118)2732735010H t v H P +?+?=+??=+??? ? 32.27m =湿空气/kg 绝干气 密度 3110.118 0.493/2.27 H H H kg m v ρ++= =湿空气 2.在总压101.33KPa 下,已知湿空气的某些参数,利用湿空气的H-I 图查出本题附表中空格内的数值,并给出序号4中各数值的求解过程示意图。 习题2附表
解: 上表中括号内的数据为已知,其余值由图H I -查得。 分题4的求解示意图如附图所示,其中A 为状态点。 3.干球温度为20℃、湿度为0.009kg 水/kg 绝干气的温空气通过预热器加热到50℃后,再送至常压干燥器中,离开干燥器时空气的相对温度为80%,若空气在干燥器中经历等焓干燥过程,试求: (1)1m 3原温空气在预热过程中始的变化; (2)1m 3原温空气在干燥器中获得的水分量。 解:(1)31m 原湿空气在预热器中焓的变化 当0020,0.009/t C H kg kg ==绝干气时,由H I -图查出043/I KJ kg =绝干气。 当01050,0.009/t C H H kg kg ===绝干气时,由H I -图查出
化工热力学答案3章
Vander Waals 状态方程的 和k 的表达式 解: Van der waals 方程 p 一 V b V 2 pdV 、Q 和 W 。 S =-366 X 5.763-2109.26 J/(mol ? K) S A =-2109.26 J/(mol ? K) 3-1.物质的体积膨胀系数 和等温压缩系数 k 的定义分别为: 丄丄,k 丄丄。试导出服从 V T P V P T 由 Z=f(x,y) 的性质 z x 丄 1 得 p V T 1 x y y z V T T p P V 又 P 2a RT p R V T V 3 V b 2 T V V b 所以 2a RT V V b 1 V 3 2 V b T P R V RV 3 V b T P RTV 3 2a V 2 b 故 1 V RV 2 V b V T P RTV 3 2a V b 2 k 1 V V 2 V 2 b V 3 P T RTV 2a V 2 b 3-2.某理想气体借活塞之助装于钢瓶中,压力为 TdS A =-2109.26 J/(mol ? K) pdV V 2 pdV 2V 1 RT dV RTln 2 =2109.2 J/mol V 1 V 3-3.试求算1kmol 氮气在压力为 10.13MPa 温度为773K 下的内能、焓、熵、 C V 、 C p 和自由焓之值。假 34.45MPa,温度为93 'C,反抗一恒定的外压力 3.45 MPa 而等温膨胀,直到两倍于其初始容积为止,试计算此过程之 U 、 H 、 S 、 A 、 G 、 TdS 、 解:理想气体等温过程, U =0、 H =0 Q =-W = pdV V 2 RT dV RTl n2 =2109.2 J/mol V W =-2109.2 J/mol 又 dS CP " V P dP 理想气体等温膨胀过程 dT =0、 dS dP P S 2 dS S| P 2 R dl n P P Rln P P 2 P 1 Rln2 =5.763J/(mol -K)
化工热力学(第三版)陈钟秀课后习题答案
第二章 2-1.使用下述方法计算1kmol 甲烷贮存在体积为0.1246m 3、温度为50 C 的容器中产生的压力:(1)理想气 体方程;(2) R-K 方程;(3)普遍化关系式。 解:甲烷的摩尔体积 V=0.1246 m 3/1kmol=124.6 cm 3/mol 查附录二得甲烷的临界参数: T c =190.6K P c =4.600MPa V c =99 cm 3/mol 3 =0.008 (1)理想 气体方程 P=RT/V=8.314 X 323.15/124.6 10^=21.56MPa (2) R-K 方程 0.4夕74842 190.2 6 4. 6 160 P. 2^2K 0.5mol_ 2 8 314 x 190 6 531 b =0.08664 c =0.08664 6 2.985 10 m mol P c 4.6 汇 10 "V - b~T°'5V V b 3.222 0~5 Z5 Z5 323.15. 12.46 10 12.46 2.985 10 =19.04MPa (3)普遍化关系式 T r =「T c =323. 15 1 90. 6 1. 6V r 5二V V c =124.6 99 = 1.259<2 ???利用普压法计算, Z = z° ?「z 1 此时,P=P c P r =4.6 X .687=21.56MPa 同理,取 乙=0.8975依上述过程计算, 的值。 /? P=19.22MPa 2-2.分别使用理想气体方程和 Pitzer 普遍化关系式计算 510K 、2.5MPa 正丁烷的摩尔体积。已知实验值为 3 1480.7cm 3 /mol 。 解:查附录二得正丁烷的临界参数: T c =425.2K P c =3.800MPa V c =99 cm 3/mol 3 =0193 RT c 8.314 323.15 12.46-2.985 10 ZRT 二 P c P r V PV RT P r 旦 RT 4.6 106 12 .46 10\“.2133P r 8.314 323.15 迭代:令 Z o = 1T P r0=4.687 又 Tr=1.695 , 0 1 查附录三得:Z =0.8938 Z =0.4623 0 1 Z =Z Z =0.8938+0.008 0.4623=0.8975 直至计算岀的相邻的两个 Z 值相差很小,迭代结束,得 Z 和P
化工热力学(第三版)第二章答案
化工热力学(第三版) 习题解答集 朱自强、吴有庭、李勉编著
前言 理论联系实际是工程科学的核心。化工热力学素以概念抽象、难懂而深深印在学生的脑海之中。特别使他们感到困惑的是难以和实际问题进行联系。为了学以致用,除选好教科书中的例题之外,很重要的是习题的安排。凭借习题来加深和印证基本概念的理解和运用,补充原书中某些理论的推导,更主要的是使学生在完成习题时能在理论联系实际的锻炼上跨出重要的一步。《化工热力学》(第三版)的习题就是用这样的指导思想来安排和编写的。 《化工热力学》自出版以来,深受国内同行和学生的关注和欢迎,但认为习题有一定的难度,希望有一本习题集问世,帮助初学者更有效地掌握基本概念,并提高分析问题和解决问题的能力。为此我们应出版社的要求把该书第三版的习题解撰并付印,以飨读者。 在编写过程中除详尽地进行习题解答外,还对部分习题列出了不同的解题方法,便于读者进一步扩大思路,增加灵活程度;对部分有较大难度的习题前加上“*”号,如果教学时间较少,可以暂时不做,但对能力较强的学生和研究生也不妨一试。使用本题解的学生,应该先对习题尽量多加思考,在自学和独自完成解题的基础上加以利用和印证,否则将与出版此书的初衷有悖。 参加本习题题解编写的人员是浙江大学化工系的朱自强教授、南京大学化工系的吴有庭教授、以及李勉博士等,浙江大学的林东强教授、谢荣锦老师等也对本习题编写提供了有益的帮助。在此深表感谢。由于编写时间仓促,有些地方考虑不周,习题题解的写作方法不善,甚至尚有解题不妥之处,希望读者能不吝赐教,提出宝贵意见,以便再版时予以修改完善。
第二章 流体的压力、体积、浓度关系:状态方程式 2-1 试分别用下述方法求出400℃、4.053MPa 下甲烷气体的摩尔体积。(1) 理想气体方程;(2) RK 方程;(3)PR 方程;(4) 维里截断式(2-7)。其中B 用Pitzer 的普遍化关联法计算。 [解] (1) 根据理想气体状态方程,可求出甲烷气体在理想情况下的摩尔体积id V 为 331 6 8.314(400273.15) 1.381104.05310 id RT V m mol p --?+= = =??? (2) 用RK 方程求摩尔体积 将RK 方程稍加变形,可写为 0.5 ()() RT a V b V b p T pV V b -= +- + (E1) 其中 2 2.5 0.427480.08664c c c c R T a p RT b p == 从附表1查得甲烷的临界温度和压力分别为c T =190.6K, c p =4.60MPa ,将它们代入a, b 表达式得 2 2.5 6-20.5 6 0.427488.314190.6 3.2217m Pa mol K 4.6010 a ??= =???? 5 3 1 6 0.086648.314190.6 2.9846104.6010 b m m ol --??= =??? 以理想气体状态方程求得的id V 为初值,代入式(E1)中迭代求解,第一次迭代得到1V 值为 5 16 8.314673.15 2.9846104.05310 V -?= +?? 35 0.5 6 3 3 5 3.2217(1.38110 2.984610)67 3.15 4.05310 1.38110 (1.38110 2.984610) -----??-?- ??????+? 3 5 5 3 3 1 1.38110 2.984610 2.124610 1.389610m m ol -----=?+?-?=?? 第二次迭代得2V 为
化工热力学习题集(附标准答案)
化工热力学习题集(附标准答案)
————————————————————————————————作者:————————————————————————————————日期:
模拟题一 一.单项选择题(每题1分,共20分) 本大题解答(用A 或B 或C 或D )请填入下表: 1. T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为(C ) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽 2. T 温度下的过冷纯液体的压力P ( A ) A. >()T P s B. <()T P s C. =()T P s 3. T 温度下的过热纯蒸汽的压力P ( B ) A. >()T P s B. <()T P s C. =()T P s 4. 纯物质的第二virial 系数B ( A ) A 仅是T 的函数 B 是T 和P 的函数 C 是T 和V 的函数 D 是任何两强度性质的函数 5. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到( ) A. 第三virial 系数 B. 第二virial 系数 C. 无穷项 D. 只需要理想气体方程 6. 液化石油气的主要成分是( A ) A. 丙烷、丁烷和少量的戊烷 B. 甲烷、乙烷 C. 正己烷 7. 立方型状态方程计算V 时如果出现三个根,则最大的根表示( B ) A. 饱和液摩尔体积 B. 饱和汽摩尔体积 C. 无物理意义 8. 偏心因子的定义式( A ) A. 0.7lg()1 s r Tr P ω==-- B. 0.8lg()1 s r Tr P ω==-- C. 1.0lg()s r Tr P ω==- 9. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( B ) A. 1x y z Z Z x x y y ???? ?????=- ? ? ?????????? B. 1y x Z Z x y x y Z ????????? =- ? ? ?????????? C. 1y x Z Z x y x y Z ????????? = ? ? ?????????? D. 1y Z x Z y y x x Z ????????? =- ? ? ?????????? 10. 关于偏离函数M R ,理想性质M *,下列公式正确的是( C ) A. *R M M M =+ B. *2R M M M =- C. *R M M M =- D. *R M M M =+ 11. 下面的说法中不正确的是 ( B ) (A )纯物质无偏摩尔量 。 (B )任何偏摩尔性质都是T ,P 的函数。 (C )偏摩尔性质是强度性质。(D )强度性质无偏摩尔量 。 12. 关于逸度的下列说法中不正确的是 ( D ) (A )逸度可称为“校正压力” 。 (B )逸度可称为“有效压力” 。 (C )逸度表达了真实气体对理想气体的偏差 。 (D )逸度可代替压力,使真实气体 的状态方程变为fv=nRT 。 (E )逸度就是物质从系统中逃逸趋势的量度。 题号 1 2 3 4 5 6 7 8 9 10 答案 题号 11 12 13 14 15 16 17 18 19 20 答案
化工热力学(下册)第二版-夏清-第2章-吸收答案
?第二章 吸收? 1. 从手册中查得101.33 KPa 、25 ℃时,若100 g水中含氨1 g,则此溶液上方的氨气平衡分压为0.987 K Pa。已知在此组成范围内溶液服从亨利定律,试求溶解度系数H (kmol/ (m 3·k Pa))及相平衡常数m 。 解:(1) 求H 由33NH NH C P H *=.求算. 已知:30.987NH a P kP *=.相应的溶液浓度3NH C 可用如下方法算出: 以100g 水为基准,因为溶液很稀.故可近似认为其密度与水相同.并取其值为31000/kg m .则: 3333 31/170.582/1001 1000 0.582/0.590/()0.987NH NH NH a C kmol m H C P kmol m kP *= =+∴===? (2). 求m .由333 333330.9870.00974101.331/170.01051/17100/18 0.00974/0.9280.0105 NH NH NH NH NH NH NH NH y m x P y P x m y x ****=== ===+=== 2. 101.33 kpa 、10 ℃时,氧气在水中的溶解度可用p O2=3.31×106x 表示。式中:P O2为氧在气相中的分压,k Pa 、x为氧在液相中的摩尔分数。试求在此温度及压强下与空气充分接触后的水中,每立方米溶有多少克氧。 解: 氧在空气中的摩尔分数为0.21.故: 222 266101.330.2121.2821.28 6.43103.31106 3.3110O O a O O P Py kP P x -==?====??? 因2O x 值甚小,故可以认为X x ≈ 即:2266.4310O O X x -≈=? 所以:溶解度6522232()6.431032 1.1410()/()11.4118()g O kg O kg H O m H O --????==?=?????
化工热力学答案
第二章 均相反应动力学习题 1. 【动力学方程形式】 有一气相反应,经实验测定在400℃下的速率方程式为: 2 3.66A A dP P dt = 若转化为2 (/.)A kC A r mol hl =形式, 求相应的速率常数值及其单位。 2. [恒温恒容变压定级数] 在恒容等温下,用等摩尔H 2和NO 进行实验,测得如下数据: 总压(MPa )0.0272 0.0326 0.038 0.0435 0.0543 半衰期(s ) 256 186 135 104 67 求此反应级数 3.[二级反应恒容定时间] 4.醋酸和乙醇的反应为二级反应,在间歇反应反应器中,5min 转化率可达50%,问转化率为75%时需增加多少时间? 4、【二级恒容非等摩尔加料】 溴代异丁烷与乙醇钠在乙醇溶液中发生如下反应: i-C 4H 9Br+C 2H 5Na →Na Br+i-C 4H 9 OC 2H 5 (A) (B) (C) (D) 溴代异丁烷的初始浓度为C A0=0.050mol/l 乙醇钠的初始浓度为C B0=0.0762mol/l,在368.15K 测得不同时间的乙醇钠的浓度为: t(min) 0 5 10 20 30 50 C B (mol/l) 0.0762 0.0703 0.0655 0.0580 0.0532 0.0451 已知反应为二级,试求:(1)反应速率常数;(2)反应一小时后溶液中溴代异丁烷的浓度;(3)溴代异丁烷消耗一半所用的时间。 5. [恒温恒容变压定级数] 二甲醚的气相分解反应CH 3OCH 3 → CH 4 +H 2 +CO 在恒温恒容下进行,在504℃获得如下数据: t (s ) 0 390 777 1195 3155 ∞ Pt ×103(Pa ) 41.6 54.4 65.1 74.9 103.9 124.1
化工热力学课后答案
化工热力学课后答案(填空、判断、画图) 第1章 绪言 一、是否题 1. 封闭体系的体积为一常数。(错) 2. 封闭体系中有两个相βα,。在尚未达到平衡时,βα,两个相都是均相敞开体系; 达到平衡时,则βα,两个相都等价于均相封闭体系。(对) 3. 理想气体的焓和热容仅是温度的函数。(对) 4. 理想气体的熵和吉氏函数仅是温度的函数。(错。还与压力或摩尔体积有关。) 5. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积 相等,初态和终态的温度分别为T 1和T 2,则该过程的? =2 1 T T V dT C U ?;同样,对于初、 终态压力相等的过程有? =2 1 T T P dT C H ?。(对。状态函数的变化仅决定于初、终态与途径 无关。) 二、填空题 1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。 2. 封闭体系中,温度是T 的1mol 理想气体从(P i ,V i )等温可逆地膨胀到(P f ,V f ),则所做的 功为() f i rev V V RT W ln =(以V 表示)或() i f rev P P RT W ln = (以P 表示)。 3. 封闭体系中的1mol 理想气体(已知ig P C ),按下列途径由T 1、P 1和V 1可逆地变化至P 2,则 A 等容过程的 W = 0 ,Q =()1121T P P R C ig P ???? ??--,?U =() 1121T P P R C ig P ???? ??--,?H = 112 1T P P C ig P ??? ? ??-。 B 等温过程的 W =21ln P P RT -,Q =2 1ln P P RT ,?U = 0 ,?H = 0 。 第2章P-V-T关系和状态方程 一、是否题 1. 纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。(错。可以通过超临界流体区。) 2. 当压力大于临界压力时,纯物质就以液态存在。(错。若温度也大于临界温度时,则是 超临界流体。)
(完整版)化工热力学(第三版)答案陈钟秀
2-1.使用下述方法计算1kmol 甲烷贮存在体积为0.1246m 3、温度为50℃的容器中产生的压力:(1)理想气体方程;(2)R-K 方程;(3)普遍化关系式。 解:甲烷的摩尔体积V =0.1246 m 3/1kmol=124.6 cm 3/mol 查附录二得甲烷的临界参数:T c =190.6K P c =4.600MPa V c =99 cm 3/mol ω=0.008 (1) 理想气体方程 P=RT/V=8.314×323.15/124.6×10-6=21.56MPa (2) R-K 方程 2 2.52 2.560.52 6 8.314190.60.427480.42748 3.2224.610 c c R T a Pa m K mol P -?===???? 531 68.314190.60.08664 0.08664 2.985104.610 c c RT b m mol P --?===??? ∴() 0.5RT a P V b T V V b = --+ ()()50.555 8.314323.15 3.222 12.46 2.98510323.1512.461012.46 2.98510---?= - -???+? =19.04MPa (3) 普遍化关系式 323.15190.6 1.695r c T T T === 124.699 1.259r c V V V ===<2 ∴利用普压法计算,01Z Z Z ω=+ ∵ c r ZRT P P P V = = ∴ c r PV Z P RT = 654.61012.46100.21338.314323.15 c r r r PV Z P P P RT -???===? 迭代:令Z 0=1→P r0=4.687 又Tr=1.695,查附录三得:Z 0=0.8938 Z 1=0.4623 01Z Z Z ω=+=0.8938+0.008×0.4623=0.8975 此时,P=P c P r =4.6×4.687=21.56MPa 同理,取Z 1=0.8975 依上述过程计算,直至计算出的相邻的两个Z 值相差很小,迭代结束,得Z 和P 的值。 ∴ P=19.22MPa 2-2.分别使用理想气体方程和Pitzer 普遍化关系式计算510K 、2.5MPa 正丁烷的摩尔体积。已知实验值为1480.7cm 3/mol 。 解:查附录二得正丁烷的临界参数:T c =425.2K P c =3.800MPa V c =99 cm 3/mol ω=0.193
化工热力学 第三版 课后答案完整版 朱自强
第二章 流体的压力、体积、浓度关系:状态方程式 2-1 试分别用下述方法求出400℃、4.053MPa 下甲烷气体的摩尔体积。(1) 理想气体方程;(2) RK 方程;(3)PR 方程;(4) 维里截断式(2-7)。其中B 用Pitzer 的普遍化关联法计算。 [解] (1) 根据理想气体状态方程,可求出甲烷气体在理想情况下的摩尔体积id V 为 (2) 用RK 方程求摩尔体积 将RK 方程稍加变形,可写为 0.5() () RT a V b V b p T pV V b -= +-+ (E1) 其中 从附表1查得甲烷的临界温度和压力分别为c T =190.6K, c p =4.60MPa ,将它们代入a, b 表达式得 以理想气体状态方程求得的id V 为初值,代入式(E1)中迭代求解,第一次迭代得到1V 值为 第二次迭代得2V 为 353 5 20.56335355331 3.2217(1.389610 2.984610) 1.38110 2.98461067 3.15 4.05310 1.389610(1.389610 2.984610) 1.38110 2.984610 2.1120101.389710V m mol ------------??-?=?+?- ??????+?=?+?-?=??1V 和2V 已经相差很小,可终止迭代。故用RK 方程求得的摩尔体积近似为 (3)用PR 方程求摩尔体积 将PR 方程稍加变形,可写为
() ()() RT a V b V b p pV V b pb V b -= +-++- (E2) 式中 22 0.45724c c R T a p α= 从附表1查得甲烷的ω=0.008。 将c T 与ω代入上式 用c p 、c T 和α求a 和b , 以RK 方程求得的V 值代入式(E2),同时将a 和b 的值也代入该式的右边,藉此求式(E2)左边的V 值,得 56 3563355353558.314673.15 2.68012104.05310 0.10864(1.39010 2.6801210) 4.05310[1.39010(1.39010 2.6801210) 2.6801210(1.39010 2.6801210)] 1.38110 2.6801210 1.8217101.3896V ------------?= +?-???-??????+?+???-?=?+?-?=331 10m mol --?? 再按上法迭代一次,V 值仍为3311.389610m mol --??,故最后求得甲烷的摩尔体积近似为3311.39010m mol --??。 (4)维里截断式求摩尔体积 根据维里截断式(2-7) 11()c r c r Bp p Bp Z RT RT T =+ =+ (E3) 01c c Bp B B RT ω=+ (E4) 0 1.60.0830.422/r B T =- (E5) 1 4.20.1390.172/r B T =- (E6) 其中 已知甲烷的偏心因子ω=0.008,故由式(E4)~(E6)可计算得到
