物理化学期末复习资料
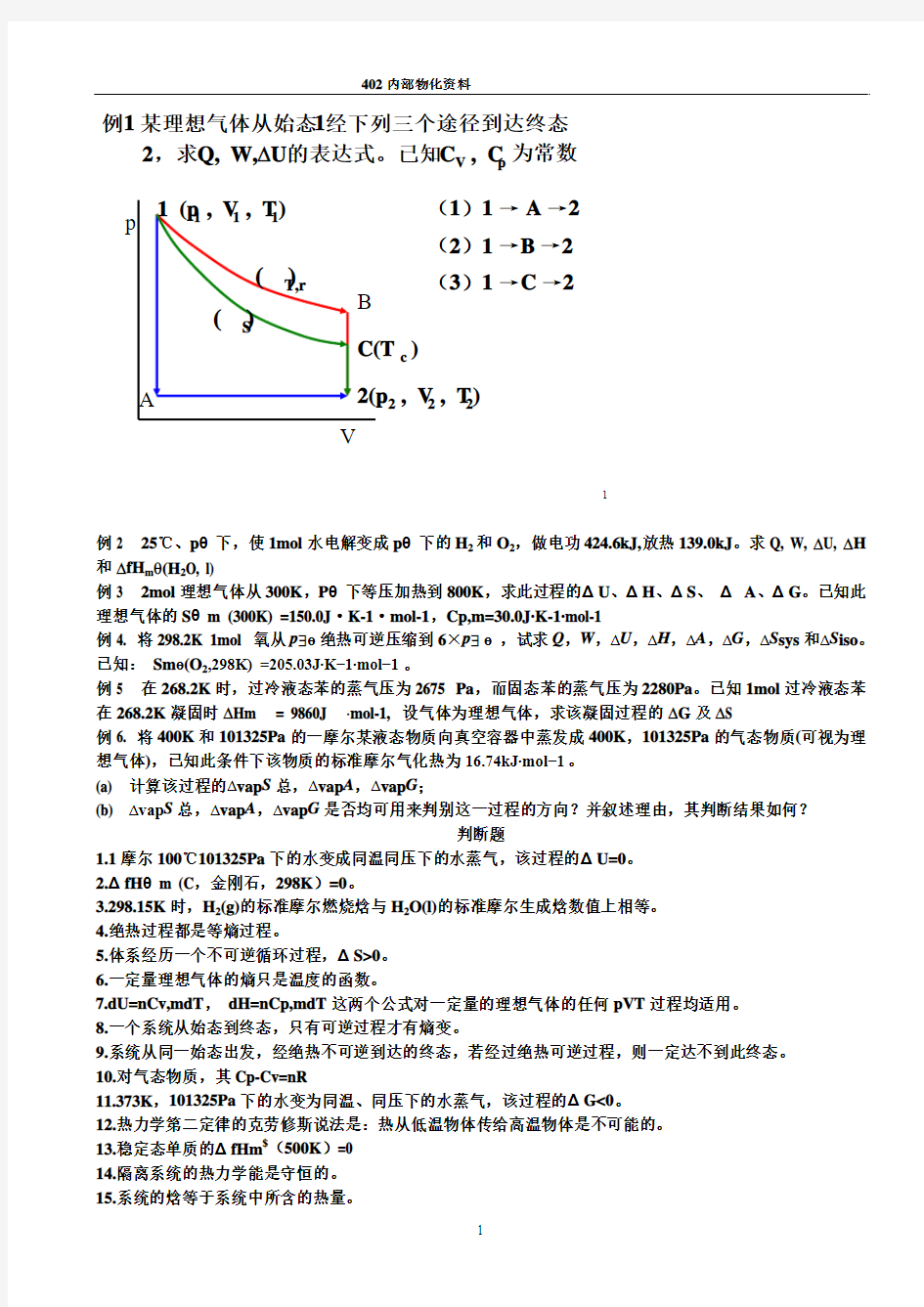

例2 25℃、pθ下,使1mol水电解变成pθ下的H2和O2,做电功424.6kJ,放热139.0kJ。求Q, W, ?U, ?H 和?fH mθ(H2O, l)
例3 2mol理想气体从300K,Pθ下等压加热到800K,求此过程的ΔU、ΔH、ΔS、ΔA、ΔG。已知此理想气体的Sθm (300K) =150.0J·K-1·mol-1,Cp,m=30.0J·K-1·mol-1
例4. 将298.2K 1mol 氧从p??绝热可逆压缩到6×p??,试求Q,W,?U,?H,?A,?G,?S sys和?S iso。已知:Sm?(O2,298K) =205.03J·K?1·mol?1。
例5 在268.2K时,过冷液态苯的蒸气压为2675 Pa,而固态苯的蒸气压为2280Pa。已知1mol过冷液态苯在268.2K凝固时?Hm = 9860J ?mol-1, 设气体为理想气体,求该凝固过程的?G及?S
例6. 将400K和101325Pa的一摩尔某液态物质向真空容器中蒸发成400K,101325Pa的气态物质(可视为理想气体),已知此条件下该物质的标准摩尔气化热为16.74kJ·mol?1。
(a) 计算该过程的?vap S总,?vap A,?vap G;
(b) ?vap S总,?vap A,?vap G是否均可用来判别这一过程的方向?并叙述理由,其判断结果如何?
判断题
1.1摩尔100℃101325Pa下的水变成同温同压下的水蒸气,该过程的ΔU=0。
2.ΔfHθm (C,金刚石,298K)=0。
3.298.15K时,H2(g)的标准摩尔燃烧焓与H2O(l)的标准摩尔生成焓数值上相等。
4.绝热过程都是等熵过程。
5.体系经历一个不可逆循环过程,ΔS>0。
6.一定量理想气体的熵只是温度的函数。
7.dU=nCv,mdT,dH=nCp,mdT这两个公式对一定量的理想气体的任何pVT过程均适用。
8.一个系统从始态到终态,只有可逆过程才有熵变。
9.系统从同一始态出发,经绝热不可逆到达的终态,若经过绝热可逆过程,则一定达不到此终态。
10.对气态物质,其Cp-Cv=nR
11.373K,101325Pa下的水变为同温、同压下的水蒸气,该过程的ΔG<0。
12.热力学第二定律的克劳修斯说法是:热从低温物体传给高温物体是不可能的。
13.稳定态单质的ΔfHm$(500K)=0
14.隔离系统的热力学能是守恒的。
15.系统的焓等于系统中所含的热量。
16.系统的焓(变)等于系统在恒压过程中吸收的热量。
17.热力学可逆过程实际上是可以实现的。
18.热力学能、焓、熵、亥姆霍兹函数、吉布斯函数都是热力学定律引出的状态函数。
19.封闭系统恒温过程中所做的最大功等于吉布斯函数的减少值。
20.封闭系统恒温过程中所做的最大非膨胀功等于亥姆霍兹函数的减少值。
21.偏摩尔量是容量性质的状态函数。
22. 化学势是容量性质的状态函数。
23.理想稀溶液中的溶剂遵从亨利定律,溶质遵从拉乌尔定律。
24.理想混合气体中任意组分B的逸度f B就等于其分压pB。
25.任何一个偏摩尔量(化学势)都是温度、压力和组成的函数。
26.对于非理想气体,Z<1表示实际气体极容易压缩。
27.对于纯组分,化学势等于Gibbs自由能。
28.热力学的不可逆过程就是不能向相反方向进行的过程。此话对吗?
29.一个爆炸反应体系应看作是绝热系统。
30.一个隔离系统的熵永不减少。
31.理想稀溶液Raoult定律与Henry定律没有区别。
32.溶质在气相和在溶液中的分子状态不相同,Henry定律也能适用。
填空题
1.Qv=ΔU应用条件是__________,_________,__________。
2.纯物质完美晶体___________________时熵值为零。
3.热力学第三定律的普朗克说法的数学表达式是——。
4.熵增原理表述为________________________________________________________________________________________。
5.物理量Q、T、P、V、W、U、H、S、A、G ,其中属于状态函数的是————;与过程有关的是————;状态函数中属于容量性质的是—————;属于强度性质的是————。
6.节流膨胀过程是————,膨胀后温度将———。
7.热力学第二定律的经典表述之一是——-————————;其数学表达公式是——————————。
8.卡诺循环过程包括——、——、———、———。
9.理想气体在等温下向真空膨胀,则ΔU=———,ΔH=————,ΔS————。
10.在隔离系统中发生某剧烈化学反应,使系统的温度及压力皆明显升高,则系统的:ΔS—;ΔU—;ΔH——;ΔA—;
ΔG——。(填>0,=0,<0或无法确定。)
11.使一个过程的熵变等于零,应满足的条件是————————————————
12.给自行车打气时,把气筒内的空气作为系统,打气筒、橡皮管和轮胎均不导热,则该过程中Q—0,W—0。
13.理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的终态压力,则终态的温度T可逆——T不可逆;V可逆—V不可逆;ΔH可逆—ΔH不可逆。
14.在恒熵、恒容、不做非膨胀功的封闭系统中,当热力学函数——到达最——值的状态为平衡状态
15.1mol单原子理想气体p1,T1,V1等容冷却到P2,T2,V1,则该过程的ΔU——0,ΔS——0,W——0。
16.298K气相反应2CO(g)+O2(g)=2CO2(g),该反应的ΔG——ΔA,ΔU——ΔH。
17.热力学的最基本方程式是————————,它适用于—————,——————,—————。
18.判断变化方向的判据有——————个,常用的为——————,——————,——————。
19.反应进度的定义式为———————————,单位为————,必须与————————对应。
20.理想气体混合物中任意组分B的化学势的表达式中的标准态为_______________________。
21.非理想气体混合物中任意组分B的化学势表达式为_________________________________。
22. 对1mol范德华气体(?S/?V)T=_______________。
23. 对于任何宏观物质,其焓H一定_______内能U,(填上>,<,=)因为_________;对于等温理想气体反应,
分子数增多的?H一定_________?U,因为____________。
24. 对于封闭体系W f=0的化学反应和相变化,若用∑μBd n B≤0公式判断过程的方向和限度,其适用条件是______,或______,______,______
25. 有四杯含相同质量不同溶质的水溶液(稀),分别测定其沸点,沸点升得最高的是()
(A)Al2(SO4)3 (B)MgSO4(C)K2SO4(D)C6H5SO3H
26. 298时有一仅能透过水的半透膜,将0.01和0.001 mol·dm-3的蔗糖溶液分开,欲使该系统达平衡需在__________ 溶液上方施加压力______
27. 在温度一定时,纯液体A的饱和蒸气压为pA*,化学势μA*。并且已知在标准压力下的凝固点为Tf*。当A中溶入少量溶质而形成稀溶液时,上述三物理量分别为pA, μA , TA ————————
28. 已知在373K时液体A、B的饱和蒸气压分别为66.66 kPa,101.325kPa。设A和B构成理想溶液。则当A在溶液中的物质的量分数为0.5时,气相中A的物质的量分数为————————
29.一定T,p下,Gibbs ? Duhem公式告诉我们,一个溶液中各组分的偏摩尔量的变化之间的关系式是:__________。
30.当一个化学反应的____________等于零时,该反应的热效应就不受温度影响。
31.有个学生对理想气体的某个公式记得不太真切了,他只模糊地记得是(?S/?x)y = ?nR/p,按你的看法,这个公式的正确表达式中,x应为______,y应为______。
选择题
1.非理想气体绝热可逆压缩过程的熵变()
A. 等于零
B.大于零
C.小于零
D.无法确定
2. dG=-SdT+Vdp适用的条件是()
A. 理想气体
B.等温等压下
C.封闭体系
D. 非体积功为零的封闭体系
3.在300K时,5mol的理想气体由1L等温可逆膨胀到10L,则过程
的ΔS是
A.11.51R
B. -11.51R
C. 2.303R
D.-2.303R
4.使一过程ΔA=0应满足的条件是()
A.等温等容只作膨胀功的可逆过程
B.等容绝热且只作膨胀功的过程
C.可逆绝热过程
D.等温等压只作膨胀功的可逆过程
5.使一过程ΔG=0应满足的条件是()
A.等温等容只作膨胀功的可逆过程
B.等容绝热过程
C.可逆绝热过程
D.等温等压只作膨胀功的可逆过程
6. 1mol理想气体经一等温可逆压缩过程,则()
A.ΔG>ΔA
B.ΔG <ΔA
C.ΔG=ΔA
D.无法比较
7.ΔH=ΔU+Δ(pV),式中Δ(PV)的意思是()
A.Δ(pV)=ΔpΔV
B.Δ(pV)=p2V2-p1V1
C.Δ(pV)=ΔpV+ VΔp
D.Δ(pV)=p(V2-V1)
8.理想气体等温自由膨胀过程为()
A.ΔU>0
B.W <0
C.ΔH=0
D. Q>0
9.当理想气体反抗一定的压力做绝热膨胀时,则()
A.焓总是不变
B.热力学能总是增加
C.焓总是增加
D.热力学能总是减少
10.在隔离系统内()
A.热力学能守恒,焓守恒
B.热力学能不一定守恒,焓守恒
C.热力学能守恒,焓不一定守恒
D.热力学能守恒和焓均不一定守恒
11.从同一始态出发,理想气体经可逆与不可逆两种绝热过程( )
A.可以到达同一终态
B.不可能到达同一终态
C.可以到达同一终态,但给环境留下不同影响
D.无法确定
12.可逆热机的效率为η,冷冻机的冷冻系数为β,则η和β的数值满足()
A.η<1,β<1
B.η≤1, β≤1
C.η<1,β>1
D.η<1,β可能小于、等于或大于1
13.实际气体经节流膨胀后,()
A.Q<0,ΔH=0,Δp<0
B.Q=0,ΔH=0,ΔT<0
C.Q=0,ΔH<0,Δp<0
D.Q=0,ΔH=0,Δp<0
14.对于实际气体,处于下列哪种情况是,其行为与理想气体相近()
A.高温高压
B.高温低压
C.低温高压
D.低温低压
15.范德华方程式中,把实际气体作为理想气体处理时,应引入的修正因子的数目为()
A.4
B.3
C.2
D.1
16.热力学第一定律的数学表达式ΔU=Q+W只能适用于()
A.理想气体
B.封闭系统
C.隔离系统
D.敞开系统
17.同一温度下,同一气体物质的Cp与Cv之间()
A. 前者一定大于后者
B. 前者一定小于后者
C. 前者一定等于后者
D. 难以比较
18.若系统为1mol物质,则下列各组哪一组所包含的量皆属于状态函数()
A. U, Qp, Cp, C
B. Qv, H, Cv, C
C. U, H, Cp, Cv
D. ΔU,ΔH, Qp, Qv
19.一定量的理想气体,从同一始态出发发生可逆膨胀,则等温膨胀的终态体积与绝热膨胀的体积之间是:()
A.前者大于后者
B.前者小于后者
C.二者相等
D.二者之间没一定关系
20.对于理想气体,焦耳-汤姆逊系数μ()
A.大于零
B.等于零
C. 小于零
D.难以确定
21.1mol单原子理想气体从温度为300K绝热压缩到500K时,其焓变约为()
A. 零
B.4157J
C. 2494J
D. -4157J
22.工作在373K 和298K的两个热源间的卡诺热机其效率是()
A. 20%
B. 25%
C. 75%
D. 100%
23.下列各式哪个不受理想气体的条件限制()
A.ΔH=ΔU + pΔV
B. Cp-Cv=R
C. PVγ=常数
D.W=nRTln(V2/V1)
24.对于双原子理想气体γ=Cp/CV应等于()
A. 1.00
B. 1.40
C. 1.67
D. 2.00
25.1mol的理想气体在TK时经等温可逆膨胀过程,则系统的()
A.ΔU>0
B. ΔS=0
C. ΔS>0
D.ΔS<0
26. 298K,101325Pa下,有两瓶萘的苯溶液,第一瓶为两升(溶有0.5mol萘),第二瓶为一升(溶有0.25mol 萘)。若以u1和u2分别表示两瓶中萘的化学势,则
A.u1=10u2B.u1=2u2C.u1=u2 D. 10u1=u2
27.苯(A)与甲苯(B)形成理想混合物,当把5mol苯与5mol甲苯混合形成溶液,这时,与溶液相平衡的蒸汽中,苯(A)的摩尔分数是:
A. y A = 0.5
B. y A < 0.5
C. y A > 0.5
D.无法确定
28.冬季建筑施工时,为了保证施工质量,常在浇筑混凝土时加入盐类,为达到上述目的,现有下列几种盐,你认为用哪一种效果比较理想?
A. NaCl
B. NH4Cl
C. CaCl2
D. KCl
29.理想溶液的通性是
A、ΔV混合=0,ΔH混合=0,ΔS混合>0,ΔG混合<0
B、ΔV混合=0,ΔH混合=0,ΔS混合>0,ΔG混合=0
C、ΔV混合>0,ΔH混合>0,ΔS混合>0,ΔG混合<0
D、ΔV混合=0,ΔH混合=0,ΔS混合=0,ΔG混合=0
30.已知甲、乙、丙、丁的摩尔凝固点降低常数分别为8.8,16.8,80.5,173,今有一未知物能在上述四种溶剂中溶解,欲测定该未知物的分子量,最适宜的溶剂是
A、甲
B、乙
C、丙
D、丁
31.有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外相等时关闭活塞,此时筒内温度将
A、不变
B、升高
C、降低
D、无法判定
32.下列函数中为强度性质的是
A、S
B、(?G/?p)T
C、(?U/?V)T
D、CV
33.关于偏摩尔量,下面的叙述中不正确的是
A、偏摩尔量的数值可以是正数,负数和零;
B、溶液中每一种广度性质都有偏摩尔量,而且都不等于其摩尔量;
C、除偏摩尔吉氏自由能外,其它偏摩尔量都不等于化学势;
D、溶液中各组分的偏摩尔量之间符合吉布斯?杜亥姆关系式
思考题
1.因为Qp=ΔH,QV=ΔU,能否作如下结论:Qp和Q V是状态函数。
2.1mol理想气体在等温和恒定压力下由V1膨胀到V2,此过程Q= p外(V2-V1)。因为过程是等压过程,所以ΔH=Q,即ΔH= p外(V2-V1)。此结果与理想气体等温过程ΔH=0是否矛盾?
3.如果一个系统放热,其内能是否一定减少?其焓是否一定减少?
4.在隔离系统中,如果发生一个变化过程,热力学能变是否一定等于零?焓变是否一定为零?
5.赫斯定律的内容如何?它能解决什么问题?
6.什么是标准摩尔生成焓和标准摩尔燃烧焓?
7.由热力学原理说明,自同一始态出发,绝热可逆过程和绝热不可逆过程不可能到达同一个终态。
8.理想气体等温可逆膨胀过程ΔS=nRln(V2/V1)>0。但根据熵判据,可逆过程ΔS=0。两种说法是否矛盾?
9.理想气体由p1等温膨胀到p2,则ΔG=nRTln(p2/p1)。因为p2 10.理想气体在等温条件下进行自由膨胀,则此过程dU=0,pdV=δW=0。根据关系式dU=TdS-pdV可知,TdS=0,则过程熵不变?上述推理和结论是否正确? 11.根据dG=-SdT + Vdp,对任意等温等压过程dT=0,dp=0,则dG一定为零。此结论对吗?为什么? 12.稀溶液的的依数性中,哪些只适用于非挥发性溶质?哪些对挥发性溶质也适用? 13.偏摩尔量有几种形式?常用的是哪种?加和公式能适用于所有的偏摩尔量吗? 14.化学势有几种形式?常用的是哪种?加和公式能适用于所有的化学势吗? 15.请写出拉乌尔定律的内容和公式。16.请写出亨利定律的内容和公式。 17.有人认为孤立体系状态改变时,内能是守恒量,而焓不是守恒量,请对此加以评论并举例说明。 18. 在100℃,pθ下,1mol水定温蒸发为蒸气,假设蒸气为理想气体,因为这一过程中的温度不变,所以,?U=0, Qp =∫Cp dT=0这一结论对否?为什么? 1.一个标准大气压25℃时在原电池中1molH2和0.5molO2可逆的生成1molH2O(l)放热48.62KJ,试计算(1)该反应的△S;(2)1atm,25℃时,H2和O2直接反应是否自发? (已知反应的△H=-28583KJ )(附加) 2.常压下110℃过热水,变成110℃水汽,在该过程中Gibbs自由能和焓的变化是 A、△G<0,△H>0 B、△G>0, △H<0 C、△G=0,△H=0 D、△G<0, △H<0(附加) 402物化期末模拟题(100分) 1.下述说法中,哪一种正确() (A)、热容C不是状态函数 (B)、热容C与途径无关 (C)、恒压热容C p不是状态函数 (D)、恒容热容C V不是状态函数 2.25℃时,将11.2升O 2与11.2升N 2 混合成11.2升的混合气体,该过程( ) (A)、?S > 0,?G < 0 (B)、?S < 0,?G < 0 (C)、?S = 0,?G = 0 (D)、?S = 0,?G < 0 。 3、某单组分体系的V m(l)>V m(s),当压力升高时,其熔点将( ) A. 升高 B. 降低 C. 不变 D. 不确定 4、某气体进行不可逆循环过程的熵变为( ) A. ΔS系= 0 , ΔS环= 0 B. ΔS系= 0 , ΔS环> 0 C. ΔS系> 0 , ΔS环= 0 D. ΔS系> 0 , ΔS环> 0 5、1mol理想气体经一等温可逆压缩过程,则() A. ΔG >ΔF B. ΔG <ΔF C. ΔG =ΔF D. ΔG与ΔF无法进行比较 6、下面有关统计热力学的描述,正确的是:() (A) 统计热力学研究的是大量分子的微观平衡体系; (B) 统计热力学研究的是大量分子的宏观平衡体系; (C) 统计热力学是热力学的理论基础; (D) 统计热力学和热力学是相互独立互不相关的两门学科。 7、对于定位体系,N个粒子分布方式D所拥有微观状态数W D为:() (A) W D = N!πN i g i/N i!;(B) W D = N!πg i Ni/Ni!; (C) W D = N!πg i Ni/Ni;(D) W D= πg i Ni/Ni!。 8、苯(A)与甲苯(B)形成理想混合物,当把5mol苯与5mol甲苯混合形成溶液,这时,与溶液相平衡的蒸汽中,苯(A)的摩尔分数是:() (A) y A = 0.5 ; (B) y A < 0.5 ; (C) y A > 0.5 ; (D) 无法确定 。 9、下列气体溶于水溶剂中,哪个气体不能用亨利定律( ) (A) N 2 ; (B) O 2 ; (C) NO 2 ; (D) CO 。 10、注脚“1”代表298K 、p θ 的O 2,注脚“2”代表298K 、2p θ 的H 2,那么( ) (A) 2121 ,μμμμ≠≠; (B) 因为21 μμ≠,1μ与2μ大小无法比较 ; (C) 2121 ,μμμμ=>; (D) 2121 ,μμμμ<< 11、NH 4HS (s )和任意量的NH 3(g )及H 2S (g )达平衡时,有( ) (A) C = 2,Φ = 2,f = 2 (B) C = 1,Φ = 2,f = 1 (C) C = 2,Φ = 3,f = 2 (D) C = 3,Φ = 2,f = 3 12、NaCl 水溶液和纯水经半透膜达成渗透平衡时,该体系的自由度是( ) (A) 1 (B) 2 (C) 3 (D) 4 13、在相图上,当体系处于下列哪一点时只存在一个相? ( ) (A) 恒沸点 (B) 熔点 (C) 临界点 (D) 低共熔点 14、化学反应体系在等温等压下发生Δξ= 1 mol 反应,所引起体系吉布斯自由能的改变值Δr G m 的数值正好等于体系化学反应吉布斯自由能 (?G /?ξ)T ,p ,i n 的条件是: ( ) (A) 体系发生单位反应 (B) 反应达到平衡 (C) 反应物处于标准状态 (D) 无穷大体系中所发生的单位反应 15、已知反应3O 2(g) = 2O 3(g) 在25℃时,Δr H m $ =-280 J ?mol -1,则对该反应有利的条件是: ( ) (A) 升温升压 (B) 升温降压 (C) 降温升压 (D) 降温降压 1、在隔离体系中发生某剧烈的化学反应,使体系的温度及压力皆明显上升,则该体系 的△H 0,△F 0。(填>,=,<) 2、卡诺热机的效率只与 有关,而与 无关。 3、含有CaCO 3(s),CaO(s),CO 2(g)的混合物与CO 2(g)和N 2(g)的混合物达渗透平衡时, 该体系的物种数S 为 ,独立组分数C 为 ,相数Φ为 ,自由度f 为 。 4、化学平衡的化学势判据是 _____________________________________ ,其适用条件是 ________________________________________________ 。 12L 相图,并标 出各区域、各线、各交点的相数,自由度数。 2. 证明:若一气体状态方程满足pV m = RT+bp 时,则该气体的内能仅是温度的函数。 已知Hg-T L 二组分体系的数据如下 3.(10分)某一化学反应若在等温等压下(298.15K,p θ)进行,放热40.0 kJ ,若使该反应 通过可逆电池来完成,则吸热4.0kJ 。 ⑴计算该反应的ΔrSm. ⑵当该反应自发进行时(即不做电功时),求环境的熵变和总熵变; ⑶计算体系可能做的最大功为多少?(10分) 4.(10分)已知1000K时,AB双原子分子的振动配分函数q0,V= 1.25,(q0,V为振动基态能量规定为零的配分函数)。 (1) 求振动特征温度? (2) 求处于振动基态能级上的分布分数N0/N = ? 5.(10分)在单斜硫与斜方硫的晶态转变点附近,它们的蒸气压公式分为 斜方硫:lg(p/pθ)=-5267/T + 11.866,单斜硫:lg(p/pθ)=-5082/T + 11.364,试计算:①硫的晶态转变温度;②转变点时的晶型转变热。 6.(10分)合成氨循环气压机第二缸内混合气组成如下(体积分数/%)∶ N2H2NH3CH4,Ar等CO2 19.31 58.30 9.87 12.52 10-6 压力是13.61×106Pa,温度是43℃,问: (1) 在此条件下能否生成氨基甲酸胺。已知反应 CO2 (g) + 2NH3 (g) = NH2COONH4 (s) $= 6.82 。 在此温度下的标准平衡常数K p (2) 为避免氨基甲酸胺的生成,混合气中CO2的物质的量分数不应超过什么值? 物理化学(下册)期末考试大纲 第八章: 电化学、原电池、电解池、正负极、阴阳极等基本概念和电解定理;电导、电导率、摩尔电导率的意义及其与溶液浓度的关系;离子独立移动定律及电导测定的应用;电解质的离子平均活度、平均活度因子及其计算方法;离子强度的计算,德拜-休克尔极限公式. 第九章: 可逆电池,电池的书面写法,电极反应和电池反应,可逆电池的热力学(桥梁公式、Eθ与Kθa的关系),用Nernst公式计算电极电势和电池电动势,电动势测定的应用(计算平均活度因子、解离平衡常数和pH值). 第十章: 极化现象,超电势,极化对电解电压和原电池电动势的影响,电解过程中电极电势的计算及反应顺序的判断,金属的电化学腐蚀与防护,化学电源的类型. 第十一章: 反应速率表示法,基元反应,反应机理,反应级数,反应分子数,简单级数反应的速率方程(推导和计算)及特点(反应速率常数的量纲、半衰期),典型复杂反应(对峙、平行、连续)的特点,对峙、平行反应速率方程的推导,温度对反应速率的影响,阿仑尼乌斯公式的含义及由它求活化能,链反应的特点,用稳态近似、平衡假设、速控步等近似方法推导速率方程. 第十二章: 碰撞理论、过渡状态理论的要点,离子强度对反应速率的影响,光化学反应的基本定律,光化学反应与热反应的差别,量子产率,催化作用原理,催化剂,酶催化. 第十三章: 表面吉布斯自由能和表面张力的含义,表面张力与温度的关系,弯曲液面上的附加压力,杨-拉普拉斯公式,开尔文公式,液-固界面现象(铺展、润湿、接触角、毛细管液面高度),表面活性剂的作用,表面活性物质在溶液中的分布,物理吸附、化学吸附的特点,朗格缪尔等温吸附模型. 第十四章: 分散系统,胶体,胶体的结构表示式,胶体的丁铎尔效应,电动现象(电泳、电渗),电动电位,胶体的稳定性及一些因素对它的影响,大分子溶液与胶体的异同,大分子物质平均摩尔质量的种类,唐南平衡. OO六一二og 学年第一学期期末考试 物理化学试题A卷 注意:学号、姓名和所在年级班级不写、不写全或写在密封线外者,试卷作废—*.计算题。(本大题6分) 将某电导池盛以0.02 mol dm3 KC l溶液(25C时其电导率为0.277 S m1), 在25C 时测得其电阻为82.4 Q,再换用0.005 mol dm 3K2SO溶液,测得其电阻为326.0 Q。求: (1) 电导池常数K(l/A); (2) KSO溶液的电导率; (3) KSO溶液的摩尔电导率 二. 问答题。请回答下列各题。(本大题4分) 在进行重量分析实验时,为了尽可能使沉淀完全,通常加入大量电解质 (非沉淀剂),或将溶胶适当加热,为什么?试从胶体化学观点加以解释。 三. 计算题。请计算下列各题。(本大题10分) 均相反应2A+B3Y+Z在一定温度体积下进行,测得动力学数据如下: 其中C A,0及C B,0分别表示A及B的初始浓度;A,0表示A的初始消耗速率,即,假定反应速率方程的形式为 (1) 确定分级数,的值和总反应级数; (2) 计算反应的活化能。 四. 计算题。请计算下列各题。(本大题6分) CH 4气相热分解反应2CHGR +H2的反应机理及各元反应的活化能如下: 已知该总反应的动力学方程式为: 试求总反应的表观活化能。 五. 计算题。请计算下列各题。 (本大题8分) 下列电池的电动势在 25C 时为1.448 V : Pt | H 2 ( p ) | HCl ( b=0.1 mol - kg -1, =0.796 ) |Cl < p ) | Pt (1) 写出电极反应和电池反应; (2) 计算氯电极的标准电极电势 E (Cl |Cl 2 |Pt )。 六. 推导题。(本大题6分) 气相反应2A(g) Y(g), 是二级反应,反应开始时只有A ,压力为p”, 试推导反应系统的总压力p 与时间t 的函数关系式。 七. 选择题。在题后括号内,填上正确答案代号。(本大题共 22小题,总计60分) 1、 (3分)在等温等压下影响物质的表面吉布斯函数的因素:( ) (1) 是表面积A; (2)是表面张力 ; (3) 是表面积A 和表面张力 ;(4)没有确定的函数关 系。 2、 (3分)弯曲液面的饱和蒸气压总大于同温度下平液面的蒸气压。是不是 ? 3、 (2分)微小颗粒物质的熔点 与同组成大块物质的熔点 的关系是:( ) (1) ; (2) = ; (3) ; (4)不能确定。 4、 (4分)朗缪尔等温吸附理论的基本假设为: (2) CH CH 3- +H- E I =423 kJ -mol CH + CH4GH +H- 日=201 kJ -mol -+ CH 4 CH 3- +H E 3=29 kJ -mol -+ CH 3- CH 4 E -i =0 kJ -mol (D 物化复习资料 1.1. 热力学参数的计算: 1.1.1. W 1) δW=-PdV (P 为外界环境的压力) 2) 恒外压过程:,amb amb P const W P W ==-? 3) 恒压过程:12,amb P P P const W P V ====-? 4) 自由膨胀过程(向真空):0,0amb P W == 5) 恒容过程:0,0dV W == 6) 理想气体恒温可逆过程:2 1 ln V W nRT V =- 7) 理想气体绝热可逆过程:00 1121 11,()1PV PV const W V V γγ γγγ--==-- 1.1. 2. ,U H ?? 1) 理想气体:,,,v m p m U nC T H nC T ?=??=? 2) ()H U PV ?=?+? 3) 相变焓: a.融化和晶型转变(恒温恒压):,0,P Q H W P V U H =?=-?≈?≈? b.融化和晶型转变(恒温):0,,W Q U U H ≈≈??≈? c.蒸发和升华(恒温恒压): ,()()P Q H W P V PV g nRT U H PV H nRT =?=-?≈-=-?=?-?=?- 4) 摩尔反应焓:()()r m B f m B c m B B H H B H B θθθ νν?=?=-?∑∑ 1.1.3. Q 1) 恒容变温过程:,,,V V m V V m Q dU nC dT Q nC T δ===? 8) 恒压变温过程:,,,P P m P P m Q dH nC dT Q nC T δ===? 2) 凝聚态物质变温过程(按恒压计算): ,,,,0P P m P P m Q nC dT Q nC T H W P V δ==?=?=-?≈ 1.1.4. S ?:()()r sys r sys sys amb sys amb sys amb Q Q Q Q S T T T T ?= +=- 1) 单纯PVT 变化:22,,1 1ln ln V m P m P V S nC nC P V ?=+ 2) 凝聚态物质:2 1 ,T P m T nC dT S T ?=? 3) 相变过程:设计可逆相变过程求解(具体可以看122P 的例题3.5.2) 4) 化学变化:()r m B m B S S B θθ υ?=∑ 1.1.5. ,A G ?? 1) 恒温:,A U T S G H T S ?=?-??=?-? 2) 理想气体恒温过程:2211 0,0,ln ln V P U H S nR nR V P ?=?=?==- 3) 恒温恒压可逆相变:()0,G A P V n g RT ?=?=-?=-?(蒸发、升华)、 0(晶型转变) 4) 化学变化:(),r m r m r m B f m B G H T S G B θθθθυ?=?-?=?∑ 5) 恒温可逆:r A W ?= 6) ()G A PV ?=?+? 第一章 气体性质 1.对于真实气体,当处于()条件时,其行为与理想接近。 A.高温高压 B.高温低压 C.低温低压 D. 2.某真实气体的压缩因子Z < 1,则表示该气体,() A.易被压缩 B.难于压缩 C.易液化 D.难液化 3.物质能以液态形式存在的最高温度是() A.沸腾温度 B.临界温度 C.玻义尔温度 D. 4.对比温度是其所处的温度与()比值。 A.玻义尔温度 B.临界温度 C. 沸腾温度 5.对于临界点的描述,下列说法中()是不正确的。 A.临界点处 B.在临界点处,液体和蒸气具有相同的密度 C.临界点所对应的温度是气体可以加压液化所允许的最高温度 D. 在临界参数中,临界体积是最易精确测定的 6.理想气体的微观模型是() A.各种分子间的作用力相等,各种分子的体积大小相等 B.所有分子都看作一个质点,它们具有相同的能量 C.分子间无作用力,分子本身不占有体积 D. 处于临界温度以上的气体 7.描述真实气体的状态方程有许多种,但它们都有一个共同的特点是() A.当压力趋近于零时,都可还原成 B.当温度越高时,都可还原成 C.当压力趋于无穷大时,都可还原成 D.当压力趋近于零时,都可还原成范德华方程 8.对应状态原理的正确描述应该是() A.各种气体处于相同的温度和压力之下 B.各种气体处于相同的对比压力和对比温度下具有近似相同的对比体积 C.各种气体压缩因子都是1 D.各种气体都处于临界温度以上 pVT b T c T B T f T T B T c T b T 22()0,()0 T T p p V V ??==??m pV RT =pV nRT =pV nRT =2()()m m a p V b RT V + -= 一 化学热力学基础 1-1 判断题 1、可逆的化学反应就是可逆过程。(×) 2、Q 和W 不是体系的性质,与过程有关,所以Q+W 也由过程决定。(×) 3、焓的定义式H=U+pV 是在定压条件下推导出来的,所以只有定压过 程才有焓变。(×) 4、焓的增加量ΔH 等于该过程中体系从环境吸收的热量。(×) 5、一个绝热过程Q=0,但体系的ΔT 不一定为零。(√) 6、对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。 (√) 7、某理想气体从始态经定温和定容两个过程达终态,这两个过程Q 、 W 、ΔU 及ΔH 是相等的。(×) 8、任何物质的熵值是不可能为负值或零的。(×) 9、功可以全部转化为热,但热不能全部转化为功。(×) 10、不可逆过程的熵变是不可求的。(×) 11、任意过程中的热效应与温度相除,可以得到该过程的熵变。(×) 12、在孤立体系中,一自发过程由A B,但体系永远回不到原来状 态。(√) 13、绝热过程Q=0,而T Q dS δ=,所以dS=0。(×) 14、可以用一过程的熵变与热温商的大小关系判断其自发性。(√) 15、绝热过程Q=0,而ΔH=Q ,因此ΔH=0。(×) 16、按克劳修斯不等式,热是不可能从低温热源传给高温热源的。 (×) 17、在一绝热体系中,水向真空蒸发为水蒸气(以水和水蒸气为体 系),该过程W>0,ΔU>0。(×) 18、体系经过一不可逆循环过程,其体S ?>0。(×) 19、对于气态物质,C p -C V =nR 。(×) 20、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板, 空气向真空膨胀,此时Q=0,所以ΔS=0。(×) 21、高温物体所含的热量比低温物体的多,因此热从高温物体自动流 向低温物体。(×) 22、处于两相平衡的1molH 2O (l )和1molH 2O (g ),由于两相物质的 温度和压力相等,因此在相变过程中ΔU=0,ΔH=0。(×) 23、在标准压力下加热某物质,温度由T 1上升到T 2,则该物质吸收的 热量为?=2 1 T T p dT C Q ,在此条件下应存在ΔH=Q 的关系。(√) 24、带有绝热活塞(无摩擦、无质量)的一个绝热气缸装有理想气体, 内壁有电炉丝,将电阻丝通电后,气体慢慢膨胀。因为是一个恒压过 程Q p =ΔH ,又因为是绝热体系Q p =0,所以ΔH=0。(×) 25、体系从状态I 变化到状态Ⅱ,若ΔT=0,则Q=0,无热量交换。(×) 26、公式Vdp SdT dG +-=只适用于可逆过程。 ( × ) 27、某一体系达到平衡时,熵最大,自由能最小。 《物理化学》综合复习资料 一、选择题 1. 对比温度r T 的值一定是 ( ) A. =1 B. >1 C. <1 D. 以上三者皆有可能 2、 一定量理想气体经过恒温膨胀过程后 ( ) A. ?U > 0 B. ?S > 0 C. ?H > 0 D. ?G > 0 3、化学反应达到平衡时 ( ) A. 0=?θm r G B. 0=?m r G C. 0=?θm r H D. 0=?θm r S 4、 实际液态混合物的温度—组成图上有恒沸点,恒沸点处气相组成y B 和液相组成x B 间的关系是 ( ) A. y B > x B B. y B = x B C. y B < x B D. 二者无确定的关系 5、标准氢电极 ( ) A. 规定其电极电势为0 B. 规定25℃时其电极电势为0 C. 电极中氢离子的浓度为1 D. 电极中导电材料可以为锌 6、封闭物系恒温、恒压及无其它功时,能自动进行的过程 ( ) A. ?U < 0 B. ?S < 0 C. ?G < 0 D. ?H < 0 7、系统进行任一循环过程( ) (A)0=H ; (B )0=?S ; (C )0=Q ; (D )0=W 。 8、若实际气体较理想气体难压缩,则压缩因子Z ( ) (A) > 1; (B) = 1; (C) < 1; (D) 不确定 9、封闭物系,下列何过程的ΔG = 0 ( ) (A)绝热可逆过程; (B) 等温等压且非体积功为零的可逆过程; (C) 等温等容且非体积功为零的过程; (D) 等温等压且非体积功为零的过程。 10、描述电极上通过的电量与已发生电极反应的物质的量之间的关系的是( ) (A )亨利定律; (B )质量作用定律; (C )范德霍夫定律; (D )法拉第定律。 11、298K 时 1mol ?dm -3Na OH 溶液的电阻为 2000 Ω,它的电导为( ) (A )0.001 S ; (B )0.0005 S ; (C )2000 S ; (D )2000Ω。 化学专业《物理化学》下册期末考试试卷 一、单项选择题(每小题2分,共30分) 1、0.001 mol ·kg -1 K 3[Fe(CN) 6] 水溶液的离子强度为:( ) (A) 6.0×10-3 mol ·kg -1 (B) 5.0×10-3 mol ·kg -1 (C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg -1 2、电导测定应用广泛,但下列问题中哪个是不能用电导测定来解决的( ) (A)求难溶盐的溶解度 (B)求弱电解质的解离度 (C)求平均活度系数 (D)测电解质溶液的浓度 3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1 的 NaAc 溶液的离子平均活度系数分别为 γ ±,1和 γ ±,2,则有 ( ) (A) γ ±,1= γ ±,2 (B) γ ±,1> γ ±,2 (C) γ ±,1< γ ±,2 (D) γ ±,1≥ γ ±,2 4、金属与溶液间电势差的大小和符号主要取决于: ( ) (A) 金属的表面性质 (B) 溶液中金属离子的浓度 (C)金属与溶液的接触面积 (D)金属的本性和溶液中原有的金属离子浓度 5、金属活性排在H 2之前的金属离子,如Na + 能优先H +在汞阴极上析出,这是由于:( ) (A) φθ(Na +/ Na) < φ θ(H +/ H 2) (B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2) (D) H 2在汞上析出有很大的超电势, 以至于φ (Na +/Na) > φ (H +/H 2) 6、已知Λ ()K O H m 291,2∞=4.89×10-2-1 2 mol m S ??,此时(291K)纯水中的m (H +) =m (OH -) =7.8×10-8 mol ·kg -1 ,则该温度下纯水的电导率为( ) (A)3.81×10-9 S ·m -1 (B )3.81×10-6 S ·m -1 (C)7.63×10-9 S ·m -1 (D )7.63×10-6 S ·m -1 7、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ; (C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。 8、某反应速率常数k = 2.31 × 10-2mol -1·dm 3·s -1,反应起始浓度为1.0 mol ·dm -3,则其反应半衰期为: ( ) (A) 43.29 s ; (B) 15 s ; (C) 30 s ; (D) 21.65 s 。 9、反应A + B → C + D 的速率方程为r = k[A][B] ,则反应:( ) (A) 是二分子反应 ; (B) 是二级反应但不一定是二分子反应 ; (C) 不是二分子反应 ; (D) 是对A 、B 各为一级的二分子反应 。 10、有关绝对反应速率理论的叙述中,不正确的是: ( ) (A) 反应分子组实际经历途径中每个状态的能量都是最低 ; (B) 势能垒是活化络合物分子在马鞍点的能量与反应物分子的能量之差 ; (C) 活化络合物在马鞍点的能量最高 ; (D) 反应分子组越过马鞍点后可能返回始态 。 11、在低于室温的温度下,在固体表面上的气体吸附一般是什么形式:( ) (A) 形成表面化合物 ; (B) 化学吸附 ; (C) 液化 ; (D) 物理吸附 。 期末练习题 1. 当某溶质溶于某溶剂中形成浓度一定的溶液时,若采用不同的标准浓度, 则下列说法中正确的是: ( ) (A) 溶质的标准态化学势相同 (B) 溶质的化学势相同 (C) 溶质的活度系数相同 (D) 溶质的活度相同 2. 在298K 时,设液体A 和B 能形成理想的液态混合物,它们的蒸气形成理想的气态混合物。 已知纯A 和纯B 的饱和蒸汽压分别为kPa p A 50=*,kPa p B 60=* ,如液相中 40.0=A x ,则平衡的气相中B 的摩尔分数B y 的值为 ( ) (A )0.25 (B) 0.40 (C) 0.50 (D) 0.64 3. 在一定温度和压力下,设纯的A(l)的化学势为*μ,其标准态化学势为θμ。如在A 中加入另一液相B(l),形成理想的液态混合物,这时A(l)的化学势为A μ,标准态化学势为θμA ,则两种化学势之间的关系为 ( ) (A )*μ=A μ,θμ=θμA (B )*μ>A μ,θμ<θμA (C )*μ=A μ θμ>θμA (D )*μ>A μ,θμ=θμA 4. 在298K 时,已知①H 2(g)和②O 2(g)在水中的Henry 系数分别为 91,1012.7?=x k Pa, 92,1044.4?=x k Pa. 在相同的温度和压力下,两者在水中的饱和溶解的量用摩尔分数表示分别为x 1和x 2,两者的关系为 ( ) (A )x 1>x 2 (B) 无法比较 (C) x 1=x 2 (D )x 1<x 2 5. 在恒温抽空的玻璃罩中,封入两杯液面相同的糖水(A )和纯水(B )。经 历若干时间后,两杯液面的高度将是: ( ) (A )A 杯高于B 杯 (B )A 杯等于B 杯 (C )A 杯低于B 杯 (D )视温度而定 一. 选 择 题(每小题2分,共40分,请将答案填入下表。) 1. 气体分子的平动能为22/3 94h mV (式中m 为分子的质量,V 为容器的体积,h 是Planck 常数),则其能级的简并度为( )。 (A) 1 (B) 2 (C) 3 (D) 6 2.水溶液中H +和OH -的电迁移率特别大,其原因是( )。 (A) 发生电子传导 (B) 发生质子传导 (C) 离子荷质比大 (D) 离子水化半径小 3.下列电解质溶液的浓度都为0.01mol·kg -1,离子平均活度因子最小的是( )。 (A) ZnSO 4 (B) CaCl 2 (C) KCl (D) LaCl 2 4.下列电池中能测定AgCl 的溶度积K sp 的是( )。 (A) Ag|AgCl(s)|KCl(aq)|I 2 (B) Ag|Ag +||Cl -|AgCl(s)|Ag (C) Ag|Ag +||Cl -|Cl 2|Pt (D) Ag|AgCl|Pt 5.将金属插入含该金属离子的溶液中,由于金属的溶解或溶液中金属离子在金属表面上沉积,可能使金属表面带上某种电荷,产生界面电势。若已知Zn│ZnSO 4电极的标准电极电势为-0.763V ,则金属锌表面上所带的电荷一定是( )。 (A) 正电荷 (B) 负电荷 (C) 不带电荷,因为溶液始终是电中性的 (D) 无法判断,正电荷和负电荷都有可能 6.用对消法测定电池的电动势时,下列电池中可作为标准电池的是( )。 (A)丹尼尔电池 (B)伏打电池 (C)韦斯登电池 (D)伽法尼电池 7.某一电池反应,若算得其电池电动势为负值时,表示此电池反应是 ( )。 (A) 正向进行 (B) 逆向进行 (C) 不可能进行 (D) 反应方向不确定 物理化学复习提纲 一、 热力学第一定律 1. 热力学第一定律:ΔU = Q -W (dU=δQ -δW ,封闭体系、静止、无 外场作用) *热Q,习惯上以系统吸热为正值,而以系统放热为负值;功W ,习惯上以系统对环境作功为正值,而以环境对系统作功为负值。 **体积功 δW=(f 外dl =p 外·Adl )=p 外dV=nRT ?21/V V V dV =nRTlnV 2/V 1=nRTlnp 1/p 2 2. 焓:定义为H ≡U+pV ;U ,H 与Q ,W 区别(状态函数与否?) 对于封闭体系,Δ H= Qp, ΔU= Qv, ΔU= -W (绝热过程) 3. Q 、W 、ΔU 、ΔH 的计算 a. ΔU=T nCv.md T T ?21= nCv.m(T 2-T 1) b. ΔH=T nCp.md T T ?21= nCp.m(T 2-T 1) c. Q :Qp=T nCp.md T T ?21;Qv=T nCv.md T T ?2 1 d. T ,P 衡定的相变过程:W=p (V 2-V 1);Qp=ΔH=n ΔH m ;ΔU=ΔH -p(V 2-V 1) 4. 热化学 a. 化学反应的热效应,ΔH=∑H(产物)-∑H (反应物)=ΔU+p ΔV (定压反应) b. 生成热及燃烧热,Δf H 0m (标准热);Δr H 0m (反应热) c. 盖斯定律及基尔戈夫方程 [G .R.Kirchhoff, (?ΔH/?T)=C p(B) -C p(A)= ΔCp] 二、 热力学第二定律 1. 卡诺循环与卡诺定理:η=W/Q 2=Q 2+Q 1/Q 2=T 2-T 1/T 2,及是 (Q 1/T 1+Q 2/T 2=0)卡诺热机在两个热源T 1及T 2之间工作时,两个热源的“热温商”之和等于零。 2. 熵的定义:dS=δQr/T, dS ≠δQir/T (克劳修斯Clausius 不等式, dS ≥δQ/T ;对于孤立体系dS ≥0,及孤立系统中所发生任意过程总是向着熵增大的方向进行)。 熵的统计意义:熵是系统混乱度的度量。有序性高的状态 所对应的微观状态数少,混乱度高的状态所对应的微观状态数多,有S=kln Ω, 定义:S 0K =0, 有 ΔS=S (T)-S 0K =dT T Cp T ??/0 3. P 、V 、T 衡时熵的计算: a. ΔS=nRlnP 1/P 2=nRlnV 2/V 1(理气,T 衡过程) b. ΔS=n T T nCp.md T T /21?(P 衡,T 变) c. ΔS=n T T nCv.md T T /21?(V 衡,T 变) d. ΔS=nC v.m lnT 2/T 1+ nC p.m lnV 2/V 1(理气P 、T 、V 均有变化时) 4. T 、P 衡相变过程:ΔS=ΔH 相变/T 相变 5. 判据: a. ΔS 孤{不能实现可逆,平衡不可逆,自发 00 0?=? (ΔS 孤=ΔS 体+ΔS 环, ΔS 环=-Q 体/T 环) 相平衡: 1.思考题(用相律说明纯物质在一定得P下的熔点为定值)K=S-R-R’=1-0-0=1;f=K-Ф+1=1-2+1=0. (Ф=2熔点时有固液两相) 2.水的蒸发热大于0,为什么在0.8大气压下煮鸡蛋不容易熟,用克拉贝龙公式说明 3.水的三相点与冰点有无区别? 三相点是严格的单组分体系,水呈气、液、固三相共存时对应的温度为0.01℃,压力为0.610kPa。而冰点是在水中溶有空气和外压为101.325kPa时测得的数据。首先,由于水中溶有空气,形成了稀溶液,冰点较三相点下降了0.00242℃,其次,三相点时体系的蒸气压低于冰点时的外压,由于压力的不同冰点又下降了0.00747℃,故冰点时的温度约为0℃。 电化学: 1.电解质溶液的电导测定 测量电解质溶液的电阻时不能用直流电源,因为直流电通过电解质溶液时,溶液中的离子会定向流动,并在阴极和阳极上发生氧化还原反应,从而有物质析出,因此这种电解作用可以改变了电解质溶液的浓度和性质。所以一般采用交流电桥法测定电解质溶液的电阻。 动力学: 1.比较反应级数与反应分子数的异同 (1)定义:反应分子数是参加反应的反应物微粒(分子、原子、离子)数目,反应级数是经验速率方程中个物质浓度的指数之和 (2)概念范畴:反应分子数是微观概念,针对基元反应,反应级数是宏观概念,针对宏观化学反应 (3)可取值:反应分子数只能是1、2或3,反应级数可以是正整数、0、负整数甚至分数 (4)存在性:反应分子数一定存在,反应级数不一定存在(对于不满足经验速率方程的反应而言没有反应级数)P.s针对具体反应而言,反应分子数通常是固定的,而反应级数与反应条件(温度、催化剂等)依赖关系较大,条件发生变化则反应级数往往不同 2.二级反应一定是双分子反应吗?为什么?举例说明 单分子反应、双分子反应和三分子反应都是对基元反应来说的。 双分子反应当然是二级反应; 但二级反应并不一定是基元反应,所以也就无法保证是双分子反应 一、 判断题(每题1分,5题,共5分) 1. 化学反应的标准平衡常数K 与反应的压力无关。( ) 2. 金属导体的电阻随温度升高而增大,电解质溶液的电阻随温度升高而减少。( ) 3. 盐桥的作用是导通电流和减小液体接界电势。( ) 4. 原电池正极的电极电势为正值,负极的电极电势为负值。( ) 5. 对所有的化学反应,都可以指出它的反应级数。( ) 二、 选择题(每题2分,18题,共36分) 1. 1000 K 时 ,CO (g) +O 2 (g) == CO 2(g ) 其K 1= 5.246×1012; C(s) + CO 2(g) == 2CO(g) 其K 2= 1.719×10 -5 则反应C(s) +O 2(g) == CO (g) 的K 3为:()。 (1) 1.109×10-6 (2)1.036×10-10 (3) 9.018×107 (4)4.731×1020 2. 影响任意一个化学反应的标准平衡常数值的因素为:()。 (1) 催化剂; (2) 温度; (3) 压力。 3. 对某些电解过程应用法拉第定律产生偏差的原因是:()。 (1) 应用的温度范围不当; (2) 应用的浓度范围不当; (3) 电解过程不可逆; (4) 过程中有副反应发生。 4. 准确测量通过电解池的电量用银电量计或铜电量计,而不用电流表和计时器 (如秒 表),主要原因是:()。 (1)电量计便宜;(2)电量计使用方便; (3)电解电流难于恒定;(4)物质质量的测准比较容易。 5. 在298.15 K 时,质量摩尔浓度为0.1 mol ·kg -1和0.01 mol ·kg -1HCl 溶液的液 接电势为E J (1);质量摩尔浓度为0.1 mol ·kg -1 和0.01 mol ·kg -1 KCl 溶液的液接电势为E J (2),则有:()。 (1)E J (1)=E J (2);(2)E J (1)>E J (2); (3)E J (1) 第八章 电化学 选择题 1.离子独立运动定律适用于 (A) 强电解质溶液 (B) 弱电解质溶液 (C) 无限稀电解质溶液 (D) 理想稀溶液 答案:C 3. 在电导测量实验中, 应该采用的电源是 (A) 直流电源 (B) 交流电源 (C) 直流电源或交流电源 (D) 测固体电导用直流电源, 测溶液电导用交流电源 答案:D 4. CaCl 2摩尔电导率与其离子的摩尔电导率的关系是 (A))()()(22- ∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (B) ) (2)()(22- ∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (C))()(21)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (D))}()({21)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m 答案:B 5.电池Cu ∣Cu +‖Cu 2+,Cu +∣Pt 和Cu ∣Cu 2+‖Cu +,Cu 2+∣Pt 的反应 均可简写作Cu+Cu 2+=2Cu +此电池的 (A) θ m r G ?、θ E 相同 (B) θm r G ?相同、θ E 不同 (C)θm r G ?不同、θE 相同 (D)θ m r G ?、θE 均不同 答案:B 6. 恒温、恒压下可逆电池放电过程 (A) ΔH=Q (B)ΔH 复习资料 一、选择题 1. 一定量的理想气体从同一始态出发,分别经 (1) 等温压缩,(2) 绝热压缩到具 有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有 ( C ) A. H1> H2 B. H1= H2 C. H1< H2 D. 不一定 2.下列的过程可应用公式ΔH=Q进行计算的是( C ) A. 不做非体积功,终态压力相同但中间压力有变化的过程 B. 不做非体积功,一直保持体积不变的过程 C. K,pθ下液态水结成冰的过程 D. 恒容下加热实际气体 3.下述说法中,哪一个错误 ( B ) A. 体系放出的热量一定等于环境吸收的热量 B. 体系温度的降低值一定等于环境 温度的升高值 C. 热力学平衡时体系的温度与环境的温度相等 D. 若体系1与体系2分别与环境达成热平衡,则此两体系的温度相同 4.体系的状态改变了,其内能值 (C ) A.必定改变 B. 必定不变 C. 不一定改变 D.状态与内能无关 5.石墨的燃烧热 ( B ) 生成热 C. 等于金刚石燃烧热 D.等于零 A.等于CO生成热 B.等于CO 2 6.ΔH =Q p , 此式适用于下列那个过程( B ) A. 理想气体从1 013 250 Pa 反抗恒定的外压101 325 Pa 膨胀到101 325 Pa B. 0℃ ,101 325 Pa 下冰融化成水 C. 电解 CuSO 4水溶液 D. 气体从 (298 K,101 325 Pa) 可逆变化到 (373 K,10 Pa) 7. 下述说法,何者正确( C ) A. 水的生成热即是氧气的燃烧热 B. 水蒸气的生成热即是氧气的燃烧热 C. 水的生成热即是氢气的燃烧热 D. 水蒸气的生成热即是氢气的燃烧热 8. 正常沸点时液体气化为蒸气的过程在定压下升高温度时体系的Δvap G $值应如何变 化( C ) A.Δvap G θ= 0 B. Δvap G θ≥ 0 C.Δvap G θ< 0 D. Δvap G θ> 0 9.下列关于吉布斯自由能(G )的描述中,不正确的是( C ) 是体系的状态函数; 的绝对值不能确定; 具有明确的物理意义; 是具有能量的量纲 10.一封闭体系从始点出发,经过循环过程后回到始点,则下列( D )的值为零。 (A) Q (B) W (C) Q-W (D) Q+W 11. 理想气体绝热向真空膨胀,则(B ) A.ΔS = 0,W = 0 B.ΔH = 0,ΔU = 0 C.ΔG = 0,ΔH = 0 D.ΔU =0,ΔG =0 12理想气体经历等温可逆过程,其熵变的计算公式是 ( D ) A.ΔS =nRT ln(p 1/p 2) B.ΔS =nRT ln(V 2/V 1) C.ΔS =nR ln(p 2/p 1) D.ΔS =nR ln(V 2/V 1) 物理化学总复习 第一章 热力学第一定律 δWe= - p e d V d U =δQ +δW 基本要求 1 熟悉基本概念,系统与环境、状态与状态函数、过程与途径、热和功、准静态过程与可逆过程、内能与焓等。 2 掌握各种过程Q 、W 、U ?和H ?的计算。 3 掌握应用Hess 定律、生成焓及燃烧焓计算反应热的方法。 4 熟悉反应热与温度的关系,能用基尔霍夫定律求算各温度的反应热。 内容提要 第二节 热力学基本概念 1系统与环境:敞开系统、封闭系统、孤立系统。 2系统的性质 3热力学平衡态 4状态函数与状态方程 5过程与途径 6热和功 第三节 热力学第一定律 1热力学第一定律 2 热力学能 3 热力学第一定律的数学表达式 第四节 可逆过程与体积功 1体积功 2功与过程 3可逆过程 第五节 焓 1焓的定义H=U+ pV 2恒容热效应和恒压热效应V Q U =? p Q H =Δ 第六节 热容 1 热容的定义。 2 定容热容与定压热容V C p C 第七节 热力学第一定律的应用 1 热力学第一定律应用于理想气体 2理想气体的C p 与V C 之差 3 理想气体的绝热过程 第八节 热化学 1化学反应的热效应 2 反应进度 3 热化学方程式 第九节 化学反应热效应的计算 1Hess 定律 2生成焓和燃烧焓 O m f H ? O m c H ? 3反应热与温度的关系——基尔霍夫定律 第二章 热力学第二定律 d 0Q S T δ-≥ 2221 ,,1112ln ln ln ln V m p m T V T p S nC nR nC nR T V T p ?=+=+ 基本要求 1理解热力学第二定律的建立过程,S 的引入及引入F 和G 的原因; 2掌握克劳修斯不等式,过程可逆性判断; 3掌握?S 、?F 、?G 在各种变化过程中的计算; 变化过程 单纯状态函数变化 相变 化学变化 恒温过程恒压过程 恒容过程绝热过程 恒温恒压可逆相变 恒压过程 恒容过程 可逆过程 不可逆过程 4理解热力学第三定律及规定熵,掌握在化学变化中标准状态函数的计算; 5 掌握吉布斯-亥姆霍兹公式; 内容提要 第一节自发过程的特征 第二节 热力学第二定律 克劳修斯表述“热量由低温物体传给高温物体而不引起其它变化是不 温州大学期末考试试卷 考试科目 物理化学(下) 考试成 绩 试卷类型 G 考试形式 考试对象 一、是非题(正确者打‘?’,错误者打‘×’。共10小题,每题1分) 1、 质量作用定律是碰撞理论的直接结果。 ( ) 2、 过渡态理论中的“马鞍点”是势能面上的最高点。 ( ) 3、 绝对纯净的液态水可以过冷到0℃以下而不结冰。 ( ) 4、 对于电池:Ag m AgNO m AgNO Ag )()(2313,m 较小的一端是负极。 ( ) 5、 液体l 在固体s 表面发生铺展的必要条件是:γs-g ≥γs-l + γl-g ( ) 6、 光化学反应的量子效率Φ不可能小于1。 ( ) 7、 弯曲液面产生的附加压力的方向总是指向该曲面的曲心。 ( ) 8、 高度分散的CaCO 3的分解压比块状CaCO 3的分解压大。 ( ) 9、 同温度下,小液滴的饱和蒸气压恒大于平面液的饱和蒸气压。 ( ) 10、 反 应 级 数 n 不 可 能 是 负 数 。 ( ) 二、选择题(只有一个正确答案,多选得零分。共30题,每题2分) 1、 在电导测量实验中, 应该采用的电源是: ( ) ①直流电源 ②交流电源 ③直流电源或交流电源 ④测固体电导用直流电源, 测溶液电导用交流电源 2、 能证明科尔劳乌施经验式 ()1(c m m β-Λ=Λ∞)的理论是: ( ) ① 阿仑尼乌斯 (Arrhenius) 电离理论 ② 德拜-休克尔 (Debye-Huckel) 离子互吸理论 学院-------------------------------------- 班级---------------------------------- 姓名------------------------------------- 学号------------------------------------- -----------------------------------------装--------------------------订---------------------------------线--------------------------------------- 化学专业《物理化学》下册期末考试试卷(1)(时间120分钟) 1、0.001 mol ·kg -1 K 3[Fe(CN) 6] 水溶液的离子强度为:( ) (A) 6.0×10-3 mol ·kg -1 (B) 5.0×10-3 mol ·kg -1 (C) 4.5×10-3 mol ·kg -1 (D) 3.0×10-3 mol ·kg -1 2、电导测定应用广泛,但下列问题中哪个是不能用电导测定来解决的( ) (A)求难溶盐的溶解度 (B)求弱电解质的解离度 (C)求平均活度系数 (D)测电解质溶液的浓度 3、298 K 时, 0.005 mol ·kg -1 的 KCl 和 0.005 mol ·kg -1 的 NaAc 溶 液的离子平均活度系数分别为 γ ±,1和 γ ±,2,则有 ( ) (A) γ ±,1= γ ±,2 (B) γ ±,1> γ ±,2 (C) γ ±,1< γ ±,2 (D) γ ±,1 ≥ γ ±,2 4、金属与溶液间电势差的大小和符号主要取决于: ( ) (A) 金属的表面性质 (B) 溶液中金属离子的浓度 (C)金属与溶液的接触面积 (D)金属的本性和溶液中原有的金属离子浓度 5、金属活性排在H 2之前的金属离子,如Na + 能优先H +在汞阴极上析出,这是由于:( ) (A) φθ (Na +/ Na) < φ θ(H +/ H 2) (B) η (Na) < η (H 2) (C) φ (Na +/ Na) < φ (H +/ H 2) (D) H 2在汞上析出有很大的超电势, 以至于φ (Na +/Na) > φ (H +/H 2) 6、已知Λ()K O H m 291 ,2∞=4.89×10-2 -12mol m S ??,此时(291K)纯水中的m (H +) =m (OH -) =7.8×10-8 mol ·kg -1,则该温度下纯水的电导率为( ) (A)3.81×10-9 S ·m -1 (B )3.81×10-6 S ·m -1 (C)7.63×10-9 S ·m -1 (D )7.63×10-6 S ·m -1 7、基元反应体系aA + dD → gG 的速率表达式中,不正确的是:( ) (A) -d[A]/dt = k A [A]a [D]d ; (B) -d[D]/dt = k D [A]a [D]d ; (C) d[G]/dt = k G [G]g ; (D) d[G]/dt = k G [A]a [D]d 。 学院: 年级/班级: 姓名: 学号: 装 订 线 内 不 要 答 题 《物理化学》课程复习资料 一、单项选择题: 1.对隔离体系而言,以下说法正确的是 [ A.体系的热力学能守恒,焓不一定守恒 ] 2.经下列过程后,体系热力学能变化不为零(ΔU ≠0)的是 [ D.纯液体的真空蒸发过程 ] 3.下列关于理想溶液的混合热力学性质正确的是 [ C.Δmix S > 0,Δmix G < 0 ] 4.理想气体恒压膨胀,其熵值如何变化? [ B.增加 ] 5.在下列热力学函数中,可以用于判断过程自动与否的是 [ C.ΔG T, ] 6.若反应2H 2(g) + O 2(g) ==== 2H 2O(g) 的热效应为△r H m ,则 [ B.Δf H m [H 2O(g)] = 0.5Δr H m ] 7.已知反应H 2(g) + 0.5O 2(g) == H 2O (g)在298K 、p Θ下的反应焓变为)K 298(m r Θ?H ,下列说法中不正确的是 [ B.)K 298(m r Θ?H H 2(g) 的标准摩尔燃烧焓 ] 8.某化学反应在298K 时的标准Gibbs 自由能变化为负值,则该温度时反应的标准平衡常数K Θ值将[B.K Θ>1] 9.合成氨反应 N 2(g )+ 3H 2(g )== 2NH 3(g )达平衡后加入惰性气体,保持体系温度和总压不变(气体为 理想气体),则有 [ C.平衡左移,K p Θ 不变 ] 10.在一定的温度T 和压力p 下,反应3O 2(g) ? 2O 3(g)的以组元分压表示的平衡常数K p 与以组元物质的量 分数表示的平衡常数K y 之比为 [ D.p -1 ] 11.在373K 、 p Θ下,水的化学势为μl ,水蒸气的化学势为μg ,则 [ A.μl = μg ] 12.在α、β两相中均含有物质A 和B ,A 和B 在α相中的化学势分别为μA(α)和μB(α),A 和B 在β相中的化学势分别为μA(β)和μB(β),当两相达到平衡时应有 [ B.μB(α) = μB(β) ] 13.FeCl 3和H 2O 能形成FeCl 3·2H 2O 、FeCl 3·6H 2O 、2FeCl 3·5H 2O 和2FeCl 3·7H 2O 四种水合物,该体系的组元数和在恒压下最多可能平衡共存的相数为 [ B.C = 2,Φ= 4 ] 14.下列关于杠杆规则适用对象的说法中,不正确的是 [ B.适用于二组元体系的任何相区 ] 15.对(基)元反应A +2B → P 而言,其反应速率方程可以用不同反应物浓度对时间的变化率来表示,即有2B A A A d d c c k t c =-,2B A B B d d c c k t c =-和2B A P P d d c c k t c =三种形式,则k A ,k B 和k P 三者之间的关系为[ C.k A =0.5k B =k P ] 16.标准氢电极是指 [ C.Pt ,H 2(p H 2=p Θ )| H +(a = 1) ] 17.在298K 时,测得浓度为0.1和0.01 mol·kg -1的HCl 溶液构成浓差电池的液接电势为E j(1);若溶液浓度相同,而换用KCl 溶液,则其液接电势为E j(2)。两液接电势的关系为 [ A.E j(1) > E j(2) ] 18.电极电势的改变可以改变电极反应速率,其直接原因是改变了 [ A.反应活化能 ] 19.在相同的温度及压力下,把一定体积的水分散成许多小水滴,经这一变化过程以下性质保持不变的是[ B.表面张力 ] 20.已知肥皂液的表面张力为0.025N·m -1,若球形肥皂泡的直径为1×10-2m ,则该球形肥皂泡所受的附加压强为 [ D.20 Pa ] 21.298K 时,苯蒸气在石墨上的吸附符合兰缪尔吸附等温式,在苯蒸气压为40Pa 时,覆盖度θ = 0.05;当θ = 0.5时,苯的蒸气压为 [ B.760 Pa ] 22.关于物理吸附与化学吸附,下面说法中不正确的是 [ B.物理吸附有选择性,化学吸附无选择性] 23.在一定量的以KCl 为稳定剂的AgCl 溶胶中加入电解质使其聚沉,同浓度下列电解质溶液的用量由小到大的顺序正确的是 [ A.AlCl 3<ZnSO 4<KCl ] 24.在碱性溶液中用HCHO 还原HAuCl 4制备Au 溶胶,其主要反应为:HAuCl 4+5NaOH→NaAuO 2+4NaCl+3H 2O 2NaAuO 2+3HCHO+NaOH→2Au+3HCOONa+2H 2O 若Au 溶胶以AuO 2-为稳定剂,则Au 溶胶的结构式为 [ D.[(Au)m ·x AuO 2-·(x – y ) Na +] y -·y Na + ]最新傅献彩《物理化学》_(下册)_期末总复习
物理化学下册试题及答案
物化复习资料
物理化学期末复习(第五版上)
物理化学期末考试题库(上下册)
物理化学综合复习资料
《物理化学》下册期末考试试卷
(精选)物理化学期末考试习题及答案
《物理化学(第五版)》下册试题
天津大学版物理化学复习提纲
物理化学期末复习
物理化学下册期末试卷(一)
物理化学练习题(下册)
Q (D)ΔH 、Q 关系不定 答案:B 7.298K 时,当H 2SO 4溶液的浓度从0.01mol/kg 增加到0.1mol/kg 时,其电导率κ和摩尔电导率Λm 将 (A) κ减小,Λm 增加 (B) κ增加,Λm 增加 (C) κ减小,Λm 减小 (D) κ增加,Λm 减小 答案:D 8.下列电解质中,离子平均活度系数最大的是 A. 0.01 mol/kg NaCl B. 0.01 mol/kg CaCl 2 C .0.01 mol/kg LaCl 3 D. 0.01 mol/kg CuSO 4 答案:A 9.用同一电导池分别测定浓度为0.01mol/kg 和0.1mol/kg 的两个电解质溶液,其电阻分别为1000Ω和500Ω,则它们的摩尔电导率之比为 (A) 1:5 (B) 5:1 (C) 10:5 (D) 5:10 答案:B 9.电极Tl 3+,Tl +/Pt 的电势为θ1E =1.250 V ,电极Tl +/Tl 的电势
物理化学复习资料
物理化学总复习
温州大学化学专业物理化学(下)期末考试试卷G
《物理化学》下册期末考试试卷
物理化学——期末考试复习资料中南大学
