紫杉醇全合成
紫杉醇全合成
⒇
黄化民 李叶芝(吉林大学化学系,长春,130023)
摘要 评论了紫杉醇全合成的合成战略、合成路线、逆合成分析及展望。参考文献9篇。
关键词 紫杉醇 合成战略 逆合成分析
紫杉醇(Paclitax el,商品名Tax ol)是从红豆杉属(Tax us)的紫杉(红豆杉)树的树皮中分离得到的一种抗癌新药。美国FDA 在1993年批准为抗卵巢癌及乳腺癌的新药。对肺癌及其它癌症的
治疗应用也已进入临床试验阶段[1,2]。1971年首次从红豆杉中提取得
到,并确定了其结构[3]。紫杉树长势极为缓慢,且紫杉醇含量极低,仅
为~0.007%。为此用化学全合成的方法制备紫杉醇是近二十多年来
摆在合成化学家面前的非常引人入胜的挑战,到目前为止,世界上只
有美国和日本两个国家的一些研究组完成了紫杉醇的全合成研究。
下面分成三个方面进行讨论。
一、全合成的战略(Strateg y )选择
已完成紫杉醇全合成研究的研究组在1994年有Holto n 研究组(Florida State University )[4]
,
Nicolaou 研究组(Univ ersity of Califo rnia )[5],1995年有Danishefsky 研究组(Institateforcancer
Resea rch New Yo rk )[6],1997年有Wender 研究组(Stanfo rd Univ ersity)[7]和Mukaiyam a 研究组
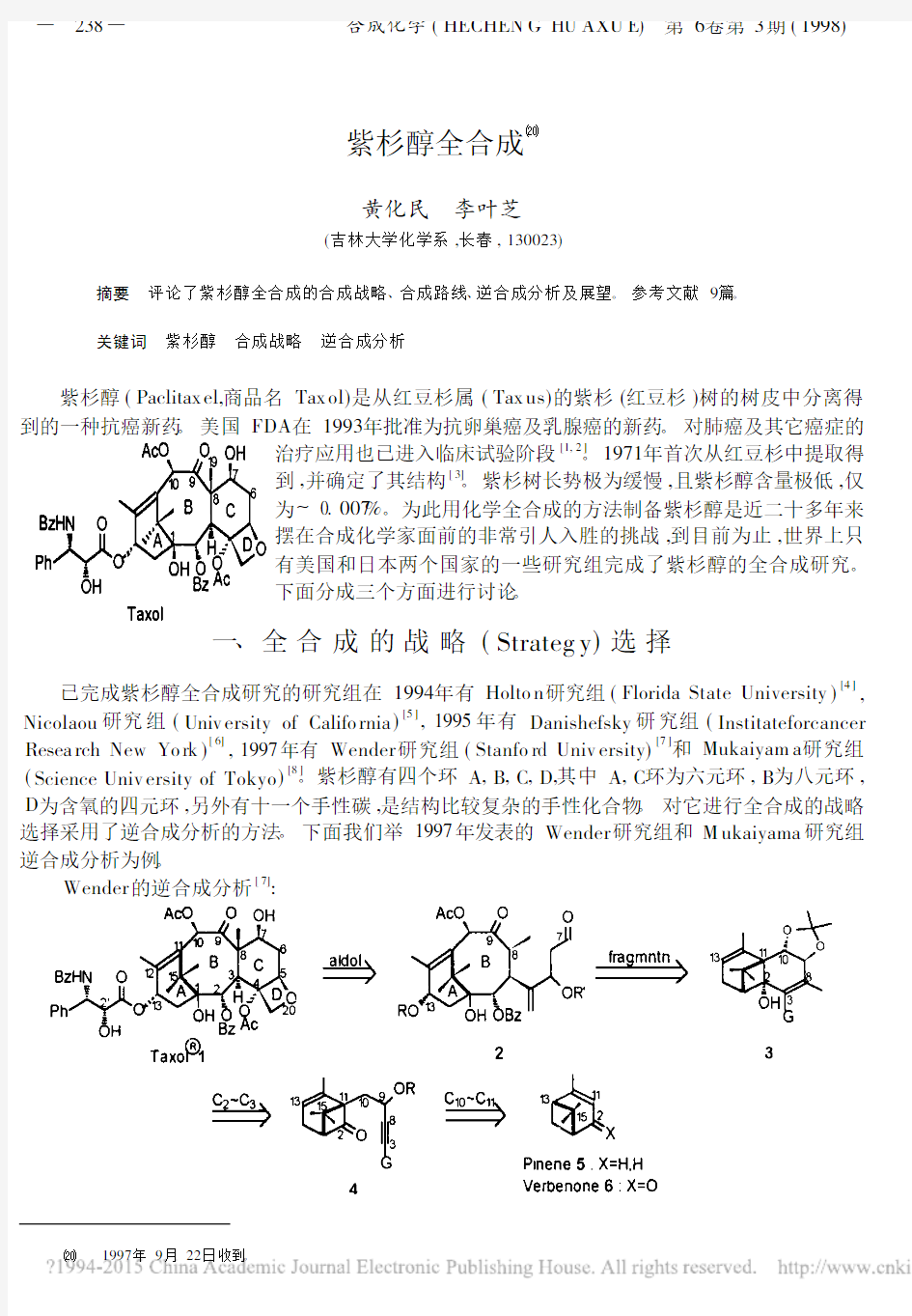
(Science Univ ersity of Tokyo )[8]。紫杉醇有四个环A ,B ,C ,D ,其中A ,C 环为六元环,B 为八元环,D 为含氧的四元环,另外有十一个手性碳,是结构比较复杂的手性化合物。对它进行全合成的战略选择采用了逆合成分析的方法。下面我们举1997年发表的Wender 研究组和M ukaiyama 研究组逆合成分析为例。
Wender 的逆合成分析[7]
:—238—合成化学(HECHEN G HU AXU E) 第6卷第3期(1998)⒇1997年9月22日收到。
DOI:10.15952/https://www.360docs.net/doc/f61902572.html, k i .cjsc.1998.03.006
根据Wender的逆合成分析,可用樟脑或者α-蒎烯为合成紫杉醇的起始物,由六环开始建造A环,再建造A,B环,再建造A,B,C环,最后完成A,B,C,D环的合成。是由A环开始,逐环合成的战略。
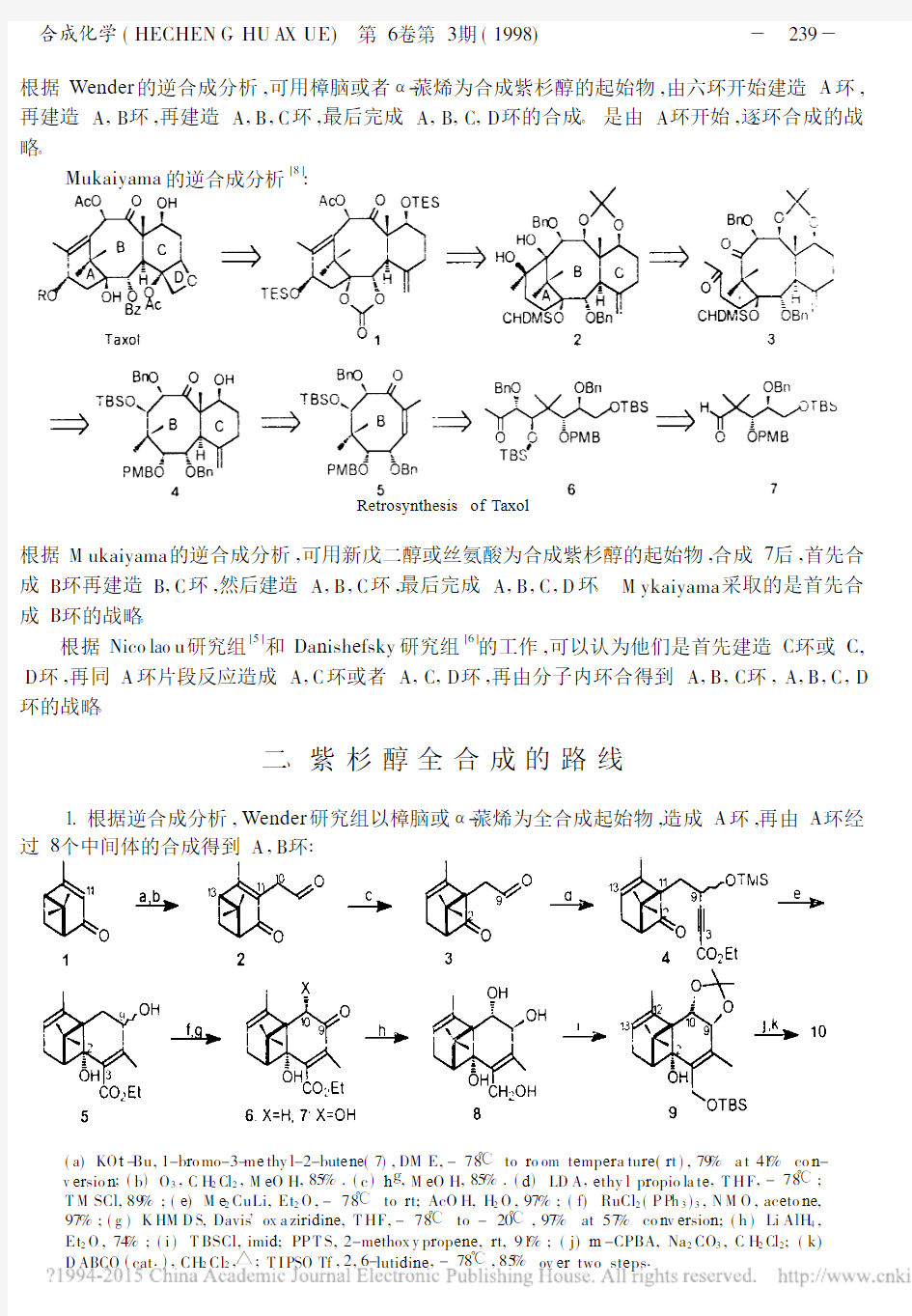
Mukaiyama的逆合成分析[8]:
Retrosynthesis of Taxol
根据M ukaiyama的逆合成分析,可用新戊二醇或丝氨酸为合成紫杉醇的起始物,合成7后,首先合成B环再建造B,C环,然后建造A,B,C环,最后完成A,B,C,D环。M ykaiyama采取的是首先合成B环的战略。
根据Nico lao u研究组[5]和Danishefsky研究组[6]的工作,可以认为他们是首先建造C环或C, D环,再同A环片段反应造成A,C环或者A,C,D环,再由分子内环合得到A,B,C环,A,B,C,D 环的战略。
二、紫杉醇全合成的路线
1.根据逆合成分析,Wender研究组以樟脑或α-蒎烯为全合成起始物,造成A环,再由A环经过8个中间体的合成得到A,B环:
(a)KO t-Bu,1-bro mo-3-me thy l-2-bute ne(7),DM E,-78℃to ro om tempera ture(rt),79%a t41%co n-
v ersio n;(b)O3,C H2Cl2,M eO H,85%.(c)h g,M eO H,85%.(d)LD A,ethy l propio la te,T HF,-78℃;
T M SCl,89%;(e)M e2CuLi,Et2O,-78℃to rt;AcO H,H2O,97%;(f)RuCl2(P Ph3)3,N M O,aceto ne,
97%;(g)K HM D S,Davis’ox a ziridine,T HF,-78℃to-20℃,97%at57%co nv ersion;(h)Li AlH4,
Et2O,74%;(i)T BSCl,imid;PP T S,2-methox y propene,rt,91%;(j)m-CPBA,Na2CO3,C H2Cl2;(k)
D ABCO(cat.),CH2Cl2,△;T I PSO Tf,2,6-lutidine,-78℃,85%ov er two steps.
(l)KO t-Bu,O2,P(O Et)3,T HF,-40℃;N H4Cl,M eO H,rt;Na BH4,91%;(m)H2,Cra btree’s ca ta ly st,
C H2Cl2,rt;TM S-Cl,pyridine,-78℃;triph osgene,0℃,98%;(n)PCC,4?mo lecular siev es,CH2Cl2,
100%
由A,B环出发又经过合成中间体建造A,B,C环。由A,B,C环继续反应建造了A,B,C,D环,最后经过酯化反应得到目标产物:
(a)Ph3PC HOM e,T HF,-78℃,91%;(b)1N HCl(a q),Na I,diox ane,94%a t90%conv ersio n;(c)
T ESCl,pyr,C H2Cl2,-30℃,92%;(d)Dess-M a rtin periodinane,CH2Cl2;Et3N,Eschenmoser’s salt,
97%;(e)allyl-M g Br,ZnCl2,T HF,-78℃,89%;(f)BO M Cl,(i-Pr)2N Et,55℃;(g)N H4F,M eO H,rt,
93%ov er tw o steps;(h)Ph Li,T HF,-78℃;Ac2O,DM AP,py r,79%;(i)7,C H2Cl2,rt,1h,80%at63%
co nv er sion;(j)O3,C H2Cl2,-78℃;P(O Et)3,86%
(k)DM AP(xs),CH2Cl2;Tr oc Cl,62%.(l)N a I,HCl(aq),aceto ne,97%at67%co nv er sion;(m)M sCl,
py r.DM AP,CH2Cl2,83%;(n)LiBr,aceto ne,79%at94%co nv ersio n;(o)O sO4,py r,T HF;N a HSO3;
imid.CHCl3,76%at94%conv ersio n;(p)tripho sg ene,py r,CH2Cl2,92%;(q)KCN,EtO H,0℃,76%a t
89%co nv er sion;(r)(i-Pr)2N Et,toluene,110℃,95%at83%conv ersio n;(s)Ac2O,DM A P,89%;(t)
T ASF,T HF,0℃;Ph Li,-78℃,46%10-deacety lbacca tinⅢ,33%baccatinⅢ.
2.Mukaiyama研究组的合成路线[8]
根据M ukaiyama研究组的逆合成分析,他们是以新戊二醇或丝氨酸为全合成的起始物,由新戊二醇或丝氨酸经过以下各步合成化合物4:
Synthesis of optically act ive trialkoxy aldehyde4(Route2)
化合物4经过以下步骤建造B环及B,C环:
Synthesis of BC ring system
再由B,C环建造了含A,B,C环的化合物进而继续反应得到A,B,C,D环,最后A,B,C,D环的化合物同β-氨基酸衍生物反应得到目标产物紫杉醇:
Total synthesis of Taxol
3.Danishefsky的全合成路线
Danishefsky的全合成战略是先造成C,D环及A环片段,他的合成路线如下:
C,D环片段的合成:
Reag ents:(a)Na BH4,EtO H,0℃,97%;(b)Ac2O,DM A P,py r,CH2Cl2,0℃,99%;(c)(HO C H2)2,Ph H, naphthalenesulfo nic acid,reflux,70%;(d)N aO M e,M eO H,T HF,98%;(e)T BSO Tf,2,6-lutidine,
CH2Cl2,0℃,97%.
Reag ents:(a)(i)BH3·T HF,T HF,0℃~r t;(ii)H2O2,NaO H,H2O;(iii)PDC,CH2Cl2,0℃~rt;(iv) NaO M e,M eO H,62%;(b)(i)K HM DS,T HF,-78℃;(ii)PhN Tf2,81%;(c)Pd(O Ac)2,PPh3,CO,Hu-nig’s base,M eO H,DM F,73%;(d)DIBA L,h ex a nes,-78℃,99%;(e)M e3S+I-,K HM D S,T HF,0℃, 99%;(f)Al(O i-Pr)3,PhM e,reflux,99%.
Reag ents:(a)OsO4,N M O,aceto ne,H2O,66%;(b)T M SCl,pyr.CH2Cl2,-78℃~r t;(c)T f2O,-78℃~rt;(d)(HO CH2)2,40℃,69%.
Reag ents:(a)BnBr,Na H,TBAl,T HF,0℃~r t,98%;(b)T sO H,ace tone,H2O,70℃,84%.
Reag ents:(a)T M SO T f,Et3N,CH2Cl2,-78℃;(b)3,3-dime thy ldio xira ne,CH2Cl2,0℃;CSA,aceto ne, rt,89%;(c)Pb(O Ac)4,M eO H,Ph H,0℃,97%;(d)M eO H,CP T S,70℃,97%;(e)Li Al H4,T HF,0℃, 100%;(f)o-N O2C6H4SeCN,P Bu3,T HF,r t,88%.
A环片段的合成:
Reag ents:(a)H2N N H2,Et3N,EtO H,72%;(b)I2,DBN,T HF,52%;(c)I2,DBN,T HF,89%;(d)TM-SCN,cat.K CN,18-cro w n-6,CH2Cl2,89%.
再由C,D环同A环的片段反应造成A,C,D环,其反应表示为:
Reag ents:(a)(i)T HF,-78℃,93%;(ii)T BA F,T HF,-78℃,80%;(b)mCPBA,CH2Cl2,r t,80%;(c) H2,Pd/C,-5℃,EtO H,65%;(d)CDI,N a H,DM F,81%;(e)L-Selectride,T HF,-78℃,93%.
通过A,C,D环分子内环合反应,得到A,B,C,D环,最后经过酯化反应得到目标产物:
Reag ents:(a)PhN Tf2,K HM D S,T HF,-78℃,98%;(b)P PT S,acetone,H2O,96%;(c)Ph3P=CH2,
T HF,-78℃~0℃,77%;(d)Pd(PPh3)4,K2CO3,CH3CN,85℃,49%.
Reag ents:(a)TBA F,T HF,rt,92%;(b)T ESO Tf,Et3N,CH2Cl2,-78℃,92%;(c)M CPBA,N a HCO3,
CH2Cl2,r t,45%;(d)H2,Pd/C,EtO H,r t,82%;(e)Ac2O,DM AP,py r,r t,66%;(f)Ph Li,T HF,-78℃,
93%;(g)O sO4,py r,105℃;(h)Pb(O Ac)4,Ph H,M eO H,0℃,61%;(i)Sm I2,Ac2O,T HF,-78℃,
92%;(j)K O t-Bu,(Ph SeO)2O,T HF,-78℃;KO t-Bu,T HF,-78℃,81%;(k)Ac2O,DM A P,pyr,76%.
Reag ents:(a)PCC,N aO Ac,Ph H,reflux,64%;(b)N aBH4,M eO H,79%;(c)HF·py r,T HF,85%;(d)
refs8,9a nd42.
三、展望
紫杉醇是目前已发现的又一种有抗癌活性的天然药物,除了开辟天然紫杉醇的来源以外,世界各国合成化学家都在迎接这一挑战,进行化学合成紫杉醇的研究工作,我国已有半合成紫杉醇及其
类似物研究工作发表[9]。但到目前为止,只有美国和日本的报道完成了紫杉醇的全合成。他们研究的共同特点是:采用逆合成分析的方法确定全合成战略;找到由易得的起始物为原料;使用有特色的尽可能有高立体选择性的实验方法。但紫杉醇是结构比较复杂的化合物,它有A,B,C,D四个环和11个手性碳。为了保证环的形成及其立体选择性,目前除Mukaiyam a的合成路线中每一步选择性都较好以外,多数的合成路线过程过长,合成的总产率过低。因此,为了提高总的收率,在合成路线上仍有改进的余地,也可以考虑缩短反应过程,在合成战略上也还可以另辟新径。对紫杉醇及其类似物从天然产物中的提取、分离、精制、化学修饰及其类似物的半合成研究仍有大量研究工作可作。作为我国的合成化学家应尽快地开辟自己的合成战略路线,开展全合成研究,迎接这一挑战。
致谢:M ukaiyama教授的论文“Asymm etric T o ta l Synthesis of T ax ol”在1997年发表后立即给我们寄来了论文的单行本,对完成本篇文章给了启示和推动作用,谨此致谢。
参考文献
[1] 魏昌华等:中国药学杂志,1996,31(5),359.
[2] 俞培忠等:中国药学杂志,1996,31,390.
[3] W ani,M.C.;Ta ylor,H.L.;W all,M.E.;Cog go n,P.;M cphail,A.T.:J.Am.Chem.Soc.,1971,93,2325.
[4] Ho lto n,R.A.;Somo za,C.;Kim,H-B.;Liang,F.,et a l.:J.Am.Chem.Soc.,1994,116,1597;1994,116,1599.
[5] N ico lao u,R.C.;Ya ng,Z.;Liu,J.J.,et al.:N atur e,1994,367,630.
[6] Da nishefsky,S.J.;M aste rs,et al.:Ang ew.Chem.Iut.Ed.Eng l.,1995,34,1723.
[7] W ender,A.;Badham N eil F.,e t a l.:J.Am.Chem,Soc.,1997,119,2755;2757.
[8] M ukaiyama,M.J.A.;Shin,I.,et al.:Pr oc.J apan,Acad,1997,73,Ser B,95.
[9] Qin,Y.;Qi,C.F.;X iao,T.L.:Chinese Chem.L ett.,1996,7(10),886.
Total Synthesis of Taxol
Huang,Hua-Min Li,Ye-Z hi
(Depar tment of Chemistr y,J ilin U niv er sity,Cha ng ch un,130023)
Abstract Strateg y o f to tal sy nthesis of taxo l,retrosynthetic analysis,ro ute o f sy nthesis a nd prospects for the synthesis of tax ol w ere discussed with9references.
Keywords Tax ol,Strategy o f sy nthesis,Retrosy nthetic analysis.
紫杉醇
抗癌药物 ——紫杉醇 一、前沿 1963年美国化学家瓦尼(M.C. Wani)和沃尔(Monre E. Wall)首次从一种生长在美国西部大森林中称谓太平洋杉(Pacific Yew)树皮和木材中分离到了紫杉醇的粗提物。在筛选实验中,Wani和 Wall发现紫杉醇粗提物对离体培养的鼠肿瘤细胞有很高活性,并开始分离这种活性成份。由于该活性成份在植物中含量极低,直到1971年,他们才同杜克(Duke)大学的化学教授姆克法尔(Andre T. McPhail)合作,通过x-射线分析确定了该活性成份的化学结构——一种四环二萜化合物,并把它命名为紫杉醇(taxol)。 紫杉醇具有显著的抗癌活性和独特的作用机理,现主要用于治疗晚期乳腺癌和卵巢癌等癌症。紫杉醇分子结构复杂,具有特殊的三环[6+8+6]碳架和桥头双键以及众多的含氧取代基。其全合成引起国内外许多有机化学家的兴趣。先后共有30多个研究组参与研究,实属罕见。经20多年的努力,于1994年才由美国的R.A.Holton与K.C.Nicolaou两个研究组同时完成紫杉醇的全合成。随后,S.T.Danishefsky(1996年)、P.A.Wender(1997年)、T.Mukaiyama(1998年)和I.Kuwajima(1998年)4个研究组也完成这一工作。6条合成路线虽然各异,但都具有优异的合成战略,把天然有机合成化学提高到一个新水平。 紫杉醇是目前已发现的最优秀的天然抗癌药物,在临床上已经广泛用于乳腺癌、卵巢癌和部分头颈癌和肺癌的治疗.紫杉醇作为一个具有抗癌活性的二萜生物碱类化合物,其新颖复杂的化学结构、广泛而显著的生物活性、全新独特的作用机制、奇缺的自然资源使其受到了植物学家、化学家、药理学家、分子生物学家的极大青睐,使其成为20世纪下半叶举世瞩目的抗癌明星和研究重点,包括寻找新的生物资源、化学全合成、半合成、衍生物制备、生物转化、生物合成、生物工程、构-效关系研究、作用机制研究、药理学和药效学等研究.2011年是发现紫杉醇结构40周年,对紫杉醇发现的曲折历史过程进行回顾和总结,以纪念这一伟大发现并纪念为紫杉醇的研究与第二代紫杉醇的开发作出贡献的科学家。 二、紫杉醇的制备 1.1 天然红豆杉植物提取 紫杉醇的最直接来源是对天然植物红豆杉属种的提取红豆杉属植物共11种,我国有4种及1种变种,它们分别是云南红豆杉、西藏红豆杉(又名喜马拉雅红豆杉)、中国红豆杉、东北红豆杉、南方红豆杉(又名美丽红豆杉)。由于这些植物数量极少,自身繁殖率低,生长缓慢,且紫杉醇的含量又极低(每千克干树皮最多只能得到50~150mg 的纯紫杉醇),生产1g紫杉醇需砍伐3~4棵60年树龄的大树。在这种情况下,要获得足够的紫杉醇用于临床研究和基础研究,单纯靠从天然植物树皮中提取必将给红豆杉属植物的在自然界中的生存带来极大的威胁。但由于从树皮中提取紫杉醇的工艺已经成熟且工业化,因此,人们可利用人工栽培的方法来解决天然资源不足的问题. 1.2人工栽培
第6章紫杉醇生产工艺
第六章紫杉醇的生产工艺 6.1 概述 6.1.1 紫杉醇类药物 1、紫杉醇 紫杉醇(Paclitaxel,Taxol?)的化学名称为5β,20-环氧-1β,2α,4α,7β,13α-五羟基-紫杉-11-烯-9-酮-4-乙酸酯-2-苯甲酸酯-10-乙酰基-13-[(2′R,3′S) -N-苯甲酰基-3′-苯基异丝氨酸酯] ,英文化学名称为13-[(2′R,3′S) -N-carboxyl-3′-phenylisoserine, N-benmethyl ester, 13-ester with 5β,20-epoxyl-1β,2α,4α,7β,13α-hexahydroxytax-11-en-9-one-4-acetate-2-benzoate,trihydrate。 紫杉醇具有复杂的化学结构,属三环二萜类化合物,整个分子由三个主环构成的二萜核和一个苯基异丝氨酸侧链组成(图6-1)。分子中有11个手性中心和多个取代基团。分子式为C47H51NO14,分子量为853.92,元素百分比为C:66.41,H:6.02,N:1.64,O:26.23。紫杉醇难溶于水,易溶于甲醇、二氯甲烷和乙氰等有机溶剂。 图6-1 紫杉醇的化学结构 2、多烯紫杉醇 多烯紫杉醇(多西他赛,Docetaxel,Taxotere?,图6-2)是在开展紫杉醇半合成研究过程中发现的一种紫杉醇类似物,两者仅在母环10位和侧链上3'位上的取代基略有不同。多烯紫杉醇的化学名称是5β,20-环氧-1β,2α,4α,7β,10β,13α-六羟基-紫杉-11-烯-9-酮-4-乙酸酯-2-苯甲酸酯-13-[(2′R,3′S) -N-叔丁氧羰基-3′-苯基异丝氨酸酯]·三水合物,英文化学名称为-13-[(2′R,3′S) -N-carboxyl-3′-phenylisoserine, N-tertbutyl ester, 13-ester with 5β,20-epoxyl-1β,2α,4α,7β,10β,13α-hexahydroxytax-11-en-9-one-4-acetate-2-benzoate,trihydrate 。分子式为C43H53NO14·3H2O,相对分子质量为861.9。 1985年,法国罗纳普朗克乐安公司(Rhone-Poulenc Rorer)公司和法国国家自然科学研究中心(CNRS)以10-DAB作为母环骨架,通过半合成方法成功地合成出多烯紫杉醇,目
紫杉醇地合成
紫杉醇的合成 这学期的有机合成设计原理与应用是陈老师教授的,给我感觉最深刻的是其灵活的头脑和丰富的知识储备,他教授的不仅仅是书本上的现有知识,还把他的人生经验也说给我们听,这样可以是我们避免走弯路错路。通过这门课程的学习,我知道书本上的知识是最基本的,首先我们应当把最基本的问题搞懂搞通,其次我们还必须查找丰富资料。巧妇难为无米之炊,就是这个道理。当我们拿到一个待合成的化合物时,首先我们先要分析它是由什么官能团组成的,往往有机合成不可能一步就能反应好的,所以我们就需要对合成路线进行分析,而最常用的设计方法就是逆合成法。 以下我以陈老师上课所讲过的紫杉醇为例,分析其合成方法与步骤。 紫杉醇是红豆杉属植物中的一种复杂的次生代谢产物, 也是目前所了解的惟一一种可以促进微管聚合和稳定已聚合微管的药物。同位素示踪表明, 紫杉醇只结合到聚合的微管上, 不与未聚合的微管蛋白二聚体反应。细胞接触紫杉醇后会在细胞内积累大量的微管,这些微管的积累干扰了细胞的各种功能,特别是使细胞分裂停止于有丝分裂期,阻断了细胞的正常分裂。通过Ⅱ-Ⅲ临床研究,紫杉醇主要适用于卵巢癌和乳腺癌,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也都有一定疗效。 紫杉醇的化学结构式如下:
从中可以知道紫杉醇的化学结构极其复杂,它的分子中含稠合的两个六元环、一个八元环和一个四元醚环,并含有两个手性碳的侧链,共有十一个手性碳。由于红豆杉资源有限,因此对在合成紫杉醇的研究上是一重大挑战。在此,不对称合成方法就起了重要作用。 不对称合成法也称手性合成、立体选择性合成、对映选择性合成,是研究向反应物引入一个或多个具手性元素的化学反应的有机合成分支。按照Morrison和Mosher的定义,不对称合成是“一个有机反应,其中底物分子整体中的非手性单元由反应剂以不等量地生成立体异构产物的途径转化为手性单元”。这里,反应剂可以是化学试剂、催化剂、溶剂或物理因素。普通不对称合成是指依靠直接或间接有天然获得的手性化合物衍生的基团诱导产生手性化合物的合成。不对称合成目前在药物合成和天然产物全合成中都有十分重要的地位。但无疑,现在最完善的不对称合成技术,要数存在于生物体内的酶。能否实现像酶一样高效的催化体系,是对人类智慧的挑战。 但不对称合成法有何重要意义呢?举个简单的例子,青霉素我们再熟悉不过了,作为一种药力强,副作用小的抗生素药物,长期以来一直被人们广泛的使用。然而近来人们发现,青霉素分子同样存在两种手性分子,其中一种有药效,而另一种却根本没有。换句话说,我们花了一瓶青霉素的
紫杉醇的合成
苏州大学研究生考试答卷封面 考试科目: 有机合成考试得分 院别: 材料与化学化工学部专业: 分析化学 学生姓名: 饶海英学号: 20114209033 授课教师: 考试日期: 2012 年 1 月8 日 天然抗癌药物紫杉醇的合成进展 摘要:本文对多烯紫杉醇的合成的各种合成方法进行了综述。 关键词:多烯紫杉醇合成抗癌 多烯紫杉醇(daxotere) 商品名为多西她赛(Docetaxel) , 化学名为[ 2aR-( 2aα, 4β, 4aβ, 6β,9α, ( aR3, βS3) , 11α, 12α, 12aα, 12bα) ] -β- [ [ (1, 1 2二甲基乙氧基)羰基]氨基] -α-羟基苯丙酸[ 12b-乙酰氧-12 -苯甲酰氧-2a, 3, 4, 4a, 5, 6, 9,10, 11, 12, 12a, 12b -十二氢-4, 6, 11-三羟基-4a, 8,13, 13 -四甲基-5-氧代-7, 11-亚甲基-1H-环癸五烯并-[ 3, 4 ]苯并[ 1, 2-b ]氧杂丁环-9-基]酯,就是法国罗纳普朗克·乐安公司开发的半合成紫杉醇的衍生物,它对晚期乳腺癌、非小细胞肺癌、卵巢癌、前列腺癌、胰腺癌、肝癌、头颈部癌、胃癌等均有效。其作用机制就是通过与肿瘤细胞微管蛋白结合, 加强微管蛋白的聚合、抑制微管解聚,最终形成稳定的非功能性微管束, 从而抑制肿瘤细胞的有丝分裂与增殖[1-3] 。 商业化生产的紫杉醇类抗癌药物大多采用半合成方法,这就是现阶段最具经济性与可操作性的合成方法。多烯紫杉醇的半合成方法就是利用从红豆杉属植物的针叶中提取的10-去乙酰基巴卡亭Ⅲ (10-DAB ) ,通过选择性保护部分羟基, 然后在10-DAB C13位的羟基上连接合成的手性侧链, 再去掉保护基团得到。其中以多烯紫杉醇C13位侧链的合成以及该侧链与选择性保护的母核10-DAB进行酯化反应最为重要[4-5] 。 紫杉醇的构效关系已经被众多学者所研究与总结。具有游离羟基的C13位侧链,C2与C4位的酯基,C4、C5位四元含氧环及紫杉烷的刚性环结构对抗癌活性都起着很重要的作用。 1988年,Potier等从欧洲紫杉(Taxus baccata)中分离得到10-去乙酰巴卡亭(Baccatin) Ⅲ( DAB),DAB 已被成功地用来半合成紫杉醇,并已工业化生产[6]。半
紫杉醇化学半合成进展
文章编号:1009-220X (2001)03-0052-09 紫杉醇化学半合成进展ΞΞΞΞ 周忠强 梅兴国 常俊丽 陈 菁 柯 铁 (华中理工大学生命科学与技术学院,湖北武汉430074) 摘 要:综述了以10-去乙酰巴卡亭Ⅲ和10-去乙酰紫杉醇为前体的紫 杉醇化学半合成。 关键词:紫杉醇;半合成;10-去乙酰巴卡亭Ⅲ;10-去乙酰紫杉醇;侧链 中图分类号:O621.3 文献标识码:A 1971年,Wani 等[1]从短叶红豆杉(T axus brevifolia )树皮中分离得到紫杉醇(tax ol ,1)。它对常规化疗,包括顺铂在内无效的卵巢癌有独特的疗效。美国食品和药物管理局于1992年12月批准紫杉醇作为治疗转移性卵巢癌的新药上市,1994年又批准该药用于治疗转移性乳腺癌;加拿大和瑞典也于1993年批准该药上市,。 紫杉醇在树皮中含量只占树皮干重的0.007%~0.069%,而且提取难度颇大。紫杉醇的生物合成研究取得了较大进展[2],但与工业化生产仍有一定距离。多年来,化学家们一直致力于紫杉醇的化学合成研究。紫杉醇的全合成已取得成功[3~7],但皆因路线长、收率低等原因目前无法实现工业化。比较而言,化学半合成具有实用价值。已报 道的半合成一类以10-去乙酰巴卡亭Ⅲ(10-deacetyl baccatin Ⅲ )为前体,另一类则以10-去乙酰紫杉醇(10-eaccetyl tax ol )为前体。下面分别对这两类半合成进行综述 。第26卷第3期 2001年9月 广 州 化 学 G uangzhou Chem istry V ol.26,N o.3 Sept.,2000 收稿日期:2000-06-19 基金项目:国家“九五”科技攻关项目(96-C02-03-01)
紫杉醇的合成
苏州大学研究生考试答卷封面 考试科目:有机合成考试得分:________________院别:材料与化学化工学部专业:分析化学 学生姓名:饶海英学号: 033 授课教师: 考试日期: 2012 年 1 月 8 日
天然抗癌药物紫杉醇的合成进展 摘要:本文对多烯紫杉醇的合成的各种合成方法进行了综述。 关键词:多烯紫杉醇合成抗癌 多烯紫杉醇(daxotere) 商品名为多西他赛(Docetaxel) , 化学名为 [ 2aR-( 2aα, 4β, 4aβ, 6β,9α, ( aR3, βS3) , 11α, 12α, 12aα, 12bα) ] -β- [ [ (1, 1 2二甲基乙氧基)羰基]氨基] -α-羟基苯丙酸[ 12b-乙酰氧-12 -苯甲酰氧-2a, 3, 4, 4a, 5, 6, 9,10, 11, 12, 12a, 12b -十二氢-4, 6, 11-三羟基-4a, 8,13, 13 -四甲基-5-氧代-7, 11-亚甲基-1H-环癸五烯并-[ 3, 4 ]苯并[ 1, 2-b ]氧杂丁环-9-基]酯,是法国罗纳普朗克·乐安公司开发的半合成紫杉醇的衍生物,它对晚期乳腺癌、非小细胞肺癌、卵巢癌、前列腺癌、胰腺癌、肝癌、头颈部癌、胃癌等均有效。其作用机制是通过与肿瘤细胞微管蛋白结合, 加强微管蛋白的聚合、抑制微管解聚,最终形成稳定的非功能性微管束, 从而抑制肿瘤细胞的有丝分裂和增殖[1-3] 。 商业化生产的紫杉醇类抗癌药物大多采用半合成方法,这是现阶段最具经济性和可操作性的合成方法。多烯紫杉醇的半合成方法是利用从红豆杉属植物的针叶中提取的10-去乙酰基巴卡亭Ⅲ (10-DAB ) ,通过选择性保护部分羟基, 然后在10-DAB C 13 位的羟基上连接合成的手性侧链, 再去掉保护基团得到。其中以多 烯紫杉醇C 13 位侧链的合成以及该侧链与选择性保护的母核10-DAB进行酯化反应最为重要[4-5] 。 紫杉醇的构效关系已经被众多学者所研究和总结。具有游离羟基的C 13 位侧 链,C 2和C 4 位的酯基,C 4 、C 5 位四元含氧环及紫杉烷的刚性环结构对抗癌活性都起 着很重要的作用。 1988年,Potier等从欧洲紫杉(Taxus baccata)中分离得到10-去乙酰巴卡亭(Baccatin) Ⅲ( DAB),DAB 已被成功地用来半合成紫杉醇,并已工业化生产[6]。半合成紫杉醇被认为是除人工种植外,扩大紫杉醇来源的最有效途径。随着对紫杉醇类似物构效关系的深入研究,第一个紫杉醇类似物的半合成药物多烯紫杉醇 被开发成功。多烯紫杉醇C 13侧链中C 3 N上叔丁氧羰基取代了紫杉醇的苯羰基,其 体外对微管解聚的抑制率是紫杉醇的2倍,抗癌谱也宽于紫杉醇,水溶性高出紫
Taxol biosynthesis and molecular genetics-紫杉醇生物合成途径
Taxol biosynthesis and molecular genetics Rodney Croteau*,Raymond E.B.Ketchum,Robert M.Long,Ru diger Kaspera &Mark R.Wildung Institute of Biological Chemistry,Washington State University,Pullman,WA,99164-6340,USA;*Author for correspondence(Tel:+1-509-335-1790;Fax:+1-509-335-7643;E-mail:croteau@https://www.360docs.net/doc/f61902572.html,) Key words:baccatin,cytochrome P450taxoid hydroxylases,paclitaxel,Taxaceae,taxadiene synthase, taxane diterpenoids,taxoid acyl transferases,taxoids,Taxol,Taxus,yew. Abstract Biosynthesis of the anticancer drug Taxol in Taxus(yew)species involves19steps from the universal diterpenoid progenitor geranylgeranyl diphosphate derived by the plastidial methyl erythritol phosphate pathway for isoprenoid precursor supply.Following the committed cyclization to the taxane skeleton,eight cytochrome P450-mediated oxygenations,three CoA-dependent acyl/aroyl transfers,an oxidation at C9, and oxetane(D-ring)formation yield the intermediate baccatin III,to which the functionally important C13-side chain is appended in?ve additional steps.To gain further insight about Taxol biosynthesis relevant to the improved production of this drug,and to draw inferences about the organization,regula-tion,and origins of this complex natural product pathway,Taxus suspension cells(induced for taxoid biosynthesis by methyl jasmonate)were used for feeding studies,as the foundation for cell-free enzymology and as the source of transcripts for cDNA library construction and a variety of cloning strategies.This approach has led to the elucidation of early and late pathway segments,the isolation and characterization of over half of the pathway enzymes and their corresponding genes,and the identi?cation of candidate cDNAs for the remaining pathway steps,and it has provided many promising targets for genetically engineering more e?cient biosynthetic production of Taxol and its precursors. Abbreviations:DD-RT-PCR–di?erential display of mRNA-reverse transcription-polymerase chain reac-tion;DMAPP–dimethylallyl diphosphate;DXP–1-deoxy-D-xylulose-5-phosphate;EST–expressed se-quence tags;GGPP–geranylgeranyl diphosphate;GGPPS–geranylgeranyl diphosphate synthase;IPP–isopentenyl diphosphate;IPPI–isopentenyl diphosphate isomerase;MEP–2-C-methyl-D-erythritol phos-phate;NMR–nuclear magnetic resonance spectroscopy;PAM–phenylalanine aminomutase; TS–taxadiene synthase. Taxol,arguably the most successful anti-cancer drug of all time,was structurally de?ned by Wall and Wani and their colleagues in1971(Wani et al., 1971)and gained?rst marketing approval from the U.S.Food and Drug Administration for the treatment of refractory ovarian cancer in1992and metastatic breast cancer in1994(Su?ness and Wall,1995).The very long development time for this drug was a consequence of limited supply from the original source,the bark of the Paci?c yew Taxus brevifolia(the harvest was destructive, the puri?cation was complicated,and the yields were low but,conversely,the politics of supply were exceedingly abundant(Goodman and Walsh, 2001)),coupled to formulation problems due to the very hydrophobic nature of this diterpenoid natural product and concerns about side e?ects (Arbuck and Blaylock,1995).Were it not for the encouragement of Matt Su?ness and others at the National Cancer Institute(Wall and Wani,1995; Phytochemistry Reviews(2006)5:75–97óSpringer2006 DOI:10.1007/s11101-005-3748-2
紫杉醇
第七章 7.4 紫杉醇的生产工艺 7.4.1 概述 紫杉醇(Paclitaxel,Taxol?,图1),最早是由美国化学家Wani 和Wall于1971年从太平洋红豆杉的树皮中提取到的一种具有抗肿瘤活性的物质。它具有独特的抗癌机制,其作用位点为有丝分裂和细胞周期中至关重要的微管蛋白。紫杉醇能促进微管蛋白聚合而形成稳定的微管,并抑制微管的解聚,从而抑制了细胞的有丝分裂,最终导致癌细胞的死亡。紫杉醇1992年12月被美国FDA批准用于治疗晚期卵巢癌。1994年,批准用于治疗转移性乳腺癌,1997年FDA批准使用紫杉醇治疗爱滋病关联的Kaposi's恶性肿瘤;1998年和1999年,FDA又分别批准半合成紫杉醇与顺铂联合使用作为治疗晚期卵巢癌和非小细胞肺癌的一线用药。紫杉醇是近几年国际公认的疗效确切的重要的抗肿瘤药物之一。 -五羟基-紫杉-11-烯-9-酮-4-乙酸酯-2-苯甲酸酯-10-乙酰基-13-a,13b,7a,4a,2b,20-环氧-1b紫杉醇具有复杂的化学结构,整个分子由三个主环构成的二萜核和一个苯基异丝氨酸侧链组成。分子中有11个手性中心和多个取代基团。分子式C47H51NO14,分子量853.92,元素百分比C:66.41,H:6.02,N:1.64,O:26.23。化学名:5 [(2′R,3′S) -N-苯甲酰基-3′-苯基异丝氨酸酯] 紫杉醇的来源最初以天然提取为主,主要是从由红豆杉属植物的树皮中分离得到。红豆杉植物是生长极为缓慢的乔木或灌木,其树皮中紫杉醇的含量平均为万分之一点五,从中提取紫杉醇的收率大约为万分之一,这样制取1 kg紫杉醇就需树皮10吨,这种生产紫杉醇的方法严重破坏资源和环境。目前,包括我国在内的许多国家都已经禁止或严格限制用这种方法来生产紫杉醇。为解决紫杉醇的大量供应问题,人们曾探索通过组织和细胞培养、化学合成等方法制取紫杉醇。其中,化学合成是人们首先想到的解决紫杉醇药源问题的一条途径。这里的化学合成又有全合成和半合成之分。 如前所述,紫杉醇的分子结构十分复杂,分子中有众多的功能基团和立体化学特征,如此复杂的结构堪称是对化学合成的一个挑战。1994年,紫杉醇的全合成在实验室获得成功[1,2]。到目前为止,文献报道的紫杉醇的全合成路线共有3条,即1994年由Holton和Nicolaou研究组几乎同时完成的2条路线以及1996年Danishefsky小组报道的路线。紫杉醇的全合成中,反应步骤多达20—25步,大量使用手性试剂,反应条件极难控制,制备成本昂贵,虽然具有重要的理论意义,但不适合大规模工业生产。 为了避免合成紫杉醇复杂的母环部分,人们探索了半合成的制备方法。研究发现,红豆杉植物中除紫杉醇外,还有大量母环结构与紫杉醇类似的化合物,其中,最重要的是巴卡亭
抗癌药物紫杉醇的制备、抗癌机理和应用前景
抗癌药物紫杉醇的制备、抗癌机理和应用前景 摘要紫杉醇具有显著的抗癌活性和独特的作用机理,现主要用于治疗晚期乳腺癌和卵巢癌等。紫杉醇分子结构复杂,具有特殊的三环[6+8+6]碳架和桥头双键以及众多的含氧取代基,其全合成引起国内外许多有机化学家的兴趣。本文简述紫杉醇的制备、抗癌机理和不良反应。 关键词紫杉醇制备抗癌机理不良反应 紫杉醇(Taxol)是从短叶红豆杉树皮中分离得到的一种四环二萜化合物。1992年12月29日美国FDA正式批准紫杉醇作为治疗晚期卵巢癌的新抗癌药物。由于该药疗效确切、副作用小,在美国上市后销售情况一直很好,并保持着20%以上的年销售增长率。2000年该药的销售额已超过10亿美元。紫杉醇被当今世界上公认为广谱、活性最强的抗癌药物,尤其是对子宫癌、卵巢癌、乳腺癌具有特殊的疗效,它的问世被誉为20世纪90年代国际上抗癌药三大成就之一[1]。美国FDA已原则上同意其他国家及厂家生产紫杉醇制剂并可以作为通用名药上市,这就打破了美国施贵宝公司对该药的垄断生产。这一决定意味着紫杉醇制剂价格将大幅下降,从而有利于广大肿瘤患者服用。然而由于这种天然化合物资源极其有限,严重的限制了其研究和应用的进度。同时尖锐的供需矛盾也在医学、化学和植物组织培养领域的科学家中引起了一场非同寻常的广泛研究,以增加这种化合物的来源和寻找高效、低毒、来源丰富的紫杉醇类似物。经过40多年努力,已经取得了可喜的进展。 1紫杉醇的制备 1.1天然红豆杉植物提取[2,3] 紫杉醇的直接来源是从天然植物红豆杉树皮、树叶中提取。但并不是所有品种的红豆杉树均含有紫杉醇,而且不同种类的红豆杉紫杉醇含量的多少差别非常明显。红豆杉属植物共11种,我国有4种及1种变种,它们分别是云南红豆杉、西藏红豆杉(又名喜马拉雅红豆杉)、中国红豆杉、东北红豆杉、南方红豆杉(又名美丽红豆杉)。紫杉醇在不同植物来源以及植物体不同部位的含量与提取分离有着直接关系。Vidensek对东北红豆杉幼苗以及成树的不同部位中的紫杉醇含量作了分析,结果表明,成树紫杉醇的含量高低依次为:树皮>树叶>树根>树干>种子>心材。对于不同植物来源的组织培养细胞中的紫杉醇含量,陈未名等作了大量研究,结果表明,愈伤组织中的紫杉醇含量以云南红豆杉为最高,其次为欧洲红豆杉,再次为红豆杉;而悬浮培养细胞中的紫杉醇含量从高到低依次为云南红豆杉、欧洲红豆杉、红豆杉。 红豆杉植物样品经过预处理,再用有机溶剂提取,然后用液-液萃取法、固相萃取法、CO2超临界流体萃取法等方法进行萃取,再经过柱层析法、薄层色谱法、沉淀法、胶束电动毛细管色谱法、膜分离法、树脂吸附分离法、高速逆流色谱法、化学反应法、药理作用靶点法分离纯化。
抗癌药物紫杉醇
抗癌药物紫杉醇 简介 1963年美国化学家瓦尼(M.C. Wani )和沃尔(Monre E. Wall )首次从一种生长在美国西部大森林中称谓太平洋杉(Pacific Yew )树皮和木材中分离到了紫杉醇的粗提物。在筛选实验中,Wani 和 Wall 发现紫杉醇粗提物对离体培养的鼠肿瘤细胞有很高活性,并开始分离这种活性成份。由于该活性成份在植物中含量极低,直到1971年,他们才同杜克(Duke )大学的化学教授姆克法尔(Andre T. McPhail )合作,通过x-射线分析确定了该活性成份的化学结构——一种四环二萜化合物,并把它命名为紫杉醇(taxol )。 紫杉醇是红豆杉属植物中的一种复杂的次生代谢产物, 也是目前所了解的惟一一种可以促进微管聚合和稳定已聚合微管的药物。同位素示踪表明, 紫杉醇只结合到聚合的微管上, 不与未聚合的微管蛋白二聚体反应。细胞接触紫杉醇后会在细胞内积累大量的微管,这些微管的积累干扰了细胞的各种功能,特别是使细胞分裂停止于有丝分裂期,阻断了细胞的正常分裂。 通过Ⅱ-Ⅲ临床研究,紫杉醇主要适用于卵巢癌和乳腺癌,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也都有一定疗效。 主要性质 【英文名称】 Paclitaxel 【别 名】 泰素,紫素,特素 【化学名称】 5β,20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉烷-11-烯-9-酮-4,10-二乙酸酯-2-苯甲酸酯-13[(2’R ,3’S )-N-苯甲酰-3-苯基异丝氨酸酯] 【分 子 式】 145147NO H C 【分 子 量】 853.92 【CA S NO 】 33069-62-4 【产品来源】 为红豆杉科植物红豆杉的干燥根、枝叶以及树皮。 【规格含量】 99.5% 【物理性质】 白色结晶体粉末。无臭,无味。不溶于水,易溶于氯仿、丙酮等有机溶剂。
紫杉醇的提取工艺设计研究方案
紫杉醇提取纯化方法的研究进展 紫杉醇是最早从红豆杉属植物中分离出来的三环二菇类化合物,是继阿霉素和顺铂之后最热点的抗癌新药。紫杉醇具有复杂的化学结构,分子由3个主环构成二菇核,分子中有11个手性中心和多个取代基团,母环部分是一个复杂的四 环体系,有许多功能基团和立体化学特征。分子式C 47H 51 NO 14 ,分子量853.92。 同位素示踪表明, 紫杉醇只结合到聚合的微管上, 不与未聚合的微管蛋白二聚体反应。细胞接触紫杉醇后会在细胞内积累大量的微管,这些微管的积累干扰了细胞的各种功能,特别是使细胞分裂停止于有丝分裂期,阻断了细胞的正常分裂。通过Ⅱ-Ⅲ临床研究,紫杉醇主要适用于卵巢癌和乳腺癌,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也都有一定疗效。 紫杉醇属于有丝分裂抑制剂,它的独特机制在于可以诱导和促进微管蛋白 聚合,促进微管装配及阻止微管的生理解聚,由此抑制癌细胞纺锤体的形成,阻止 有丝分裂的完成,使其停留在G2期和M期直至死亡,从而起到抗癌的作用。迄今为止紫杉醇是唯一促进微管聚合的新型抗癌药。这一新的发现引起了各国医药界的极大兴趣。现在已有包括我国在内的十多个国家批准了紫杉醇类药物的正式生产。目前有关紫杉醇研究的几个主要问题是:紫杉醇的提取;紫杉醇的人工合成;紫杉醇的临床应用(水不溶性问题的解决);紫杉醇的构效关系;紫杉醇的抗癌机理。紫杉醇的抗癌机理 1971年,Wani等报道了紫杉醇在一些实验体系中具有抗癌活性。1978 年,Schiff等发现紫杉醇在极低的浓度下(0.25μM)可以完全抑制Hela细胞的分裂,而且在对细胞4小时的培养过程中,对DNA、RNA和蛋白质的合成没有明显影响。
抗癌药物紫杉醇的全合成_Holton合成紫杉醇路线的剖析
天然产物研究与开发 NA TU RAL PRODU CT R ESEA RCH AND D EV ELO PM EN T V o1.13 N o.3 抗癌药物紫杉醇的全合成 ——Ho lton 合成紫杉醇路线的剖析 陈巧鸿 王锋鹏3 (华西医科大学药学院天然药物化学教研室 成都 610041) 摘 要 从全合成战略与路线、关键反应、保护基应用和立体化学方面对Ho lton 的线性全合成紫杉醇路线进行剖析归纳。 关键词 合成;紫杉醇;Ho lton 法合成 0 引言 紫杉醇(p actitaxo l 1商品名taxo l )具有显著的 抗癌活性和独特的作用机理,现主要用于治疗晚期乳腺癌和卵巢癌等癌症。紫杉醇分子结构复杂,具有特殊的三环[6+8+6]碳架和桥头双键以及众多的含氧取代基。其全合成引起国内外许多有机化学家的兴趣。先后共有30多个研究组参与研究,实属罕见。经20多年的努力,于1994年才由美国的R .A .Ho lton 与K .C .N ico laou 两个研究组同时完成紫杉醇的全合成。随后,S .T .D an ishefsky (1996年)、P .A .W en 2 der (1997年)、T .M ukaiyam a (1998年)和I .Kuw aji 2m a (1998年)4个研究组也完成这一工作。6条合成路线虽然各异,但都具有优异的合成战略,把天然有机合成化学提高到一个新水平。 紫杉醇的合成研究曾有人作了很好的总结[1~4]。1998年,黄化民等综述了P .A .W ender ,T . M ukaiyam a 及S .J .D an ishefsky 三个研究组的全合 成战略与路线[5]。最近,我们组又从合成战略与路线、模型反应、关键反应以及保护基的应用等方面对K . C .N ico laou 的全合成紫杉醇作了较详细的总结[6] 。这里,我们再就R .A .Ho lton 全合成紫杉醇的方法进行剖析归纳,以有助于对紫杉醇全合成的认识。 R .A .Ho lton 及其同事是最早从事紫杉醇合成的研究组之一。他们成功地构建了紫杉烷骨架、首次合成天然紫杉烷类化合物taxu sin 2、以baccatin 衍生物3为原料半合成紫杉醇,该法已被BM S 公司用于工业化生产紫杉醇。因4的合成方法由I .O ji m a 等发展而来,故又称为Ho lton 2O ji m a 法。其特点是步骤少,收率高。5条紫杉醇全合成路线都直接引用该法连接132酯侧链。R .A .Ho lton 的紫杉醇全合成路线以细致为特色。其成功的主要原因是经历约10年时间对紫杉醇分子构象与反应性的深入研究以及对多种化学合成方法的改进和发展 。 1 全合成的战略与路线 8 8
紫杉醇
羟丙基甲基纤维素 物理性状: 本品为非离子型纤维素醚,外观为白色的粉末,无嗅无味,溶于水及大多数极性有机溶剂和适当比例的乙醇/水、丙醇/水、二氯乙烷等,在乙醚、丙酮、无水乙醇不溶,在冷水中溶胀成澄清或微浊的胶体溶液。水溶液具有表面活性,透明度高、性能稳定。HPMC具有热凝胶性质,产品水溶液加热后形成凝胶析出,冷却后又溶解,不同规格的产品凝胶温度不同。溶解度随粘度而变化,粘度越低,溶解度越大,不同规格的HPMC其性质有一定差异,HPMC在水中溶解不受PH值影响。颗粒度:100目通过率大于100%。堆密度:0.25-0.70g/ (通常0.4g/ 左右),比重1.26-1.31。变色温度:180-200℃,炭化温度:280-300℃。HPMC具有增稠能力,排盐性、PH稳定性、保水性、尺寸稳定性、优良的成膜性以及广泛的耐酶性、分散性和粘结性等特点。 用途介绍: 1.建筑业:作为水泥沙浆料的保水剂、缓凝剂使沙浆具有泵送性。在抹灰浆、石膏料、腻子粉或其他的建材作为黏合剂,提高涂抹性和延长可操作时间。用作粘贴瓷砖、大理石、塑料装饰,粘贴增强剂,还可以减少水泥用量。HPMC的保水性能使浆料在涂抹后不会因干得太快而龟裂,增强硬化后强度。 2.陶瓷制造业:在陶瓷产品制造中广泛用作黏合剂。 3.涂料业:在涂料业作为增稠剂、分散剂和稳定剂,在水或有机溶剂中都具有良好相溶性。作为脱漆剂。 4.油墨印刷:在油墨业作为增稠剂、分散剂和稳定剂,在水或有机溶剂中都具有良好相溶性。 5.塑料:作成形脱模剂、软化剂、润滑剂等。 6.聚氯乙烯:聚氯乙烯生产中做分散剂,系悬浮聚合制备PVC的主要助剂。 7.其它:本品还广泛用于皮革、纸制品业、果蔬保鲜和纺织业等。 1 羟丙甲纤维素(HPMC) 英文:Hydroxypropyl Methyl Cellulose 简称:HPMC或MHPC 别名:羟丙基甲基纤维素;纤维素羟丙基甲基醚;Hypromellose,Cellulose, 2-hydroxypropyl methyl Cellulose ether. Cellulose hydroxypropyl methyl ether Hyprolose;CAS号:[ 9004-65-3 ] 来源:HPMC为选用高度纯净的棉纤维素作为原料,在碱性条件下经专门醚化而制得,全过程在GMP条件和自动化监控下完成,不含任何动物器官和油脂等活性成分。物理性状:本品为非离子型纤维素醚,外观为白色的粉末,无嗅无味,溶于水及大多数极性有机溶剂(如:二氯乙烷)和适当比例的乙醇/水、丙醇/水等。水溶液具有表面活性、透明度高、性能稳定。HPMC具有热凝胶性质,产品水溶液加热后形成凝胶析出,冷却后又溶解,不同规格的产品凝胶温度不同。溶解度随粘度而变化,粘度越低,溶解度越大,不同规格的HPMC其性质有一定的差异,HPMC在水中溶解不受PH值影响。颗粒度:100目通过率大于100%。堆密度:0.25-0.70g/ (通常0.5g/ 左右),比重1.26-1.31。变色温度:190-200℃,炭化温度:280-300℃。表面张力:2%水溶液为42-56dyn/cm。HPMC随甲氧基含量增加,凝胶点下降,水溶解度上升,表面活性也上升。HPMC具有增稠、排盐性、灰份低、PH稳定性、保水性、尺寸稳定性、优良的成膜性以及广泛的耐酶性、分散性和粘结性等特点。(仅供参考)用途介绍(仅供参考): 1. 片剂包衣:在固体制剂中用作薄膜包衣材料,能形成坚韧、光洁美观的薄膜,使用浓度2%—8%。包衣后增加药剂对光、热、湿的稳定性;无味无臭,易于服用,而且HPMC对色素、遮光剂、润滑剂等其它材料相容性良好。普通包衣:用水或30-80%乙醇溶解HPMC,配成的3-6%溶液,加入辅助成分(如:土温-80、蓖麻油、PEG400、滑石粉等)。2. 肠溶性包衣隔离层:在片剂、颗粒剂表面先以HPMC 包衣作底涂隔离层,再在外面包一层HPMCP肠溶材料,HPMC膜可以提高肠溶包衣药剂在贮藏中的稳定性。3. 缓释制剂:以HPMC为致孔道剂,依托乙基纤维素为骨架材料,可制成缓释长效片。4. 增稠剂和胶体的保护胶剂及滴眼剂:作增稠剂常用浓度为0.45-1%。5. 粘合剂:作黏合剂一般浓度为2%-5%,用于提高疏水胶的稳定性,常用浓度为0.5-1.5%。6. 可用作延滞剂,控释剂致孔道剂和助悬剂。悬浮剂:作悬浮剂常用量为0.5-1.5%。7. 食品:作为增稠剂加入到各种饮料、奶制品、调味品、营养食品中,作为增稠剂、黏结剂、乳化剂、悬浮剂、稳定剂、保水剂、赋形剂等。8. 在化妆品中用作为黏合剂和乳化剂、成膜剂等。安全性:健康危害:本品安全无毒,可作食品添加剂,无热量,对皮肤、黏膜接触无刺激。一般认为是安全的(FDA1985),每日容许摄入量25mg/kg(FAO/WHO 1985),操作时应佩带防护用品。环境影响:避免任意抛撒使粉尘飞扬造成空气污染。物理及化学性危害:避免与火源接触,在密闭环境中应避免形成大量的粉尘,防止爆炸性危害。运储事项:注意防晒防雨防潮,避直接光照,密封于干燥处存放。包装规格:桶装:净重25kg/件
紫杉醇Danishefsky合成路线
紫杉醇Danishefsky合成路线 答:(一)D环的合成 a、硼氢化钠将羰基还原为醇 b、用乙酰氯、DMAP和吡啶酰基化 c、羰基被乙二醇在萘磺酸催化下保护为缩酮(双键移位) d、被活化的双键经过硼氢化-氧化反应得到醇 e、乙酰基被叔丁基二甲基硅基(TBDMS)取代,吡啶-铬酐把羟基氧化成酮 f、酮经过Corey-Chaykovsky反应得到环氧化物 g、异丙醇铝将环氧化物打开,得到烯丙基醇 h、四氧化锇和N-甲基-N-氧化吗啉氧化双键得到两个顺式羟基 i、一级醇被三甲基氯硅烷转化为硅醚 j、二级醇经三氟甲磺酸酐转化为磺酸酯 k、缩合成环氧化物 a g h b d e f j (二)C环的合成 a、用苄基溴,氢化钠和季铵盐作为相转移催化剂,用苄基保护醇 b、用R-甲苯磺酸从酮上除去缩醛保护基 c、通过与三氟甲磺酸三甲基甲硅烷基酯反应形成甲硅烷基烯醇醚 d、在甲醇中用四乙酸铅在氧化灌洗,开环生成了一个甲基基团和一个醛基 e、用甲醇和可力丁对甲苯磺酸酯(CPTS)将乙醛缩醛保护起来
f 、用氢化铝锂将酯还原为伯醇 g 、羟基被转化为亚硒化物,用过氧化氢氧化后得到烯烃 h 、用臭氧和三苯膦进行臭氧分解可提供醛 (三)A 环的合成 a 、乙基异丙基酮与吗啉反应 b 、与丙烯酰氯反应 c 、双键被水解,生成酮 d 、与肼在三乙胺和乙醇中的反应提供了腙 e 、与碘的反应,使碘腙碘化 f 、酮基被转化为三乙氧基氰、氰化钾和一种克罗米醚 g 、锂与丁基锂在-78°C 反应 O 2 N c f i
(四)B 环的合成 a 、酮基被脱保护,消除了三甲基硅基 b 、双键被氧化与MCPBA 的环氧化物 c 、在碳上加氢生成二醇 d 、作为环状碳酸酯酯,在二甲基甲酰胺中与碳酰亚胺咪唑和氢化钠反应 e 、脱氢化,烯烃还原 f 、在-78°C ,酮与苯基三氟酰亚胺和钾反应后转化为Te36 g 、Ive 组的缩醛基团被脱保护 h 、醛基脱氧,被转化为双键 i 、第二环闭合 O N O N O O O O 2 I O I O I CN OTMS Li CN OTMS a b c d g f h Cl O
紫杉醇的合成
紫杉醇的合成(综述) 化学与化工学院 化学101 201008040127 张国文 摘要:简要介绍紫杉醇的性质,药性以及几种化学全合成方法。 关键字:抗癌药 紫杉醇 全合成法 紫杉醇(paclitaxel ):分子式:C 47H 51O 14N,分子量:853.906g/mol,半衰期:5.8h 。 结构式: NH O O O O 系统名:5β,20-环氧-1,2α,4,7β,10β,13α-六羟基紫杉烷-11-烯-9-酮-4,10-二乙酸酯-2-苯甲酸酯-13[(2’R ,3’S)-N-苯甲酰-3-苯基异丝氨酸酯] 俗名(别名):红豆杉醇,紫醇,特素,紫烷素,路泰,泰素等。
发现史:是由美国北卡罗纳州三角研究所的wall博士和wani博士于1967年发现的。 物理性质:白色结晶体粉末,无臭,无味,不溶于水,易溶于氯仿,丙酮等有机溶剂。 用途:抗癌新药,它对难治的晚期的转移性卵巢癌或乳腺癌有良好的抗癌活性,对小细胞和非小细胞癌,恶性黑色素癌,头颈部癌等也有一定活性。作用机理为促使细胞内形成稳定的微管束,以干扰细胞周期后的G2有丝分裂。并抑制细胞复制,主要用于治疗晚期卵巢癌和乳腺癌,也用于治疗鳞状细胞癌,头颈部癌和黑色素癌。 药物需求概况:据生物谷网页报道:紫杉醇(包括紫杉醇注射剂和半合成紫杉醇注射剂)2 006年全球销售额为37亿美元,位居抗癌药之首。另据统计目前紫杉醇的年需求量为600K g,而目前世界年产量为300Kg。故紫杉醇药物原料目前市场是明显的供不应求。 合成路线: 1.生物合成 2.利用紫杉树的细枝、叶等可再生材料,提取初级原料,再人工半合成生产 紫杉醇 3.有机化学合成 有机合成方法:紫杉醇分子结构复杂,具有特殊的三环[6+8+6]碳架和桥头双键以及众多的含氧取代基。其全合成引起国内外许多有机化学家的兴趣。先后共有30多个研究组参与研究,实属罕见。经20多年的努力,于1994年才由美国的R.A.Holton与K.C.Nicolaou两个研究组同时完成紫杉醇的全合成。 后来,S.T.Danishefsky(1996年)、P.A.Wen-der(1997年)、T.Mukaiyama(1 998年)和I.Kuwaji-ma(1998年)4个研究组也完成这一工作。6条合成路线虽然各异,但都具有优异的合成战略,把天然有机合成化学提高到一个新水平 一、 Holton全合成路线(1994) 美国弗罗里达国立大学Robert.A.Holton教授领导的研究小组从1983年开始进行紫杉醇全合成研究工作,历经十二年,于1994年成功完成了全合成 10-12]。该法已被BMS 公司用于工业化生产紫杉醇。Holton法采用了由A环开始到AB环、然后到C环、最后到D 环的线性合成战略。价廉易得的樟脑5为起始原料,经多步反应制得关键中间体6。6由R.A.Holton发展的环氧醇裂解反应定量转化为具AB环系的7。经羟醛缩合及类似Cha
