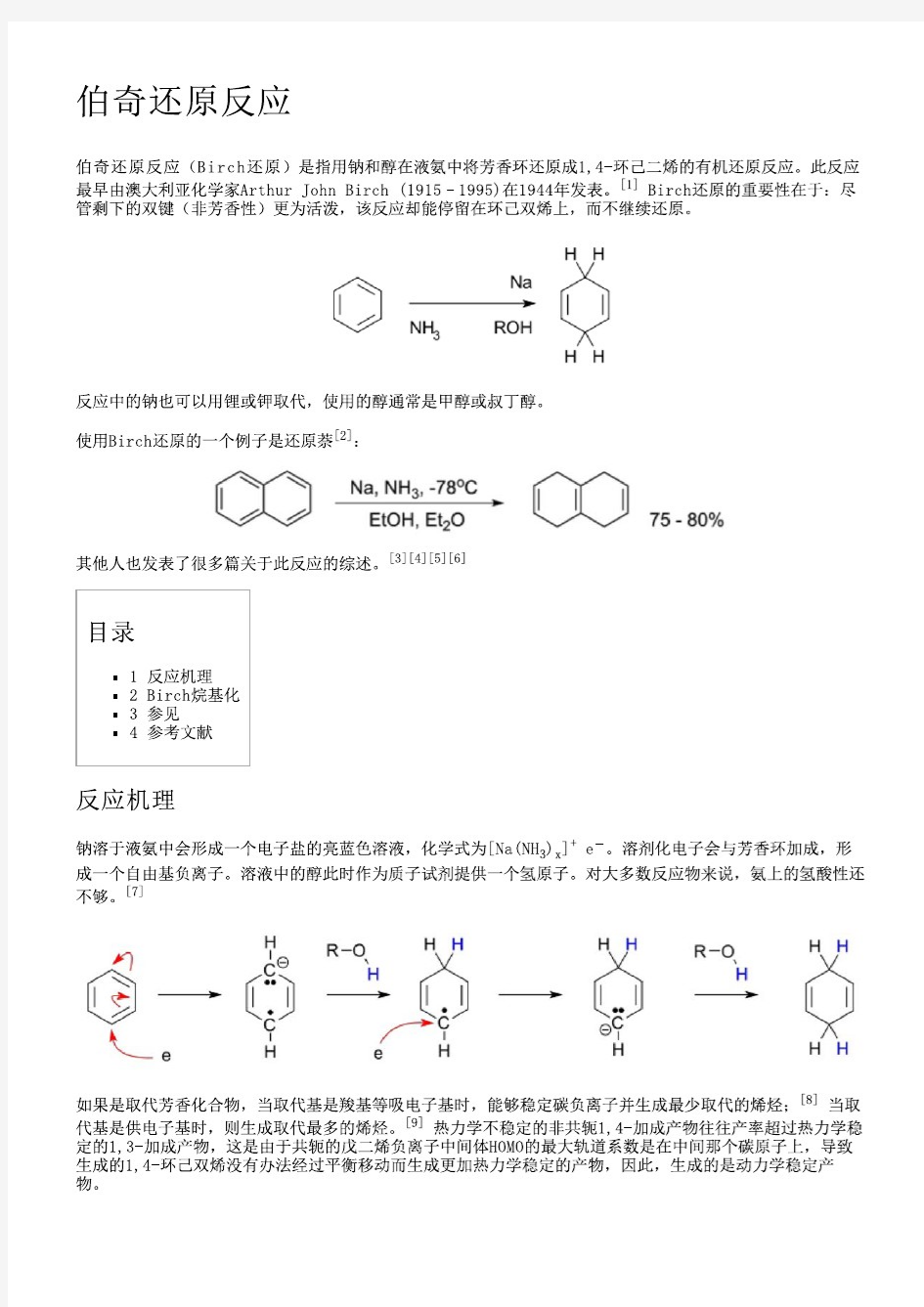
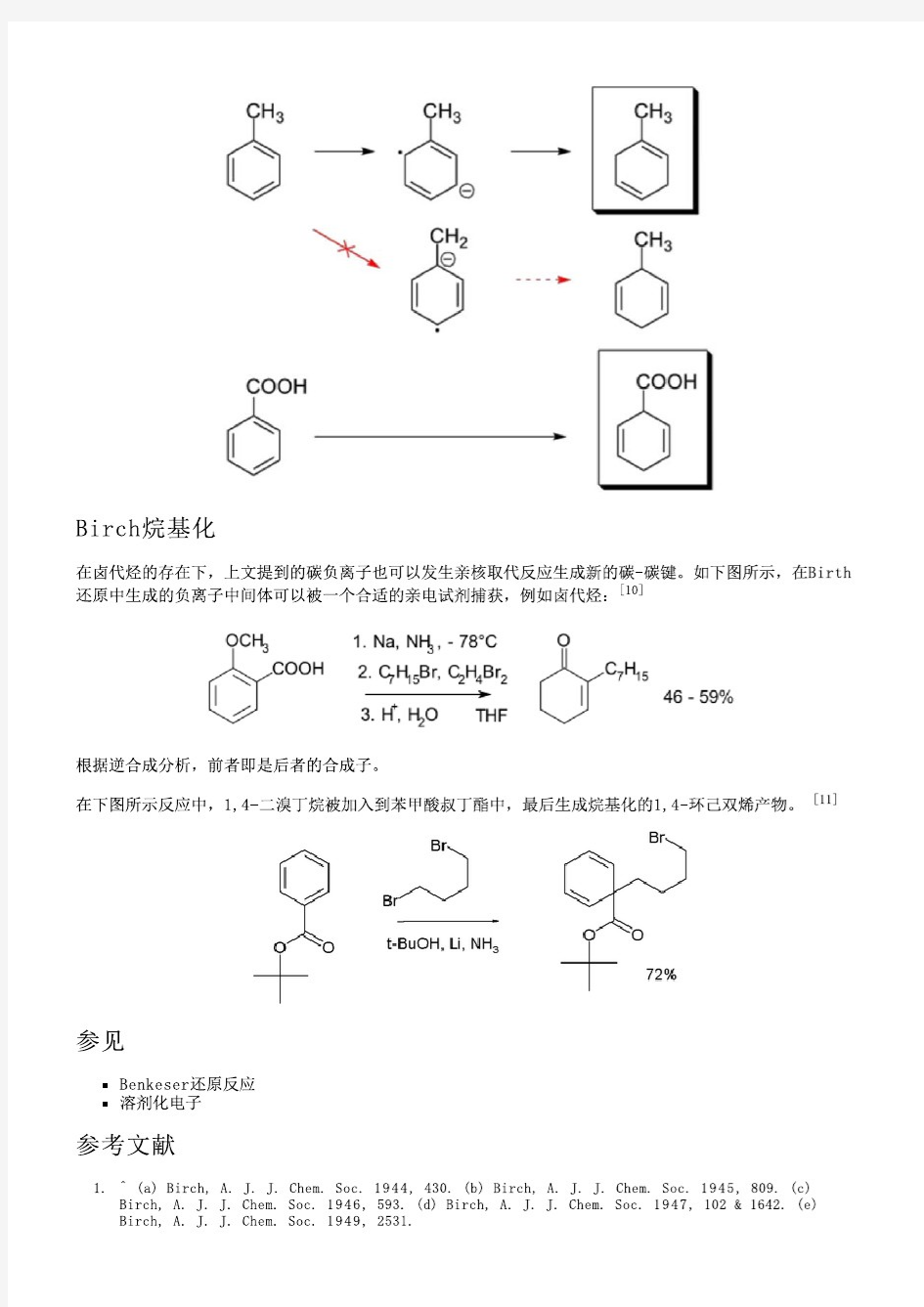
伯奇还原反应
偶联反应
金属钯催化Sonogashira偶联反应 (芳基炔与芳基卤偶联) 一、实验题目: 金属钯催化Sonogashira偶联反应(芳基炔与芳基卤偶联) 二、实验日期: 实验地点: 实验指导老师: 三、实验目的 1. 学习金属催化的有机偶联反应 2. 掌握Sonogashira偶联的反应机理。 3. 熟练氮气保护、金属催化、回流反应等有机基本操作。 四、实验原理 Sonogashira偶联反应现代有机合成中一种非常重要的形成碳碳键的偶合技术。用于在不饱和碳原子之间形成碳碳单键。 反应是碘代乙烯或芳香烃与端炔之间经催化生成炔烯化合物的反应。反应催化剂为钯和氯化亚铜。反应需要碱性条件下进行。
反应催化循环如下: 钯与碘乙烯发生氧化加成反应,生成乙烯基碘化钯;氯化亚铜在碱性条件下与炔生产炔化铜,后者与乙烯基碘化钯发生金属交换反应,生成乙烯基炔化钯,然后发生还原消除反应生成零价钯和烯炔,完成一个催化循环。 同大多数钯介导的偶合反应一样,该反应一般只适用于不饱和碳原子之间的偶合。在传统有机合成中,乙烯基卤素都是惰性化合物,很难发生取代反应,但在现代有机合成中这种观念发生了彻底的变化。在钯催化下乙烯基卤素化合物变得相当活泼,能发生一系列取代反应。而Sonogashira偶联反应就是其中一个反应代表。烯炔结构是天然产物中常见的结构,特别是菊科植物的次生代谢产物富含这种结构。在全合成研究中Sonogashira偶联反应无疑是一种有力的合成手段。
本次实验是将碘苯和对乙基苯乙炔进行Sonogashira偶联反应,使得苯和碳碳三键直接相连。 反应方程式如下: I CuI,PPh 2 32 + 120C Pd(PPh)Cl 实验装置: 五、实验部分 1、实验仪器:10 mL圆底烧瓶、球形冷凝管、酒精灯、针头、橡胶塞、空气球 2、实验药品:碘代苯、对乙基苯乙炔、碘化亚铜、三乙胺、二氯-二-(三苯基磷)钯
有机人名反应
有机人名反应 有机人名反应 1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢 2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮 3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物 4.Criegee臭氧化:烯烃臭氧化后水解成醛酮 5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚 6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮 7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇 8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变 9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮 10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮 11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮 12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化 13.Sarett氧化:CrO3?Py络合物氧化醇成醛酮 14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物 15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇 16.Wacker氧化:Pd催化剂下,烯烃氧化成酮 1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN试剂经过自 由基开裂发生醇的去氧作用 2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键 连接取代基;带吸电子基团的苯环,取代基在烯丙位。) 3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇
氧化还原滴定法原理
四、氧化还原滴定法原理 (一)氧化还原滴定指示剂 常用指示剂有以下几种类型: (1).自身指示剂 有些标准溶液或被滴定物质本身有颜色,而滴定产物无色或颜色很浅,则滴定时就无需另加指示剂,本身颜色变化起着指示剂的作用叫作自身指示剂。 MnO4-(紫红色)+ 5Fe2+ + 8H+ = Mn2+(肉色,近无色)+ 5Fe3+ + H2O KMnO4的浓度约为2×10-6 mol/L 时就可以看到溶液呈粉红色,KMnO4滴定无色或浅色的还原剂溶液,不须外加指示剂。KMnO4称为自身指示剂。 (2).显色指示剂 有些物质本身并没有氧化还原性,但它能与滴定剂或被测物质产生特殊的颜色,因而可指示滴定颜色。 I2 + SO2 + 2H2O = 2I- + SO42- + 4H+ 可溶性淀粉与碘溶液反应,生成深蓝色的化合物,可用淀粉溶液作指示剂。在室温下,用淀粉可检出10-5mol/L 的碘溶液。温度升高,灵敏度降低。 (3).本身发生氧化还原反应的指示剂 这类指示剂的氧化态和还原态具有不同的颜色,在滴定过程中,指示剂由氧化态变为还原态,或由还原态变为氧化态,根据颜色的突变来指示终点。 作用原理:设指示剂氧化还原电对为 式中In(O)和In(R)分别代表具有不同颜色的指示剂的氧化态和还原态。随着滴定的进行,溶液电位值发生变化,指示剂的也按能斯特方程所示的关系发生变化:
变色范围 理论变色点 指示剂选择:使 落在滴定突跃范围之内。例如 Cr 2O 72-(黄色) + 6 Fe 2+ + 14 H + = 2Cr 3+(绿色)+ 6Fe 3+ + 7H 2O 需外加本身发生氧化还原反应的指示剂,如二苯胺磺酸钠指示剂,紫红→无色。 指示剂变色的电势范围为: 'In In 0.059 (V)E E n θ?≤± (考虑离子强度和副反应) 氧化还原指示剂的选择:指示剂的条件电势尽量与反应的化学计量点电势一致。 (4)常用的氧化还原指示剂 ① 二苯胺磺酸钠: H + 氧化剂 二苯胺磺酸钠 二苯胺磺酸 二苯联苯胺磺酸 (还原型) (无色) 氧化剂 二苯联苯胺磺酸紫(紫色)(氧化型) 反应的 n =2,变色电位范围:2059.085.0-~2 059.085.0+ 即 0.82 ~ 0.88 (V) 二苯胺磺酸钠指示剂空白值: 产生原因:a.指示剂用量;b.滴定剂加入速度、被滴定剂浓度及滴定时间等因素有关 消除办法:用含量与分析试样相近的标准试样或标准溶液在同样条件下标定K 2Cr 2O 7 。
suzuki偶联反应
Suzuki-Miyaura交叉偶联反应机理及其在有机合成中的应用 学院:化学学院 专业:有机化学 学号: 姓名:
一、Suzuki-Miyaura 交叉偶联反应概念 Suzuki 反应(铃木反应),也称作Suzuki 偶联反应、Suzuki-Miyaura 反应(铃木-宫浦反应),是一个较新的有机偶联反应,是在钯配合物催化下,芳基或烯基的硼酸或硼酸酯与氯、溴、碘代芳烃或烯烃发生交叉偶联。 Z=Cl,Br,I 自从1981年Suzuki 等报道了通过钯催化的有机硼化学物和卤代烃可以在很温和的条件下发生偶联反应制备不对称联芳烃以后,为芳-芳键的形成展开了一个新的领域[1]。Suzuki-Miyaura 交叉偶联反应被证明是目前制备联芳基及其衍生物最为广泛利用的方法,因为其具有很强的底物适应性及官能团耐受性,常用于合成多烯烃、苯乙烯和联苯的衍生物,从而应用于众多天然产物、有机材料的合成中。铃木章也凭借此贡献与理查德·赫克、根岸英一共同获得2010年诺贝尔化学奖。 二、Suzuki-Miyaura 交叉偶联反应机理 Suzuki-Miyaura 交叉偶联的反应机理通常是一个普通的催化循环过程。这个过程主要包括三个步骤: (1)氧化加成(oxidative addition) (2)转移金属化(transmetalation) (3)还原消除(reductive elimination) Ar-Pd-Ar 1 Ar-Ar Pd(0) ArX ArPdX ArPdOH NaOH NaX B(OH)4 ArB -(OH)3 NaOH ArB(OH)2 氧化加成 还原消除 转移金属化 Z B(OH)2 Br Z + 3% Pd(PPh 3)4Benzene, Na 2CO 3/H 2O
氧化还原反应的表示方法
氧化还原反应的表示方法 (一)用双线桥法:表明元素的原子在反应前后得失电子情况的一种方法。 氧化剂+ 还原剂还原产物+ 氧化产物 方法步骤: (1).标好价:给化合价有变化的元素标好化合价。 (2).列变化:用线桥列出同一元素在化学反应前后化合价的变化,箭头必须由反应物指向生成物,且两端 对准同种元素 (3).求总数:求出反应前后得(失)电子的总数 (电子总数=化合价的改变值﹡改变化合价的原子的个数) (4).查守恒:检查得失电子的总数是否相等 例题1:2H2S + O2 == 2S + 2H2O 练习1:(1) I2 + SO2 + 2H2O == H2SO4 + 2HI (2) 4NH3 + 5O2 == 4NO + 6H2O 例题2:MnO2 + 4HC l(浓)== MnCl2 + Cl2 ↑+ 2H2O 练习2:(1).3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑+ 4H2O (2).K2Cr2O7 + 14HCl == 2KCl + 2CrCl3 + 3Cl2↑+ 7H2O 归纳1:如果线桥两端同种元素的原子个数不等,则应按数值小的计算。 例题3:3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O 练习3:(1) .Cl2 + H2O == HCl + HClO (2). 3S + 6KOH == 2K2S + K2SO3 + 3H2O
归纳2:同一物质中同种元素的中间价态转化为高价态和低价态,称歧化反应。 例题4:NO + NO2 + 2NaOH == 2NaNO2 + H2O 练习4:(1)2H2S + SO2 == 3S + 2H2O (2)KClO3 + 5KCl + H2SO4== 3K2SO4 + 3Cl2↑+ 3H2O 归纳3:同种元素不同价态之间发生反应,元素由高价态与低价态反应生成中间价态的物质,称归中反应。 例题5:KClO3 + 6HCl == KCl + 3Cl2 ↑+ H2O 练习5:H2SO4 + H2S == SO2 ↑+ S↓+ 2H2O 归纳4:价态“归中”规律:同种元素不同价态之间发生氧化还原反应,化合价“只靠拢,不交叉”。化合价逐级升降。 思考:(1)、2KMnO4 == K2MnO4 + MnO2 + O2↑ 双线桥法应用:定性、定量判断氧化剂、还原剂;氧化产物、还原产物 例6.3S+6KOH=2K2S+K2SO3+3H2O中,被氧化与被还原的S原子数之比为A.1 :1 B.2 :1 C.1 :2 D.3 :2 () 练6.反应8NH3+3C12=6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比是:A.3 :1 B.1 :3 C.1 :1 D.3 :8 () (二)单线桥法 氧化剂+ 还原剂还原产物+ 氧化产物 (1)箭头必须由还原剂(失电子)指向氧化剂(得电子),箭头两端对准得失电子的元素。(2)箭头方向表明电子转移的方向,无须注“得失” (3)电子数目只要写成总数形式。如:Cu + Cl2== CuCl2
实验:还原反应的探究
聚焦初中还原反应实验 1.下面是三套还原氧化铜的实验装置
装置甲与乙的不同点 反应物 角度
①A 敞口,B 密闭
原因(用物质性质说明)
②A 不 ①H2 无毒,CO 有毒 ②A 产物水是液体,倒流会引起试管破裂。 B 产物 CO2 是气体
用尾气处理,B 需要点燃尾气 ③A 试管口略向下倾斜,B 玻璃 管水平
生成物 角度
A产物的检验是滴入盛有无水硫 白色无水硫酸铜遇水变蓝,CO2 使澄清石灰 酸铜的蒸发皿,B产物的检验是 水变浑浊 通入盛有澄清石灰水的锥形瓶
注意:1.用氢气碳一氧化碳还原氧化铜,从环保的角度考虑最好的是氢气,产物生成水。 2、氢气、一氧化碳还原氧化铜是吸热反应;碳还原氧化铜是放热反应。
实验一:氢气还原氧化铜 实验步骤: (l)先向试管中装人氧化铜、固定试管
①试管口应倾斜向下(试管口下倾角度的稍大,实验效果更好):防止在试管口处冷凝的水流
到试管底部使试管炸裂。
②导气管管口应伸入接近试管底部;目的是排尽试管内的空气。
③试管口不用塞子,如果试管用塞子塞住就无法排出试管内的空气
(2)通人经过验纯的纯净氢气(目的是为了防止加热时混合气体发生爆炸.) (3)点燃酒精灯给试管加热(先预热,再集中在装有氧化铜部位加热,目的是防止试管受热不 均而发生炸裂) (4)实验结束后撤离酒精灯 (5)继续通氢气直到试管冷却(目的是防止高温时生成的铜 被空气中的氧气重新氧化为氧化铜) (6)可能出现的其他问题:氢气中含有酸性物质(如 HCl),氧化铜与氢气中的酸性物质和水 分发生反应,而变成铜离子,无法再被还原为铜单质。
1 / 12
有机合成反应Heck反应
经典化学合成反应标准操作 1. 前言 (1) 2. 分子内的Heck反应 (2) 2.1 生成烯基取代的反应 (2) 2.1.1 分子内Heck反应化生成环外双键示例 (3) 2.2 形成季碳中心的反应 (4) 2.2.1 分子内不对称Heck反应示例 (5) 2.3 多烯大环的合成 (5) 2.2.1 Heck反应用于合成大环多烯示例 (6) 3. 分子间的Heck 反应 (7) 3.1 常规分子间Heck反应 (7) 3.1.1 Pd(OAc)2-P(o-tol)3体系用于不饱和羧酸酯的Heck反应标准操作三 (8) 3.1.2 不饱和酮的Heck反应标准操作 (9) 3.1.3 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作一 (9) 3.1.4 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作二 (9) 3.1.5 芳香卤代物和不饱和羧酸的Heck反应合成反式3-芳基不饱和酸示例 .. 10 3.1.6 非共轭双键Heck反应示例 (10) 3.2 不对称分子间Heck反应 (11) 3.3 非常用离去基团的Heck反应(Irina P. Beletskaya Chem. Rev. 2000, 100, 3009-3066) (11) 3.3.1 重氮盐参与的Heck反应示例 (12) 3.3.2 酰氯参与的Heck反应示例 (14)
1. 前言 通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用范围越来越广泛,使该反应已经成为构成C-C键的重要反应之一。另外,Heck反应具有很好的Trans选择性 R X Pd(0) Z R Z X = I, Br, OTf, etc Z = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc 研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO > Br >> Cl)与Pd0L2的加成,形成PdⅡ配合物中间体;(b)配位插入(Cordination-insertion):烯键插入Pd-R键的过程;(c)β-H的消除;(d)催化剂的再生:加碱催化使重新得到Pd0L2。
化学:氧化还原反应表示方法
《氧化还原反应》的表示方法 唐荣德 反映氧化还原反应中电子转移情况有两种表示法:单线桥和双线桥。 (1) 单线桥(也叫单箭号) 意义:表示电子转移的方向和总数(或:表示不同元素原子或离子间电子得失情况)。它体现了“谁给谁”。 表示法:箭号一定在等式左边,箭头上只标明电子转移总数。如: 该表示法的特点是:箭头指向的物质为氧化剂。(对于自身氧化还原反应,则箭头指向的元素起氧化作用) (2) 双线桥(也叫双箭号) 意义:表示同一元素原子或离子间电子得失情况(或:表示电子得与失及氧化、还原过程)。它体现了“谁变谁”。 表示法:箭号一定横跨等式两边,且不少于两根箭号。在箭号上要标上“得到”或“失去”,也可以用“+”或“-”来表示,然后写出具体的电子数目。 对于分子内的氧化还原反应,特别是歧化反应,使用单线桥不方便,用双线桥好。双线桥易画,但麻烦;单线桥简单,能看出氧化剂。双线桥可用在氧化还原反应方程式配平上。在考试评分中,回答表示氧化还原反应的电子转移方向和数目(或总数)时,使用任一种表示法都算正确。 其实,单线桥和双线桥并不以线桥的多少来划分,有两根或三根线桥的不一定是单线桥,但双线桥却不可能只有一根线桥。因此,要判断是哪种线桥,关键是看线桥是在等式的左边,还是横跨了等式的两边。如: 双线桥单线桥 双线桥 单线桥 两种表示法也有多种形式,如硫铁矿燃烧的氧化还原反应方程式: 以上分析可以看出,双线桥是分析法,可理解为是微观的;单线桥是综合法,可理解为宏观的。 要注意,以下容易标错的氧化还原反应方程式。 如铝与NaOH溶液反应,把NaOH当成氧化剂,且标示如下是错的: 因为该化学方程式是总反应方程式,反应过程是铝先与水反应生成氢氧化铝和氢气,然后氢氧化铝和碱反应生成偏铝酸钠和水,前者是置换反应,水是氧化剂;后者是复分解反应,NaOH作为碱与酸反应,并不是氧化剂。正确的应是如下表示法: 又如浓硫酸与硫化氢反应,如下表示是错的: 因为氧化还原反应是逐步氧化和逐步还原的,即-2价的S首先变成0价的S,再氧化才
Heck反应机理及示例
Heck 反应的机理及示例 机理:Heck 反应的机理有一定的规律,通常认为反应共分四步:(a )氧化加成(Oxidative addition ): RX (R 为烯基或芳基,X=I > TfO > Br >> Cl)与Pd 0L 2的加成,形成Pd Ⅱ配合物中间体;(b )配位插入 (Cordination-insertion ):烯键插入Pd-R 键的过程; (c )β-H 的消除; (d )催化剂的再生:加碱催化使重新得到Pd 0L 2。 示 例: OMe O MeO N O NCO 2Me OMe N O MeO O NCO 2Me OMe Pd(PPh ) , NEt (12eq)MeCN, 80℃, 10h 12 A stirred solution of 1 (98 mg, mmol), triethylmine mL, mmol) and catalytic tetrakis(triphenylphosphine)palladium(0) (ca. 5 mg, 4 μmol) in mL of acetonitrile was heated at 80 ℃ in a sealed tube under an argon atmosphere for 10 h. The reaction mixture turned dark orange after ca. 10 min, and the catalyst plated out on the walls of the tube as a shiny layer of palladium metal upon completion of the reaction. The reaction mixture was cooled to room temperature; the reaction was quenched with aqueous NaHCO 3(15 mL), and
氧化还原吸收法
编订:__________________ 审核:__________________ 单位:__________________ 氧化还原吸收法 Deploy The Objectives, Requirements And Methods To Make The Personnel In The Organization Operate According To The Established Standards And Reach The Expected Level. Word格式 / 完整 / 可编辑
文件编号:KG-AO-8083-51 氧化还原吸收法 使用备注:本文档可用在日常工作场景,通过对目的、要求、方式、方法、进度等进行具体的部署,从而使得组织内人员按照既定标准、规范的要求进行操作,使日常工作或活动达到预期的水平。下载后就可自由编辑。 氧化还原法是指将H?S在液相中直接氧化为元素硫的气体脱硫方法。与醇胺法相比,氧化还原法优点在于: ①净化度高,净化气中H?S含量可低于5mg/m 3; ②在脱硫的同时直接生产元素硫,基本无废气污染; ③多数方法可选择性脱除H?S而基本上不脱除CO?; ④操作温度为常温,操作压力为高压或常压。 这类方法已在克劳斯装置尾气、低含硫气井、焦炉气、水煤气、合成气等气体中广泛应用。以下以改良蒽醌二磺酸钠法(改良ADA法)为例说明其工艺流程(图2-40)。
原料气从吸收塔底部进入,通过填料层与自上而下流动的再生贫液发生逆流接触,气体中硫化氢被溶液所吸收,从吸收塔顶部出来的气体为净化气。从吸收塔底部出来的溶液称为富液,它吸收了硫化氢并与之发生氧化还原反应,故不再具有脱硫性质,需要再生。富液进入氧化器用空气使之氧化,重新恢复脱硫性能。由于ADA溶液与硫化氢发生氧化还原反应后直接生成了粉末状硫单质悬浮于溶液中,当空气从氧化器底部通入时,以气泡形式携带悬浮的硫单质进入上层液面形成泡沫,把含有硫单质的泡沫引入硫浆液罐储存,再通过离心机或过滤机对固液进行分离,固体即可加工成硫磺产品,液体部分则流入溶液罐。从氧化器底部出来的溶液是已经再生彻底的贫液,进入溶液罐再用泵打入吸收塔循环使用。当溶液因排污产生一定损失时,可向溶液罐中补充新鲜溶液及用水调节溶液浓度。 吸收塔可以采用任何一种高效气一液接触设备。常用的是木格填料塔或喷射塔。因吸收过程中有元素
偶联反应及举例
偶联反应[编辑] 偶联反应,也写作偶合反应或耦联反应,是两个化学实体(或单位)结合生成一个分子的有机化学反应。狭义的偶联反应是涉及有机金属催化剂的碳-碳键形成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。在偶联反应中有一类重要的反应,RM(R = 有机片段, M = 主基团中心)与R'X的有机卤素化合物反应,形成具有新碳-碳键的产物R-R'。[1]由于在偶联反应的突出贡献,根岸英一、铃木章与理查德·赫克共同被授予了2010年度诺贝尔化学奖。[2] 偶联反应大体可分为两种类型: ?交叉偶联反应:两种不同的片段连接成一个分子,如:溴苯 (PhBr)与氯乙烯形成苯乙烯(PhCH=CH2)。 ?自身偶联反应:相同的两个片段形成一个分子,如:碘苯 (PhI)自身形成联苯 (Ph-Ph)。 反应机理[编辑] 偶联反应的反应机理通常起始于有机卤代烃和催化剂的氧化加成。第二步则是另一分子与其发生金属交换,即将两个待偶联的分子接于同一金属中心上。最后一步是还原消除,即两个待偶联的分子结合在一起形成新分子并再生催化剂。不饱和的有机基团通常易于发生偶联,这是由于它们在加合一步速度更快。中间体通常不倾向发生β-氢消除反应。[3] 在一项计算化学研究中表明,不饱和有机基团更易于在金属中心上发生偶联反应。[4]还原消除的速率高低如下: 乙烯基-乙烯基> 苯基-苯基> 炔基-炔基> 烷基-烷基 不对称的R-R′形式偶联反应,其活化能垒与反应能量与相应的对称偶联反应R-R与R′-R′ 的平均值相近,如:乙烯基-乙烯基> 乙烯基-烷基> 烷基-烷基。 另一种假说认为,在水溶液当中的偶联反应其实是通过自由基机理进行,而不是金属-参与机理。[5] §催化剂[编辑] 偶联反应中最常用的金属催化剂是钯催化剂,有时也使用镍与铜催化剂。钯催化剂当中常用的如:四(三苯基膦)钯等。钯催化的有机反应有许多优点,如:官能团的耐受性强,有机钯化合物对于水和空气的低敏感性。 如下一些关于钴催化的偶联反应的综述[6],钯[7][8][9][10][11]和镍[12]介导的反应以及它们的应用[13][14]。 §离去基团[编辑] 离去基团X在有机偶联反应中,常常为溴、碘或三氟甲磺酰基。较理想的离去基团为氯,因有机氯化合物相对其他的这些离去基团更廉价易得。与之反应的有机金属化合物还有锡、锌或硼。 §操作条件[编辑]
有机合成反应Heck反应
经典化学合成反应标准操作 1. 前言 通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联
反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用范围越来越广泛,使该反应已经成为构成C-C键的重要反应之一。另外,Heck反应具有很好的Trans选择性 R X Pd(0) Z R Z X = I, Br, OTf, etc Z = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc 研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO > Br >> Cl) 与Pd0L 2的加成,形成PdⅡ配合物中间体; (b)配位插入(Cordination-insertion): 烯键插入Pd-R键的过程;(c)β-H的消除;(d)催化剂的再生:加碱催化 使重新得到Pd0L 2 。
总的说来,Heck反应可以分为两大类:分子内反应和分子间反应。第一篇该反应的报道是Heck 在1972年发表。 I +Pd(OAc)2 (20 mol%) n Bu N (1 eq) NMP, 100°C, 2h Nolley, .; Heck, R. F.; Tetrahedron 1972, 37, 2320 Mori 和 Ban于1977年首次报道了分子内的Heck反应: Br N Ac CO2Me N Ac CO2Me Pd(OAc)2 (2 mol%) PPh, DMF TMEDA (2 equaiv) 125°C, 5h 43% Indole product formed as result of Pd-H isomerization of product clefin Mori, M.; Ban, K.; Tetrahedron1977, 12, 1037
氧化还原反应方程式配平方法归纳
氧化还原反应方程式配平方法归纳 一、左配法对于被氧化、被还原的元素在不同物质中的氧化还原反应,一般从左边反应物着手配平。例1:配平 Ag3AsO4+Zn+H2SO4-Ag+AsH3+ZnSO4+H2O解析:根据化合价升、降总数相等,先配平化学方程式左边化合价有变化的物质的化学计量数。2Ag3AsO4+11Zn+H2SO4-Ag+AsH3+ZnSO4+H2O再根据质量守恒,用观察法即可配平其他物质的化学计量数。配平后的化学方程式为:2Ag3AsO4+11Zn+11H2SO4=6Ag+2AsH3↑+11ZnS O4+8H2O 二、右配法如果化合价有升降的元素是同一物质中的同一元素,或者氧化剂、还原剂是同一物质时,一般先从化学方程式右边着手配平。例2:配平P+CuSO4+H2O---Cu3P+H3PO4+H2SO4解析:因为反应物P的化合价同时有升降,若先配平化学方程式左边的化学计量数,较为繁琐,采用右配法。根据化合价升、降总数相等,先配平化学方程式右边化合价有变化的物质的化学计量数。P+CuSO4+H2O5-Cu3P+6H3PO4+H2SO4再根据质量守恒,用观察法即可配平其他物质的化学计量数。配平后的化学方程式为: 11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 三、奇数配偶法如果一个氧化还原反应方程式的一边某元素的原子数位偶数,而另一边为奇数时,可将该元素的原子先配成偶数,使该元素原子数在等式两边相等,然后再配平其他元素。例3:配平S+C+KNO3-CO2+N2+K2S解析:反应物KNO3中三种元素
的原子均为奇数,而生成物中三种元素的原子数均为偶数,故可先将KNO3的系数配成2得:S+C+2KNO3-CO2+N2+K2S,再用观察法配平其他物质的化学计量数。配平后的化学方程式为: S+3C+2KNO3=3CO2↑+N2↑+K2S 四、零价配平法若遇到用常规方法无法确定化合价的物质,可假设物质中各元素的化合价均为0,再计算出各元素的化合价的升、降值,并使元素的化合价的升、降总数相等,配平化合价有变化的元素,最后用观察法配平其他物质的化学计量数。例4:Fe3C+HNO3-Fe(NO33+NO2+CO2+H2O解析:复杂的Fe3C按常规方法无法确定其中Fe和C的具体化合价,此时可以假设组成该物质的各元素的化合价均为0,再根据化合价升、降法配平。先配平 Fe3C和NO2的化学计量数:1Fe3C+HNO3- Fe(NO33+13NO2+CO2+H2O,再根据质量守恒,用观察法即可配平其他物质的化学计量数。配平后的化学方程式为: Fe3C+22HNO3=3Fe(NO33+13NO2↑+CO2↑+11H2O 五、整体标价法当某一元素的原子在某化合物中有多个时,为方便配平操作,可以将它们作为一个整体对待,根据化合物中元素化合价代数和为零的原则予以整体标价。例5:配平S +Ca(OH2-CaSx+CaS2O3+H2O解析:根据化学方程式的特点,上述反应采用右配法。分析化合价升降时,把Sx、S2作为一个整体对待。S +Ca(OH2-2CaSx+1CaS2O3+H2O再根据质量守恒,用观察法即可配平其他物质的化学计量数。配平后的化学方程式为:2
偶联反应
偶联反应 目录 偶联反应 常见的偶联反应包括 偶联反应具体说明 偶联反应所需要注意的 用途 Suzuki反应 偶联反应 偶联反应(英文:Coupled reaction),也作偶连反应、耦联反应、氧化偶联,是由两个有机化学单位(molecules)进行某种化学反应而得到一个有机分子的过程.这里的化学反应包括格氏试剂与亲电体的反应 偶联反应 (Grinard),锂试剂与亲电体的反应,芳环上的亲电和亲核反应(Diazo,Addition-Elimination),还有钠存在下的Wutz反应,由于偶联反应 (Coupled Reaction)含义太宽,一般前面应该加定语.而且这是一个比较非专业化的名词. 狭义的偶联反应是涉及有机金属催化剂的碳-碳键生成反应,根据类型的不同,又可分为交叉偶联和自身偶联反应。进行偶联反应时,介质的酸碱性是很重要的。一般重氮盐与酚类的偶联反应,是在弱碱性介质中进行的。在此条件下,酚形成苯氧负离子,使芳环电子云密度增加,有利于偶联反应的进行。重氮盐与芳胺的偶联反应,是在中性或弱酸性介质中进行的。在此条件下,芳胺以游离胺形式存在,使芳环电子云密度增加,有利于偶联反应进行。如果溶液酸性过强,胺变成了铵盐,使芳环电子云密度降低,不利于偶联反应,如果从重氮盐的性质来看,强碱性介质会使重氮盐转变成不能进行偶联反应的其它化合物。偶氮化合物是一类有颜色的化合物,有些可直接作染料或指示剂。在有机分析中,常利用偶联反应产生的颜色来鉴定具有苯酚或芳胺结构的药物。 常见的偶联反应包括 反应名称--年代--反应物A--反应物B --类型--催化剂--注 Wurtz反应 1855 R-X sp³ 自身偶联 Na Glaser偶联反应 1869 R-X sp 自身偶联 Cu Ullmann反应 1901 R-X sp² 自身偶联 Cu Gomberg-Bachmann反应 1924 R-N2X sp² 自身偶联以碱作介质
氧化还原反应化学方程式配平的常用方法
氧化还原反应方程式配平方法 一、配平原则 ⒈反应前后各元素的原子个数相等,即质量守恒。 ⒉氧化剂得电子总数与还原剂失电子总数相等,即电子守恒。 ⒊氧化剂化合价降低的总数值与还原剂化合价升高的总数值相等。 二、配平步骤 ⒈标变价:写出反应物和生成物的化学式,标出变价元素的化合价。 ⒉列变化:列出反应前后元素化合价的升、降变化值。 ⒊求总数:使化价升高和降低的总数相等。 ⒋配系数:用观察的方法配平其他物质的化学计量数,配平后,把单线改成等号。 ⒌查守恒:检查方程式两边是否“质量守恒”和“电荷守恒”。 三、配平方法 1. 逆配法:部分氧化还原反应、自身氧化还原反应、歧化反应等宜选用此种方法配平,即先从氧化产物和还原产物开始配平。 例1. (1) 解析: 首先确定CrCl 3和Cl 2 的化学计量数分别是2和3,然后根据反应前后各种原 子个数相等配平得: 2. 零价法:对于不易确定元素化合价的物质(如铁、砷、碳等组成的化合物)参加的氧化还原反应,根据化合物中各元素的化合价代数和为零的原则,把组成该物质的各元素化合价看作零价,然后计算出各元素化合价的升降值,并使升降值相等。 例2. 解析:
首先确定Fe 3C和NO 2 的化学计量数分别是1和13,然后根据反应前后各种原 子个数相等配平得: 3. 待定系数法:一般设组成元素较多的物质的化学计量数为1,其他物质的化学计量数分别设为a、b、c……,根据原子个数守恒列等式求解,若化学计量数为分数,应化为整数。此法适用于一切氧化还原反应,主要用于变价元素在三种或三种以上的复杂氧化还原反应。 例3. 解析:设CuSO 4的化学计量数为1、FeS 2 的化学计量数为a、H 2 O的化学计量 数为b,根据Cu、Fe、H的原子个数守恒,则Cu 2S、FeSO 4 、H 2 SO 4 的化学计量数 分别为、a、b,再根据S、O的原子个数守恒得: 解得 配平得: 4.平均标价法:当同一反应物中的同种元素的原子出现两次且价态不同时,可将它们同等对待,即假定它们的化合价相同,根据化合物中化合价代数和为零的原则予以平均标价,若方程式出现双原子分子时,有关原子个数要扩大2倍。 例4. NH4NO3-HNO3 +N2+ H2O 分析:NH4NO3中N的平均化合价为+1价,元素化合价升降关系为:NH4NO3→HNO3:+1→+5 升4×1价
负载型钯催化剂在Heck反应中的应用
万方数据
万方数据
万方数据
负载型钯催化剂在Heck反应中的应用 作者:陶荣哨, 孙莉, 汪祝胜, 胡卫雅, 裴文 作者单位:浙江工业大学化学工程与材料学院,杭州,310014 刊名: 化工生产与技术 英文刊名:Chemical Production and Technology 年,卷(期):2013,20(4) 参考文献(24条) 1.Mizoroki T.Mori K.Ozaki A Arylation of olefin with aryl iodide catalyzed by palladium 1971 2.Heck R F.Nolley J P Palladium-catalyzed vinylic hydrogen substitution reactions with aryl,benzyl,and styryl halides 1972(14) 3.Farina V High-turnover palladium catalysts in crosscoupling and Heck chemistry:a critical overview 2004 4.Miyazaki F.Yamaguchi K.Shibasaki M The synthesis of a new palladacycle catalyst.Development of a high performance catalyst for Heck reactions 1999 https://www.360docs.net/doc/f711193282.html,gasi M.Moggi P Anchoring of Pd on silica functionalized with nitrogen containing chelating groups and applications in catalysis 2002(82/183) 6.Steel P G.Teasdale C W T Polymer supported palladium N-heterocyclic carbine complexes:long lived recyclable catalysts for cross coupling reactions 2004 7.Corma A.Garcia H.Leyva A Basic zeolites containing palladium as bifunctional heterogeneous catalysts for the Heck reaction[外文期刊] 2003(01) 8.Artok L.Bulut H Heterogeneous suzuki reactions catalyzed by pd(0)-y zeolite[外文期刊] 2004(20) 9.Tonks L.Anson M S.Hellgardt K Palladium catalysed Heck reactions and allylic substitution reactions using glass bead technology 1997(24) 10.F Zhao.B M Bhanage.M Shirai Heck reactions of iodobenzene and methyl acrylate with conventional supported palladium catalysts in the presence of organic and/or inorganic bases without ligands 2000(06) 11.C P Mehnert.D W Weaver.J Y Ying Heterogeneous Heck catalysis with palladium-grafted molecular sieves 1998 12.M Wagner.K K(o)hler.L Djakovitch Heck reactions catalyzed by oxide-supported palladium-structure-activity relationships 2000 13.Andersson C M.Karabelas K.Hallberg A Palladium/ Phosphinated polystyrene as a catalyst in the Heck arylation.a comparative study 1985 14.刘蒲.王岚.李利民壳聚糖钯(0)配合物催化Heck芳基化反应研究[期刊论文]-有机化学 2004(01) 15.Belen Altava.M Isabel https://www.360docs.net/doc/f711193282.html,ardo Palladium Nmethylimidazolium supported complexes as efficient catalysts for the Heck reaction 2006 16.G Singh.S Bail.Ajai K Singh Palladium(0) complexes of (P,P) and(P,N) ligands immobilized on silica gel as catalysts in selective Heck type carbon-carbon coupling reactions 2007 17.胡国辉.周健民.杨育林气相法二氧化硅负载胺-钯配合物的制备及对Heck反应催化性能的研究[期刊论文]-浙江大学学报(理学版) 2009(05) 18.Fengyu Zhao.Masayuki Shirai Palladium-catalyzed homogeneous and heterogeneous Heck reactions in NMP and water-mixed solvents using organic,inorganic and mixed bases 2000 19.裴文.董华水相中Pd/C催化的杂环芳卤的还原偶联反应研究[期刊论文]-有机化学 2008(05) 20.周健民.杨育林.赵岚MCM-41固载胺钯配合物的制备及对Heck反应催化性能的研究[期刊论文]-有机化学 2008(05) 21.唐中民.赖国华.周仁贤MCM-41分子筛固载腈钯配合物的合成及其催化Heck偶联反应的性能[期刊论文]-化学通报(印刷版) 2009(09) 22.K K(o)hler.W Magner.L Djakovitch Supported palladium as catalyst for carbon-carbon bond construction (Heck reaction) in organic synthesis 2001
有机合成经典反应Heck反应
- 经典化学合成反应标准操作 1. 前言 (1) 2. 分子的Heck反应 (3) 2.1 生成烯基取代的反应 (3) 2.1.1 分子Heck反应化生成环外双键示例 (3) 2.2 形成季碳中心的反应 (5) 2.2.1 分子不对称Heck反应示例 (6) 2.3 多烯大环的合成 (6) 2.2.1 Heck反应用于合成大环多烯示例 (7) 3. 分子间的Heck 反应 (8) 3.1 常规分子间Heck反应 (8) 3.1.1 Pd(OAc)2-P(o-tol)3体系用于不饱和羧酸酯的Heck反应标准操作三 9 3.1.2 不饱和酮的Heck反应标准操作 (11) 3.1.3 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作一 (11) 3.1.4 杂环芳香卤代物和不饱和羧酸酯的Heck反应标准操作二 (11) 3.1.5 芳香卤代物和不饱和羧酸的Heck反应合成反式3-芳基不饱和酸示例12 3.1.6 非共轭双键Heck反应示例 (12) 3.2 不对称分子间Heck反应 (14)
3.3 非常用离去基团的Heck反应(Irina P. Beletskaya Chem. Rev. 2000, 100, 3009-3066) (14) 3.3.1 重氮盐参与的Heck反应示例 (15) 3.3.2 酰氯参与的Heck反应示例 (17) 1. 前言 通常把在碱性条件下钯催化的芳基或乙烯基卤代物和活性烯烃之间的偶联反应称为Heck反应。自从20世纪60年代末Heck 和Morizoki独立发现该反应以来,通过对催化剂和反应条件的不断改进使其的应用围越来越广泛,使该反应已经成为构成C-C键的重要反应之一。另外,Heck反应具有很好的Trans选择性 R X Pd(0) Z R Z X = I, Br, OTf, etc Z = H, R, Ar, CN, CO2R, OR, OAc, NHAc, etc 研究表明,Heck反应的机理有一定的规律,通常认为反应共分四步:(a)氧化加成(Oxidative addition): RX (R为烯基或芳基,X=I > TfO > Br >> Cl)与Pd0L2的加成,形成PdⅡ配合物中间体;(b)配位插入(Cordination-insertion):烯键插入Pd-R键的过程;(c)β-H的消除;(d)催化剂的再生:加碱催化使重新得到Pd0L2。
