常见无机化合物颜色
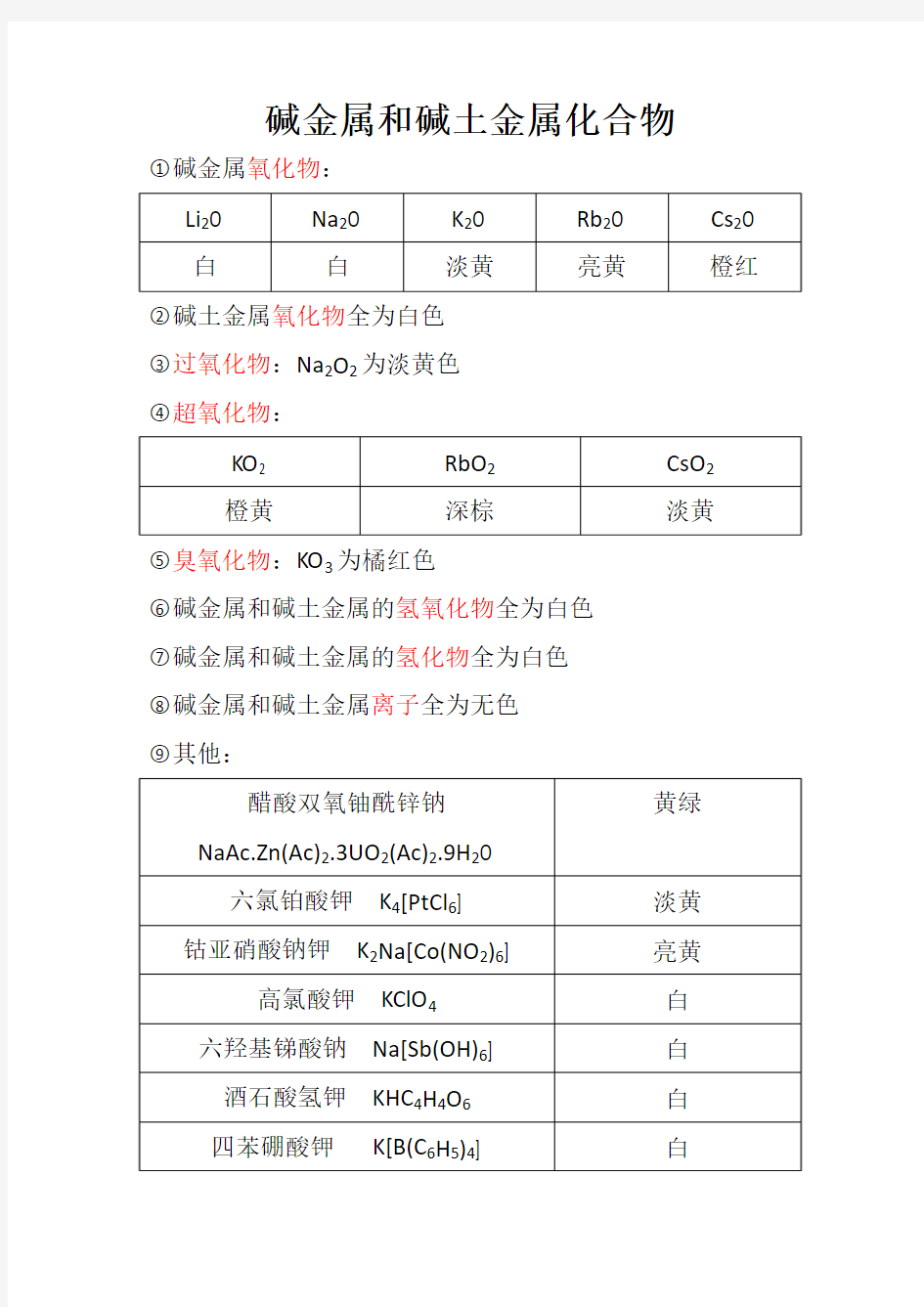
碱金属和碱土金属化合物○1碱金属氧化物:
○2碱土金属氧化物全为白色
○3过氧化物:Na2O2为淡黄色
○4超氧化物:
○5臭氧化物:KO3为橘红色
○6碱金属和碱土金属的氢氧化物全为白色
○7碱金属和碱土金属的氢化物全为白色
○8碱金属和碱土金属离子全为无色
○9其他:
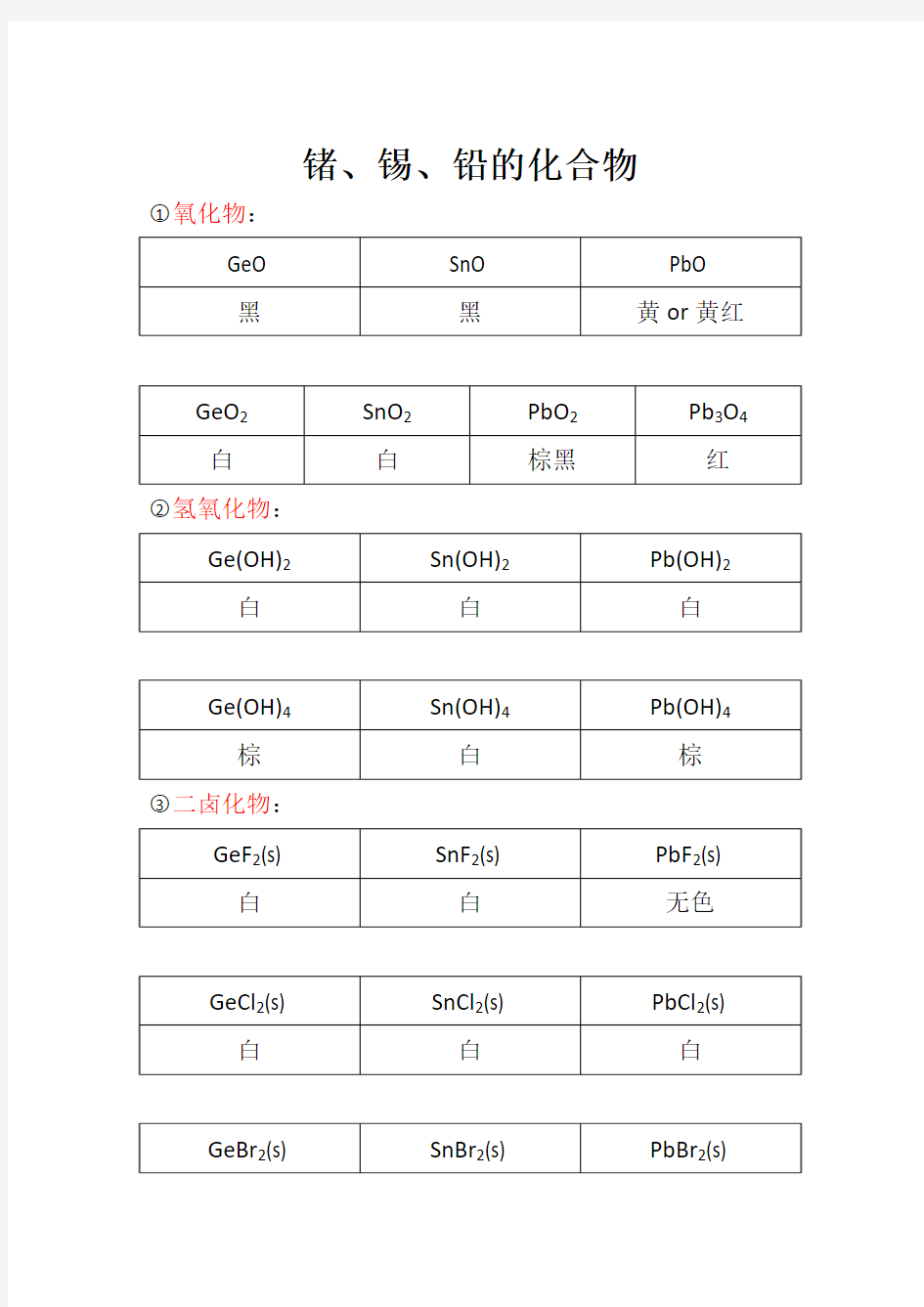
锗、锡、铅的化合物○1氧化物:
○2氢氧化物:
○3二卤化物:
○4四卤化物:
○5硫化物:
○6铅的含氧酸盐:
锑、铋的化合物○1氢化物都是无色的气体
○2氧化物:
○3三卤化物:
○4五卤化物:
○5硫化物:
铜的化合物
○1氧化物:
○2氢氧化物:Cu(OH)2为蓝色
○3硫化物:Cu2S为黑色
○4卤化物:
CuCl2在浓度很高时为黄绿色;浓时为绿色;稀时为蓝色;无水时为棕黄色
○5配合物:
○6其他:
银和金的化合物
○1银:
○2金:
锌族元素的化合物○1锌族M2+离子全为无色
○2氧化物:
○3硫化物:
○4卤化物:
○5配合物:
钛的化合物
钒的化合物○1氧化物:
○2离子:
铬的化合物○1Cr(Ⅲ):
○2Cr(Ⅵ):
锰的化合物○1Mn(Ⅱ):
○2Mn(Ⅳ):
○3Mn(Ⅵ)和Mn(Ⅶ):
铁的化合物○1氧化物和氢氧化物:
○2盐类:
Fe(Ⅱ)一般为浅绿色;Fe(Ⅲ)一般为红棕色
○3配合物:
钴和镍的化合物○1氧化物:
○2氢氧化物:
○3盐类:
○4配合物:
铂系金属的化合物○1氧化物:
○2卤化物:
○3配合物:氯铂酸盐为黄色
其他过渡金属化合物○1锆和铪的化合物:
○2铌和钽的化合物:
○3钼和钨的化合物:
○4锝和铼的化合物:
非金属元素的化合物
无机化合物颜色表
无机颜色表 含部分元素化合物常温下物态、颜色、形态等物理化学性质 卤族(英VIIA): Solid:I2 紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3 橙;I2O5 白; I2O4 黄(离子晶体);I4O9 黄(离子晶体). Liquid:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状. Gas:F2 浅黄;(CN)2无色;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕;(SCN)n 砖红色固体. 氧族(英VIA): Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3 橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;Cu S 黑↓;Na2S2O3 白;Na2S2O4 白; SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白加热变黄;H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色. Liquid:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO32-(aq) 无色;SO4 2-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红. Gas:O2 无色;O3 低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2Te 无色. 卤化硫(未注明者均为无色): Liquid:SF6;S2F10;SCl4 淡黄;SCl2 红籗2Cl2 无色;S2Br2 红. Gas:SF4;SF2;S2F2. 卤砜、卤化亚砜、卤磺酸: Liquid:SOCl2 白色透明;SO2Cl2 无色发烟. 氮族(英VA): Solid:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;P Br3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;AsI3 红;As4S4 红(雄黄);As4S6 黄(雌黄);As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X<>I) 白;SbI3 红;Sb2S3 橘红↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑. Liquid:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3^-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X<>I) 无色;. Gas:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH 3 无色;BiH3 无色. 卤化氮(未注明者均为无色): Solid:NBr3?(NH3)6 紫,爆炸性;NI3?(NH3)6 黑,爆炸性; Liquid:NCl3;无色 Gas:NF3;无色 碳族(英IVA): Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH) 2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;Ge
第三部分 常见无机物及其应用
第三部分常见无机物及其应用 元素化合物的知识是化学基本概念、基本理论、化学实验、化学计算的载体和核心。将元素化合物的知识系统化、结构化是学习本部分内容的一个好方法;从多个角度来认识元素化合物能更全面更深刻地理解元素化合物。 异。了解Na+、K+离子的检验方法。 铝单质及其重要化能说出铝的重要化合物的物理性质;认识铝的主要 化学性质(与氧气、酸、强碱反应);认识氧化铝和 氢氧化铝的两性;认识氢氧化铝的制备原理及加热 分解的性质; 化学 第一、二、三节 一、知识整理 1.常见金属元素的位置和物理通性 (1)元素在周期表中的位置 (2)金属材料的物理通性 常用的金属材料主要有金属和合金两类,它们具有如下的物理通性:①金属具有金属光泽;②金属具有导电性;③金属具有导热性;④金属具有良好的延展性。
2.比较金属性强弱的方法 元素金属性的本质是指元素的原子失电子能力。它取决于金属的原子半径、核电荷数、最外层电子数等因素。可以从以下几个方面来比较元素金属性强弱: (1)根据金属的原子结构; (2)根据元素在周期表中的位置; (3)根据最高价氧化物对应水化物的碱性强弱; (4)根据与氧气反应的难易; (5)根据与水反应的条件难易; (6)根据与非氧化性酸反应的剧烈情况; (7)根据金属间发生的置换; (8)根据原电池反应,做负极的金属比做正极的金属活泼。 3.金属活动性顺序的应用 在金属的复习中,充分发挥金属活动性顺序表在金属及化合物知识整合方面的功能对提高复习的实效性极为有利。 金属与氧气反应 常温极易氧 化,燃烧产生过氧化物或超氧化物 常温形成氧膜,点燃剧烈反应 常温与氧气缓慢 反应,高温下Fe 可在纯氧中燃烧 铜加热与氧化合,余难反应Mg 加热反铁与水蒸气反应 二、重点知识解析 1.钠及其钠的化合物 (1)钠及其钠的化合物的知识体系
化学必修常见无机物复习题有答案
江苏省苏州中学2009-2010学年度第一学期期中考试 高一物理 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两卷,满分100分,考试时间90分钟。第Ⅰ卷将正确的选项填涂在答题卡相应位置上,第Ⅱ卷直接做在答案专页上。 第Ⅰ卷(选择题,共36分) 一.单项选择题(以下各题只有一个答案正确) 1.下列说法正确的是: A.加速度增大,速度一定增大B.速度变化量越大,加速度就越大 C.物体有加速度,速度就增大D.物体加速度很大,速度可能为零 2.小李讲了一个龟兔赛跑的故事:龟、免从同一地点出发,发令枪响后龟缓慢地向终点跑去,直至到达终点,兔自恃跑得快,让龟跑了一段时间后才开始跑,当它超过龟后便在路旁睡起觉来,醒来一看,龟已接近终点了,于是便奋力追去,但最终还是让龟先到达了终点,据此,我们可以将龟兔赛跑的运动过程用位移一时间图象来表示,在下图中正确的是 3.如图所示,物体相对静止在水平传送带上随传送带同向匀速运动。它受到的力是 A.重力、弹力、静摩擦力 B.重力、弹力 C.重力、弹力、滑动摩擦力 D.重力、滑动摩擦力 4.如图所示,质量为10kg的物体在水平面上向右运动,此时受到水平向右外力作用F=20N,物体与平面之间的动摩擦因数为,则物体受到的合力是(g=9.8m/s2) A.20N,水平向右 B.,水平向左 C.,水平向右 D.,水平向右 二.多项选择题(以下各题有两个或两个以上答案正确)5.下列情况中的物体,哪些可以看作质点 A.研究从北京开往上海的一列火车的运行速度 B.研究汽车后轮上一点运动情况 C.体育教练员研究百米赛跑运动员的起跑动作 D.研究地球公转时的地球v F
无机化学常用化学式物质颜色常用俗称
无机化学反应式 1、2Na+2H 2O=2NaOH+H 2↑ 2、2Na 2O 2+2H 2O=4NaOH+O 2↑ 3、2Na 2O 2+2CO 2=2Na 2CO 3+O 2 4、NaOH 和NaHCO 3离子方程式为:OH - +HCO 3- =CO 32- +H 2O 5、氯气溶于水(新制氯水中含 .H + .Cl - .ClO - .OH -): Cl 2+H 2O=HCl+HClO Cl 2+2NaOH=NaCl+NaClO+H 2O 6、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂): 2HClO 光照 2HCl+O 2↑ 7、Ca(ClO)2+CO 2+H 2O=CaCO 3↓+2HClO 8、MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O 9、2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑ 10、 Al 2O 3+2NaOH=2NaAlO 2+H 2O 11、Al(OH)3+NaOH=NaAlO 2+2H 2O 12、H 2O 2的分解: 2H 2O 22 MnO 2H 2O+O 2↑ 13、2SO 2+O 2 催化剂、△ 2SO 3 14、SO 2+Cl 2+H 2O=2HCl+ H 2SO 4 15、Cu+2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O 16、C+2H 2SO 4(浓)CO 2↑+2SO 2↑+2H 2O 17、 催化剂高温、高压 22 N +3H 32NH 18、N 2+O 2 放电 ChemPaster 2NO 19、2NO+O 2=2NO 2 20、3NO 2+H 2O=2HNO 3+NO 21、4NH 3 +5O 2 4NO+6H 2O 22、用浓盐酸检验氨气(白烟生成): NH 3+HCl=NH 4Cl 23、2NH 4Cl+Ca(OH)2 CaCl 2+2NH 3↑+2H 2O (实验室制氨气) 24、Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 25、 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O 26、C+4HNO 3(浓)=CO 2↑+4NO 2↑+2H 2O 27、Fe+3SCN -=Fe(SCN)3 28、盐类水解: ①CH 3COO - +H 2O CH 3COOH+OH - ② CO 32- +H 2O 3-+OH - ③HCO 3- +H 2O 2CO 3+OH - ④NH 4+ +H 2O 3?H 2O+H + ⑤Fe 3+ +3H 2O Fe(OH)3+3H + 29、铝热反应: 2Al+Fe 2O 3高温 2O 3 4Al+3MnO 2 高温 2O 3 30、Al 2(SO 4)3+6NH 3·H 2O=2Al(OH)3↓+3(NH 4)2SO 4(实验室室制备氢氧化铝)
【速效记忆·化学竞赛】无机化合物颜色表(彩色版)
无机化合物颜色表(彩色版) 含部分元素化合物常温下物态、颜色、形态等物理化学性质 (字体颜色仅供参考和方便记忆,标准颜色还请参照实物。白色和无色均以标准字体表示,黑色表示为加粗体) 卤族(英VIIA): Solid:I2紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3橙;I2O5白; I2O4黄(离子晶体); I 4O 9 黄(离子晶体). Liquid:Br2红棕;BrF3浅黄绿;IBr3棕;Cl2O6暗红;Cl2O7无色油状;HClO4无色粘稠状;(SCN) 2 黄色油状. Gas:F2浅黄;(CN)2无色;Cl2黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2黄 色;Br 2 O 深棕;(SCN)n 砖红色固体. 氧族(英VIA): Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓; MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb 2S 3 橘红↓;SnS 褐色↓;HgS 黑(沉淀), 红(朱砂);Ag 2S 黑↓;CuS 黑↓;Na 2 S 2 O 3 白;Na 2 S 2 O 4 白; SeO 2 白,易挥发;SeBr 2 红;SeBr 4 黄;TeO 2白加热变黄;H 2 TeO 3 白;TeBr 2 棕;TeBr 4 橙;TeI4 灰黑;PoO 2 低温黄(面心立 方),高温红(四方);SO 3无色;SeO 3 无色易潮解;TeO 3 橙色;H 6 TeO 6 无色. Liquid:H2O 无色;纯H2O2淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4无色油状;SO32-(aq) 无 色;SO 42-(aq) 无色;SeO 2 (l) 橙;TeO 2 (l) 深红. Gas:O2无色;O3低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2无 色;H 2Se 无色;H 2 Te 无色. 卤化硫(未注明者均为无色): Liquid:SF6;S2F10;SCl4淡黄;SCl2樱桃红;S2Cl2 金黄色;S2Br2红. Gas:SF4;SF2;S2F2. 卤砜、卤化亚砜、卤磺酸: Liquid:SOCl2白色透明;SO2Cl2无色发烟. 氮族(英VA): Solid:铵盐无色晶体;氮化金属白;N2O3蓝色(低温);N2O5白;P 白,红,黑;P2O3白; P 2O 5 白;PBr 3 黄;PI 3 红;PCl 5 无色;P 4 S x 黄;P 2 S 3 灰黄;P 2 S 5 淡黄;H 4 P 2 O 7 无色玻璃状; H 3PO 2 白;As 灰;As 2 O 3 白;As 2 O 5 白;AsI 3 红;As 4 S 4 红(雄黄);As 4 S 6 黄(雌黄);As 2 S 5 淡 黄;Sb 银白;Sb(OH) 3白↓;Sb 2 O 3 白(锑白,颜料);Sb 2 O 5 淡黄;SbX 3 (X<>I) 白;SbI 3 红; Sb 2S 3 橘红↓;Sb 2 S 5 橙黄;Bi 银白略显红;Bi 2 O 3 淡黄;Bi 2 O 5 红棕;BiF 3 灰白;BiCl 3 白; BiBr 3黄;BiI 3 黑↓;Bi 2 S 3 棕黑. Liquid:N2H4无色;HN3无色;NH2OH 无色;发烟硝酸红棕;NO3-无色;王水浅黄,氯气 味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX 3无色;纯H 3 PO 4 无色粘稠状;AsX 3 (X<>I) 无色;. Gas:N2无色;NH3无色;N2O 无色甜味;NO 无色;NO2红棕;PH3无色;P2H6无色;AsH3无 色;SbH 3无色;BiH 3 无色. 卤化氮(未注明者均为无色): Solid:NBr3?(NH3)6紫,爆炸性;NI3?(NH3)6黑,爆炸性; Liquid:NCl3;无色 Gas:NF3;无色 碳族(英IVA): Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银
高考化学冲刺训练3.1常见无机物及其应用
江苏省2013高考化学冲刺训练常见无机物及其应用 一、单项选择题 1.下列类比关系正确的是( ) 与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O反应也生成AlO2- 与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 与Cl2反应生成FeCl3,则与I2反应可生成FeI3 与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 2.(2011·福建高考)下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( ) 3.(2011·山东高考)Al、Fe、Cu都是重要的金属元素。下列说法正确的是( ) A.三者对应的氧化物均为碱性氧化物 B.三者的单质放置在空气中只生成氧化物 C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al 4.下列实验报告记录的实验现象正确的是( )
是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断正确的是 ( ) 元素可能为Al 元素可能为Si C.反应①和②互为可逆反应 D.反应①和②一定为氧化还原反应 二、不定项选择题 6.(2011·镇江模拟)A、B、C、D、E都是中学化学中常见物 质,它们均含有同一种短周期元素,在一定条件下可发生如 图所示的转化,其中A是单质,B在常温下是气态氢化物, C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是( ) A.A可能是金属 B.由C生成D肯定发生了电子转移 C.A生成C肯定属于离子反应 D.B和E可能会发生反应生成一种盐
(最新整理)初中化学常见物质颜色和沉淀
初中化学常见物质颜色和沉淀 初中化学常见物质颜色和沉淀 编辑整理: 尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初中化学常见物质颜色和沉淀)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为初中化学常见物质颜色和沉淀的全部内容。
初中化学常见物质颜色和沉淀 初中化学常见物质的颜色 (一)、固体的颜色 1、黑色固体(5种):木炭,氧化铜,二氧化锰,四氧化三铁,铁粉 2、红色固体:铜-—紫红色,氧化铁Fe2O3-—红(棕)色 3、蓝色晶体:硫酸铜晶体CuSO4·5H2O 4、蓝色沉淀:氢氧化铜 5、蓝色溶液:含有Cu2+的溶液—硫酸铜溶液,氯化铜溶液,硝酸铜溶液 8、绿色固体:碱式碳酸铜 9、紫黑色固体:高锰酸钾 (二)、液体的颜色 10、紫红色溶液:高锰酸钾溶液 11、紫色溶液:石蕊溶液 12、黄色溶液:含有Fe3+的溶液-硫酸铁溶液,氯化铁溶液,硝酸铁溶液 13、浅绿色溶液:含有Fe2+的溶液-硫酸亚铁溶液 14、无色液体:水,稀盐酸,稀硫酸,酚酞试液 15、红褐色沉淀:氢氧化铁 (三)、常见气体 16、无色气体:单质——氧气,氢气,氮气。 化合物-二氧化碳,一氧化碳,甲烷,氯化氢,二氧化硫。 初中化学常见沉淀物质 红褐色絮状沉淀--———---Fe(OH)3 浅绿色沉淀--——-—--—-—---Fe(OH)2 蓝色絮状沉淀———-——-—-—-Cu(OH)2 白色沉淀———-—-----—-—-——-CaCO3,BaCO3,AgCl,Mg(OH)2,BaSO4 (其中BaSO4、AgCl是不溶于 HNO3的白色沉淀,Mg(OH)2、CaCO3、BaCO3是溶于HNO3的白色沉淀)。 初中化学常见物质的颜色 (一)、固体的颜色
2017年-高考化学常见无机物及化合物专题复习
2017年-高考化学常见无机物及化合物专题复习
2017年高考化学常见无机物及化合物专题复习 【考情快报】 在高考中该部分知识的主要题型是直接考查常见无机物性质及其应用的选择题、框图推断题和以常见无机物的知识作为载体综合考查有关概念、理论、实验和计算的非选择题。 (1)金属元素及其重要化合物中侧重考查铁、铝、钠、铜的单质、氧化物、氢氧化物和盐的性质及其应用。(2)非金属元素及其重要化合物中侧重考查SO2、NO、NO2、CO、Cl2、HNO3、H2SO4、碳酸盐等物质的性质及其应用。 【基础回顾】 一、金属及其化合物
对于Na、Al、Fe、Cu等元素的单质及其化合物,其中:1.能与冷水剧烈反应的单质是___,反应的离子方程式为__________________________。能用作供氧剂的是______。 2.能与NaOH溶液反应的单质是Al,反应的离子方程式为____________________________;能与NaOH溶液反应的氧化物是Al2O3,反应的离子方程式为_______________________;属于两性氢氧化物的是_______。 3.以上元素形成的氢氧化物中,易被空气中的氧气氧化的是Fe(OH)2,反应的化学方程式为_____________。 4.四种元素形成的金属阳离子共有__种,其中氧化性最强
的是Fe3+。它与单质铜反应的离子方程式为______。 二、非金属单质及其化合物 1.对于H、C、N、O、Si、S、Cl等元素形成的单质中(1)属于空气主要构成成分的是______,它们相互反应的化学方程式为_________________; (2)能用于自来水消毒的是____,它与NaOH溶液反应的离子方程式为_______________________,实验室中制备该气体的化学方程式为_____________________________________; (3)属于半导体材料的是___,其工业制取方法为_____________ _________。 2.在CO、CO2、SO2、NO、NO2、SiO2等氧化物中 (1)能用做工业炼铁还原剂的是______。 (2)能使品红溶液褪色的是_____。 (3)能与水反应生成强酸的是NO2,反应的化学方程式为____________________。 (4)属于普通玻璃构成成分的是_____,它与氢氟酸反应的化学方程式为_______________________。 3.在浓硝酸、稀硝酸、浓硫酸、稀硫酸中 (1)常温时能使Fe、Al钝化的是_______________。 (2)清洗试管内壁上的单质铜通常选用_______,反应的离子方程式为_________________________________。(3)见光易分解的是_______,反应的化学方程式为
常见无机物质颜色表
常见无机物质的颜色表 卤族(VIIA): Solid:I2 紫黑;ICl 暗红;ICl3 橙;I2O5 白;IBr 暗灰;IF3 黄色;I2O4 黄;I4O9 黄. Liquid:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状;(SCN)n 砖红色固体.Gas:F2 浅黄;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕. 氧族(VIA): Solid:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb2S3 橘红↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白加热变黄;H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色. Liquid:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO4^2-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红. Gas:O2 无色;O3 低浓度无色,高浓度淡蓝;S2(g) 黄,上浅下深;H2S 无色;
SO2 无色;H2Se 无色;H2Te 无色. .卤化硫(未注明者均为无色): Liquid:SF6;S2F10;SCl4 淡黄;SCl2 红;S2Cl2;S2Br2 红. Gas:SF4;SF2;S2F2. 卤砜、卤化亚砜、卤磺酸: Liquid:SOCl2 白色透明;SO2Cl2 无色发烟. 氮族(VA): Solid:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;AsI3 红;As4S4 红(雄黄);As4S6 黄(雌黄);As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X<>I) 白;SbI3 红;Sb2S3 黑↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑. Liquid:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3^-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;氨合电子(液氨溶液) 蓝;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X<>I) 无色;. Gas:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色. 卤化氮(未注明者均为无色):
第13章检验一些无机化合物第2讲
第13章检验一些无机化合物 第二讲混合物的检验 [考纲要求] 1.了解常见气体的检验。 2.综合运用化学知识对常见的混合物进行鉴定和鉴别. 分点清理查漏补缺 考点一:常见气体的检验 【基础再现】 【题组建模】 1.某无色气体可能由O2、CO、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(盛有Na2O2)后气体呈红棕色,则下列推断正确的
A.原气体中一定有NO和O2B.原气体中一定有NH3、NO、CO2、CO C.原气体中一定没有CO D.原气体中一定没有HCl、Br2、O2 答案.D 解析:依题意气体无色,故无Br2,通过过氧化钠后呈红棕色,说明一定有CO2和NO,又因NO 与O2不能共存,故原混合气中无O2;通过浓硫酸时体积减少,则一定有NH3,NH3不能与HCl共存,故原混合气中无HCl;至于原混合气中有无CO则无法判断。 2、下图为常见实验装置,请根据要求填空.(装置可重复使用) (1)检验水蒸气存在的现象是 (2)证明C02存在的原理是_________________________________(用化学方程式表示) (3)如果要吸收大量的C02气体,选择的装置是(填编号) (4)如果要验证混合气体中含有H2、C0和水蒸气,则仪器连接的先后顺序为______________(填 编号) 考点:常见气体的检验与除杂方法;仪器的装配或连接;二氧化碳的检验和验满;碱的化学性质。 专题:常见气体的实验室制法、检验、干燥与净化。 分析:本题属于气体的净化题,可以用不同的物质除去,用浓硫酸干燥氧气、氢气等常见气体,浓碱溶液可以吸收二氧化碳等酸性气体,二氧化碳用石灰水来检验;用无水硫酸铜检验是否有水生成,因为无水硫酸铜有一个特性:遇到水就会变蓝色.验证混合气体中含有H2、C0和水蒸气时,要注意先验证水,再检验其它气体. 解答:解:(1)用无水硫酸铜检验是否有水生成,因为无水硫酸铜有一个特性:遇到水就会变蓝色.故答案为:D中固体变蓝色 (2)二氧化碳用石灰水来检验,石灰水会变浑浊.二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水.故答案为:CO2+Ca(0H)2=CaCO3↓+H2O (3)浓碱溶液可以吸收二氧化碳,因此二氧化碳可以用氢氧化钠溶液吸收.故答案为:B (4)混合气体中含有H2、C0和水蒸气时,要注意先验证水,通过E装置以后,验证生成产物时,还要注意先验证水,再验证二氧化碳,否则影响检验效果.故答案为:DAEDC 点评:本考点考查了气体的净化或除杂质,也考查了气体的干燥,是中考的重点也是一个难点.根据物质的溶解性和除杂质的条件,要认真分析,综合把握.还要加强记忆除去常用离子的方法,从而突破难点.初中阶段常用的干燥剂要记牢,而且要掌握其性质,了解一种干燥剂能与哪一类物质反应,能做哪些气体的干燥剂等.本考点经常出现在选择题、填空题和实验题中. 3、已知2H2SO4(浓)+C CO2↑+2SO2↑+2H2O.为了证明木炭与浓硫酸反应有二氧化碳和二氧化 硫生成,甲、乙两位同学分别用下面的装置进行实验.实验中甲同学在C中盛放足量的饱和碳酸氢钠溶液,乙同学在C中盛放足量的酸性高锰酸钾溶液,两位同学在其他装置中盛放的药品相同且适量.
无机化合物颜色大全(按族分类)
无机化合物颜色大全 ?? 化合物的溶度积常数表 ?? 化合物性质的查询 ?? 较全的物质的颜色 无机颜色表(含部分元素化合物常温下物态、颜色、形态等物理化学性质)卤族(英VIIA): Solid:I 2 紫黑;ICl 暗红;IBr 暗灰;IF 3 黄色;ICl 3 橙;I 2 O 5 白; I 2O 4 黄(离子晶体);I 4 O 9 黄(离子晶体). Liquid:Br 2 红棕;BrF 3 浅黄绿;IBr 3 棕;Cl 2 O 6 暗红;Cl 2 O 7 无色油状; HClO 4 无色粘稠状;(SCN) 2 黄色油状. Gas:F 2 浅黄;(CN) 2 无色;Cl 2 黄绿;I 2 (g) 紫;BrF 红棕;BrCl 红; Cl 2O 黄红;ClO 2 黄色;Br 2 O 深棕;(SCN) n 砖红色固体. 氧族(英VIA): Solid:S 淡黄;Se 灰,褐;Te 无色 金属光泽; Na 2S,(NH 4 ) 2 S,K 2 S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Sb 2S 3 橘红 ↓;SnS 褐色↓;HgS 黑(沉淀),红(朱砂);Ag 2S 黑↓;CuS 黑↓;Na 2 S 2 O 3 白; Na 2S 2 O 4 白; SeO 2 白,易挥发;SeBr 2 红;SeBr 4 黄;TeO 2 白(加热变黄);H 2 TeO 3 白;TeBr 2 棕;TeBr 4 橙;TeI 4 灰黑;PoO 2 低温黄(面心立方),高温红(四方);S O 3 无色;SeO 3 无色易潮解;TeO 3 橙色;H 6 TeO 6 无色. Liquid:H2O 无色;纯H 2 O 2 淡蓝色粘稠;CrO(O 2 ) 2 (aq) 蓝;纯H 2 SO 4 无色 油状;SO 32-(aq) 无色;SO 4 2-(aq) 无色;SeO 2 (l) 橙;TeO 2 (l) 深红. Gas:O 2 无色;O 3 低浓度无色,高浓度淡蓝(鱼腥味);S 2 (g) 黄,上浅下 深;H 2S 无色;SO 2 无色;H 2 Se 无色;H 2 Te 无色. 卤化硫(未注明者均为无色): Liquid:SF 6,S 2 F 10, SCl 4 淡黄;SCl 2 红 ;S 2 Cl 2 无色;S 2 Br 2 红. Gas: SF 4 ; SF 2 ; S 2 F 2 . Liquid:SOCl 2 白色透明;SO 2 Cl 2 无色发烟. 氮族(英VA): Solid:铵盐 无色晶体;氮化金属 白;N 2O 3 蓝色(低温);N 2 O 5 白;P 白, 红,黑;P 2O 3 白;P 2 O 5 白;PBr 3 黄;PI 3 红;PCl 5 无色;P 4 S x 黄;P 2 S 3 灰黄;P 2 S 5 淡黄;H 4 P 2 O 7 无色玻璃状;H 3 PO 2 白;As 灰;As 2 O 3 白;As 2 O 5 白;AsI 3 红;As 4S 4 红(雄黄);As 4 S 6 黄(雌黄);As 2 S 5 淡黄;Sb 银白;Sb(OH) 3 白↓;Sb 2 O 3 白(锑 白,颜料);Sb 2O 5 淡黄;SbX 3 (X<>I) 白;SbI 3 红;Sb 2 S 3 橘红↓;Sb 2 S 5 橙黄;B i 银白略显红;Bi 2O 3 淡黄;Bi 2 O 5 红棕;BiF 3 灰白;BiCl 3 白;BiBr 3 黄;BiI 3 黑↓;Bi 2S 3 棕黑. Liquid:N 2H 4 无色;HN 3 无色;NH 2 OH 无色;发烟硝酸 红棕;NO 3 -(l) 无色;王水 浅黄,氯气味;硝基苯 黄色油状;氨合电子(液氨溶液) 蓝;PX 3 无 色;纯H 3PO 4 无色粘稠状;AsX 3 (X<>I) 无色;.
高中化学物质颜色大全
1.红色: Fe(SCN)3(红色溶液) Cu2O(红色固体) Fe2O3(红棕色固体) 红磷(暗红色固体) 液溴(深红棕色) Fe(OH)3(红褐色固体) Cu(紫红色固体) 溴蒸气、NO2(红棕色) 品红溶液(红色) 在空气中久置的苯酚(粉红) 石蕊遇酸性溶液(红色) 酚酞遇碱性溶液(红色) 2.紫色: 石蕊在中性溶液中(紫色) Fe3+与苯酚反应产物(紫色) I2(有金属光泽紫黑色固体) KMnO4 固体(紫黑色) MnO4—(紫红色溶液) 钾的焰色反应(紫色) I2蒸气、I2在非极性溶剂中(紫色) 3.橙色:溴水(橙色) K2Cr2O7溶液(橙色) 4.黄色: AgI(黄色固体) AgBr(淡黄色固体) Ag3PO4(黄色固体) FeS2(黄色固体) Na2O2(淡黄色固体) S(黄色固体) Au(金属光泽黄色固体) I2的水溶液(黄色) 碘酒(黄褐色) 久置的KI溶液(黄色)(被氧化为I2) Na的焰色反应(黄色) TNT(淡黄色针状) 工业浓盐酸(黄色)(含有Fe3+) NaNO2(无色或浅黄色晶体) Fe3+的水溶液(黄色) 硝基苯中溶有浓硝酸分解的NO2时(黄色) 久置的浓硝酸(黄色)(溶有分解生成的NO2) 浓硝酸粘到皮肤上(天然蛋白质)(显黄色) 5.绿色: Cu2(OH)2CO3(绿色固体) Fe2+的水溶液(浅绿色) FeSO4·7H2O(绿矾) Cl2、氯水(黄绿色) F2(淡黄绿色) CuCl2的浓溶液(蓝绿色) 7.棕色:FeCl3固体(棕黄色) CuCl2固体(棕色) 6.蓝色: Cu(OH)2、CuSO4·5H2O、Cu2+在水溶液中(蓝色) 石蕊遇碱性溶液(蓝色) 硫、氢气、甲烷、乙醇在空气中燃烧(淡蓝色火焰) 一氧化碳在空气中燃烧(蓝色火焰) 淀粉遇I2变蓝色 Cu(OH)2溶于多羟基化合物(如甘油、葡萄糖等)的水溶液中(绛蓝色) 7.黑色: FeO; Fe3O4; FeS; CuO; CuS; Cu2S; MnO2; C粉; Ag2S; Ag2O; PbS;AgCl、AgBr、AgI、AgNO3光照分解均变黑; 绝大多数金属在粉末状态时呈黑色或灰黑色。 8.白色:常见白色固体物质如下(呈白色或无色的固体、晶体很多): AgCl; Ag2CO3; Ag2SO4; Ag2SO3; BaSO4; BaSO3; BaCO3; Ba3(PO4)2; BaHPO4; CaO; Ca(OH)2; CaCO3; MgO; Mg(OH)2; MgCO3; Fe(OH)2; AgOH; PCl5; SO3; 三溴苯酚; CuSO4; 铵盐(白色固体或无色晶体); Fe(OH)2沉淀在空气中的现象:白色→(迅速)灰绿色→(最终)红褐色 pH试纸:干燥时呈黄色;中性时呈淡绿色;酸性时呈红色,酸性越强,红色越深;碱性时呈蓝色,碱性越强,蓝色越深 红色石蕊试纸:红色(用于检验碱性物质) 蓝色石蕊试纸:蓝色(用于检验酸性物质) 淀粉试纸:白色(用于检验碘单质) KI—淀粉试纸:白色(用于检验氧化性物质) 石蕊:pH<5时呈红色;pH介于5~8时呈紫色;pH>8时呈蓝色。 酚酞:pH<8.2时呈无色;pH介于8.2~10时呈粉红色;pH>10时呈红色。 甲基橙: pH<3.1时呈红色;pH介于3.1~4.4时呈橙色;pH>4.4时呈黄色。 甲基红: pH<4.4时呈红色;pH介于4.4~6.2时呈橙色;pH>6.2时呈黄色。 使品红褪色的气体:SO2(加热后又恢复到红色)、Cl2(加热后不恢复红色)
无机化学常用化学式物质颜色常用俗称
无机化学常用化学式物质颜色常用俗称 Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】
无机化学反应式 1、2Na+2H 2O=2NaOH+H 2↑ 2、2Na 2O 2+2H 2O=4NaOH+O 2↑ 3、2Na 2O 2+2CO 2=2Na 2CO 3+O 2 4、NaOH 和NaHCO 3离子方程式为:OH - +HCO 3- =CO 32- +H 2O 5、氯气溶于水(新制氯水中含 .H + .Cl - .ClO - .OH -): Cl 2+H 2O=HCl+HClO Cl 2+2NaOH=NaCl+NaClO+H 2O 6、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂): 2HClO 光照2HCl+O 2↑ 7、Ca(ClO)2+CO 2+H 2O=CaCO 3↓+2HClO 8、MnO 2+4HCl(浓)MnCl 2+Cl 2↑+2H 2O 9、2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑ 10、 Al 2O 3+2NaOH=2NaAlO 2+H 2O 11、Al(OH)3+NaOH=NaAlO 2+2H 2O 12、H 2O 2的分解: 2H 2O 22MnO 2H 2O+O 2↑ 13、2SO 2+O 2催化剂、△ 2SO 3 14、SO 2+Cl 2+H 2O=2HCl+ H 2SO 4 15、Cu+2H 2SO 4(浓)CuSO 4+SO 2↑+2H 2O 16、C+2H 2SO 4(浓) CO 2↑+2SO 2↑+2H 2O 17、 催化剂高温、高压 22 N +3H 3 2NH 18、N 2+O 2 放电 2NO 19、2NO+O 2=2NO 2 20、3NO 2+H 2O=2HNO 3+NO 21、4NH 3 +5O 24NO+6H 2O 22、用浓盐酸检验氨气(白烟生成): NH 3+HCl=NH 4Cl 23、2NH 4Cl+Ca(OH)2 CaCl 2+2NH 3↑+2H 2O (实验室制氨气) 24、Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O 25、 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O 26、C+4HNO 3(浓)=CO 2↑+4NO 2↑+2H 2O 27、Fe+3SCN -=Fe(SCN)3 28、盐类水解: ①CH 3COO - +H 2O CH 3COOH+OH - ② CO 32- +H 2O HCO 3-+OH - ③HCO 3- +H 2O H 2CO 3+OH - ④NH 4+ +H 2O NH 3H 2O+H + ⑤Fe 3+ +3H 2O Fe(OH)3+3H + 29、铝热反应: 2Al+Fe 2O 3高温 2Fe+Al 2O 3 4Al+3MnO 2 高温 3Mn+2Al 2O 3 30、Al 2(SO 4)3+6NH 3·H 2O=2Al(OH)3↓+3(NH 4)2SO 4(实验室室制备氢氧化铝) 31、高温下铁与水反应 :3Fe+4H 2O (g) 高温 Fe 3O 4+4H 2 32、FeCl 3+3NaOH=Fe(OH)3↓+3NaCl 33、4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 34、2FeCl 2+Cl 2=2FeCl 3 35、2FeCl 3+Fe=3FeCl 2 36、氯化铁溶液中加入铜粉: 2FeCl 3+Cu=2FeCl 2+CuCl 2 37、金属的冶炼:Fe 2O 3+3CO 高温 2Fe+3CO 2 CuO+C 高温Cu+CO↑ 38、铜锌原电池:正极:2H ++2e - =H 2↑ 负极:Zn-2e - =Zn 2+ 39、钢铁的吸氧腐蚀:正极:O 2+4e - +2H 2O=4OH - 负极:Fe-2e - =Fe 2+ 40、Fe(OH)3胶体的制取:FeCl 3 +3H 2O Fe(OH)3(胶体)+3HCl 41、电解CuCl 2溶液:阳极:2Cl - -2e - =Cl 2↑ 阴极:Cu 2++2e - =Cu 总反应: CuCl 2 通电 2↑
无机化合物(主族、过渡)的颜色整理(word版)
一、金属活动性顺序 K>Ba>Ca>Na>Li>Mg>Al>Ti>V>Be>Mn>Zn>Cr>Fe>Co>Ni>Sn>Pb>(D)>(H)>Cu>Hg>Ag>Rh>Pd>Pt>Au 二、MNO 3 的热分解规律 ①K→Na活泼金属MNO 3→MNO 2 + O 2 ↑ ②Mg→Cu等较活泼金属MNO 3→MO + NO 2 ↑+ O 2 ↑ ③Hg以后不活泼金属MNO 3→M + NO 2 ↑+ O 2 ↑ 三、焰色反应 Li深红;Na黄;K紫;Rb红紫;Cs紫红;Ca砖红;Sr洋红;Ba绿四、碳族 ①Sn(Ⅱ) SnO灰色粉末;Sn(OH) 2白↓,偏碱性;SnCl 2 SnF 2 白;SnBr 2 淡黄;SnI 2 橙;SnS棕↓ ②Sn(Ⅳ) SnO 2白;Sn(OH) 4 绿色;SnF 4 白;SnBr 4 无色;SnI 4 红;SnS 2 金黄(俗称"金粉")↓;SnCl 4 (l)无色 ③Pb(Ⅱ) PbO黄或黄红;Pb 2O 3 橙;PbS黑↓;PbF 2 无色↓;PbCl 2 白↓;PbBr 2 白;PbI 2 金黄;PbSO 4 白↓; PbCO 3白↓;Pb(OH) 2 白↓;Pb 3 (CO 3 ) 2 (OH) 2 铅白↓ ④Pb(Ⅳ) Pb 3O 4 (2PbO?PbO 2 ):红(铅丹/红铅) PbO 2棕;2PbO·PbO 2 红;PbS 2 红褐;PbCl 4 (l)无色;PbF 4 无色;Pb(NO 3 ) 2 无色;Pb(Ac) 2 ?H 2 O无色晶体 五、氮族As 2O 3 白;As 2 O 5 黄 ①Sb Sb 2O 3 白(锑白);Sb 2 O 5 淡黄;Sb 2 S 3 橘红↓;Sb 2 S 5 橙黄;SbX 3 (X=F,Cl,Br)白;SbI 3 红; Sb(OH) 3 白↓②Bi Bi 2O 3 淡黄;Bi 2 O 5 红棕(不稳定);Bi 2 S 3 棕黑;BiF 3 灰白;BiCl 3 白;BiBr 3 黄;BiI 3 黑↓ 六、硫 ①硫化物 BaS白↓;ZnS白↓;FeS黑↓;CuS黑↓;Ag 2 S黑↓;HgS黑(沉淀),红(朱砂);MnS肉红↓; CdS黄↓;SnS褐色↓;PbS黑↓;As 2S 3 黄;As 2 S 5 黄;Sb 2 S 3 橙红;Sb 2 S 5 橙红;Bi 2 S 3 棕黑弱碱 ②硫代化物 可溶于Na 2S溶液生成可溶性硫代酸盐的:As 2 S 3 Sb 2 S 3 SnS 2 HgS 七、铬(3d54s1) ①水合离子 Cr2+蓝;Cr3+紫;CrO 2-绿;Cr(OH) 4 -亮绿;CrO 4 2-黄;Cr 2 O 7 2-橙红; ②简单化物 CrO黑;Cr 2O 3 绿;CrO 2 暗红针状;CrO 3 橙;CrO 5 (aq)蓝;Cr(OH) 2 黄棕;Cr(OH) 3 灰蓝 [CrO(O 2) 2 ]OEt 2 蓝;CrO 2 Cl 2 深红液体;CrCl 2 白;CrCl 3 紫 ③络合物 [Cr(H 2O) m (NH 3 ) n ]3+,(m+n=6) for(m=6) 紫→紫红→浅红→橙红→橙黄→黄 [Cr(H 2O) 4 Cl 2 ]Cl暗绿→(冷却HCl)→[Cr(H 2 O) 6 ]Cl 3 紫色→(乙醚HCl)→[Cr(H 2 O) 5 Cl]Cl 2 ?H 2 O淡绿 ④水合物 Cr 2(SO 4 ) 3 ?18H 2 O紫色立方晶体→Cr 2 (SO 4 ) 3 ?15H 2 O深绿色片状→Cr 2 (SO 4 ) 3 桃红色粉末 ⑤沉淀铬酸盐 BaCrO 4黄↓;PbCrO 4 黄↓;Ag 2 CrO 4 砖红↓ 八、锰(3d54s2) ①水合离子
