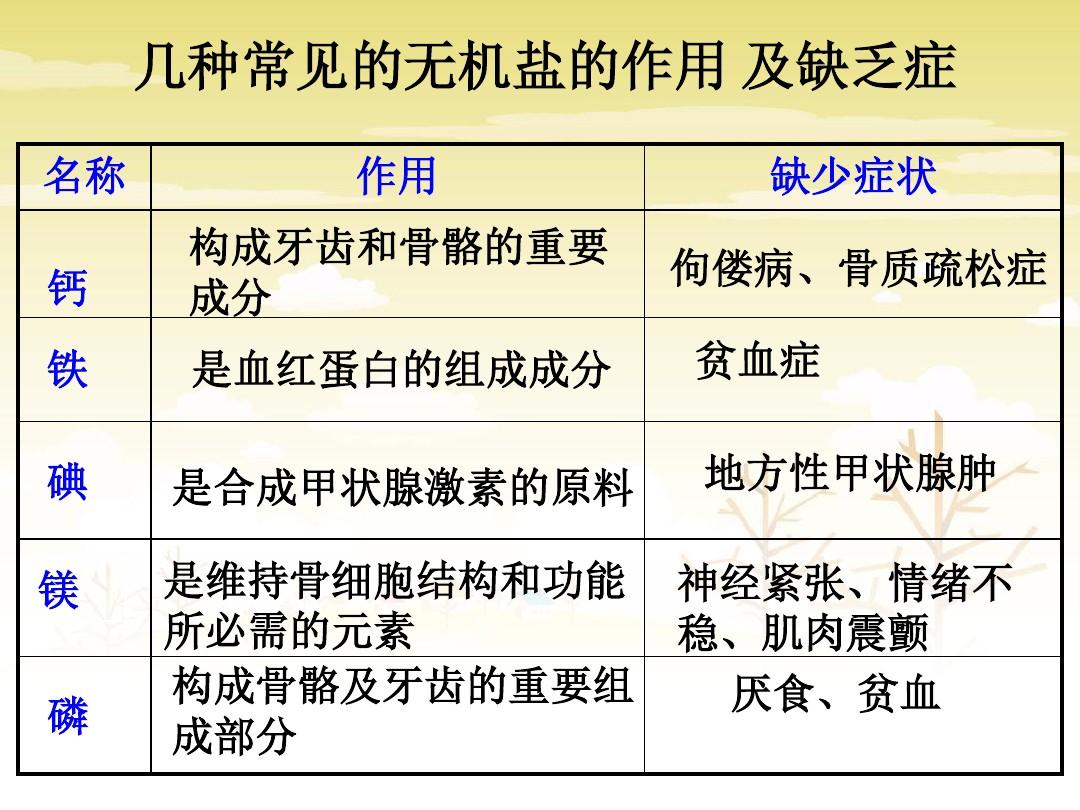
几种常见的无机盐的作用及缺乏症
常见盐和盐的性质,盐的小实验
课题:5.5-6 常见盐和盐的性质,盐的小实验授课人赵菊敏 年级:一年级课的类型:新授课时:2 教学目的:1、使学生掌握盐的命名原则。 2、了解含盐、纯碱、碳酸氢钠、碳酸钙的性质。 3、掌握盐的通性。 教学重点:盐的化学通性。 教学难点:盐的命名 德育要点:热爱化学,热爱生活,量弯引起质变,结构决定性质;安全教育 教学方法:讲授、实验、练习 教具:多媒体喷壶、素描纸、实验用品 教学过程: [组织教学] [复习巩固] [引入新课][演示实验]一喷两色字 分别用KSCN、K4[Fe(CN)6].3H2O在纸上写字,晾干。用小喷壶向上喷FeCl3溶液,分别显出红色字和蓝色字。 [提出问题]盐都有咸味吗?为什么说食盐是人体不可缺少的主要物质?吃东西越咸,身体就越好吗? [投影][讲解] 1. 盐的组成和命名 1)盐的组成 盐是由金属离子和酸根离子结合而成的化 合物。 (2)盐的分类和命名 ①通称: 按照盐分子里金属离子的种类来命名,可分为钠盐、钙盐、钡盐等。 按照盐分子里酸根离子的种类来命名, 可分为硫酸盐、碳酸盐、硝酸盐等。 1. 盐的组成和命名 ②根据酸碱的中和程度: 正盐:酸碱完全中和的产物。对于含氧酸盐,金属元素显示高价的盐,命名为“某酸某金属”;金属元素显示低价命名为“某酸亚某金属”。 CuSO4 Na2SO4 NaSO3 Ca(ClO)2 Na2CO3 CuSO4 Na3PO4 Fe2(SO4)3 FeSO4 对于无氧酸盐,金属元素显示高价的命名为“某化某金属”,金属元素显示低价命名为“某化亚某金属”FeCl3 FeCl2 酸式盐:酸中的氢离子被部分中和的产物。命名时在正盐中酸的名称后加个“氢”字,若酸式盐中含有多个可电离的氢原子,命名时可标明数字。 NaHSO4 NaHCO3 Na2HPO4 NaH2PO4 碱式盐:碱中的氢氧根离子被部分中和的产物。命名时在正盐的名称前加“碱式”二字。Cu2(OH)2CO3 [练习] 1、命名:CuCl2 CuCl HgCl2 Hg2Cl2 KNO3 Fe2S3 FeS BaSO3 Ca(HCO3)2 Cu2(OH)2SO4 2、用以下物质填空:Na2CO3 NaHSO4 BaCl2 CaHPO4 Cu2(OH)2CO3 CaCO3
专题九常见酸碱盐的性质及用途
专题九常见酸碱盐的性质及用途 一.选择题(本题包括16个小题,每小题2分,共32分。每小题只有一个选项符合题意。请将正确选项的序号填入下表相应空格内。) 程中产生的物质的酸碱性是: A.酸性 B.碱性 C.中性 D.无法判断 2 C.柠檬汁的酸性比食醋强D.雨水能使蓝色石蕊试纸变红 3.化学就在我们身边,生活中处处有化学。根据你所学过的化学知识,下列说法错误的是 (A)“请往菜里加点盐”中的“盐”特指食盐——NaCl (B)体温表中的水银不是银,是金属汞 (C)食品工业中,发酵粉的主要成份是小苏打——Na 2CO 3 (D)生活中常用的铁制品都是铁的合金 4.下列物质在敞口容器中久置,质量减小的是 A.浓硫酸B.浓硝酸C.固体NaOH D.固体NaCl 5.为防止食品变质,常在食品包装盒中放入一小袋用来吸收水分和氧气的物质是 A.生石灰B.固体烧碱C.碳酸氢钠D.铁粉 6. 除去氯化钠溶液中含有的少量氢氧化钠,可以选用的试剂是 A. 盐酸 B. 酚酞 C. 二氧化碳 D. 碳酸钠 7 该实验室购进了两瓶无水氯化钙,应将它放在 A.甲橱B.乙橱C.丙橱D.丁橱 8. 小强家的仓库里存有少量无标签但密封良好的化肥。为了确定该化肥的成分,他取少量化肥与熟石灰粉末混合、研磨,闻到刺激性气味。由此判断该化肥为 A. 氯化铵 B. 碳酸钾 C. 硫酸钾 D. 硝酸钠 9.益阳松花皮蛋闻名全国,远销东南亚国家。其制作的配料有纯碱、食盐、生石灰、草木灰(内含碳酸钾)、开水,以及米糠、稻壳等辅料。配料之间首先是生石灰与水反应生成熟石灰,试推断另外最有可能发生的化学反应是 A.化合反应 B.分解反应 C.复分解反应D.置换反应 10.下列物质发生的变化与空气的成分无关的是
水和无机盐
水和无机盐 学校:___________姓名:___________班级:___________考号:___________ 第I卷(选择题) 评卷人得分 一、单选题(本题共30道小题,每小题0分,共0分) 1.如表是微生物培养基的成分。下列有关说法错误的是 编号① ②③④④ 成分(NH4)2SO4KH2PO4FeSO4CaCl2H2O 含量/g 0.4 4.0 0.5 0.5 100mL A. 此培养基可用来培养自养型微生物 B. 此表中的营养成分共有三类,即水、无机盐、氮源 C. 若除去①,此培养基可培养圆褐固氮菌 D. 培养基中若加入氨基酸,则它可充当碳源、氮源和生长因子 2.如表是植物细胞在放入蔗糖溶液前,以及放入甲、乙、丙三种不同浓度的蔗糖溶液后,细胞的形态。下列叙述正确的是() 实验处 放入前放入甲溶液放入乙溶液放入丙溶液理 细胞的 形态 A. 浸泡在甲溶液中的细胞,细胞液浓度逐渐增大 B. 浸泡在乙溶液中细胞的内外浓度相等,没有水分子进出细胞 C. 浸泡在丙溶液中的细胞出现质壁分离时,液泡内充满蔗糖溶液
D. 三种蔗糖溶液的浓度大小关系为甲溶液<乙溶液<丙溶液 3.水是生命之源,是一切生命活动的基础。下列有关水的说法错误的是() A. 水可以参与细胞中的化学反应 B. 细胞中的化学反应必须在水中进行 C. 种子入库前晒干的目的是减少种子体内的自由水和结合水 D. 自由水与结合水比值降低,会影响细胞的代谢活动 4.组成蛋白质的氨基酸之间通过肽键相连,肽键结构式是() A. —NH—COO B. —NH—CO— C. NH2—COOH— D. NH2—COOH 5.下列关于组成生物的元素和化合物的说法,正确的是() A. 细胞中的微量元素因含量极少而不如大量元素重要 B. 组成细胞的元素同样存在于自然环境中 C. 细胞中的无机盐多以化合物形式存在 D. 无论鲜重还是干重,组成细胞的元素中C的含量最多 6.下列关于无机盐和其他化合物对人体与动物机能影响的叙述,正确的是 A. 摄入过多过咸食物后,会引起细胞内液的量增加 B. 骨骼肌纤维内乳酸积累过多,会引起细胞体积增大 C. 发生局部炎症反应时的肿胀,是由于组织中的Na+浓度增加所致 D. 将蛙神经纤维置于适宜的溶液后再适当增加溶液的KCl浓度,其静息电位绝对值增大 7.下列关于细胞中无机盐的叙述,正确的是 A. 细胞中的无机盐大多数以化合物的形式存在 B. 无机盐的浓度大小不会影响细胞的形态 C. 一般情况下,植物正常生长所需锌盐量大于所需钾盐量 D. 生物体内无机盐含量会因生物的种类、生物所处的生长发育期不同而有所不同 8.在研磨时加入少许二氧化硅和碳酸钙,其作用分别是() A. 研磨充分,溶解色素 B. 防止色素受破坏,溶解色素 C. 研磨充分,防止色素被破坏 D. 防止色素被破坏,研磨充分 9.高渗性脱水是指机体中水和钠同时丧失,且失水多于失钠。下列叙述错误的是 A. 渗透压感受器产生兴奋后,大脑皮层会产生渴觉 B. 由垂体释放到血浆中的抗利尿激素增多 C. 肾小管和集合管重吸收的水增多,使尿量减少 D. 若机体继续失水,细胞外的水向细胞内流动 10.下列各项中,正确表示肽键的是() A. —CO—NH2 B. —CO—NH C. NH—CO D. —NH—
酸碱盐化学性质的归纳
初中化学—酸碱盐化学性质得归纳 一、酸得化学性质 1、酸得通性:酸→H++酸根离子 2、常见得酸:硫酸(H 2SO 4) H2SO 4→H ++ SO 42- 硝酸(H NO3) HNO 3→H++ NO 3- 盐酸(HCl) HC l→H ++ Cl - 碳酸(H 2CO 3) H2CO 3→H++ CO 32- 醋酸(CH 3COOH) C H3C OOH →H ++CH 3C OO-(醋酸根离子) 3、酸具有酸得通性——原因:不同得酸在溶于水时,都能电离出相同得H +。 4、酸得化学性质归纳 (1)酸溶液与酸碱指示剂得反应 紫色石磊溶液遇酸溶液变红,无色酚酞溶液遇酸溶液不变色 (2)酸与活泼金属反应 表达式:酸+金属→盐+H 2↑ (置换反应) 条件:金属活动性必须在H 得前面(K 、Ca 、Na 除外) 比如:Fe+H2SO 4===Fe SO 4+ H 2↑ Zn +2HCl === ZnCl 2+ H 2↑ Cu+H 2SO 4 /HC l 不能反应,因为Cu 在H 后面 (3)酸与某些金属氧化物反应 表达式:酸+金属氧化物→盐+H 2O (复分解反应) 条件:常见得金属氧化物(ZnO 、F e2O 3、Al 2O 3) 比如:Zn O +H2SO 4===Zn SO 4+ H 2O Fe 2O 3+6HCl ===2FeCl 3+3H 2O Al 2O 3 +3H 2SO 4=== A l2(SO 4)3+3H 2O F e2O 3+3H2SO4=== Fe2(SO 4)3+3H 2O (4)酸与碱反应 表达式:酸+碱→盐+H 2O (中与反应、复分解反应) 条件:酸与碱都能反应 比如:NaOH+HCl ===NaCl+H 2O
高中化学 盐的物理化学性质和用途
盐的性质 ?盐的定义: 盐是指由金属离子(或钱根离子)和酸根离子构成的化合物,盐在溶液里能解离成金属离子(或钱根离子)和酸根离子。根据阳离子不同,可将盐分为钠盐、钾盐、钙盐、钱盐等,根据阴离子不同,可将盆分为硫酸盐、碳酸盐,硝酸盐等。 生活中常见的盐有: 氯化钠(NaCl),碳酸钠(Na2CO3)、碳酸氧钠(NaHCO3)、碳酸钙和农业生产上应用的硫酸铜(CuSO4)。 ?盐的物理性质: (1)盐的水溶液的颜色常见的盐大多数为白色固体,其水溶液一般为无色。但是有 些盐有颜色,其水溶液也有颜色。例如:胆矾(CuSO4·5H2O)为蓝色,高锰酸钾为紫黑色;含Cu2+的溶液一般为蓝色,含Fe2+的溶液一般为浅绿色,含Fe3+的溶液一般为黄色。 (2)盐的溶解性记忆如下钾钠硝钱溶水快(含K+,Na+,NH4+,NO3-的盐易溶于水);硫 酸盐除钡银钙(含SO42-的盐中,Ag2SO4, CaSO4微溶,BaSO3难溶)都易溶;氯化物中银不溶(含Cl-的盐中,AgCl不溶于水,其余一般易溶于水);碳酸盐溶钾钠钱[含CO32-的盐,Na2CO3、(NH4)2CO3、K2CO3易溶,Na2CO3微溶,其余难溶〕。 盐的化学性质: (1)盐+金属一另一种盐+另一种金属(置换反应),例如:Fe+CuSO4==FeSO4+Cu
规律:反应物中盐要可溶,金属活动性顺序表中前面的金属可将后面的金属从其盐溶液中置换出来(K, Ca,Na除外)。 应用:判断或验证金属活动性顺序和反应发生的先后顺序。 (2)盐+酸→另一种盐+另一种酸(复分解反应),例如;HCl+AgNO3==AgCl↓ +HNO3。 规律:反应物中的酸在初中阶段一般指盐酸、硫酸、硝酸。盐是碳酸盐时可不溶,若是其他盐,则要求可溶。应用:实验室制取CO2,CO32-、Cl-,SO42-的检验。 (3)盐+碱→另一种盐+另一种碱(复分解反应) 规律:反应物都可溶,若反应物中盐不为按盐,生成物其中之一为沉淀或水。 应用:制取某种碱,例如:Ca(OH)2+Na2CO3== CaCO3↓+2NaOH。 (4)盐+盐→另外两种盐 规律:反应物都可溶,生成物至少有一种不溶于水。 应用:检验某种离子或物质。例如:NaCl+AgNO3 =AgCl↓+NaNO3(可用于鉴定Cl-);Na2SO4+BaCl2==BaSO4↓+2NaCl(可用与鉴定SO42-) ?几种常见盐的性质及用途比较如下表:
2021年一、常见酸碱盐的性质和用途
九年级化学“酸碱盐”相关内容复习提纲一、常见酸碱盐的性质和用途 欧阳光 明 (2021 .03.07 ) 分类 酸:(酸→H++酸根离子)碱:[碱→金属离子(NH4+)+OH-] 盐:[盐→金属离子(NH4+)+酸根离子] 名称(化学式) 氢氯酸 (HCl) 硫酸 (H2SO4) 硝酸 (HNO3) 氢氧化钠 (NaOH) 氢氧化钙 [Ca(OH)2] 氯化钠 (NaCl) 碳酸钠 (Na2CO3) 碳酸氢钠 (NaHCO3) 碳酸钙 (CaCO3) 俗称盐酸烧碱、火碱、苛性 钠 熟石灰、消石灰食盐纯碱、苏打小苏打 性质盐酸是氯化氢气体的 水溶液,“纯净”浓盐 酸:无色、有刺激性气 味、有酸味液体, 具有 挥发性(敞口置于空气 中,瓶口有白雾),有腐 蚀性,工业用盐酸:黄 色(含Fe3+) 纯净浓硫酸:无色 粘稠、油状液体, 具有吸水性(溶 于水放出大量 热),脱水性(强 腐蚀性),强氧化 性 ,不具有挥发 性 与盐酸 的性质 相似,具 有强的 氧化性 白色固体,极易溶于水 (溶解放热),吸水易 潮解—作干燥剂,水溶 液有涩味和滑腻感,具 有强的腐蚀性 白色粉末,微溶于 水固体,有一定的腐 蚀性,水溶液俗称石 灰水 白色固体,易溶于 水,水溶液有咸 味,溶解度受温度 影响不大, 白色粉末状 固体,易溶 于水,水溶液 呈碱性 白色晶体,易溶 于水,水溶液显 碱性,受热易分 解 △ 2NaHCO3==Na2CO3 + H2O+CO2↑ 白色不溶于水的固体, 是大理石、石灰石、蛋 壳、贝壳、白垩、汉白 玉主要成分; 高温分解: 高温 CaCO3===CaO+ CO2↑ 用途①金属除锈 ②制造药物 ③人体中含有少量盐 酸,助消化 ①金属除锈 ②浓硫酸作干燥 剂 ③生产化肥、精 炼石油 化工原 料 制化肥 原料 ①氢氧化钠固体作干燥 剂 ②化工原料:制肥皂、 造纸 ③去除油污:炉具清洁 剂中含氢氧化钠 ①工业:制漂白粉, 制NaOH ②农业:改良酸性 土壤、配波尔多液 ③建筑:石灰浆刷 墙、三合土 (1)作调味品 (2)作防腐剂 (3)融雪剂(降 低雪的熔点) (4)农业上用 NaCl溶液来选种 (5)制生理盐水 用于玻璃、 造纸、纺 织、洗涤、 食品工业等 制火碱 制糕点所用的发 酵粉 医疗上,治疗胃 酸过多 建筑材料 补钙剂 治疗胃酸过多 通性(具有通性的原因:不同酸能解离出相同的H+) (1)与酸碱指示剂的反应:使紫色石蕊试液变红 色,不能使无色酚酞试液变色 (2)金属 + 酸→盐 + 氢气 (3)金属氧化物 + 酸→盐 + 水 (4)碱 + 酸→盐 + 水 (5)盐 + 酸→另一种盐 + 另一种酸 (具有通性的原因:不同碱能解离出相同的 OH-) (1)碱溶液与酸碱指示剂的反应:使紫色 石蕊试液变蓝色,使无色酚酞试液变红色 (2)非金属氧化物+碱→盐+水 (3)酸+碱→盐+水 (4)盐+碱→另一种盐+另一种碱 1、盐(可溶)+ 金属 1 →金属 2 + 新盐(金属1比金属2活泼,K、 Ca、Na除外) 2、盐 + 酸→新盐 + 新酸(满足复分解反应的条件) 3、盐 + 碱→新盐 + 新碱(反应物需都可溶,且满足复分解反应的条 件) 4、盐 + 盐→两种新盐(反应物需都可溶,且满足复分解反应的条件)
水和无机盐的调节习题
水和无机盐的调节习题 一、选择题(每小题有一个或几个答案符合题意要求) 1.正常成年人每天(24h)应该饮入多少毫升水,才能满足正常的生命活动的需要?A.500ml B.1000ml C.1300ml D.2500ml 2.汗液排出的人体代谢废物是() A.尿素和尿酸B.水和无机盐C.CO2和油脂D.油脂和乳酸 3.人体内的无机盐存在的状态,大多为() A.分子B.离子C.络合物D.与蛋白质结合 4.下列说法中,正确的是() A.尿是体内多余的水分B.每天排出的尿量应等于通过饮食的摄入量 C.小肠是摄取水分的唯一器官D.肺是排出水分的一个器官 5.饮食中的Na+经人体而排出的途径有() A.皮肤B.肾脏C.大肠D.肺 6.调节水和无机盐代谢的最高中枢是() A.垂体前叶B.大脑皮层C.下丘脑D.垂体后叶 7.水的下列哪种特性有利于体内的化学反应() A.流动性B.分子极性强C.分子比热大D.有润滑作用 8.下列对排尿的生理意义的叙述中,不正确的是() A.维持体内环境的相对稳定B.排出细胞代谢的终产物 C.维持血浆和组织液的平衡D.调节体内水分和无机盐的含量 9.以下关于水和无机盐平衡及其调节的叙述,正确的是() A.人体内水和无机盐平衡是神经调节和激素调节共同作用的结果 B.人在饮水不足时,抗利尿激素分泌减少,尿的排出量减少 C.K+在维持细胞外液渗透压上起到决定性作用 D.当血钾含量升高时,醛固酮分泌量增加,K+的重吸收增加 10.下列的人体生理过程中,不属于排泄的是() A.二氧化碳和水由呼吸系统排出B.汗液的排出 C.蛋白质代谢终产物的排出D.皮脂腺的分泌 11.人体血浆中蛋白质过少,会出现的症状是() A.脱水B.抽搐C.组织水肿D.贫血 12.下列代谢产物中参与对人体生理功能的调节作用的是() A.水B.尿素C.二氧化碳D.无机盐 13.能使血糖降低的激素来自() A.胰岛A细胞B.胰岛B细胞 C.肾上腺D.脑垂体 14.糖尿病的主要成因是() A.吃糖过多B.吃纤维素多的食物少 C.胰岛A细胞受损D.胰岛B细胞受损 15.糖尿病人的临床表现是() A.吃得多,但日渐消瘦B.喝水多,但口还干渴 C.尿得多,尿有果香味D.尿得多,尿有醇香味 16.糖尿病患者在饮食上应该() A.多吃香蕉少吃糖B.多吃粗粮少吃肥肉 C.多吃蔬菜少吃水果D.多吃甘薯少吃油腻 17.如果某人持续性出现糖尿,能肯定他是糖尿病患者;有的人口味过于清淡,炒菜时放盐极少,长期这样下去,对他的健康不会有什么影响。这两种说法依次是()A.不正确、正确B.不正确、不正确
常见盐的性质和用途
镁离子用氢氧根离子除去,过量的氢氧根离子用稀盐酸除去, 所以添加试剂的顺序可以为,碳酸根离子放到钡离子之后,盐酸放在最后即可。 方案一: (1)滴加过量的氢氧化钠溶液,目的是除去镁离子 (2)滴加过量的氯化钡溶液,目的是除去硫酸根离子 (3)滴加过量的碳酸钠溶液,目的是除去溶液中的钙离子和钡离子 (4)过滤 (5)向滤液中滴加过量的稀盐酸,目的是除去溶液中过量的氢氧根离子和碳酸根离子 (6)蒸发 方案二: (1)滴加过量的氯化钡溶液,目的是除去硫酸根离子 (2)滴加过量的氢氧化钠溶液,目的是除去镁离子 (3)滴加过量的碳酸钠溶液,目的是除去溶液中的钙离子和钡离子 (4)过滤 (5)向滤液中滴加过量的稀盐酸,目的是除去溶液中过量的氢氧根离子和碳酸根离子 (6)蒸发 方案三: (1)滴加过量的氯化钡溶液,目的是除去硫酸根离子 (2)滴加过量的碳酸钠溶液,目的是除去溶液中的钙离子和钡离子 (3)滴加过量的氢氧化钠溶液,目的是除去镁离子 (4)过滤 (5)向滤液中滴加过量的稀盐酸,目的是除去溶液中过量的氢氧根离子和碳酸根离子 (6)蒸发 三、盐的化学性质 1、和金属反应(金属排在盐中金属前面,盐必须溶于水) 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu(铁的表现生成一层红色物质溶液变为浅绿色) 铜和硝酸银溶液反应:Cu + 2A gNO3 === Cu(NO3)2 + 2A g 2、和酸反应 碳酸钠和硫酸反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑ 盐酸和硝酸银溶液反应:HCl + AgNO3=== AgCl↓ + HNO3 3、和碱溶液反应 (1)生成沉淀 氢氧化钙溶液与碳酸钠溶液:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(白色沉淀) 氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4(蓝色沉淀) 氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl(红褐色沉淀) 氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl(白色沉淀) (2)铵盐和碱生成氨气 2NH4Cl+ Ca(OH)2CaCl2 + 2H2O +2NH3↑(有水珠和刺激性气味的气体生成,该气体能使湿润的红色石蕊试纸变蓝)氯化铵和氢氧化钠反应:NaOH+NH4Cl==NaCl+NH3↑+H2O 4、和盐溶液反应(反应物必须溶于水,生成沉淀) (1)氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3 (2)硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl (3)碳酸钠和氯化钙Na2CO3+ C a Cl2= CaCO3↓+2 NaCl
常见酸碱盐知识归纳
酸碱盐知识归纳 一、组成: 1、酸的组成——氢离子+酸根离子 2、碱的组成——金属离子+氢氧根离子 3、盐的组成——金属离子+酸根离子(铵根离子+酸根离子) 4、复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。AB+CD=AD+CB 5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。 6、中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。 二、熟记常见元素和原子团的化合价口诀: (正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。 (负价)负一价:氟、氯、溴、碘;负二价:氧和硫。 (可变正价):一二铜汞,二三铁,二四碳,四六硫。 原子团的化合价: 负一价:氢氧根(OH—),硝酸根(NO3—),氯酸根(ClO3—),高锰酸根(MnO4—); 负二价:硫酸根(SO42—),碳酸根(CO32—),亚硫酸根(SO32—),锰酸根(MnO42—); 负三价:磷酸根(PO43—); 正一价:铵根(NH4+)。 三、熟记下列反应方程式: (一)酸的性质 (1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。 (2)酸+碱=盐+水。 (3)酸+某些金属氧化物=盐+水。 (4)酸+活泼金属=盐+氢气。 (5)酸+盐=新盐+新酸。 1、锌跟稀盐酸反应:Zn + 2HCl = ZnCl2 + H2↑ 有气泡产生, 2、锌跟稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2↑锌粒逐渐减少。 3、铁跟稀盐酸反应:Fe + 2HCl = FeCl2 + H2↑ 有气泡产生,铁逐渐减少 4、铁跟稀硫酸反应:Fe + H2SO4 =FeSO4 + H2↑ 溶液变成浅绿色 5、铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失, 6、铁锈跟稀硫酸反应:Fe2O3+ 3 H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色 7、氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失, 8、氧化铜跟稀硫酸反应:CuO + H2SO4= CuSO4 + H2O 溶液变成蓝色 9、氢氧化铜跟稀盐酸反应:Cu(OH)2 + 2HCl = CuCl2 + 2H2O 蓝色沉淀消失 10、氢氧化铜跟稀硫酸反应:Cu(OH)2 + H2SO4 = CuSO4 + 2H2O 变成蓝色溶液
第4课时无机盐和水对植物生长的作用
第4课时无机盐和水对植物生长的作用 1.(2018·昆明)幼根的生长依靠细胞数量的增加和细胞体积的增大,根尖中能分裂产生新细胞的部位是() A.根冠B.分生区 C.伸长区D.成熟区 2.(2018·广东)下列有关植物参与自然界中水循环的叙述,错误的是() A.通过根吸收水分B.通过筛管运输水分 C.通过气孔散失水分D.蒸腾作用提高大气湿度 3.(2018·乐山)植物从土壤中吸收水分并输送到各个部分,请问吸收水分的部位、运输水分的结构分别是() A.根尖伸长区、导管B.根尖成熟区、导管 C.根尖伸长区、筛管D.根尖成熟区、筛管 4.(2017·衡阳)某生物兴趣小组在校园绿化活动中,移栽树木时采取了以下措施,其中做法与作用不相符的是() A.根部带土坨——保护根毛 B.剪去部分枝叶——降低蒸腾作用 C.为植物打针输液——补充水和无机盐 D.盖遮阳网——减弱光合作用 5.(2018·绍兴、义乌)下列结构对功能的自述,不合理的是()
6.(2018·扬州)下列为某同学观察玉米根尖结构的细胞图,其中最有利于根吸收水分的细胞是() 第6题图 第7题图 ★7.如图为测定蒸腾作用的简易装置,整个装置密封且充满水,管中留有一个气泡,将此装置放于阳光下,观察气泡的移动,根据标尺计算出气泡移动位置,进而计算出水分变化的数量,这一数量主要表示() A.光合作用消耗的水量,气泡向左移动 B.呼吸作用产生的水量,气泡向右移动 C.蒸腾作用散失的水量,气泡向左移动
D.蒸腾作用散失的水量,气泡向右移动 第8题图 ★8.(2017·苏州)如图是探究“溶液浓度大小对植物吸水的影响”实验。取两个大小相同的萝卜,各从其顶端向下挖一个大小一样的洞。在图1中萝卜的洞内装上浓盐水,在图2中萝卜的洞内装上等量的清水。过一段时间后,观察现象,下列有关叙述错误的是() A.图1中萝卜会变软 B.图2中萝卜洞里的水会变多 C.细胞内溶液浓度大于外界溶液浓度时,细胞吸水 D.对栽培作物施肥时,要注意“薄肥勤施” 9.(2017·德阳)生物圈的水循环离不开植物的蒸腾作用。下列关于植物蒸腾作用的叙述错误的是() A.蒸腾作用主要通过叶片表皮的气孔完成 B.炎热的夏天,蒸腾作用能降低叶片表面的温度 C.蒸腾作用可以拉动水分和无机盐由根部运到茎、叶等部位 D.蒸腾作用散失了大量的水分,这对植物的生长是不利的 第10题图 10.(2018·临沂)如图是绿色开花植物的某些生理过程示意图。下列说法错误的是() A.a表示根对水分的吸收,吸收的主要部位是根尖的成熟区 B.b表示水分由导管从低往高运输,动力主要来自蒸腾作用
酸碱盐的性质归纳
武汉市楚才中学2012年中考复习之 酸、碱、盐的性质及化学方程式归纳 一、酸→H++酸根离子 1、浓酸的特性: 浓盐酸:有挥发性,有刺激性气味 浓硫酸:有强烈的腐蚀性,脱水性,吸水性,稀释时放出大量的热 2、稀酸的化学性质: (1)使紫色石蕊变红,无色酚酞不变色 (2)酸+活泼的金属→盐+H2↑ ①实验室制氢气(锌与稀硫酸反应) Zn + H2SO4 == ZnSO4 + H2↑ Zn + 2HCl == ZnCl2 + H2↑ ②铁与稀盐酸的反应 Fe + 2HCl == FeCl2 + H2↑ (实验现象:铁丝逐渐溶解,有无色气泡产生,溶液由无色变成浅绿色) ③铁与稀硫酸的反应 Fe + H2SO4 === FeSO4 + H2 ↑ (实验现象:铁丝逐渐溶解,有无色气泡产生,溶液由无色变成浅绿色) ④镁与稀盐酸的反应Mg + 2HCl === MgCl2 + H2↑ ⑤镁与稀硫酸的反应Mg + H2SO4 ==== MgSO4 +H2 ↑ ⑥铝与稀盐酸的反应2Al + 6HCl === 2AlCl3 + 3H2↑ ⑦铝与稀硫酸的反应2Al + 3H2SO4 ===Al2(SO4)3 +3H2 ↑ (3)酸+金属氧化物-----盐 + 水 ①稀盐酸与氧化铁的反应6HCl+Fe2O3===2FeCl3+3H2O(除锈原理) 实验现象:红棕色固体逐渐溶解,溶液由无色变成黄色 ②稀盐酸与氧化铜的反应2HCl+CuO==CuCl2+H2O 实验现象:黑色固体逐渐溶解,溶液由无色变成蓝色 ③稀硫酸与氧化铁的反应3H2SO4+Fe2O3===Fe2(SO4)3+3H2O(除锈) 实验现象:红棕色固体逐渐溶解,溶液由无色变成黄色 ④稀硫酸与氧化铜的反应H2SO4+CuO==CuSO4+H2O 实验现象:黑色固体逐渐溶解,溶液由无色变成蓝色 ⑤稀盐酸与氧化铝的反应6HCl+Al2O3===2AlCl3+3H2O ⑥稀硫酸与氧化铝的反应3H2SO4+ Al 2O3=== Al 2(SO4)3+3H2O ⑦稀盐酸与氧化钙的反应2HCl+CaO==CaCl2+H2O ⑧稀硫酸与氧化钙的反应H2SO4+CaO==CaSO4+H2O ⑨稀盐酸与氧化镁的反应2HCl+MgO==MgCl2+H2O ⑩稀硫酸与氧化镁的反应H2SO4+MgO==MgSO4+H2O (4)酸 + 碱 -------盐 + ①稀盐酸与氢氧化钠的反应HCl+NaOH===NaCl+H2O ②盐酸与氢氧化钙的反应2HCl+Ca(OH)2===CaCl2+2H2O ③稀硫酸与氢氧化钠的反应H2SO4+2NaOH===Na2SO4+2H2O
中考生物 无机盐和水对植物生长的作用 - 学生
第4课时无机盐和水对植物生长的作用 一、选择题 1.(2017宿迁中考)植物生长发育过程中需要量最大的含有哪些元素的无机盐() A.氮、磷、钾 B.铁、硼、钾 C.钾、钙、镁 D.钠、钾、铁 2.植物体在进行下列生理活动时,受到气孔开闭影响的是() ①光合作用;②呼吸作用;③蒸腾作用;④水分的吸收和运输;⑤无机盐的运输。 A.①②③④ B.①③④⑤ C.②③④⑤ D.①②③④⑤ 3.下列关于植物叶片各部分结构(如图所示)和功能的叙述,错误的是() A.①属于输导组织,具有运输作用 B.②④属于上皮组织,具有保护作用 C.③属于营养组织,能进行光合作用 D.⑤为气孔,是气体交换的“窗口” 4.(2017衡阳中考)某生物兴趣小组在校园绿化活动中,移栽树木时采取了以下措施,其中做法与作用不相符的是() A.根部带土坨——保护根毛 B.剪去部分枝叶——降低蒸腾作用 C.为植物打针输液——补充水和无机盐 D.盖遮阳网——减弱光合作用 5.德化县美湖镇有棵高大的千年樟树,促进水分“爬”上树梢的动力来自() A.光合作用 B.吸收作用 C.蒸腾作用 D.呼吸作用 6.如图所示曲线能正确表示在晴朗的高温天气状态下,绿色植物蒸腾作用强度变化的是() A)B) C)D) 7.(2017宜兴中考)下列有关蒸腾作用的叙述错误的是() A.蒸腾作用可以促进植物根部对水分和有机物的吸收 B.植物进行蒸腾作用可以避免自身被阳光灼伤 C.移栽树苗时去掉一些枝叶可以减弱蒸腾作用 D.蒸腾作用可以提高大气湿度,加快水循环 8.(2017富阳中考模拟)如图所示,天平两端托盘上放置盛有相同清水的密封玻璃瓶,长势相同的两枝条经过 橡皮塞插入水中,右边枝条只留一半数目的叶片,放在阳光下,调节天平至平 衡。一个小时后,其结果是() A.光合作用量不等,天平向左边倾斜 B.呼吸作用量不等,天平向左边倾斜 C.蒸腾作用量不等,天平向右边倾斜 D.两边作用几乎相同,天平依然平衡
几种常见无机盐的缺乏症及食物来源见下表
几种常见维生素的功能、缺乏症及食物来源见下表:
(1)食物来源:谷类、豆类和根茎类等食物中含有较多的糖类。(2)功能:糖类是人体主要的供能物质,人体的一切活动,包括走路、学习、呼吸等都要消耗能量,这衅能量大部分是由糖类提供的。(3)缺乏时的症状:瘦弱、乏力、低血糖。 脂肪 (1)食物来源:猪油、奶油、蛋黄、花生油、芝麻、豆类和硬果类等食物中含有较多的脂肪。 (2)功能:脂肪也是人体能量来源的重要物质,但是脂肪一般是储存在体内作为备用能源 (3)缺乏时的症状:瘦弱。 蛋白质 (1)食物来源:奶、蛋、鱼,瘦肉、豆类制品等。 (2)功能: ①组成细胞的主要有机物,如蛋白质是构成细胞膜、染色体的主要成分。 ②能源物质,蛋白质能分解释放能量,为人体的牛命活动提供能量。 ③人的生长发育以及受损细胞的修复和更新都离不开蛋白质。 (3)缺乏时的症状:长期供应不足可导致营养不良,发生贫血。
(1)来源:食物和饮料。 (2)作用: ①人体细胞的主要成分之一,占体重的60%~70%。 ②人体各种生命活动离不开水,人体内的细胞生活在液体环境中。 ③人体内的营养物质和废物都必须溶解在水中才能进行运输。 无机盐 无机盐在人体内的含量不多,约占体重的4%,是构成人体的重要原料,如钙和磷是构成牙齿和骨骼的重要成分。无机盐还参与人体的各种代谢活动,是人体生长发育等生命活动正常进行的重要保证。 维生素 维生素不是构成细胞的主要原料,不为人体提供能量,人体每日对它们的需要鼙也很小。但是,维生素对人体的重要作用是其他营养物质所不能代替的。人体一旦缺乏维生素,就会影响正常的隹长发育,甚至患病。 很多妈妈都问过小孩皮肤粗糙怎么办这个问题,小孩的皮肤相对而言比较薄嫩,到了秋冬干燥的季节就容易粗糙,同时也有很少的宝宝是天生的皮肤粗糙,那么小孩皮肤粗糙怎么办呢?我们来听听专家是怎么说的吧。 海军总医院皮肤专家指出,宝宝皮肤粗糙问题的产生是因为皮肤缺少所致,一般婴儿体内水分占体重的70%~75%,较成人(60%~65%)高,因其生长发育旺盛,故需水量也多,由于供水不足很有可能会产生宝宝皮肤粗糙问题。水分的需要量与年龄、体重、食物的质与量,代谢高低、体温与肾浓缩功能等因素有关,年龄越小相对需水量越大,因而要解决宝宝皮肤粗糙怎么办的问题,就
元素和化合物水和无机盐知识点总结
一、组成细胞的元素和化合物 1.组成细胞的元素分类 (1)按含量分 大量元素:等 微量元素:等(2)按作用分 最基本元素: 组成人体细胞的主要元素: (按占细胞鲜重的百分比) 2.组成细胞的化合物 1)种类 无机化合物: 有机化合物:、脂质、蛋白质、 (2)含量 ①占细胞鲜重最多的化合物是。 ②占细胞鲜重最多的有机化合物是。 ③占细胞干重最多的化合物是。 三、细胞中的无机物 1.细胞中的水 (1)存在形式:和。 (2)含量变化:生物体的含水量与和生物的 有关。 (3)功能 ①自由水 a.细胞内的 b.参与许多 c.运送和 d.为细胞生存提供
②结合水:是的重要组成成分。 (4)自由水与结合水的联系 自由水结合水 2.细胞中的无机盐 (1)含量:很少,占细胞鲜重的1%~1.5%。 (2)存在形式:绝大多数以的形式存在,少部分是细 胞内的组成成分。 (3)功能:维持细胞和生物体的,维持细胞的 平衡等。 1.种类与含量 (1)上述元素分类是针对生物整体概况的,具体到某种生物 时元素的归属可能不同,如氯元素(Cl)是组成人体的大量元素,但对植物而言却属于微量元素。 (2)大量元素和微量元素都是组成生物体的必需元素。生物体内所含有的元素却不一定都是必需元素。 (3)占人体细胞干重最多的元素是C,占人体细胞鲜重最多的元素是氧,无论鲜重还是干重,C、H、O、N四种元素的含量最多。 2.元素的统一性和差异性 (1)元素种类上的统一性 ①生物界与非生物界在元素种类上具有统一性,构成生物体的化学元素在无机自然界都能找到,没有一种是生物界所特有的。 ②生物界元素都是从无机环境中获取的,如下图:
中考化学-酸碱盐知识点归纳
酸、碱、盐知识点归纳 一、常见的酸和碱 注:盐酸是氯化氢气体溶于水形成的溶液,属于混合物。 (1)浓盐酸的挥发性:盐酸的溶质的质量分数越大,挥发性越强。 雾是小液滴,烟是固体小颗粒,浓盐酸挥发出的氯化氢(HCl)气体与遇空气中的水蒸气形成盐酸小液滴,不是白烟。 (2 (3)浓硫酸的特性:吸水性(物)、腐蚀性(化)、脱水性(化,是腐蚀性的一种) (4)浓硫酸的稀释:将浓硫酸沿器壁慢慢倒入装有水的烧杯中,并不断搅拌。 绝不能把水倒入浓硫酸里。因为浓硫酸密度比水大,而且溶于水放出大量的热,如果把水倒入浓硫酸中,水浮在浓硫酸之上,造成局部沸腾。 (5)其他常见的酸:硝酸(HNO3)、醋酸(CH3COOH) 2.酸的化学性质(酸具有相似的化学性质是因为酸溶液中都含有H+) +
(1)用石灰石、水、纯碱为原料制熟石灰、烧碱: ①石灰石→生石灰:↑+23 CO CaO CaCO 高温 ②生石灰→熟石灰:CaO + H 2O = Ca(OH)2,放出大量的热 ③纯碱→烧碱:Na 2CO 3 + Ca(OH)2 = CaCO 3↓ + 2NaOH (2)其他常见的碱:氢氧化钾(KOH )、氨水(NH 3·H 2O ) 4.碱的化学性质(碱具有相似的化学性质是因为碱溶液中都含有OH -) -注:并不是所有非金属氧化物都能与碱反应,如H 2O 、CO 。
5.浓硫酸、氢氧化钠事故的处理: (1)浓硫酸:立即用大量的水冲洗,并涂上3%~5%的碳酸氢钠溶液; (2)氢氧化钠:用较多的水冲洗,并涂上硼酸溶液。 6.常见的干燥剂: (1)浓硫酸:因能与NH 3反应,所以不能用于干燥NH 3 (2)氢氧化钠固体:因能与CO 2、SO 2等反应,所以不能用于干燥CO 2、SO 2 (3)生石灰:吸收水分,食品的干燥剂,CaO + H 2O = Ca(OH)2 (4)铁粉:吸收氧气、水蒸气,抗氧化剂,食品的保鲜剂 7.氢氧化钠固体为什么要密封保存? (1)氢氧化钠易吸收空气中的水而潮解; (2)氢氧化钠易吸收空气中的二氧化碳而变质,2NaOH + CO 2 = Na 2CO 3 + H 2O 8.中和反应:酸和碱作用生成盐和水的反应。 (1)NaOH + HCl = NaCl + H 2O 该反应无明显现象,为了便于观察,在NaOH 溶液中滴几滴无色酚酞,溶液呈红色,再逐滴滴加稀盐酸,红色逐渐消失,证明NaOH 与盐酸发生了反应。 (2)中和反应关键是“酸和碱之间的反应”。 Fe 2O 3 + 6HCl = 2FeCl 3 + 3H 2O ,CuO + H 2SO 4 = CuSO 4 + H 2O ,2NaOH + CO 2 = Na 2CO 3 + H 2O 以上反应虽然有盐和水生成,但都不是中和反应。 所以说:有盐和水生成的反应不一定是中和反应。 9.酸性氧化物、碱性氧化物: (1)酸性氧化物: (2)碱性氧化物: (3)水: 二、酸碱性和酸碱度 1.酸碱性:酸性、碱性、中性。注意:呈酸性不等于一定是酸、呈碱性不等于一定是碱。如纯碱不是碱,但其水溶液呈碱性,pH>7。 2.酸碱度:溶液酸碱性的强弱程度。用pH 表示,范围:0~14。 (1)pH = 7 时,溶液呈中性;滴入紫色石蕊试液不变色,滴入无色酚酞溶液不变色; (2)pH < 7 时,溶液呈酸性;pH 越小,酸性越强,越接近7,酸性越弱;滴入紫色石蕊试液变红色,滴入无色酚酞溶液不变色; (3)pH > 7 时,溶液呈碱性,pH 越大,碱性越强,越接近7,碱性越弱;滴入紫色石蕊试 酸性氧化物 + 水→酸 碱→盐+水(可溶性碱) 碱性氧化物+ 水→碱(可溶性碱) 酸→盐+水 酸性氧化物→酸 水+ 碱性氧化物→碱(可溶性碱) CuSO 4→CuSO 4·5H 2O
第4课时 无机盐和水对植物生长的作用知识分享
第4课时无机盐和水对植物生长的作用
第4课时无机盐和水对植物生长的作用 1.(2018·昆明)幼根的生长依靠细胞数量的增加和细胞体积的增大,根尖中能分裂产生新细胞的部位是() A.根冠B.分生区 C.伸长区D.成熟区 2.(2018·广东)下列有关植物参与自然界中水循环的叙述,错误的是() A.通过根吸收水分B.通过筛管运输水分 C.通过气孔散失水分D.蒸腾作用提高大气湿度 3.(2018·乐山)植物从土壤中吸收水分并输送到各个部分,请问吸收水分的部位、运输水分的结构分别是() A.根尖伸长区、导管B.根尖成熟区、导管 C.根尖伸长区、筛管D.根尖成熟区、筛管 4.(2017·衡阳)某生物兴趣小组在校园绿化活动中,移栽树木时采取了以下措施,其中做法与作用不相符的是() A.根部带土坨——保护根毛 B.剪去部分枝叶——降低蒸腾作用 C.为植物打针输液——补充水和无机盐 D.盖遮阳网——减弱光合作用 5.(2018·绍兴、义乌)下列结构对功能的自述,不合理的是()
6.(2018·扬州)下列为某同学观察玉米根尖结构的细胞图,其中最有利于根吸收水分的细胞是() 第6题图 第7题图 ★7.如图为测定蒸腾作用的简易装置,整个装置密封且充满水,管中留有一个气泡,将此装置放于阳光下,观察气泡的移动,根据标尺计算出气泡移动位置,进而计算出水分变化的数量,这一数量主要表示() A.光合作用消耗的水量,气泡向左移动 B.呼吸作用产生的水量,气泡向右移动 C.蒸腾作用散失的水量,气泡向左移动
D.蒸腾作用散失的水量,气泡向右移动 第8题图 ★8.(2017·苏州)如图是探究“溶液浓度大小对植物吸水的影响”实验。取两个大小相同的萝卜,各从其顶端向下挖一个大小一样的洞。在图1中萝卜的洞内装上浓盐水,在图2中萝卜的洞内装上等量的清水。过一段时间后,观察现象,下列有关叙述错误的是() A.图1中萝卜会变软 B.图2中萝卜洞里的水会变多 C.细胞内溶液浓度大于外界溶液浓度时,细胞吸水 D.对栽培作物施肥时,要注意“薄肥勤施” 9.(2017·德阳)生物圈的水循环离不开植物的蒸腾作用。下列关于植物蒸腾作用的叙述错误的是() A.蒸腾作用主要通过叶片表皮的气孔完成 B.炎热的夏天,蒸腾作用能降低叶片表面的温度 C.蒸腾作用可以拉动水分和无机盐由根部运到茎、叶等部位 D.蒸腾作用散失了大量的水分,这对植物的生长是不利的 第10题图 10.(2018·临沂)如图是绿色开花植物的某些生理过程示意图。下列说法错误的是() A.a表示根对水分的吸收,吸收的主要部位是根尖的成熟区 B.b表示水分由导管从低往高运输,动力主要来自蒸腾作用
初三化学专题复习五 常见盐的主要性质和用途
初三化学专题复习五常见盐的主要性质和用途班级:姓名: 二、盐的化学性质 1. 盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,金属不是钾、钙、钠)化学方程式举例: 2. 盐+ 酸→ 新盐+ 新酸 化学方程式举例: 3. 盐+ 碱→ 新盐+ 新碱(反应物需都可溶,且满足复分解反应的条件) 化学方程式举例: 4.盐+ 盐→ 两种新盐(反应物需都可溶,且满足复分解反应的条件) 化学方程式举例: 三、酸碱盐的溶解性: (1)不溶于水,也不溶于酸的沉淀: 不溶于水,但能溶于酸的沉淀:(不溶性碳酸盐) (不溶性碱) 有色沉淀: (红褐色)(蓝色) (2)酸碱盐溶解性顺口溜
钾钠铵盐均可溶,硝酸盐遇水影无踪, 盐酸盐除氯化银,硫酸盐除硫酸钡, 碳酸盐类多不溶,磷酸盐类亦相同 四、离子共存问题: 共存的离子:H+: OH- : (部分金属离子) Ba2+ : Ag+ : Ca2+ : 五、化肥 1.氮肥 作用:促进植物促进植物茎、叶生长茂盛、叶色浓绿(促苗)。缺氮的表现:叶黄) 常用氮肥 铵根离子的检验 方法一:取样,加水溶解,加入氢氧化钠溶液,如果闻到刺激性氨味,说明有铵根离子:NH4NO3+NaOH=NaNO3+NH3↑+H2O 如果现象不明显,可以加大反应物的浓度,或者加热。 方法二:取样,加熟石灰研磨,如果闻到刺激性氨味,说明有铵根离子:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O 2.钾肥 作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆)。(缺钾的表现:叶尖发黄) 常用钾肥:氯化钾、硫酸钾、草木灰(主要成分是) 3.磷肥 作用:促进植物根系发达,穗粒增多,饱满(催果)。(缺磷:生长迟缓,产量降低,根系不发达) 常用磷肥:磷矿粉(磷酸钙)、钙镁磷肥、过磷酸钙(磷酸二氢钙和硫酸钙的混合物) 过磷酸钙不能与碱性物质混合施用,如草木灰、熟石灰等。 磷酸根的化合价是-3,其中磷元素的化合价是+5。
酸碱盐化学性质总结教学内容
酸碱盐化学性质总结 一、 酸的化学性质 (1) 酸跟酸碱指示剂作用 酸使紫色石蕊试液变红,使无色酚酞试液不变色。 (2) 金属+酸→盐+氢气 (在金属活动表中排在氢前面的金属) ↑+=+2442H ZnSO SO H Zn ↑+=+222H FeCl HCl Fe ↑+=+2342423)(32H SO Al SO H Al ↑+=+222H MgCl HCl Mg (3) 金属氧化物+酸→盐+水 O H FeCl HCl O Fe 2332326+=+ O H SO Fe SO H O Fe 234242323)(3+=+ O H CaCl HCl CaO 222+=+ O H CuSO SO H CuO 2442+=+ (4) 碱+酸→盐+水 O H SO Na SO H NaOH 2424222+=+ O H CaSO SO H OH Ca 244222)(+=+ O H AlCl HCl OH Al 23333)(+=+ O H MgCl HCl OH Mg 22222)(+=+ (5)盐+酸→新盐+新酸 ↑ ++=+22232CO O H CaCl HCl CaCO ↑++=+22424232CO O H SO Na SO H CO Na HCl BaSO SO H BaCl 24422+↓=+ ↑++=+223CO O H NaCl HCl NaHCO 33HNO AgCl HCl AgNO +↓=+ 二、 碱的化学的性质 (1) 碱溶液跟酸碱指示剂作用 参加反应的碱必须可溶或微溶。 碱溶液使紫色石蕊试液变蓝,使无色酚酞试液变红。 (2) 非金属氧化物+碱(溶液)→盐+水 (碱必须是可溶或微溶性的碱) O H CaCO OH Ca CO 2322)(+↓=+ O H CO Na NaOH CO 23222+=+ O H SO Na NaOH SO 23222+=+ O H SO Na NaOH SO 24232+=+ (3) 酸+碱→盐+水 O H NaCl HCl NaOH 2+=+ (4) 盐+碱→新盐+新碱