限制性内切酶分析法在柯萨奇B组病毒检测及分型中的应用_孙非

基金项目:国家自然科学基金资助项目(3987172)
作者单位:130021长春,吉林大学再生医学科学研究所病毒研究室(孙非、肖兰、刘志屹、张淑芹、刘建伟);澳大利亚联邦科学院黑山研究所(李忠谊);东北师范大学生命科学院(许守民)#基础实验诊断研究#
限制性内切酶分析法在柯萨奇B组病毒
检测及分型中的应用
孙非肖兰刘志屹张淑芹刘建伟李忠谊许守民
=摘要>目的探讨限制性内切酶分析法在柯萨奇B组病毒B1~B6型检测及分型中的应用。方法利用GCG软件对柯萨奇B1~B6型病毒cDNA全序列进行了限制性内切酶酶切位点的分析。结果共114种限制性内切酶在柯萨奇B1~B6型病毒cDNA中分布有不同数量的酶切位点。经过比较和分析,得到了它们的一个共同cDN A片段,在这个cDNA片段中,B1~B6型病毒各自具有特异性的核苷酸序列(特异的限制性内切酶位点),对柯萨奇B组病毒6个已知型别标准毒株进行了成功的分型和检测。结论本方法有效地解决了在柯萨奇B组病毒检定以往方法中所存在的非特异性问题,可以对柯萨奇B组病毒进行准确的检定和型别鉴定。
=关键词>柯萨奇病毒B组;寡核苷酸序列分析;限制酶图谱法
A new method to detect and subtype coxsackie
B group virus-restriction enzyme analysis method
*S UN Fei,X IA O Lan,LI U Zhi-yi,ZH A N G Shu-qin,LI U Jian-w ei,LI Zhong-y i,X U S hou-min1 Dep art ment of Virology,I nstitute of Fr ontier M edical Science of Jilin Univer sity,Changchun130021, China
=Abstract>Objective T o establish a new method to detect and subtype Cox sackie B group vir us quickly and accurately1M ethod Analyze the restr iction enzyme digestion websites in the complete cDNA sequences of Coxsackie B gr oup vir us with the GCG software1Result114kinds of restriction enzymes have different incisive w ebsites in cDNA of Coxsackie B g roup virus,after comparison and analysis;we find a same cDN A sequence,in w hich6types of Coxsackie B g roup virus hav e special sequences respectively (special restr ictio n enzyme incisive websites)1T herefore,we can detect and subty pe the6types of coxsackie B group virus successfully1C onclusion T his method resolv es the problem o f high specificit y in detecting Cox sackie B g roup virus by traditional ways1It can identify and subty pe Coxsackie B group vir us accurately1
=Key words>Cox sackie Virus B;Oligonucleotide Array Sequence Analysis;Restriction Enzy me M apping
柯萨奇B组病毒(Coxsackie B g roup virus, CBV)是危害人类健康的重要病原体之一[1]。对其检测所采用的ELISA、分子杂交和RT-PCR技术都有各自的优点,但它们共同缺陷是较高的非特异性结果,至今还没有一种检测方法既能对柯萨奇B 组病毒进行检定,又能对其病毒型别进行准确的鉴别。我们通过大量的实验,建立了限制性内切酶分析检测法。该方法根据柯萨奇B组6个型别病毒cDNA相同核苷酸片段中存在有各自特异的限制性内切酶位点这一特性,成功的对柯萨奇B组病毒6个已知型别的标准毒株进行了检测和分型。
材料和方法
11实验材料:人羊膜细胞(本室保存);柯萨奇B组病毒B1~B6型标准株(本室保存)。
21主要试剂和仪器:Trizol裂解液、SUPERSCRIPT TMòRT,均购于美国GIBCO/ BRL公司;TagDNA聚合酶,购于美国HOT STARTAG QIAGEN公司;NEBuffer2、限制性内切酶,均购于美国NEW ENGLAND Biolabs有限公司;NCPCO二氧化碳培养箱购于美国医疗仪器公司;冷冻高速离心机购于德国SIGMA公司;PCR
仪购于日本AST ZC 公司。
31分析软件:美国Accelrys Inc 1利用美国Auelrys Inc 公司的GCG 软件进行分析。
41共同cDNA 片段引物的设计:上游引物B5P2:5c CGGTACCTTT GTGCGCCTGTT TT3c ,下游引物B3P :5c -TC AA TTGTC AC C A TAAGC AGC C A-3c 这对引物用于扩增柯萨奇B1~B6型病毒第64~610位核苷酸,扩增产物为547bp 。
5.Trizol 法提取柯萨奇B 组B1~B6型病毒的RNA:按T rizol 试剂说明书的操作步骤进行常规RNA 提取。
61B1~B6型共同cDNA 片段的逆转录和扩增:RT -PCR 和PCR 按常规方法进行[2]。
7.B1~B6型病毒共同cDNA 序列样品的制备、纯化和测序:测序分析按文献进行正体[3]。
81限制性内切酶对柯萨奇B1~B6型病毒共同cDNA 片段进行酶切消化:分别应用Sca ?、Sph ?、Nco ?、Hind ó和Pst1对CBV 的6个型别进行酶切消化,酶消化缓冲液均采用NEBuffer 2,总体积20L l,36e 过夜,第2天进行琼脂糖凝胶电泳分析。
结
果
1.cDNA 共同序列的分析和确定:通过GCG 软件分析和比较,我们得到了柯萨奇B1~B6型病毒的一段相同位置和长度的cDNA 片段,在这个cDNA 片段中,B1~B6型病毒各自具有特异性的核苷酸序列(特异性限制性内切酶位点,见图1)
。
图1 柯萨奇B 组病毒1~6型同一位置cDNA 序列中 限制性内切酶位点的差别
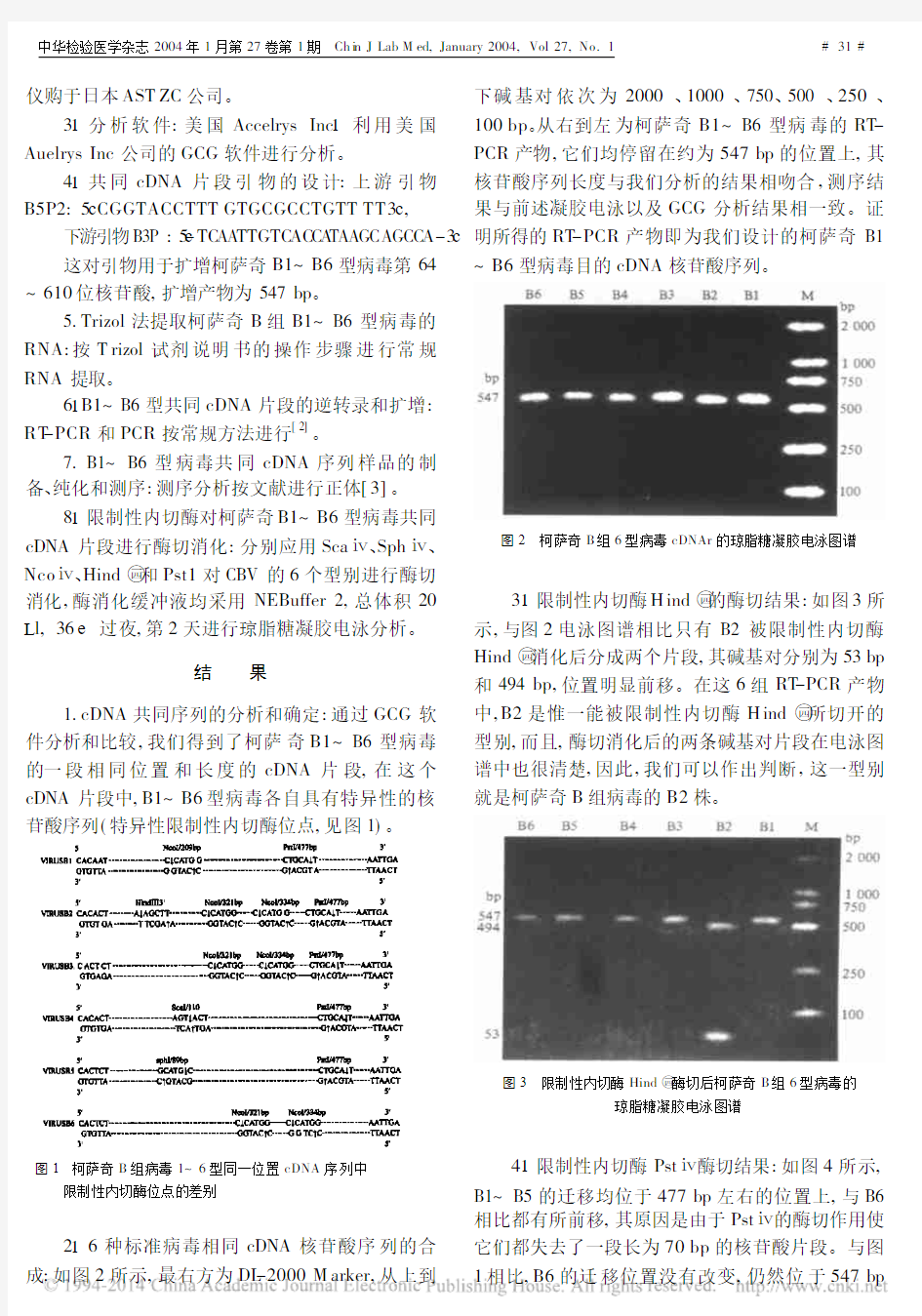
216种标准病毒相同cDNA 核苷酸序列的合
成:如图2所示,最右方为DL -2000M arker,从上到
下碱基对依次为2000、1000、750、500、250、100bp 。从右到左为柯萨奇B1~B6型病毒的RT -PCR 产物,它们均停留在约为547bp 的位置上,其核苷酸序列长度与我们分析的结果相吻合,测序结果与前述凝胶电泳以及GCG 分析结果相一致。证明所得的RT -PCR 产物即为我们设计的柯萨奇B1
~B6型病毒目的cDNA 核苷酸序列。
图2 柯萨奇B 组6型病毒cDNAr 的琼脂糖凝胶电泳图谱
31限制性内切酶H ind ó的酶切结果:如图3所示,与图2电泳图谱相比只有B2被限制性内切酶
Hind ó消化后分成两个片段,其碱基对分别为53bp 和494bp,位置明显前移。在这6组RT -PCR 产物中,B2是惟一能被限制性内切酶H ind ó所切开的型别,而且,酶切消化后的两条碱基对片段在电泳图谱中也很清楚,因此,我们可以作出判断,这一型别就是柯萨奇B 组病毒的B2株。
图3 限制性内切酶Hind ó酶切后柯萨奇B 组6型病毒的
琼脂糖凝胶电泳图谱
41限制性内切酶Pst ?酶切结果:如图4所示,B1~B5的迁移均位于477bp 左右的位置上,与B6相比都有所前移,其原因是由于Pst ?的酶切作用使它们都失去了一段长为70bp 的核苷酸片段。与图1相比,B6的迁移位置没有改变,仍然位于547bp
左右的位置,以上实验表明:B1~B5都具有限制性内切酶Pst ?的酶切位点,而B6
没有。
图4 限制性内切酶Pat1酶切后柯萨B 组6型病毒的琼脂 糖凝胶电泳图谱
51限制性内切酶Nco ?的酶切结果:如图5所示,加样的排序从右到左依次为Marker 、B1、B2、B3、B4、B5、B6。B1经过酶切后分成209bp 和338bp 的两条片段;B2、B3和B6都形成了321bp 、213bp 和13bp 的3条片段;B4、B5的迁移位置则停留在547bp 左右。与图2对比,B1很容易被分离开来,B2、B3和B6尽管对NcoI 都有相同位置的位点,但B3仅有PstI 位点而不存在Hind ó位点,所以也很容易将B3鉴别,而B4和B5位置未改变。由此可见,Nco ?在准确鉴别B1和B3的同时,还可以将B4和B5从B1~B6型病毒中区分开来。
61限制性内切酶Sca ?和Sph ?的酶切结果:图6从左到右的加样排序依次为Sca ?酶切的B4、B5、Marker 、Sph ?酶切的B4和B5,和图2相比,Sca ?酶切后,B4位置向前迁移,形成437bp 和110bp 的两条片段,B5位置未变;而Sph ?酶切后,B5位置向前迁移,形成458bp 和89bp 的两条片段,B4的迁移位置未改变。由此可见,Sca ?可切开B4,但不能切开B5;Sph ?可切开B5,不能切开B4。Sca ?和Sph ?可以分别对B4和B5做出准确的鉴别。
71对病毒进行分型:Hind ó,Pst ?,Nco1,Sca ?和Sph ?在NEBuffer2中均可以表现出高于75%
的
图5 限制性内切酶Nco1酶切后柯萨B 组6型病毒
的琼脂糖凝胶电泳图谱
图6 限制性内切酶S ca ?和Sph ?酶切后柯萨奇 B4B5病毒的琼脂糖凝胶
检测溶液,然后将被检测样品酶切后产物的电泳图谱和我们的标准图谱(标准图谱见图7)。进行对比,就可以快速准确地对柯萨奇B 组6个型别的病毒进行检测和分型。我们应用该检测方法已经成功的对长春地区春季流行的柯萨奇B 组病毒丘疹样皮肤疾患与麻疹皮肤丘疹进行了区分(另文发)。
讨
论
我们建立了一种新型柯萨奇B 组病毒限制性活性,所以我们选择了使这5种酶活性均保持在较
注:100bp以下的片段为空心,100bp以上的片段为实
心,在实际操作中可以忽略100bp以下的片段
图7柯萨奇B组1-6型病毒的标准酶切鉴别图谱
高水平的NEBuffer2作为共同缓冲液,制备了混合内切酶分析法,它的主要原理就在于不同型别的病毒尽管它们的基因组组内同源性为80%[4],但在它们全序列cDNA中,限制性内切酶位点的种类、同一种类内切酶的分布位置及数量都存在着一定差异;利用GCG核酸软件分析系统,我们可以确定具有限制性内切酶位点差异的同一段cDNA序列,并应用专一性的限制性内切酶来完成这一检定过程。我们通过上述的大量实验和多次重复性实验完成并证明了该检测方法的可信性。
与传统的柯萨奇B组病毒的检测方法相比,本方法可以对极微量的标本进行检测,它避免了柯萨奇B组病毒RNA在提取中极易被酶消化的问题,也克服了临床上所采用的ELISA、分子杂交和RT-PCR技术易出现的非特异性缺点。其次,限制性内切酶分析法利用了限制性内切酶位点在核苷酸序列中具有分布差异这一特征,选定了5种限制性内切酶作为对柯萨奇B1~B6型病毒进行鉴定和分型的工具。利用它,我们就可以快速而准确地对柯萨奇B1~B6型病毒进行鉴定和分型。
由于限制性内切酶分析法具有极高的特异性和灵敏性,而且,限制性内切酶在酶切过程中具有很好的稳定性和特异性,因此,该检测方法具有灵敏性高,特异性好的两大优点。另外,由于病毒核酸一旦发生碱基缺失、增加或其他碱基的变化,均会使原核酸序列中限制性内切酶位点的种类及位置也发生相应变化,因此该检测方法还可以用来对柯萨奇B组病毒特定位点的基因突变进行检定。该检测方法的优点是其他任何传统临床检测方法所不能比拟的,尤其是对一些由柯萨奇B组病毒所致的特殊疾病的临床检测,如皮肤病、克山病和病毒性心肌炎等更为重要。所以该方法不仅为柯萨奇B组病毒疾病的病毒学,分子生物学和免疫学等基础医学研究奠定了坚实的理论和实践基础,同时也为临床疾病的准确诊断提供了重要手段。
参考文献
1杜平.主编.现代临床病毒学.北京:人民军医出版社.1991, 445.
2Valassina M,Valentini M,Valensi n PE,et al.Fast duplex one-step RT-PCR for rapid differential diagnosis of entero-or toscana virus m eningi tis.Diagn M icrobiol Infect Dis,2002,43:201-205.
3Vivier JC,Clay CG,Grabow w o,et al.Detection and rapid differenti ation of human enterviruses in w ater s ources by restriction enzyme analysis.W ater S ci T echnol,2001,43:209-212.
4Kl ump W M,Bergmann I,M uller BC,et https://www.360docs.net/doc/fe13075246.html,plete nucleotide s equence of i n fectious Coxsackievirus B3cDNA:tw o initial5.
uridine residues are regained during plus-strand RNA synthesis.J Virol,1990,64:1573-1583.
(收稿日期:2003-05-16)
(本文编辑:唐栋)
#消息#
2004年5中华检验医学杂志6直接订阅优惠办法
中华医学会杂志社出版发行部常年办理本刊零售/批发业务。读者直接订阅全年杂志可享受优惠价。2004年本刊单价12100元,年价144100元,优惠价129160元,含邮寄费。如需挂号,每册加收2100元。汇款单上务请注明所购刊名、年份、刊期、册数。
汇款地址:北京东四邮局58信箱;邮政编码:100010;收款人:出版发行部。
本刊编辑部
常用限制性内切酶酶切位点汇总
Acc65I识别位点AccI识别位点AciI识别位点AclI识别位点AcuI识别位点 AfeI识别位点AflII识别位点AflIII识别位点AgeI识别位点AhdI识别位点AleI识别位点AluI识别位点AlwI识别位点AlwNI识别位点ApaI识别位点ApaLI识别位点ApeKI识别位点ApoI识别位点AscI识别位点AseI识别位点AsiSI识别位点AvaI识别位点AvaII识别位点AvrII识别位点BaeI识别位点BamHI识别位点BanI识别位点BanII识别位点
BbvCI识别位点BbvI识别位点 BccI识别位点BceAI识别位点BcgI识别位点 BciVI识别位点 BclI识别位点 BfaI识别位点 BfuAI识别位点 BglI识别位点 BglII识别位点 BlpI识别位点 Bme1580I识别位点BmgBI识别位点BmrI识别位点BmtI识别位点BpmI识别位点Bpu10I识别位点BpuEI识别位点BsaAI识别位点BsaBI识别位点BsaHI识别位点BsaI识别位点BsaJI识别位点BsaWI识别位点BsaXI识别位点BseRI识别位点BseYI识别位点
BsiEI 识别位点BsiHKAI 识别位点BsiWI识别位点BslI 识别位点BsmAI识别位点 BsmBI识别位点BsmFI识别位点BsmI识别位点BsoBI识别位点Bsp1286I识别位点BspCNI识别位点BspDI识别位点BspEI识别位点BspHI识别位点BspMI识别位点BspQI识别位点BsrBI识别位点BsrDI识别位点BsrFI识别位点BsrGI识别位点BsrI识别位点BssHII识别位点BssKI识别位点BssSI识别位点BstAPI识别位点BstBI识别位点BstEII识别位点BstNI识别位点
限制性内切酶
限制性核酸内切酶是一类能够识别双链DNA分子中的某种特定核苷酸序列(一般4-8bp),并在此处切割DNA双链的核酸内切酶。主要存在于原核生物,是原核生物自我保护的一种机制。它的作用包含两类,一种是对外的,限制作用,指一定类型的细菌可以通过限制性核酸内切酶的作用,破坏入侵的外源DNA,使得外源DNA对生物细胞的入侵受到限制。另一种是对内的,修饰作用,指在特定位置发生甲基化,可免遭自身限制性酶的破坏。 限制性核酸内切酶的发现是在本世纪中期,Arber等人对λ噬菌体在大肠杆菌不同菌株上的平板培养效应的研究为基础,发现了原核生物体内存在着寄主控制的限制和修饰系统。实验是:在K株或B株大肠杆菌上生长繁殖的噬菌体λ(K)或λ(B),再次感染原寄主菌体的成斑率为1,而感染新的寄主菌株的成斑率则分别为10-4和4*10-4所以说受到了限制。在 20 世纪 60 年代,噬菌体学家阐明了宿主限制和修饰现象的生化机制。该研究工作在 Me-selson 和 Yuan(1968)纯化得到了大肠杆菌 K12 的限制性内切酶时达到高峰。因为这个内切酶可以把未修饰的 DNA 切割成大的分离片段,人们认为它一定识别一个靶序列。从而提供了对 DNA 进行可控操作的前景。但不幸的是,K12 内切酶不具备人们希望的性质。虽然它确实是结合到一定的区域序列上,切割却在几千个碱基对以外“随机”发生的(Yuan 等,1980)。经过大量努力后,终于在1970 年取得了突破,人们发现了在流感嗜血杆菌(Haemophilusinfluenzae)中存在一种酶,其作用更加简单(Kelly & Smith,1970;Smith & W ilcox,1970),即这个酶可以识别双链 DNA 分子中的一个特定靶序列,并在该序列之内切断多聚核苷酸链,从而产生长度和序列一定的分离片段。突破性的进展始于 Hamilton Smith 的发现,他从嗜血流感细菌(Haemophilus influenzae)菌株 Rd中找到了一种限制性内切酶(Smith & Wilcox,1970),并阐明了它在噬菌体 T7 DNA 中切割的核苷酸序列(Kelly & Smith,1970)。这个酶现在命名为 Hind Ⅱ。嗜血流感细菌还具有另一个Ⅱ型的限制酶 Hind Ⅲ,而且含量很大。幸运的是,Hind Ⅲ不切割T7 DNA,因此 Hind Ⅱ制剂中可能混有的 Hind Ⅲ将不产生任何问题(Old 等,1975)。在发现 HindⅡ后不久,又分离到其他几个Ⅱ型的限制性内切酶,并分析了它们的性质,EcoRⅠ是其中最重要的一个(Hedgepeth 等,1972)。它们随即迅速用于最初的重组 DNA 实验中。
限制性核酸内切酶
限制性核酸内切酶 限制性核酸内切酶( restriction endonucleases ),简称限制酶,是一类能识别和切割双链 DNA 分子中的某些特定核苷酸序列的核酸水解酶,主要从细菌中分离得到。根据结构和功能特性,把限制酶分为Ⅰ、Ⅱ和Ⅲ型。Ⅰ型限制酶的切点不固定,很难形成稳定的、特异性切割末端;Ⅲ型限制酶对 DNA 链的识别序列是非对称的,不产生特异性的 DNA 片段,故基因工程实验中基本不用Ⅰ型和Ⅲ型限制酶。 Ⅱ型限制酶的主要作用是切割 DNA 分子,在 DNA 重组、构建新质粒、建立 DNA 的限制性酶切图谱、 DNA 的分子杂交、制备 DNA 的放射性探针、构建基因文库等方面起到重要作用,是基因工程重要的工具酶。 Ⅱ型限制性核酸内切酶的特点是:一般能识别和切割 4~8 个碱基对的核苷酸序列;大多数识别序列具有回文结构。 Ⅱ型限制性核酸内切酶的切割方式有三种:切割产生 5 ' 突出的粘性末端( sticky ends );切割产生 3 ' 突出的粘性末端;切割产生平头末端( blunt ends )。 Ⅰ型限制性内切酶既能催化宿主DNA的甲基化,又催化非甲基化的DNA的水解;而Ⅱ型限制性内切酶只催化非甲基化的DNA的水解。III型限制性内切酶同时具有修饰及认知切割的作用根据酶的功能特性、大小及反应时所需的辅助因子,限制性内切酶可分为两大类,即I类酶和Ⅱ酶。最早从大肠杆菌中发现的EcoK、EcoB就属于I类酶。反应过程中除需Mg2+外,还需要S-腺苷-L甲硫氨酸、ATP;在DNA分子上没有特异性的酶解片断,这是I、Ⅱ类酶之间最明显的差异。因此,I类酶作为DNA的分析工具价值不大。Ⅱ类酶有EcoR I、BamH I、Hind Ⅱ、Hind Ⅲ等。反应只需Mg2+;最重要的是在所识别的特定碱基顺序上有特异性的切点,因而DNA分子经过Ⅱ类酶作用后,可产生特异性的酶解片断,这些片断可用凝胶电泳法进行分离、鉴别。 限制酶一般不切割自身的DNA分子,只切割外源DNA。 每种限制酶特异识别专一DNA序列,并在切割位点将其准确切割。 限制酶是基因工程用来切割目的基因的酶,DNA复制不需要。 DNA复制需要的是解旋酶和DNA聚合酶。 根据限制酶的结构,辅因子的需求切位与作用方式,可将限制酶分为三种类型 第一型限制酶:同时具有修饰(modification)及认知切割(restriction)的作用;另有认知(recognize)DNA上特定碱基序列的能力,通常其切割位(cleavage site)距离认知位(recognition site)可达数千个碱基之远。例如:EcoB、EcoK。 第二型限制酶:只具有认知切割的作用,修饰作用由其他酵素进行。所认知的位置多为短的回文序列(palindrome sequence);所剪切的碱基序列通常即为所认知的序列。是遗传工程上,实用性较高的限制酶种类。例如:EcoRI、HindⅢ。 第三型限制酶:与第一型限制酶类似,同时具有修饰及认知切割的作用。可认知短的不对称序列,切割位与认知序列约距24-26个碱基对。例如:EcoPI、HinfⅢ。 甲基化(DNA methylation) DNA甲基化是最早发现的修饰途径之一,大量研究表明,DNA甲基化能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。
限制性内切酶酶切位点汇总
Acc65I识别位点 AccI识别位点 AciI识别位点 AclI识别位点 AcuI识别位点 AfeI识别位点 AflII识别位点 AflIII识别位点 AgeI识别位点 AhdI识别位点 AleI识别位点 AluI识别位点 AlwI识别位点 AlwNI识别位点 ApaI识别位点 ApaLI识别位点 ApeKI识别位点 ApoI识别位点 AscI识别位点 AseI识别位点 AsiSI识别位点 AvaI识别位点 AvaII识别位点 AvrII识别位点 BaeI识别位点 BamHI识别位点 BanI识别位点 BanII识别位点
BbvCI识别位点 BbvI识别位点 BccI识别位点 BceAI识别位点 BcgI识别位点 BciVI识别位点 BclI识别位点 BfaI识别位点 BfuAI识别位点 BglI识别位点 BglII识别位点 BlpI识别位点 Bme1580I识别位点 BmgBI识别位点 BmrI识别位点 BmtI识别位点 BpmI识别位点 Bpu10I识别位点 BpuEI识别位点 BsaAI识别位点 BsaBI识别位点 BsaHI识别位点 BsaI识别位点 BsaJI识别位点 BsaWI识别位点 BsaXI识别位点 BseRI识别位点 BseYI识别位点
BsiEI识别位点 BsiHKAI识别位点 BsiWI识别位点 BslI识别位点 BsmAI识别位点 BsmBI识别位点 BsmFI识别位点 BsmI识别位点 BsoBI识别位点 Bsp1286I识别位点 BspCNI识别位点BspDI识别位点 BspEI识别位点 BspHI识别位点 BspMI识别位点 BspQI识别位点 BsrBI识别位点 BsrDI识别位点 BsrFI识别位点 BsrGI识别位点 BsrI识别位点 BssHII识别位点 BssKI识别位点 BssSI识别位点 BstAPI识别位点 BstBI识别位点 BstEII识别位点 BstNI识别位点
常用限制性内切酶酶切位点保护残基
酶切位点保护碱基-PCR引物设计用于限制性内切酶 发布: 2010-05-24 20:19| 来源:生物吧| 编辑:刘浩| 查看: 161 次 本文给出了分子克隆中常用限制性内切酶的保护碱基序列,如AccI,AflIII,AscI,AvaI,BamHI,BglII,BssHII,BstEII,BstXI,ClaI,EcoRI,HaeIII,HindIII,KpnI,MluI,NcoI,NdeI,NheI,NotI,NsiI,PacI,PmeI,PstI,PvuI,SacI,SacII,SalI,ScaI,SmaI,SpeI,SphI,StuI,XbaI,XhoI,XmaI, 为什么要添加保护碱基? 在分子克隆实验中,有时我们会在待扩增的目的基因片段两端加上特定的酶切位点,用于后续的酶切和连接反应。由于直接暴露在末端的酶切位点不容易直接被限制性核酸内切酶切开,因此在设计PCR引物时,人为的在酶切位点序列的5‘端外侧添加额外的碱基序列,即保护碱基,用来提高将来酶切时的活性。 其次,在分子克隆实验中选择载体的酶切位点时,相临的两个酶切位点往往不能同时使用,因为一个位点切割后留下的碱基过少以至于影响旁边的酶切位点切割。 该如何添加保护碱基? 添加保护碱基时,最关心的应该是保护碱基的数目,而不是种类。什么样的酶切位点,添加几个保护碱基,是有数据可以参考的。 添加什么保护碱基,如果严格点,是根据两条引物的Tm值和各引物的碱基分布及GC含量。如果某条引物Tm值偏小,GC%较低,添加时多加G或C,反之亦反。 为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列含识别序列的短双链寡核苷酸作为酶切底物进行实验。实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。 实验方法:用γ-[32P]ATP在T4多聚核苷酸激酶的作用下标记0.1A260单位的寡核苷酸。取1μg已标记了的寡核苷酸与20单位的内切酶,在20°C条件下分别反应2小时和20小时。反应缓冲液含70mM Tris-HCl (pH 7.6), 10 mM MgCl2, 5 mMDTT及适量的NaCl或KCl(视酶的具体要求而定)。20%的PAGE(7M尿素)凝胶电泳分析,经放射自显影确定酶切百分率。 本实验采用自连接的寡核苷酸作为对照。若底物有较长的回文结构,切割效率则可能因为出现发夹结构而降低。
常用限制性内切酶酶切位点
AatII 识别位点 Acc65I 识别位点 AccI 识别位点 AciI 识别位点 AclI 识别位点 AcuI 识别位点 AfeI 识别位点 AflII 识别位点 AflIII 识别位点 AgeI 识别位点 AhdI 识别位点 AleI 识别位点 AluI 识别位点 AlwI 识别位点 AlwNI 识别位点 ApaI 识别位点 ApaLI 识别位点 ApeKI 识别位点 ApoI 识别位点 AscI 识别位点 AseI 识别位点 AsiSI 识别位点
AvaI识别位点 AvaII识别位点 AvrII识别位点 BaeI识别位点 BamHI 识别位点 BanI识别位点 BanII识别位点 BbsI识别位点 BbvCI识别位点 BbvI识别位点 BccI识别位点 BceAI识别位点BcgI识别位点BciVI识别位点BclI识别位点 BfaI识别位点BfuAI识别位点BglI识别位点BglII识别位点BlpI识别位点Bme1580I识别位点BmgBI识别位点BmrI识别位点
BmtI 识别位点 BpmI 识别位点 Bpu10I 识别位点 BpuEI 识别位点 BsaAI 识别位点 BsaBI 识别位点 BsaHI 识别位点 BsaI 识别位点 BsaJI 识别位点 BsaWI 识别位点 BsaXI 识别位点 BseRI 识别位点 BseYI 识别位点 BsgI 识别位点 BsiEI 识别位点 BsiHKAI 识别位点 BsiWI 识别位点 BslI 识别位点 BsmAI 识别位点 BsmBI 识别位点 BsmFI 识别位点 BsmI 识别位点
限制性核酸内切酶与核酸内切酶、外切酶
限制性核酸内切酶百科名片
其3′→5′外切酶活性使双链DNA分子产生出单链区,经过这种修饰的DNA 再配合使用Klenow酶,同时加进带放射性同位素的核苷酸,便可以制备特异性的放射性探针。 核酸内切酶 核酸内切酶(endonuclease)在核酸水解酶中,为可水解分子链内部磷酸二酯键生成寡核苷酸的酶,与核酸外切酶相对应。从对底物的特异性来看,可分为DNaseⅠ、DNaseⅡ等仅分解DNA的酶;脾脏RNase、RNaseT1等仅分解RNA的酶。如链孢霉(Neurospora)的核酸酶就是既分解DNA又分解RNA的酶。一般来说,大都不具碱基特异性,但也有诸如脾脏RNase、RNaseT1等或限制性内切酶那种能够识别并切断特定的碱基或碱基序列的酶。[1] 寡核苷酸,是一类只有20个以下碱基对的短链核苷酸的总称(包括脱氧核糖核 酸DNA或核糖核酸RNA内的核苷酸),寡核苷酸可以很容易地和它们的互补对链接,所以常用来作为探针确定DNA或RNA的结构,经常用于基因芯片、电泳、荧光原位杂交等过程中。 RNA聚合酶 科技名词定义 中文名称:RNA聚合酶 英文名称:RNA polymerase 定义1:以一条DNA链或RNA链为模板催化由核苷-5′-三磷酸合成RNA的酶。 所属学科:生物化学与分子生物学(一级学科);酶(二级学科) 定义2:以一条DNA链或RNA链为模板催化由核苷-5′-三磷酸合成RNA的酶。 所属学科:细胞生物学(一级学科);细胞遗传(二级学科)
定义3:以DNA或RNA为模板合成RNA的酶。 所属学科:遗传学(一级学科);分子遗传学(二级学科) 本内容由全国科学技术名词审定委员会审定公布 RNA聚合酶(RNA polymerase):以一条DNA链或RNA为模板催化由核苷-5′-三磷酸合成RNA的酶。是催化以DNA为模板(template)、三磷酸核糖核苷为底物、通过磷酸二酯键而聚合的合成RNA的酶。因为在细胞内与基因DNA的遗传信息转录为RNA有关,所以也称转录酶。 逆转录酶 科技名词定义 中文名称:逆转录酶 英文名称:reverse transcriptase 其他名称:依赖于RNA的DNA聚合酶(RNA-dependent DNA polymerase,RNA指导的DNA聚合酶 (RNA-directed DNA polymerase) 定义:编号:EC 2.7.7.49。以RNA为模板催化脱氧核苷-5′-三磷酸合成DNA的酶。在逆转录病毒及其他某些病毒中发现有此类酶。 所属学科:生物化学与分子生物学(一级学科);酶(二级学科) 本内容由全国科学技术名词审定委员会审定公布
高中生物论文解读限制性核酸内切酶应用的考点例析人教版
解读《限制性核酸内切酶应用的考点例析》 我们知道限制性核酸内切酶(限制酶)是指能识别DNA中特定碱基顺序,并在特定位点切割双链DNA的核酸内切酶。它在生物学中应用相当广泛,是基因工程中的工具酶,用来构建重组DNA分子,对于遗传性疾病的基因定位和基因诊断的研究也具有重要的应用价值。下面我们以问题的形式简要地了解它在这些方面的应用。 1。限制酶的特点 例1.下面哪项不具有限制酶识别序列的特征() A.GAATTC B.GGGGCCCC C.CTGCAG D.CTAAATC CTTAAG CCCCGGGG GACGTC GATTTAG 解析:限制酶识别的各种序具有回文对称的特点。所谓回文对称序列就是当以不同的方向分别阅读DNA的两条互补链时,DNA的两条链上的碱基序列相同。如A中的DNA分子,其中一条链从左向右阅读碱基序列是GAA TTC,另一条互补链从右向左阅读碱基序列也是GAATTC。 答案:D 例2.限制酶HindⅢ酶切DNA的识别序列是AAGCTT,限制酶HpaⅡ酶切DNA的识别序列是CCGG。假定DNA分子中A、T、G、C所含的比例相等,那么,限制酶HindⅢ酶切割双链DNA的概率是,酶切位点间的平均距离约kb(千碱基);限制酶HpaⅡ酶切割双链DNA的概率是,酶切位点间的平均距离约kb。 解析:因为限制酶识别序列具有回文对称序列的特点,这两个序列在相应的互补链上又会呈现,因此我们只需考虑DNA的一条链即可。六碱基长HindⅢ识别序列AAGCTT出现的概率是(1/4)6或1/4096,因此HindⅢ酶切位点之间的平均距离大约为4 kb。同样的道理,4碱基长的HpaⅡ酶识别序列CCGG出现的概率是(1/4)4或1/256,因此HpaⅡ酶切位点的平均距离大约为0.25 kb。 2.黏性末端与限制酶类型的关系 例3.用同一种限制酶处理会产生相同的黏性末端,但用不同的限制酶处理也可能产生相同的黏性末端。下列所示的四个黏性末端是由()种限制酶作用产生的。 解析:不同的限制酶的识别序列和切割位点不同。要判断题中的4个黏性末端是由几种限制酶作用下产生的,不光要看共有几种黏性末端,更重要的是要看作用产生这些黏性末端的限制酶的识别序列和切割位点是否相同。经过分析,题中4幅图所示的黏性末端应该分别是由4种限制酶作用产生的,这4种酶的识别序列及切割位点依次是:G↓AATTC,C↓AA TTG,G↓TTAAC,C↓TTAAG。 答案:4 3.限制酶图谱分析 例4.一线性DNA分子分别用限制酶HindⅢ和SmaⅠ消化,然后用这两种酶混合消化,得到如下片段: HindⅢ 2.5 kb,5.0 kb SmaⅠ 2.0 kb,5.5 kb HindⅢ和SmaⅠ 2.5 kb,3.0 kb,2.0 kb (1)画出此丝性DNA分子的限制酶图谱。 (2)两酶混合消化的片段再用限制酶EcoRⅠ消化,结果导致凝胶上3.0 kb的片段消失,产
(整理)限制性内切核酸酶
第三章限制性内切核酸酶 一、填空题 1. 严格地说限制性内切核酸酶(restriction endonuclease)是指已被证明是的酶。基因工程中把 那些具有识别的内切核酸酶统称为限制性内切核酸酶。 2.年Luria和Human在T偶数噬菌体对大肠杆菌感染实验中首次发现了细菌的现象。 3.1970年,Smith和Wilcox从流感嗜血杆菌中分离到一种限制酶,能够特异性的切割DNA, 这个酶后来被命名为,这是第一个分离到的Ⅱ类限制性内切核酸酶。 4.通过比较用不同组合的限制性内切核酸酶处理某一特定基因区域所得到的不同大小的片段,可 以构建显示该区域各限制性内切核酸酶切点相互位置的。 5.Ⅱ类限制性内切核酸酶分子量较小.一般在20~40kDa,通常由——亚基所组成。它们的作用底物 为双链DNA,极少数Ⅱ类酶也可作用于单链DNA,或DNA/RNA杂合双链;这类酶的专一性强,它不仅对酶切点邻近的两个碱基有严格要求,而且对更远的碱基也有要求,因此,Ⅱ类酶既具有专一性,也具有专一性,一般在识别序列内切割。切割的方式有,产生末端的DNA片段或的DNA片段。作用时需要——作辅助因子,但不需要和 6.完全的回文序列具有两个基本的特点,就是:和 7.Ⅱ类限制性内切核酸酶一般识别个碱基,也有识别多序列的限制性内切核酸酶;根据对限制性内切核酸酶识别序列的分析,限制性内切核酸酶识别序列具有倾向,即它们在识别序列中含量较高。 8.EcoK是I类限制性内切核酸酶,分子组成是_______ 分子量是300kDa.在这些亚基中,α亚基具有 作用;β亚基具有的活性;γ亚基的作用则是, 9.个体之间DNA限制性片段长度的差异叫 10.限制性内切核酸酶是按属名和种名相结合的原则命名的,第一个大写字母取自,第二、三两个字母取自,第四个字母则用表示。 11.限制性内切核酸酶AcyI识别的序列是5’-GRCGYG-3’,,其中R,Y 12.在酶切反应管加完各种反应物后,需要离心2秒钟,其目的是和 13.部分酶切可采取的措施有:(1)(2)(3)等。 14.第一个分离的限制性内切核酸酶是;而第一个用于构建重组体的限制性内切核酸酶是 15.限制性内切核酸酶BsuRI和HaeⅢ的来源不同,但识别的序列都是,它们属于。 16.由于DNA是由4种碱基组成的,所以任何限制性内切核酸酶的切割频率的理沦值应该是· 17.SalI和NotI都是哺乳动物中识别序列稀有的酶,在哺乳动物基因组的5kb片段中,找到NotI切点 的概率是。 18.部分酶切是指控制反应条件,使得酶在DNA序列上的识别位点只有部分得到切割,它的理论依据 是。 19.Ⅰ类限制酶识别DNA的位点和切割的DNA位点是不同的.切割位点的识别结合有两种模型,一种是,另一种是。 20.限制性内切核酸酶通常保存在浓度的甘油溶液中。 二、判断题 1.限制与修饰现象是宿主的一种保护体系,它足通过对外源DNA的修饰和对自身DNA的限制实现的。 2.限制性内切核酸酶在DNA中的识别/切割位点的二级/三级结构也影响酶切效率, 一般来说, 完全切割质粒或病毒DNA,要比切割线状DNA需要更多的酶,最高的需要20倍, 3.如果限制性内切核酸酶的识别位点位于DNA分子的末端,那么接近末端的程度也影响切割,如 HpaII和MboI要求识别序列之前至少有一个碱基对存在才能切割。 4.能够产生防御病毒侵染的限制性内切核酸酶的细菌,其本身的基因组中没有被该核酸酶识别的序列。 5.限制性图谱与限制性片段长度多态性(RFLP)图谱的最显著的区别在于前者是一个物理图谱而后者
限制性内切酶分类指南
30多年前,当人们在对噬菌体的宿主特异性的限制-修饰现象进行研究时,首次发现了限制性内切酶。细菌可以抵御新病毒的入侵,而这种"限制"病毒生存的办法则可归功于细胞内部可摧毁外源DNA的限制性内切酶。首批被发现的限制性内切酶包括来源于大肠杆菌的EcoR I 和EcoR II,以及来源于Heamophilus influenzae的Hind II和Hind III。这些酶可在特定位点切开DNA,产生可体外连接的基因片段。研究者很快发现内切酶是研究 限制性内切酶的主要功能是保护细菌不受噬菌体的感染,这一观点已被人们广泛接受。它们作为微生物免疫机制的一部分行使其功能。当一个没有限制性内切酶的细菌被病毒感染时,大部分病毒颗粒都能成功地进行感染。然而一个有限制性内切酶的同种细菌被成功感染的比率显著下降。出现更多的限制性内切酶将会起到多重保护作用;而一个拥有4到5种各自独立的限制性内切酶将会使细胞坚不可摧。 限制性内切酶常常伴随一到两种修饰酶(甲基化酶)出现。后者的作用是保护细胞自身的DNA 不被限制性内切酶破坏。修饰酶识别的位点与相应的限制性内切酶相同,但只甲基化每条链中的一个碱基,而不是切开DNA链。限制性内切酶识别位点处的甲基基团伸入到双螺旋的大沟中去,阻碍了限制性内切酶的作用。这样,限制性内切酶和它的"搭档"--甲基化酶一起就构成了限制-修饰(R-M)系统。在一些R-M系统中,限制性内切酶和修饰酶是两种不同的蛋白,它们各自独立行使自己的功能;而在另一些系统中,两种功能由同一种限制-修饰酶的不同亚基,或是同一亚基的不同结构域来执行。 传统上将限制性内切酶按照亚基组成、酶切位置、识别位点、辅助因子等因素划分为三大类。然而,蛋白测序的结果表明,限制性内切酶的变化多种多样,若从分子水平上分类,则应当远远不止这三种。 I型限制性内切酶是一类兼有限制性内切酶和修饰酶活性的多个亚基的蛋白复合体。它们在识别位点很远的地方任意切割DNA链。以前人们认为I型限制性内切酶很稀有,但现在通过对基因组测序的结果发现这一类酶其实很常见;尽管I型酶在生化研究中很有意义,但由于不产生确定的限制片段和明确的跑胶条带,因而不具备实用性。 II型酶在其识别位点之中或临近的确定位点特异地切开DNA链。它们产生确定的限制片段和跑胶条带,因此是三类限制性内切酶中唯一用于dna分析和克隆的一类。II型限制性内切酶由一群性状和来源都不尽相同的蛋白组成,因而任意一种限制性内切酶的氨基酸序列可能与另一种限制性内切酶的氨基酸序列截然不同。实际上,从已知的情况上看,这些酶很可能是在进化过程中各自独立产生的,而非来源于同一个祖先。 II型限制性内切酶中最普遍的是象Hha I、Hind III和Not I这样在识别序列中进行切割的酶。这一类酶是构成商业化酶的主要部分。大部分这类酶都以同二聚体的形式结合到DNA上,因而识别的是对称序列;但有极少的酶作为单聚体结合到DNA上,识别非对称序列。一些酶识别连续的序列(如EcoR I识别GAATTC);而另一些识别不连续的序列(如Bgl I识别GCCNNNNNGGC)。限制性内切酶的切割后产生一个3"羟基端和一个5"磷酸基团。它们的活性要求镁离子,而相应的修饰酶则需要S-甲硫氨酸腺苷的存在。这些酶一般都比较小,亚基一般都在200-300个氨基酸左右。 另一种比较常见的酶是所谓的IIS型酶,比如Fok I和Alw I,它们在识别位点之外切开DNA。
限制性核酸内切酶
限制性核酸内切酶 限制性核酸内切酶:是识别DNA的特异序列,并在识别位点或其周围切割双链DNA的一 类内切酶。 限制性核酸内切酶的分类: 根据限制酶的结构,辅因子的需求切位与作用方式,可将限制酶分为三种类型,分别是第一 型(Type I)、第二型(Type II)及第三型(Type III)。 第一型限制酶 同时具有修饰(modification)及认知切割(restriction)的作用;另有认知(recognize)DNA上特定 碱基序列的能力,通常其切割位(cleavage site)距离认知位(recognition site)可达数千个碱基之远,并不能准确定位切割位点,所以并不常用。例如:EcoB、EcoK。 第二型限制酶 只具有认知切割的作用,修饰作用由其他酵素进行。所认知的位置多为短的回文序列(palindrome sequence);所剪切的碱基序列通常即为所认知的序列。是遗传工程上,实用性较 高的限制酶种类。例如:EcoRI、HindIII。 第三型限制酶 与第一型限制酶类似,同时具有修饰及认知切割的作用。可认知短的不对称序列,切割位与 认知序列约距24-26个碱基对,并不能准确定位切割位点,所以并不常用。例如: EcoPI、HinfIII。 限制酶在遗传学方面的应用: 1、在甚因工程方面 利用能产生“粘性末端”的限制酶, 进行DNA的体外重组, 是较为方便的, 只要用同一 限制酶处理不同来源的DNA, 由于所产生的水解片段具有相同的粘性末端, 可以彼此“粘合”,再经连接酶处理, 就成为重组DNA分子了. 目前, 基因工程上, 限制酶主要应用于以下两方面 ? (1)目的基因与载体的重组 细菌细胞中的限制酶能水解外源DNA , 因此必须通过适当的载体(质粒或噬菌体)的帮助 才能将外源DNA引人受体细胞并在其中增殖和表达。将供体DNA与载体用同样的限制酶处理, 使载体带上各种各样的外源DNA片断, 然后引人受体细菌细胞增殖, 菌细胞增殖, 再筛 选出所需的菌株, 便获得带有某一目的基因的繁殖系.用这种方法, 已成功地将酵母菌的咪哇
AgeI限制性内切酶使用说明书
H om e ?P roducts ?AgeI AgeI Product Information FAQs Protocols Other Tools & Resources Related Products Description Properties and Usage Quality Control This enzyme has transitioned to an improved new buffer system. Visit https://www.360docs.net/doc/fe13075246.html, for further details. The new and current Double Digest Finder and current Activity/Performance Chart for the CutSmart buffer system are available. The previous version of the Double Digest Finder , as well as the previous Version of Activity/Performance Chart that use the former buffer system, are still available for your convenience. AgeI has High Fidelity (HF) and RE-Mix Master Mix versions available. Isoschizomers Catalog # Size Concentration Price Qty R0552S 300 units 5,000 units/ml $67.001R0552L 1,500 units 5,000 units/ml $268.001 Categories: Restriction Endonucleases: A Applications: Restriction Enzyme Digestion Description AgeI has a High Fidelity v ersion AgeI-HF? (NEB #R3552). High Fidelity (HF ?) Restriction Enzymes hav e 100% activ ity in CutSmart ? Buffer; single-buffer simplicity means more straightforward and streamlined sample processing. HF enzymes also exhibit dramatically reduced star activ ity. HF enzymes are all Time-Sav er qualified and can therefore cut substrate DNA in 5-15 minutes with the flexibility to digest ov ernight without degradation to DNA. Engineered with performance in mind, HF restriction enzymes are fully activ e under a broader range of conditions, minimizing off-target products, while offering flexibility in experimental design. Product Source An E. coli strain that carries the AgeI gene from Ruegeria gelatinovora (ATCC 25655). Reagents Supplied The following reagents are supplied with this product: Properties and Usage Unit Definition One unit is defined as the amount of enzyme required to digest 1 μg of λ DNA in 1 hour at 37°C in a total reaction of 50 μl. NEBuffer 1.110X
限制性内切酶的一般原则和建议!
限制性内切酶的一般原则和建议! 1.如何做酶切反应? 该问题看似什么简单: DNA中加上酶,然后保温一段时间就可以了。但是在实际操作过程中,我们不断听到:切不动,装不上。问题在什么地方?能系列生产限制性内切酶的公司国际上,就那么几个,位列前 3 的是NEB, Fermentas, SibEnzyme。这些公司提供酶的品质一般都能得到保证。您可以怀疑酶的质量问题,但是更多的问题来源于模板是否合适酶切要求。下面几点对你的酶切是有帮助的。 1) 成功酶切的关键是准备好模板DNA。DNA样品中不能含有有机溶剂(会使酶变性或产生星号货性),不能含有干扰酶活性的污染物质,不能含有高浓度的EDTA (TE中的EDTA浓度较低,对Mg的浓度影响较小);同时要对DNA甲基化程度及其对酶切效率的影响要做到心中有数。 2) 选用合适的酶。根据酶切序列选用,特别注意选用甲基化对酶活性的干扰。 3) 正确使用和保存酶。酶需要保存在-20度的低温环境中,只是在需要用酶才从冰箱中取出来。运输和临时存放时需要将酶至于冰上。手拿酶管时不要接触酶管下步含酶的部分,移酶时尽可能用长TIP, 避免污染。用完后需要及时送回原处。注意:酶通常是最后加。所有4) 反应体积需要根据实验目的定,常规的酶切一般要维持在10-50ul,酶切鉴定10-20ul就可以了。 5) 模板浓度问题:浓度过高,溶液黏度过大,酶不能有效扩散,酶切效果不会好。浓度过低,也会影响酶活性。 6) 注意模板用量和反应体积的关系。对酶用量,模板用量,反应体积等要素的确定需要的是时间和经验的积累。 7) 酶切反应的各个组分加完后,需要用TIP小心混匀几次,short spin 一下就可以保温了。一般不能使用振荡器混匀。 8) 反应温度的选择。一般反应都用37度,但是 Sma I 的最适合温度是25度,37度时酶仍表现出活性,但是效率下降50%。部分从耐热菌制备的酶需要在37度以上的温度反应,如Taq I的最适温度为65度,37度保温,效率仅为前者的1/10。 9) 反应时间的选择。一般酶切鉴定30分钟就可以了。要完全酶切可以采用少量的酶长时间反应,或较高的酶量短时间处理都可以达到。在使用高酶量的时候需要注意甘油的最终浓度不要超过5%,也就是说10ul的体系,酶的用量不要超过1ul。 10) 是否和如何终止反应?酶切鉴定之类的实验不需要特殊处理。灭活的手段:加入高浓度的EDTA;65度或80度热处理20-30分钟;部分从高温菌纯化出来的内切酶由于最适的反应温度比较高,热处理灭活不一定完全,需要用苯酚/氯仿/乙醇方法纯化;电泳回收也是实验室常用除酶的手段。 2.如果遇到酶切不动或切不完全,该怎么办? 要回答这么问题常常需要了解酶活性单位是如何确定,我们多次接到这样的问题:1个单位的酶能在60分钟内切1ug的DNA,为什么我们的DNA那么少切那么长时间也不能切开或切完全?从下面几个因素去考虑: 1) 酶是否有活性:酶的活性单位通常是在60分钟酶切1ug lambda DNA或特定线状DNA所需要的酶量。鉴定酶的活性高低不是用您待切的DNA模板,也不是别的公司的酶来判定。因为不同公司酶可能是从不同系统中纯化的,虽然识别位点相同,但是酶的特性可能是有差异的。鉴定酶必须使用使用说明书上认定的酶活确定的方式,通常需要用lambda DAN做模板来判定。同时如果酶对甲基化敏感,还需要用Dcm-, Dam-的DNA.不排除由于运输或分装不当导致酶活性下降,这种情况是很少发生。我们公
DNA限制性内切酶——酶切Buffer组分及其活性
DNA限制性内切酶——酶切Buffer组分及其活性 TaKaRa公司,为了方便限制酶的统一使用,采用了通用缓冲液(Universal Buffer) 测定限制酶活性的体系(5种通用缓冲液中,用标注的),以此时的活性值作为100%。并把在其它通用缓冲液中的相对活性表示如下表。有( ) 标记的是易受Star活性影响的缓冲液,为了避免Star活性的影响,希望尽量使用或标注的缓冲液。每种限制酶都有其自身的基本缓冲液(Basal Buffer),其中AccⅢ、BalⅠ、BcnⅠ、BglⅠ、Bpu1102Ⅰ、Cfr10Ⅰ、Eam1105Ⅰ、Eco52Ⅰ、NruⅠ、Psh BⅠ、Sna BⅠ、SspⅠ、TaqⅠ、VpaK11B Ⅰ(共14种)由于没有十分合适的通用缓冲液,只能使用基本缓冲液(Basal Buffer)。各种限制酶的基本缓冲液组成不同,相互之间不能通用。各种限制酶在基本缓冲液中的相对活性也被列于下表,供参考。 限制酶在各种缓冲液中的相对活性 附带·活性测定用Buffer 推荐使用的Buffer
*1+0.01%BSA→100%:Afl II, Aor13H I, Eco O65 I, Fok I, Hin1 I, Mun I, Nco I, Pvu I, Sse8387 I, Xba I *2 +0.01%BSA+0.01%Triton X-100→100%:Not I *3不加BSA
按Universal Buffer分类的限制酶
各Universal Buffer的组成 ■ 使用注意事项 10×Buffer都为10倍浓度的缓冲液。此外,10×T溶液中不含BSA,在使用时将BSA添加进去,使最终浓度为0.01%,有些限制酶(带有*1或*2标记)的反应体系中需加BSA或Triton X-100,添附的溶液是10倍浓度(0.1%) 的液体,使用时,请在反应体系中添加1/10量进行反应。 ■ 保存 -20℃ 反应停止液组份表 (10 × Loading Buffer) 1%SDS 60%Glycerol 0.05%Bromophenol Blue ■ 使用方法 本公司的酶包装中全部附带有反应停止液。使用时请添加反应液量的1/10,即可停止反应,进行电泳。-20℃保存时,会出现SDS 沉淀,请于温水浴中溶解后使用。在室温下保存时,SDS有时也会出现沉淀,此时同样请于温水浴中将其溶解后使用。 ■ 保存 开封后室温保存。
常用限制性内切酶酶切位点总结
常用限制性内切酶酶切位点总结
————————————————————————————————作者:————————————————————————————————日期:
Acc65I识别位点 AccI识别位点 AciI识别位点 AclI识别位点 AcuI识别位点 AfeI识别位点 AflII识别位点 AflIII识别位点 AgeI识别位点 AhdI识别位点 AleI识别位点 AluI识别位点 AlwI识别位点 AlwNI识别位点 ApaI识别位点 ApaLI识别位点 ApeKI识别位点 ApoI识别位点 AscI识别位点 AseI识别位点 AsiSI识别位点 AvaI识别位点 AvaII识别位点 AvrII识别位点 BaeI识别位点 BamHI识别位点 BanI识别位点 BanII识别位点
BbvCI识别位点 BbvI识别位点 BccI识别位点 BceAI识别位点 BcgI识别位点 BciVI识别位点 BclI识别位点 BfaI识别位点 BfuAI识别位点 BglI识别位点 BglII识别位点 BlpI识别位点 Bme1580I识别位点 BmgBI识别位点 BmrI识别位点 BmtI识别位点 BpmI识别位点 Bpu10I识别位点 BpuEI识别位点 BsaAI识别位点 BsaBI识别位点 BsaHI识别位点 BsaI识别位点 BsaJI识别位点 BsaWI识别位点 BsaXI识别位点 BseRI识别位点 BseYI识别位点
BsiEI识别位点 BsiHKAI识别位点 BsiWI识别位点 BslI识别位点 BsmAI识别位点 BsmBI识别位点 BsmFI识别位点 BsmI识别位点 BsoBI识别位点 Bsp1286I识别位点 BspCNI识别位点BspDI识别位点 BspEI识别位点 BspHI识别位点 BspMI识别位点 BspQI识别位点 BsrBI识别位点 BsrDI识别位点 BsrFI识别位点 BsrGI识别位点 BsrI识别位点 BssHII识别位点 BssKI识别位点 BssSI识别位点 BstAPI识别位点 BstBI识别位点 BstEII识别位点 BstNI识别位点
限制性内切酶酶切位点保护碱基
寡核苷酸近末端位点的酶切 (Cleavage Close to the End of DNA Fragme nts (oligo nu cleotides)) 为了解不同内切酶对识别位点以外最少保护碱基数目的要求,NEB采用了一系列 含识别序列的短双链寡核苷酸作为酶切底物进行实验。实验结果对于确定双酶切顺序将会有帮助(比如在多接头上切割位点很接近时),或者当切割位点靠近DNA末端时也很有用。在本表中没有列出的酶,则通常需在识别位点两端至少加上6个保护碱基,以确保酶切反应的进行。 实验方法:用r[32P]ATP在T4多聚核苷酸激酶的作用下标记0.1A260单位的寡核苷酸。取1卩已标记了的寡核苷酸与20单位的内切酶,在20°C条件下分别反 应2小时和20小时。反应缓冲液含70 mM Tris-HCl (pH , 10 mM MgCI, 5 mM DTT 及适量的NaCI或KCI (视酶的具体要求而定)。20%的PAGE(7 M尿素)凝胶电泳分析,经放射自显影确定酶切百分率。 本实验采用自连接的寡核苷酸作为对照。若底物有较长的回文结构,切割效率则可能因为出现发夹结构而降低。 DNA合成,新链的延伸方向是573因此,需要在5端加上酶切位点,因为内切酶除了有特异的识别位点之外,还需多几个无需特异性的碱基提供一个platform让它可以结合上去,否则 会掉下来.引物的结构就是(573):保护碱基+酶切位点+原来的引物序列 首先要看目的基因中是否含有该酶切位点,只有没有的才可以选(小虾米酶切位点分析)。其次,如果需要做表达,需要考虑起始密码子,防止移码突变
DNA合成,新链的延伸方向是5T3因此,需要在5端加上酶切位点,因为内切酶除了有特异的识别位点之外,还需多几个无需特异性的碱基提供一个platform 让它可以结合上去,否则 会掉下来.引物的结构就是(573):保护碱基+酶切位点+原来的引物序列?
