酸碱中和滴定总结(最全版)

酸碱中和滴定
1.酸碱中和滴定的定义:是指利用已知物质的量浓度的酸或碱溶液(称为标准液)来测定未知的碱或酸(称为待测液)的物质的量浓度的过程。
2.酸碱中和滴定的原理:H++OH—→H2O(用离子方程式表示)。
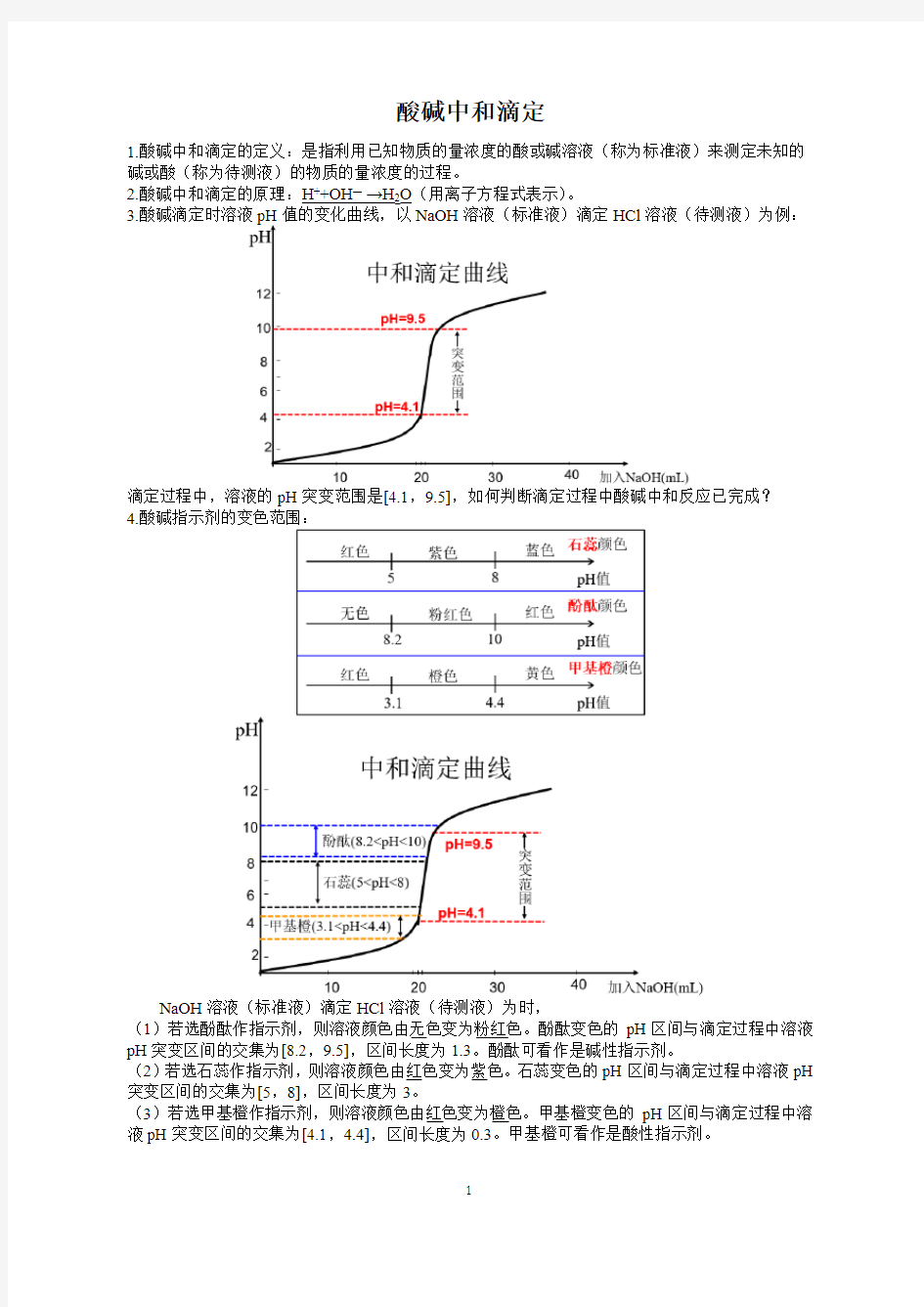
3.酸碱滴定时溶液pH NaOH溶液(标准液)滴定HCl溶液(待测液)为例:
滴定过程中,溶液的pH突变范围是[4.1,9.5],如何判断滴定过程中酸碱中和反应已完成?
4.酸碱指示剂的变色范围:
NaOH溶液(标准液)滴定HCl溶液(待测液)为时,
(1)若选酚酞作指示剂,则溶液颜色由无色变为粉红色。酚酞变色的pH区间与滴定过程中溶液pH突变区间的交集为[8.2,9.5],区间长度为1.3。酚酞可看作是碱性指示剂。
(2)若选石蕊作指示剂,则溶液颜色由红色变为紫色。石蕊变色的pH区间与滴定过程中溶液pH 突变区间的交集为[5,8],区间长度为3。
(3)若选甲基橙作指示剂,则溶液颜色由红色变为橙色。甲基橙变色的pH区间与滴定过程中溶液pH突变区间的交集为[4.1,4.4],区间长度为0.3。甲基橙可看作是酸性指示剂。
5.酸碱指示剂的选择原则:变色范围要灵敏,即指示剂变色的pH区间与滴定过程中溶液pH突变
注意:
(1)一般强酸滴定强碱选甲基橙作指示剂,强碱滴定强酸选酚酞作指示剂。
(2)强酸滴定弱碱时,完全中和后,溶液显酸性,滴定时只能选甲基橙作指示剂。
强碱滴定弱酸时,完全中和后,溶液显碱性,滴定时只能选酚酞作指示剂。
6.酸碱中和滴定的实验过程,以NaOH溶液(标准液)滴定HCl溶液(待测液)为例:
(1)查漏:用蒸馏水检查酸式滴定管和碱式滴定管是否漏液。
(2)润洗:分别用HCl溶液、NaOH溶液润洗酸式滴定管和碱式滴定管。确保溶液的浓度不被剩余在滴定管中的水稀释而变小。
(3)注液:润洗后,分别向酸式滴定管和碱式滴定管中注入一定量的HCl溶液、NaOH溶液。并调节液面至零或零刻度线以下,记下各自的起始读数,分别记为V(酸始)、V(碱始)。
(4)取待测液:用酸式滴定管向锥形瓶中注入一定体积的待测液(HCl溶液),记录读数为V(酸末),则加入到锥形瓶中的待测HCl溶液的体积:V(HCl)= V(酸末)—V(酸始)。后向锥形瓶中滴加2-3滴酚酞溶液作指示剂。
(5)滴定:左手控制碱式滴定管的活塞,右手摇动锥形瓶,向锥形瓶中滴加NaOH溶液,眼睛注视锥形瓶中溶液颜色的变化。刚开始滴定时,流速可以稍快些,临近滴定终点时,滴液要慢,避免过量。
(6)滴定终点判断:当溶液颜色由无色变为红色且30秒内不褪色时,停止滴定。记录读数为V(碱末),则滴入的NaOH溶液的体积:V(NaOH)= V(碱末)—V(碱始)。
(7)同一样品滴定2-3次。
(8)计算,取平均值:c(NaOH)·V(NaOH)= c(HCl)·V(HCl),c(HCl)待测=c(NaOH)标准·V(NaOH)/V(HCl)。
7.酸碱中和滴定需要的实验仪器:酸碱滴定管、锥形瓶、铁架台、滴定管夹、烧杯等。
8.酸碱中和滴定需要的试剂:标准液、待测液、指示剂。
9.酸碱滴定管是测量放出液体体积的定量仪器,规格有10mL、25mL和50mL,最小刻度为0.1mL,读数估读到0.01mL。滴定管上端标有温度、容积和零刻度,最大刻度在下方。
10.滴定管活塞手柄有红色、蓝色两种,一般红色的用于盛放酸液,蓝色的用于盛放碱液,它们的使用方法完全相同。
11.滴定管上标有棕色刻度线,观察背景是白底蓝线,由于光在空气、水中折射率不同,蓝线在液面下变粗,蓝线的粗细交界点所对应的刻度即是准确读数。
例1.(酸碱中和滴定的理论探究)
1.NaOH溶液(标准液)滴定HCl溶液(待测液)时,若选酚酞作指示剂,由于酚酞变色的pH区间与滴定过程中溶液pH突变区间的交集为[8.2,9.5],故达到滴定终点时溶液显碱性,不是中性。若选甲基橙作指示剂,由于甲基橙变色的pH区间与滴定过程中溶液pH突变区间的交集为[4.1,4.4],故达到滴定终点时溶液显酸性,不是中性。既然选择这两种指示剂,达到滴定终点时,溶液并不是呈中性的,那为什么我们仍然可以选它们作指示剂呢?
现用20mL 0.1000mol/L NaOH标准液滴定20mL HCl待测液(浓度也为0.1000mol/L),完成下表:
(1)多加一滴或少加一滴NaOH溶液,尽管最终的溶液不为中性,但测出的酸的浓度的误差为±0.25%,小于实验允许的误差范围±2%,所以酸碱中和滴定不必强求最终溶液显中性。
(2)本例中,当选酚酞作指示剂时,溶液颜色由无色变红色,实则是多加了一滴NaOH溶液,溶液最终显碱性。若选甲基橙作指示剂,溶液颜色由红色变橙色,实则是少加了一滴NaOH溶液,溶液最终显酸性。
(3)临近滴定终点时,多加一滴或少加一滴标准液,溶液的pH值变化会很大,所以不要小看一滴溶液的魔力,它能教会你“量变引起质变”的真谛。
例2.(酸碱中和滴定的误差分析)
2.测定未知浓度溶液的浓度,分析下列情况造成的测定影响,填“偏高”、“偏低”或“无影响”。(1)滴定前,用蒸馏水洗涤滴定管后,未用标准液润洗:___________。偏高
(2)滴定前,装标准液的滴定管尖端有气泡,滴定后气泡消失:___________。偏高
(3)滴定前,用待测液润洗锥形瓶:___________。偏高
(4)取待测液时,滴定管用蒸馏水洗涤后,未用待测液润洗:___________。偏低
(5)锥形瓶用蒸馏水洗涤后,误用标准溶液润洗:___________。偏低
(6)读取标准液的刻度时,滴定前平视,滴定后俯视:___________。偏低
(7)滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出:___________。偏低
(8)滴定后,装标准液的滴定管尖端挂有液滴未滴入锥形瓶中:___________。偏高
(9)滴定管水洗后,直接用来量取待测溶液:___________。偏低
(10)滴定过程中向锥形瓶内加少量蒸馏水:___________。无影响
(11)滴定过程中,装标准液的滴定管漏液:___________。偏高
(12)锥形瓶使用前未干燥:___________。无影响
(13)指示剂颜色改变不足半分钟即停止滴加标准液:___________。偏低
(14)过晚估计滴定终点:___________。偏高
(15)一滴标准溶液附在锥形瓶壁上未洗下:___________。偏高
例3.(强碱弱酸或强酸弱碱的滴定)
3.已知:将10mL 0.1mol/L Na2CO3溶液用0.1mol/L盐酸滴定时,若用酚酞溶液作指示剂,滴定终点时消耗盐酸10mL;若用甲基橙作指示剂,滴定终点时消耗盐酸20mL。现有一份白色粉末,可能含有NaOH、Na2CO3、NaHCO3中的一种或两种。现取一定量的该粉末配成适当浓度的稀溶液并分成两等份,分别用0.1mol/L盐酸滴定。一份用酚酞溶液作指示剂,消耗盐酸a mL;另一份用甲基橙作指示剂,消耗盐酸b mL。下列说法正确的是(A)
①若a=0,则固体中只含有NaHCO3
②若a=b,则固体中只含有NaOH
③若2a>b>a,则固体中含有NaOH、Na2CO3
④若2a A.①②③④ B.只有③④ C.只有①② D.只有①③④ 解:将10mL0.1 mol·L-1Na2CO3溶液用0.1mol·L-1盐酸滴定时,若用酚酞作指示剂,终点时消耗盐酸10 mL;若用甲基橙作指示剂,终点时消耗盐酸20 mL,说明盐酸滴定碳酸钠溶液,用甲基橙作指示剂,达到滴定终点时完全生成二氧化碳,用酚酞作指示剂,达到滴定终点时生成碳酸氢钠。用酚酞作指示剂,达到滴定终点时,NaOH与盐酸反应生成氯化钠和水、Na2CO3与盐酸反应生成碳酸氢钠;NaHCO3与盐酸没反应;用甲基橙作指示剂,达到滴定终点时,NaOH与盐酸反应生成氯化钠和水、Na2CO3与盐酸反应生成二氧化碳、NaHCO3与盐酸反应生成二氧化碳;若a=0,则固体中只含NaHCO3,故①正确;若a = b,则固体中只含NaOH,故②正确;若2a>b>a,则固体中含有NaOH、Na2CO3,故③正确;④若2a 变式训练: 1.有一支25mL的酸式滴定管,其中盛有溶液的液面恰好在10mL刻度处,若将管内溶液全部流下排出,用量筒承接,所得溶液的体积为(C) A.10mL B.15mL C.大于15mL D.不能确定 2.(多选)用某仪器量一液体体积时,平视时读数为n mL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能是(BC ) A.量筒 B.酸式滴定管 C.碱式滴定管 D.容量瓶 3.下图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是(B) A.①是量筒,读数为2.5mL B.②是量筒,读数为2.5 mL C.③是滴定管,读数为3.5mL D.②是温度计,读数为2.5 ℃ 4.第三组学生进行了两次滴定,消耗标准盐酸体积的数据如下表,其中第2次滴定后滴定管的读数如右图所示,将这一读数填入表中。 该组学生所测得的烧碱样品中NaOH的质量分数为__________________。 【答案】51.20.00 0.99 5. 中有气泡,滴定后气泡消失,则测定结果将________(填“偏高”、“偏低”或“不影响”)。解:0.1149,偏高 6.常温下,盐酸与氢氧化钠溶液相互滴定的滴定曲线如下图,下列叙述不正确的是(B) A.滴定过程的任何时刻都存在:[H+]+[Na+]=[OH-]+[Cl-] B.曲线b是用氢氧化钠溶液滴定盐酸溶液的滴定曲线 C.氢氧化钠溶液的物质的量浓度为0.1mol/L D.滴定时可选甲基橙或酚酞作指示剂 解:A、盐酸与氢氧化钠溶液相互滴定,溶液中存在的离子有H+、Na+、OH-、Cl-,根据电荷守恒,任何时刻都存在:[H+]+[Na+]=[OH-]+[Cl-],A正确;B、曲线b的pH是由大到小,说明是盐酸溶液滴定氢氧化钠溶液的曲线,B错误;C、由曲线可知氢氧化钠溶液的pH=13,所以氢氧化钠溶液的物质的量浓度为0.1mol?L-1,C正确;答案选B。 7.在100 mL某一元弱酸(HA)的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是(C) A.该弱酸在滴定前的浓度是0.15 mol/L B.该弱酸稀释10倍后pH为4 C.滴定过程为求滴定终点,最合适的指示剂是酚酞 D.滴定终点时,c(A-)=c(Na+)>c(H+)=c(OH-) 解:A. 在100 mL某一元弱酸(HA)的溶液中,用0.50 mol/L氢氧化钠溶液滴定,恰好完全反应消耗氢氧化钠溶液20.00mL,该弱酸在滴定前的浓度是0.1 mol/L,错误;B.0.1 mol/L该弱酸的pH=3,稀释10倍后pH小于4,B错误;C.完全反应生成强碱弱酸盐,溶液显碱性,最合适的指示剂是酚酞,正确;D. 滴定终点时,c(Na+)> c(A-)>c(OH-)>c(H+),错误。 8.下列有关中和滴定的部分操作顺序正确的是(B) ①标准溶液润洗滴定管②往滴定管中注入标准溶液③检查滴定管是否漏水④滴定 ⑤洗涤滴定管⑥调整滴定管中液面在“0”或“0”以下刻度⑦记数 A.⑤①②③④⑥⑦ B.③⑤①②⑥⑦④ C.③⑤②⑦①⑥④ D.②⑥⑦①③⑤④ 9.用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是(C ) A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗 B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗 C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失 D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确 10.常温下,将pH=3的某酸与pH=11的NaOH溶液等体积混合,混合后溶液的pH满足(D ) A. pH=7 B.pH≥7 C.pH>7 D.pH≤7 11.实验室用100mL 0.10mol/L盐酸去滴定100mL 0.10mol/L NaOH溶液,如果允许滴定误差为 ±0.1%,则滴定终点时溶液的pH值范围是(C) A.5~8 B.3.3~10.7 C.4.3~9.7 D.4.4~10 12.已知c(NH4Cl)<0.1mol/L时溶液pH>5.1,现在用0.1 mol/L HCl滴定10 mL 0.05 mol/L的氨水,用甲基橙作指示剂,达到终点时所用HCl的量应是(D) A.10 mL B.5 mL C.小于5 mL D.大于5 mL 解:已知c(NH4Cl)<0.1 mol·L-1时溶液pH>5.1,现在用0.1 mol·L-1HCl滴定10 mL 0.05 mol·L-1的氨水,当酸碱恰好反应时,要消耗5mL 0.1 mol·L-1盐酸,c(NH4Cl) <0.1 mol·L-1,溶液的pH>5.1。用甲基橙作指示剂,由于甲基橙的变色范围是3.1~4.4,故当达到终点时所用HCl的量应是大于5 mL,故选D。 13.实验室现有3种酸碱指示剂,其pH变色范围如下: 甲基橙:3.1~4.4;石蕊:5.0~8.0;酚酞:8.2~10.0 用0.10mol/L NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是(D) A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂 C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂 酸碱中和滴定实验误差分析 1.用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱 中和滴定。 2.酸碱中和反应的实质:H++OH-=H2O 公式:a. n(H +) =n(OH-) b. C(H+)V(H+)==C(OH-)V(OH-) 3.中和滴定过程中,容易产生误差的6个方面是: ①洗涤仪器(滴定管、移液管、锥形瓶); ②气泡; ③体积读数(仰视、俯视)俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。; ④指示剂选择不当; ⑤杂质的影响; ⑥操作(如用力过猛引起待测液外溅等)。 具体分析如下: (1)滴定前,在用蒸馏水洗涤滴定管后,未用标准液润洗。(偏高) (2)滴定前,滴定管尖端有气泡,滴定后气泡消失。(偏高) (3)滴定前,用待测液润洗锥形瓶。(偏高) (4)取待测液时,移液管用蒸馏水洗涤后,未用待测液润洗。(偏低) (5)取液时,移液管尖端的残留液吹入锥形瓶中。(偏高) (6)读取标准液的刻度时,滴定前平视,滴定后俯视。(偏低) (7)若用甲基橙作指示剂,最后一滴盐酸滴入使溶液由橙色变为红色。(偏高) (8)滴定过程中,锥形瓶振荡太剧烈,有少量溶液溅出。(偏低) (9)滴定后,滴定管尖端挂有液滴未滴入锥形瓶中。(偏高) (10)滴定前仰视读数,滴定后平视刻度读数。(偏低) (11)滴定过程中向锥形瓶内加入少量蒸馏水。(无影响) (12)滴定过程中,滴定管漏液。(偏高) (13)滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准溶液至锥形瓶中。(操作正确,无影响) (14)过早估计滴定终点。(偏低) (15)过晚估计滴定终点。(偏高) (16)一滴标准溶液附在锥形瓶壁上未洗下。(偏高) (上文所指偏高偏低抑或无影响是指待测酸碱浓度) 分析技巧:1.分析不当操作对公式中四个变量其中一个或多个的大小影响, 2.根据公式,分析对V标准液的影响,V标准液比理论偏大,则待测液浓度测量值比 实际值偏大,反之亦然。故而V 标准液 是我们考察的重点。 3.对于(11),分析向已经准确量取好的待测液中滴加入水,虽然改变了待测液 浓度和体积,但并不影响n 待测液,所以V 标准液 不变化,对测量结果无影响。 、解表药 1. 辛温解表药 麻黄:发汗、平喘、利水 桂枝:发汗解表、温经通阳 紫苏:发表散寒、行气宽中、解鱼蟹毒 荆芥:祛风解表、透疹止痒、(炭)止血 防风:祛风解表、胜湿、止痛、解痉 白芷:祛风解表、燥湿止带、消肿排脓、止痛 生姜:发汗解表、温中止呕、温肺止咳 香薷:发汗解表、和中化湿、利水消肿 羌活:解表散寒、祛风胜湿、止痛 辛夷:散风寒、通鼻窍 藁本:发表散寒、祛风胜湿、止痛 苍耳子:散风寒、通鼻窍、祛风湿、止痛 2. 辛凉解表药 薄荷:疏散风热、清利头目、利咽、透疹 蝉蜕:疏风热、透疹、明目退翳、息风止痉 桑叶:疏风清热、清肝明目 菊花:疏风清热、解毒、明目、平肝 葛根:发表解肌、升阳透疹、解热生津 柴胡:和解退热、疏肝解郁、升举阳气 牛蒡子:疏散风热、解毒透疹、利咽散肿升麻:发表透疹、清热解毒、升阳举陷 蔓荆子:疏散风热、清利头目 淡豆豉:解表、除烦 二、清热药 1. 清热泻火药 石膏:清热泻火、除烦止渴、收敛生肌 知母:清热泻火、滋阴润燥 栀子:泻火除烦、清热利湿、凉血解毒、消肿止痛夏枯草:清肝火、散郁结、降血压 芦根:清热生津、止呕、除烦、利尿 天花粉:清热生津、消肿排脓 淡竹叶:清热除烦、利尿 2. 清热燥湿药 黄苓:清热燥湿、泻火解毒、止血安胎 黄连:清热燥湿、泻火解毒 黄柏:清热燥湿、泻火解毒、退虚热 龙胆草:清热燥湿、泻肝火 苦参:清热燥湿、祛风杀虫、利尿 3. 清热凉血药 生地黄:清热凉血、养阴生津、止血 玄参:清热凉血、解毒、养阴 牡丹皮:清热凉血、活血散瘀、退虚热 赤芍:清热凉血、祛瘀止痛水牛角:清热、凉血、解毒 紫草:凉血活血、解毒透疹 4. 清热解毒药 金银花:清热解毒、疏散风热、清热解暑(露)连翘:清热解毒、疏散风热、消痈散结 蒲公英:清热解毒、利湿 大青叶:清热解毒、凉血清斑 牛黄:清热解毒、息风止痉、化痰开窍 鱼腥草:清热解毒、排脓、利尿 射干:清热解毒、祛痰利咽 白头翁:清热、解毒、凉血 板兰根:清热解毒、凉血、利咽 青黛:清热解毒、凉血散肿 土茯苓:解毒、除湿、利关节 山豆根:清热解毒、利咽喉、散肿止痛 白花蛇舌草:清热、利湿、解毒、消痈 紫花地丁:清热解毒 穿心莲:清热解毒、燥湿 马齿苋:清热解毒、凉血止血 马勃:清肺、利咽、解毒、止血 秦皮:清热解毒、清肝明目 白鲜皮:清热解毒、除湿、止痒 鸦胆子:清热解毒、截疟治痢、(外)腐蚀赘疣 酸碱中与滴定知识梳理 一、中与反应及中与滴定原理 1、中与反应:酸+碱(正)盐+水 注意:酸与碱恰好完全中与,溶液不一定呈中性,由生成得盐性质而定(盐类水解)。 2、中与滴定原理(只研究一元强酸与一元强碱得中与反应) 由于酸、碱发生中与反应时,反应物间按一定得物质得量之比进行,基于此,可用滴定得方法确定未知酸或碱得浓度。 对于反应: HA +BOH====BA+H2O 1mol 1mol C(HA)、V(HA)C(BOH)、V(BOH) 即可得C(HA)、V(HA)=== C(BOH)、V(BOH) 若取一定量得HA溶液(V足),用标准液BOH[已知准确浓度C(标)]来滴定,至终点时消耗标准液得体积可读出(V读)代入上式即可计算得C(HA) 若酸滴定碱,与此同理 3、滴定方法得关键 (1)准确测定两种反应物得溶液体积 (2)确保标准液、待测液浓度得准确 (3)滴定终点得准确判定(包括指示剂得合理选用) 4、滴定实验所用得仪器与注意事项 (1)仪器:酸式滴定管、碱式滴定管、滴定管夹(配铁架台,并垫白纸作背景增加对比度,以便于观察溶液颜色变化)、锥形瓶 滴定管得构造特点(与量筒区别) 1、滴定管分酸式滴定管;碱式滴定管 酸式滴定管-------玻璃活塞-------量取或滴定酸溶液或强氧化性试剂; 酸式滴定管不得用于装碱性溶液,因为玻璃得磨口部分易被碱性溶液侵蚀,生成有粘性得硅酸钠,使塞子无法转动。(玻璃得主要成份为SiO2 属于酸性氧化物。 酸性氧化物+碱→盐+水,即SiO2+2NaOH = Na2SiO3+H2O 瓶口内侧与瓶塞都就是经过磨砂处理得,表面粗糙,造成碱性得液体容易滞留,并且水分蒸发,碱液浓度增大,促使二者更易反应。其她部位因表面光滑而难于反应) 碱式滴定管-------橡胶管+内嵌玻璃珠(玻璃珠直径稍大于橡胶管内径)-------量取或滴定碱性溶液(可以就是氢氧化钠这类强碱,也可以就是碳酸钠这类水解呈碱性得盐);不宜于装对橡皮管有侵蚀性得溶液,如强酸、碘、高锰酸钾、硝酸银等。 2、刻度上边得小(有0刻度),下边得大。要注意滴定管得刻度,0刻度在上,往下越来越大,全部容积大于它得最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度。滴定管得下部尖嘴内液体不在刻度内,量取或滴定溶液时不能将尖嘴内得液体放出。 注:量筒无0刻度,因为对于量筒来说,只要没有加入液体,体积即为0,0刻度对量筒无意义,刻度上边得大,下边得小。 3、精确度就是百分之一。即可精确到0、01ml 一、解表药 1.辛温解表药 麻黄:发汗、平喘、利水 桂枝:发汗解表、温经通阳 紫苏:发表散寒、行气宽中、解鱼蟹毒 荆芥:祛风解表、透疹止痒、(炭)止血 防风:祛风解表、胜湿、止痛、解痉 白芷:祛风解表、燥湿止带、消肿排脓、止痛生姜:发汗解表、温中止呕、温肺止咳 香薷:发汗解表、和中化湿、利水消肿 羌活:解表散寒、祛风胜湿、止痛 辛夷:散风寒、通鼻窍 藁本:发表散寒、祛风胜湿、止痛 苍耳子:散风寒、通鼻窍、祛风湿、止痛 2.辛凉解表药 薄荷:疏散风热、清利头目、利咽、透疹蝉蜕:疏风热、透疹、明目退翳、息风止痉桑叶:疏风清热、清肝明目 菊花:疏风清热、解毒、明目、平肝 葛根:发表解肌、升阳透疹、解热生津 柴胡:和解退热、疏肝解郁、升举阳气 牛蒡子:疏散风热、解毒透疹、利咽散肿升麻:发表透疹、清热解毒、升阳举陷 蔓荆子:疏散风热、清利头目 淡豆豉:解表、除烦 二、清热药 1.清热泻火药 石膏:清热泻火、除烦止渴、收敛生肌 知母:清热泻火、滋阴润燥 栀子:泻火除烦、清热利湿、凉血解毒、消肿止痛夏枯草:清肝火、散郁结、降血压 芦根:清热生津、止呕、除烦、利尿 天花粉:清热生津、消肿排脓 淡竹叶:清热除烦、利尿 2.清热燥湿药 黄芩:清热燥湿、泻火解毒、止血安胎 黄连:清热燥湿、泻火解毒 黄柏:清热燥湿、泻火解毒、退虚热 龙胆草:清热燥湿、泻肝火 苦参:清热燥湿、祛风杀虫、利尿 3.清热凉血药 生地黄:清热凉血、养阴生津、止血 玄参:清热凉血、解毒、养阴 牡丹皮:清热凉血、活血散瘀、退虚热 赤芍:清热凉血、祛瘀止痛 水牛角:清热、凉血、解毒 紫草:凉血活血、解毒透疹 4.清热解毒药 金银花:清热解毒、疏散风热、清热解暑(露)连翘:清热解毒、疏散风热、消痈散结 蒲公英:清热解毒、利湿 大青叶:清热解毒、凉血清斑 牛黄:清热解毒、息风止痉、化痰开窍 鱼腥草:清热解毒、排脓、利尿 射干:清热解毒、祛痰利咽 白头翁:清热、解毒、凉血 板兰根:清热解毒、凉血、利咽 青黛:清热解毒、凉血散肿 实验——酸碱中和滴定 【学习目标】 ①掌握酸碱中和滴定的原理及反应实质。 ②学会酸碱中和滴的操作方法步骤和指示剂的选择。所使用的仪器名称和特点、对仪器洗涤的要求。 ③能正确分析实验操作中的误差 【知识回顾】 【知识点1】中和滴定的概念及原理 1.概念:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法。 2.实质:中和反应。 3.关键:①准确测定标准液和待测溶液的体积; ②准确判断:反应的终点。 【知识点2】滴定管 ①酸式滴定管——酸性或具有氧化性的物质, 碱式滴定管——碱性或具有还原性的物质。 ②精确度——0.01ml ③洗涤——滴定管在使用前经检查后要进行洗涤,须先用蒸馏水,然后再用待盛液润洗2~3次。但锥形瓶用蒸馏水洗净后不能再用待盛液润洗,否则将会引起误差。 【知识点3】中和滴定的仪器和药品 1.仪器:酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、烧杯等 2.试剂:标准液、待测液、指示剂; 【知识点4】指示剂的选择: 变色要灵敏、明显, 一般强酸滴定强碱用指示剂选用酚酞。 中和滴定,肯定不用石蕊 【知识点4】中和滴定的操作(以标准盐酸滴定NaOH为例) 1.准备:①洗涤②查漏③润洗④装液体⑤排气泡 ⑥调整液面⑦读数 2.滴定:①量取待测液并加指示剂②滴定至终点并读数 ③重复操作三次④计算 【注意】 ①滴定时在瓶底垫一张白纸; ②滴定时左手控制旋钮、右手振荡锥形瓶、目光注视锥形瓶内溶液颜色变化。 ③锥形瓶:只用蒸馏水洗涤,不能用待测液润洗 ④先快后慢,当接近终点时,应一滴一摇 ⑤注入标准液至“0”刻度上方2~3cm处,将液面调节到“0”刻度(或“0”刻度以下某一刻度) 【知识点5】滴定终点判断 当最后一滴刚好使指示剂颜色发生明显的改变而且半分钟内不恢复原来的颜色,即为滴定终点。 【知识点6】中和滴定的误差分析 1原理:c(待)=, c(待)的大小取决于V(标)的大小,V(标)大,则c(待)大,V(标)小,则c(待)小。 【练习】 1.下列有关滴定操作的顺序正确的是() ①用标准溶液润洗滴定管②往滴定管内注入标准溶液 ③检查滴定管是否漏水④滴定⑤洗涤 A.⑤①②③④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④2.现用0.10 mol·L-1的盐酸滴定10 mL 0.05 mol·L-1的NaOH溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是() A.10 mL B.5 mL C.大于5 mL D.小于5 mL 3.某稀NaOH溶液的浓度大约在0.07—0.08 mol·L-1之间,实验室现有①0.1 mol·L-1②1.0 mol·L-1③5.0 mol·L-1的三种标准盐酸,若要通过中和滴定法确定氢氧化钠的准确浓度,则应选用的标准盐酸是() A.① B.② C.③ D.①②③均可 4.实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作可能使测定结果偏低的是() A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次 B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 C.锥形瓶内溶液颜色变化由黄色变橙色时,立即记下滴定管液面所在刻度 D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2—3次 5.用已知浓度的盐酸来测定某Na2CO3溶液的浓度时,若配制Na2CO3溶液时所用Na2CO3中分别含有:①NaOH ②NaCl ③NaHCO3④K2CO3杂质,所测结果偏低的是() A.仅① B.仅② C.②③ D.②③④ 6.有①②③三瓶体积相等、浓度都是1 mol·L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液的体积是( ) A.①=③>② B.③>②>① C.③=②>① D.①=②=③ 7.右图是滴定前后液面所处的刻度,则消耗溶液的体积为A.V1 mL B.V2mL C.(V2-V1)mL D.(V1- V2) mL 8.图10-2为10 mL一定物质的量浓度的盐酸x,用一定浓度的NaOH溶液y滴定的图示,依图示推出x和y的物质的 量浓度正确的是( 向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用KMnO4某酸性溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4mol· L-1的KMnO4溶液。 (1)写出用KMnO4滴定H2C2O4的离子方程式 _______________________。 (2)判断滴定终点的方法是 ________________________________________。 酸碱中和滴定原理的计算 酸碱中和滴定原理: 在中和反应中使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶液完全中和,测出二者所用的体积,根据化学方程式中酸碱物质的量比求出未知溶液的物质的量浓度。根据酸碱中和反应的实质是: H++OH-=H2O C酸V酸=C碱V碱或:C未知V未知=C标准V标准,或 一、简单酸碱中和滴定 1.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞 (B)用标准溶液润洗滴定管2-3次 (C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液 (D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm (E)调节液面至0或0刻度以下,记下读数 (F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度 若滴定开始和结束时,碱式滴定管中的液面如图所示, 则起始读数为________mL,终点读数为_______________________ mL; 所用盐酸溶液的体积为____________mL. 0.00 25.90 根据C酸V酸=C碱V碱可得盐酸溶液的体积25.90mL. 2.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为:某学生根据三次实验分别记录有关数据如下表: 实验编号KOH溶液的 浓度/mol·L-1 滴定完成时,KOH溶液滴 入的体积/mL 待测盐的体积/mL酸 1 0.10 22.6 2 20.00 2 0.10 22.72 20.00 3 0.10 22.80 20.00 列式计算该盐酸溶液的物质的量浓度:c(HCl)=。 根据C酸V酸=C碱V碱,混合碱的体积为(22.62+22.72+22.80)/3=22.71mL,可得盐酸溶液的浓度为0.1136 mol/L 3.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂某同学根据3次实验分别记录有关数据如下表:依据下表数据列式计算该NaOH 溶液的物质的量浓度。 滴定次数待测NaOH 体积/mL 0.1000mol/L盐酸的 体积/mL 滴定前滴定后溶液体 酸碱中和滴定及应用 一、概念:用已知物质的量的浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶 液)的方法叫做酸碱中和滴定。 二、原理:在中和反应中,使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶液 完全中和,测出二者所用的体积,根据化学方程式中酸碱物质的量比求出未知溶液的物质的量浓度。 反应实质:H ++OH-=H 2O 在滴定达到终点(即酸碱恰好反应)时: 有n(H+)=n(OH-) 即c酸V酸=c碱V碱 三.滴定的关键 ①准确测定参加反应的两种溶液的体积(所用的仪器是滴定管) ②准确判断中和反应是否恰好完全反应,即滴定终点(借助酸碱指示剂) 四、酸碱中和滴定指示剂的选择 ⑴选取指示剂的原则:①终点时,指示剂的颜色变化明显、灵敏 ②变色范围与终点pH接近 NaOH(ml) 0.00 10.00 15.00 18.00 19.00 19.96 20.00 20.04 21.00 22.00 30.00 溶液pH 1.0 1.5 1.8 2.3 2.6 4.0 7.0 10.0 11.4 11.7 12.3 ⑵ 指示剂对应溶液的颜色变色范围 甲基橙橙色红3.1橙4.4黄 酚酞无色无8浅红10红 紫色石蕊紫色红5 紫8蓝 ①强酸强碱间的滴定:酚酞溶液或甲基橙均可,一般不选用石蕊(变色不明显) ②强酸滴定弱碱:生成强酸弱碱盐溶液呈酸性,选用甲基橙作指示剂 ③强碱滴定弱酸:生成强碱弱酸盐溶液呈碱性,选用酚酞作指示剂 ④通常选用颜色有浅变深的指示剂 (3 指示剂 酚酞甲基橙 操作 强碱滴定强酸无色变为浅红色橙色变为黄色 强酸滴定强碱浅红色变为无色黄色变为橙色 五.中和滴定的实验仪器和试剂 ⑴中和滴定所用的实验仪器: 酸式滴定管,碱式滴定管,滴定管夹,铁架台,锥形瓶,烧杯、(白纸)等。 ⑵酸(碱)式滴定管 ①结构特点: a.酸式玻璃活塞盛酸性溶液及碘水、溴水、高锰酸钾、双氧水等强氧化 性的溶液(不能盛放碱液、水解呈碱性的盐溶液、HF) 碱式橡皮管玻璃球盛碱性溶液(不宜于装酸性溶液,也不能装碘水、 溴水、高锰酸钾、双氧水等强氧化性的溶液) b.有温度,零刻度在上方,最大刻度在下,最小刻度0.1mL,精确度0.01 mL ②规格:25ml 50ml等 ③用途:中和滴定(精确测定);精确量取溶液的体积(两次读数差) (3) 使用注意: a.滴定管应先检查是否漏水(方法),再用蒸馏水洗涤,最后用待盛溶液润洗。 b.酸式滴定管:用于装酸性溶液,及碘水、溴水、高锰酸钾、双氧水等强氧化性的溶液。不得用于装碱性溶液,因 为玻璃的磨口部分易被碱性溶液侵蚀,使塞子无法转动,也不能装氢氟酸。 c.碱式滴定管:用于装碱性溶液,不宜于装酸性溶液,也不能装碘水、溴水、高锰酸钾、双氧水等强氧化性的溶液。 d.锥形瓶:是进行中和滴定的反应容器。使用前只须用蒸馏水洗净即可,也不必干燥,里面留有少量蒸馏水不影响实验结果。无须用待测液润洗。 六、中和滴定的基本操作和步骤(标准液:盐酸;待测液:氢氧化钠溶液) (1)检漏:使用前先检查滴定管是否漏水。(方法) (2)洗涤: 滴定管:先用蒸馏水洗净后,然后分别用少量标准液和待测液分别润洗相应的滴定管2-3次;原则:少量多次。 语文课本中的文章都是精选的比较优秀的文章,还有不少名家名篇。如果有选择循序渐进地让学生背诵一些优秀篇目、精彩段落,对提高学生的水平会大有裨益。现在,不少语文教师在分析课文时,把文章解体的支离破碎,总在文章的技巧方面下功夫。结果教师费劲,学生头疼。分析完之后,学生收效甚微,没过几天便忘的一干二净。造成这种事倍功半的尴尬局面的关键就是对文章读的不熟。常言道“书读百遍,其义自见”,如果有目的、有计划地引导学生反复阅读课文,或细读、默读、跳读,或听读、范读、轮读、分角色朗读,学生便可以在读中自然领悟文章的思想内容和写作技巧,可以在读中自然加强语感,增强语言的感受力。久而久之,这种思想内容、写作技巧和语感就会自然渗透到学生的语言意识之中,就会在写作中自觉不自觉地加 以运用、创造和发展。 “师”之概念,大体是从先秦时期的“师长、师傅、先生”而来。其中“师傅”更早则意指春秋时国君的老师。《说文解字》中有注曰:“师教人以道者之称也”。“师”之含义,现在泛指从事教育工作或是传授知识技术也或是某方面有特长值得学习者。 “老师”的原意并非由“老”而形容“师”。“老”在旧语义中也是一种尊称,隐喻年长且学识渊博者。“老”“师”连用最初见于《史记》,有“荀卿最为老师”之说法。慢慢“老师”之说也不再有年龄的限制,老少皆可适用。只是司马迁笔下的“老师”当然不是今日意义上的“教师”,其只是“老”和“师”的复合构词,所表达的含义多指对知识渊博者的一种尊称,虽能从其身上学以“道”,但其不一定是知识的传播者。今天看来,“教师”的必要条件不光是拥有知识,更重于传播知识。【选修四】高中化学必备知识点:3.2.4酸碱中和滴定 《酸碱中和滴定》学案 学习目标: 1.了解酸、碱滴定管的结构特点和使用方法。 2.理解中和滴定的原理,能够绘制中和滴定过程中PH变化的曲线。 3.经历中和滴定的过程,知道中和滴定的步骤,掌握中和滴定的实验操作。 4.在理解中和滴定原理的基础上,掌握实验误差分析策略。 学习重点:中和滴定的基本实验操作 学习难点:实验误差分析 教学过程: 【问题一】——酸碱中和反应 1.酸碱中和反应的实质是什么? 2.简单计算,完全中和20mL 0.1mol/L HCl,需mL0.5mol/L NaOH(aq); 完全中和20mL 0.1mol/L HCl,需10 mL mol/L NaOH(aq);若改为20mL 0.1mol/L H2SO4,则答案如何? 3、总结酸碱中和反应中酸碱浓度与体积关系的计算式 【问题二】——酸碱中和滴定 1、已知某酸(碱)浓度,如何来测定未知碱(酸)浓度? 2、依据原理是什么?实验过程中需要测定的数据有哪些? 3、精确测定溶液体积 1)掌握滴定管的结构和使用方法 a 酸碱滴定管的结构——注意刻度和酸碱式区别以及与量筒的对比 b使用方法 c滴定管在使用前需要洗涤,并用清水润洗2-3次,在装酸液/碱液之前,必须用待盛液体润洗,思考,如果不润洗会导致什么结果? 2)了解移液管的使用※ 4、怎么确定滴定终点(酸碱恰好完全反应)? 记忆常见酸碱指示剂变色范围 5、实验步骤 6、简单计算 常温下,50mL水中,加1滴(1mL为20滴)0.1mol/L HCl,溶液pH= ; 若改为加0.1mol/L NaOH,结果又如何? 7、思考,酸碱中和滴定终点时,是恰好pH=7吗?你如何理解这个问题的? 8:、误差分析 1)为什么要用待盛液润洗滴定管?怎么润洗? 2)为什么要排尽玻璃尖嘴管中的气泡,怎样操作? 3)滴定过程中用_______手控制活塞,用________手摇动锥形瓶,眼睛应注视__________ 解表药 一.发散风寒药 ★麻黄 [ 宣肺平喘,利水消肿,(表实无汗) ★桂枝 [(解肌)温通经脉,助阳化气,(表实无汗,表虚有汗) ★紫苏 [ 行气宽中,(行气安胎) 发汗解表解鱼蟹毒 ▲生姜 [ 温中止呕,温肺止咳,(解药毒) ▲香薷 [ 化湿和中,利水消肿,(阴暑证,夏月之麻黄) ★荆芥 [ 透疹消疮,炒炭止血 ★防风发表散风 [ 渗湿止痛,止痉,止泻 ★白芷 [ 止痛,通鼻窍,消肿排脓,燥湿止带,(阳明头痛——前额头痛) ★羌活 渗湿止痛,(太阳头痛——巅顶头痛) ▲藁本散寒祛风 ▲细辛 [ 通鼻窍,止痛,温肺化饮,(阳虚外感;煎服2-5g,入丸散0.5-1g) ▲苍耳子 [ 散风除湿,止痛 通鼻窍 ▲辛夷 [ 发散风寒(木笔花,春花;包煎) 二.发散风热药 ★薄荷 [ 清利头目,疏肝解郁,(后下;3-6g) ★牛蒡子利咽,透疹 [ 解毒消肿,(大力子,鼠粘子,恶实) ▲蝉蜕 [(开音,治音哑),明目退翳,止痉 ★桑叶疏散风热 [ 清肺润燥 ★菊花平肝明目 [ 清热解毒(黄菊花——疏散风热,白菊花—— 平肝明目) ▲蔓荆子 [ 清利头目,(太阳头痛) ★柴胡 [(疏散),疏肝解郁,(升阳举陷——中气下 退热陷,内脏下垂等;邪在少阳,寒热往来) ★葛根解表升阳 [(解肌),止泻,透疹,生津止渴,(升阳止 泻——清阳不升之泄泻等) ▲升麻 [ 透疹,清热解毒,(升阳举陷) 淡豆豉[ 除烦 比较:麻黄与桂枝;紫苏与生姜;麻黄与香薷;羌活与白芷; 薄荷、牛蒡子与蝉蜕;柴胡与葛根 清热药 一.清热泻火药 ★石膏 [ 除烦止渴,(气分实热要药),清肺胃热,收敛生肌,(煅后外用)清热泻火 酸碱中和滴定知识点-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN 实验——酸碱中和滴定 【知识点1】酸碱中和滴定的概念及原理 1、概念:用已知浓度的酸(或碱)滴定未知浓度的碱(或酸)溶液的方法称为酸碱中和滴定。 2、原理:酸提供的H+和碱提供的OH-恰好完全反应 3、中和反应的实质:H++ OH-=H2O(等物质的量反应)。 定量关系:n(H+)=n(OH-) 若是一元酸和一元碱反应,则有 n酸=n碱,C酸. V酸 = C碱. V碱 【知识点2】酸碱中和滴定管 1、两种滴定管构造上的不同点:上端标注有________,_________, ___________。 酸式滴定管---玻璃活塞,用于装______, _______,______溶液 碱式滴定管---带有玻璃球的橡胶管,用于装_______ 溶液 2、滴定管的读数方法:0刻度在上,从上往下 读,最大量程有25mL、50mL等,注意与量筒(无0 刻度)比较; 3、精确度:,取到小数点后两位,如:、最后一 位是估计值(注意与量筒()比较)。 4、滴定管的洗涤:先用蒸馏水洗涤,再用标准液 (或待测液)来润洗。 5、滴定管的固定:垂直于桌面,高度以滴定管尖伸入锥形瓶约1cm为宜。 6、滴定时,左手控制活塞、右手摇动锥形瓶,眼睛注视锥形瓶内液体的颜色变化。 7、滴定终点的判断:当最后一滴液体滴下后,锥形瓶内溶液颜色发生变化,且在半分钟内不变色,说明达到滴定终点。 8、再次进行滴定时,一定要将滴定管内液体重新注入至0刻度处,以免滴定时液体不足。 9、实际滴出的溶液体积=滴定后的读数-滴定前的读数 【知识点3】酸碱指示剂的选择 指示剂变色范围的pH 石蕊<5红色5~8________>8蓝色 甲基橙<~橙色>黄色 酚酞<8无色8~10________>10____ A、指示剂的pH变色范围尽可能接近中和时的pH B、颜色变化明显。 常用中和滴定指示剂:_______ ________ ③指示剂的用量:________滴 ④滴定终点确定:指示剂的颜色发生突变并且半分钟不变色即达到滴定终点。【知识点4】酸碱中和滴定操作 考点过关(中)考点9 酸碱中和滴定及应用 酸碱中和滴定是高中化学最重要的定量实验之一,在科学实验中占重要地位,它的原理和操作方法可以扩展到氧化还原滴定和沉淀滴定,中和滴定原理是熟悉的酸碱中和反应,由于酸碱中和反应与日常生活及实验室工作联系非常密切应用性强,所以常以酸碱中和反应原理为切入点,考查水解平衡和电离平衡理论的运用,其实验操作、仪器使用、指示剂选择、滴定终点判断、误差分析、定量计算等知识既是学习的重点,也是学习的难点。以酸碱中和滴定曲线为载体,全面考查电解质溶液和化学学科守恒的思想观念,已经成了近几年高考频繁出题的新热点。 酸碱中和反应的实质可用离子方程式H ++OH -=H 2O 来表示,在中和反应中,H +、OH -之间的物质的量关系是n (H +)=n (OH -);若用参加反应的c (H +)、c (OH -)来表示,其关系式为c (H +)·V 酸=c (OH -)·V 碱,由此可计算c (H +),其表达式是c (H +)=c -V 碱 V 酸;也可计算c (OH -),其表达式是c (OH -)=c +V 酸V 碱。由c (H + )、c (OH -)可分别求出相应酸、碱的浓度。中和滴定的关键是准确判断滴定终点(中和反应恰好反应完全的时刻),指示剂的选择不但要考虑变色明显、灵敏,而且要选择指示剂的变色范围与滴定时pH 突跃范围相吻合,这样就能准确指示到达滴定终点(即酸碱恰好中和时的pH)。其方法是在待测液中加2~3滴指示剂,观察滴定过程中其颜色的变化,常选用的指示剂是酚酞或甲基橙,不用石蕊试液的原因是石蕊试液颜色变化不明显。酸碱中和滴定所用的主要仪器是锥形瓶和滴定管,酸式滴定管包括玻璃活塞、长玻璃管,可盛放酸性溶液、强氧化性溶液,不能盛放碱性溶液及氢氟酸,碱式滴定管包括长玻璃管、橡皮管、玻璃球,可盛放碱性溶液。滴定管的上端都标有规格大小、使用温度、0刻度,滴定管的精确读数为0.01mL 。滴定管使用前先检查滴定管活塞是否漏水,在加入反应液之前,洁净的滴定管要用所要盛装的溶液润洗2~3遍。 【例题1】下面是关于酸碱中和滴定实验操作的叙述:①取一锥形瓶,用待测NaOH 溶液润洗两次;②在一锥形瓶中加入25.00 mL 待测NaOH 溶液;③加入几滴石蕊试剂作指示剂;④取一支酸式滴定管,洗涤干净;⑤直接往酸式滴定管中注入标准酸溶液,进行滴定;⑧左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶;⑦两眼注视着滴定管内盐酸液面变化,直至滴定终点。其中叙述错误.. 的是( ) A.④⑥⑦ B.①⑤⑥⑦C.③⑤⑦ D.①③⑤⑦ 酸碱中和滴定的实验步骤可以提炼为6个关键字。洗(洗涤):洗涤仪器并进行检漏、润洗;取(取液):向酸(碱)式滴定管中注入标准液,向锥形瓶中注入待测液,加入2~3滴指示剂;滴(滴定):在锥形瓶下垫一张白纸,向锥形瓶中先快后慢地加入标准液(后面逐滴加入),至指示剂发生明显的颜色变化(如由红色变 酸碱中和滴定实验误差分析 上传: 何琼华更新时间:2012-5-19 20:47:38 酸碱中和滴定是中学化学实验中的重要定量实验,特别是其实验误差分析是学生学习和掌握本实验的重点和难点。在教学中,学生遇到有关实验误差分析总会出现困惑,直接影响到学生对实验结果的准确判断和相关问题的解决。为了突破这一教学难点,在教学中,首先引导学生从酸碱中和滴定原理入手,理解中和滴定原理,即:酸提供的H+的物质的量与碱提供的OH-的物质的量相等。然后把原理公式化,即:C(待)=n·C(标)·V(标)/V(待)(n表示酸碱反应的物质的量之比)。其次在误差分析中,明确公式中的n、V(待)和C(标)均为确定量,只有V(标)是变量,C(待)和V(标)成正,实验中引起的各种误差,只要造成V(标)偏大的所得C(待)都偏高,反之偏低。把引起误差因素最终归结到V(标)的变化上,再进行实验误差分析。根据引起误差的原因,对常见的分类归纳分析如下: 一、仪器洗涤不当 酸碱中和滴定实验中,滴定管、移液管和锥形瓶都要用蒸馏水洗净,且滴定管、移液管还要用待装液润洗2∽3次,锥形瓶不润洗。若洗涤不当就会引起误差,如: 1、滴定管蒸馏水洗后未用标准液润洗,就直接装入标准液,造成标准液稀释,溶液浓度降低,滴定中消耗V(标)偏大,C(待)偏高。 2、盛待测液滴定管或移液管水洗后,未用待测液润洗就取液加入锥形瓶,造成待测液被稀释,V(标)偏小,C(待)偏低。 3、锥形瓶水洗后,又用待测液润洗,再取待测液,造成V(标)偏大,C(待)偏高。 4、滴定前,锥形瓶用水洗涤后,或锥形瓶中残留水未干燥,或取完待测液后再向锥形瓶中加点水便于观察,虽然V(待)增大,但C(待)变小,其物质的量不变, 无影响。 二、读数不当 在读数时,应将滴定管直立在水平面上,两眼平视,视线与液面凹面最低处水平相切。若读数不当就会引起误差,如: 1、盛标准液的滴定管,滴定前仰视滴定管读数,滴定后平视滴定管读数, 造成V(标)减小,C(待)偏低。 2、盛标准液的滴定管,滴定前平视滴定管刻度线,滴定终了仰视刻度线,读数偏大,造成V(标)偏大,C(待)偏高。 发散风寒:麻黄桂枝并葱白,香薷防风及荆芥,紫苏姜羌白芷辛,苍耳藁本及辛夷。 发散风热:薄荷蔓荆牛蒡子,蝉蜕桑菊与浮萍,柴葛升麻淡豆豉。 清热泻火:石膏知母及栀子,芦根竹叶天花粉,夏枯决明密蒙花。 清热燥湿:三黄苦参龙胆草,秦皮外加白鲜皮。 清热解毒:金银野菊翘蒲公,紫花地丁穿心莲,大青叶合并青黛,板蓝马勃及射干,白头马齿苋贯众,鱼腥草合败酱草,山豆蚤休土茯苓,熊胆漏芦山慈菇红藤,白花半边 鸦胆子。 清热凉血:生地玄参水牛角,丹皮赤芍及紫草。 清虚热:青蒿地骨皮白薇,银柴胡合胡黄连。 攻下药:大黄芒硝番芦荟。润下药:火麻仁合郁李仁。 峻下逐水药:甘遂大戟配芫花,商陆巴豆牵牛子。 祛风寒湿:独活川乌与草乌,木瓜威灵仙海棠,乌梢蕲蛇海风藤。 祛风湿热:秦艽梧桐络石腾,雷公藤并海桶皮,豨莶草桑枝防己。 祛风湿强筋骨:五加桑寄生狗脊。 化湿专治湿浊阻,苍术厚朴佩藿香,白草豆蔻砂草果。 利水消肿药:猪苓茯苓薏苡仁,泽泻合并香加皮。 利尿通淋药:车前通草合木通,瞿麦冬葵灯心草,滑石石韦合萆薢,海金萹蓄地肤子。 利湿退黄药:茵陈金钱杖珠草。 温里主治里寒证,附子干姜桂吴萸,高良丁香小茴香,花椒茇橙茄胡椒。 陈青枳实并枳壳,薤白合并大腹皮,木香乌药沉檀香,荔枝川楝青木香,香附佛手及香橼,绿萼梅及玫瑰花,柿蒂并刀豆。 消食药:山楂莱菔鸡内金,麦芽神曲及谷芽。 驱虫药:使君雷丸槟榧子,南瓜鹤草苦楝皮。 凉血止血:大小地榆苎麻根,槐花白茅侧柏叶。 化瘀止血:三七茜草及蒲黄,降香合并花蕊石。 收敛止血:白及紫珠仙鹤草,棕桐碳合血余碳。 温经止血:艾叶炮姜灶心土。 活血止痛:川芎延胡索郁金,姜黄乳香及没药,五灵脂合夏天无。 活血调经:丹参益母草泽兰,鸡血红花配牛膝。桃仁合并不留行。 活血疗伤:血竭儿茶苏碎补,土鳖自然马钱奴,三棱莪术穿山甲,水蛭虻虫及斑鳖。 温化寒痰:半夏天南白芥子,白前旋覆皂白附。 清热化痰:贝母瓜蒌胖大海,天竺胆南竹沥茹,前胡礞石桔梗,海藻昆布黄药子,海浮石并海蛤壳。 止咳平喘:苦杏紫苏马金花,紫苑款冬百枇杷,葶苈桑白皮白果。 重症安神:朱砂琥珀磁龙骨。 养心安神:酸枣柏子夜交藤,灵芝合欢皮远志。 平抑肝阳:石决珍珠代赭石,牡蛎罗布麻蒺藜。 息风止痉:羚角牛黄钩天麻,全蝎蜈蚣蚕地龙。 开窍药:麝香苏合冰菖蒲。 补气药:太子刺五加白术,绞蓝甘景天沙棘,大枣黄芪白扁豆,西洋党人参山药。 补血药:当归龙眼何首乌,熟地阿胶及白芍。 补阴药:南北沙参斛天冬,麦冬百合及黄精,玉竹桑椹龟鳖甲,枸杞女贞墨旱莲。 补阳药:淫羊巴戟天仙茅,肉苁锁阳补骨脂,鹿菟丝沙紫河车,蛤蚧冬虫核桃仁,杜仲续断益智仁。 酸碱中和滴定知识梳理 一、中和反应及中和滴定原理 1、中和反应:酸+碱 (正)盐+水 注意:酸和碱恰好完全中和,溶液不一定呈中性,由生成的盐性质而定(盐类水解)。 2、中和滴定原理(只研究一元强酸与一元强碱的中和反应) 由于酸、碱发生中和反应时,反应物间按一定的物质的量之比进行,基于此,可用滴定的方法确定未知酸或碱的浓度。 对于反应: HA + BOH====BA+H 2O 1mol 1mol C (HA).V (HA) C (BOH).V (BOH) 即可得 C (HA).V (HA)=== C (BOH).V (BOH) )HA () BOH ()BOH ()HA (V V .C C = 若取一定量的HA 溶液(V 足),用标准液BOH[已知准确浓度C (标)]来滴定,至终点时消耗标准液的体积可读出(V 读)代入上式即可计算得C (HA ) 定读 标V V .C C )HA (= 若酸滴定碱,与此同理 3、滴定方法的关键 (1)准确测定两种反应物的溶液体积 (2)确保标准液、待测液浓度的准确 (3)滴定终点的准确判定(包括指示剂的合理选用) 4、滴定实验所用的仪器和注意事项 (1)仪器:酸式滴定管、碱式滴定管、滴定管夹(配铁架台,并垫白纸作背景增加对比度,以便于观察溶液颜色变化)、锥形瓶 滴定管的构造特点(与量筒区别) 1、滴定管分酸式滴定管;碱式滴定管 酸式滴定管-------玻璃活塞-------量取或滴定酸溶液或强氧化性试剂; 酸式滴定管不得用于装碱性溶液,因为玻璃的磨口部分易被碱性溶液侵蚀,生成有粘性的硅酸钠,使塞子无法转动。(玻璃的主要成份为SiO 2 属于酸性氧化物。 酸性氧化物+碱→盐+水,即SiO 2+2NaOH = Na 2SiO 3+H 2O 瓶口内侧与瓶塞都是经过磨砂处理的,表面粗糙,造成碱性的液体容易滞留,并且水分蒸发,碱液浓度增大,促使二者更易反应。其他部位因表面光滑而难于反应) 碱式滴定管-------橡胶管+内嵌玻璃珠(玻璃珠直径稍大于橡胶管内径)-------量取或滴定碱性溶液(可以是氢氧化钠这类强碱,也可以是碳酸钠这类水解呈碱性的盐);不宜于装对橡皮管有侵蚀性的溶液,如强酸、碘、高锰酸钾、硝酸银等。 2、刻度上边的小(有0刻度),下边的大。要注意滴定管的刻度,0刻度在上,往下越来越大,全部容积大于它的最大刻度值,因为下端有一部分没有刻度。滴定时,所用溶液不得超过最低刻度。滴定管的下部尖嘴内液体不在刻度内,量取或滴定溶液时不能将尖嘴内的液体放出。 实验——酸碱中和滴定 【知识点1】酸碱中和滴定的概念及原理 1、概念:用已知浓度的酸(或碱)滴定未知浓度的碱(或酸)溶液的方法称为酸碱中和滴定。 2、原理:酸提供的H+和碱提供的OH-恰好完全反应 3、中和反应的实质:H++OH-=H2O(等物质的量反应)。 定量关系:n(H+)=n(OH-) 若是一元酸和一元碱反应,则有n酸=n碱,C酸. V酸= C碱. V碱 【知识点2】酸碱中和滴定管 1、两种滴定管构造上的不同点:上端标注有________,_________,___________。 酸式滴定管---玻璃活塞,用于装______,_______,______溶液 碱式滴定管---带有玻璃球的橡胶管,用于装_______溶液 2、滴定管的读数方法:0刻度在上,从上往下读,最大量 程有25mL、50mL等,注意与量筒(无0刻度)比较; 3、精确度:0.01ml,取到小数点后两位,如:24.00mL、23.38mL 最后一位是估计值(注意与量筒(0.1ml)比较)。 4、滴定管的洗涤:先用蒸馏水洗涤,再用标准液(或待测 液)来润洗。 5、滴定管的固定:垂直于桌面,高度以滴定管尖伸入锥形 瓶约1cm为宜。 6、滴定时,左手控制活塞、右手摇动锥形瓶,眼睛注视锥形瓶内液体的颜色变化。 7、滴定终点的判断:当最后一滴液体滴下后,锥形瓶内溶液颜色发生变化,且在半分钟内不变色,说明达到滴定终点。 8、再次进行滴定时,一定要将滴定管内液体重新注入至0刻度处,以免滴定时液体不足。 9、实际滴出的溶液体积=滴定后的读数-滴定前的读数 【知识点3】酸碱指示剂的选择 ①常用指示剂的变色范围 指示剂变色范围的pH 石蕊<5红色5~8________ >8蓝色 甲基橙<3.1______ 3.1~4.4橙色>4.4黄色 酚酞<8无色8~10________ >10____ ②指示剂的选择原则 A、指示剂的pH变色范围尽可能接近中和时的pH B、颜色变化明显。 常用中和滴定指示剂:_______ ________ ③指示剂的用量:________滴 ④滴定终点确定:指示剂的颜色发生突变并且半分钟不变色即达到滴定终点。 【知识点4】酸碱中和滴定操作 1、基本仪器有:滴定管(酸式和碱式)、铁架台(带滴定管夹)、锥形瓶(可装待测液,也可装标准液)、烧杯(盛废液,不能装待测液) 2、酸碱中和滴定操作程序 (1)滴定前的准备 ①.检查滴定管是否漏水,活塞是否灵活. 方剂分类总结 几本具有代表的著作 《五十二病方》:现存最早记载方剂的医书《内经》:最早记载治法及组成原则的医书 《伤寒杂病论》:“方书之祖” 集理,法,方药于一体的医书《太平惠民和剂局方》:第一部由政府编制而成的药典,第一部中成药典《普济方》:载方最多的古代医书 《伤寒明理论。药方论》:第一部剖析组方原则之书 《医学心悟》:首先归纳“八法”之书 所治病证的病机 治咳嗽——杏苏散(风寒燥邪犯肺,肺失宣降)麻黄汤(风寒束表,肺气不宣)清燥救肺汤(燥热伤肺,气阴两伤,肺失宣降)治咳喘(喘)小青龙汤(风寒束表,水饮内停) 苏子降气汤(痰涎雍盛,肾气不足,肺失宣降)定喘汤(风寒外束,痰热内蕴,肺失宣降)麻黄汤(风寒束表,肺气不宣)麻杏甘石汤(风热袭肺,或风寒郁而化热,热壅于肺,肺失宣降)治泄泻参苓白术散(脾胃气虚,湿浊阻滞) 藿香正气丸(风寒束表,湿阻中焦)四神丸(肾阳虚衰,不温脾土)真人养脏汤(脾肾虚寒,固摄无权)理中丸(中焦虚寒,升降失常)补中益中汤(脾胃气虚,中气下陷,气虚发热)治痢疾——白头翁汤(热毒壅滞肠中,深陷血分)芍药汤(湿热疫毒下注大肠,壅滞气机,气血不和)治呕逆——温胆汤(胆胃不和,痰热内扰)吴茱萸汤(胃中虚寒,浊阴上逆)旋覆代赭汤(胃气虚弱,痰浊内阻,气机上逆)橘皮竹茹汤(胃虚有热,气机上逆)治月经不调——温经汤(冲任虚寒,瘀血内阻,阴血不足)归脾汤(思虑过度,劳伤心脾,气血两虚)四物汤(营血虚滞,血行不畅)治月经不调——逍遥散(肝气郁结,血虚脾弱)治便秘——麻子仁丸(肠胃燥热,脾津不足)黄龙汤(热结阳明,气血不足)增液承气汤(热结阴亏,无水舟停)大承气汤(实热积滞壅结肠胃;热盛津伤)济川煎(肾虚精亏,肠燥便秘)治“四逆”——四逆散(肝脾不和,阳气内郁)四逆汤(阴寒内盛,阳气衰微) 当归四逆汤(血虚阳弱,经脉受寒,凝滞不通)吴茱萸汤(胃中虚寒,浊阴上逆)大承气汤(实热积滞壅结肠胃;热盛津伤)乌梅丸(脾肾虚寒蕴热,蛔虫内扰)温脾汤(脾阳不足,运化失常,寒积结于肠胃)治腹痛——理中丸(中焦虚寒,升降失常)小建中汤(中焦虚寒,气血阴阳俱虚,阳虚为主,)吴茱萸汤(胃中虚寒,浊阴上逆)治发热(甘温除热)——补中益中汤(脾胃气虚,中气下陷,气虚发热)当归补血汤(血虚气弱,阳浮于外)小建中汤(中焦虚寒,气血阴阳俱虚,阳虚为主,)——青蒿鳖甲汤(温病后期,邪伏阴分证)治胁痛——一贯煎(肝肾阴虚,肝失所养,肝气郁滞)逍遥散(肝气郁结,血虚脾弱)四逆散(肝脾不和,阳气内郁)治头痛——川芎茶调散(风邪循经上犯头目,阻遏清阳)吴茱萸汤(胃中虚寒,浊阴上逆)治中风——镇肝熄风汤(阴虚阳亢,气血上逆)补阳还五汤(气虚血瘀络阻,筋脉肌肉失养)治崩漏——黄土汤(脾阳不足,脾不统血)归脾汤(脾虚血少,脾不统血)固冲汤(脾气虚弱,冲脉不固)理中丸(脾阳不足,脾不统血)治失眠——朱砂安神丸(心火偏亢,阴血受灼,心神失养)天王补心丹(心肾阴亏,虚热内扰)温胆汤(胆胃不和,痰热内扰)酸枣仁汤(肝血不足,阴虚内热,虚火内扰)治痰饮——苓桂术甘汤(中阳不足,饮停心下)真武汤(肾阳不足,水泛为饮)治带下——完带汤(肝郁脾虚,湿浊下注)龙胆泻肝汤(肝胆湿热下注) 治咳嗽痰血——咳血方(木火刑金)百合固金汤(肺肾阴虚、虚火上炎)酸碱中和滴定实验误差分析
中医考研之中药总结
酸碱中和滴定知识梳理
中医考研之中药总结
实验——酸碱中和滴定知识点和练习
酸碱中和滴定基础学习知识原理的计算
酸碱中和滴定及应用-教师版
高中化学必备知识点:3.2.4酸碱中和滴定
酸碱中和滴定--学案
中医考研 中药功效主治总结笔记
酸碱中和滴定知识点
酸碱中和滴定及应用1
酸碱中和滴定实验误差分析
考研中药口诀总结
酸碱中和滴定知识梳理
酸碱中和滴定知识点
最新中医综合考研方剂学总结
